Method Article
마이크로웰 배양을 이용한 고환 특이적 구조를 이용한 돼지 고환 오르가노이드 생성
요약
여기서, 우리는 시판되는 마이크로웰 배양 시스템을 사용하여 고환 특이적 조직 구조를 가진 돼지 고환 오르가노이드의 재현 가능한 생성을 위한 프로토콜을 제시한다.
초록
오르가노이드는 생체 내에서 장기의 조직 구조 와 기능을 재량화 할 수있는 여러 세포 유형으로 구성된 3 차원 구조입니다. 오르가노이드의 형성은 기본 및 번역 연구의 다른 길을 열었습니다. 최근 몇 년 동안, 고환 오르가노이드는 남성 생식 생물학 분야에 대한 관심을 얻고있다. 고환 오르가노이드는 세포-세포 상호 작용, 조직 발달 및 세균 세포 틈새 미세 환경의 연구를 허용하고 높은 처리량 약물 및 독성 스크리닝을 용이하게 합니다. 고환 특정 조직 아키텍처를 가진 고환 오르가노이드를 믿을 수 있고 재현가능하게 생성하는 방법이 필요합니다. 마이크로웰 배양 시스템은 피라미드 모양의 마이크로웰의 조밀한 배열을 포함합니다. 전 사춘기 고환에서 파생된 고환 세포는 이 마이크로웰로 원심분리되고 고환 특정 조직 건축 및 세포 협회를 가진 고환 오르가노이드를 생성하기 위하여 배양됩니다. 이 과정을 통해 수천 개의 균일 한 오르가노이드를 생성 할 수 있습니다. 여기에보고된 프로토콜은 남성 생식을 연구하는 연구자들에게 광범위한 관심사가 될 것입니다.
서문
최근에는 3차원(3D) 오르가노이드에 대한 관심이 다시 부호 높아지고 있습니다. 장1,위2,췌장3,4,간5,뇌6 과 같은 다른 장기는 성공적으로 3D 오르가노이드 시스템으로 파생되었습니다. 이들 오르가노이드는 생체내 장기에 대한 건축적 및 기능적 유사성을 가지며 단층 배양 시스템7보다조직 미세환경연구에 생물학적으로 더 관련성이 있다. 그 결과, 고환 오르가노이드는8,9,10,11,12뿐만아니라 관심을 얻기 시작했다. 지금까지 보고된 방법의 대부분은 복잡하고, 비높은처리량(10)이며 ECM 단백질8,10의첨가가 필요하다. 이러한 복잡성은 재현성 문제도 발생합니다. 간단하고 재현 가능한 방법은 생체 내에서 고환과 같은 세포 협회와 고환 오르가노이드의 생성을 허용하는 것이 필요하다.
우리는 최근에 이러한 요구 사항을 해결하는 시스템을보고했다12. 돼지를 모델로 사용하여 마이크로웰 시스템에서 원심 강제 응집 방식을 사용했습니다. 마이크로웰 시스템에서, 각 웰은 동일한 작은마이크로웰(13)을다수 함유한다. 이것은 균일 한 크기의 수많은 스페로이드의 생성을 허용한다. 마이크로웰 시스템은 고환 별 아키텍처를 갖춘 많은 수의 균일한 오르가노이드를 생성할 수 있었습니다. 이 시스템은 간단하며 ECM 단백질을 첨가할 필요가 없습니다.
프로토콜
참고 : 1 주 된 돼지의 고환은 상업용 돼지의 거세에서 부산물로 상업용 돼지 농장에서 얻은 것입니다. 고환의 소싱은 캘거리 대학의 동물 관리 위원회에 의해 승인되었습니다.
1. 조직 소화를 위한 효소 용액의 준비
참고: 두 가지 다른 콜라게나아제 IV 용액(솔루션 A, B) 및 데옥시리보누틱스 I(DNase I) 용액을 포함하는 세 가지 다른 효소 솔루션이 필요합니다.
- 용액 A를 준비하려면, 콜라게나아제 IV S 20mg(재료 표)과콜라게나아제 IV W(재료표)40 mg을 고당포도 둘베코의 변형 된 독수리 배지 (DMEM)의 25 mL에 녹입니다. 그런 다음 0.22 μm 필터로 필터를 살균합니다. 트립신 활성을 억제하기 위해 용액 A에 태아 소 혈청 (FBS)의 0.4 mL를 추가하십시오.
- 용액 B를 준비하려면, 80 mg의 콜라게나아제 IVW(재료 표)를DMEM 40 mL에 녹입니다. 그런 다음 0.22 μm 필터로 필터를 살균합니다.
- DNase I 용액(7 mg/mL)을 준비하려면 DMEM 10 mL에 DNase I 70 mg을 용해시서. 그런 다음 0.22 μm 필터로 필터를 살균합니다.
참고: 여기에 설명된 콜라게나아제 IV 용액의 효소 농도는 원래 기사14에명시된 농도(2 mg/mL)와 다릅니다. 현재 프로토콜은 약간 더 높은 생존율을 가진 셀을 산출합니다. 그러나, 두 프로토콜에 의해 단리된 세포는 동일한 조직 건축을 가진 organoids를 일으킵니다.
2. 고환 조직 효소 소화
- 고환을 멸균 비커로 모으고 1% 페니실린/스트렙토마이신(P/S)을 함유한 인산완충식염수린(PBS)으로 씻으소서. 세척 후, 1% P/S를 함유한 PBS로 고환을 100mm 조직 배양 접시로 옮기고 오토클레이브 가위와 집게를 사용하여 튜니카 질및 부고환을 제거합니다. 분리된 고환을 새로운 100mm 접시로 옮기고 1% P/S가 들어 있는 PBS로 철저히 씻으십시오.
- 불임을 유지하려면 다른 멸균 가위와 집게를 사용하여 투니카 알부기네아에서 고환 자렌치마를 벗깁니다. 튜니카 바로 아래의 세로 축을 따라 고환을 잘라냅니다. 그런 다음 두 개의 집게를 사용하여 튜니카에서 고환을 껍질을 벗기고 1% P/S로 1 mL DMEM이 들어있는 새로운 100mm 접시에 넣습니다.
- 1-2mm 조직 조각으로 멸균 가위로 껍질을 벗긴 고환을 다진다. 잘라낸 후 멸균 집게를 사용하여 결합 조직의 흰색 조각을 제거하십시오.
- 다진 조직 조각을 용액 A로 옮기고 DMEM으로 최대 50 mL까지 올려 콜라게나아제 IVS(재료 표)에대해 0.4 mg/mL의 농도와 콜라게나아제 IV W(재료 표)의 농도를 0.8 mg/mL로얻습니다. 용액 A를 37°C 수조에 30분 동안 담그고, 5분마다 튜브를 부드럽게 반전시키고 DNA 방출을 시각적으로 확인한다.
- 자유 부동 DNA가 관찰되는 경우 DNase I의 500 μL을 추가합니다. 30 분 후, 1.5 분 동안 25 °C에서 브레이크와 90 x g에서 튜브를 원심 분리하고 상류를 폐기.
참고 : DNA는 흐린 물질로 나타납니다. 튜브가 흔들리면 조직 조각이 가라앉고 DNA는 해상에 머무르게 됩니다.
- 자유 부동 DNA가 관찰되는 경우 DNase I의 500 μL을 추가합니다. 30 분 후, 1.5 분 동안 25 °C에서 브레이크와 90 x g에서 튜브를 원심 분리하고 상류를 폐기.
- 튜브에 용액 B를 추가하고 DMEM으로 최대 50 mL까지 콜라게나아제 IV W(재료 표)의농도를 얻습니다. 튜브를 37°C 수조에 30분 동안 넣고 5분마다 튜브를 부드럽게 반전시다. 자유 부동 DNA가 관찰되는 경우 DNase I의 500 μL을 추가한다.
- 30 분 후, 1.5 분 동안 25 °C에서 브레이크와 90 x g에서 튜브를 원심 분리. 그 후 상급을 버리고 1 % P / S로 PBS로 한 번 씻으십시오.
참고: 용액 A와 B 모두에서 버려진 상피제는 주로 전면 세포를 포함합니다. - 최대 50mL의 PBS로 튜브를 위로 올려보십시오. 조심스럽게 상단에서 세관을 수집하고 새로운 50mL 튜브에 배치합니다.
참고 : 소화되지 않은 큰 조직 조각은 바닥에 빠르게 정착하고 소화 된 반분부 관은 현탁액에 남아 있습니다. 큰 조직 조각을 수집해서는 안됩니다. 이 절차는 원래 튜브의 용액이 거의 명확하고 소화되지 않은 조직 단편이 남아 있을 때까지 여러 번 반복 될 수 있으며, 이는 폐기 될 수 있습니다. - 90 x g의 튜브를 25 °C에서 브레이크로 1.5 분 동안 원심 분리하고 상급기를 폐기하십시오. 신선한 PBS와 원심분리기를 다시 넣습니다. 이 세척 단계를 두 번 반복합니다.
- 마지막 PBS 세척 후, 상층을 제거하고 PBS의 5 mL에서 반분엽 튜브를 다시 중단. 그런 다음 15 mL의 0.25% 트립신-에틸렌디아미네테트라아세트산(EDTA)을 튜브에 넣습니다. 튜브를 37°C 수조에 놓고 2분마다 부드럽게 반전시다. 많은 자유 부동 DNA가 관찰되는 경우, DMEM의 5 mL로 DNase I의 500 μL을 추가하십시오.
- 현미경의 밑에 단 하나 세포에 관의 효소 소화를 평가합니다 (5 분 후에, 그 후에 매 2 분). 대부분 단일 세포가 검출될 수 있는 경우, FBS 5 mL로 반응을 멈추고 70 μm 메쉬를 통해 필터한 다음 40 μm 메쉬를 통과합니다.
참고: 소화에 사용되는 50 mL 튜브의 캡(용액 A, B 및 0.25% 트립신-EDTA)의 캡이 제대로 조여지므로 주의해야 합니다. 수조의 오염이 우려되는 경우, 파라핀 필름은 멸균을 보장하기 위해 캡을 감싸는 것일 수 있습니다. - 500 x g의 단일 셀을 55 °C에서 5 분 동안 브레이크로 원심 분리하고 농축 매체 (DMEM / F12 )에서 5 % FBS 및 1 % P / S를 함유한 농축 매체에서 다시 중단하고 생존 가능한 셀의 수를 계산합니다. 이것은 시작 세포 집단입니다. 100 x 103 세포를 수정하고기재된 바와 같이 생식 세포 마커 UCHL1(유비퀴틴 C-말기 하이드로라제 L1)에 대한 면역세포화학을 수행하고 이 시작 세포 집단에서 생식 세포의 백분율을 결정한다.
참고: 생식 세포 마커 Promylolocytic 백혈병 아연 핑거 단백질 (PLZF)15 또한 UCHL1에 대한 적합한 대안으로 사용될 수있다. 시작 세포 집단에서, 예상된 세포 수율은 조직의 약 700-800 x 10 9/g이다. 이 세포 인구에 있는 생식 세포의 백분율은 4-5%이어야 합니다. - 조직 배양 인큐베이터 (37 °C)에서 2 일 동안 2 일 동안 두 개의 초저 부착 100mm 페트리 접시 (DMEM / F12의 10 mL에 10 x10 6 세포 에 매달려 있는 세포)에 이 시작 세포 인구의 약 20 x 106을 놓습니다. , 5 % CO2,21 % 산소). 나머지 세포와 함께 배아 세포 농축을 수행합니다.
참고 : 최적의 생존율과 세포 품질을 보장하기 위해, 생식 세포 농축 및 후속 정량화가 일어나는 동안, 시작 세포 집단은 2 일 동안 매우 낮은 부착 조직 배양 요리에 배양에 배치됩니다.
3. 생식 세포 농축
참고: 위에서 설명한 절차는 주로 세르톨리 세포와 생식 세포를 산출합니다. 다른 접착 특성은 차동 도금을 통해 세르톨리 세포와 배아 세포를 분리할 수 있게 합니다.
- 종자 20-25 x 106 세포는 차등 도금에 대한 농축 배지 (DMEM/F12 와 5% FBS 및 1% P/S)의 총 부피에서 100 mm 조직 배양 접시 당 시작 세포 집단의. 세포를 인큐베이터(37°C, 5%CO2,21%O2)에넣고 1.5시간 후에, 대부분의 세르톨리 세포가 플레이트에 부착되도록 한다.
- 2 개의 플레이트의 상판 (주로 배아 세포를 함유)을 하나의 새로운 100mm 플레이트에 수집하고 결합하여 인큐베이터에 다시 넣습니다. 1 시간 후, 다시 새로운 100mm 플레이트에 2 플레이트의 상급을 결합합니다. 접시를 밤새 인큐베이터에 다시 놓습니다.
참고 : 결합 된 상피제는 주로 생식 세포를 포함합니다. 플레이트와 함께 폐기되는 부착 된 세포는 주로 Sertoli 및 경막 근막 세포와 같은 고환 체세포입니다. - 농축된 생식 세포를 다음과 같이 2개의 분획으로 수집한다.
참고 : 농축 된 생식 세포는 다르게 부착되지 않은 분획과 약간 부착 된 분획을 부착합니다. 이 두 분획은 함께 농축 된 생식 세포 집단을 형성합니다.- 비 부착 분수 : 상급을 수집합니다.
- 약간 부착 분수 : PBS로 부드럽게 플레이트를 세척하고 실온에서 5 분 동안 0.25 % 트립신 -EDTA의 1 :20 희석2 mL로 처리하고 농축 매체 2 mL로 반응을 멈추고 비 부착 분율과 동일한 튜브에서 수집하십시오.
참고: 0.25% 트립신-EDTA는 1:20 트립신 용액을 생성하기 위해 PBS로 희석되어야 합니다.
- 세포 카운터를 사용하여 세포의 총 수를 계산, 100 x 103 세포를 수정하고 설명 된바와 같이 세균 세포 마커 UCHL1에 대한 면역 세포 화학을 수행하고이 농축 된 세포 집단에서 세균 세포의 비율을 결정합니다.
참고: 이 세포 집단에 있는 생식 세포의 백분율은 적어도 60-70%이어야 합니다. 정량화를 위한 면역 세포 화학은 1 일이 필요하기 때문에, 농축된 세포는 최적의 세포 품질 및 생존을 보장하기 위하여 1% P/S로 보충된 DMEM/F12를 가진 초저 부착 100 mm 페트리 접시에 두어야 합니다.
4. 파종을위한 세포의 준비
- 시작 세포 준비를 수확하려면 초저 부착 100mm 접시로부터 50 mL 튜브에 상판체를 수집합니다. 부착 된 세포를 수집하기 위해 PBS로 플레이트를 힘차게 씻으하십시오. 효소 소화가 필요하지 않습니다.
참고 : 고환 세포 중 일부는 주로 Sertoli 세포가 초저 부착 판에 약간 부착 될 수 있습니다. - 시작 세포 제제및 농축된 생식 세포를 결합하여 25% 생식 세포를 함유하는 작동 세포 제제를 수득한다. 500 x g의 브레이크가 있는 원심분리기는 25°C에서 5분 동안, 상복부를 버리고 오르가노이드 형성 배지에서 세포를 다시 일시 중단합니다(DMEM/F12는 인슐린 10 μg/mL, 트랜스페린 5.5 μg/mL, 셀레늄 6.7 ng/mL, 20 ng/mL 로 보충됨) , 1% P/S). 셀 밀도를 mL당 2.4 x 106으로 조정합니다.
참고 : 이 프로토콜에서13을 사용한 마이크로 웰 플레이트의 각 우물에는 1,200 마이크로 웰이 포함되어 있습니다. - 아래 수식을 사용하여 아래에 설명된 대로 당 셀 수를 계산합니다.
웰당 세포 수 = 각 오르가노이드에 대해 군집화될 세포의 마이크로웰 x 개수. - 각각 1, 000 세포에서 오르가노이드를 생성하려면 각각 (각각 1,200 x 1,000 세포 =) 1.2 x 106 세포를 시드합니다. 세포가 배지의 0.5 mL의 부피에서 시드되는 방식으로 세포 현탁액의 세포 밀도를 조절한다. 각각 1,000개의 세포에서 형성된 오르가노이드의 경우 mL당 2.4 x 106 세포의 밀도를 사용합니다(0.5 mL의 1.2 x 106세포).
5. 세포를 수신하는 마이크로웰의 준비
참고 : 세포가 마이크로 웰 표면에 부착되지 않도록하려면 제조업체에서 구입할 수있는 계면 활성제 헹구 솔루션으로 치료하십시오.
- 각 우물에 0.5 mL의 헹구 솔루션을 추가하십시오. 우물에 기포가 갇혀 있지 않은지 확인하십시오. 기포를 제거하려면 25 °C에서 브레이크로 플레이트를 2,000 x g에서 2 분 동안 원심 분리하십시오.
- 저배율 반전 현미경으로 플레이트를 관찰하여 기포가 마이크로웰에서 제거되었는지 확인합니다. 갇힌 기포가 관찰되면 25 °C에서 브레이크가 있는 2,000 x g에서 다시 원심분리기를 2분 간 유지하여 남은 기포를 제거합니다.
- 뚜껑으로 접시를 덮고 실온에서 30 분 동안 배양하십시오. 처리가 완료된 후에는 헹구는 용액을 제거하고 멸균수 또는 PBS로 즉시 플레이트를 세척하십시오. 헹구는 용액으로 처리 후 플레이트가 마르지 않도록하십시오.
6. 고환 오르가노이드의 생성
- 0.5 mL의 오르가노이드 형성 배지(세포 없이)를 각 웰에 추가하고 25°C에서 브레이크를 2,000 x g에서 원심분리기로 2분 간 추가하여 갇힌 기포를 제거합니다. 저배율 반전 현미경 으로 우물을 관찰하여 기포가 제거되었는지 확인하십시오. 갇힌 기포가 관찰되면 25 °C에서 브레이크가 있는 2,000 x g에서 다시 원심분리기를 2분 간 유지하여 남은 기포를 제거합니다.
- 작동 셀 서스펜션0.5 mL를 추가하고 위아래로 파이펫팅하여 부드럽게 섞습니다. 500 x g의 원심분리기에서 25°C에서 5분 동안 브레이크를 밟습니다.
- 플레이트를 세포 배양 인큐베이터로 5일 동안 전사하고 배양한다. 격일로 미디어의 절반을 변경합니다.
- 어떤 오르가노이드를 잃지 않고 매체를 변경하려면, 웰의 벽에 피펫 팁을 터치하고 부드럽게 반월 상 연골을 터치하고 천천히 매체를 그립니다. 반월 상 연골을 따라 내려가십시오. 신선한 매체를 추가하려면, 매체 철수와 같은 쪽에 우물의 벽에 피펫 팁을 터치하고 천천히 벽 아래로 흐를 수 있도록, 잘 벽에 부드럽게 신선한 매체를 추가합니다.
- 오르가노이드를 회수하려면 넓은 입 피펫을 사용하여 매체를 위아래로 부드럽게 피펫합니다. 이것은 오르가노이드가 마이크로웰에서 나올 수 있게 합니다.
- 오르가노이드를 수집하고, PBS로 세척하고, 생식 세포 마커(UCH-L1), 세르톨리 세포 마커(GATA 결합 단백질 4-GATA4), 경막하 근이성 세포 마커(α-Smooth Muscle Actin-αSMA) 및 Leydig 세포 마커(Cytochrome)에 대한 면역 세포 화학을 수정하고 수행합니다. P450-CYP450)을기재한 바와 같이 12및 공초점 현미경하에서 가시화한다.
결과
마이크로웰에서 배양된 1주된 돼지 고환으로부터 분리된 세포는 스페로이드(그림1A,그림 2)로자체 조직되었으며, 묘사되고 뚜렷한 외관(seminiferous 상피) 및 내부 구획( (그림1B,그림 2). 두 구획을 콜라겐IV+ve 지하 막에 의해 분리하였다. UCH-L1+ve 세균 세포 및 GATA4+ve 세르톨리 세포는 지하 막의 외부 구획에 있었다(도 1B, 도 2). α-SMA+ve 경막 근막 세포를 지하 막의 내부를 따라 국한되었고 시토크롬 P450+ve Leydig 세포는 간진기의 중심에 있었다(도1B, 도 2). 이구조(도 2)는레이디그 세포, 상외 근이 세포가 간질 구획내의 간질에 위치하는 실체 조건(도1C)과유사합니다. 및 생식 세포, 세르톨리 세포는 반분위상피에 위치한다.
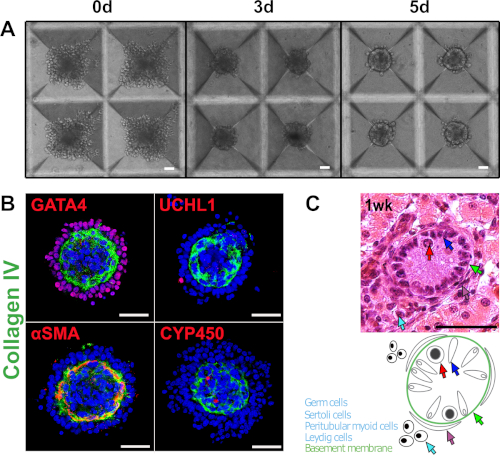
그림 1: 마이크로웰 유래 고환 오르가노이드는 반전된 지형을 가진 고환 특이적 조직 구조를 나타낸다. (A)돼지 고환 세포에서 0, 3, 및 5일 동안 마이크로웰 배양. (B)특정 세포 유형을 식별하는 고환 오르가노이드의 면역 형광 이미지 : 세르톨리 세포 (GATA4), 지하 막 (콜라겐 IV); 생식 세포 (UCH-L1); 상구 형 근막 세포 (α-SMA); 레이디그 세포 (CYP450). (C)조직학적 외관 (H&E) 및 1 주 된 돼지 고환의 개략적 표현. 특정 셀 유형은 해당 화살표로 표시됩니다. 배율 막대 = 50 μm. 이 그림은 사키브 외12에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 오르가노이드 형성의 개략적 표현. 단리된 단 하나 고환 세포는 고환 오르가노이드를 생성하기 위하여 5 일 동안 마이크로웰에서 종자 되고 배양됩니다. 이 그림은 사키브 외12에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 생체 내 고환과 유사한 조직 구조를 가진 많은 수의 고환 오르가노이드의 일관되고 반복 가능한 생성을 허용하는 간단한 방법을 확립했습니다12. 접근법은 돼지 고환 세포를 사용하여 개발되었지만, 마우스, 비인간 영장류 및 인간고환(12)에도보다 광범위하게 적용가능하다. 고환 오르가노이드8,9,10,11을생산하기 위한 여러 가지 다른 방법이 보고되었다. Baert 외. 성인 인간 고환의 탈세포화에 의해 얻어진 엑스트라 셀룰러 매트릭스(ECM)로 고환 세포를 배양함으로써 성인 및 전 사춘기 샘플로부터 인간 고환 오르가노이드를생성하였다 11. 이 모델은 뚜렷한 고환 형태를 가지고 있지 않았지만, 오르가노이드는 테스토스테론과 사이토카인을 분비 할 수있습니다 11. 또 다른 인간 오르가노이드 모델은 용해성 고환 ECM 단백질 및 오르가노이드를 이용한 매달려 있는 드롭 배양 방법을 사용하여 펜더이식(Pendergraft)등8에의해 보고되었다. Alves-Lopes 외. 쥐10에서고환 오르가노이드를 생성하는 독특한 3 층 지하 막 매트릭스 (예를 들어, Matrigel) 그라데이션 시스템을 사용했다. 이 시스템의 세포는 혈액 고환 장벽이 있는 관 구조를 생성했습니다. 이러한 튜불형 구조의 생식 세포는 또한 레티노산자극(10)에반응하였다. 이러한 모든 방법은 다소 복잡하고 높은 처리량 의 사용에 도전적이다. 대조적으로, 마이크로웰 시스템은 간단하고, 재현 가능하며, 오르노티픽 고환 오르가노이드를 생성할 수 있으며 높은 처리량 약물 및 독성 검정에 사용될 수 있다.
여기에서 설명한 방법에서 우리는 세포 조밀도 1,000 세포/마이크로웰 (1,000 세포/오르가노이드)를 사용했지만, 이 방법은 125개의 세포/마이크로웰12만큼적은 오르가노이드를 생성하는 데 사용될 수 있습니다. 제한된 샘플을 실험할 때 특히 사용할 수 있습니다.
원심 분리 중에 플레이트가 올바르게 균형을 이루지 못하면 세포의 고르지 못한 분포가 다양한 크기와 모양을 가진 오르가노이드의 생성을 일으킬 수 있습니다. 마이크로웰 플레이트의 균형을 제대로 맞추려면 주의를 기울여야 합니다. 세포가 시드되면 미디어 변경 중에 플레이트를 처리하는 데주의를 기울여야합니다. 인큐베이터에서 그것을 꺼내거나 매체 변경 중에 난류를 만들 때 플레이트를 너무 많이 흔들면 일부 오르가노이드가 마이크로웰에서 나오고 다른 사람들과 융합될 수 있습니다13.
포유류 세균 세포 틈새는 복잡하고 다세포입니다. 세르톨리 세포, 상회성 근이성 세포, Leydig 세포와 같은 고환의 상이한 세포는 모두 생식세포 유지 및 운명16,17에기여한다. 우리의 오르가노이드 시스템은 특정 세포 모형에 있는 다른 신호 통로를 조작하기 위하여 이용될 수 있습니다. 관심 있는 유전자는 위관성 근이성 세포, 세르톨리 세포와 같은 생식 세포 또는 다른 고환 체세포에서 위 또는 하향 조절될 수 있다. 이 수정된 세포는 그 때 ECM 침착, 형태 형성, 세포 세포 신호 및 정액 생성에 편집의 효력을 공부하기 위하여 이용될 수 있는 수정한 고환 오르가노이드를 생성하기 위하여 그밖 고환 세포와 결합될 수 있습니다. 이러한 변형은 또한 약물 스크리닝을 위한 특정 질병 표현형을 생성하기 위하여 수행될 수 있다. 마이크로웰 시스템을 사용하여 배양물 또는 초저부착 U-bottom 플레이트8과같은 구형 오르가노이드의 생성을 위한 다른 방법에 비해, 마이크로웰 시스템을 이용하여 보다 접근성이 뛰어나고 수정. 예를 들어, 생식 세포는 유전자 변형 또는 실험 인자로 처리되고 간단한 원심분리에 의해 미리 만들어진 야생 형 오르가노이드상에 배치되고 하류 효과를 위해 관찰될 수 있다.
공개
Ungrin 박사는 발명가로 아그레웰 기술에 재정적 관심을 가지고 있습니다.
감사의 말
이 작품은 NIH / NICHD HD091068-01 박사 에 의해 지원되었다 박사 Ina 도브린스키.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm ultra low attachment tissue culture dish | Corning | #CLS3262 | |
| 100 mm tissue culture dish | Corning | #353803 | |
| Aggrwell 400 | Stemcell Technologies | #34411 | |
| Anti-Adherence Rinsing Solution | Stemcell Technologies | #07010 | |
| Collagenase type IV from Clostridium histolyticum | Sigma-Aldrich | #C5138 | referred as Collagenase IV S |
| Collagenase type IV Worthington | Worthington-Biochem | #LS004189 | referred as Collagenase IV W |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | #DN25 | |
| Dulbecco’s Modified Eagle’s Medium/F12 | Gibco | #11330-032 | |
| Dulbecco’s Modified Eagle’s Medium - high glucose | Sigma-Aldrich | #D6429 | |
| Dulbecco’s Phosphate Buffered Saline | Sigma-Aldrich | #D8537 | |
| Epidermal Growth Factor | R&D Systems | #236-EG | |
| Falcon Cell Strainers 70 µm | FisherScientific | #352350 | |
| Falcon Cell Strainers 40 µm | FisherScientific | #352340 | |
| Fetal Bovine Serum | ThermoFisher Scientific | #12483-020 | |
| Insulin-Transferrin-Selenium | Gibco | #41400-045 | |
| Penicillin-Streptomycin | Sigma-Aldrich | #P4333 | |
| Porcine testicular tissue | Sunterra Farms Ltd (Alberta, Canada) | ||
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit | Millipore | #SCGP00525 | |
| Trypsin-EDTA | Sigma | #T4049 |
참고문헌
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Barker, N., et al. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 6 (1), 25-36 (2010).
- Huch, M., et al. Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis. Embo Journal. 32 (20), 2708-2721 (2013).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Takebe, T., et al. Vascularized and functional human liver from an iPSC-derived organ bud transplant. Nature. 499 (7459), 481-484 (2013).
- Quadrato, G., et al. Cell diversity and network dynamics in photosensitive human brain organoids. Nature. 545 (7652), 48-53 (2017).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Pendergraft, S. S., Sadri-Ardekani, H., Atala, A., Bishop, C. E. Three-dimensional testicular organoid: a novel tool for the study of human spermatogenesis and gonadotoxicity in vitrodagger. Biology of Reproduction. 96 (3), 720-732 (2017).
- Strange, D. P., et al. Human testicular organoid system as a novel tool to study Zika virus pathogenesis. Emerging Microbes & Infections. 7 (1), 82-82 (2018).
- Alves-Lopes, J. P., Soder, O., Stukenborg, J. B. Testicular organoid generation by a novel in vitro three-layer gradient system. Biomaterials. 130, 76-89 (2017).
- Baert, Y., et al. Primary Human Testicular Cells Self-Organize into Organoids with Testicular Properties. Stem Cell Reports. 8 (1), 30-38 (2017).
- Sakib, S., et al. Formation of organotypic testicular organoids in microwell culture. Biology of Reproduction. , (2019).
- Razian, G., Yu, Y., Ungrin, M. Production of Large Numbers of Size-controlled Tumor Spheroids Using Microwell Plates. Journal of Visualized Experiments. (81), 50665 (2013).
- Sakib, S., et al. Formation of organotypic testicular organoids in microwell culture. Biology of Reproduction. 100 (6), 1648-1660 (2019).
- González, R., Dobrinski, I. Beyond the Mouse Monopoly: Studying the Male Germ Line in Domestic Animal Models. ILAR Journal. 56 (1), 83-98 (2015).
- Oatley, J. M., Brinster, R. L. The germline stem cell niche unit in mammalian testes. Physiological Reviews. 92 (2), 577-595 (2012).
- Chen, L. Y., Willis, W. D., Eddy, E. M. Targeting the Gdnf Gene in peritubular myoid cells disrupts undifferentiated spermatogonial cell development. Proceedings of the National Academy of Science USA. 113 (7), 1829-1834 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유