Method Article
스크래치 마이그레이션 분석 및 등갈 피부 접기 챔버 에서 생체 외 및 상처 치유의 생체 내 분석
요약
여기서, 우리는 1차 섬유아세포를 이용한 시험관내 스크래치 분석및 마우스에서 의 피부 상처 치유 분석실험을 위한 프로토콜을 제시한다. 두 방법 모두 시험관 내 및 생체 내 상처 치유를 평가하는 간단한 방법입니다.
초록
손상된 절단 상처 치유는 당뇨병을 앓고있는 환자와 노인에게 중요한 관심사이며 효과적인 치료가 필요합니다. 적절한 생체외 및 생체내 접근법은 피부 상처 치유 과정을 개선하기 위한 약물 치료를 위한 새로운 표적 분자의 식별에 필수적이다. 우리는 전압 게이트 칼슘 채널 (Cavβ3)의 β3 소단위를 두 개의 독립적 인 분석법, 즉 생체 외 스크래치 이동 분석 및 생체 내 등쪽 피부 접힘 챔버 모델에서 상처 치유에 영향을 미치는 잠재적 인 표적 분자로 확인했습니다. 1 차 마우스 배아 섬유아세포 (MEFs) 야생 형 (WT) 및 Cavβ3 결핍 마우스 (Cavβ3 KO) 또는 SiRNA로 처리 된 WT 마우스로부터 급성으로 분리 된 섬유 아세포는 Cacnb3 유전자의 발현을 하향 조절합니다. , Cavβ3을 인코딩하여 사용했습니다. 스크래치는 결합 된 세포 단층에 적용하고 갭 클로저는 마이그레이션 셀에 의해 갭의 완전한 재모독까지 정의 된 시점에서 현미경 이미지를 복용하여 뒤따랐다. 이들 이미지는 분석되었고, 각 조건에 대해 세포 이동 속도를 결정하였습니다. 생체 내 분석에서, 우리는 WT와 Cavβ3 KO 마우스에 등쪽 피부 접이식 챔버를 이식하고, 직경 2mm의 정의된 원형 상처를 적용하고, 감염및 탈수로부터 보호하기 위해 유리 커버 슬립으로 상처를 덮고, 거시적 상처 폐쇄를 모니터링했습니다. 시간이 지남에 따라. 상처 폐쇄는 Cacnb3-유전자결핍 마우스에서 상당히 빨랐다. 생체외 분석의 결과는 생체외 분석과 상관관계가 잘 연관되기 때문에, 시험관내 분석노는 생체내 상처 치유 모델에 의한 시험관 내 안타를 검증하기 전에 높은 처리량 스크리닝에 유용할 수 있다. 우리가 야생형 및 Cavβ3 결핍 마우스 또는 세포를 위해 여기에서 보여준 것은 또한 Cavβ3 이외에 특정 분자를 위해 적용될 수 있습니다.
서문
피부 상처 치유는 피부의 무결성을 회복하고 감염으로부터 유기체를 보호하기 위해 피부 손상 직후에 시작됩니다. 상처 치유 과정은 네 개의 겹치는 단계를 거칩니다. 응고, 염증, 새로운 조직 형성 및 조직 리모델링1. 세포 마이그레이션은 이러한 단계에서 매우 중요합니다. 염증성 세포, 면역 세포, 각질 세포, 내피 세포 및 섬유아세포는 상이한 시점에서 활성화되고 상처 부위2를침범한다. 시험관 내 및 생체 내 상처 치유를 조사하는 방법은 근본적인 메커니즘을 이해하는 것뿐만 아니라 새로운 약물을 테스트하고 피부 상처 치유를 개량하고 가속화하는 것을 목표로하는 새로운 전략을 개발하는 데 큰 관심이 있습니다.
셀 마이그레이션을 모니터링하고 분석하기 위해 스크래치 마이그레이션 분석을 사용할 수 있습니다. 그것은 종종 시험관 내 상처 치유 분석이라고합니다. 이 방법은 세포 배양 시설3을필요로 한다. 그것은 간단한 절차이고, 고급 장비의 필요가 없고 대부분의 세포 생물학 실험실에서 분석이 수행될 수 있습니다. 이 분석에서, 무세포 영역은 동봉된 세포 단층, 바람직하게는 상피-또는 내피 유사 세포 또는 섬유아세포의 기계적 파괴에 의해 생성된다. 스크래치 가장자리의 셀은 생성된 간격을 다시 채우기 위해 마이그레이션됩니다. 시간이 지남에 따라 감소하는 세포 없는 영역의 정량화는 이동 속도와 유사하며 세포가 간격을 좁힐 필요가 있는 시간을 나타냅니다. 이를 위해, 조사자는 WT 마우스 또는 관심 유전자가 결여된 마우스로부터의 급성 단리된 세포또는4, 또는 신뢰할 수 있는 세포 저장소로부터 사용할 수 있는 불멸의 세포를 사용할 수 있다. 스크래치 분석법은 약리활성 화합물의 영향 또는 형질 감염된 cDNAs 또는 siRNAs가 세포 이동에 미치는 영향을 연구할 수 있게 합니다.
생체 내에서 상처 치유는 피부의 물리적 무결성을 가능한 한 빨리 복원하기 위해 각질 세포, 염증 세포, 섬유 아세포, 면역 세포 및 내피 세포를 포함한 다양한 세포 유형을 필요로하는 복잡한 생리적과정입니다 1 . 생체 내에서 연구하는 다른 방법은 과거5,6,7,8에서개발및 사용되어 왔다. 본 항에 기재된 등쪽 피부접이식 챔버는 이전에 상처 치유 어세9에사용되었다. 마우스에 대한 변형된 등지 피부 접힘 챔버 제제로서 사용된다. 변형된 스킨폴드 챔버 모델은 몇 가지 장점이 있다. 1) 그것은 상처 치유 과정을 관찰하는 것을 방지하고 마우스의 상처 수리에 영향을 미칠 수있는 피부 수축을 최소화합니다. 2) 이 챔버는 유리 커버 슬립으로 상처를 덮어 조직 감염과 탈수를 줄여 치유 과정을 지연시킬 수 있습니다. 3) 혈류와 혈관을 직접 모니터링 할 수 있습니다. 4) 상처를 치료하고 치유를 가속화하기 위해 약리활성 화합물 및 시약의 반복적 인 국소 적용을허용9,10.
우리는 고전압 게이트 칼슘 채널 (Cavβ3)의 β3 소단위를 두 개의 독립적 인 프로토콜, 즉 생체 외 스크래치 이동 분석 및 생체 내 등쪽 피부 접힘 챔버 모델을 사용하여 피부 상처 치유에 영향을 미치는 잠재적 인 표적 분자로 확인했습니다. 시험관내 분석의 경우, 우리는 1차 섬유아세포를 사용하였지만, 이들 세포는 Cavβ3 단백질을 코딩하는 Cacnb3 유전자를 발현하지만 탈분극 유도된Ca2+ 유입 또는 전압 의존적Ca2+ 전류가 부족하다. 우리는 이 섬유아세포에서 Cavβ3의 새로운 기능을 기술했습니다: Cavβ3는 이노시톨 1,4,5-삼위산염 수용체(IP3R)에 결합하고 소포체로부터 칼슘 방출을 제약합니다. 마우스에서 Cacnb3 유전자의 삭제는 IP3에 대한 IP3R의 감도 증가, 향상된 세포 이동 및 증가된 피부 상처 복구4를유도한다.
프로토콜
모든 실험 절차는 자를란트 와 자를란트 대학의 윤리 규정 및 동물 복지위원회에 따라 승인되고 수행되었습니다.
1 1 1 차적인 세포 배양 및 siRNA 형질감염
참고 : 설명 된 방법에서 1 차 섬유 아세포가 사용됩니다. 이들 세포는 상처 치유 및 조직 리모델링11에중요한 역할을 한다. 본 실험에서, Cacnb3 유전자는, 고전압 게이트 칼슘채널(12)의 Cavβ3 소단위를 코딩하여 하향 조절되었고, 이에 따라 생체내 세포 이동 및 피부 상처 수리에 그 역할을 나타내고4.
- siRNA의 준비: siRNAs를 재구성하기 전에, 내용이 바닥에 있는지 확인하기 위해 튜브를 잠시 원심 분리합니다. 100 μL RNase-free 버퍼(100 mM 칼륨 아세테이트, 30 mM HEPES, pH 7.5)에서 siRNAs를 20 μM의 농도로 재구성합니다. 이것은 siRNAs의 재고 솔루션입니다.
- Aliquot 이 스톡 용액은 튜브당 10 μL(20 μM 농도)에서 사용될 때까지 -20°C에서 보관합니다.
- 초미세 영구 마커를 사용하여, 항상 관심의 동일한 스크래치 영역을 식별하고 그 폐쇄를 따를 수 있도록 각 우물의 하단에 수평 라인6 웰 플레이트를 표시합니다.
참고: 6-well 배양 플레이트는 충분히 크기 때문에, 셀 단층 전반에 걸쳐 200 μL 파이펫 팁을 사용하여 일관되고 재현 가능하며 수직 스크래치를 적용할 수 있는 충분한 공간과 유연성을 제공하기 위해 이 분석기에 사용되었다. 제한된 수의 셀을 사용할 수 있는 경우, 대안이자 비용 효율적인 방법은 12-또는 24웰 배양 플레이트를 사용하는 것입니다. - 플레이트 1차 섬유아세포는 야생형 및 β3 결핍 마우스4로부터분리되어, 2 mL 덜베코의 변형된 독수리 배지(DMEM)가 10% 태아 소 혈청(FCS)으로 보충된 경우 5 x 105 세포의 밀도에서 6웰 플레이트에서 잘 한다.
참고: 웰당 5 x 105 세포는 6웰 배양 플레이트와 1차 마우스 섬유아세포에 대해 확립되었습니다. 12- 또는 24-well 세포 배양 플레이트 또는 그밖 세포 모형을 사용하는 경우에 시험은, 크기에서 다를 수 있었습니다 필요할 수 있습니다. 세포는 생물학적 안전 캐비닛 클래스 II와 같은 멸균 환경에서 처리되어야 합니다. - 6웰 플레이트에 세포 유형, 유전자형 및 날짜를 표시합니다.
- 6웰 플레이트를 세포 배양 인큐베이터내로 옮기고 24시간 동안 37°C 및 5%CO2에서 세포를 유지한다.
- 다음날, 인큐베이터에서 플레이트를 꺼내, 우물에서 세포 배양 배지를 흡인하고, 그것을 버리고 우물의 벽에 조심스럽게 첨가하여 2.25 mL 신선한 배양 배지로 대체한다.
- siRNAs와 섬유 아세포를 트랜스 펙트하기 위해, 제조 업체에서 권장하는 대로 지질 기반 의 형질 감염 시약을 사용합니다.
- 각 형질감염에 대해 두 개의 미세 원심 분리튜브에 라벨을 붙입니다. 첫 번째 에서, 형질감염 시약의 9 μL을 추가하고 150 μL 감소 된 혈청 배지로 희석하십시오. 두 번째 튜브에서 1.5 μL siRNA(Cacnb3 siRNA-1, Cacnb3 siRNA-2 또는 스크램블 된 siRNA를 음성 대조군으로)를 넣고 150 μL 감소 된 혈청 배지로 희석하십시오.
- 희석된 siRNA를 2s. 21°C에서 5분 동안 인큐베이션하여 희석된 형질감염 시약 및 와류를 함유하는 튜브에 첨가한다.
- Cacnb3 siRNA-1, Cacnb3 siRNA-2 또는 스크램블 siRNA로 우물을 라벨링합니다. siRNA-형질감염 시약 혼합물의 250 μL을 세포에 드롭와이즈로 첨가한다.
- 6웰 배양판을 다시 인큐베이터에 넣고 세포를 37°C 및 5%CO2에서 72시간 동안 유지한다.
- Cacnb3 유전자 침묵의 효율을 확인하기 위해, 형질감염된 세포를 수집하고 앞서 설명한 바와 같이 면역블롯 분석을수행한다 4.
2. 시험관 내 상처 치유 분석 (스크래치 마이그레이션 분석)
- 인큐베이터에서 세포 배양 판을 꺼내 10x 목적을 사용하여 현미경하에서 세포를 검사하였다. 스크래치 분석이 100% 합의에 도달한 경우에만 시작합니다.
참고: 정확성과 재현성을 위해 100% 합류는 스크래치 마이그레이션 분석을 시작하는 필수 요소입니다. 따라서, 배양 웰에 동일한 수의 세포를 시드하고, 각각의 웰을 수렴하고, 동일한 시점(일 0+)에 스크래치를 적용하는 것이 중요하다. 세포가 100% 합류에 도달한 후에 더 오래 기다리는 것은 다른 반응을 불러일으킬 수 있습니다. - 일단 세포가 100% 합류에 도달하면, 우물에서 배양 배지를 흡인하고 그것을 폐기합니다.
- 파이펫 팁(200 μL)을 사용하여 웰 의 중간에 있는 동시 셀 단층을 가로질러 웰 의 바닥에 표시된 수평 선에 수직 스크래치를 수동으로 생성합니다.
- 2 mL 인산완충식염수(PBS)로 각각 2회 헹구고(137 mM NaCl, 2.7 mM KCl, 1.5 mM KH2PO4,8.1 mMNa2HPO4,pH 7.4)로 손상된 세포, 느슨한 세포 및 긁힌 부위로부터 방출된 요인을 제거한다. 세포 배양에서 세포를 분리하지 않도록 우물의 벽에 조심스럽게 PBS 2 mL을 추가하십시오.
- 10% 혈청 또는 1% 혈청을 함유하는 세포 배양 배지 2 mL를 각 우물에 조심스럽게 추가합니다.
참고: 10% 혈청 및 1% 세럼 미만의 스크래치 분석기를 수행하여 관찰된 효과가 세포 증식 및 이동 또는 세포 이동에 의해서만 발생한다는 것을 확인하는 것이 좋습니다. - 플레이트를 현미경 단계로 옮기고 가벼운 현미경을 사용하여 10배 배율로 긁힌 직후(잘 당 2개 영역)의 밝은 필드 이미지를 캡처합니다. 항상 스크래치의 동일한 영역을 이미지하려면 단계(1.3)로 준비된 가로선을 사용하고 이 선 위에 하나의 이미지와 이 선 아래에 있는 하나의 이미지를 가져가십시오. 이미지를 TIFF 또는 JPEG로 저장합니다.
- 현미경 단계는 세포 성장 상태를 유지하지 않기 때문에, 플레이트를 세포 배양 인큐베이터로 다시 옮기고 세포를 37°C 및 5%CO2로유지한다.
- 6, 10 및 30 h 후, 플레이트를 다시 현미경 단계로 이동하고 단계 2.6에 설명된 것과 동일한 방식으로 이미지를 캡처합니다.
참고: 이러한 시간 포인트는 기재된 절차 및 1차 섬유아세포에 대해 확립되었습니다. 첫 번째 파일럿 실험 동안, 더 많은 시간 포인트를 테스트하여 섬유아세포가 격차를 얼마나 빨리 다시 채우는지 확인했습니다. 0, 6, 10 및 30h가 합리적인 시작 지점이지만, 조사자는 각 응용 프로그램과 각 셀 유형에 대해 적절한 시간 지점을 최적화하고 설정해야 합니다. 더 정확한 대안은, 가능한 경우에, 시간 경과 현미경 검사법을 사용하는 것입니다. - ImageJ13을사용하여 초기 무세포 영역(100%)을 정량화합니다. 및 6, 10 및 30 h 후 나머지 영역(그림 1). 그런 다음 셀 마이그레이션을 통해 다시 채워진 스크래치 영역의 백분율은 초기 스크래치 영역을 기준으로 계산됩니다.
3. 스크래치 영역 분석
- Open ImageJ 소프트웨어13.
- 이미지를 ImageJ 메뉴 모음에 삭제하여 첫 번째 이미지를 JPEG(예: 24비트 RGB 이미지 1360x1024)로 업로드합니다.
- 프리핸드 선택 버튼을 선택하고 셀 프리 영역을 표시합니다.
- 분석을 클릭하고 측정을선택합니다. 결과가 있는 창에 영역 값이 포함된 창이 나타납니다.
- 이 값을 분석 스프레드시트로 전송합니다.
- 시간 점 0h에서 각 이미지에 대해 3.2-3.5 단계를 반복한 다음 다음 시간 포인트 6, 10 및 30h에 대해 다시 시작합니다.
- 다음 방정식을 사용하여 각 스크래치에 대해 6, 10 및 30h 후에 셀을 마이그레이션하여 다시 채워진 스크래치 영역의 백분율을 계산합니다.
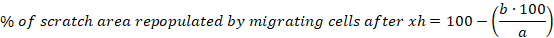
a = 초기 스크래치의 셀 프리 영역, b = 6 시간 이후의 셀 없는 영역 - 6시간 이후 셀을 마이그레이션하여 다시 채워진 스크래치 영역의 백분율에 대한 평균 및 표준 오차(S.E.M.)를 계산합니다.
4. 생체 내 피부 상처 치유 분석
참고: C57BL/6 야생형 수컷(체중 22-26g을 가진 8-12주) 및 Cavβ3 결핍 마우스를 이 연구에 사용됩니다.
- 실험을 시작하기 하루 전에, 피부 접힘 챔버 준비에 사용되는 모든 수술 기구, 나사, 너트 및 티타늄 프레임을 오토클레이브합니다.
참고 : 티타늄 프레임은 두 개의 대칭 보완 반으로 구성되어 있으며 상처가 적용되고 현미경 검사법 (그림 2a참조)이 있는 원형 관찰 창이 있습니다. - 케타민 (75 mg / kg 체중)과 자일라진 (25 mg / kg 체중)의 혼합물을 포함하는 0.1 mL 식염수 / 10g 의 체중을 복강 내 (즉, 체외)에 의해 야생 형 또는 β3 결핍 마우스 (22-26 g 체중)를 마취. 발가락 핀치에 대한 반응이 부족하여 마취의 깊이를 확인하십시오.
참고 :이 주사는 약 30 분 외과 마취를 제공하고 마취의 깊이는 마우스의 반사를 확인하여 수술 절차를 통해 제어해야합니다. - 눈의 건조나 손상을 방지하려면 안과 연고를 두 눈에 바르고 필요한 경우 반복하십시오.
- 조심스럽게 마우스 dorsum을 면도, 전기 면도기를 사용하여 다음 면도 영역에 제모 크림의 응용 프로그램은 나머지 머리를 제거합니다. 마우스 피부를 손상시키지 않도록 주의하십시오. 모든 모발을 완전히 제거하기 위해 탈모 크림을 약 10분 동안 그대로 둡니다.
- 대칭 티타늄 챔버 프레임의 한 부분을 복용하여 티타늄 챔버를 준비하고 한쪽에 너트와 연결 나사를 고정합니다. 이러한 견과류는 피부내 혈관의 압축을 피하기 위해 챔버의 두 대칭 부분 사이에 400-500 μm을 유지하는 스페이서 역할을 할 것이다.
- 마우스 뒷면에서 크림을 제거하고 따뜻한 (35-37 °C) 수돗물로 털이없는 부위를 청소하십시오.
- 수술을 할 장소가 깨끗하고 따뜻하며 (37 °C) 가습되었는지 확인하십시오.
- 피부 소독제로 마우스의 털이 없는 부위를 소독합니다. 광원 앞에서 마우스의 뒤쪽 피부의 주름을 취하고 티타늄 챔버가 이식 될 피부의 이중 층의 중간 선을 배치합니다. 그 후, 폴리 프로필렌 봉합사로 피부를 고정하고 꼬리에 꼬리를 물고 금속 랙에 봉합사의 다른 쪽을 조여 마우스 접힌 피부를 들어 올립니다. 마우스가 편안하게 앉을 수 있도록 랙높이를 조정합니다.
- 티타늄 챔버를 마우스의 뒤쪽 피부의 주름에 이식하여 접힌 등쪽 피부 층을 티타늄 프레임의 두 대칭 반쪽 사이에 끼우는 방식으로 삽입합니다. 티타늄 프레임의 전반부는 폴리프로필렌 봉합사를 통해 등쪽 피부 주름의 뒷면에 우수한 가장자리에 부착합니다.
참고 : 티타늄 프레임에는 우수한 가장자리에 8 개의 구멍이 있으며(그림 2a)접힌 피부는 8 개의 구멍 각각에 폴리 프로필렌 봉합사에 의해 잘 고정되어야합니다. - 다음 단계로 이동하기 전에 마우스의 반사를 확인하여 마취깊이가 유지되는지 확인하십시오.
- 티타늄 챔버의 전반부에 부착된 두 개의 연결 나사를 피부 접기를 뒤쪽에서 앞쪽으로 관통합니다. 연결 나사의 매끄러운 침투를 돕기 위해 피부에 작은 절개를 (미세 가위를 사용하여) 확인합니다.
- 랙에서 마우스를 분리하고 측면 위치에 놓습니다. 티타늄 챔버의 두 번째 상보반을 3개의 연결 나사 위에 놓고(그림 2a참조) 티타늄 프레임의 후반부를 통과하기 위해 손가락으로 약간의 압력을 가합니다. 그런 다음 스테인레스 스틸 너트로 두 대칭 부품을 모두 고정합니다.
- 너무 느슨하면 분리 될 수 있으므로이 단계에서 나사의 압박감에주의하십시오. 대조적으로, 너무 단단하면, 그것은 피부 주름을 짜내고, 혈류를 감소시키고 조직 손상 및 괴사로 이끌어 낼 수 있습니다.
참고: 4.5단계에서 제조된 너트는 티타늄 챔버의 두 대칭 반쪽 사이에 400-500 μm의 거리를 유지하는 스페이서 역할을 한다. 약간의 저항이 느껴질 때까지 너트를 조여야 합니다. - 펜치를 사용하여 나사의 나머지 부분을 잘라냅니다.
참고: 이 단계에서는 나사가 잘못된 방향으로 벗겨지는 경우를 대비하여 눈 보호를 위해 실험실 안전 안경을 사용해야 합니다. - 재발성 상처 크기를 보장하기 위해 피부 접이식 챔버의 관찰 창 내의 피부 중앙에 표준화된 생검 펀치(직경 2mm)로상처 부위를 표시합니다.
- 미세 한 집게와 가위를 사용 하 여 표피와 진피와 함께 전체 피부를 제거 하 여 표시 된 영역 내에서 원형 상처를 만듭니다. 최종 상처 부위는 약 3.5-4.5 mm2, 그림 2b를 참조하십시오. 0.5 mL 멸균 식염수 (0.9 % NaCl, 37 °C)로 상처를 청소하십시오.
- 유리 커버 슬립으로 상처를 덮고 티타늄 챔버의 스냅 링 플라이어를 사용하여 스냅 링으로이 유리 커버 슬립을 고정하십시오.
- 수술 을 마친 직후, 카메라가 장착 된 입체 현미경의 이미징 단계에 마우스를 놓고 조명 아래 이미지 (0 일째)를 찍습니다. 40배 배율을 사용하고 향후 오프라인 분석을 위해 이미지를 저장합니다.
참고: 조사관은 캡처 직후 이미지를 검사하여 향후 오프라인 분석에 품질이 충분한지 확인해야 합니다. 피부 접이식 챔버의 제조 및 피부 상처의 성능은 약 30 분이 소요됩니다. - 적어도 2 시간 동안 마취에서 회복하는 동안 따뜻한 장소에 마우스를 유지하십시오. 그 후, 개별 케이지에 있는 마우스를 동물 시설(12 시간 빛/어두운 주기)으로 옮기고 마우스가 음식과 물에 접근할 수 있는지 확인합니다.
- 3일 후 상처 후 마우스를 마우스 구속기에 놓고 이미징 단계 위에 구속기를 고정시다.
- 카메라가 장착된 스테레오현미경 아래에 스테이지를 놓습니다. 40배 배율로 조명 아래에서 이미지를 찍고, 모든 사진을 녹화하고, 향후 오프라인 분석을 위해 저장합니다.
- 6일째, 10일 및 14일째에 4.20 단계와 4.21단계를 다시 반복합니다.
- ImageJ13의오프라인 분석을 위해 상처 이미지를 사용합니다. 0일째의 상처 부위는 100%로 간주되며 시간이 지남에 따라 상처 폐쇄는 초기 상처 부위를 기준으로 플롯됩니다. 대표적인 결과는 그림 2c,d에나와 있습니다.
- 백분율 계산(%) 다음 방정식을 사용하여 각 시점에서 상처 부위의 다음을 수행합니다.
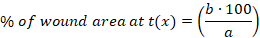
x: 시간 점 (일 0, 3, 10 또는 14), a: 0일째의 상처 부위, b: 시간 지점 x의 상처 부위
결과
스크래치 분석은 야생형 및 β3 결핍 MEFs의 동시 세포 단층상에서 수행하였다(도1c). 200 μL 파이펫 팁을 사용하여 "스크래치"를 수행 한 후, 두 유전형의 세포가 스크래치 영역으로 이동하고 간격을 닫습니다. 이미지는 6, 10 및 30시간 후에 촬영하였다(도1a). 셀 마이그레이션을 백분율(%)으로 정량화했습니다. 스크래치 를 수행한 후 6시간 후에 셀을 마이그레이션하여 다시 채워진 스크래치 영역입니다. Cavβ3 결핍 MEF를 마이그레이션하는 것은 야생 형 마우스로부터의 MEF보다 훨씬 일찍 스크래치 영역을 폐쇄하였다(그림1a,b). 세포 증식의 임의의 효과를 배제하기 위해, 스크래치 마이그레이션 분석기는 10% 또는 1% FCS의 존재 에서 수행되었다. 10% FCS에서 두 과정 모두 존재하며, 세포 증식 및 이동은 1% FCS 세포 증식에서 최소화된다. 섬유아세포는 10%(도1b,왼쪽) 또는 1% FCS(도1b,오른쪽)에서 유사한 이동 패턴을 보였으며, 관찰된 표현형에 대한 세포 증식 기여의 가능성을 배제하였다. Cavβ3 결핍 MEF는 두 조건 하에서 야생형 MEF보다 훨씬 일찍 갭을 폐쇄했습니다. β3 결핍 섬유아세포에서 관찰된 Cavβ3 의존적 효과를 확인하기 위해, 야생형 섬유아세포는 Cavβ3 단백질을 하향 조절하기 위해 siRNA로 형질전환하였다(도1e). 하향 조절에 대한 대조군으로서, 면역혈전은 siRNA 치료의 효율을 확인하기 위해 수행되었다. 2개의 독립적인 Cacnb3 특이적 siRNAs (siRNA1 및 siRNA2) 및 스크램블된 siRNA (대조군으로)가 사용되었다. Cacnb3-특이적siRNAs로 처리된 섬유아세포는 β3 결핍 섬유아세포와 같이 동작한다(도1d),즉, Cavβ3 단백질의 부재에서 이동이 증가된다(도1e).
생체 내에서, 등쪽 피부접이식 챔버(도2a, b)를이식하고 2 mm 직경의 정의된 원형 상처가 다시 면도(도2b)에발생하였으며, 야생형 및 Cavβ3 결핍 마우스(유전자형당 8마리) 8-12 주 및 22-26g 무게). 상처는 표피와 진피를 가진 완전한 피부를 제거함으로써 수행되었다. 두 유전자형 간의 피부 상처 치유를 비교하기 위해, 피부 접힌 챔버 내의 상처 부위를 상처(0일째) 직후 촬영한 후 3, 6, 10 및 14일 후 상처를 촬영하였다(도2c). 상처의 크기는 이러한 디지털 이미지에서 측정되었고 주어진 날의 상처 부위는 백분율(%) 으로 나타났습니다. 초기 상처부위(그림2d). 상처 폐쇄는 야생 형 대조군과 비교하여 β3 결핍 마우스에서 증가된다. 야생형과는 대조적으로, β3 결핍 마우스의 상처는 10일 후에 이미 거의 완전히 폐쇄되었다. 14 일째에 상처는 두 유전형 모두에서 완전히 닫혔습니다(그림 2c,d).
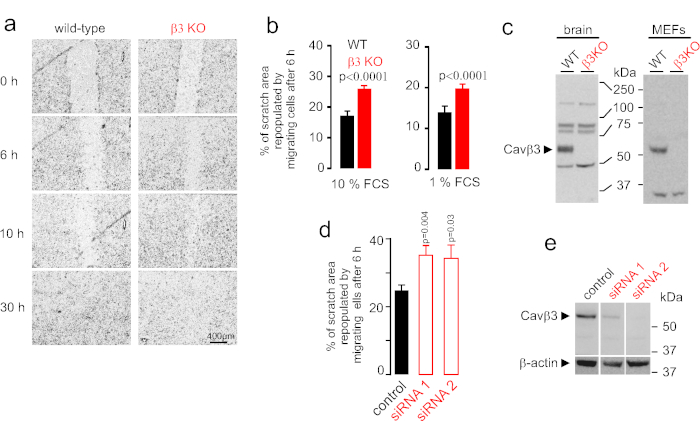
그림 1 : 시험관 내 스크래치 마이그레이션 분석 . (a)야생형(WT, 왼쪽) 및 Cavβ3 KO(β3 KO, 오른쪽) 원발성 마우스 배아 섬유아세포(MEFs)로부터의 배양물의 대표적인 이미지는 스크래치를 수행한 후 즉시, 6, 10 및 30시간 후에. 이미지는 8비트 회색 스케일로 변환되었으며, 밝기뿐만 아니라 대비를 적용하여 셀 프리 영역을 최대로 시각화했습니다. 원래 24비트 RGB 이미지에서 셀 프리 영역(셀 마이그레이션에 의해 다시 채워진 스크래치 영역의 %)을 분석하여 수행하였다. (b)백분율을 보여주는 막대 그래프(%) 6시간 후 세포를 이동시켜 다시 채우면 야생형(10%, 왼쪽) 또는 낮음(1%, 오른쪽) 태아 소 혈청(FCS)이 야생형(검정) 및 Cavβ3 KO(적색)실험(c)면역블롯(50)의 존재 lane당 μg) 및 섬유아세포(MEFs, 100 μg/lane 당)는 Cavβ3 특이적 항체를 사용한다. β3 단백질(55 kDa)은 야생형 뇌(대조군으로 사용됨) 및 섬유아세포에 존재하지만, Cavβ3 결핍 마우스로부터 제조된 Cavβ3 결핍 뇌 및 섬유아세포의 단백질 추출물에는 존재하지 않는다. (d)스크램블된 siRNA(대조군, 검정) 또는 2개의 독립적인 Cacnb3 siRNAs(siRNA1 및 siRNA2, 적색 오픈 바)로 처리된 야생형 세포에서 6시간 후에 세포를 이동시킴으로써 다시 채워진 스크래치 영역의 백분율의 요약. (e)(d)에서실험으로부터 상응하는 면역블롯. 데이터는 평균 ± SEM으로 나타내고, p 값은 짝이 없는 두 꼬리 학생의 t-검정을 사용하여 계산하였다. 패널 a와 b는 [Belkacemi et al., 2018]4에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 생쥐의 생체내 피부 상처 치유. (a)티타늄 프레임 내부 측면 뷰는 티타늄 챔버의 절반을 보여주고 전면 측면 보기는 나사와 너트가 부착 된 두 개의 대칭 반쪽으로 조립 된 티타늄 챔버를 보여줍니다. (b)마우스는 등쪽 피부를 면도하고 2개의 대칭 티타늄 프레임(티타늄 프레임의 무게가 약 2g)으로 구성된 등쪽 스킨폴드 챔버를 장착하고 원형 상처(직경 2 mm)를 도포한 후. (c)상처 후 직접 상처의 이미지 (0 일) 및 3, 6, 10, 및 14 일 후 상처. 완전한 상피화와 함께 상처 폐쇄의 연속적인 과정은 야생형(WT, top) 및 Cavβ3 KO(β3 KO, 하부) 마우스에서 14일 동안 도시된다. (d)지시된 시점에서, 상처 부위는 컴퓨터 보조 영상 분석 프로그램을 이용하여 결정하고 0일째에 부상 직후 상처 부위의 백분율로 플롯하였다(평균 ± SEM 의 n=8, β3 KO 마우스 및 해당 야생형 제어 마우스). P 값은 양방향 ANOVA 및 본페로니의 다중 비교 테스트를 사용하여 계산되었습니다. 패널 c와 d에서 수정되었습니다 [Belkacemi 외, 2018]4. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 원고에서, 우리는 생체 외 및 생체 내 상처 치유 분석기를 설명하고 얻어진 결과를 상관시상한다. 시험관내 분석의 경우, 1차 마우스 섬유아세포4,14,15를 사용하였으며 이는 상처 치유 및 조직 리모델링에 중요한 역할을 한다11. 단층으로 성장하는 다른 부착 세포 유형 (예를 들어, 상피 세포, 내피 세포, 각질 세포)도 사용할 수 있습니다. 정확하고 재현 가능한 결과를 얻기 위해서는 동일한 수의 생존 가능하고 건강한 세포를 도금하고 동일한 수준의 컨플루시로 스크래치를 적용하는 것이 가장 중요합니다. 생물학적 및 기술적 복제를 수행하는 것이 좋습니다. 본 방법에서는 6 웰 플레이트가 사용되었지만 12- 또는 24 웰 플레이트는 특히 제한된 수의 셀만 사용할 수있는 경우에도 사용할 수 있습니다. siRNA 처리의 경우에, 실험의 각 세트 후에 면역 블롯 분석은 표적 단백질이 능등하게 하향 조절되는지 확인하기 위하여 필수적입니다. 형질감염 시약 및 시간 윈도우는 마이그레이션 분석으로 시작하기 전에 각 세포 유형에 대해 테스트되고 선택되어야 합니다. 섬유아세포 및 Cacnb3 유전자의 경우, 원하는 하향 조절 수준에 도달하는 데 3~4일이 걸렸습니다. 대조적으로, 스크래치 마이그레이션 분석은 더 짧은 시간(6시간 ~ 24시간)을 필요로 한다. 스크래치 크기의 높은 가변성을 피하기 위해 동일한 조사자가 각 실험 세트에 스크래치를 적용하고 파이펫 팁에 의해 동일한 압력을 관리하고 상처를 가능한 한 수직으로 표시 선에 유지해야 합니다. 플레이트 의 바닥에 걸쳐 세포 단층. 세포 단층전반에 걸쳐 기계적 스크래치의 적용은 손상된 세포에서 세포 외 공간으로 다른 세포 요인 (예를 들어, ATP)의 방출로 이끌어 냅니다. 이 요인은 차례로 셀방식반응16에영향을 미칠 것이다 인접한 세포에 있는 Ca2+-signaling를 포함하여 paracrine 신호를 유도할 것입니다. 이러한 효과를 피하기 위해, 배양 인서트를 도금 세포에 사용할 수 있으며 이러한 인서트를 제거한 후 인서트를 제거한 후 인접한 세포를 손상시키지 않고 무세포 갭이생성된다(17). 높은 처리량 스크리닝의 경우, 조사관은 시중에서 사용할 수 있는 기기를 사용하여 96웰 플레이트에서 재현 가능하고 일관된 스크래치를 만드는 것을 고려할 수 있습니다. 시간이 지남에 따라 세포 이동 역학을 지속적으로 따르기 위해 사용자는 자동 이미지 캡처를 위해 고급 상용 시스템을 사용하는 것을 고려할 수 있습니다. 그러나 스크래치 응용 프로그램 및 이미지 캡처를 위한 자동화된 시스템은 비용이 많이 들기 때문에 항상 사용할 수 있는 것은 아닙니다. 시간 경과 화상 진찰을 위한 더 접근하고 비용 효과적인 해결책은 예를 들면 시스템 (ATLIS: 적당한 시간 경과 화상 진찰 및 인큐베이션 시스템)를 사용하여 Hernandez Vera 및 동료18에의해 기술될 것입니다.
임의의 세포 증식 억제제의 부재에서, 스크래치 이동 분석에서의 갭의 재모집단은 세포 이동 및 세포 증식의 조합이다. 세포 이동만을 모니터링하기 위해, 세포 증식은 예를 들어 액티노마이신 C19 또는 미토마이신 C20을사용하여 치료함으로써 억제될 수 있다. 이러한 화합물의 적절 한 농도 신중 하 게 결정 하 고 이러한 화합물의 독성 효과 피하기 위해 테스트 해야 합니다., 세포의 생존력과 마이그레이션 하는 능력에 영향을 미칠 수 있는. 본 항에 기재된 바와 같이, 배양배지에서 혈청 결치 또는 혈청 농도의 감소는 세포 증식의 영향을 감소시키는 또 다른 방법이다. 혈청 기아는 몇몇 다른 세포 기지를 둔 세포 기지를 둔 세포 기지를 둔 세포 성 세포 세포 에서 이용됩니다. 높은 수의 세포 반응을 유도할 수 있으며, 이는 얻어진 결과 및해석(21)을방해할 수 있다. 혈청 기아는 신중하게 적용되어야하며 실험을 시작하기 전에 세포 생존력에 미치는 영향을 평가해야합니다. 본 기사에서, 10% 또는 1% 혈청의 존재 에서 1 차 섬유아세포의 이동이 도시된다(도 1b참조). 예상대로, 혈청의 낮은 농도에서 느린 마이그레이션 속도. 그러나, β3 결핍 섬유아세포는 두 조건 모두에서 야생형 세포보다 더 빨리 이동한다; 낮은 높은 혈청 농도.
등지 피부 접이식 챔버를 이용한 피부 상처 치유 분석기는 생체 내에서 시간이 지남에 따라 피부 상처 폐쇄를 조사하는 비교적 간단한 절차이다. 티타늄 등쪽 피부 접이식 챔버의 이식은 랫트22에서처음으로 기술되었다. Sorg 등은 SKH1-hr 털이 없는 마우스에서 이 기술을 사용하여 상처 치유및 새로운 혈관 형성을 따랐다9. 본 항에 기술된 스킨폴드 챔버 모델은 등쪽 피부, 귀23 또는 뒷사지7에 대해 수행된 고전적인 상처 치유 아세(healing) 법제에 비해 많은 장점을 갖는다. 유리 커버 슬립으로 상처 부위를 덮면 감염과 조직 외상을 예방하고 상처의 건조를 제한합니다. 유리 커버 슬립으로 덮인 관찰 챔버는 치유 과정에서 언제든지 열 수 있어 다른 약리활성 화합물 (예를 들어, Cavβ3용 siRNA 용액 또는 연고)의 국소 적용을 허용하고 챔버는 치유 과정 중에 언제든지 열 수 있습니다. 다시 닫힙싸습니다. 뮤린 피부 상처 치유 과정은 수축 및상피화(24)로구성된다. 마우스에서 등지 스킨 폴드 챔버를 사용하여 피부 수축을 최소화하고 주로 상피화 과정을 연구 할 수있는 기회를 제공합니다. 또한 상처 폐쇄 과정을 관찰하고 모니터링할 수 있는 명확한 창을 제공합니다. 티타늄 챔버의 한 가지 단점은 마우스가 14 일 동안 약 2g (26g 마우스의 무게의 7.7 %)의 무게를 가진 티타늄 챔버를 운반해야한다는 것입니다. 이것은 마우스를 위한 몇몇 불편을 일으키는 원인이 될 수 있습니다, 마우스가 이 방을 잘 용납하고 그(것)들이 편안하고 쉽게 음식과 근해에 도달할 수 있는 것처럼 보이지만. 이 기사에서 제시 된 피부 상처 치유 모델은 마우스 당 하나의 상처만 연구 할 수 있습니다. 다른 출판 된 방법25,26 연구에 필요한 동물의 수를 줄일 것 이다 마우스 당 두 개의 상처를 적용 제안. 모든 마우스가 객관적인 정보와 신뢰할 수 있고 재현 가능한 결과를 얻기 위해 비슷한 크기의 원형 상처를 만드는 것이 매우 중요합니다. 시간이 지남에 따라 상처의 이미지를 찍기 위해 마우스를 마우스 억제기에 고정하고 무대에 배치하고 피부 접이식 챔버는 입체 현미경 아래에 위치합니다. 억제기를 사용하면 마취를 피하고 쥐의 스트레스를 최소화하는 데 도움이됩니다. 마우스는 희생될 수 있고 상처 부위로부터의 조직은 조직학적 분석, RNA 수집 또는 단백질 생화학을 위해 치유 과정의 여러 단계(완전한 치유 후 또는 초기 시점)에서 이식 및 수집될 수 있다.
요약하면, 우리는 2개의 기술, 1 차적인 섬유아세포및 마우스에 있는 생체내 피부 상처 치유 분석법을 사용하여 시험관내 스크래치 분석법을 보여주었습니다. 두 분석에서, 상처 치유 /갭 폐쇄는 전압 게이트 칼슘 채널의 Cavβ3 소단위의 부재에서 증가한다. 야생형 및 Cavβ3 결핍 마우스 또는 세포와 마찬가지로, 두 가지 모두 다른 특정 분자의 부재 또는 존재와 잘 연관될 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 박사 페트라 바이스 거버와 SPF 동물 시설의 트랜스 유전자 단위 (SFB의 프로젝트 P2 894) 의료 학부의 및 자를 란트 대학의 의료 학부에서 임상 및 실험 수술 연구소의 동물 시설, 홈버그. 안드레아스 벡 박사님이 원고를 비판적으로 읽어 주신 것에 감사드립니다. 이 연구는 도이치 포르충스게마인샤프트(DFG) 손더포스충스베라이히(SFB) 894, A3~A.B. 및 V.F.에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.9 % NaCl | |||
| 1 ml syringes | BD Plastipak | 303172 | |
| 6 well plate | Corning | 3516 | |
| Biopsy punch | Kai Industries | 48201 | 2 mm |
| Cacnb3 Mouse siRNA Oligo Duplex (Locus ID 12297) | Origene | SR415626 | |
| Depilation cream | any depilation cream | ||
| Dexpanthenol 5% (BEPANTHEN) | Bayer | 3400935940179.00 | (BEPANTHEN) |
| Dihydroxylidinothiazine hydrochloride (Xylazine) | Bayer Health Care | Rompun 2% | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by life technologies | 41966-029 | |
| Fetal bovine serum | Gibco by life technologies | 10270-106 | |
| Hexagon full nut | |||
| Ketamine hydrochloride | Zoetis | KETASET | |
| Light microscope | Keyence, Osaka, Japan | BZ-8000 | Similar microscopes might be used |
| Lipofectamine RNAiMAX Transfection Reagent | Thermo Fisher Scientific | 13778075 | |
| Micro-forceps | |||
| Micro-Scissors | |||
| Mouse restrainer | Home-made | ||
| Normal scissors | |||
| Objective | Nikon | plan apo 10x/0.45 | |
| Opti-MEM | Gibco by life technologies | 51985-026 | |
| Polypropylene sutures | |||
| Screwdriver | |||
| Skin disinfectant (octeniderm) | Schülke & Mayr GmbH | 118212 | |
| Slotted cheese head screw | |||
| Snap ring | |||
| Snap ring plier | |||
| Surgical microscope with camera | Leica | Leica M651 | |
| Titanium frames for the skinfold chamber | IROLA | 160001 | Halteblech M |
| Wire piler |
참고문헌
- Gurtner, G. C., Werner, S., Barrandon, Y., Longaker, M. T. Wound repair and regeneration. Nature. 453, 314-321 (2008).
- Martin, P. Wound healing--aiming for perfect skin regeneration. Science. 276, 75-81 (1997).
- Gabbiani, G., Gabbiani, F., Heimark, R. L., Schwartz, S. M. Organization of actin cytoskeleton during early endothelial regeneration in vitro. Journal of Cell Science. 66, 39-50 (1984).
- Belkacemi, A., et al. IP3 Receptor-Dependent Cytoplasmic Ca(2+) Signals Are Tightly Controlled by Cavbeta3. Cell Reports. 22, 1339-1349 (2018).
- Breuing, K., Eriksson, E., Liu, P., Miller, D. R. Healing of partial thickness porcine skin wounds in a liquid environment. Journal of Surgical Research. 52, 50-58 (1992).
- Colwell, A. S., Krummel, T. M., Kong, W., Longaker, M. T., Lorenz, H. P. Skin wounds in the MRL/MPJ mouse heal with scar. Wound Repair and Regeneration. 14, 81-90 (2006).
- Vagesjo, E., et al. Accelerated wound healing in mice by on-site production and delivery of CXCL12 by transformed lactic acid bacteria. Proceedings National Academy of Science. 115, 1895-1900 (2018).
- Eming, S. A., et al. Accelerated wound closure in mice deficient for interleukin-10. American Journal of Pathology. 170, 188-202 (2007).
- Sorg, H., Krueger, C., Vollmar, B. Intravital insights in skin wound healing using the mouse dorsal skin fold chamber. Journal of Anatomy. 211, 810-818 (2007).
- Laschke, M. W., Vollmar, B., Menger, M. D. The dorsal skinfold chamber: window into the dynamic interaction of biomaterials with their surrounding host tissue. European Cell and Materials. 22, 147-164 (2011).
- Trepat, X., Chen, Z., Jacobson, K. Cell migration. Comprehensive Physiology. 2, 2369-2392 (2012).
- Hofmann, F., Belkacemi, A., Flockerzi, V. Emerging Alternative Functions for the Auxiliary Subunits of the Voltage-Gated Calcium Channels. Current Molecular Pharmacology. 8, 162-168 (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9, 676-682 (2012).
- Chen, L., et al. Protein 4.1G Regulates Cell Adhesion, Spreading, and Migration of Mouse Embryonic Fibroblasts through the beta1 Integrin Pathway. Journal of Biological Chemistry. 291, 2170-2180 (2016).
- Dewor, M., et al. Macrophage migration inhibitory factor (MIF) promotes fibroblast migration in scratch-wounded monolayers in vitro. FEBS Letters. 581, 4734-4742 (2007).
- Handly, L. N., Wollman, R. Wound-induced Ca(2+) wave propagates through a simple release and diffusion mechanism. Molecular Biology of the Cell. 28, 1457-1466 (2017).
- Cappiello, F., Casciaro, B., Mangoni, M. L. A Novel In Vitro Wound Healing Assay to Evaluate Cell Migration. Journal of Visualized Experiments. (133), 56825 (2018).
- Hernandez Vera, R., Schwan, E., Fatsis-Kavalopoulos, N., Kreuger, J. A Modular and Affordable Time-Lapse Imaging and Incubation System Based on 3D-Printed Parts, a Smartphone, and Off-The-Shelf Electronics. PLoS One. 11, 0167583 (2016).
- Reinhart-King, C. A. Endothelial cell adhesion and migration. Methods in Enzymology. 443, 45-64 (2008).
- Treloar, K. K., Simpson, M. J. Sensitivity of edge detection methods for quantifying cell migration assays. PLoS One. 8, 67389 (2013).
- Pirkmajer, S., Chibalin, A. V. Serum starvation: caveat emptor. American Journal of Physiology-Cell Physioliology. 301, 272-279 (2011).
- Papenfuss, H. D., Gross, J. F., Intaglietta, M., Treese, F. A. A transparent access chamber for the rat dorsal skin fold. Microvascular Research. 18, 311-318 (1979).
- Deoliveira, D., et al. An ear punch model for studying the effect of radiation on wound healing. International Journal of Radiation Biology. 87, 869-877 (2011).
- Chen, L., Mirza, R., Kwon, Y., DiPietro, L. A., Koh, T. J. The murine excisional wound model: Contraction revisited. Wound Repair and Regeneration. 23, 874-877 (2015).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiment. (75), e50265 (2013).
- Wahedi, H. M., Park, Y. U., Moon, E. Y., Kim, S. Y. Juglone ameliorates skin wound healing by promoting skin cell migration through Rac1/Cdc42/PAK pathway. Wound Repair and Regeneration. 24, 786-794 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유