Method Article
처리 및 인간의 기본 전립선 Organoid 문화에 대 한 평가
요약
여기, 우리 인간의 기본 전립선 organoid 처리 안내 다음 끝점 표현 형을 평가 하는 것이 좋습니다 프로토콜을 제시. 시드, 문화 유지 보수, 매트릭스 젤에서 복구 형태 론 적 정량화, 포함 및 단면, FFPE 단면, 전체 마운트 얼룩, 및 상업적인 분석의 응용 프로그램 설명 합니다.
초록
이 문서에서는 3 차원 (3D) 경작, 처리, 및 인간의 기본 전립선 organoids의 평가 대 한 상세한 프로토콜을 설명합니다. 과정의 미디어 변경 organoids로 확장을 육성 하기 위해 96-잘 microplate에 3D 매트릭스 젤에 띄엄띄엄 상피 세포의 시드를 포함 한다. 형태는 다음 z 스택 이미지의 전체 잘 포착 하 여 평가 됩니다. Z 스택의 압축은 organoids 출력, 순환, 진원도, 지역 등의 다양 한 계량 측정은 단일 포커스 이미지를 만듭니다. DNA, RNA 및 단백질 organoids 매트릭스 젤에서 복구에서 수집할 수 있습니다. 관심의 세포 인구 organoid 분리에 의해 평가 될 수 있다 고 cytometry 흐름. 포 르 말린-고정-파라핀-포함 (FFPE) 단면 이어서 조직학 평가 및 항 체 얼룩이 지기 사용 됩니다. 전체-마운트 immunofluorescent 얼룩 organoid 형태를 유지 하 고 제자리에organoids 단백질 지 방화의 관찰을 용이 하 게. 3D organoids에 대 한 2 차원 단층 세포에 전통적으로 사용 되는 상업 분석 실험을 수정할 수 있습니다. 함께 사용이 프로토콜 기술을 전립선 organoid 성장, morphologic 특성 및 분화 마커의 표현 척도를 강력한 도구를 제공 합니다.
서문
Organoids는 organogenesis 및 질병 연구에 귀중 한 도구입니다. 그들은 동물 모델을 덜 비싼 대안을 제공 하 고 환자 파생 된 organoids 맞춤된 의학1,2,3에 대 한 전략으로 발전 하 고 있습니다. 이 3 차원 (3D) 문화 시스템 기질 구성 요소 (매트릭스 젤)4의 젤으로 시드 줄기 또는 조상 세포 조직에서 수확 (유도 만능 줄기 세포) 포함. 세포 증식 하 고 차별화, 셀룰러 계층 구조와 관심의 기능 단위의 장기의 형태를 정리 하는 organotypic 구조체에 발생 합니다. Organoids 다양 한 장기, 침 샘, 위, 소장, 간, 전립선, 폐 및 두뇌4등에서 발생 하는 셀을 사용 하 여 재배 되었습니다. 비록 수많은 프로토콜 전립선 organoids5,6을 설정 하는 단계를 설명 하는, organoids에서 양적 끝점을 달성 하는 방법에 자세한 방법을 찾기 위해 도전 이다. 이 종이 인간의 기본 전립선 세포에 대 한 개발 하는 방법을 요약 하 고 세부 organoid 고기를 평가 하기 위해 제안 된 끝점의 시리즈. 이러한 기술은 전립선 organoids 최적화 했다 고 다른 3D 셀 문화에 적용 될 수 있습니다.
전립선 organoid 문화는 귀중 한 생체 외에서 모델을 사용 하 여 단층 문화의 한계 없다 설립 불멸 하 게 셀 라인으로 최근에 나왔다. 양성 전립선 상피와 전립선 암 모델에 생체 외에서 불멸 하 게 세포를 사용 하 여 도전 이다. 양성 세포의 수는 제한, 그리고 모든 oncogenes7변화 받은. Monolayers에 기본 전립선 상피 세포 하지 luminal 세포로 분화 하 고 안 드로 겐 수용 체8부족. 전립선 암 세포 선의 대다수는 기능 안 드로 겐 수용 체, 초기 질병 상태, 및 부족 키 유전자 변화 환자 종양9에서 발견 되었습니다 중요 한 중재자를 필요가 없습니다. 전립선 organoid 문화 양성 상피에서 쉽게 재배 될 수 있으며 줄기 세포 속성, 조상 세포, 분화, 및 microenvironment4,5에 실험 변경의 효과 공부 하 고 귀중 한. 전립선 암 organoids 환자 질환과 치료10에 대 한 응답을 모델링 하는 정밀 의학 접근의 일환으로 성장 수 있다.
이 프로토콜은 다양 한 세포 유형, 사용 하는 기존 프로토콜에서 컴파일 되었습니다 하지만 그것은 여기 인간의 기본 전립선 세포에서 사용 하기 위해 최적화 되었습니다. 그것은 칭찬 Sawyers, Clevers, 고 쉔에 의해 제시 된 프로토콜5,6 , 뿌리고, 밝은 필드 이미징, cryopreservation, 성장과 전립선 쥐와 인간 organoids의 RNA와 DNA 격리를 설명 하는. 전체-마운트 프로토콜 마헤 외 에서 수정 11, 위장 상피 organoids를 사용 하 고 설명 합니다 라이브 이미징 및 냉동 고 포함 파라핀. Borten 외. 12 유 방, 결 장, 그리고 밝은 필드 영상에서 대 장 암 organoid 형태학의 분석을 설명합니다. 또한, 리차드는 외. 13 전립선 organoids의 형태 론 적 평가 대 한 메서드를 사용. 마지막으로, Hu 외. 14 챔버 슬라이드를 organoids immunofluorescent 단일 셀과 교류 cytometry 분석 분야의 분산에 얼룩 전에 하룻밤 접착 전립선의 방법을 설명 합니다.
이 프로토콜의 목표 셀 시드; 포함 한 프로토콜로이 기술적으로 도전적인 방법 충분 한 세부 사항에서 설명 하는 것입니다. 미디어와 매트릭스 젤 유지 보수; cytometry;에 대 한 셀의 컬렉션 RNA, DNA, 단백질 추출; morphologic 평가 밝은 필드 z-스택 분석; 포함, 처리 및 조직학 얼룩;에 대 한 단면 그리고 면역 형광 또는 형광등 조사 분석에 대 한 전체 설치. 생물 학적 관련성 및 이러한 다양 한 끝점의 해석 실험 설계 및 분석에 사용 되는 항 체 사이에서 달라질 수 있습니다. 이 프로토콜의 활용을 통해 사용자가 끝점의 도구 키트와 함께 실험을 설정할 준비가 느껴야 합니다.
인간의 기본 전립선 상피 (사전) 세포 프로토콜 Peehl15,16 에서 설명 하 고 앞에서 설명한17, (4)까지 통행의 제한 된 수를 유지 하 여 실험실에서 설립 되었다 그러나 그들은 또한 상업용 공급 업체에서 사용할 수 있습니다. Hepatocyte 미디어 기반 혈 청 무료6, KSFM 기반13및 R-spondin 1 조절5 미디어 모두 성공적으로 organoids을 생산 하는 데로 게시 됩니다. KSFM 기반 그래서 여기 설명 첨가제의 적은 번호가 필요 합니다.
프로토콜
다음 프로토콜은 일리노이 대학 시카고 병원에서 환자의 조직에서 수확 인간의 기본 전립선 상피 세포를 사용 하 여 최적화 되었다. 이 실험을 위해 사용 하는 모든 인간의 조직 프로토콜 인수를 통해 기관 검토 위원회 승인 및 시카고에 일리노이의 대학에서 면제 했다. 문화 조건 관심의 세포 유형에 따라 달라 집니다 동안 끝점 organoids의 다른 조직에 적용할 수 있습니다.
1. 상피 세포의 변화 하는 미디어 매트릭스 젤으로 시드
- 필요한 자료를 수집: 인간의 기본 전립선 상피 세포 (예약), 얼음, 96-잘 microplate, 얼음, keratinocyte 혈 청 무료 미디어 (KSFM)에 매트릭스 젤 숯 박탈된 태아 둔감 한 혈 청 (FBS), 그리고 dihydrotestosterone (DHT).
- KSFM의 47.5 mL 2.5 mL 숯불 박탈된 FBS와 dihydrotestosterone (DHT)의 결합 하 여 얼음에 10 nM DHT, 다음 예약의 최종 농도 KSFM 기반 organoid 미디어를 준비 합니다.
- 셀 문화 후드 무 균 기술을 사용 하 여 3D 매트릭스로 플레이트 세포.
- 부드럽게 믹스 감기 KSFM 기반 organoid 미디어 50% 매트릭스를 얼음 처럼 차가운 매트릭스 젤 젤 혼합 천천히 위아래로 pipetting, 거품을 피하.
참고: 매트릭스 젤 4 ° C에서 하룻밤 해 동 고 가능 하면 얼음에 보관 될 해야 합니다. 그것은 실내 온도 (RT)에 신속 하 게 굳은 것 이다. - 미리 피 펫 팁 차가운 미디어와 전송 40-50 50% 행렬의 μ 젤 96 잘 접시에 사용 될 각의 하단에 젖은. 코트 기본 레이어를 우물의 바닥.
이 거품을 만들 수 있습니다 참고: 피 펫에 두 번째 중지 완전히 분배 하지 않습니다. - 기본 레이어를 강화 하기 위해 30-45 분 동안 37 ° C 배양 기에 96 잘 접시를 놓습니다.
참고: 고형화 했다 또는 셀 수 있습니다 접시의 바닥에 매트릭스를 통해가 고는 단층으로 성장 될 때까지 기본 레이어에 상피 세포를 플레이트 하지 마십시오. - 100-1000 셀/100 μ의 최종 농도 달성 하기 위해 매트릭스 젤와 33% 매트릭스 젤 KSFM 기반 organoid 미디어에 상피 세포를 혼합. 플레이트 잘 당 33% 매트릭스 젤/셀 혼합물의 100 μ를 사용 하 여 기본 레이어 위에 상피 세포.
참고: 이전 실험 그 상피 세포 차원에서 너무 밀도가 시드 제한 됩니다 organoid 성장의 크기 시드 너무 띄엄띄엄 귀 착될 수 있다 매우 낮은 수익률13동안 나타났습니다. 그것은 관심, 환자 전용 organoid 형성 효율에 따라 셀 형식에 대 한 시드 조건을 최적화 하는 것이 중요입니다.
- 부드럽게 믹스 감기 KSFM 기반 organoid 미디어 50% 매트릭스를 얼음 처럼 차가운 매트릭스 젤 젤 혼합 천천히 위아래로 pipetting, 거품을 피하.
- 응고, 매트릭스 젤 수 있도록 30-45 분 동안 37 ° C 배양 기에서 96 잘 접시를 놓습니다 다음 부드럽게 천천히 우물의 가장자리에 pipetting으로 셀 위에 KSFM 기반 organoid 미디어의 100 μ를 추가 합니다.
- 2-3 일 마다 미디어를 변경 합니다. 우물의 측에 대하여 pipetting 미디어와 매트릭스 젤 사이 공간 신중 하 게 제거 미디어의 50 μ와 신선한 미디어의 50 μ를 바꿉니다.
참고: 장기 문화에 대 한 매트릭스 젤 2-3 주에 한 번씩 변경 해야 합니다. 매트릭스 젤 문화 불안정 나타납니다 현미경 반투명 주름을 표시 하는 경우 매트릭스 젤 세분화 했다 그리고 교체 해야 합니다.
2입니다. 매트릭스 젤에서 Organoids의 수집
참고: organoids의 컬렉션은 매트릭스 젤 변경, 뿌리고 또는 RNA 추출, DNA 추출, 단백질 추출, cytometry의 끝점입니다.
- 따뜻한 중립 protease와 행 크 스 소금물 (HBSS) 37 ° C 물 욕조에 균형.
- 조심 스럽게 매트릭스 젤을 방해 하지 않고 우물에서 미디어를 제거.
- 각 잘 ~ 1 ~ 200 μ 중립 protease의 추가: 2 비율 매트릭스 젤: 중립 protease의 고 37 ° c.에 20 분 동안 품 어
- 기계적으로 아래로 pipetting으로 매트릭스 젤: 중립 효소 혼합물을 분리.
- 37 ° c.에 20 분 동안 품 어
- Microcentrifuge 튜브 또는 볼륨 따라 원뿔 튜브에 중립 protease 매트릭스 젤 세포 혼합물을 전송 합니다. 펠 렛 셀 3-5 분 300 x g 에서 원심.
참고: 없는 셀 펠 릿 나타나면 매트릭스 젤 완전 하 게 해리 하지 수 및 분홍색 상쾌한에서 튜브의 하단에 반투명 위상으로 구상 될 수 있다. 제거는 상쾌한 고 추가 더 중립적인 효소 1:2 비율로 매트릭스 젤 펠 릿, 37 ° C에서 또 다른 20-40 분 동안 품 어 300 x g에서 원심 분리를 반복. - Organoid 펠 릿 인수는 상쾌한을 제거 합니다. 뿌리고 (단계 2.7.1 참조), organoid 세포 RNA, DNA, 또는 단백질 추출에 대 한 진행 (단계 2.7.2 참조), cytometry, 그리고 단일 셀 시퀀싱 (단계 2.7.3 참조)에 의해 처리 단일 세포.
- 장기 문화에 대 한 부드럽게 1.1-1.5 단계에 설명 된 단계에 따라 33% 신선한 매트릭스 젤과 접시에 그대로 organoids resuspend. 해리 organoids 단일 셀으로 replate, 따뜻한 휴대-분리 효소의 1 mL에 펠 릿을 resuspend 및 10-15 분 동안 37 ° C에서 품 어, HBSS의 5 mL로 한번 세척 하 고 다시 다음 단계 1.1-1.5 신선한 매트릭스 젤에 접시.
- 재료의 테이블에 에서 나열 된 RNA 추출, DNA 추출, 또는 단백질 추출에 대 한 적절 한 세포의 용 해 버퍼에 organoid 펠 릿을 resuspend 하 고 제조 업체의 프로토콜을 따릅니다.
- 따뜻한 휴대-분리 효소의 1 mL에 organoids를 resuspend 하 고 단일 세포로는 organoids 해리를 10-15 분 동안 37 ° C에서 품 어. HBSS의 5 mL로 한 번 씻어 고 흐름 cytometry5 또는 단일 셀 시퀀싱18에 대 한 프로토콜.
참고: 매트릭스 젤의 낮은 농도에서 단일 세포로 분열을 중립 효소 수 있습니다 필요 하지, 그리고 셀 분리 효소 단계 2.2 후 우물에 직접 적용할 수 있습니다.
3. 전체 잘 이미지 수집 및 Organoid 형태학의 분석
- 전체-잘 z-스택 이미지를 동력으로 전송된 빛 거꾸로 현미경을 사용 하 여 X / Y 단계 ( 그림 1A에 나와 있는 워크플로) 검색.
- 우물의 바닥에 조정 초점 위치, 첫 번째 organoid 발생 기본 계층에서 초승달 모양으로 잘의 중심에 있을 것입니다 때까지 위쪽으로 집중 시작 합니다. 이 위치에서 z-플레인을 설정 합니다.
- 마지막 organoid 초점, 우물의 주변에 있을 것입니다 때까지 위쪽으로 초점을 계속 합니다. 이 위치에서 최고의 z 평면을 설정 합니다.
참고: z-스택의 위아래를 설정한 후이 위치 모든 나머지 우물 내에서 organoids 캡처하고 필요에 따라 위/아래 조정 확인 합니다. Z-범위 각 잘 내 모든 organoid 포함 하는 단일 검색에 사용 될 수 있습니다. - 잘, 더 큰 해상도 대 한 더 큰 숫자를 사용 하 여 당 15-35 z-비행기를 캡처하십시오. 전체 잘 이미지를 캡처, 병합 하 고 필요한 경우 사분면 또는 하위 수집.
참고:이 좋습니다을 단일 반대로 여러 z-비행기 z-비행기, 그림 1B 는 organoids는 초점 하나의 z-비행기를 캡처할 때에서 볼 수 있듯이. - 다운스트림 분석에 대 한 z-스택 이미지를 저장 합니다.
- 자유형 그리기 기능 이미지 소프트웨어를 사용 하 여 이미지를 분석 합니다.
- 3.1.4 단계에서 설정 하나의 z-평면 이미지를 엽니다.
- 필요한 경우, 단일, 전체 그럼 이미지에 각 개별 z-평면에서 찍은 이미지 타일. 새로운 이미지를 별도 파일로 저장 합니다. 각 z-비행기 인수에 대 한이 프로세스를 반복 합니다.
- 이미지 소프트웨어를 사용 하 여 단일 우물에서 모든 z-비행기에 대 한 전체-잘 이미지를 열고을 z-비행기의 스택에서 필드 (EDF) 이미지의 확장된 깊이 만듭니다.
참고: 이미지의이 종류는 우물의 단일 초점에서 이미지를 만들려면 각 z-비행기의 최고의 초점 영역을 선택 합니다. - 측정 되는 이미지의 눈금 막대를 소프트웨어의 픽셀 규모를 설정 합니다.
- 이미지 소프트웨어의 자유형 그리기 도구를 사용 하 여 모든 organoid 우물에의 경계를 추적 합니다.
- 이미지 소프트웨어에서 추적된 organoid 경계에 대 한 측정 메트릭을 가져옵니다.
참고: 권장된 매개 변수는 지역, 순환, 및 최대/최소 반경 비율. 이 통계의 응용 프로그램을 설명 하는 대표적인 결과 그림 1C에 표시 됩니다. 지역은 organoid의 경계에 의해 정의 된 다각형에서 계산 됩니다. 진원도 직경 동등한은 organoid의 최대 흰 족제비, 0은 덜 원형 그리고 1 더 원형 원과의 영역에 organoid 영역의 비율입니다. 최대/최소 반경 최대 반지름과 최소 추적된 organoid 반경 사이의 비율이입니다.
순환 =
반경 비율 =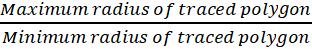
4. 포 르 말린 고정 및 파라핀 조직학 끝점에 대 한 Organoids의 포함
- 포함 공급 준비: HBSS, 2 %agar 솔루션, 조직학 마킹 염료, 조직학 젤 플라스틱 팁 형, 테이프, 플런저 1 cc 인슐린 주사기, 얼음 팩, 카세트, 10% 중립 버퍼링 된 포 르 말린 (NBF), 연필, 그리고 75% 조직학 급료 에탄올 (EtOH)에서.
- 2 개의 microcentrifuge 관 2 %agar 솔루션의 준비. 물 욕조에 또는 액체 형태로 agar를 유지 하기 위해 100-110 ° C에서 열 블록에 품 어. 1-2 방울 더 연결 하 고 포함 하는 동안 방향 유지에 염료는 agar의 상위를 나타내는 것입니다 2 %agar 솔루션 중 하나를 표시를 추가 합니다. 잘 믹스.
- 55-65 ° c.에 물 목욕 또는 열 블록에서 조직학 젤 따뜻한
- 1000 μ 피 펫 팁을 사용 하 여, 피 펫 팁 ~ 50 μ를 보유 하 고 실린더 만들기의 작은 부분을 절단 하 여 금형을 만듭니다. 첫 번째 금형 주위에 맞는 두 번째, 더 넓은 금형을 만듭니다.
- 포장 테이프 (접착성 측을)으로 얼음 팩 테이프 형 준수 여 감기 블록을 만듭니다.
- 1 cc 인슐린 주사기에서 플런저를 제거 하 여 플런저를 만듭니다.
- 그림 2A에묘사 된 워크플로 다음 처리를 위해 조직학 젤 플러그에는 organoids를 포함 합니다.
- 매트릭스 젤 해리 고 단계 2.1-2.7에 따라 organoids을 펠 렛.
- 300 x g 에서 3-5 분 동안 회전 하는 상쾌한 제거 하 여 HBSS 고 다시 펠 렛의 1 mL를 한번 organoid 펠 릿을 세척.
- 다시 액체 조직학 젤의 30-50 μ에 organoid 펠 릿을 일시 중단 합니다. 부드럽게 천천히 위아래로 pipetting으로 혼합. 차가운 블록에 금형으로 조직학 젤/organoid 혼합물을 전송 하 고 냉각 하 고 플러그인으로 공고히 견본을 허용.
- 플런저를 사용 하 여 작은 금형 및 큰 금형에 플러그를 밀어. 큰 금형을 채우기 위해 플러그 주위 분명 2 %agar 플라스틱
- 조직학 염료 착 색 2 %agar 샘플의 상위를 플러그 위에 플라스틱
- 일단 냉각, 조직학 카세트에 플러그를 전송 하는 플런저를 사용 합니다. 10%에 연필과 장소 카세트를 사용 하 여 카세트 라벨 NBF 고정 하룻밤을 위한.
- 10%에서 카세트를 전송 70% 조직학 학년 EtOH NBF.
- 프로세스 조직학 젤 사용 가능한 경우는 프로세서에 사전 설정된 생 프로토콜을 사용 하 여 연결 합니다. 사전 설정을 사용할 수 없는 경우 다음 시퀀스 및 길이 입력: 70% EtOH 6 분, 70% EtOH 10 분, 80% EtOH 10 분, 95% EtOH 2 시간 10 분, 100% EtOH 3 시간 10 분, 15 분 동안 3 번 크 실 렌 3 시간 15 분 대 한 파라핀 권장에서 일탈 하 고 시퀀스 처리 파열된 organoids (그림 3A) 발생할 수 있습니다.
- 이 처음으로 구분 수를 organoids를 포함 하는 변색된 부분 허용 됩니다 색 부분이 위로 향하도록 조직학 젤 플러그를 포함 합니다.
- 섹션 FFPE 조직학 젤 블록:
- 필요한 공급 수집: FFPE 조직학 젤 블록, 조직학 펜, 조직 부동 물, 얼음, 톰, 톰 블레이드, 워크스테이션, 긍정적으로 위탁 현미경 슬라이드 및 실험실 오븐 포함 얼음 양동이.
- 채우기 물 목욕까지 매우 전체 및 40 ° C로 설정 후 미리 따뜻한 실험실 오븐 45-50 ° c
- 얼음 양동이 준비 다음 얼음와 얼음 물 슬러리를 만드는 물을 추가. 때까지 그들은 매우 추운 얼음 블록을 진정.
참고: 블록 얼음에 1 일 최대 설정할 수 있습니다 하지만 만약 하룻밤 왼쪽 블록 화 될 것입니다 다시 처리 될 필요가 있을 것 이다. - 톰 카세트 클램프 블록 삽입 나이프 홀더를 블레이드를 추가 하 고 컴퓨터에서 모든 보호조치 잠금 해제.
- 파라핀 블록 (적) 10 µ m 두께 얼굴을 정돈 하 여 시작 합니다. 일단 섹션 나온다 플러그 영역이 포함 된, 트리밍 중지 하 고 톰 회전자를 고정 한 진정 얼음에 다시 블록을 전송. 여러 블록 구분 될 경우, 각 얼굴 4.5.6 단계로 이동 하기 전에 차단 합니다.
- 새, 사용 하지 않는 부분에 블레이드를 이동 하 고 다시 클램프 블록을 전송. 컴퓨터의 잠금을 해제 하 고 섹션 당 5 μ m에서 트리밍 시작 합니다.
참고: 최상의 결과 얻으려면 5 μ m를 권장 하지만 3-10 μ m 하 셔도 됩니다. - 핀셋을 사용 하 여, 40 ° C 물 목욕 하는 섹션을 전송 하 고 밖으로 확산 섹션을 허용 합니다. 물에 세로로 찍기 하 여 슬라이드에 섹션을 전송.
참고: 각도에서 찍기 섹션 거품 목욕의 바닥에서 전송 하 고 샘플의 왜곡이 발생할 수 있습니다. - (그림 2BC) 현미경 섹션을 시각화.
참고: 있는 organoid 존재, 그것 표시 됩니다 그림 2B에서 빨간색 화살표와 비슷합니다. 거품 (그림 2B, 파란색 화살표) organoids와 유사한 나타날 수 있으며 건조 organoids 나타나는 반투명 (그림 2C) 신선한 슬라이드에 분별 하기 쉽습니다. 아무 organoids는 존재 하는, 블록에 섹션 추가.
- Organoids 포함 된 슬라이드를 획득 하는 경우 슬라이드의 뒷면에서 섹션 주변 조직학 펜와 45-50 ° c.에 하룻밤 구워 원형
- 슬라이드를 수집 및 H & E 진행 (단계 4.9.1 참조) immunohistochemical (단계 4.9.2 참조), 또는 immunofluorescent 얼룩 (단계 5 참조).
참고: 대표적인 결과 그림 3B에 표시 됩니다.- H & E 염색을 수행 하려면 재료 목록에서 키트를 얻을 하 고 제조업체의 사양을 따릅니다.
- Immunohistochemical 얼룩을 수행 하려면 재료 목록에서 키트 및 1 차적인 항 체를 얻을 하 고 제조업체의 사양을 따릅니다.
5. immunofluorescent FFPE의 얼룩이 지 고 Sectioned Organoids
- 수집 용품: 4 단계에서 구운된 슬라이드, 크 실 렌, 100 %EtOH, 95 %EtOH, 70 %EtOH, 이온된 수 (디 H2O), coplin 항아리, 항 원 검색 인산 염 버퍼 솔루션 (나트륨 구 연산 염 버퍼 또는 EDTA Tris 버퍼), 식 염 수 (PBS), 5% 정상 말 혈 청 (x 1 보 건국) PBS, 1% 소 혈 청 알 부 민 (BSA) PBS, 랙 얼룩, 얼룩 접시, 챔버, 소수 성 장벽 펜, 습기, 1 °와 관심, 그리고 counterstains의의 항 체 2 ° 들리면에 0.3% 비 이온 세제에 0.1% 비 이온 세제로 관심입니다.
- Deparaffinize 및 coplins 다음 솔루션으로 가득에 담거 서 슬라이드를 rehydrate: 크 실 렌 (3 딥, 5 분), 100 %EtOH (2 딥, 3 분 각), 95 %EtOH (2 딥, 3 분 각), 70 %EtOH (2 딥, 3 분 각), 그리고 디 H2O 2 (딥 각 3 분).
- Antigen 검색 솔루션 및 100 ° c 사전 열 은폐 챔버 얼룩 요리를 채우기
- 미리가 열된 착 색 접시에 슬라이드를 immersing 하 여 항 원 복구를 수행 하 고 100 ° c.에 5-10 분 동안 품 어 주기가 완료 되 면, 뚜껑을 열기 전에 20 분 동안 앉아 은폐 챔버를 하실 수 있습니다.
- 슬라이드 접시가 RT에 냉각 하 고, 일단 실행 디 h 조2O를 5 분에 대 한 슬라이드를 헹 굴 착 색 접시를 놓습니다.
- 얼룩 접시에서 슬라이드를 제거 하 고 소수 성 장벽 펜 샘플 원을 그립니다 습도 챔버에 슬라이드를 하다.
- 어떤 비 특정 항 체를 샘플 주위 소수 서클에 PBS에 0.1% 비 이온 세제로 보 건국 5%를 적용 하 여 얼룩 차단 (약 30 μ 샘플을 충당 하기 위해 필요).
- Coplins 워시 슬라이드 PBS 3 시간 5 분으로 가득합니다.
- 추가 1 ° 항 체 (자료 테이블) 샘플 주위 소수 서클에 PBS에 0.3% 비 이온 세제로 1 %BSA 희석 (약 30 μ 섹션 커버 한다), 다음 RT에 또는 하룻밤 습도 챔버에 4 ° C에서 1 시간에 품 어.
- Coplins PBS 3 시간 5 분으로 가득에 슬라이드를 씻어.
- 추가 2 ° 항 체 샘플 주위 소수 서클에 PBS에 0.3% 비 이온 세제로 1 %BSA 희석 (약 30 μ 영역을 다룰 것입니다), 다음 1 h 습도 챔버 RT에 대 한 품 어.
- PBS 3 시간 5 분으로 가득 coplin에 슬라이드를 씻어.
- 추가 샘플, 주위 소수 서클에 PBS에 0.3% 비 이온 세제로 1 %BSA 제조업체의 사양에 희석 DAPI 다음 어둠 (30 μ)에서 2-5 분 RT에서 품 어.
- Coplins PBS 3 시간 5 분으로 가득에 슬라이드를 씻어.
- Antifade 설치 미디어와 coverslip, 슬라이드를 탑재 다음 현미경 결과 시각화.
6. Immunofluorescent 얼룩에 대 한 Organoids의 전체 설치
- 수집 용품: 챔버 슬라이드 또는 confocal 접시, 인산 염 버퍼 식 염 수 (PBS), 통, 50mm NH4Cl PBS, PBS, PBS, PBS, 1 °와 2 ° 항 체에 0.3% 비 이온 세제로 1 %BSA에서 0.1% 비 이온 세제로 보 건국 5%에서에서 0.1% 비 이온 세제에 관심, 그리고 관심의 counterstains.
- 조심 스럽게 organoid 문화 미디어와 매트릭스 젤 사이 공간을 떠나 잘의 측에 대하여 pipetting으로 방해 하지 않고 최대한 많은 미디어를 제거.
- 사용 하 여 트림, 사전 미디어 또는 PBS, 젖은 1000 μ 피 펫 팁, 관심의 organoid(s)를 포함 하는 매트릭스 젤의 한 방울 (25-50 μ)를 인출 하 고 챔버 슬라이드 잘 또는 confocal 접시의 중앙에 분배.
참고: 솔리드 33% 매트릭스 젤은 없습니다. 그것은 완전히 설정 하지 젤로 비슷한 처리 젤라틴 액체입니다. 큰 오프닝 트림된 피 펫 팁 전송 도중에서 organoids를 방지할 것 이다. - Organoids 부모 문화에 남아, 미디어를 따뜻한 KSFM에 기초를 둔 미디어 바꿉니다.
- 육안 또는 해 범위 초과 미디어와 매트릭스 젤 파인 팁 피 펫 (10-200 μ)와 챔버 슬라이드에서 발음.
참고: 부착 시와 챔버 슬라이드를 pretreat 옵션 이다. - 남은 매트릭스의 autofluorescence를 관찰 하는 선택적 제어 챔버 슬라이드의 빈 우물에 매트릭스 젤의 동일한 볼륨을 접시.
- 유리에 고착 하 고 세척 단계 샘플의 손실을 방지 organoid 홍보를 30-45 분 동안 37 ° C 배양 기에서 챔버 슬라이드를 놓습니다.
- 천천히를 pipetting 슬라이드에서 분리 방지, 부드럽게 흔들어 동안 RT에 5 분에 대 한 1 x PBS의 200 μ와 organoids를 세척.
- PBS와 부드럽게 흔들어 동안 RT에서 30 분 동안 4 %paraformaldehyde 200 μ와 수정 x 1을 제거 합니다. 매트릭스 젤이이 단계 후에 분명 나타나는지 확인 합니다.
참고: 메탄올 또는 포 르 말린 고정 또한 가능 하다. 고정 방법은 특정 종류의 고정 방식이 있습니다 crosslink 관심의 항 원 또는 형광-라벨-관심사의 단백질을 끄다 특정 항 체에 대 한 최적화 되어야 합니다. - 정착 액을 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척.
참고: 단계 세척의 길이 organoid 크기에 따라 최적화 되어야 합니다. 5 분은 충분 한 시작 지점, 하지만 필요에 따라 세척 단계를 길게 할 수 있다. - 부드럽게 흔들어 동안 50mm NH41 x PBS RT에서 30 분 동안에 Cl의 200 μ와 autofluorescence를 끄다.
참고:이 단계는 organoid의 루멘에서 파편 및 실험 설계에서 발생할 수 있습니다 (GFP) 등 형광 단백질 식 autofluorescence를 끄다 것입니다. 488 채널에는 fluorophore를 사용을 하지만 GFP 신호를 보존 하기 위해 원하는 경우 건너뛸 수 있습니다 경우에 포함 되어야 합니다. - NH4Cl를 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척.
- 부드럽게 흔들어 동안 RT에서 30 분 동안 1 x PBS에 0.1% 비 이온 세제-100의 200 μ에 organoids를 permeabilize.
- 부드럽게 흔들어 동안 PBS와 5 분의 1 x PBS의 200 μ로 두 번 세척 1 회에 0.1% 비 이온 세제-100를 제거 합니다.
- PBS에서 0.1% 비 이온 세제 X-100 200 μ와 5% 보 건국으로 차단 하 고 부드럽게 흔들어 동안 RT에서 60 분 동안 품 어.
- 블로킹 버퍼를 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척.
- 0.3%와 1 %BSA 1 ° 항 체 희석 1 x PBS에 Triton X-100 챔버 슬라이드의 200 μ에 추가 하 고 다음 4 ° c.에 1-3 일 동안 품 어
- 1 ° 항 체를 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척.
- 0.3%와 1 %BSA 2 ° 항 체 희석 1 x PBS에 Triton X-100 챔버 슬라이드의 200 μ에 추가 그리고 어둠 속에서 4 ° C에서 1-3 일 동안 품 어.
참고: 보육 시간 길이 organoid 크기와 항 체에 대 한 최적화 되어야 합니다. 일부는 organoid를 관통 하는 시간이 더 필요 합니다. 또한 항 체 농도 최적화가 필요 합니다. 일반적으로, 2 x FFPE 섹션 사용 농도 1 ° 항 체에 대 한 적절 한 고 FFPE 섹션에 대 한 동일한 농도 2 ° 항 체에 대 한 적절 한. - 2 ° 항 체를 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척.
- Counterstain phalloidin와 말라와 DAPI 또는 Hoescht, 0.3%와 1 %BSA 제조업체의 권장 사항에 따라 희석 핵 트리톤-X 1 x PBS에. 챔버 슬라이드를 200 μ를 추가 후 어둠 속에서 40 분 RT에서 품 어.
- 신선한 1 PBS 또는 설치 미디어의 200 μ에 탑재 하 고 즉시 이미지 (형광 보존 되어야 아니라면 더 이상 최대 5 일 동안). 대표 결과 그림 3C에 표시 됩니다.
참고: 나트륨 아 지 드 confocal 영상 쉽게 사용할 수 없는 경우 오염을 방지 하기 위해 샘플을 추가할 수 있습니다. 개간 에이전트 추가 이미지를 개선할 수 있습니다.
7. 분석 및 형광 프로브에 대 한 Organoids의 전체 설치
참고: 상업적으로 이용 가능한 분석 실험 및 형광 프로브/염료 (예는 재료 목록에 포함 됩니다) 있습니다 전체 실장 organoids 유용한 끝점19의 다양 한 관찰 하에 사용 하기 위해 amendable. 다음 프로토콜은 듀 확산 붙일 셔 서 키트 인데 어떤 키트 전체 마운트 예제와 함께 사용 하기 위해 수정할 수 있습니다.
- 조심 스럽게 미디어의 50 μ를 제거 하 고 미디어와 매트릭스 젤 사이 공간을 떠나 잘의 측에 대하여 pipetting으로 듀 솔루션 작업 x 20 μ M 2의 50 μ를 바꿉니다.
- 1-3 일 (듀 통합 시간 원하는 길이로 세포 유형의 선택에 대 한 최적화 합니다) 4 ° C에서 품 어.
- 단계 6.2-6.8 챔버 슬라이드 또는 confocal 요리에 관심의 organoids를 전송 합니다.
- PBS를 제거 하 고 부드럽게 흔들어 동안 3.7% paraformaldehyde RT에서 30 분의 200 μ와 수정. 있도록 매트릭스 젤이이 단계 후에 분명히 표시.
- 정착 액을 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS의 200 μ로 두 번 세척. PBS를 제거 하 고 부드럽게 흔들어 동안 0.5% 비 이온 세제-100의 200 μ RT에서 30 분 동안 1 x PBS에 추가.
- 제조업체의 사양에 따라 칵테일 형광 반응 x 1을 준비 합니다.
- 0.5% 비 이온 세제-100를 제거 하 고 부드럽게 흔들어 동안 5 분의 1 x PBS에 3 %BSA 200 μ로 두 번 세척.
- 반응 칵테일을 추가 하 고 어둠 속에서 RT에서 30 분 동안 품 어.
- 부드럽게 흔들어 동안 5 분의 1 x PBS에 형광 반응 칵테일 및 3 %BSA 200 μ로 한번 세척을 제거 합니다. Counterstain 및 따라 마운트 6.21-6.22 (그림 3D) 단계.
결과
인간의 기본 전립선 organoids의 성공적인 문화, 시 형태학과 차별화 수 수 평가 밝은 필드 이미지 분석 및 FFPE 및 전체 마운트 얼룩 기법을 사용 하 여.
밝은 분야 심상 붙 잡음의 과정은 그림 1A에 나와 있습니다. Organoids 3D 매트릭스에 성장 하 고 다른 초점 비행기에 걸쳐 분산 됩니다. 관찰 하기 위해 초점에 organoids 많은 비행기를 통해, 그것은 하나의 z-비행기 (그림 1B, 왼쪽) 대신 EDF 이미지 (그림 1B, 오른쪽)을 사용 하 여 좋습니다. 연구실에서 organoids 다른 실험 조건 하에서 성장 형태에 변화 될 수 있습니다. 영역을 사용 하 여, 순환 (에 의해 얼마나 비슷한는 organoid 원 정의) 및 최대/최소 반경 (길이 측정) 사용자 organoid 크기와 모양의 표시 주고 형태학의 정량 판독을 제공. 이 측정의 유용성을 강조, 유사한 지역 하지만 각기 다른 형태와 organoids의 대표 이미지 그림 1C, 있는 긴 organoid 덜 순환 되며 구형 보다 더 큰 최대/최소 비율에 표시 됩니다. organoid입니다.
조직학에 대 한 organoids를 포함 하는 것은 샘플의 내부를 관찰 하 고 그 괴가 한 organoid의 핵심 내 존재를 유용한 끝점입니다. 그림 2AB, C에서이 프로세스 및 밝은 분야 현미경 흠 없는, sectioned 샘플의 대표적인 결과 대 한 워크플로 제공 됩니다. 그림 3A (왼쪽)에 비해 제대로 분실된 organoid 손으로 그림 3A (오른쪽)와 그림 3B에서 organoids를 보여 줍니다. 샘플의 분화 상태를 확인, 기저 세포 마커 (cytokeratin 5 및 p63)8 luminal 셀 표식 (cytokeratin 8)8함께 보고 하는 것이 좋습니다. Organoids 얼룩을 바란다면 제자리에, 전체 산 얼룩이 지는 편리한 대안을 이며 이러한 대표적인 결과 그림 3C디에서 제공 됩니다.

그림 1: 3D 문화에서 organoids의 형태 평가. ( A) 인간의 기본 전립선 organoids 전송 된 빛에 의해 인수에 대 한 이미지 수집 및 압축 워크플로 거꾸로 현미경을 동력으로 X / Y 검색 단계와 동반자 소프트웨어. (B) 단일 z-스택 (왼쪽된) 대의 대표 이미지. 보여주는 여러 z-스택 단일 투사 이미지에 결합 될 때 더 많은 organoids 초점에는 인간의 기본 전립선 organoids의 전체 음 샘플의 EDF 이미지 (오른쪽) (눈금 막대 = 1000 µ m). (C) 같은 지역에 있는 형태학 상으로 다른 인간의 기본 전립선 organoids의 지역, 순환, 및 최대/최소 비율을 위한 대표 이미지 (눈금 막대 = 200 µ m). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: Organoid 흐름과 결과 구분 하는 대표를 포함. ( A) 인간의 기본 전립선 organoid 워크플로 포함. (B) agar (녹색 화살표), 조직학 젤 (검은색 화살표), (파란색 화살표), organoids (빨간색 화살표)을 묘사한 밝은 분야 현미경 인간의 기본 전립선 organoids를 포함 하는 흠 없는, 신선한 슬라이드의 대표 이미지 (눈금 막대 1000 μ = m). (C) 갓 잘라 슬라이드 (왼쪽) vs흠 없는. 흠 없는 건조 슬라이드 (오른쪽), organoids (빨간 화살표) 건조 하 때 반투명 표시 (눈금 막대 = 500 µ m) 밝은 분야 현미경 분별 힘들어 하 고. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
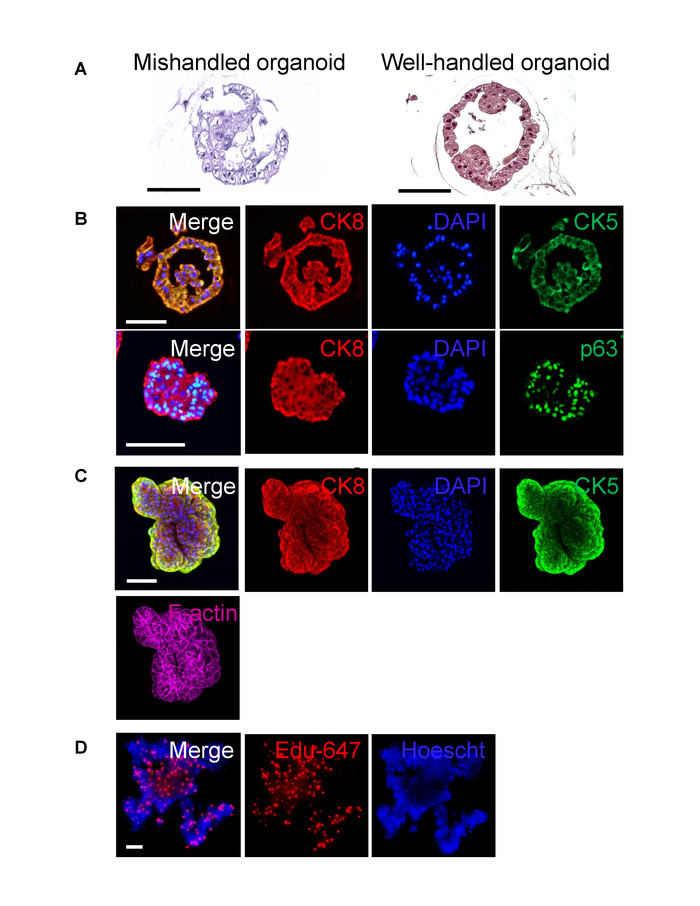
그림 3: sectioned 및 전체 실장 organoids에 조직학 얼룩. (A) H & E 잘 처리 organoid (오른쪽) 옆 (공격적 pipetting, 잘못 처리 프로토콜, 왼쪽) 실패에서 깨진된 인간의 기본 전립선 organoid의 얼룩 (눈금 막대 = 100 µ m). (B) , 포 르 말린 고정 파라핀 포함 된 인간의 기본 전립선 organoid sectioned, 그리고 8 (위)와 기저 p63 luminal cytokeratin 8 (아래) 기저 cytokeratin 5 또는 luminal cytokeratin 얼룩이 지 고 confocal 현미경 (몇 군데 눈금 막대 = 100 µ m). (C) 는 전체 탑재 인간의 기본 전립선 organoid 기저 cytokeratin 5 또는 luminal cytokeratin 8 얼룩이 지 고 phalloidin와 DAPI, confocal 현미경으로 몇 군데 counterstained (눈금 막대 = 100 µ m). (D) 붙일 물 전체 탑재 인간 기본 전립선 세포 organoid 듀 고 카운터 Hoescht, confocal 현미경으로 몇 군데 물 (눈금 막대 = 500 µ m) 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
Organotypic 문화는 업과 환경 체 외에서 의 편의와 조직에 대 한 흥미 진 진한 새로운 방법입니다. 현재, 실험실 organoids 여러 종류의 다양 한 끝점에 대 한 조직에서 성장. 이 문서에서 설명 하는 방법 유용한 끝점 요약 및 새로운 기술을 완전히 3D 기본 전립선 세포 배양의 특성을 강조.
미디어 인간 기본 전립선 세포 organoids5,,613양성을 위한 조리법의 다양 한이 있다. 모두 실용적이 고 유사한 결과 얻기 위해 하는 동안 KSFM에 기초를 둔 미디어13 사용 하 여 최소한의 첨가제 그것 설명 그래서 여기. 또한, 서류 10%에서 75%로 문화 전립선 organoids5,,613매트릭스 젤에 대 한 여러 농도 사용 하 여 출판 되었습니다. 매트릭스 젤 비싼 시 약 때문에 33% 매트릭스 젤 장기 (2-3 주), 육성 하기 위해 충분 한 것 표시 되었습니다 가능한, unclumped organoids13, 이것이 권장된 농도. 그러나, 매트릭스 젤 많은 숫자, 그래서이 한다 고려 될 때 도금 사이 단백질 농도에서 달라질 수 있습니다. 그것은 또한 많은 사이 불일치를 줄이기 위해 여러 실험에서 사용 하기 위해 대량에서 매트릭스 젤을 구입 하는 것이 좋습니다. 다른 실험실 96 잘 접시 잘5코팅 대신 방울 같은 매트릭스 젤, 도금에 대 한 다양 한 포맷을 출판 했습니다. 두 방법 모두 형성 가능한 organoids, 하지만 여기에 설명 된 형식 수 있습니다 더 부족 하 게, 도금 하는 셀에 대 한 더 큰 organoids13로 셀의 확장을 촉진을 보여줘 왔다. 그러나, 도금 밀도 최적화 되어야 합니다 환자 전용 대형 효율성 기반으로. 매트릭스 젤 증가율 감소, 페 놀 레드-무료, 높은 농도, 등등을 포함 하 여 여러 형태로 제공 됩니다. 성장 인자 감소 것이 좋습니다 문화 조건, 정의 및 페 놀 레드 무료 GFP를 표현 하는 셀 또는 z-스택 이미지 캡처를 포함 하는 실험에서 작업할 때 좋습니다. 그것은 매트릭스 젤 실내 온도에 신속 하 게 굳은 매트릭스 젤 도금 단계 차가운 약으로 수행 해야 합니다.
Organoids 다른 실험적 치료에서 성장 될 수 있습니다 변경 모양, 그래서 밝은 필드 이미징 연구 관찰된 형태학 고기에 널리 사용 됩니다. 그럼에도 불구 하 고, 기록 하 고 영역 또는 모양 측정은 도전 두 가지 이유: 이미지 캡처 및 3 차원 샘플 2) 적용 지역 등 2 차원 매개 변수 중 선택 1) 바이어스. 이미지 캡처의 한 전략 임의의 필드를 기록 하 고 해당 필드에 organoids의 미리 결정 된 수를 측정 하는 것입니다 하지만이 선택, 동안 바이어스를 만들 수 있으며 선택한 필드에서 모든 organoids 초점에서 되지 않을 수 있습니다. 전체-잘 이미징 96 잘 microplate 형식에 대 한 최적화 된 관심의 전체 organoid 인구를 수집 하 여이 샘플링 바이어스를 제거 합니다. 그러나, 반면에 현미경 목표에 따라 여러 분야를 수집 하 고 전체 잘 이미지를 얻기 위해 바둑판식으로 할 수 있습니다. 하나의 z-비행기12의 경우, 측정 영역을 설명 하는 일부 실험실 하지만 초점에 모든 organoids을 잡으려고 그것 수집 하 고 단일 EDF 이미지13에 여러 비행기를 쌓아 좋습니다. 경우에 따라 매트릭스 젤에 초승달 모양의 이미지를에서 vignetting을 발생할 수 있습니다 그리고 배경 교정 방법 이미지 분석 소프트웨어를 사용 하 여 적용할 필요가 있습니다. 정확한 볼륨은 organoid 크기;에 대 한 가장 적절 한 측정 그러나,이를 정확 하 게, 여러 z-스택 이미지로 어렵습니다. 순환 및 최대/최소 비율와 같은 다른 유용한 형태학 크기 전체-그럼 EDF 이미지에 모든 organoids에서 쉽게 계산할 수 있습니다. 함께, 이러한 방법을 샘플링 바이어스 도전을 극복 하 고 3D 공간에서 3D 개체에서 2D 매개 변수 측정 사용.
포 르 말린 고정 및 파라핀 organoids의 포함 되며 고 오신 (H & E), immunohistochemical (IHC), 및 immunofluorescent (IF) 얼룩 시각화 및 분석6,11, 에 대 한 일반적인 방법입니다. 그러나 20.,이 기술을 설명 하는 게시 포함 프로세스에 대 한 포괄적인 내용을 부족. 또한, organoids 파라핀 블록 내에서 찾기 어려운 수 있습니다. 일부 실험실 미리 trypan와 organoids11단면 동안 위치에 원조를 포함 하기 전에 블루 얼룩. 여기 설명 하는 방법을 단면 효율을 증진을 포함 하는 동안 organoid/조직학 gelplug의 방향에 대 한 조직학 염료를 사용 하 여를 통합 합니다. H & E 슬라이드의 괴 사, 핵, 질감과 확산, 시험을 촉진 하 고 따라서 셀 영역에 걸쳐 건강 한 되도록 organoid 문화에 대 한 필수 끝점 이어야 한다. Organoid 문화의 힘은 샘플을 더 나은 환자 조직 vivo에서 세포의 다른 유형의 혼합물의 구성 되어 있다. 예를 들어 전립선, 기저와 luminal 세포는 전립선 organoids5, 2D 부족 luminal 차별화8성장 세포 동안에. Organoid 차별화, 평가 연구원 평가 CK5 등 p63 기저 표식과 같은 안 드로 겐 수용 체와 CK88luminal 표식 것이 좋습니다. 관심의 다른 실험적인 단백질 얼룩 이러한 기술을 사용 하 여 공부도 수 있다.
비록 FFPE 섹션 내부 구획을 통해 조직학 방법 (H & E, IF, IHC)에 있는 셀의 수, 이미지는 횡단면, 그리고 organoid 모양 포함 프로세스에 의해 변경 될 수 있습니다. 전체-마운트 얼룩 얼룩을 제자리에서형태학 고기를 보존 하 고 허용 하는 단백질 지 방화의 이미지 관찰 organoid 수 있습니다. 전체 설치 전체 조직 또는 전체 동물 표본, zebrafish 또는 마우스 배아 등 얼룩을 활용 하는 도구 이며 쉽게 organoids에 대 한 적응. 여기에 설명 된 기술은 마헤외. 여 프로시저에서 수정 된 11, 초기 성장 및 얼룩에 대 한 챔버 슬라이드에 직접 위장 organoids의 문화를 자세히 설명 하 고 전체 부모 문화 정착 필요. 여기에 설명 된 메서드 얼룩의 시간에서 챔버 슬라이드에 대 한 관심의 단일 organoid (또는 organoids)의 이전을 포함 한다. 부모 문화의 정착 없이 지속적인 실험에서 전체 산 분석에 대 한 개별 organoids의 선택 수 있습니다. 그것은 permeabilization와 표본을 통해 침투 되도록 1 차 및 이차 항 체에 대 한 보육 시간을 최적화 하는 데 필요한 전체 마운트 얼룩을 수행할 때 (어디 하나 이상의 일에서 권장). 일단 몇 군데 통해 confocal 현미경 검사 법, 3D 렌더링 시각화 및 특정 단백질의 지역화 샘플에 존재 하는 긍정적으로 얼룩진된 셀의 수를 계산을 생산 수 있습니다. Cytometry 기저, luminal의 인구를 계량 하기 유용한 끝점 또는 줄기 세포5,14. 이 세포는 매트릭스 젤에서 복구 하 고 부드럽게 얼룩에 대 한 해리. 사용자가 현재 문학에 따라 분리에 대 한 적절 한 마커를 선택 신중 하 게 해야 합니다. 인간의 기본 전립선 상피 세포에 대 한 CD26 및 CD49f는 적합 한 luminal 기저 마커, 각각5,21.
요약,이 프로토콜은 인간의 기본 전립선 organoid 성장, 수집, 및 실험적인 끝점을 자세히 설명합니다. 메모의, 설명 설치 기술 일반적으로 형광 프로브 기반 실험 확산19, apoptosis, subcellular 세포 기관이 얼룩 보고 같은 2D 셀에 대 한 고용 하는 다른 분석 실험의 다양 한에 적용할 수 있습니다. 또한, 수집 및 분리 방법은 여기에 설명 된 단일 셀 RNA 시퀀싱18에 대 한 준비에 활용 될 수 있습니다. 이 소설, 연구자 최적화 하 고 미래에 찾아보기 수 있는 고 충실도 끝점의 다양 한 가능성을 보여 줍니다.
공개
저자는 공개 없다.
감사의 말
우리는 UIC Biorespository 멤버, 닥터 클라라 Valyi-Nagy, 알렉스 Susma, 뿐만 아니라 1 차 셀 문화에 대 한 조직 획득의 촉진에 대 한 박사 마이클 Abern, 다니엘 Moreira, 그리고 시몬 Crivallero, 비뇨기과 감사합니다. 우리는 그들의 조직 연구에 기부 UIC 비뇨기과 환자를 감사 합니다. 이 작품, 부분에 부의 방어 전립선 암 연구 프로그램 건강 불균형 아이디어 상 PC121923 (Nonn)와 임상의 UIC 센터 및 임상 및 변환 과학자 (번역 과학 Pre-doctoral 교육에 의해 투자 되었다 PECTS) 프로그램 (McCray와 리차드)는 시카고 건강 주식 공동 (Nonn와 리차드)로 알려져 있는 국립 보건원의 국립 암 연구소, 보조금 번호 U54CA202995, U54CA202997, 및 U54CA203000에 의해. 내용은 전적으로 저자의 책임 이며 반드시 건강의 국가 학회 또는 국방부의 공식 의견을 대표 하지는 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cells of interest | |||
| Keratinocyte-SFM (KSFM) | ThermoFisher Scientific | 17005042 | |
| Fetal Bovine Serum, charcoal stripped, USDA-approved regions (FBS) | ThermoFisher Scientific | 12676029 | |
| 5α-Dihydrotestosterone (DHT) | Sigma-Aldrich | D-073-1ML | |
| Flat bottom, polystyrene 96-well cell culture treated plate | ThermoFisher Scientific | 161093 | |
| Matrigel (matrix gel) | Corning | Various | Matrix-gel: growth Factor Reduced, Phenol-red free, etc. depending on application |
| Ice Bucket | |||
| Cell Culture Hood | |||
| 1.5 mL micro-centrifuge tubes or 15 mL conical | ThermoFisher Scientific | 05-408-130, 339650 | |
| Centrifuge | |||
| Dispase (neutral protease) | STEMCELL Technologies | 7923 | neutral protease |
| Hanks' balanced salt solution (HBSS) | ThermoFisher Scientific | 14025076 | |
| TrypLE Express (cell dissociation enzymes) | ThermoFisher Scientific | 12605036 | Cell dissociation enzymes (trypsin may also work, depending on cell type, but TrypLE is more gentle and recommended for primary cells) |
| TRIzol | ThermoFisher Scientific | 15596018 | suggested RNA extraction solution |
| RIPA Lysis and Extraction Buffer | ThermoFisher Scientific | 89900 | suggested protein extraction solution |
| DNAzol | ThermoFisher Scientific | 10503027 | suggested DNA extraction solution |
| Organoids | |||
| Flat bottom, polystyrene 96-well cell culture treated plate | ThermoFisher Scientific | 161093 | |
| Brightfield microscope with camera capabilities | ex. EVOS FL Auto Imaging System | ||
| Photo analysis software | ex. Photoshop, CELLESTE, ImageJ, MorphoLibJ, CellProfiler | ||
| Graphing software | ex. Graphpad, Excel, etc | ||
| Organoids | |||
| Ice pack | |||
| Masking tape | |||
| Pipette tips (1000 μL) | |||
| Razor blade | |||
| Dispase | STEMCELL Technologies | 7923 | |
| Agarose | Sigma-Aldrich | A9045 | |
| HistoGel (histology-gel) | ThermoFisher Scientific | HG-4000-012 | |
| Pencil | |||
| "Plunger" from 1 cc insulin syringe | |||
| Tissue Casette | Thomas Scientific | 1202D72 | |
| Container to hold fixative | |||
| 10% neutral buffered formalin (NBF) | Sigma-Aldrich | HT501128 | |
| Histology pen, xylene and EtOH-resistant | Sigma-Aldrich | Z648191-12EA | STATMARK pen |
| Ethanol (histologic grade) | Fisher Scientific | A405P-4 | For fixation and graded dilutions during processing |
| Xylenes | Sigma-Aldrich | 214736-1L | |
| Deionized water | |||
| Paraffin | Leica | various | |
| Tissue processor | |||
| Embedding workstation | |||
| Economy Tissue Float Bath | Daigger | EF4575E XH-1001 | |
| Microtome | |||
| Microtome blades | Ted Pella | 27243 | |
| Positively charged microscope slides | Thomas Scientific | 1158B91 | |
| Laboratory Oven | ThermoFisher Scientific | PR305225G | |
| Hematoxylin and Eosin Stain Kit | Vector Laboratories | H-3502 | Suggested H&E staining kit |
| ABC Peroxidase Standard Staining Kit | ThermoFisher Scientific | 32020 | Suggested immunohistochemistry staining kit |
| Androgen Receptor Primary Antibody (AR) | Cell Signaling Technology | 5153S | Suggested primary antibody for IHC |
| FFPE, sectioned organoid sample baked on a slide | |||
| Ethanol (histologic grade) | Fisher Scientific | A405P-4 | dilutions should be performed using deinoized water |
| Xylenes | Sigma-Aldrich | 214736-1L | |
| Deionized water (DI H2O) | |||
| Antigen retrieval solution | Sigma-Aldrich, Abcam | C9999, ab93684 | |
| 1x Phosphate Buffered Saline - PBS | ThermoFisher Scientific | 10010023 | |
| Triton X-100 | Sigma-Aldrich | X100-1L | |
| Normal Horse Serum | thermoFisher Scientific | 31874 | |
| Bovin Serum Albumin | Sigma-Aldrich | A2058 | |
| Counterstain (DAPI, Hoescht) | Sigma-Aldrich | D9542 | |
| Sodium azide | Sigma-Aldrich | S2002 | suggested for storage but not required |
| Confocal microscope | |||
| Coplin | Fisher Scientific | 19-4 | |
| Staining rack | IHC World | M905-12DGY | |
| Staining dish | IHC World | M900-12B | |
| Decloaking chamber | Biocare Medical | DC2012 | |
| Humidity chamber | Thomas Scientific | 1219D68 | |
| Hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| Cytokeratin 8/18 primary antibody (CK8) | ARP American Research Products | 03-GP11 | suggested primary antibody for IF |
| p63-alpha antibody (p63) | Cell Signaling Technology | 4892S | suggested primary antibody for IF |
| Keratin 5 Polyclonal Antibody (CK5) | Biolegend | 905501 | suggested primary antibody for IF |
| Goat anti-rabbit secondary | ThermoFisher Scientific | A21245 | suggested secondary antibody for p63 or CK5 detection (do not use at same time) |
| Goat anti-guinea pig secondary | ThermoFisher Scientific | A-11075 | suggested secondary antibody for CK8 detection |
| Microscope cover glass | Globe Scientific | 1414-10 | |
| Anti-fade mounting media | ThermoFisher Scientific | S36972 | |
| Organoids | |||
| Pipette tips (1000 μL) | |||
| Pipette tips (200 μL) | |||
| 8-well chamber slide | ThermoFisher Scientific | 154534PK | It is also possible to use a confocal dish, depends on preference of user |
| Cell-Tak | Corning | CB40240 | optional adherent reagent |
| 1x Phosphate Buffered Saline (PBS) | ThermoFisher Scientific | 10010023 | |
| 4% paraformaldehye (PFA) | Biotium | 22023 | other fixatives such as methanol or formalin can be used |
| 50mM NH4Cl | sigma-Aldrich | 254134 | |
| Triton™ X-100 (non-ionic detergent) | sigma-Aldrich | X100-1L | |
| Normal Horse Serum (NHS) | thermoFisher Scientific | 31874 | |
| Bovin Serum Albumin (BSA) | sigma-Aldrich | A2058 | |
| Counterstain (DAPI, Hoescht) | Sigma-Aldrich | D9542 | |
| Counterstain (phalloidin) | thermoFisher Scientific | A22287 | |
| Sodium azide | sigma-Aldrich | S2002 | suggested for storage but not required |
| Confocal microscope | |||
| Cytokeratin 8/18 primary antibody (CK8) | ARP American Research Products | 03-GP11 | suggested primary antibody for IF |
| p63-alpha antibody (p63) | Cell Signaling Technology | 4892S | suggested primary antibody for IF |
| Keratin 5 Polyclonal Antibody (CK5) | Biolegend | 905501 | suggested primary antibody for IF |
| Goat anti-rabbit secondary | ThermoFisher Scientific | A21245 | suggested secondary antibody for p63 or CK5 detection (do not use at same time) |
| Goat anti-guinea pig secondary | ThermoFisher Scientific | A-11075 | suggested secondary antibody for CK8 detection |
| Visikol HISTO-M | Visikol | various | optional clearing agent |
| Organoids | |||
| Pipette tips (1000 μL) | |||
| Pipette tips (200 μL) | |||
| 8-well chamber slide | ThermoFisher Scientific | 154534PK | It is also possible to use a confocal dish, depends on preference of user |
| Cell-Tak | Corning | CB40240 | |
| 1x Phosphate Buffered Saline - PBS | ThermoFisher Scientific | 10010023 | |
| Cell assay of interest | Various | Various | Click-iT EdU Alexa Fluor proliferation assay (fluorescently-labelled EdU proliferation kit), Image-iT Lipid Peroxidation Kit, etc) and fluorescent probes/dyes (ex. HCS mitochondrial Health Kit, CellMask, LIVE/DEAD Viability assays, CellROX reagents, etc) |
| Organoids | |||
| Ice bucket | |||
| Cell culture hood | |||
| 1.5 mL eppendorf tubes or 15 mL conical | |||
| Microcentrifuge | |||
| Dispase | STEMCELL Technologies | 7923 | |
| TrypLE Express (cell dissociation enzymes) | ThermoFisher Scientific | 12605036 | Cell dissociation enzymes (trypsin may also work, depending on cell type, but TrypLE is more gentle and recommended for primary cells) |
| Hanks' balanced salt solution (HBSS) | ThermoFisher Scientific | 14175079 | |
| Flow Tube with Cell Strainer Snap Cap | Fisher Scientific | 08-771-23 | |
| Cytokeratin 5 Antibody - FITC | Millipore Sigma | FCMAB291F | Suggested flow antibody |
| Cytokeratin 8 Antibody - Alexafluor 405 | Abcam | ab210139 | Suggested flow antibody |
| CD49f - Alexafluor 647 | BioLegend | 313609 | Suggested flow antibody |
| CD26 - PE | BioLegend | 320576 | Suggested flow antibody |
| Flow cytometer |
참고문헌
- Clevers, H. Modeling Development and Disease with Organoids. Cell. 165, 1586-1597 (2016).
- Simian, M., Bissell, M. J. Organoids: A historical perspective of thinking in three dimensions. Journal of Cell Biology. 216 (1), 31-40 (2017).
- Kretzschmar, K., Clevers, H. Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental Cell. 38, 590-600 (2016).
- Fatehullah, A., Tan, S. H., Barker, N. Organoids as an in vitro model of human development and disease. Nature Cell Biology. 18 (3), 246-254 (2016).
- Drost, J., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-954 (2014).
- Sobel, R. E., Sadar, M. D. Cell lines used in prostate cancer research: a compendium of old and new lines--part 2. The Journal of Urology. 173 (2), 360-372 (2005).
- Uzgare, A. R., Xu, Y., Isaacs, J. T. In vitro culturing and characteristics of transit amplifying epithelial cells from human prostate tissue. Journal of Cellular Biochemistry. 91 (1), 196-205 (2004).
- Sobel, R. E., Sadar, M. D. Cell lines used in prostate cancer research: a compendium of old and new lines--part 1. The Journal of Urology. 173 (2), 342-359 (2005).
- Puca, L., et al. Patient derived organoids to model rare prostate cancer phenotypes. Nature Communications. 9 (1), 2404(2018).
- Mahe, M. M., et al. Establishment of Gastrointestinal Epithelial Organoids. Current Protocols in Mouse Biology. 3 (4), 217-240 (2013).
- Borten, M. A., Bajikar, S. S., Sasaki, N., Clevers, H., Janes, K. A. Automated brightfield morphometry of 3D organoid populations by OrganoSeg. Scientific Reports. 8 (1), 5319(2018).
- Richards, Z., McCray, T., Marsili, J., Zenner, M. L., Manlucu, J. T., Garcia, J., Murray, M., Voisine, C. M., Murphy, A. B., Abdulkadir, S. A., Prins, G. S., Nonn, L. Prostate stroma increases the viability and maintains the branching phenotype of human prostate organoids. iScience. , in press (2018).
- Hu, W. -Y., et al. Isolation and functional interrogation of adult human prostate epithelial stem cells at single cell resolution. Stem Cell Research. 23, 1-12 (2017).
- Peehl, D. M. Primary cell cultures as models of prostate cancer development. Endocrine-Related Cancer. 12 (1), 19-47 (2005).
- Peehl, D. M. Growth of prostatic epithelial and stromal cells in vitro. Methods in Molecular Medicine. 81, 41-57 (2003).
- Mihelich, B. L., et al. miR-183-96-182 cluster is overexpressed in prostate tissue and regulates zinc homeostasis in prostate cells. Journal of Biological Chemistry. 286 (52), 44503-44511 (2011).
- Macosko, E. Z., et al. Highly Parallel Genome-wide Expression Profiling of Individual Cells Using Nanoliter Droplets. Cell. 161 (5), 1202-1214 (2015).
- Barrett, C. W., Short, S. P., Choksi, Y. A., Williams, C. S. Whole-mount Enteroid Proliferation Staining. Bio-Protocol. 6 (12), (2016).
- Gao, D., et al. Organoid cultures derived from patients with advanced prostate cancer. Cell. 159 (1), 176-187 (2014).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유