Method Article
형광 활성 세포 선별을 통해 확립 된 정제 GABAergic 또는 Glutamatergic 뉴런의 일차 세포 배양
요약
이 프로토콜은 출생 후 생쥐 또는 쥐의 신 피 질 및 해 마 로부터 형광 GABAergic 또는 glutamatergic 뉴런의 정제 및 배양을 위한 세포 선별 방법을 설명 한다.
초록
이 프로토콜의 전반적인 목표는 GABAergic 또는 glutamatergic 뉴런에서 파생 된 정제 된 뉴런 배양 물을 생성 하는 것입니다. 정제 된 뉴런은 16 일 동안 시험관 내에서 정의 된 배지에서 배양 될 수 있으며, 전기 생리학적, 형태학 적 및 생존 분석을 포함 하 여 해리 된 배양 물에서 통상적으로 수행 되는 모든 분석을 가능 하 게 한다. 이러한 배양의 주요 이점은 신경 교 세포 또는 다른 뉴런 유형에 서 발생 하는 것과 같은 복잡 한 외부 영향이 없는 특정 세포 유형이 선택적으로 연구 될 수 있다는 것 이다. 그러나 순화 한 세포를 가진 실험을 계획할 때, 신경 세포는 그들의 성장과 생존을 위한 글 리아 컨디셔닝 된 매체에 강하게 의존 한다는 것을 주의 하는 것이 중요 합니다. 또한, glutamatergic 뉴런은 시 냅 스 전달의 확립에 대 한 글 리-분 비 인자에 의존 한다. 따라서 우리는 또한 신경 세포를 비 접촉 배열로 배양 하는 방법을 기술 한다. 이러한 방법을 사용 하 여, 우리는 GABAergic 및 glutamatergic 뉴런 네트워크의 개발 사이의 주요 차이점을 확인 했습니다. 따라서, 정제 된 뉴런의 문화를 연구 하는 것은 신 경계가 어떻게 발전 하 고 기능 하는지에 대 한 우리의 이해를 촉진 하기 위한 큰 잠재력을가지고. 더욱이, 정제 된 배양 물은 약리학 적 제제, 성장 인자 또는 특정 세포 유형에 대 한 유전적 조작의 결과를 탐구 하기 위한 직접적인 작용을 조사 하는데 유용할 수 있다. 더 많은 형질 전환 동물이 사용할 수 있게 되 면, 관심의 추가 특정 세포 유형에 라벨링, 우리는 여기에 설명 된 프로토콜이 그들의 적용 가능성과 잠재력에 성장할 것으로 예상.
서문
세포 분류는 세포의 이종 혼합물 로부터 관심 있는 살아있는 세포를 분리 하기 위한 강력한 도구입니다. 세포는 형광 표지1,2의 발현 뿐만 아니라 크기 및 형태 기준에 기초 하 여 정렬 될 수 있다. 종종 형광 단-공액 항 체는 세포 특이 적 표면 항 원을 표적화 하 여 별개의 세포 유형에 라벨을 지정 하는데 사용 된다3,4. 대안적으로, 형질 전환 동물 또는 바이러스 전달 시스템은 세포 특이 적 프로모터5,6하에서 형광 단을 발현 하도록 설계 되었다. 역사적으로, 형질 전환 도구 및 동물의 개발은 비용과 시간이 많이 소요 되었습니다. 최근에는 비용 절감과 기술적인 어려움이 적기 때문에 사용 가능한 리포터 회선 수가 크게 증가 했습니다. 형질 전환 도구 및 리포터 동물의 가용성이 계속 해 서 증가 함에 따라 형광 기반 세포 선별 방법의 유용성 및 적용 성이 있어야 한다.
우리는 최근 세포 배양7에 대 한 준비에서 일차 뉴런을 정제 하기 위해 형질 전환 동물 로부터 세포 선별을 일상적으로 적용할 수 있음을 입증 하였다. 쥐 또는 마우스 중 하나에서 세포를 선별 함으로써, 우리는 GABAergic 또는 glutamatergic 뉴런6,9중 어느 하나에 특이 적으로 형광 리포터 단백질을 발현 하는 형광 뉴런을 분리 하 고 배양 할 수 있었다. 이러한 정제 된 뉴런 배양 물을 연구 함으로써, 우리는 GABAergic 및 glutamatergic 뉴런 들이 시 냅 스 전송7의 확립에 대 한 글 리 분 비 인자에 의존 하는 방식에서 중요 한 차이를 확인할 수 있었다. 추가적으로, 정제 된 뉴런을 가진 신경 교 세포를 공동 배양 함으로써, 신경 교 세포 들이10,11의 성장 및 생존에서 재생 하는 중요 한 역할을 보여주는 이전의 관측 들을 확대할 수 있었다. 따라서, 세포 분류와 세포 배양의 조합을 통해 서, 우리는 고립 된 특정 뉴런 유형의 개발 뿐만 아니라 그들의 기능에 신경 교 세포의 영향을 조사할 수 있었습니다.
우리는 여기에 형질 전환 쥐 또는 쥐의 피 질 및 해 마 로부터 GABAergic 및 glutamatergic 뉴런의 정제 및 배양을 위한 프로토콜을 제시 한다. 우리는 또한가이 슬 러 외12에서 적응 된 정제 뉴런 및 신경 교 세포의 비접촉 공동 배양을 위한 방법을 제시 한다. 정제 된 GABAergic 배양 물을 생성 하기 위해, 우리는 VGAT-비너스 로부터 형광 뉴런 들을 선별 하 여,이를 선택적으로 > 95%의 향상 된 황색 형광 단백질 변이체 (Venus)를 발현 하는 Wistar 랫 트8 또는 Vgat-비너스 마우스 (13) 대뇌 피 질의 GABAergic 뉴런. 순화 된 glutamatergic 문화를 생성 하기 위하여는, 우리 NexCre에서 형광 성 뉴런을 분류 했습니다; Ai9 마우스 (6)는 대뇌 피 질 glutamatergic 뉴런에서 tdtomato를 발현 한다. 전체 선별 및 배양 절차는 3-4 h 내에서 수행 될 수 있으며 전기 생리학적, 형태학 적 및 세포 생존 분석에 적합 한 수백 개의 복제 배양을 생성 하는 데 사용 될 수 있습니다. 이 방법은 간단 하 고 재현 가능 하며 관심 있는 세포 유형에 대해 97% 이상의 순수 한 정제 된 뉴런 배양 물을 생산할 수 있습니다.
프로토콜
모든 절차 및 동물 유지 관리는 제도적 지침, 독일 동물 복지 법 및 동물 보호에 관한 유럽 위원회 지침 86/609/EEC에 따라 수행 되었으며, 현지에서 허가를 받았습니다. 정부 기관 (0215).
참고: 이 프로토콜은 단일 형질 전환 쥐 또는 강아지 쥐 (출생 후 0 ~ 2)에서 정제 된 뉴런의 배양을 설명 합니다. 모든 기술은 무 균 조건 하에서 수행 되어야 한다. 모든 솔루션은 0.2 µm 필터를 사용 하 여 소독 해야 합니다 ( 재료 표참조). 유리 커버 슬립 및 해 부 도구는 185 ° c에서 3 시간 동안 열 살 균 해야 합니다.
1. 폴 리 라이 신과 코팅 유리 커버 슬립
- 200 µ 폴 리 라이 신 (PLL) 용액의 5Ml 분 취를 제거 하 여 유리 커버 슬립을 준비 합니다. 순수한 주입 학년 물 45 mL를 추가 하 여이 원 액을 20 µ g/mL에 희석 하십시오. 필터-용액을 새로운 50 mL 원추형 튜브로 소독 하십시오. 이 튜브를 "PLL 멸 균"으로 라벨을 부착 합니다.
참고: 상 온에 저장 된 물을 사용 하 여 해 동 공정의 속도를 높일 수 있습니다. - 멸 균 PLL 솔루션에 100 멸 균, 원형, 12mm 유리 커버 슬립을 추가 합니다. 심지어 코팅을 보장 하기 위해, 2 ~ 3 분에 대 한 매 5-10 분 마다 튜브를 교 반. 이 방법으로 커버 슬립을 1 시간 동안 코팅 합니다.
참고: 독일에서 제조한 원형 유리 커버 슬립 (지름 = 12mm)은 안정적인 배양 표면을 제공 하 고 24 웰 세포 배양 판의 웰에 쉽게 들어갈 수 있기 때문에 선호 됩니다. - PLL 코팅의 40 분 후에 티슈 페이퍼 2 개를가지고 흐름 캐비닛에 평평 하 게 놓습니다. 70% 에탄올을 사용 하 여 종이를 소독 한 다음 평평 하 게 하 여 주름을 제거 하 고 건조 상태로 둡니다.
- 유리 커버 슬립을 PLL로 1 시간 코팅 한 후 과량의 PLL 솔루션을 제거 하 고 멸 균 주입 등급 물을 추가 하십시오. 2 ~ 3 초 동안 커버 슬립을 부드럽게 교 미 하 여 초과 PLL의 제거를 허용 합니다. 이 헹 굼 단계를 추가로 2 회 반복 합니다.
- 여분의 물을 제거한 다음 커버 슬립을 멸 균 티슈 페이퍼로 옮겨 준다. 각 커버 슬립을 곡선형 핀셋으로 조심 스럽게 분리 하 고 건조 시켜 둡니다.
참고: 쉽게 분리 되지 않는 커버 슬립은 폐기 될 수 있습니다. 대안적으로, 소량의 물을 첨가 하 여 분리를 도울 수 있다. - 건조 한 후 커버 슬립을 24 웰 배양 플레이트에 옮겨 주세요.
참고: 커버 슬립은 해 부 과정을 시작 하기 전에 약 30 분-1 시간을 준비 해야 합니다. 플레이트는 필요할 때까지 37 ° c 및 5% CO2에서 인큐베이터 에 보관할 수 있습니다.
2. 하 마 및 피 질 조직의 해리
- 세포 배양 용액의 제조
- 신경 조직의 해리에 대 한, 먼저 세포 배양 완충 액의 40 mL 분 취를 제 상 한다 (mM에서의 조성 물): 116 염화 나트륨, 5.4, 1.3 0.52ha2·1c4 · 2N·22h 및 25d 포도 당, pH = 7.4). 15 mL 원뿔형 튜브에 대 한 12 mL의 세포 배양 완충 액을 측정 하는 단계; "BSA"로 레이블. 5 mL의 세포 배양 완충 액을 다른 15 mL 튜브로 측정 하는 단계; "파파 인"으로 라벨을 지정 합니다. 37 ° c에서 15 분 동안 수조 내에 두 튜브를 배양 합니다.
- 나머지 세포 배양 완충 액을 필터-멸 균 하 고, 필요 시까지 4°c에서 보관 하 여 "완충 메 마른"으로 라벨을 부착 한다.
- 소 혈 청 알 부 민 (BSA)의 120 mg을 계량 하 고 "BSA" 라는 레이블이 붙은 튜브에 추가 합니다. 파파 인 7 mg을 무게를 내 고 튜브에 추가 합니다. 15 분 동안 수조에 두 튜브를 돌려줍니다.
참고: 파파 인 분말의 전달을 용이 하 게 하기 위해 계량 보트에 소량의 버퍼를 추가 하는 것이 도움이 된다. - 모든 분말이 용 해 되 면, 각 용액을 신선한 15 mL 원추형 튜브에 필터-살 균 합니다. 튜브 파파 인에 대해, 필터링 된 용액에 "파파 인-멸 균"으로 라벨을 부착 합니다. 튜브 BSA에 대 한, 3 튜브에 멸 균 BSA 솔루션을 분할, BSA 용액 4 mL를 포함 하는 각각. 각 튜브에 ' BSA 멸 균 '과 ' 1 ', ' 2 ' 또는 ' 3 '으로 라벨을 부착 합니다. 모든 튜브를 다시 수조에 반환 하 고 필요할 때까지 37 ° c에서 계속 배양 합니다.
- 조직 해 부를 위한 준비
- 35 mm 여과 지 ( 재료 표참조)를 한 장씩 복용 하 고 70% 에탄올로 소독 하십시오. 100 mm 페 트리 접시의 뚜껑을 흐르는 캐비닛에 두고 건조 시킵니다.
- 해 마와 피 질의 해 부에 필요한가 위, 집게, 메스 및 주걱 ( 재료 표참조)을 배치 합니다.
- 장소 2 35 mm 페 트리 접시와 100 mm 페 트리 접시 흐름 캐비닛의 중앙에 접근 할 수 있는 위치에 멸 균 필터 종이를 포함.
- 트랜스 제 닉 NexCre를 수집; Ai9 및 VGAT 금성 마우스 새끼는 해 부 해야 합니다. 적절 한 여기 및 방출 필터 ( 재료 표참조)가 있는 형광등을 사용 하 여 야생 유형 littermates의 형광 새끼를 구별 하십시오.
- 동물을 하 부 하기 직전에 냉장, 멸 균 세포 배양 완충 액으로 35 mm 페 트리 디쉬를 각각 채 웁 니다.
참고: 한 페 트리 접시는 분리 사이의 도구를 청소 하는 것입니다, 다른 하나는 해 마와 피 질을 수집 하기 위한 것입니다.
- 조직 해 부
- 세포 배양 완충 액이 부 어 지 면 서, 출생 후 하루 0-2 형질 전환 마우스 또는 쥐 새끼 큰, 날카로운가 위를 사용 하 여 머리를 흐름 캐비닛으로 전달 하는 멸 균 100 mm 페 트리 접시를 사용 합니다. 포 셉,가 위 및 주걱을 사용 하 여 신중 하 게 형질 전환 강아지의 뇌를 멸 균 여과 지에 전달 합니다.
- 소 뇌를 멀리 하 고 2 반구를 분리 하는 타입 22 메스를 사용 합니다. 작은 주걱을 사용 하 여 횡 방향으로 반구를 굴려. 각 반구에서 부드럽게 아래로 눌러 피 질이 필터 종이와 접촉 하도록 합니다. 조심 스럽게 해 마와 피 질을 나타 내기 위해 중간 뇌 부위를 이동 합니다.
참고: 반구에 아래로 누를 때 너무 많은 압력을 적용 하지 않도록 주의 하거나 세포가 분쇄 될 수 있다. - 각 반구에서 해 마와 피 질을 분리 하는 메스 또는 주걱을 사용 합니다. 해 부 조직을 냉장 세포 배양 완충 액을 함유 하는 35 mm 페 트리 디쉬에 전달 한다.
참고: 여러 동물을 하 부 하는 경우, 얼음에 50 mL 원추형 튜브에 멸 균 세포 배양 버퍼를 저장 합니다. 각각의 해 부 후, 해 부 된 조직을 냉장 세포 배양 완충 액으로 전달 한다. - 코르 티코-해 마 조직의 성공적인 해 부 후, 흐름 캐비닛에 물 욕조에서 멸 균 파파 인 용액을 전송 한다. 3 mL 파스퇴르 피 펫을 사용 하 여 해 부 해 마와 피 질을 멸 균 35 mm 페 트리 접시의 뚜껑으로 옮겨 준다. 조직이 작은 조각에 있을 때까지 유형 22 메스의 평평한 부분을 사용 하 여 십자 동작으로 들어온다.
- 소량의 파파 인 용액을 사용 하 여 페 트리 디쉬의 뚜껑 으로부터 다진 조직을 무 균 파파 인 튜브로 전달 한다. 파파 인 튜브를 수조에 반환 하 고 25 분 동안 37 ° c에서 조직을 배양 한다.
- 파파 인 인큐베이션 동안, 완전 한 형광 매체 용액을 구성 한다. B27의 1ml의 분 취 제를 제 상, Glutamax 및 펜 strep의 0.5 ml의 분 취 액의 0.5 ml의 분 취 액. 최대 절전 모드의 aliquot 48.5 mL은 50 mL 원뿔형 튜브에 낮은 형광 매체를 제공 합니다. B27, Glutamax 및 펜 Strep를 솔루션에 추가 합니다. 용액을 잘 흔들어 준 다음 필터 소독 하 고 "완전 한 미디어 최대 절전 모드" (날짜 및 이니셜 포함)로 라벨을 지정 합니다. 수 조에서 37 ° c에서 배양 합니다.
- 파파 인 배양 후, 유로 파파 인과 멸 균 BSA 튜브를 흐름 캐비닛에 전달 합니다. 1 mL 파스퇴르 피 펫을 사용 하 여 파파 인 튜브에서 BSA-튜브 1로 코르 티코 해 마 조직을 제거 하십시오.
참고: 과도 한 파파 인 용액의 전달을 최소화 하기 위해 주의 하십시오.
- 세포의 해리
- 조직의 큰 덩어리를 분해 하기 위해, 1 mL 파스퇴르 피 펫을 사용 하 여 조직을 여러 번 트리 팅 합니다. 이 후, 미세 팁 파스퇴르 피 펫을 사용 하 여 조직 7 번을 삼 출 한다. 조직에서 30 초 동안 방치 하면 더 큰 조직을 퇴적 물에 사용할 수 있습니다.
- 30 초 후에 BSA 튜브 1에서 BSA 튜브 2로 1 mL의 용액 및 조직을 전송 합니다. 미세 팁 파스퇴르 피 펫을 사용 하 여 BSA-튜브 2 여러 번에 조직을 삼 투.
- Trituration 후, BSA 튜브 1에서 조직 및 용액의 낮은 1 mL를 다시 전송 하지만, 지금 BSA-튜브 3. 미세 팁 파스퇴르 피 펫을 사용 하 여 BSA-튜브 3 여러 번에 조직을 삼 출.
- Trituration 후, BSA 튜브 1로 튜브 2 및 3에서 모든 솔루션과 조직을 전송 합니다. 3000 x g 에서 3 분간 원심 분리기를 2-3.
- 원심 분리 중에 완전 한 신경 기저 A 배지 (NBA 미디어)를 구성 합니다. 용 수 조에서 37 ° c에서 48.5 ml의 원뿔형 튜브에 NBA 미디어의 aliquot를 50를 배양 한다. 이 튜브에 라벨 "NBA만". 또한, B27의 1Ml의 분 취 제를 해 동 하 고, 실 온에서의 Glutamax 및 펜 Strep의 0.5 mL의 분 취 액을 0.5.
- 원심 분리 후, 펠 라이 온 조직에서 상층 액을 조심 스럽게 제거 하 고 2 mL의 완전 한 배지에서 세포를 재 일시 중단 한다. P1000 파이 펫을 사용 하 여 조직을 위 아래로 20 회 트리 트 레이트 합니다.
참고: 세포를 너무 세게 피 펫 팅 하지 않도록 주의 하십시오. 너무 많은 압력이가 해지면 세포가 손상 될 수 있습니다. - 1 mL 파스퇴르 피 펫을 사용 하 여 30 µm 세포 체를 통해 세포 현 탁 액을 폴리스 티 렌 샘플 튜브로 걸러 냅니다.
참고: 세포 현 탁 액이 세포 체를 통해 즉시 통과 하지 않는 경우에, 흐름을 시작 하기 위하여 살 균 장갑을 가진 체의 꼭대기에 눌러야 할 수 있습니다. 이 중요 한 단계 는 셀 분류기의 막힘을 방지 합니다. - 선별 후 뉴런을 수집 하려면 완전 한 미디어의 300 µ L을 폴 리 프로필 렌 튜브의 필요한 수로 피 펫 팅 하 여 수집 튜브를 준비 하십시오.
- 셀 서 스 펜 션을 정렬 하기 위해 셀 분류기로 이동 시킬 준비가 되었습니다. 샘플을 희석 해야 하는 경우에는 셀 서 스 펜 션, 여분의 수집 튜브 및 여분 미디어를 가져가 라.
3. 정제 된 GABAergic 또는 Glutamatergic 뉴런의 세포 분류
참고: 선별 하는 동안 세균 오염의 가능성을 최소화 하기 위해 선별 기의 샘플 튜브를 70% 에탄올로 헹 구 어 정렬 하기 전에 5 분 이상. 상세한 정렬 매개 변수는 계측기 마다 다르며 근본적인 고려 사항은 다음과 같습니다.
- 첫 번째 셀 정렬 중에 야생 유형 동물의 세포를 정렬 하 고 비교 하 여 레이블이 없는 셀에서 배경 형광 수준을 설정 합니다.
- 정렬할 각 형광 셀 유형에 대해 적절 한 여기 및 방출 필터를 선택 합니다. 각각 488 nm 또는 531 nm 여기 파장을 사용 하 여 금성 및 TdTomato 단백질을 자극 합니다. 530/40 및 575/30 방출 필터 세트를 통해 방출 된 빛을 각각 감지 합니다.
- 완전 한 매체의 300 μ l를 포함 하는 폴 리 프로필 렌 수집 튜브를 세포 수집을 위한 셀 분류기에 추가 하십시오.
- 고 순도의 경우, 밝게 표시 된 형광 셀을 정렬 하십시오 ( 그림 1b 참조: 정렬 된 셀의 도트 플롯).
- 정렬 후 최적의 결과를 위해 정렬 된 셀의 순도 테스트를 수행 하 여 순도 수준을 추정 합니다. 정렬 다음의 일반적인 셀 회수율은 70 ~ 80%입니다.
- 각 수집 튜브에 정렬 된 셀 수를 기록해 둡니다. 이 값은 셀 정렬 도구에 의해 주어진 다.
참고: 셀 정렬은 70 µm 노즐 (70 psi 보호관 유체 압력) 또는 100 µm 노즐 (20 psi 외피 유체 압력)을 사용 하 여 수행할 수 있습니다.
4. 정렬 된 뉴런의 배양
- 셀 선별 후, 1 mL 파스퇴르 피 펫을 사용 하 여 수집 된 세포를 2 mL 둥근 바닥 원심 분리기 튜브로 옮깁니다. 세포를 3 분간 3000 x g 에서 원심 분리 하 여 세포 펠 렛을 형성 한다.
참고: 셀 펠 렛의 위치를 식별 하는 데 도움이 되도록 둥근 바닥 원심 분리기 튜브를 바깥쪽으로 향하게 하 여 뚜껑의 힌지 (즉, 튜브의 동일한 측면에서 힌지로)를 원심 분리기 튜브 뒤쪽에 형성 할 수 있습니다. - 원심 분리 하는 동안 B27 0.5, Glutamax 및 펜 Strep의 0.5 ml의 1 mL을 미리 데워 진 NBA 미디어의 48.5 mL에 추가 하십시오. 용액을 잘 흔들어 다음 멸 균 및 라벨을 "NBA 완료 미디어" (날짜 및 이니셜 포함)로 표시 합니다. 필요할 때까지 물 목욕으로 돌아가십시오.
- 원심 분리 후, 1 mL 파스퇴르 피 펫을 사용 하 여 상층 액을 다른 원심 분리기 튜브로 이송 (세포 펠 렛이 교란 된 경우 상 등 액을 유지 한다). 1000 셀/µ의 세포 밀도를 달성 하기 위해 미리 데워 진 완전 한 NBA 미디어의 필요한 양으로 세포 펠 렛을 재 일시 중단 하 고 P200 또는 P1000 파이 펫을 사용 하 여 위아래로 파이 펫 팅 하 여 세포를 재 정지 시킵니다.
- 해리 된 세포의 존재를 확인 하려면 4 배 또는 10 배 대물 렌즈를 사용 하 여 현미경으로 세포 용액을 확인 하십시오. 대안적으로, 커버 슬립 상에 소량의 세포 용액을 파이 펫 팅 하 고 현미경 하에서 확인 한다. 다 수의 세포가 존재 하는 경우에, 4.3 단계의 상층 액은 폐기 가능 하다.
- 세포를 도금 하기 전에 2 ~ 3 초 동안 중간 속도로 소용돌이를 하 여 균일 한 세포 현 탁 액을 보장 한다. Vortexing에 따라, 셀 현 탁 액의 10 µ L을 각 커버 슬립의 중심으로 신속 하 게 피 펫 팅 합니다. 세포를 피 펫 팅 한 후 각 플레이트를 인큐베이터 (5% CO2/37 ° c)로 신속 하 게 복귀 하 고 1 시간 동안 배양 합니다.
참고: 여러 개의 24 웰 플레이트에 셀을 추가 하는 경우, 플레이트 사이에 세포를 볼 텍 싱 하 여 균일 한 세포 밀도를 보장 합니다. - 1 시간 후, 미리 따뜻하게 완전 한 NBA 미디어의 500 µ L로 세포를 공급 하 고 인큐베이터로 돌아갑니다.
참고: 세포를 공급할 때 세포 분리를 피하기 위해 매체를 우물의 측면 아래로 부드럽게 피 펫 하는 것이 중요 합니다. 짧은 실험 (< 16 일)의 경우, 상기 밀도에서 먹이는 것은 필요 하지 않습니다. 더 큰 밀도의 세포를 도금 할 때 더 빈번한 급지 간격이 필요할 수 있습니다 ( 토론참조).
5. 성상 세포 강화 신경 교 지원 배양 물
참고: 신경 교 배양14 의 제조 및 세포 배양 삽입물의 사용은 이전에 기술 되었다12. 간단히 말해, 농축 된 아 교 세포 배양 글 리아는 코 티코-하 마 조직 으로부터 유래한 다 (meninges 제거 됨; P2-P5), 20 µ의 PLL 코팅 6 웰 플레이트에서 일주일 동안 배양 되었으며, DMEM 배지를 보충 한 혈 청.
- 정제 된 뉴런 및 신경 교 세포를 공동 배양 하기 위해, 필요한 수의 세포 배양 삽입 (0.4 µm 기 공 크기에 대 한 교 활 신경 교 세포를 통로- 물질 표참조). 세포를 통과 시키기 위해, 부 화기 로부터 confluent 신경 교 세포를 함유 하는 6 웰 플레이트를 제거 하 고 2 개의 웰 스를 2 회 세척 한 후, 2 mL의 미리 따뜻하게 (37) 인산 완충 식 염 수 (PBS)를 사용 한다.
- PBS 용액을 흡 장 하 고 P1000 피 펫을 사용 하 여 미리 데워 진 (37°c) 트립 신 (1:250)/EDTA (0.25%/0.02%) 각 웰에 대 한 해결책.
- 6 웰 플레이트를 인큐베이터에 반납 하 고 세포 분리를 위해 2 ~ 3 분 간격으로 점검 합니다.
- 중요 한 세포 분리가 발생 한 후에는 미세 팁 파스퇴르 피 펫을 사용 하 여 세포 및 세포 용액을 부드럽게 위아래로 피 펫 하 여 개별 세포를 더 분리 하 고 분리할 수 있도록 돕습니다.
- 셀 용액을 15 mL 원추형 튜브로 전송 하 고 3 분 동안 3000 x g 에서 원심 분리기로 이동 합니다.
- P1000 피 펫을 사용 하 여 세포를 재 일시 중단 하 고 미리 데워 진 (37 ° c) NBA 완전 배지는 셀 펠 렛이 용액에 있을 때까지 위아래로 부드럽게 파이 펫 팅을 수행 합니다.
- 하 모 세포종 또는 자동화 된 세포 카운터를 사용 하 여 세포 수를 수행 합니다.
참고: 문화 7 일 후 약 750000-1000000 세포는 6 웰 플레이트의 각 웰에서 수확 할 수 있습니다. - 4만의 각 세포 배양 액을 500 µ L 방울 (80 세포/µ L)에 삽입 하는 교 신경 세포.
- 세포가 1 시간 동안 부착 되도록 허용한 후, 멸 균 포 셉을 사용 하 여 정제 된 뉴런을 포함 하는 24 웰 플레이트에 신경 교 피복 세포 배양 삽입물을 전달 한다. 세포 배양 삽입물 (약 300 µ L)의 표면에서 과잉 배지를 제거 한다.
참고: 기포가 종종 세포 배양 삽입물 아래에 갇 히 게 될 수 있으므로, 삽입을 부드럽게 기울여 이러한 기포를 분리 해야 할 수 있습니다. 더 많은 신경 교 세포가 세포 배양 삽입물에 첨가 되는 경우, 추가적인 세척 및 원심 분리기 단계는 세포 생존에 유해할 수 있는 과잉 트립 신을 제거 하기 위해 요구 될 수 있다.
결과
형질 전환 마우스 또는 랫 트 코르 티코-하 마 조직 으로부터 형광 뉴런의 해리 및 세포 분류는 약 3 ~ 4 시간 내에 수행 될 수 있다. 결과는 16 일 동안 배양에서 성장할 수 있는 매우 순수한 형광 뉴런의 인구입니다.
정제 된 배양 물을 생성 하기 위해, 형질 전환 동물을 적절 한 필터 세트로 형광 램프를 사용 하 여 먼저 동정 하였다 (형광 신생아 VGAT 금성 및 NexCre의 예; Ai9 마우스 새끼는 도 1a에 나타나 있다). 형질 전환 동물의 동정에이 어, 해 부 된 조직은 해리 되 고, 가장 강하게 형광 뉴런은 정제 된 세포 집단을 생성 하도록 분류 되었다. 예를 들면 형광 강도 도트 플롯 NexCre; FACS 동안 얻어진 Ai9 및 VGAT 금성 마우스 뉴런은 도 1b에 나타나 있다. 최적화 될 때, 그것은 개별 P0 NexCre의 피 질과 해 마에서 50만와 80만 세포 사이에서 수확 하는 것이 가능 합니다; Ai9 또는 VGAT 비너스 마우스. 셀은 600 이벤트/s의 속도로 정렬 될 수 있습니다. 세포 순도의 추정치는 핵 마커로 서 DAPI를 사용 하 여 수행 하였다 (도 1c). 강하게 양성 세포를 분류 함으로써, 97% 이상의 순도는 일상적으로 달성 될 수 있다7.
성공적인 선별 후, 도금 된 뉴런은 둥근 모양으로 나타나야 하 고, 매끄러운 멤브레인을가지고 있으며, 신경 세포를 시험관 내 약 1 시간 후에 새싹을 볼 수 있어야 합니다 (그림 2a, B). 7 일 동안 시험관 내에서, 일부 세포 사 멸은 명백 할 수 있지만, 생존 가능한 세포는 모든 배양 조건 (도 2c, D)에 존재 해야 한다. 시험관 내에서 12 ~ 16 일 동안, 전체 세포 패치-클램프 기록 물 및 바이 셀 틴-필 링 (15)을 사용 하 여 정제 된 뉴런의 형태학 적 및 전기 생리학적 개발을 조사할 수 있다 (도 3). 순화 한 문화의 분석은 glutamatergic와 GABAergic 신경 둘 다가 그들의 세포 바디에서 축 삭과 모 수석을 확장할 수 있었습니다 (그림 3a, B) 및 반응에 있는 활동 잠재력을 생성 하는 능력을 유지 한다는 것을 계시 합니다 (그림 3c, D). 특히, 그러나, 정제 다음, GABAergic 뉴런은 상당한 양의 자발적인 시 냅 스 전달을 받았으며, glutamatergic 뉴런은 신경 교 세포의 부재 하에 매우 작은 시 냅 시스 전달을 받는다 (도 3e , F) 7.
우리가 이전에 보고 한 바와 같이, 정제 된 배양의 세포는 정렬 되지 않은 문화권에서 보다 더 저조한 생존 하는 경향이 있고 상당히 작은 모 수석 및 축 삭7. 이러한 적자를 극복 하기 위해, 우리는 신경 교 세포 들을12,14로 정제 된 배양 물의 개발을 지원 하기 위한 방법 들을 적응 및 적용 하였다. 우리의 신경 교 지원 배양 물 (DIV7)의 세포 조성은 도 4a에 나타나 있다. 이들 배양 물은 주로 신경 교 섬유와 산 성 단백질 (GFAP) 양성 성상 세포를 포함 하지만 또한 분화 분자 (CD11b) 양성 미세 교 및 myelin 염기 단백질 (MBP) 양성 oligodendrocytes의 일부 군집을 함유 하였다. 7 DIV 이후에, 이들 세포는 정제 된 뉴런의 비접촉 지 지체를 제공 하기 위해 세포 배양 삽입물을 통과 시킬 수 있다 (도 4b, C). 글 리아 뉴런 공동 배양의 분석은 약 4만 신경 교 세포가 정제 된 glutamatergic 및 GABAergic 뉴런 모두의 장기적인 생존과 성장을 개선 하기에 충분 하다는 것을 보여준다 (도 4d, E). 더욱이, 전기 생리학적 분석은 신경 교 세포와 공동 배양 한 glutamatergic 뉴런 들이 매우 활발 하 게 활동 하 고 있으며, 네트워크 활성 (신경 교 glutamatergic 뉴런의 움직임을 폭발적으로 증가 시켰다는 것을 보여준다 잠재력: 62%; n=28; 도 4f , G). 따라서 신경 교 지원은 뉴런 성장과 생존 촉진 뿐만 아니라, 시 냅 스 전달을 촉진 하 고 glutamatergic 문화권에서 네트워크 활동의 확립에도 중요 합니다.
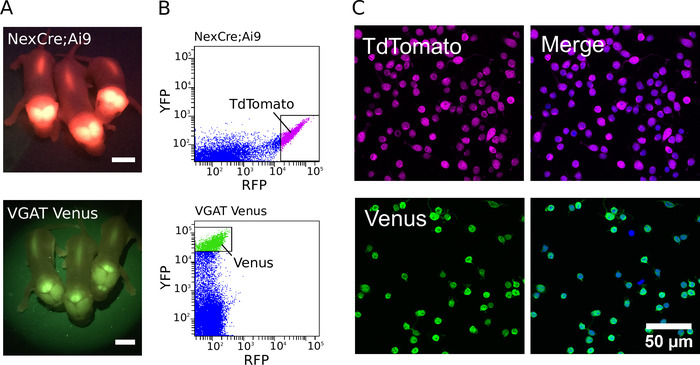
그림 1: glutamatergic 및 GABAergic 뉴런의 정제 (A) 상기 NexCre에서 TdTomato의 이식 유전자 발현 으로부터의 형광 신호를 보여주는 이미지; Ai9 마우스 (상단)와 VGAT 비너스 마우스 (하단)의 비너스. 축척 막대 = 5mm. (B) NexCre에서 코 티코-해 마의 해리 된 세포의 TdTomato와 금성 형광의 강도 산 점도 플롯; Ai9 마우스 (상단)와 VGAT 비너스 마우스 (하단). 강하게 형광 TdTomato 또는 비너스 뉴런을 선별 (게이팅 박스에 의해 표시) 하도록 선택 하였다. (왼쪽) 정렬 된 TdTomato (상단) 및 금성 (바닥) 긍정적 인 뉴런의 공초점 이미지. (C, 오른쪽) DAPI (파란색 의사 색상)와 공동으로 얼룩진 셀을 보여주는 병합 된 이미지입니다. TdTomato 형광 내 생 이며 고정에도 불구 하 고 강한 남아 (마젠타 의사 색). 금성 발현은 GFP 및 알 렉 사 Fluor-488-공액 이차 항 체 (녹색 의사 색)에 대하여 지시 된 일차 항 체의 조합을 사용 하 여 향상 된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
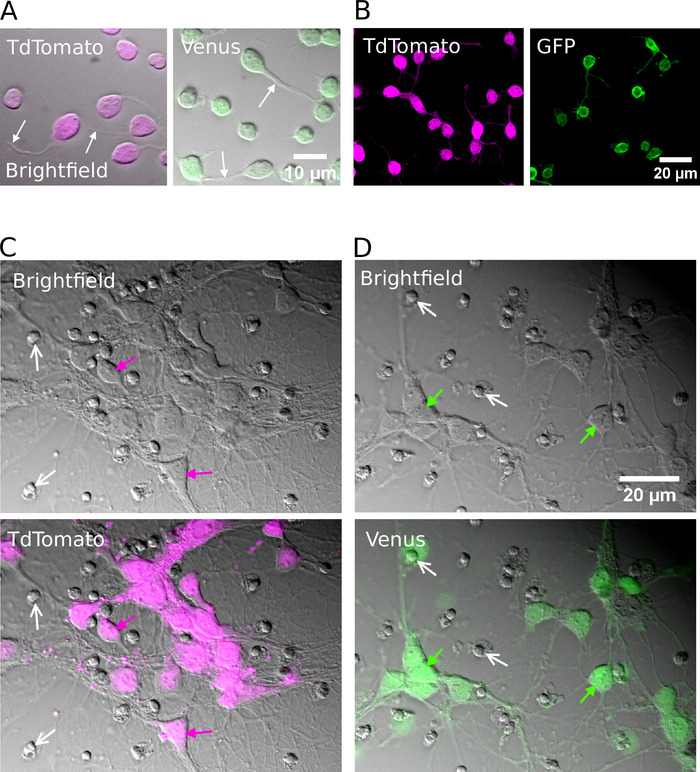
그림 2: 정제 된 glutamatergic 또는 GABAergic 뉴런의 세포 배양. (A) 결합 된 적외선 (밝은 필드) 이미지와 TdTomato (왼쪽)와 비너스 (우측)에서 형광 신호를 중첩 하 여 시험관 내에서 1 시간 동안 배양 하였다. 백색 화살표는 성장 하는 신경의 위치를 나타낸다. (B) 양성 뉴런의 TdTomato (left) 및 비너스 (우측)의 공초점 이미지를 시험관 내에서 1 시간 동안 배양 하였다. (C, D) 밝은 필드 (상단)와 TdTomato (C) 및 금성 양성 뉴런 (D)의 결합 된 밝은 필드 및 형광 이미지를 시험관 내에서 7 일 동안 배양 하였다 (DIV). 흰색 화살표는 죽은 세포에서 응축 된 핵의 위치를 보여줍니다. 유색 화살표는 형광 표지 뉴런을 식별 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 정제 된 뉴런의 형태학 적, 전기 생리학적 및 시 냅 스 성질. (A, B) TdTomato (A) 및 비너스 포지티브 뉴런의 공초점 이미지는 각각 13 및 14 div에 있다. 셀은 신경 세포 시각화를 돕기 위해 거꾸로 된 룩 업 테이블을 사용 하 여 검은색으로 표시 됩니다. Insets는 확인 된 뉴런에 의해 발현 되는 형광 신호를 보여준다. (C, D) TdTomato (C)와 비너스 포지티브 뉴런 (D)에서 하이퍼 편광 (200 pA, 20pa 스텝) 및 전 셀 패치 클램프 레코딩에의 한 디 편광 (200 pA) 전류 펄스 로부터의 전압 응답. Insets는 상응 하는 기록 된 뉴런을 보여줍니다. 각 셀의 휴식 막 전위는 기록 추적의 왼쪽에 표시 됩니다. (E) 대표적인 전압-클램프 레코딩 (10 초) 및 비너스 포지티브 뉴런 (F)에서 얻어진 다. 자발적인 흥분 성의 후 시 냅 스 이벤트 (EPSCs)는 TdTomato 양성 뉴런에서 기록 되었다, 50 mV의 유지 잠재력에 유지. 자발적으로 발생 하는 억제 후 시 냅 스 이벤트 (IPSCs)는 0mv의 유지 전위에서 유지 되는 금성 양성 뉴런 으로부터 기록 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 신경 교 공동 배양을 통한 신경 발달 지원. (A) 신경 교 세포의 면역 표지 된 신경 교 배양 물 (gfap, 좌측), 분화 분자 (CD11b, 중) 및 마이 엘 린 염기 단백질 (MBP)에 대 한 공초점 이미지. 신경 교 세포는 7 DIV를 위해 배양 하였다. (B) 세포 배양 삽입물의 이미지는 비 접촉 배열에서 정제 된 뉴런을 갖는 신경 교 세포를 공동 배양 하는 데 사용 된다. (C) 신경 세포와 글 리아를 공동 배양 하는 데 사용 되는 공간적 배열의 개략. (단, E) 신경 교 지원의 부재 (왼쪽) 또는 존재 (우측)에서 14 일 동안 성장 한 TdTomato (D) 및 비너스 포지티브 뉴런 (E)의 공초점 이미지. (F, G) TdTomato (F)의 전류-클램프 기록 (60 s)과 금성 양성 뉴런 (G)은 신경 교 지원의 부재 (위) 또는 존재 (바닥)에서 14 일간 배양 하였다. 뉴런은 그들의 휴식 막 전위 (각 기록 추적의 왼쪽에 제시)에서 기록 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
우리는 여기에 정제 된 신경 세포 배양 물을 생성 하기 위해 일차 뉴런의 선별 및 배양을 결합 하는 방법을 설명 합니다. 이 방법은 일반적인 일차 해리 된 뉴런 배양 프로토콜 보다 약 1 시간 이상 소요 되지만, 특정 뉴런 유형을 포함 하는 수백 개의 복제 배양을 생성 하는 것을 허용 한다. 정제 된 뉴런은 적어도 16 일 동안 단독으로 성장할 수 있으며, 축 삭과 모 수석을 연장 하 고 활동 전위의 반복적인 기차를 발사할 수 있습니다 (그림 2 와 그림 3). 중요 하 게는, 이들 세포는 전기 생리학적, 형태학 적 및 생존 분석을 포함 하는 규칙적인 일차 해리 된 뉴런 배양 물과 동일한 실험적 분석을 가능 하 게 한다. 이러한 정제 된 배양 물에 대 한 작업의 주요 이점은 특정 세포 유형의 개발이 단독으로 연구 될 수 있다는 것 이다. 정제 된 배양 물의 개발을 지원 하기 위해, 우리는 또한 신경 교 세포와 정제 뉴런을 공동 배양 하기 위한 프로토콜을 제시 한다. 이전에 나타난 바와 같이, 신경 교 세포로 정제 된 뉴런을 공동 배양 하 여 생존 율을 높이고, 성장을 촉진 하 고, 네트워크 형성7 을 촉진할 수 있다 (도 4). 따라서, 우리는 여기에 글 리아-신경 상호 작용의 연구를 추가 해야 하는 방법의 조합을 제시 하 고 관심의 다른 세포 유형의 개발 및 상호 작용을 연구 하는 데 유용 증명할 수 있습니다.
정제 된 glutamatergic 뉴런의 배양에 관한 연구는 신경 네트워크 및 시 냅 스 형성의 발달을 촉진 하는 신경 교 세포 인자를 분 비 하는 방법에 대 한 근본적인 통찰을 밝혀 내었다16,17,18 . 일반적으로 특정 뉴런 유형을 정화 하는 방법은 GABAergic 뉴런 보다는 glutamatergic 뉴런의 개발을 연구 하는 데 더 성공적으로 적용 되었습니다. 이것은이 두 세포 유형이 어떻게 발전 하는지에 대 한 우리의 이해에서 차이를 이끌어 냅니다. GABAergic과 glutamatergic 뉴런은 해부학, 생리학 및 발달 기원 측면에서 크게 차이가 나는 것을 감안할 때, 우리는 그들의 기능과 생리학을 더 잘 이해 하기 위해 자신의 권리로 GABAergic 뉴런을 연구 하는 것이 중요 합니다. 여기에 제시 된 프로토콜을 사용 하 여, 우리는 이전에 GABAergic 및 glutamatergic 뉴런은 시 냅 스 전송7의 확립에 대 한 글 리 분 비 요인에 의존 하는 방법에 중요 한 차이점을 확인 했습니다. 이 프로토콜을 게시 함으로써 우리는 다른 사람들이 뉴런 및 신경 교 세포 사이의 중요 한 상호 작용에 대 한 더 많은 통찰력을 얻을 수 있기를 바랍니다.
이 프로토콜에서, 우리는 다른 형질 전환 설치류 라인에서 GABAergic 또는 glutamatergic 뉴런을 정제 하는 데 사용 하는 유 세포 분석 기반의 세포 선별 방법을 설명 합니다. 비너스 포지티브 GABAergic 뉴런은 VGAT 금성 마우스 (13 ) 또는 쥐 (8 )와 tdtomato 양성 glutamatergic 뉴런 으로부터 정렬 되어 nexcre 로부터 정렬 되었다; Ai9 마우스 (NexCre9 및 Ai9 리포터 라인6에서 원래 사육, 20187)를 참조 하십시오. 최근 몇 년 동안, 기술 발전으로 인해, 형질 전환 동물의 생성이 현저 하 게 쉬워진다. 따라서 형광 분자를 발현 하는 동물의 가용성은 다양 한 세포 유형에 서 급격히 증가 하 고 있습니다. 이것은, 차례로, 형광 활성화 한 세포 분류의 사용 그리고 적용 성을 증가 시켰습니다. 관심 있는 세포를 분리 하는 대안적 방법은 현재16,19,20이 존재 하지만, 자연적으로 발생 하는 표면에 대 한 적절 한 항 체의 가용성에 대 한 의존성에 의해 다소 방해 된다 항. 이것은 이미 유효한 많은 세포 특정 형질 전환 리포터 동물에서 세포를 분류 하기 위하여 이용 될 수 있는 형광 근거한 세포 분류 방법과 비교 될 때 그들의 다양성을 제한 합니다. 그럼에도 불구 하 고 최적화 된 항 체 기반 선별 방법은 신속 하 고 높은 항복이 가능 하며, 축 삭과 모 수석으로 세포를 정제 할 수 있게 함으로써 세포 해부학을 더 잘 보존 할 수 있습니다21. 따라서 선별 전략을 결정할 때 항 체 선별 방법이 여전히 고려 되어야 합니다. 궁극적으로, 관심의 세포 유형, 세포가 정렬 되어야 하는 나이, 형질 전환 동물 또는 표면 항 원의 가용성 및 필요한 세포 수는 가장 적합 한 선별 전략을 선택할 때 결정적인 요인이 될 것 이다.
형광 기반 세포 선별은 세포를 정화 하는 간단 하 고 재현성 있는 방법 이지만, 세포 품질을 유지 하기 위해서는 프로토콜의 특정 단계에서 주의를 기울여야 합니다. 예를 들어, 각각의 원심 분리 단계에 따라, 세포 펠 렛이 가능한 한 빨리 재 현 탁 되 고 세포가 성공적으로 회복 되었는지 확인 하는 것이 중요 합니다. 때때로, 상 등 액을 제거할 때 세포 펠 렛이 교란 될 수 있다. 따라서 원심 분리 단계 사이에서 현미경으로 세포의 존재를 확인 하 여 광범위 한 세포 손실을 배제 하는 것이 좋습니다. 세포 도금 후에, 세포는 먹이 기 전에 적어도 1 시간 동안 고착 하는 것이 허용 되어야 합니다. 세포가 너무 빨리 공급 되 면 일부 세포가 커버 슬립에서 빠질 수 있으므로 배양 밀도가 감소 합니다. 배양 후 1 시간 후에는 세포 건강을 평가 하는 것이 좋습니다. 세포가 건강 하 게 나타나지 않는 경우 (건강 한 세포의 예가 도 2a에 도시 되어 있음), 또는 현저한 세포 사 멸이 있는 경우,이는 해리 또는 선별 과정 중에 문제의 징후 일 수 있다. 더 중요 한 고려 사항은, 임의의 세포 유형을 배양 할 때, 세포 배양 배지를 관리할 때 주의 하는 것 이다. NBA 미디어에는 pH 지시약22로 작용 하는 페 놀 레드가 포함 되어 있습니다. 미디어가 너무 황색으로 되 면, 이것은 pH가 너무 산 성이 있음을 나타낸다; 미디어가 너무 분홍색이 되 면 용액이 너무 알칼리 성 임을 나타냅니다. 스톡 솔루션은 오랜 기간 동안 개방, 특히 원추형 튜브에 인용 된 미디어는 시간이 지남에 따라 더 알칼리 성이 되는 경향이 있습니다. 그것은 따라서 매주 신선한 완전 한 NBA 미디어를 구성 하는 것이 좋습니다 매 2 주마다 전체 미디어 (대기 조건에서 중간 버퍼 따라서 더 안정적 이어야 한다). 이러한 점을 고려 하 여 세포 선별 및 세포 배양 장비에 액세스 할 수 있는 모든 실험실에서 정제 된 세포 배양을 확립 할 수 있어야 합니다.
우리의 실험의 대부분에서 우리는 단일 동물에서 정제 된 문화를 생산. 그러나 생화학 적 분석을 위해 세포를 정화 할 때 분류를 위해 여러 동물을 함께 풀 해야 할 수도 있습니다. 우리는 위의 프로토콜을 사용 하 여 8 배아 마우스 (배아 날 13 마리의 동물)까지 성공적으로 정렬 했습니다 (데이터는 표시 되지 않음). 그러나, 더 많은 동물이 정렬 될 경우, 조직 양의 증가를 수용 하기 위해 파파 인 및 BSA 용액 (2.1.4 단계에서 설명)의 부피를 증가 시킬 필요가 있을 수 있다. 추가적으로, 더 많은 세포가 문화에서 도금 되는 경우에, 더 빈번한 먹이 일정은 요구 될 수 있습니다. 시작 점으로 서, 세포는 컨디셔닝 된 미디어의 100 µ L을 제거 하 고 신선한 완전 한 NBA 미디어의 200 µ L을 추가 하 여 7 일 마다 공급 될 수 있습니다. 신경 생존을 위해, 더 많은 동물을 분류 하는 경우, 가능한 한 많은 정렬 시간을 최소화 하기 위해 생각 해야한다. 이는 정제 된 세포를 효율적으로 사용 하기 위해 다운스트림 분석을 신중 하 게 최적화 해야 하는 경우가 많습니다. 우리는 600 이벤트의 속도로 마우스 뉴런을 일상적으로 분류 했으며, 동물 당 최대 500000-800000 세포 (출생 후 0 ~ 2 일)에 해당 합니다. 그러나, 이것은 정렬 속도 및 조건의 철저 한 최적화 없이 했다. 따라서 정렬 속도 및 수율의 추가 개선이 가능 해야 합니다.
정제 된 뉴런은 생존을 위해 글 리아 컨디셔닝 미디어가 필요 합니다. 이는 신경 교 컨디셔닝 배지10으로 뉴런을 치료 하기 전에 뉴런 및 신경 교 세포를 별도로 배양 하 여 이전에 입증 되었다. 우리의 실험에서, 우리는 세포 배양 접시 내부에 배치 되는 반 투과성 세포 배양 삽입물에 신경 교 세포를 배양 하 여 정제 된 뉴런을 지원 하기로 결정 했습니다. 이 방법은 신경 교 유래 세포 외 기질 단백질과 뉴런 (12)과의 상호작용을 연구 하기 위해 성공적으로 적용 되었다. 이러한 방법에 의해 제공 되는 비 접촉, 연속 지 지체는 세포의 별개의 배양 물에 비하여 많은 장점을 가진다. 가장 주목할만 하 게, 신경 교 세포의 공동 배양은 생체 내 상황을 더욱 유사 하 게 하는 세포 배양 배지를 지속적으로 조절 하 고 컨디셔닝 할 수 있게 한다. 또한, 세포의 연속적인 공동 배양은 분리 된 배양 물에서 불가능 한 신경 세포와 글 리아 사이에 잠재적인 피드백 시그널링을 허용 한다. 우리의 프로토콜에서, 필요 하다 면, 연속적인 공동 배양 방법은 쉽게 생략 될 수 있고 글 리아 컨디셔닝 배지를 갖는 뉴런의 고전적 치료가 수행 될 수 있다.
요약 하자면, 여기에 제시 된 프로토콜은 독자에 게 자신의 정제 된 세포 배양 실험을 확립 할 수 있는 견고한 기초를 제공 하는 것을 목표로 합니다. 우리는 형질 전환 동물 및 바이러스 성 작 제물이 예측 가능한 미래를 위해 계속 증가할 것 이라는 것을 예상 합니다. 따라서 형광에 기초한 세포 선별 기술은 더욱 널리 사용 되 고 가치 있게 될 가능성이 있다.
공개
저자는 경쟁 하는 재정적인 이익이 없다는 것을 선언 합니다.
감사의 말
저자 들은 제니 키 쉬와 아나 테이 뮬러가 제공 하는 우수한 기술 지원에 대해 감사 하 고 싶다. 유 세포 분석 핵심 시설, 도이체스 레 우 스, 베를린. 생존 분석에 대 한 도움을 주셔서 감사 드립니다. 또한, 리 타 Loureiro에 게 그 프로토콜의 중요 한 판독을 위해 형광 마우스와 크리스티안 Ebner의 이미지를 포착 하는 데 도움을 주셔서 감사 하 고 싶습니다. VGAT-비너스 트랜스 제 닉 쥐는 일본의 생리 과학 연구소에서 pCS2를 사용 하 여,이 야 나가와 키 박사에 의해 생성 되었다. 이 작품은 독일 연구 위원회에 의해 지원 되었다 (도이치, DFG EXC 257에 IV).
자료
| Name | Company | Catalog Number | Comments |
| Neural Basal A media (NBA) | ThermoFisher Scientific | 10888022 | Cell Culture Buffer |
| B27 | ThermoFisher Scientific | 17504001 | Culture supplement |
| Glutamax | ThermoFisher Scientific | 35050-038 | Culture supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140-122 | Antibiotic |
| Poly-L-Lysine | SIGMA | P1399 | Coverslip coating |
| Papain | SIGMA | P4762-1G | Enzyme |
| Bovine Serum Albumin | SIGMA | A3294-100G | Serum |
| Hibernate A low fluorescence media | Brain Bits Ltd | HALF | Cell Transport media |
| Dulbeccos Modified Eagles Medium (DMEM) | Biochrom | F0435 | Glial Culture Buffer |
| Fetal Calf Serum (FCS) | Biochrom | S0115 | Serum |
| Trypsin/EDTA | Biochrom | L2163 | Enzyme |
| Fine Tip Pasteur Pipette | Neo Labs | - | Used for trituration of cells |
| 24-well plates | BD | 353047 | Culture plate |
| 50 mL Falcon tubes | BD | 352070 | - |
| 15 mL Falcon tubes | BD | 352096 | - |
| Glass coverslips: 12 mm round | Roth | P231.1 | - |
| 35 mm Petri dish | Corning | 353001 | - |
| 100 mm Petri dish | Corning | 353003 | - |
| 30 µm CellTrics Cell Sieve | sysmex | 04-004-2326 | To remove cell clumps before cell sorting |
| Round bottom polystyrene tubes | BD | 352054 | Transport tube for sorted cells |
| Round bottom polypropylyne tubes | BD | 352063 | Collection tube for sorted cells |
| Cell culture inserts – 0.4 µm transparent PET | Falcon | 353 095 | For the co-culture of neurons and glia |
| Extra fine Bonn Scissors | Fine Scientific Tools | 14084-08 | To remove overlying skin and bone of mice |
| Extra narrow Scissors | Fine Scientific Tools | 14088-10 | To remove overlying skin and bone of rats |
| Forceps | Fine Scientific Tools | 11242-40 | To hold the head in place |
| Spatula (130 mm long/5 mm tip width) | Fine Scientific Tools | 3006.1 | To remove the brain to filter paper |
| Scalpel Blades | Swan-Morton | #0308 | To mechanically dissociate neural tissue |
| Haemocytometer (Neubauer Imroved) | Optik Labor | - | To cell count dissociated cells |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/LS-1G | To excite TdTomato |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FHS/EF-4R2 | Td Tomato compatible emission filter |
| Fluorescent Miners Goggles (excitation light) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/ULS-02B2 | To excite Venus |
| Fluorescent Miners Goggles (emission filter) | Biological Laboratory Equipment Maintenance and Servce Ltd (BLS) | FS/TEF-3GY1 | Venus compatible emission filter |
| Mouse-Anti-GFP primary antibodies | UC Davis | 75-132 | To enhance Venus signal following fixation |
| Mouse-Anti-GFAP primary antibodies | SIGMA | G-3893 | The identification of reactive astrocytes |
| Rabbit-Anti-CD11b primary antibodies | Southern Biotech | 1561-15 | The identification of microglial cells |
| Rabbit-Anti-MBP primary antibodies | Millipore | AB980 | The identification of oligodendrocyes |
참고문헌
- Radcliff, G., Jaroszeski, M. J. Basics of flow cytometry. Methods in Molecular Biology. 91, 1-24 (1998).
- Feher, K., Kirsch, J., Radbruch, A., Chang, H. D., Kaiser, T. Cell population identification using fluorescence-minus-one controls with a one-class classifying algorithm. Bioinformatics. 30 (23), 3372-3378 (2014).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. Journal of Neuroscience Methods. 129 (1), 73-79 (2003).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Critical Reviews in Biotechnology. 37 (2), 163-176 (2017).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain. Journal of Neuroscience Methods. 203 (1), 10-18 (2012).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Turko, P., Groberman, K., Browa, F., Cobb, S., Vida, I. Differential Dependence of GABAergic and Glutamatergic Neurons on Glia for the Establishment of Synaptic Transmission. Cerebral Cortex. , (2018).
- Uematsu, M., et al. Quantitative chemical composition of cortical gabaergic neurons revealed in transgenic venus-expressing rats. Cerebral Cortex. 18, 315-330 (2008).
- Goebbels, S., Bormuth, I., Bode, U., Hermanson, O., Schwab, M. H., Nave, K. -. A. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44, 611-621 (2006).
- Banker, G. A. Trophic interactions between astroglial cells and hippocampal neurons in culture. Science. 209, 809-810 (1980).
- Lindsay, R. M. Adult rat brain astrocytes support survival of both NGF-dependent and NGF-insensitive neurones. Nature. 282 (5734), 80-82 (1979).
- Geissler, M., et al. Primary hippocampal neurons, which lack four crucial extracellular matrix molecules, display abnormalities of synaptic structure and function and severe deficits in perineuronal net formation. Journal of Neuroscience. 33 (18), 7742-7755 (2013).
- Wang, Y., et al. Fluorescent labeling of both gabaergicand glycinergic neurons in vesicular GABA transporter (VGAT)-venus transgenic mouse. Neuroscience. 164 (3), 1031-1043 (2009).
- Höltje, M., et al. Role of Rho gtpasein astrocyte morphology and migratory response during in vitro wound healing. Journal of Neurochemistry. 95 (5), 1237-1248 (2005).
- Booker, S. A., Song, J., Vida, I. Whole-cell Patch-clamp Recordings from Morphologically- and Neurochemically-identified Hippocampal Interneurons. Journal of Visualized Experiments. , e51706 (2014).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277 (5332), 1684-1687 (1997).
- Ullian, E. M., Sapperstein, S. K., Christopherson, K. S., Barres, B. A. Control of synapse number by glia. Science. 291, 657-661 (2001).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120, 421-433 (2005).
- Berghuis, P., et al. Brain-derived neurotrophic factor controls functional differentiation and microcircuit formation of selectively isolated fast-spiking gabaergic interneurons. European Journal of Neuroscience. 20 (5), 1290-1306 (2004).
- Liddelow, S. A., et al. Activated microglia induce neurotoxic reactive astrocytes via Il-1α, tnfα, and c1q. Nature. 541, 481-487 (2017).
- Tomlinson, M. J., Tomlinson, S., Yang, X. B., Kirkham, J. Cell separation: Terminology and practical considerations. Journal of Tissue Engineering. 4, (2013).
- Brewer, G. J., Torricelli, J. R., Evege, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. Journal of Neuroscience Research. 35 (5), 567-576 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유