Method Article
셀 기반 비 코딩 RNAs 특히 mRNA 번역을 향상 시킬 수 있는 SINEUP의 분석 실험
요약
SINEUPs는 합성 센스 비 코딩 RNAs는 바인딩 도메인 (BD)와 이펙터 도메인 (ED)를 포함 하 고 최대 조절의 번역 대상 mRNA. 여기, 우리 교양된 셀 라인, 서양 오 점 및 이미징 시스템 반자동된 높은 처리량의 번역 홍보 활동의 분석에 SINEUPs에 대 한 검색 방법을 설명 합니다.
초록
타겟 단백질 향상 뿐만 아니라 생물학 과정의 연구 뿐만 아니라 치료 및 바이오 응용 프로그램에 대 한 중요성 이다. 여기, 우리는 선택적으로 최대-규제 경작된 한 세포에 원하는 유전자의 단백질 표정 합성 antisense 비 코딩 RNAs 이라고 SINEUPs에 의하여 방법 제시. 유전자 발현의 긍정적인이 컨트롤은 post-transcriptional 수준 하 고 거꾸로 짧은 산재 핵 요소 (사인) SINEUPs의 3ʹ 끝에 반복에 의해 발휘 하는 이펙터 도메인 (ED) 구성. SINEUPs는 그것의 바인딩 도메인 (BD), 지역 5ʹ 않은 영역 (5ʹ UTR) 순서는 mRNA의 시작 codon 주위를 보완 하기 위해 설계를 통해 선택의 어떤 단백질 코딩 mRNA에 구체적으로 바인딩할 수 있습니다. 이 방식으로 설계 특정 대상 SINEUPs 경작된 한 세포에 페는 고 단백질 및 RNA 다운스트림 분석, 일반적으로 24-48 h 후 transfection 추출 됩니다. SINEUP 유도 단백질 업 레 귤 레이 션 서쪽 오 점 분석에 의해 감지 되 고 RNA 식 양이 많은 반전 녹음 방송 실시간 PCR를 사용 하 여 측정 된다. 우리는 BD 디자인은 최적의 SINEUP 활동과 테스트 다른 BD 크기와 mRNA 권장 대상의 시작 codon에 관하여 위치를 달성 하기 위한 중요 한 관찰. 따라서, 우리는 여기 대상 mRNA 융합 녹색 형광 단백질 (GFP)를 구현할 수 있는 형광 검출에 따라 반자동된 높은 처리량 이미징 방법 설명. SINEUPs 특히 대상 성적 수준을 변경 하지 않고 셀의 정상 생리 적 범위 내에서 번역을 향상 시킵니다. 이 메서드는 성공적으로 다양 한 인간, 마우스, 그리고 vivo에서 시스템과 함께 곤충 세포 선에서 내 인 성 및 외 인 대상의 범위에 대 한 고용. 또한, SINEUPs 항 체 생산을 증가 하는 RNA haploinsufficient 유전자에 대 한 치료로 작동 보고 되었습니다. SINEUPs의 다양 하 고 모듈형 자연 유전자 특정 변환 제어에 대 한 적합 한 도구를 만드는 그들.
서문
포스트 게놈 시대에 많은 통찰력 차세대 시퀀싱 기술1,2,3 의 발전으로 인하여 센스 성적 비 코딩 유전자 규제 역할에 얻은 되었습니다 및 진 편집 도구입니다. 이전 "transcriptional" 휴지통으로 간주 되었다, 성적,이 범주 유전자 규칙의 핵심 선수로 지금 설정 됩니다. 센스 성적 변조 chromatin 및 제어 안정성과 그들의 동족 단백질 코딩 감각 mRNA4,5의 표현 하는 것 보고 됩니다. 대부분의 경우, 규제의이 모드는 네거티브 하 고 센스 성적 침묵 RNA RNA 상호 작용6,7감각 들. 자연 센스 성적표의이 특성은 합성 작은 간섭 RNA (siRNA), 예측에 관한 (미르), 그리고 센스 oligos (아소)8,9,10의 형태로 downregulate 원하는 유전자에 이용 되어 ,11 에 대 한 기술 무효를 떠나 타겟 유전자를 레 귤 레이 션.
오래 비 코딩 RNAs는 antisense로 센스 RNA 분야의 관점을 변경 하는 하나의 흥미로운 연구 (lncRNAs)로 유전자 Uchl1 (L1 유비퀴틴 C 터미널 가수분해 효소)와 Uxt (대 본 편 표현)의 긍정적으로 그들의 동계어의 번역을 통제 쥐12post-transcriptional 수준에서 mRNA를 감지. 이러한 5ʹ 끝 lncRNAs 그들의 해당 감각 성적표의 5ʹ 않은 영역 (5ʹ UTR)에 여러 기지와 겹치거나 겹치지 3ʹ 끝 포함 짧은에 속하는 retrotransposon의 거꾸로 반복 하 산재 핵 요소 (사인) 가족입니다. 흥미롭게도, 우리는이 변환 업 레 귤 레이 션의 뒤에 주요 원동력 이며 임베디드 사인 반복 사인만 반복 하는 마우스에 국한 되지 않습니다 발견. 반복 포함 하는 인간의 알루미늄 lncRNAs는 또한 대상 감각 mRNAs의 번역을 향상 사인 기반 규제 antisense 비 코딩 RNAs의 소설 클래스의 아이디어를 강화 적절 하 게 선정 SINEUPs13. 최근 학문은 보여주었다 자연 SINEUPs의 잠재력 유지 되는 구체적으로 목표를 설계 합성 SINEUPs에서 다양 한 내 인 성 및 외 인 유전자14,15. SINEUPs 두 가지 중요 한 기능을가지고: 첫 번째 "바인딩 도메인" (BD)는 일반적으로 기본을 포괄 하는 시퀀스를 보완 5ʹ 끝 지역 시작 단백질 코딩 mRNA의 코 돈 그리고 두 번째 "이펙터 도메인" (ED) 통합으로 거꾸로 반복 사인 SINEUP 함수14 (그림 1)에 대 한 전제 조건입니다. SINEUPs 특히 선택의 유전자를 대상으로 BD를 디자인 하는 사용자 지정할 수 있습니다. 이 다음 기존의 mRNA overexpression 전략에 더 나은 대 안으로 생물학 통로에 관련 된 특정 유전자의 기능 해 부 밝혀 수 있습니다. 또한,이 다재 다능 한 도구 항 체 생산에 적용할 수 있는 고 기능성 단백질16,,1718, 부족 한 복용량으로 인 한 haploinsufficient 질병을 치료 하는 약물으로 19,,2021.
SINEUP 기술의 장점을 매니폴드 있습니다. 그것은 transcriptional 수준에서 대상의 식은 변경 되지 않습니다. 더 이상 BDs 하지 dsRNA 종속 스트레스 응답15을 유도 하는 동안 SINEUPs에 더 특이성을 제공 합니다. 단백질 유도 탈 선 또는 과도 한 단백질 식 때문에 어떤 해로운 효과 방지, 세포의 정상적인 생리 적 범위 내에서 유지 됩니다. SINEUPs는 다양 한 인간, 마우스와 호환 및 햄스터 교양 셀 라인, 예를 들어, HEK293T/17, HepG2, 헬러, 조, MN9D, 그리고 많은 더 많은12,13,,1415,18 ,19. SINEUPs 내 생 유전자, 뚜렷이 overexpressed 유전자 및 플래그 태그 또는 luciferase 융합 유전자, 유전자 특정 항 체14,18의 필요 대상 효율적으로 수 있습니다. 일상적인 세포 배양, transfection, 나트륨 라우릴 황산 polyacrylamide 젤 전기 영동 (SDS-PAGE), 실시간으로 양적 역 전사-중 합 효소 연쇄 반응 (qRT-PCR) 악기 및 설정, 기본 SINEUP 분석 필요 하 고 전문 지식은 짧은 시간에 주어질 수 있습니다.
여기, 우리는 유전자 합성 SINEUPs 최대 규제 번역, RNA 간섭9 와 아소 gapmers11,,2223같은 다른 기술과 달리 효과를 대상으로 하는 방법을 설명 합니다. RNA 유도 한 유전자 활성화에 대 한 널리 사용 방법은 클러스터 정기적으로 interspaced 짧은 구조 반복 기반 활성화 (CRISPRa), 유전자 발현 transcriptional 레벨24에서 실행 됩니다. 이 방법은, 비록 간단 하 고 빠르고, 여러 단일 가이드 RNAs를 (sgRNAs) 더 높은 효율을 위한 동일한 유전자를 대상으로 오프 대상 바인딩25의 기회 증가 필요 합니다. 또한, CRISPRa 시스템의 주요 효소, 촉매로 죽은 CRISPR 관련 단백질 9 (dCas9)는 낮은 바인딩 특이성 및 sgRNAs 타겟팅 양방향 발기인 지구 수 비 특히 최대-조절 유전자25근처. 반대로, SINEUPs 높은 특이성을 가진 단일 바인딩 지역에 mRNA를 대상 바인딩할 하 고 가까운 유전자의 표현에는 영향을 미치지 않습니다. 우리는 SINEUP 디자인, transfection, 단백질 및 RNA 식 분석에 관련 된 기본 단계를 설명. 또한, 반자동, 높은 처리량 이미징 시스템 여러 SINEUPs를 한 번에 화면에 최적의 SINEUPs의 검색을 위한 유용한 선물이.
프로토콜
1. BDs SINEUP 생성 대상 mRNAs의 디자인
- 녹음 시작 사이트 (TSS)와 관심의 셀에 대상 mRNAs의 번역 시작 사이트를 확인 하십시오. TSS 데이터 인코딩 및 FANTOM 프로젝트 (유전자 발현, 케이지의 모자 분석)에서 (ZENBU: http://fantom.gsc.riken.jp/zenbu/).
- 브라우저를 열고, 관심사의 유전자 검색 및 케이지 봉우리로 TSS를 확인.
- 세포 및 조직 특정 TSS의 파 킨 슨 병 질환 단백질의 7 (PARK7) 예제 분석을 참조 하십시오 그림 2에 표시 된 mRNA.
- 디자인의 40에 해당 하는 여러 다른 길이 BD 시퀀스 기초 업스트림 및 32 기지 하류 첫 번째 메티오닌 (8 월), 72의 총에서 nt.
- 사용자 정의 주문 설계 BDs SINEUP 식 벡터 ( 재료의 표참조).
참고: 기본 로컬 정렬 검색 도구 (폭발)을 피하기 위해 오프 대상 효과26여 순서 특이성을 확인 하십시오.
2. 세포 문화 및 SINEUP Transfection
- 6 잘 플레이트 또는 SINEUPs의 transfection 전에 24 h 24 잘 판에 관심 종자 세포. 인간 미 발달 신장 세포 선 (HEK293T/17)의 경우는 폴 리-D-리 코팅된 24 잘-플레이트의 당 6 잘 플레이트 또는 1.5 x 105 셀의 당 ( 재료의 표참조), 씨앗 0.5 x 106 셀 ( 재료의 표참조). 그것은 24 시간 후 70% 합칠 된다.
- 24 시간 후 6 잘 플레이트에 대 한 신선한 매체의 1.5 mL 또는 0.4 mL 24 잘 판에 대 한 신선한 매체의 매체를 변경 합니다. SINEUP-GFP 경우 transfect pEGFP C2의 0.6 µ g ( 재료의 표참조)와 SINEUP-pEGFP-c 2의 6 잘 플레이트 또는 130 ng와 670의 한 잘에 GFP의 3.4 µ g transfection 시 약 (10 µ L 6 잘 플레이트와 3 µ에 24 잘 플레이트의 한 잘에서 SINEUP GFP의 ng 24 잘 판에 L) 제조업체의 지침에 따라 ( 재료의 표참조), 그리고 24 시간 5 %CO2 인큐베이터에서 37 ° C에서 품 어.
- 6 잘 플레이트의 각 음에 인산 염 버퍼 염 분 (PBS) (37 mM NaCl, 8 m Na2HPO4 m, 2.6 m m KCl와 1.5 m m KH2포4)의 2 개 mL 또는 0.5 mL PBS 24 잘 플레이트의 각 우물에서의 세포를 씻어. 폴 리-D-리 코팅된 24 잘 판에 볼륨 Trypsin 당 0.05% 무게의 25 µ L을 추가 하 고 5 분 동안 5% CO2 배양 기에서 품 어 잘 당 셀 매체의 275 µ L을 추가. 6 잘 플레이트의 경우 각 잘에서 PBS의 2 개 mL를 추가 합니다. 위쪽 및 아래쪽 셀 (1.5 mL 6 잘 플레이트에 대 한) 또는 225 µ L 24 잘-접시 잘 단백질 추출 (단백질 추출에 대 한 프로토콜 3으로 이동)에 대 한 1에서 3/4 및 1/4 셀 (0.5 mL 6 잘 플레이트에 대 한) 또는 24 잘 접시 75 µ L의 수확을 피펫으로 RNA 추출 및 4 ° C (RNA 추출 단계 5로 이동)에서 5 분 동안 6000 x g에서 원심 분리기
참고: 영상에 의해 폴 리-D-리 코팅 24 잘-접시에서 SINEUP GFP의 효과 분석 합니다. 단계 7 (이미징 분석)로 이동 합니다.
3. 단백질 추출
- 신중 하 게 1.5 mL PBS의 발음 하 고 세포 솔루션 (20 mM Tris HCl (pH 7.5), 150 m m NaCl, 1 mM 나2EDTA, 1mm EGTA, 1% (w/v) 트리톤, 2.5 m m 나트륨 파이 인산, 1 m m β-glycerophosphate, 1 mM 나3보4 의 140 µ L을 추가 1 μ g/mL leupeptin, 및 0.005% (w/v) phenylmethylsulfonyl 불 (PMSF)) ( 재료의 표참조) 셀 펠 릿에 24 잘 접시 6 잘 플레이트 또는 60 µ L에 대 한.
- Pipetting으로 믹스 하 고 4 ° c.에 1 시간에 대 한 느린 속도로 회전 하 여 철저 하 게 혼합 4 ° c.에서 10 분 동안 14000 x g 에서 원심 분리 하 여 상쾌한 수집
-
단백질 농도 색도계 분석 실험에 의해 확인 (재료의 표 참조). 실 온에서 모든 반응 준비.
- 소 혈 청 알 부 민 (BSA) 단백질 초순에 표준의 5-6 배 희석 농도 0.2-1.5에서까지 준비 mg/mL 단백질. 신선한 표준 각 시간 준비.
- 20 µ L 시 S의 (계면 활성 제 솔루션)와 함께 작업 시 Aʹ 시 약 (알칼리 성 구리 주석산 솔루션)의 1 mL를 혼합 하 여 준비 합니다.
- 물 (부정적인 제어), BSA 표준 (단백질 표준 및 긍정적인 제어) 또는 96 잘 접시의 각 음에 단백질 샘플의 5 µ L을 로드 합니다.
- 각 잘에서 시 Aʹ의 25 µ L를 추가 합니다. 신중 하 게 잘 피하 어떤 거품 형성 당 200 µ L의 시 B (Folin 시 약)을 추가 합니다. 커버 알루미늄 호 일로 접시를 5-10 분을 기다립니다.
- 750에서 단백질 흡 광도 측정 한 분 광 광도 계 nm. 흡수도 적어도 1 시간에 대 한 안정적입니다.
- 플로팅 BSA 표준 단백질 농도 (mg/mL) x 축과 y 축에 그들의 각각 흡 광도에 의해 표준 곡선을 준비 합니다. 표준 곡선 방정식을 적용 하 여 샘플 단백질 농도 계산 합니다.
참고: 필요한 경우이 단계에서 프로토콜을 일시 중지 하거나 4 단계로 이동 합니다. 장기 저장을 위한 스냅 액체 질소와-80 ° c.에 게 단백질 샘플을 동결
4. SDS 페이지와 항 체 (서양 오 점 분석)와 대상 단백질의 검출 단백질 분리
- 염료를 로드 x 2의 볼륨을 추가 (0.1 M Tris-HCl (pH 6.8), 4 %SDS, 20% 글리세롤, 1.42 %2-mercaptethanol 및 0.2 %bromophenol 블루) 단계 3.3에서에서 단백질 샘플의 각 볼륨을. 5 분 동안 90 ° C에가 열 하 고 즉시 1 분 동안 얼음에 냉각 하십시오.
- 10-20 µ g 단백질 10 %SDS 폴 리 아크릴 아 미드 젤 샘플의 로드 및 100-150 V에서 분리) ( 재료의 표참조).
- 젤에서 0.45 μ m 니트로 막 단백질을 전송 ( 재료의 표참조) 30 분에 대 한 전송 버퍼 (25mm Tris, 192 m m 글리신과 20% 메탄올) 25 V 세미 드라이 전송 악기에 의해.
- 추가 차단 솔루션 (1 x TBST 버퍼에 5% 비 지방 건조 우유 (137 m m NaCl, 20 mM Tris HCl (pH 7.6), 0.1% 트윈-20)) ( 재료의 표참조) 막까지 컨테이너를 완전히 젖 었 고 30 분 동안 실내 온도에 그것을 품 어.
- SINEUP-GFP의 경우 교배 안티 GFP 항 체 (솔루션을 차단에 희석된 1: 2000)와 단백질 ( 재료의 표참조) 실 온에서 떨고와 30 분 막 잠복기에 의해. 내부 통제 단백질으로 안티-β-말라 항 체 (솔루션을 차단에 희석된 1: 2000)와 함께 교배 시키기 의해 β-말라 단백질 검출 ( 재료의 표참조) 실 온에서 떨고와 30 분.
- 막이 실 온에서 완전히 젖 고 세척에 대 일 분까지 1 x TBST 버퍼 컨테이너에 추가 합니다. (총 세 세척) 번 더 세척 단계 2를 반복 합니다.
- GFP 단백질 솔루션을 차단에 희석된 (1:1000) 하 교배 안티 토끼 항 체 양 고추냉이 과산화 효소 (HRP)로 활용 하 고 교배를 β-말라 단백질 희석 (차단 솔루션 1:1000) 반대로 마우스 항 체 막에 HRP와 활용 실 온에서 떨고와 30 분에 대 한
- 실 온에서 5 분 동안 1 x TBST 버퍼와 막 씻으십시오. (총 세 세척) 번 더 세척 단계 2를 반복 합니다.
- HRP 강화 된 화학 (ECL) 검출 시 약 1과 2 ( 재료의 표참조)의 동일한 볼륨을 믹스. 막 2 mL ECL 시 혼합 전송, 알루미늄 호 일 상자를 커버 하 고 실 온에서 1-2 분 동안 품 어 보자. 조심 스럽게 ECL 시 믹스에서 멤브레인을 제거 하 고 악기를 이미징 발광을 사용 하 여 노출.
5. RNA 추출 및 DNase 치료
- 추출 총 RNA 다음 표준 단층27 에서 성장 하는 세포에서 RNA 추출에 대 한 프로토콜 또는 양자 택일로 사용 하는 상용 RNA 추출 키트 ( 재료의 표참조). 간단히 상태로, 어떤 monophasic 세포 시 약 (미르) guanidine isothiocyanate를 추가 하 고 수확 셀에 페 놀 단계 2.3 (1 mL 당 ~ 5 백만 셀 미르)27.
참고: 글러브를 자주 변경 합니다. RNase 무료 시 약을 사용 하 여 diethylpyrocarbonate (DEPC)-플라스틱 도자기 및 유리 RNA 저하를 방지 하기 위해 치료. 필요한 경우이 단계에서 프로토콜을 일시 중지 합니다. 스토어-80 ° c.에서 RNA 추출 - 단계 ( 재료의 표참조) 5.1에서에서 정화 RNA에 DNase 버퍼 x 10과 DNase의 U 2의 0.1 볼륨을 추가 합니다.
- Nuclease 무료 물으로 50 µ L를 반응 볼륨을 설정 하 고 부드럽게 혼합. 30 분 동안 37 ° C에서 품 어.
- 다시 일시 중단된 DNase 비활성화 시 약의 0.1 볼륨을 추가 하 고 잘 혼합 ( 재료의 표참조). 부드러운 진동으로 실 온에서 5 분 동안 품 어.
- 원심에서 10000 x g 90 미 전송에 대 한 신선한 RNase 무료 1.5 mL 튜브에 상쾌한 (RNA DNA 무료). 다운스트림 단계 곤란 DNase의 수행을 일으킬 수 있으므로 펠 릿을 건드리지 않도록 주의 해야 합니다.
- 260 와260/A280 비율을 측정 하 여 RNA를 quantitate (순수 RNA에 대 한 범위는 1.8-2.0) UV 분 광 광도 계에.
6. 첫번째 물가 cDNA 합성 및 qRT-PCR 분석
-
첫번째 물가 cDNA 합성 (재료의 표 참조) 아래와 표준 cDNA 합성 프로토콜을 다음을 수행 합니다.
- 총 반응 볼륨의 10 µ L에서 0.75 µ M 올리고 dT 뇌관, 4.3 µ M 무작위 뇌관, dNTPs (각 10 mM) (단계 5-8)에서 200-500 ng 총 RNA와 믹스. 5 분 동안 65 ° C에서 품 어와 다음 즉시 얼음에 넣어.
- 1 x 역전사 버퍼, 1 U의 RNase 억제제, 역전사의 U 10 혼합 하 고 6.1.1에서 RNA 뇌관 믹스 10 µ L에 추가.
- 필요한 경우 총 반응 볼륨 nuclease 무료 물 20 µ L을 설정 합니다. 부드럽게 믹스 하 고 다음 60 분, 42 ° C에서 10 분, 30 ° C에서 반응 혼합 품 어 그리고 마지막으로 효소를 비활성화를 5 분 동안 95 ° C에서. 차가운 얼음에 튜브.
참고: RNA 샘플 및 얼음에 모든 시 약 thaw 고 준비 얼음에 반응 혼합. 대상 RNAs polyA RNAs만 있다면 올리고 dT 프라이 머만 (2.5 µ M)를 사용 합니다. 필요한 경우 프로토콜을 일시 중지 합니다. -20 ° c.에 합성된 cDNA를 저장
- QRT-PCR을 수행 하는 기술 triplicates에서 (n = 3, Cт 표준 편차 > 0.2) 생물 복제 (n ≥ 3) 내 10 ng cDNA의 1 µ L, 역방향 뇌관 (10 µ M), 앞으로 뇌관 (10 µ M), DNA 중 합 효소의 혼합 솔루션의 10 µ L의 0.4 µ L의 0.4 µ L를 사용 하 여 염료, nuclease 무료 물 10 µ L를 얼룩이 지는 이중 가닥 DNA의 0.4 µ L (반응 볼륨은 20 µ L) 조건; 다음 사용 하 여 PCR 제품을 감지 하 30 단계 (1 사이클)을 잡고 95 ° C, 5 단계 (40 주기) 순환에서 s s 95 ° c와 30에 대 한 s 60 ° C에서 녹여 곡선 무대. 뇌관 예 인간의 Gapdh_Fw 위한 것입니다: TCTCTGCTCCTCCTGTTC, 인간 Gapdh_Rv: GCCCAATACGACCAAATCC, EGFP_Fw: GCCCGACAACCACTACCTGAG, EGFP_Rv: CGGCGGTCACGAACTCCAG, SINEUP-GFP_Fw: CTGGTGTGTATTATCTCTTATG와 SINEUP-GFP_Rv: CTCCCGAGTCTCTGTAGC. 자료의 표를 참조 하십시오. 2-∆∆Ct ± SD 메서드28와 양적 RNA 식 분석.
7. 영상 분석 반 자동화 된 탐지 방법으로 SINEUPs의
- 24 잘 접시의 한 우물에 대 한 PBS의 0.5 mL로 세포 세척.
- Hoechst 33342 ( 재료의 표참조)의 2.0 μ g 추가 (PBS의 500 μ에 용 해) 각 24-잘-판의 고 세포는 핵 얼룩을 20 분 동안 37 ° C에서 품 어.
- 측정 Hoechst 스테인드 461 nm, 파란 방출 최대 및 녹색 방출 최대 510에 GFP 긍정적인 세포의 수를 계산 하는 녹색 형광의 강도에 셀의 총 수를 계산 하는 셀 nm 높은 처리량 마이크로-잘 이미지 cytometer (를 사용 하 여 재료의 표참조). GFP 통합 강도, 이미징 소프트웨어29를 사용 하 여 각 채널에 대 한 계산 세그먼트 개체에서 신호를 표시 하는 모든 픽셀 농도의 합을 계산 하 여 단백질은 SINEUPs의 업 규제 효과 분석 합니다.
- RNA 식 (다시 단계 5와 6 단계)을 확인 하는 세포를 수확.
결과
SINEUP-GFP는 모두 최적의 BD를 포함 하는 합성 SINEUP (-28 + 4 GFP mRNA에 중복 /)는에 드 (거꾸로 AS-Uchl1에서 사인 B2)를 통제할 수 있다 최대-GFP mRNA 번역 (그림 3A 와 3B) GFP의 표현을 변경 하지 않고 (그림 3C 와 3D) mRNA. 최적의 BDs 및 SINEUPs에 대 한 EDs 화면, 우리 감지 시간을 개선 하 고 기존의 서양 오 점 분석15에 비해 동시에 상영 되는 샘플 수를 증가 하는 반자동된 이미지 분석 프로토콜을 개발 했다. 그림 4에서 같이,이 높은 처리량 이미징 시스템 (서양 오 점 분석 48 SINEUPs에 대 한 2 주를 했다)는 3 일을 했다. 우리 이미지 cytometer GFP 통합 강도 검색 데 시연 SINEUP GFP GFP 번역 증가. 최적의 BD의 SINEUP-GFP GFP 단백질 표정에 1.4-fold 증가 유도 한다. 비록 우리가 2.6-fold에서 신호의 압축을 관찰 (서양 오 점 분석 그림 3A참조)를 1.4-fold (이미징 분석 그림 5참조), 차이 이미징 악기 소프트웨어 보정 때문일 수도 있습니다. 그럼에도 불구 하 고, 우리는 컨트롤 (그림 5A 와 5B)와 비교 하는 GFP 형광의 상당히 높은 수준의 감지.
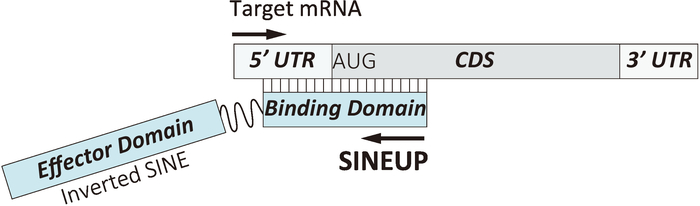
그림 1: 합성 SINEUPs의 기본적인 디자인. BD를 mRNA에 드를 대상 바인딩 도메인 = = 거꾸로 사인 시퀀스가 포함 된 이펙터 도메인. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: 녹음 방송 시작 위치 (TSSs) 인간의 파 킨 슨 질병 단백질 7 (PARK7)의 특정 조직에 셀 케이지 분석에 의해 감지 mRNA. (A) A 스냅샷 omics 데이터 통합 및 인터랙티브 시각화 시스템30을 사용 하 여 인간 PARK7 mRNA에 대 한 TSS 검색 결과 보여주는. Genomic 위치를 표시 하는 기념물과 유전자 hg19 트랙에서 수평 녹색 화살표 참조의 인간 PARK7 mRNA와 FANTOM5 케이지 1과 2 트랙에 세로 녹색 막대 표시 TSSs의 합계 (당 성적으로 측정 백만 (tpm))에서 조직 및 세포의 1,829 종류입니다. (B) 패널 A에서에서 TSS의 표시 된 영역의 확대 (1/354 규모: 35.4 kb 100 bp). 회색 영역을 음영 처리 된 FANTOM5 케이지 단계 1 및 2 트랙 나타냅니다 그림의 맨 아래에 나열 된 총 1,829에서 6 특정 셀의 TSS에. 당 성적표를 나타냅니다 (11.369, 4.998, 4.304, 3.509, 3.477, 및 3.055)이 나열 된 셀에 해당 하는 숫자는 TSS의 위치를 음영 회색에 각 특정 셀에 대 한 백만. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 서쪽 오 점 분석 SINEUP GFP에 의해 번역의 위로 규칙 확인. (A) SINEUP-GFP 안티 GFP 항 체로 서 오에 의해 시험 되었다. (B) 결과 β-말라 단백질 밴드의 강도를 정상화 했다. (C) GFP mRNA 및 (D) SINEUP RNAs 식 qRT-PCR에 의해 감지 되었다. p < 0.0005, n = 3, 양측 스튜던트 t-검정, 오차 막대는 표준 편차. 이 그림에서 다카하시 수정 되었습니다 외.15. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: SINEUP 반자동된 이미지 분석의 도식. 24 잘 판에 대 한 관심의 제 1 일: 종자 세포. 제 2 일: Transfect GFP와 SINEUP GFP. 제 3 일: 통합 GFP 강도 측정 하 여 SINEUPs의 효과 분석 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
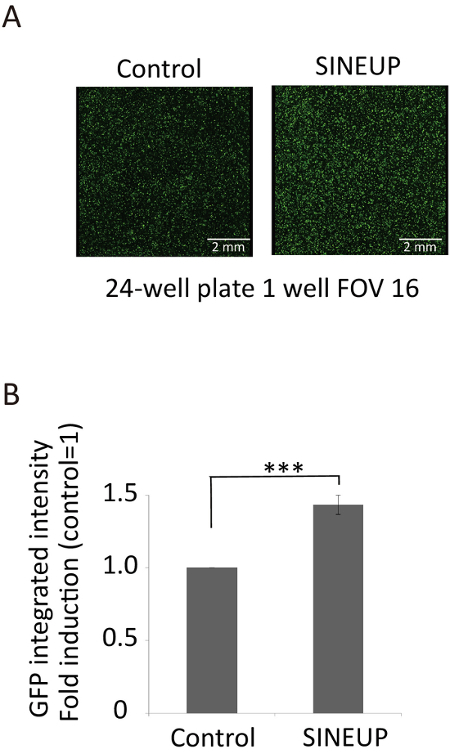
그림 5: SINEUP GFP에 의해 번역 업 규제의 높은 처리량 분석. (A) 제어 및 SINEUP-GFP transfected 세포15사이 GFP 형광의 비교. 눈금 막대 = 2 m m. (B) GFP 통합된 강도 Hoechst 33342와 핵 얼룩 계산 총 셀 수 정규화 되었는지. p < 0.0005, n = 3, 양측 스튜던트 t-검정, 오차 막대는 표준 편차. FOV: 필드의 보기입니다. 이 그림에서 다카하시 수정 되었습니다 외.15. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
우리 여기서 특별히 단백질 생산을 향상 시키기 위해 프로토콜 설명 SINEUPs 라는 비 코딩 RNA를 mRNA로 사인 포함의 의미는 대상의. 대표적인 예로, 최적 합성 SINEUP GFP 최대 조절 2.6-fold로 서쪽 오 점 분석에 의해 측정 된 GFP mRNA의 번역에 표시 됩니다.
최적의 BD를 설계 하는 것은 SINEUP 특이성 및 힘 (단백질 업 레 귤 레이 션의 정도) 중요 합니다. 이전, 우리는 서쪽 오 점 분석15 17 BDs의 SINEUP-GFP를 상영 하 고 최적의 BD에 GFP mRNA의 AUG KOZAK 시퀀스 겹치는 경우 다른 mRNAs와 되지 않을 수 있습니다 그리고 각 경우에 대 한 확인 해야 합니다 발견. 또 다른 독립적인 그룹은 또한31다른 메서드 사용 하 여 BD를 상영. 많은 BDs 심사 꽤 어렵고 복잡 수 있습니다, 우리는 높은 처리량 SINEUP 탐지 방법은 여기 소개. 이 방법은 SINEUP transfected 세포 제어 벡터 transfected 세포에 비해에 GFP 통합 밀도 상대적 변화를 측정 합니다. 되도록 셀 문화 접시의 특정 음에 동등 하 게 페 GFP 신호는 잘만 특정 지역에 집중 하지 않습니다, 그것은 매우 셀 단계 2.1에서에서 우물에 동등 하 게 배포 하는 것이 중요. 이 위해 부드럽게 클린 벤치 안에 셀 시드 후 플레이트와 10 번 (↑↓)를 흔들어 하 고는 부 화를 시작 하기 전에 5% CO2 배양 기에서 반복 합니다.
또 다른 중요 한 단계는 단계 3.3에서에서 단백질 농도의 계산 이다. 여기 miscalculations 서쪽 오 점 분석, 결과적으로 일부 약한 SINEUPs 단백질 표정에서 작은 변화 탐지를 방지 또는 오버 로드에서 가양성을 생성 하는 동안 단백질의 잘못 된 금액의 로드 될 수 있습니다. 같은 양의 표준 및 단백질 샘플 단계 3.3.3에서에서 측정 됩니다 확인 하 고 갓 준비 단백질 표준 곡선 때마다, 추천 된다. 프로토콜 여기 SINEUP GFP에 초점을 맞추고 설명 하지만 서양 오 점 분석에 대 한 사용할 수 있습니다 mRNA 관심의 대상. 보육 시간 및 항 체의 농도 최상의 결과 얻으려면 각 대상에 대 한 최적화 되어야 합니다.
SINEUPs의 독특한 특징 중 하나는 대상 mRNA 식 수준 영향을 받지 남아입니다. QRT-PCR에 의해 transfected SINEUPs 및 genomic DNA의 탐지를 피하기 위하여 DNase와 RNA를 치료에 중요 하다. SINEUP RNAs 및 대상 mRNA 표정 transfection 그리고 SINEUP 활동의 성공 확인 qRT-PCR에 의해 측정 되어야 한다. 모두 인간을 통해 풍부한 사인 시퀀스를 포함 하는 SINEUPs 및 마우스 게놈. 사인 시퀀스의 일반적인 탐지를 피하기 위해, 그것은 사인 시퀀스를 qRT-PCR 뇌관 설계 권장 하지 않습니다.
이 프로토콜에서 우리 인간의 세포 라인을 사용 하지만 SINEUPs는 여러 종12,13,14,,1819셀 줄 수에 효능. 세포 배양과 transfection 조건으로 이들은 SINEUP 벡터의 transfection 효율을 유지 다른 세포에 따라 수정할 수 있습니다. 또한, RNA 추출, cDNA 합성 및 단백질 농도 검사의 대체 방법은 qRT-PCR 및 서양 오 점 분석을 위한 필요한 RNA와 단백질 품질을 보존 하는 그들은 그에, 사용할 수 있습니다. 특정 높은 처리량 마이크로-잘 cytometer는 전체 잘 걸쳐 GFP 형광의 탐지를 사용, 사용 하는 동안 비슷한 감지 범위와 다른 cytometers 사용된31일 수 있다. 그것은 그 세포의 transfection 배포는 잘 통해 동일한 경우 다음 그것은 필요가 없습니다 GFP 형광에 대 한 전체 잘 스캔 하는 것을 주의 될 것 이다: 절반 또는 잘의 영역의 1/4 SINEUP 효과 실험에 따라 분별 하기에 충분 한 수 있습니다 알 능력입니다.
배양된 세포에서 주어진된 mRNA를 표적으로 하는 여러 BDs의 동시 상영 높은 처리량 SINEUP 검색 프로토콜을 설정 할 수 있습니다. BD에 의해 최적의 대상으로 제어 하는 규칙은 여전히 중요 하다. 이러한 멀티 플렉스 시스템 심사 다른 유전자, 예를 들어 특정 신호 전달 경로에 관여 하는 여러 유전자를 대상으로 하는 데 유용에 대 한 많은 SINEUPs의 대규모 테스트에 대 한 수 있습니다. 또한, 효과적인 SINEUPs 여러 mRNAs를 대상으로 8 월 Kozak 지역 주변의 다른 SINEUP BDs를 설계에 대 한 검색 확장에 이용 될 수 있다 ( 그림 1참조), 공동 transfecting 전체 길이 대상 mRNAs (5ʹ UTR-CD-3ʹ UTR) GFP mRNA와 융합 찾기 위해 최적의 SINEUPs와 이후 테스트 BD 후보 생 mRNA에 대 한 경작된 한 세포에 vivo에서 모델 동물, 인간과 다른 동물과 식물 종의 생쥐에서 배양된 세포에서
이 검사 프로토콜은 매우 빠르다. 우리는 수정 및 세포를 수집 하지만 그냥 생활을 배치할 필요가 필요가 없습니다 세포 이미징 악기에 문화 접시. 우리는이 프로토콜을 사용할 높은 처리량 검열 최적의 BDs의 SINEUPs를 선택 하 고 서쪽 오 점 분석 하 여 잠재적인 후보자를 평가를 제안 합니다. 따라서, 최적의 BDs와 선택 된 후보 항 체 생산18,,1921증가에 적용할 수 있습니다. 현재, RNA 치료 분야는 극적으로 성장 하고있다. 예를 들어, siRNA, 아소, mRNA, 및 CRISPR RNA 치료, 널리 그들의 각각 목표9,32의 mRNA 표정 제어를 채택 된다. 이러한 맥락에서 SINEUPs 그들의 초기 단계에 있지만 지금까지 아무도 공부 SINEUPs 변경 대상 mRNAs의 표현. 또한, SINEUPs 편집 하지 않습니다 대상 mRNA, 그러나 최대만 규제 mRNA의 번역. 또한, haploinsufficiency에서 발생 하는 손실의 기능 질병 단백질 결핍17,332-fold 유도 달성 SINEUP 치료에 의해 대상 수 있습니다. 비록 오프 대상 효과 추가 공부 필요, SINEUPs 잠재적으로 그리고 구체적으로 대상 BD 보완 시퀀스와 단일, 표현 mRNA.
이 높은 처리량 프로토콜의 한계는 적합 하지 않습니다 vivo에서 마우스 모델에서 SINEUPs 화면 BDs를 프로토콜 조치는 GFP 강도 통합 되기 때문에입니다. SINEUPs는 자연 센스 lncRNAs post-transcriptionally는, 그들은 때 대상 mRNA는 세포 또는 조직 샘플에서 적용할 수 없습니다.
그럼에도 불구 하 고, SINEUPs 이득의 기능 연구, 항 체 생산을 강화 하 고 1.5-3.0-배 범위 내에서 부족 한 단백질의 표정까지 조절 하는 RNA 치료로 적용할 수 있습니다. 여기에 설명 된 방법을 대상 및 원하는 mRNA의 번역 SINEUP 유도 향상 감지 post-transcriptional 유전자 규칙을 위한 새로운 도구를 제공 하는 유용한 가이드를 제공 합니다.
공개
해당 저자 피에로 Carninci (EP2691522A4 및 JP2017169573A), 출원된 특허에 부여 된 특허 (US9353370B2) SINEUP 기술에 대 한 지적 재산권을 보유 하는 TransSINE 기술 주식 회사의 설립자 중 하나입니다.
감사의 말
이 연구의 일부 혁신적인 생물 의학에 대 한 기초 과학 및 플랫폼 기술 프로그램에 의해 지원 되었다, 17 0301014, 의료 연구 및 개발 (아메드), 생활의 RIKEN 센터 문 부 과학성에서 연구 그랜트에 대 한 일본 기관에서 과학 기술 고 RIKEN IMS에 문 부 과학성에서 연구 그랜트. 우리 생각-도발 토론을 위한 PC 실험실 및 SINEUP 네트워크 (SISSA, 동부 쪽 Piedmont 대학 및 RIKEN)의 회원을 감사합니다. 우리는 교정에 대 한 박사 매튜 발렌타인을 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Synthetic SINEUP | Cell Guidance Systems Ltd. in UK and K.K.DNAFORM in Japan | https://www.cellgs.com/items/sineupand8482.html and https://www.dnaform.jp/en/information/20130320 | Step 1.5 |
| HEK293T/17 | ATCC | ATCC CRL-11268 | Step 2.1 |
| Falcon Multiwell Plate For Cell Culture 6 well plate | Corning | 6902A01 | Step 2.1 |
| Corning BioCoat Poly-D-Lysine 24 well Plate | Corning | 08-774-124 | Step 2.1 |
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher Scientific | 11668027 | Step 2.2 |
| pEGFP-C2 | Clontech | #6083-1 | Step 2.2 |
| Cell Lysis Buffer (10x) | Cell Signaling Technology | #9803S | Step 3.1 This is pre-mixed cell lysis solution. |
| PMSF | Cell Signaling Technology | #8553S | Step 3.1 To complete cell lysis buffer, add 0.005% (w/v) PMSF to 1x cell lysis buffer. |
| DC protein assay kit II | BIO RAD | #5000112JA | Step 3.3 |
| 10% Mini-PROTEAN TGX Precast Protein Gels, 12-well, 20 µL | BIO RAD | #4561035 | Step 4.2 |
| Amersham Protran Premium NC 0.45 (150 mm×4 m) | Amasham | 10600013 | Step 4.3, This is a 0.45 µm nitrocellulose membrane. |
| Nonfat Dry Milk | Cell Signaling Technology | #9999S | Step 4.4 A component of the blocking solution. |
| GFP Tag Antibody | Thermo Fisher Scientific | A-6455 | Step 4.5 Lot number: 1495850, RRID: AB_221570 |
| Monoclonal Anti-β-Actin antibody produced in mouse | SIGMA | A5441 | Step 4.5 Lot number: 026M4780V, RRID: AB_476744 |
| Polyclonal Goat Anti Rabbit Immunoglobulins | Dako | P0448 | Step 4.5 This is secondary antibody conjugating with HRP for anti GFP antibody. Lot number: 20017525, RRID:AB_2617138 |
| Polyclonal Goat Anti mouse Immunoglobulins | Dako | P0447 | Step 4.5 This is secondary antibody conjugating with HRP for anti β-Actin antibody. Lot number: 20019698, RRID:AB_2617137 |
| ECL Western Blotting Detection Reagents | Amersham | RPN2109 | Step 4.9 |
| Maxwell Rapid Sample Concentrator (RSC) Instrument | Promega | AS4500 | Step 5.1 This is commercially available RNA exreaction instrument. |
| Maxwell RSC simplyRNA Cells Kit | Promega | AS1390 | Step 5.1 This is commercially available RNA exreaction kit. |
| TURBO DNA-free Kit | ambion | AM1907 | Step 5.2 and 5.4 The kit contains DNase, DNase buffer and inactivation reagent. |
| PrimeScrip 1st strand cDNA Synthesis Kit | TaKaRa | 6110A | Step 6.1 The kit contains reagents of first strand cDNA synthesis. |
| TB Green Premix Ex Taq II | TaKaRa | RR820A | Step 6.2 |
| Hoechst3342 | Thermo Fisher Scientific | H3570 | Step 7.2 |
| Celigo S | Nexcelom Bioscience | 200-BFFL-S | Step 7.3 This is a high throughput micro-well image cytometer. |
참고문헌
- Katayama, S., et al. Antisense transcription in the mammalian transcriptome. Science. 309 (5740), 1564-1566 (2005).
- Carninci, P., et al. The transcriptional landscape of the mammalian genome. Science. 309 (5740), 1559-1563 (2005).
- Hon, C. C., et al. An atlas of human long non-coding RNAs with accurate 5' ends. Nature. 543 (7644), 199-204 (2017).
- Tufarelli, C., et al. Transcription of antisense RNA leading to gene silencing and methylation as a novel cause of human genetic disease. Nature Genetics. 34 (2), 157-165 (2003).
- Yu, W., et al. Epigenetic silencing of tumour suppressor gene p15 by its antisense RNA. Nature. 451 (7175), 202-206 (2008).
- Carninci, P., Hayashizaki, Y. Noncoding RNA transcription beyond annotated genes. Current Opinion in Genetics & Development. 17 (2), 139-144 (2007).
- Chu, Y., Yue, X., Younger, S. T., Janowski, B. A., Corey, D. R. Involvement of argonaute proteins in gene silencing and activation by RNAs complementary to a non-coding transcript at the progesterone receptor promoter. Nucleic Acids Research. 38 (21), 7736-7748 (2010).
- Ha, M., Kim, V. N. Regulation of microRNA biogenesis. Nature Reviews Molecular Cell Biology. 15 (8), 509-524 (2014).
- Takahashi, H., Carninci, P. Widespread genome transcription: new possibilities for RNA therapies. Biochemical and Biophysical Research Communications. 452 (2), 294-301 (2014).
- Lam, J. K. W., Chow, M. Y. T., Zhang, Y., Leung, S. W. S. siRNA Versus miRNA as Therapeutics for Gene Silencing. Molecular Therapy-Nucleic Acids. 4, e252 (2015).
- Nishina, K., et al. DNA/RNA heteroduplex oligonucleotide for highly efficient gene silencing. Nature communications. 6, 7969 (2015).
- Carrieri, C., et al. Long non-coding antisense RNA controls Uchl1 translation through an embedded SINEB2 repeat. Nature. 491 (7424), 454-457 (2012).
- Schein, A., Zucchelli, S., Kauppinen, S., Gustincich, S., Carninci, P. Identification of antisense long noncoding RNAs that function as SINEUPs in human cells. Scientific Reports. 6, 33605 (2016).
- Zucchelli, S., et al. SINEUPs are modular antisense long non-coding RNAs that increase synthesis of target proteins in cells. Frontiers in Cellular Neuroscience. 9, 174 (2015).
- Takahashi, H., et al. Identification of functional features of synthetic SINEUPs, antisense lncRNAs that specifically enhance protein translation. PLOS ONE. 13 (2), e0183229 (2018).
- Deutschbauer, A. M., et al. Mechanisms of haploinsufficiency revealed by genome-wide profiling in yeast. Genetics. 169 (4), 1915-1925 (2005).
- Indrieri, A., et al. Synthetic long non-coding RNAs [SINEUPs] rescue defective gene expression in vivo. Scientific Reports. 6, 27315 (2016).
- Patrucco, L., et al. Engineering mammalian cell factories with SINEUP noncoding RNAs to improve translation of secreted proteins. Gene. , (2015).
- Sasso, E., et al. A long non-coding SINEUP RNA boosts semi-stable production of fully human monoclonal antibodies in HEK293E cells. MAbs. , 1-8 (2018).
- Dang, V. T., Kassahn, K. S., Marcos, A. E., Ragan, M. A. Identification of human haploinsufficient genes and their genomic proximity to segmental duplications. European Journal of Human Genetics. 16 (11), 1350-1357 (2008).
- Zucchelli, S., Patrucco, L., Persichetti, F., Gustincich, S., Cotella, D. Engineering Translation in Mammalian Cell Factories to Increase Protein Yield: The Unexpected Use of Long Non-Coding SINEUP RNAs. Computational and Struct Biotechnology Journal. 14, 404-410 (2016).
- Hua, Y., et al. Antisense correction of SMN2 splicing in the CNS rescues necrosis in a type III SMA mouse model. Genes & Development. 24 (15), 1634-1644 (2010).
- Watts, J. K., Corey, D. R. Silencing disease genes in the laboratory and the clinic. Journal of Pathology. 226 (2), 365-379 (2012).
- Perez-Pinera, P., et al. RNA-guided gene activation by CRISPR-Cas9-based transcription factors. Nature Methods. 10 (10), 973-976 (2013).
- Wu, X., et al. Genome-wide binding of the CRISPR endonuclease Cas9 in mammalian cells. Nature Biotechnology. 32 (7), 670-676 (2014).
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Liu, X., Harada, S. RNA isolation from mammalian samples. Current Protocols in Molecular Biology. , (2013).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Severin, J., et al. Interactive visualization and analysis of large-scale sequencing datasets using ZENBU. Nature Biotechnology. 32 (3), 217-219 (2014).
- Yao, Y., et al. RNAe: an effective method for targeted protein translation enhancement by artificial non-coding RNA with SINEB2 repeat. Nucleic Acids Research. 43 (9), e58 (2015).
- Savić, N., Schwank, G. Advances in therapeutic CRISPR/Cas9 genome editing. Translational Research. 168, 15-21 (2016).
- Long, H., et al. RNAe in a transgenic growth hormone mouse model shows potential for use in gene therapy. Biotechnology Letters. , (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유