Method Article
분석, 동적, 안정과 초기 Microtubules Zebrafish 태아에 있는 Immunolabeling의 사용
요약
Immunolabeling 방법 개발 zebrafish 두뇌에 microtubules의 명료한 인구를 분석 하는 다른 조직에 광범위 하 게 적용 되는 여기에, 설명 됩니다. 첫 번째 프로토콜 immunolabeling 안정적이 고 동적 microtubules에 대 한 최적화 된 방법을 설명합니다. 두 번째 프로토콜 이미지와 초기 microtubules 구체적으로 정량화 하는 방법을 제공 합니다.
초록
Microtubules (MTs)는 역동적이 고 연약한 구조는 이미지에 vivo에서, 특히 척 추가 있는 태아에에서 게 도전 하는. Immunolabeling 메서드는 zebrafish 태아의 개발 신경 관에서 MTs의 명백한 인구 분석 여기 설명 되어 있습니다. 신경 조직에 포커스를 실행 하는 동안이 방법론은 다른 조직에 광범위 하 게 적용 됩니다. 그러나 절차는 일찍 중반 somitogenesis 단계 배아 (1 somite 12 somites에), 그들은 수 다른 단계 비교적 사소한 조정의 범위에 적응을 위해 최적화 됩니다. 첫 번째 프로토콜에는 안정적이 고 동적 MTs의 공간적 분포를 평가 하 고 이미지 처리 소프트웨어와 함께 이러한 인구의 정량 분석을 수행 하는 방법을 제공 합니다. 이 방법은 기존 도구 이미지 microtubule 역학 및 실시간, 사용 유전자 변형 라인 또는 태그 구문 과도 식에서 배포를 보완합니다. 그러나 사실, 이러한 도구는 매우 유용 합니다, 쉽게 역동적이 고 안정적인 MTs 사이 구분 하지 않습니다. 이미지 분석이 고유한 microtubule 인구를 셀 분극 및 morphogenesis 기본 이해 메커니즘에 대 한 중요 한 의미를 갖는다. 두 번째 프로토콜 초기 MTs를 구체적으로 분석 하는 기법을 설명 합니다. 이것은 약 nocodazole와 마약 유실 후 복구 기간 microtubule depolymerization 다음 시간이 지남에, MTs의 드 노 보 성장 특성을 포착 하 여 수행 됩니다. 이 기술은 zebrafish 태아에 있는 MTs의 연구에 적용 하지 않은 하지만 microtubule 어셈블리에 연루는 단백질의 기능 vivo에서 조사에 대 한 가치 있는 분석 결과 이다.
서문
Microtubules (MTs)는 중합체의 α-및 β-tubulin 선형 protofilaments, 몇 가지는 속이 빈 튜브1,2형태로 결합으로 조립 이다. MTs는 끝 플러스 빠른 성장 하 고 느린-성장 하 고 끝은 centrosome 또는 다른 microtubule 조직 센터 (MTOC)3에서 앵커는 마이너스와 대립 된 구조. 드 노 보 MT 형성 nucleation 복잡 한 γ-tubulin 반지에서 (γ-TURC), 마운트 어셈블리4에 대 한 서식 파일을 제공 하 여 시작 됩니다. 어떤 주어진된 셀에 MTs의 두 인구 구분할 수 그 차례 이상의 서로 다른 속도로. 동적 MTs 성장의 단계 동적 불안정5라고 하는 과정에서 수축으로 전환 하 여 그들의 세포질 환경 탐구. 동적 MTs와 달리 안정적인 MTs 비 성장 고 동적 MTs6보다는 더 긴 반감기.
세포 생물학에 있는 연구의 십 년간은 정교한 배열의 마운트 구조와 기능을 공부 하는 도구를 제공 하 고 이러한 cytoskeletal 요소에 지식의 큰 몸이 귀착되. 예를 들어, MTs 설립 및 유지 보수 뿐만 아니라 안정적인 동적 MTs7, 대의 차동 subcellular 배포에 뿐만 아니라 그들의 본질적인 극성에 기인은 세포 극성의 중심 역할을 담당할 8. 반면, 훨씬 덜은 이해 MT 아키텍처 및 척 추가 있는 태아 같은 더 복잡 한 3 차원 (3 차원) 환경에서 기능에 대 한 부분에서 높은 해상도에서 산 골격을 이미징의 도전 때문. 이 제한에도 불구 하 고 최근 세대 GFP 표현 유전자 변형 라인 라벨 MTs 또는 붙일 태그가 MT 마커의 과도 식 MTs 받 다 동적 변화 및 그들의 휴대에 대 한 우리의 이해를 증가 했다 고 zebrafish 태아에 있는 발달 역할. 전체 MT 네트워크 수 수 몇 군데는 tubulin에 유전자 변형 라인에 직접 레이블된9 또는 tubulin 고분자는 직접 표시 하지 MT 관련 된 단백질을 사용 하는 Doublecortin 같은 키 (Dclk) 또는 Ensconsin (EMTB)10, 11. 다른 선 (및 구문) 생성 된 산 플러스 끝 으로써 특히 산 내장 극성의 평가 활성화 또는 끝11,12,13, 마이너스 centrosome 고정 14. 이러한 도구의 힘 유기 체를 개발, MT의 역학을 공부 하는 능력에 있다. 이러한 연구 결과 밝혀졌다, 예를 들어 특정 세포 인구에서 MTs의 공간 및 동적 배포, mitotic의 방향 스핀 들 겪고 morphogenesis (세포 분열의 비행기의 표시기), 조직에 산 폴리머의 극성 세포 신장 등 마이그레이션 프로세스와 관련 및 MT 성장률 혜성 속도9,,1315에 의해 결정. 이러한 도구의 한계는 그들이 쉽게 안정적이 고 동적 MT 인구 사이 차별 하지 않습니다 이다.
풍부한 세포 생물학 문학에서 그리기, zebrafish 태아에 있는 안정적이 고 동적 MTs 이미지를 immunolabeling 방법 설명, 여기는 유전자 변형 라인의 사용을 보완 합니다. 제 브라에서 같은 immunolabeling 방법의 광범위 한 사용은 고정 절차 동안 MT 무결성을 보존 하기에 있는 어려움에 의해 약간 방해 되었습니다. 프로토콜 1 immunolabeling 총, 동적, 최적화 된 방법을 설명 하 고 있는 안정적인 MTs 개발 zebrafish hindbrain의 횡단면. 또한, 상업적으로 사용 하 여 간단한 메서드 사용 가능한 소프트웨어 계량 이러한 산 인구를 설명 되어 있습니다. 안정적인 MTs는 α-tubulin acetylation, detyrosination, 시간16,17동안 안정적인 MTs에 축적 등의 여러 포스트 번역 상 수정에 따라 동적 MTs에서 구별 된다. Zebrafish 태아 acetylation 속눈썹 및 axonal MTs만 안정적인 interphase MTs18, 안정된 MTs의 하위 집합을이 마커의 유용성을 제한 하지에 발생 합니다. 대조적으로, detyrosination18zebrafish 태아 있는 모든 안정적인 MTs에 나타납니다. 이 포스트 번역 상 수정 α-tubulin (detyrosinated tubulin)18 의 카 터미널 글루탐산을 노출 하 고 안티-Glu-tubulin19를 사용 하 여 검출 될 수 있다. Detyrosination 안정 MTs에 우선적으로 발생 합니다, 하지만 실험적인 증거가 포스트 번역 상 수정 산 안정성16의 원인 보다는의 결과 임을 나타냅니다. 동적 MTs 구성 상호 MT 인구, 항 체, 안티-Tyr-tubulin, 그 구체적으로 인식 하는 α-tubulin19의 tyrosinated 형태를 사용 하 여 구별 된다. 이러한 마커 및 confocal 영상 immunolabeling, 다음 MTs (길이, 번호, 및 관계 되는 풍부)의 정량 분석 개발 신경 튜브의 정의 된 영역에서 수행할 수 있습니다. 효율적인된 방안은 여기 3 차원 이미지 처리 소프트웨어를 사용 하 여이 분석을 수행 하기 위해 제공 됩니다. 이 메서드는 주소 morphogenesis 설립 또는 세포 극성20의 성숙에 관한 질문에 적용할 수 있습니다. 실제로, 안정적인 MTs의 편광 배열의 정교 포토 리셉터 morphogenesis21, 개발 신경 튜브18 및 축 삭 형성8셀의 epithelialization를 포함 하 여 많은 개발 이벤트를 동반 한다.
프로토콜 2 그들의 어셈블리 단계 (nucleation/앵커리지와 성장)22,23동안 MTs를 분석 하는 세포 생물학 분석 실험의 비보에 적응을 설명 합니다. 초기 MTs는 centrosome에서 nucleated 되며 이후 어머니 중심소체23의 subdistal 부속에 고정. Depolymerization를 다음 초기 MT 자라나 분석 하는 방법을 설명 합니다. 이 프로토콜 MTs, 약 희미하게 절차와 치료 후 회복 기간 depolymerize nocodazole 치료에 세부 정보를 제공 합니다. MT 다시 성장에서 정기적 모니터링총 MTs에 대 한 마커 immunolabeling에 의해 s 게시물 유실 (β-tubulin) 안티는 centrosome에 대 한 표시와 함께 (안티 γ-tubulin)과 핵 (4', 6-diamidino-2-phenylindole (DAPI)), 프로토콜 1에서 설명 하는 일반 절차에 따라. 이 프로토콜의 MT depolymerization 단계 드 노 보 산 성장에 대 한 평가 보다는 기존 MTs의 확장 하면 필수적 이다. 이 기술은 다른 측정 하 산 성장 속도 (depolymerization의 부재) 끝 트 란 외.와 같이 녹색 형광 단백질 (GFP EB3), 융합 단백질 3을 묶는 등 플러스 팁 마커를 사용 하 여 다른 게시 된 절차 이므로 201211. 또한,이 분석 결과 배아 드 노 보 마운트 어셈블리에 결함 분석에 특히 유용 이전에 보고 된 NEDD1 돌연변이는 γ-tubulin는 centrosome에의 채용은 장애인 등에서 불완전 한 결과 신경 관 형성 및 신경 결함24.
프로토콜
윤리 성명: 메릴랜드 볼티모어 카운티 동물 보호 지침의 대학 따라 아래 설명 된 절차.
1. 분석의 안정적이 고 동적 MTs 사용 하 여 Immunolabeling (프로토콜 1)
- 고정 전에 배아의 수동 dechorionation
- 얻기 갓 초과 시스템 물을 붓는 하 여 배아를 생성 하 고 다음 플라스틱 페 트리 접시에 남은 배아를 수집 (테이블의 자료를 참조).
- 배아 중간 가득한 새로운 요리 시스템 물 및 전송 배아에서 어떤 파편 든 지 제거 (테이블의 자료를 참조)는 배아는 깨끗 한 환경에서 개발 되도록.
- 배아 28.5에 온도 제어 인큐베이터에서 원하는 단계로 개발 있도록 ° c.
- 장소 배아 24 h 보다 젊은 후 수정 (hpf) dechorionation 이전 유리 접시에.
참고: 고정 정착 액 및 보존 MT 무결성의 빠른 침투를 극대화 하기 위해 이전 Dechorionate 배아. 있도록 추가 Ca 2 + dechorionation 동안 필요한 시스템 물 대신 사용 배아 매체. - 수동으로 해 현미경 미세 집게를 사용 하 여 배양 접시에 배아에서는 chorions를 제거 합니다.
- 막에 있는 파열을 만들려고 집게와 부드럽게 떨어져 당겨 집게의 쌍 태아 encircles 라운드, 투명 chorion에 작은 영역을 꼬집어.
- 집게를 사용 하 여 파열된 chorion에 섬세 하 게 캐 고 하 여 개방을 확대. 파열 수는 집게로 태아를 터치 하지 않도록 주의 하십시오.
- 무대 배아의 고정
- 1.5 mL 원심 분리기 튜브를 dechorionated 배아 전송 준비. 유리 파스퇴르 피 펫을 사용 하 여 가능한 많은 배아 매체 제거.
참고: 영 (중반-somitogenesis) 배아, 안락사 기간 동안 통증을 완화에 없는 추가 절차를 요구 하는 중재 통증 감각 신경 센터의 대형 이전에 고정 및 약물 치료를 수행 합니다. 발달 단계는 킴 외에 정의 된. 1995, 25. 4-5, 11-12 somite 단계 그림 2와 3에 대 한 이미지를 가져오는 데 사용 되었다. - 준비 4 %paraformaldehyde (PFA) /MT 어셈블리 버퍼 (MAB) 정착 제 (테이블의 자료를 참조) 8 %1 mL을 결합 하 여 당 1 mL 2 X MAB 및 추가 2 µ L 100 %PFA 총 볼륨의 1 mL 당 트라이 톤 X-100.
주의: PFA와 트라이 톤 X-100 피부 irritants을 포함 하는 솔루션을 처리 하는 동안 장갑을 착용. - 28.5에 5 분 동안 4 %PFA / MAB 정착 액 1 mL에에서 수정 배아 ° C. Aspirate는 피 펫과 정착 액 1 mL 신선한 정착 액 교체 및 로커에 실 온 (RT)에서 3 h에 대 한 품 어.
참고: 샘플 수정 해야 합니다 신속 하 게 그들의 생물 학적 온도 (zebrafish 28.5 ° C)에 온도 따른 산 depolymerization를 방지 하기 위해.
- 1.5 mL 원심 분리기 튜브를 dechorionated 배아 전송 준비. 유리 파스퇴르 피 펫을 사용 하 여 가능한 많은 배아 매체 제거.
- 정착 액을 발음 하 고 NP40에 식 염 수 Tris 버퍼 x 1 mL 1 추가 (TBS NP40) 버퍼. 부드럽게 교 반 하십시오 RT에 5 분에 대 한 세 번 로커에. 1 mL 신선한 1에에서 4 ° C에서 배아를 저장 X TBS-7 일 동안 NP40.
주의: NP-40, 피부 자극을 포함 하는 솔루션을 취급할 때 장갑을 착용. - 단면화 배아 immunolabeling 위한
- 열 RT 4% 낮은 융해 점 (LMP) agarose 솔루션 뜨거운 접시를 사용 하 여 취소 될 때까지 닫힌된 컨테이너에 매체를 포함 해 현미경 가까이 위치 하는 50 ° C로 설정 . 컨테이너 샘플 사이 닫히고 포함 과정 (단계 1.4.4-1.4.6)을 통해가 열 유지.
- 1.5 mL에서 전송 배아 원심 튜브 유리 피 펫을 사용 하 여 배양 접시를 하 고 1 입력 X TBS NP40.
- 26 해 현미경 배율 아래 미세 집게를 사용 하 여 페 트리 접시에 somitogenesis 단계 배아 (4-5, 11-12 somites)에서 큰 노 른 자 세포를 제거 합니다. 한 쌍의 집게와 꼬리 새싹에 의해 태아를 보유 하 고 hindbrain 조직을 유지 하기 위해 다른 쌍으로 노 른 자 세포를 벗 겨. 노 른 자 파편의 무료 페 트리 접시의 지역 데 노른자위 배아 전송.
참고: LMP agarose의 조기 경화를 방지 하기 위해 개별적으로 agarose 가득 금형에 배아를 포함. - 채우기 한 12 x 5 mm x 3 mm 200 µ L 가진 단면 형의 잘 녹아 LMP agarose는 micropipette를 사용 하 여. 수행 단계 1.4.5.-1.4.6. 신속 하 게 (20 내 금형의 s) LMP agarose RT를 냉각 하 고 고형화 하기 전에 배아를 포함.
- 미세 집게를 사용 하 여 전송 드 노른자위 배아는 tailbud에 의해 배양 접시에서 해 현미경의 테이퍼 끝으로 agarose 가득 금형.
- 는 vibratome 원하는 평면에서 삭감 되도록 금형에 태아 하 좋은 집게를 사용. Hindbrain 조직 가장자리를 직면 하 고 그것의 등 쪽 표면 및 테이퍼 지역 끝을 직면 하 고 그 앞쪽 표면 금형의 길이에 평행 하 게 실행 되도록 태아를 향하는 여 가로 섹션을 만듭니다. 잔여 배아에 대 한 단계 1.4.4-1.4.6 반복.
- 실시간에서 5 분을 강화 하기 위해 agarose 포함 허용
- 는 agarose의 높은 축 생성 40 µ m 섹션 포함 배아 (단계 1.4.1-1.4.7)는 vibratome을 사용 하 여 1로 가득 단면 접시와 함께 TBS NP40 x. 500 µ L 1에서에서 24-잘 접시에 관심의 섹션을 전송 TBS NP40 미세 집게를 사용 하 여 x. 잘 당 하나의 배아의 섹션을 놓습니다.
참고: 18 대 한 자세한 내용은 참조를 참조 하십시오. 유지는 섹션 버퍼 및 저속 (10-25 rpm) agarose 포함에서 분리를 방지 하는 나머지 단계에서 바위의 적어도 250 µ L에 있는 모든 시간에 수산화. 세제는 차단에 제시 하 고 세척 솔루션 액체 매체의 표면 장력을 감소 하 고 섹션의 침수를 허용 한다. 모든 조작 전후 동안 섹션 우물에 남아 있는 것을 확인 하십시오. 주의 사용 하 여 세척 하는 동안 실수로 버린 섹션 방지.
- 버퍼를 제거 하 고 차단 하는 솔루션의 500 µ L를 추가. 실시간에서 적어도 1 시간을 위해 바위
참고: 사용 차단 솔루션을 사용할 각 이차 항 체의 호스트 종에서 5% 세라 (테이블의 자료를 참조). - 품 300 µ L 1 차 항 체는 로커에 4 ° C에서 36-72 h에 대 한 블로킹 버퍼에 희석에. 600 µ L 1에 두 번 씻고 30 분 각, 로커에 TBS NP40 x 실시간에
참고: 더블-레이블 섹션 잠복기 (β-tubulin, 안티 또는 α-tubulin 안티) 총 MTs와 안정적인 MTs (안티-Glu-tubulin) 또는 동적 MTs (안티 Tyr tubulin)에 대 한 1 차 항 체에 의해. Α-tubulin 인구 수정 더블 라벨 총 및 post-translationally 다른 호스트 종에서 발생 한 1 차 항 체를 선택 합니다. 항 체 희석에 대 한 테이블의 자료를 참조 하십시오. - 품 300에서 µ L fluorophore 활용 된 이차 항 체의 어둠 속에서 4 ° C에서 16-24 h에 대 한 로커에 블로킹 버퍼에 희석. 600 µ L 1에 두 번 씻고 30 분 각, 로커에 TBS NP40 x 실시간에
참고: 랩 호 일 이후이 시점에서과 냉각을 방지 하기 위해 각 조작 후에 이차 항 체를 포함 하는 다 잘 요리. 호스트 면역 글로불린의 1 차적인 항 체와 반응 하는 2 차 항 체를 선택. 이차 항 체 fluorophores, 겹치지 않는 별도 방출 스펙트럼을 선택 합니다. 항 체 희석에 대 한 테이블의 자료를 참조 하십시오. - TBS NP40 락 RT에서 5 분에 3 번 실시간 세척에서 30 분 동안 로커에 DAPI 솔루션의 500 µ L에 태아를 품 어.
참고: 핵 라벨 MT 정량화 단계 1.12에서에서 수행에 대 한 셀룰러 컨텍스트를 제공 합니다. - 먼지 무료 슬라이드의 중앙에 방지 페이드 에이전트 설치 매체의 한 방울을 배치합니다. 미세 집게를 사용 하 여 장착 중간 물방울에 섹션을 전송. 먼지가 coverslip 샘플 위에 놓습니다. 슬라이드 이미징 수행 될 때까지 호 일에 싸여 건조 하 고, 어둡고, 차가운 장소에 저장.
참고: 때 현미경을 사용 하 여 섹션을 식별 하는 데 도움이 됩니다 이미징 이전 뾰족한 영구 마커를 사용 하 여 슬라이드의 뒤쪽에 섹션을 돌고. - 는 거꾸로 레이저 confocal 현미경 목표를 직면 하는 coverslip로 무대에 슬라이드를 추가 하 여 검색에 마운트 섹션 confocal 영상. 컨트롤 슬라이드에 적절 한 광학 (목표, 레이저, 및 채널 설정 같은 이득 및 오프셋)을 확인 하 고 샘플 27 사이의 일관성 유지. 데이터 손실을 방지 하기 위해 픽셀을 밀어붙이는 방지.
- Z 스택 confocal 이미지 선택 된 이차 항 체 fluorophores에 대 한 채널 설정을 사용 하 여 캡처하고 27 이미지 파일 저장 합니다. 각 섹션에 대 한 Z-스택 확보.
참고: 다음 인수 설정을 사용 하 여 그림 2와 3에서 이미지를 수집 하는 데 사용 하는 매개 변수 복제: 모드 = XYZ; 객관적인 확대 = 63 X 기름 침수 렌즈; 객관적인 숫자 조리개 1.4; = Z-단계 = 0.1 µ m; Z-깊이 = 16.23 µ m.를 사용 하 여 다음 채널 설정: 20 %UV 범위 레이저, 방출 필터 범위 DAPI 여기 430-480 nm, 광 전 증폭 관 (PMT) 이득 = 525 V, 및 PMT 오프셋 =-1.72 = %; 448 nm fluorophore (테이블의 자료를 참조) 여기 20 %488 nm 레이저, 방출 필터 범위 = 493-573 nm, PMT 이득 689 V, 및 PMT 오프셋 = =-0.2%; 32 %594 nm 레이저, 방출 필터 범위 594 nm fluorophore 여기 608-706 nm, PMT 이득 = 768 V, 및 PMT 오프셋 =-6.8 = %. - 고유한, 설명 파일 이름을 가진 원시 데이터 파일을 저장 하 고 이미지 분석 소프트웨어에서 편집 복사본을 만듭니다.
- Z-스택 최대 예측 표시의
- 공개 3 차원 이미지 분석 소프트웨어 (예를 들어, ImageJ)를 사용 하 여 데이터 파일 복사본을 엽니다. 각 채널 개별 이미지 순서 (Z-스택)으로 나타나는 확인.
- 다음 메뉴 순서를 사용 하 여 이미지 채널 분할: “ 이미지/색상/분할 채널 ”.
- 다음 메뉴 순서를 사용 하 여 관심의 채널을 오버레이하여 병합 된 이미지를 만들: " 이미지/색상/병합 채널. " 선택는 594 nm, 488 nm, 및 각각 거짓 색된 빨강, 녹색 및 파랑, 되도록 DAPI 채널. 체크 " 만들기 합성 " 선택 " 확인 " 28.
참고: 더 나은 전달 그림 2와 3, 최대 투영에 해당 MTs 하는 세부 의해 다른 두 채널에 대 한 거짓 색상 선택만 DAPI 채널 생략. - 병합된 Z 스택 검토 하 고 시작 및 끝 표시 모든 채널에 대 한 내부 최고의 Z-비행기의 위치를 기록. 외부 차선 신호 섹션의 불규칙 한 표면 때문에 일반적으로 있는 Z-비행기를 닫습니다. 29 대 한 자세한 내용은 참조를 참조 하십시오.
- 다음과 같은 3 차원 이미지 분석 메뉴 순서를 사용 하 여 Z 스택의 최대 강도 투영을 수행 하 여 단일 2 차원 이미지로 병합된 Z 스택 시각화: " 이미지/스택/Z-프로젝트 " 시작과 끝의 내부 최고 위치 입력 1.11.3 단계에서 Z-비행기는 " 시작 슬라이스 " 및 " 정지 슬라이스, " 각각. 선택 " 최대 강도 " 투영 유형 및 클릭으로 " 확인 ". 28 대 한 자세한 내용은 참조를 참조 하십시오.
- 분석 MT 라벨
- 상용 3 차원 이미지 분석 소프트웨어를 엽니다. 선택 " 만들 라이브러리 " 이미지 라이브러리에 대 한 설명이 포함 된 이름을 제공 하는 고. 클릭 " 만들기. " 라이브러리에 confocal 현미경에서 생성 된 raw 이미지 파일을 끕니다. 큰 파일 전송에 더 많은 시간 필요.
- 파일 분석을 선택 합니다. 선택 " 확장 초점 "에서 " 보기 " 메뉴는 메인 창에서 채널 병합 이미지를 표시 합니다.
- 배경 신호 감소 되 고 진정한 신호는 강력한 때까지 왼쪽 또는 오른쪽에 각 채널에 대 한 슬라이더 도구를 드래그 하 여는 임계 처리를 조정 합니다. 각 채널 (예를 들어, 직사각형 또는 mitotic 핵만 하지 자동-형광 세포질 또는 agarose에서 보여주는 DAPI 채널) 라는 분자에 대 한 진정한 신호를 보여준다 관찰.
- 선택은 " Freehand 관심 영역 (ROI) " 도구 및 분석 관심 영역 윤곽. 선택은 " 작업 " 탭 뒤에 " 선택 자르기 " 이미지를 자르려면. 자른된 이미지 파일 새 이름으로 저장 합니다. 클릭은 " 측정 "를 만드는 3 차원 분석에 관련 된 특정 개체를 필터링에 대 한 프로토콜 탭.
- 드래그 " 찾아 개체 " 프로토콜 창. 첫 번째 프로토콜 이름을 " DAPI. " DAPI 채널 드롭다운 메뉴에서 선택 합니다. 다음 설정을 DAPI 프로토콜 끌어서 넣어 아래 " 찾을 개체 " 다음 순서로 (표 1): " ObjectsŔ에서 구멍 채우기 " ObjectsŔ 감동 별도 " 개체 SizeŔ에 의해 제외 " 안 만질 ROIs 제외 ".
주: 표 1에 설정의 목표는 먼저 그의 배급의 신호를 무시 하는 임계값을 설정 하 고 크기 분석 되 고 개체의 크기와 일치 하지 않습니다. 예를 들어 세 핵 핵을 충분히 큰 신호 제거. - 나머지 조립 시퀀스 (단계 1.12.9) β-tubulin 및 표 1에 설정을 사용 하 여 다른 표식에 대 한 필터 수행.
- 선택 " 측정 " 각 프로토콜의 밑에. 선택 " 강도와 볼륨 측정 " 및 " 골격 길이 " 모든 tubulin 라벨, 하지만 DAPI 신호에 대 한 전.
- 측정 지역의 ROI를 그립니다. 관찰에서 측정 된 " 요약 " 탭 영역을 처리 하는 소프트웨어 후. 데이터를 복사 하 고 실행할 수 있는 스프레드시트, 표 2에 저장. 나중에 분석에 대 한 스프레드시트의 백업 복사본을 만듭니다.
- 선택 측정 (예를 들어 길이 산 번들, 수 산 번들/핵와 공개의의 다른 마커) 스프레드시트에서 각 그룹에 대 한 평균을 결정 하기 위해 분석.
참고: 평균 MT 번들 길이 =의 합계는 ' β-tubulin 골격 길이 의미 ' 배아의 총 수로 나눈 각 태아에 대 한. 행 20 표 2를 참조 하십시오. 변수 및 실험적인 그룹은 그래프로 쉽게 있도록 스프레드시트 포맷.
2. 드 노 보 MT 어셈블리 분석 결과 (프로토콜 2)
- 구축 및 테스트는 다 잘 흐름을 통해 장치 ( 그림 1) 2 일전 실험.
참고: 장치 nocodazole 치료 공급 재료의 테이블에서에서 사용 하 여 다음과 같은 여러 실험적인 그룹의 동시 유실 수 있습니다. 실리콘 마감재 배아를 독성 위험 포즈 건조 시간 24 시간 이상 필요 합니다.- 분할 반 50 mL 원심 분리기 튜브 지 그 또는 밴드 톱을 사용 하 여 세로로.
- 70 µ m 나일론에서 3 cm의 반경으로 잘라 7 세미 원, 메쉬 및 하 여 맞게 단단히 하나로 분할의 절반 원심 관. 원심 분리기 튜브 수족관 안전한 실리콘 마감재를 사용 하 여 10 mL 그라데이션 표시에 평행으로 세미 서클을 붙입니다. 장치를 2 일 동안 건조 하 고 물 2-3 헤 한 비 커에 몸을 담글 하 여 씻어 수 있도록
- 그런 흐름을 통해 장치에 유지 하는 액체의 높이 ¼ 인치 ( 그림 1, 2와 3)의 깊이 클레이 모델링 컷된 원심 분리기 튜브 (스레드) 최고급 라인.
- 50 mL 주사기에서 플런저를 제거 하 고 끝에 좋은 튜브의 12 인치 삽입 여 희미하게 기구를 준비 합니다. 그것은 갈 것 이다 고 모델링 점토를 사용 하 여 공동 주위 인감 튜브를 밀어.
- 사전 젖은 메쉬를 사용 하 여 전체 흐름을 통해 장치를 통해 실행 하는 액체 수 있도록 배아 중간. 각 얼음 그 액체 모든 구획에 풀 하지만 여전히 앞 빈 찰 흙 테두리는 장치. 얼음 ( 그림 1)에 흐름을 통해 장치 위에 희미하게 장치 일시 중단 링 스탠드를 사용 하 여.
- 얼음에 배아 매체의 200 mL를 진정 하 고 모든 기포를 삭제 하 고 유량 주사기의 높이 변경 하 여 약 7 mL/분 조정 흐름 율은 희미하게 장치에 충분 한 부.
- Dechorionate 배아 효소
- 게 일반적인 효소의 작업 솔루션 10 mg/mL의 1 mL를 diluting 하 여 일반적인 효소 주식 20 mL 배아 중간에.
- 배아 timepoint 그들이 원하는 개발 단계에 도달 하는 예상 되는 전에 1 시간에 수행 화학 dechorionation. 100 mm 페 트리 요리에서 배아 매체를 제거 하 여 다이제스트 chorions 배아와 관련 되지 않은 효소 작업 솔루션의 20 mL를 추가 준비.
- 5 분 동안 37 ° C에 품 배아
참고: 5 분을 초과 하지 않거나 사용 하 여 일반적인 효소 솔루션의 높은 농도이 떨어지는 태아 귀 착될 것 이다 떨어져 한 번 nocodazole 치료. - 신속 하 게 일반적인 효소 밖으로 플라스틱 하 고 약 25 mL 배아 매체와 요리를 리필. 한번 반복.
- 1 mL 유리 피 펫, 24 보다 전송 배아를 사용 하 여 유리 hpf 손상 으로부터 그들을 보호 하기 위해 요리.
- 단계 1.1.5에서에서 설명한 대로 수동으로 미세 집게의 쌍을 사용 하 여 chorions를 제거 하 여 완전 한 dechorionation.
- 유리 접시 원하는 개발 단계를 도달할 때까지 dechorionated 태아 30 분의 최소 28.5 ° C 배양 기에서 포함 된 곳.
- Depolymerize 기존 MTs
- 50 µ L 1 mg/mL 재고 nocodazole 10 mL 얼음 차가운 배아 매체와 결합 하 여 5 µ g/mL nocodazole의 작업 솔루션 준비.
주의: nocodazole, 피부 자극을 처리 하는 경우 장갑을 사용. - 10 mL 찬 nocodazole 작업 솔루션 nocodazole 치료 그룹의 배아 매체를 교환합니다. 개발 단계 (4-5 somite 배아에 대 한 예를 들어 1 시간)에 대 한 적절 한 시기에 대 한 얼음에 접시를 놓습니다. 정해 치료 제어 배아 배양 접시에서 희미하게 샘플 단계 2.3.4.1에서에서 함께 고정 될 얼음에.
- 이전 배아 실험 그룹별로 별도 구획을 사용 하 여 흐름을 통해 장치를 화재 광택된 1 mL 유리 피 펫을 사용 하 여. 50 mL 주사기의 상단에 따르고 얼음 차가운 배아 매체에 의해 nocodazole 희미하게 시작.
참고: 실험 그룹 당 적어도 30 배아를 사용 합니다. 실험 그룹 제어 배아 또는 morpholino 또는 RNA 주입 태아의 다양 한 구성 수 있습니다. 희미하게 얼음 산 성장을 억제 하면서 희미하게 8-10 분 마다 추가 배아 매체의 약 150 mL의 총은 nocodazole가 필요 합니다. MTs는 찬 온도에 안정 하 고 감기 초기 배아의 개발 지연 때문에 얼음에 배아를 유지 하는 것입니다이 분석 결과의 성공에 필수적인.
유리 접시 포함 하에 배아를 전송 하 여 실시간에 희미하게의 20 분 후 regrow 허용 MTs - 따뜻한 (28.5 ° C) 배아 중간 화재 광택된 1 mL 유리 피 펫을 사용 하 여. 최대한 빨리 배아 전송 타이머를 시작 합니다.
- 1 분 제어 및 희미하게 배아 수정, 5 분 및 10 분 1.5 mL로 약 10 배아를 pipetting 원심 튜브 1 mL 4 %PFA / MAB 수정 (28.5 ° C)로 가득와 지시에 따라 1.2.3 단계.
- 50 µ L 1 mg/mL 재고 nocodazole 10 mL 얼음 차가운 배아 매체와 결합 하 여 5 µ g/mL nocodazole의 작업 솔루션 준비.
- Immunolabeling에 설명 된 대로 섹션 1.3-1.5 샘플 준비.
- Immunolabel 부동 섹션 및 이미지 배아로 섹션에에서 설명 1.6 1.10 다음 변경 기본 항 체 사양: 사용 1: 500 토끼 안티-γ-tubulin 및 1: 200 마우스 안티-β-tubulin.
- 프로세스 단계 1.12에서에서 설명한 3 차원 이미지 분석 소프트웨어를 사용 하 여 이미지를 분석 하 고.
결과
Immunolabeling를 사용 하 여 안정적이 고 동적 MTs의 분석
프로토콜 1, 산 초 (신경 용골) 동안 부분 모집단의 분포와 신경 관 발달의 늦은 (신경 대) 단계 드러났습니다, 각각 사용 하 여 Glu tubulin 및 Tyr tubulin 표식으로 안정적이 고 동적 MTs에 대 한. 동적 MTs는 hindbrain에 신경 용골 단계 (4-5 somites)에서 지배 (그림 2A-D). 용골 신경 막대 (11-12 somites), 향상 된 epithelialization의 단계에 개발로 질적으로 적은 MTs는 복 부 막대에 특히 안티 Tyr tubulin 항 체 (그림 2E-H)와 함께 immunoreactive. 반면, Glu tubulin 흩어져 이며 신경 용골 (그림 3A D), 전체 punctate 하지만 산 책자 (그림 3E-H)에 따라 복 부 신경 막대에 농축입니다. 화살표 라벨을 증가 특정 마운트 번들 또는 구조를 가리킵니다.
안티-Glu-tubulin와 반대로 Tyr tubulin 항 체 (이중 라벨 실험 방지) 같은 호스트 종에서 생성 했다, 하지만 이러한 결과 안정적이 고 동적 MT 마커 zebrafish hindbrain에 거의 겹치는 나타냅니다. 첫째, 복 부 신경 로드 동적 (그림 2F) MTs 보다 더 안정 (그림 3F) 있다. 추세 등 쪽 신경 막대에 반대는, zebrafish 모델 일치 neurulation 있는 등 조직 남아 동적 신경 관까지 형성20. 둘째, mitotic 스핀 들은 완전히 표시 신경 용골 (그림 2D, 화살촉)에 티 르-tubulin 항 체와 일치 centrosome, 스핀 들의 기본만 하는 동안 표시 됩니다 안정성 표시와 함께 Glu tubulin ( 그림 3 D, 화살촉)입니다. Β-tubulin 면역 형광 검사, 일반적인 두 분석 알립니다 모든 MTs의 배급의 실험 하 고 일반적인 라벨을 해산 시키기 위하여 기초를 제공 한다.
3 차원 이미지 분석 소프트웨어를 사용 하 여 객체를 측정 결과 편리한 테이블 (테이블 2)로 구성 될 수 있는 데이터의 큰 금액. 길이, 수 및 지역 측정을 하려면 분석에 사용할 수 있는 데이터의 하위 집합만 사용 하는 우리. 우리가 더 분석 하지 않는 데이터의 구성 요소 중 하나는 식별 된 개체의 수입니다. 수 해야 하지 다릅니다 널리 섹션과 MTs 핵의 비율 단일 치료 조건에 비슷한 있어야 하는 처럼이 숫자는 내부 품질 관리로 사용 됩니다. 국외 자 중 분석 조정 필터 다시 실행 하는 또는 이미지는 너무 저조한 분석 분류 지표 이다. 따라서, 모든 국외 자 이미지 조정 설정은 한다. 국외 자 섹션 가난한 라벨 또는 비정상적인 개체 수 될 수 있는 물리적 손상의 표시를 위해 시험 되어야 한다. 분석 완료 되 고 품질 제어, 유용한 정보에서 복구할 수 있는 원시 데이터와 같은 평균 총 MTs의 길이 고 MTs 또는 총 MTs (표 3)에 안정적인 MTs의 비율을 안정. 이러한 측정 이외에 다른 많은 통계 (핵, centrosome, 등) 다른 세포 구조를 MTs 또는 그들의 관계에 대 한 추론을 그리는 데 사용할 수 있는 3 차원 이미지 분석 소프트웨어를 사용 하 여 얻어질 수 있다.
드 노 보 MT 어셈블리 분석 결과
Nocodazole 치료는 MTs 확산 라벨 (그림 44 D와 4 G) 인 depolymerizes. 그러나 있는 MTs regrow, 그들은 (그림 4B, 4E, 및 4 H) centrosome에서 확장,,이 단일 면 (그림 4C, 4 층, 및 4I) 그들의 비 평면 궤도 때문에 명백한 되지 않을 수 있습니다. 그럼에도 불구 하 고, 일부 이미지 분석 소프트웨어 nocodazole 희미하게 (표 4) 후 산 성장 평가 사용 하는 3 차원에서 길이 측정 할 수 있다. 표 4 에 데이터 집합에서 얻을 수 있는 중요 한 관찰 MTs의 평균 길이 나타나는지 분석 신경 튜브의 모든 지역에서 nocodazole 세척 후 시간이 지남에 따라 증가 하는. 위에서 설명 했 듯이, 3 차원 이미지 분석 소프트웨어에서 얻은 통계의 MT 데이터 (예를 들어 비율 MTs의 핵 당)을 해석 하는 셀룰러 컨텍스트를 제공할 수 있습니다.

그림 1 : 희미하게 장치의 그림 드 노 보 MT 어셈블리 분석 결과. 삽입은 세로로 잘라 50 mL 원심 분리기 튜브에 붙어 메쉬에서 만든 흐름을 통해 장치의 클로즈업. 메쉬 compartmentalizes 흐름을 통해 장치는 여러 실험적인 그룹을 동시에 처리할 수 있습니다. 사용 하는 동안 태아 매체 주사기에 추가 되 고 천천히 일정 린스를 제공 하는 모든 실험 그룹 흐름을 통해 장치를 채우기 위해 튜브를 통해 흐른다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
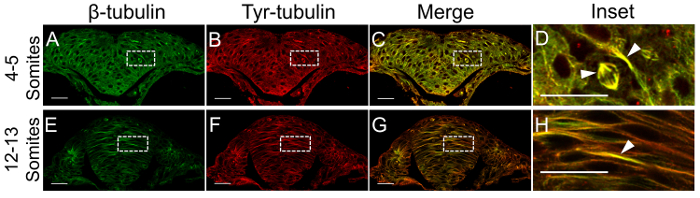
그림 2: 동적 MTs. 이미지 immunolabeling의 사용 Dechorionated 배아 transversely hindbrain, β-tubulin (그린 A 와 E)에 대 한 항 체와 immunolabeled를 통해 구분 된 적절 한 단계 (h E A d에서 4-5, 12-13 somites)에 고정 됐다 동적 산 인구를 계시 하기 위하여 모든 MTs와 tyrosinated α-tubulin B 와 F에 (빨간색)를 표시 합니다. 매우 동적인 MTs 노란색 라벨 표시 (d , H화살촉) 지역으로 병합 된 이미지 (C, G)와 그들의 더 높은 배율 (D, H)에서 볼 수 있습니다. 스케일 바 = (A-C와 E-G) 25 µ m 및 10 µ m (D와 H). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

Figure 3: 안정적인 MTs. 이미지 immunolabeling의 사용 Dechorionated 배아, hindbrain, immunolabeled를 통해 적절 한 단계 ( A-D 및 12-13 somites E-H에 somites 4-5)에서 sectioned 고정 했다. 안정적인 MTs 개는 detyrosinated 형태의 α-tubulin (Glu-tubulin)에 대 한 항 체와 ( B 와 F에 빨간색) 동안 총 MTs 일반적인 β-tubulin 항 체 ( A 와 E는 녹색)으로 시각화 했다. 병합 된 이미지 (C, G)와 그들의 더 높은 배율 (D, H) 빨간색과 노란색 신호 높은 산 안정성 (D, H에에서 화살표)의 영역을 나타냅니다. 스케일 바 = (A-C와 E-G) 25 µ m 및 10 µ m (D와 H). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 초기 MTs. 이미지 immunolabeling의 사용 Dechorionated 배아 4-5 somites 고정 되었고 transversely는 hindbrain 통해 구분. 섹션 immunolabeled β-tubulin (D, E, 그리고 F)를 성장 하는 MTs와 γ-tubulin (A, B, 및 C) nucleation 포인트/centrosome 표시 했다. 신경 튜브의 등 쪽 지역 (A, D;에서 박스 B, E 와 C F) 높은 확대에 표시 (G, H, 난, 각각) 핵 (DAPI, 블루), centrioles (γ-tubulin, 레드)와 총을 MTs (β-tubulin, 녹색). 화살촉을 화이트: MTs와 centrioles; colocalization 노란색 화살표: 셀의 두 번째 중심소체 표시 됩니다. 스케일 바 = 25 µ m (A-F) 및 10 µ m (G-나). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

표 1: 개체에 3 차원 이미지 분석 소프트웨어를 필터링에 대 한 설정 기본.
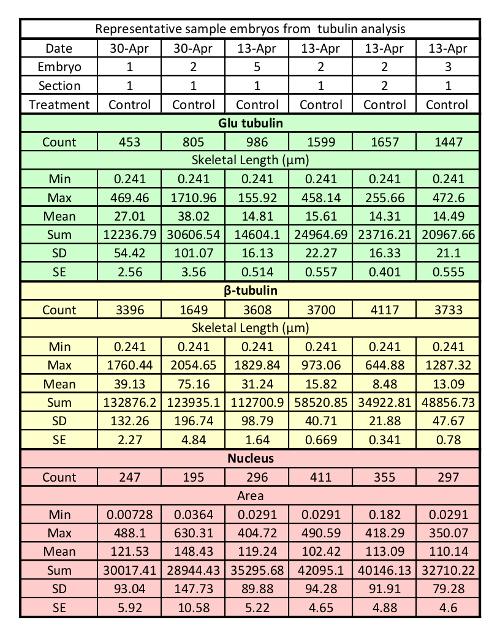
표 2: 3 차원 이미지 분석 소프트웨어 분석 안정적인 MTs를 사용 하 여 얻은 대표적인 원시 데이터 세트. 각 열은 하나의 섹션에서 측정을 나타냅니다. 최소: 작은 측정; 최대: 큰 측정; SD: 표준 편차; SE: 표준 오류가 발생 합니다.

표 3: 3 차원에서 얻을 수 있는 데이터 집합의 예제 이미지 안정 MTs 계량 분석 소프트웨어. 총 (β-tubulin)의 평균 길이 측정을 선택 하 고 안정적인 MTs (총과 안정적인의 비율 ( 표 2참조) 모든 샘플에서 관련 라벨에 대 한 평균 골격 길이의 평균 하 여 계산 (Glu-tubulin) MTs Glu-tubulin 당 β-tubulin 줄무늬 줄무늬) 평균 Glu tubulin 수로 나눈 평균 β-tubulin 계산 하 여 계산.

표 4: 데이터 집합을 분석 하는 3 차원 이미지 분석 소프트웨어에서 얻어질 수 있다의 예 드 노 보 MT 어셈블리입니다. 드 노 보 마운트 어셈블리에서 대표적인 결과 실험, nocodazole 유실 후 얻은 3 복구 시간 포인트 (1, 5, 10 분)에 대 한 데이터 집합을 비교. 각 시간 지점에 대 한 측정 핵 카운트, centrioles (γ-tubulin puncta), 총 MTs (β-tubulin 줄무늬)의 수에 대 한 얻은 표시 됩니다 선택은 몇 군데의 지역 분석 (개발 신경 튜브의 단면).
토론
현재 많은 방법이 있다 초기 zebrafish 개발에서 산 역학 이미징을 위한 조직11,12,,1314고정 태그 분자의 라이브 영상에서의 immunolabeling에 이르기까지. 단일 셀에 MTs 동적 또는 안정 상태에 있을 수 있습니다, 있지만 epithelialization는 MTs는 시간이 지남에 따라 점차적으로 안정화 과정 이다. 안정적이 고 동적 MTs에 대 한 마커를 사용 하 여이 현상을 시각화 하는 방법을 제공 합니다. 여기에 제시 된 방법은 배아 zebrafish 조직의 횡단면에 안정적인 산 인구를 동적 전환 척도를 3 차원 이미징 소프트웨어의 힘을 활용 합니다. 프로토콜 2, 메서드는 초기 MTs의 명료한 인구를 분류 하 여 그들의 성장과 nucleation 초과 따라 사용 됩니다.
MTs는 악명 높게 depolymerize 그들의 성향으로 인해 그들의 네이티브 국가에서 이미지 어렵다. 따라서,이 방법의 핵심 구성 요소 전체 태아를 통해 MTs의 급속 한 고정 이다. 이 생리 적인 온도에서 고정을 시작 하 고 안정화는 MTs와 태아의 침투성을 증가 하는 버퍼를 사용 하 여 이루어집니다. 고정 시간도 축소 고정-고정 수 마스크 epitopes, 항 체 바인딩을 방해 체포 MTs에 실패 처럼 중요 하다. 3-4 h의 제안된 고정 시간은 중간 gastrulation에서 최대 24 시간 후 수정 배아와 함께 작동 합니다. 시간 규모의 젊은 끝 배아 수정 되어야 합니다에 대 한 가까이 3 h 동안 이전 배아 전체 4 h를 할 수 있습니다. 적절 한 고정으로도 MTs 단면화 및 immunolabeling 해결의 1 주 안에 발생 합니다 시간과 함께 depolymerize 것입니다.
일단 조직 고정 제대로 immunolabeling와 함께 문제가 발생할 수 있습니다. 가장 일반적인 문제가 발생 되었습니다 조직의 센터를 통해 가난한 침투 특히, 너무 많은 섹션 같은 우물에 알을 품는 경우. 배아의 permeabilization를 개선 하기 위해 세제를 증가 함께 결합, 1 차 및 이차 항 체에 대 한 기본 항 체 및 외피 시간의 농도 증가 하는 것은 immunolabeling 문제는 대부분의 개량 것입니다. 고정 문제 또는 immunolabeling 문제 때문에 실패 하면 항 체 라벨 패턴 라벨링 하는 항 체를 검사 하 여 원인을 확인 가능 하다. 불 쌍 한 고정 막에 강렬한 라벨에 발생 되며 세포질에 라벨 확산,-고정 될 동안 산 아키텍처 유지 약한 라벨. 그러나 불 쌍 한 침투는 항 체의, 라벨 없이 조직의 중앙에 영역으로 표시 됩니다.
의미 있는 방식으로 마운트 이미지를 분석 하는 고품질 영상에 의존 합니다. 3 차원에서 산 길이 잡으려고 목표와 숫자 조리개에 대 한 가능한 최소 Z 단계 크기를 사용 해야 합니다. 여기 표시 된 이미지는 다음 생산 1.4 숫자 조리개와 오일 emersion 목표 X 63으로 캡처된: 픽셀 = 240 nm, Z 단계 0.1 µ m, Z-스택 크기 = = 16.252 µ m. 때문에 단일 산의 폭은 25 nm, 약 10 배 아래 가벼운 현미경,이 미터에 대 한 해상도의 한계를 정확 하 게 수 없습니다 측정이 기술을 사용 하 여. 대신, 모든 3 개 차원에서 달성 가능한 최소 픽셀 크기 이상의 유일한 산 길이 측정할 수 있습니다. 선 또는 평균 프레임 마운트 신호 정의 강화할 수 있다. 산 분석 고품질 섹션에 대 한 예약 한다. 조직 가난한 고정으로 몇 군데 없고 분석, 가벼운 overfixation 신중 하 게 레이저 강도 증가 의해 균형 세력 수 고 좋은 동적 범위를 유지 하면서 약한 신호를 감지 하는. 불 쌍 한 항 체 침투 하지 최적의 동안 얇은 섹션 (5-10 µ m) 이미징 결과 잘 레이블이 지정 된 영역을 이미지 수집을 제한 하 여 수정 될 수 있습니다. 라벨에서 높은 백그라운드 필터 설정을 조정 하 여에 대 한 보상 될 수 있다. 그러나,이 조정의 완료, 그것은 확인 하는 데 필요한 필터 임계값 acceptably Z 스택의 각 비행기에.
3 차원 이미지 분석 소프트웨어 계량 MT 길이, 면적, 각도, 풍부, 및 고정된 조직 단면도의 3 차원 공간에서 다른 통계를 실험을 수 있습니다. 여기 설명 하는 방법을 상업적으로 사용 가능한 소프트웨어를 사용 하 여 이러한 데이터를 얻기에 대 한 지침을 제공 합니다. 그러나, 필터링 모듈 공개 소프트웨어 관련 플러그인 또는 매크로, 분석을 모두 사용할 수 있도록 보정을 적용할 수 있습니다. 분석, 전에 raw 이미지는 정량화의 배경 및 일반적인 신호를 포함 하 여 방지 thresholded 이어야 합니다. 분석 완료 하 고 실행할 수 있는 스프레드시트 데이터 전송, 데이터 집합에서 많은 유추를 할 수 있다. 여기 계산 중 1 전체 MT 골격 ROI에 안정 되었습니다을 나타냅니다 총 MTs β-tubulin 줄무늬, 또는 안정적인 MTs의 비율 당 Glu tubulin 줄무늬 이었다. 경우는 실험 양적 데이터를 보완 하기 위해 생성 광택된 태그 이미지 파일 형식 (TIFF) 이미지 스케일 바 3 차원 이미지 분석 소프트웨어와 어려움 없이 이다.
이 분석 결과 마운트 어셈블리에서 vivo에서 내포 하는 단백질의 기능 분석을 허용 한다. Immunolabeling 교류 직렬 섹션에서 수행 하는 경우이 프로토콜 같은 배아에서 역동적이 고 안정적인 MTs 공부 하 사용 될 수 있습니다. 미래에 증가 세제 등 변경된 포함 각도 수정 이전 배아에 대 한 이러한 방법의 사용 및 해 부 질문의 넓은 범위를 허용할 것 이다.
공개
저자는 공개 없다.
감사의 말
Confocal 현미경에서는 미국 국립 과학 재단 (NSF), 부여 #DBI-0722569 자금으로 구입 했습니다. 연구로는 미국 국립 연구소의 건강/국립 연구소의 일반 의료 과학 (NIH/NIGMS) 그랜트 #GM085290 및 미국 부서 방어 (국방부) 부여 #W81XWH-16-1-0466 R.M. 브루 스 터에 게 수 여를 지원 했다. E. 생체 전 대학 및 학부 과학 교육 프로그램을 통해 하 워드 휴즈 의학 연구소에서 UMBC에 교부 금에 의해 지원 되었다, # 52008090를 부여. S.P. 브라운에 의해 미국 부의 교육 GAANN 장학금을 지원 했다, #GM055036, 그리고 자금으로 미국 국방부 부여 #W81XWH-16-1-0466 연구 조교 메이어 대학원 친교 NIH/NIGMS 보조금에 의해 자금.
자료
| Name | Company | Catalog Number | Comments |
| Agarose | Used to treat petridishes. Prepare 1% agarose by heating a solution of 1 gram agarose per 100 ml 1X embryo medium in a microwave until polymerized. | ||
| Kpipes | Sigma | P7643 | |
| NaCl | Sigma | S7653 | |
| Tris-HCl | Sigma | T3253-500G | |
| KCl | Sigma | P9333-500G | |
| CaCl2·2H2O | Sigma | C5080 | |
| NP-40 | American Bioanalyticals | AB01424 | |
| EGTA | Sigma | E3889-25G | |
| MgCl2 | Sigma | M2670-500G | |
| Bovine serum albumin (BSA) | Fisher | BP1605 | |
| Triton-x | American Bioanalyticals | AB02025 | |
| Anti-Fade mounting medium | Invitrogen | P10144 | |
| Mouse anti-β-tubulin | Developmental studies Hybridoma Bank | E7 | 1/200 |
| Rabbit anti-γ-tubulin | Genetex | GTX113286 | 1/500 |
| Rabbit anti-α-tubulin | Genetex | GTX108784 | 1/1000* |
| Rabbit anti-detyrosinated-tubulin | Millipore | AB3201 | 1/200-1/1000* Titrate antibody with first use of new lot. |
| Rabbit anti-tyrosinated-tubulin | Millipore | ABT171 | 1/500 |
| Mouse anti-centrin | Millipore | 04-1624 | 1/1000 |
| Goat 488 anti-rabbit | Thermofisher | A11008 | 1/500 |
| Goat 594 anti-rabbit | Thermofisher | A11012 | 1/500 |
| Goat 594 anti-mouse | Thermofisher | A11005 | 1/500 |
| Goat 488 anti-mouse | Thermofisher | A11001 | 1/500 |
| Vibratome | Vibratome | 1500 | |
| Forceps | World Precision Instruments | 555227F | |
| 100 mm petri dish | Cell treat | 229693 | |
| 35 mm petri dish | Cell treat | 229638 | |
| 50 ml falcon tube | Fisher | 14-432-22 | |
| Woven nylon mesh 70 um | Amazon.com | B0043D1SZG | |
| Micropipette | Gilson | F123602 | |
| Glass pipette | Fisher | NC-999363-9 | |
| Aquarium sealant | Amazon.com, by MarineLand | Silicone Sealer 1 oz (Tube) | |
| Ring stand | Fisher | 14-675BO | |
| Microbore PTFE Tubing, 0.022"ID | Cole-Parmer | WU-06417-21 | |
| Modeling clay | Amazon.com | Sargent Art 22-4000 | Any wax or oil based non-toxic modeling clay will suffice |
| Clamp | Fisher | 02-215-466 | |
| 60ml syringe | Fisher | 14-820-11 | |
| Embryo medium (E3) | 34.8 g NaCl 1.6 g KCl 5.8 g CaCl2·2H2O 9.78 g MgCl2·6H2O To prepare a 60X stock, dissolve the ingredients in H2O, to a final volume of 2 L. Adjust the pH to 7.2 with NaOH. Autoclave. To prepare 1X medium, dilute 16.5 mL of the 60X stock to 1 L. | ||
| Blocking Solution | 50 ml TBS-NP-40 2.5 ml normal goat serum 1 g BSA 625 µl Triton-X | ||
| TBS-NP-40 (pH 7.6) | 155 mM NaCl 10 mM Tris HCl 0.1% NP-40 | ||
| 2x MAB (pH6.4) | 160 mM KPIPES 10 mM EGTA 2 mM MgCl2 | ||
| Commercial 3-D Image processing Software | PerkinElmer | Volocity (V 6.2) | |
| Dry block heater | VWR | 12621-108 | Used as a hot plate to melt agarose in Protocol 1. |
| Dissecting Microscope | Leica | MZ12 | |
| Confocal Microscope | Leica | SP5 | |
| Flat embedding mold | emsdiasum.com | BEEM 70904-01 | |
| Public domain image processing software | NIH | ImageJ (V 1.5) | |
| * Success varies by lot number | |||
참고문헌
- Akhmanova, A., Steinmetz, M. O. Tracking the ends: a dynamic protein network controls the fate of microtubule tips. Nat Rev Mol Cell Biol. 9 (4), 309-322 (2008).
- Conde, C., Cáceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nat Rev Neurosci. 10 (5), 319-332 (2009).
- Kaverina, I., Straube, A. Regulation of cell migration by dynamic microtubules. Semin Cell Dev Biol. 22 (9), 968-974 (2011).
- Kollman, J. M., Merdes, A., Mourey, L., Agard, D. A. Microtubule nucleation by γ-tubulin complexes. Nat Rev Mol Cell Biol. 12 (11), 709-721 (2011).
- Howard, J., Hyman, A. A. Growth, fluctuation and switching at microtubule plus ends. Nat Rev Mol Cell Biol. 10 (8), 569-574 (2009).
- Schulze, E., Kirschner, M. Dynamic and stable populations of microtubules in cells. J Cell Biol. 104 (2), 277-288 (1987).
- Gundersen, G. G., Kalnoski, M. H., Bulinski, J. C. Distinct populations of microtubules: Tyrosinated and nontyrosinated alpha tubulin are distributed differently in vivo. Cell. 38 (3), 779-789 (1984).
- Li, R., Gundersen, G. G. Beyond polymer polarity: how the cytoskeleton builds a polarized cell. Nat Rev Mol Cell Biol. 9 (11), 860-873 (2008).
- Asakawa, K., Kawakami, K. A transgenic zebrafish for monitoring in vivo microtubule structures. Dev Dyn Off Publ Am Assoc Anat. 239 (10), 2695-2699 (2010).
- Wühr, M., Tan, E. S., Parker, S. K., Detrich, H. W., Mitchison, T. J. A model for cleavage plane determination in early amphibian and fish embryos. Curr Biol CB. 20 (22), 2040-2045 (2010).
- Tran, L. D., Hino, H., et al. Dynamic microtubules at the vegetal cortex predict the embryonic axis in zebrafish. Development. 139 (19), 3644-3652 (2012).
- Butler, R., Wood, J. D., Landers, J. A., Cunliffe, V. T. Genetic and chemical modulation of spastin-dependent axon outgrowth in zebrafish embryos indicates a role for impaired microtubule dynamics in hereditary spastic paraplegia. Dis Model Mech. 3 (11-12), 743-751 (2010).
- Yoo, S. K., Lam, P. -Y., Eichelberg, M. R., Zasadil, L., Bement, W. M., Huttenlocher, A. The role of microtubules in neutrophil polarity and migration in live zebrafish. J Cell Sci. 125 (23), 5702-5710 (2012).
- Andersen, E. F., Halloran, M. C. Centrosome movements in vivo correlate with specific neurite formation downstream of LIM homeodomain transcription factor activity. Development. 139 (19), 3590-3599 (2012).
- Lee, S. -J. Dynamic regulation of the microtubule and actin cytoskeleton in zebrafish epiboly. Biochem Biophys Res Commun. 452 (1), 1-7 (2014).
- Bulinski, J. C., Gundersen, G. G. Stabilization and post-translational modification of microtubules during cellular morphogenesis. BioEssays. 13 (6), 285-293 (1991).
- Magiera, M. M., Janke, C. Chapter 16 - Investigating Tubulin Posttranslational Modifications with Specific Antibodies. Methods Cell Biol. 115, 247-267 (2013).
- Hong, E., Jayachandran, P., Brewster, R. The polarity protein Pard3 is required for centrosome positioning during neurulation. Dev Biol. 341 (2), 335-345 (2010).
- Westermann, S., Weber, K. Post-translational modifications regulate microtubule function. Nat Rev Mol Cell Biol. 4 (12), 938-948 (2003).
- Jayachandran, P., Olmo, V. N., et al. Microtubule-associated protein 1b is required for shaping the neural tube. Neural Develop. 11, 1(2016).
- Nam, S. -C. Role of Tau, a microtubule associated protein, in Drosophila photoreceptor morphogenesis. Genes N Y N 2000. 54 (11), 553-561 (2016).
- Abal, M., Piel, M., Bouckson-Castaing, V., Mogensen, M., Sibarita, J. -B., Bornens, M. Microtubule release from the centrosome in migrating cells. J Cell Biol. 159 (5), 731-737 (2002).
- Delgehyr, N., Sillibourne, J., Bornens, M. Microtubule nucleation and anchoring at the centrosome are independent processes linked by ninein function. J Cell Sci. 118 (8), 1565-1575 (2005).
- Manning, J. A., Lewis, M., Koblar, S. A., Kumar, S. An essential function for the centrosomal protein NEDD1 in zebrafish development. Cell Death Differ. 17 (8), 1302-1314 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn Off Publ Am Assoc Anat. 203 (3), 253-310 (1995).
- Beck, A. P., Watt, R. M., Bonner, J. Dissection and Lateral Mounting of Zebrafish Embryos: Analysis of Spinal Cord Development. JoVE J Vis Exp. (84), e50703(2014).
- FÖldes-Papp, Z., Demel, U., Tilz, G. P. Laser scanning confocal fluorescence microscopy: an overview. Int Immunopharmacol. 3 (13-14), 1715-1729 (2003).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - IJ 1.46. , Available from: https://imagej.nih.gov/ij/docs/guide/ (2010).
- Z-functions - ImageJ. , Available from: https://imagej.net/Z-functions (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유