Method Article
시간 경과 브라이트 실체 현미경으로 Zebrafish의 애벌레에서 조직 복구를 캡처
요약
We present a protocol for capturing the dynamics of zebrafish larval tail fin regeneration on a whole-tissue scale using brightfield-based stereomicroscopy. This technique enables capturing the regeneration dynamics with single cell resolution. This methodology can be adapted to any stereomicroscope equipped with a CCD camera and time-lapse software.
초록
The zebrafish larval tail fin is ideal for studying tissue regeneration due to the simple architecture of the larval fin-fold, which comprises of two layers of skin that enclose undifferentiated mesenchyme, and because the larval tail fin regenerates rapidly within 2-3 days. Using this system, we demonstrate a method for capturing the repair dynamics of the amputated tail fin with time-lapse video brightfield stereomicroscopy. We demonstrate that fin amputation triggers a contraction of the amputation wound and extrusion of cells around the wound margin, leading to their subsequent clearance. Fin regeneration proceeds from proximal to distal direction after a short delay. In addition, developmental growth of the larva can be observed during all stages. The presented method provides an opportunity for observing and analyzing whole tissue-scale behaviors such as fin development and growth in a simple microscope setting, which is easily adaptable to any stereomicroscope with time-lapse capabilities.
서문
The ability of an organism to orchestrate tissue repair processes after injury is crucial for its survival 1. While all animals have the capacity to heal their wounds, the extent to which tissues regenerate differs greatly among species. Vertebrate species such as zebrafish, salamanders and frog tadpoles have the remarkable ability to regenerate lost tissues, including their appendages, portions of their eyes, heart, and central nervous system 2-4. Mammalian species, such as the African spiny mouse and rabbits, are capable of regenerating holes in their pinnae 5-7, and humans and mice regenerate portions of their liver as well as their digit tips during fetal and juvenile stages 8-12. Although it is not well understood yet why and how certain species regenerate tissues more effectively than others, the presence of similar genetic pathways suggests that these mechanisms may lie dormant in species without great regeneration potential 13,14. Thus elucidating tissue repair and regeneration mechanisms in species with satisfactory regeneration outcomes will benefit regeneration in humans.
We have chosen the larval zebrafish tail fin as a paradigm to demonstrate its regeneration with time-lapse brightfield stereomicroscopy. The zebrafish larval tail fin is anatomically simple as compared to the more complex adult structures, consisting of a two-layered, infolded epithelium with somatosensory axons innervating the skin that surrounds medially located mesenchymal cells 15. Despite the anatomical differences, larval tail fin regeneration is somewhat comparable to adult fin regeneration in terms of the molecular signatures and the outgrowth responses 16,17. As compared to the adult fin, imaging larval tail fin regeneration has however several advantages: 1) larval fin regeneration is completed within just 2-3 days 16, 2) larvae can be mounted in low-melt agarose, and 3) larvae do not require feeding until ~ 5 days post fertilization (dpf) due to the presence of the yolk sac. This makes zebrafish larvae ideal for observing tissue repair dynamics in vivo.
The presented method enables the capture of detailed dynamics underlying the early processes of fin regeneration. Many studies have utilized fluorescence-based confocal microscopy to study cellular and subcellular biological processes in embryonic and larval zebrafish. Sophisticated confocal imaging setups are however often not accessible to everyone and highly expensive as compared to other imaging techniques. In contrast, the presented methodology utilizes a Discovery V12 stereomicroscope equipped with Axiovision software and a time-lapse module, thus providing a more affordable alternative to expensive imaging equipment to examine tissue behaviors. We demonstrate that this method can be utilized for imaging tissue regeneration with high temporal resolution at a minimal cost. The implications for this method could extend beyond basic biology to advance mammalian regeneration studies using organ cultures, for therapeutic development through pharmacological and genetic screens, and it can serve as a teaching tool in a classroom setting.
프로토콜
제브라 피쉬 (진주층의 변형) 설립 프로토콜에 따라 사육 제기되었다. 모든 노력이 마취 및 안락사에 대한 1 mM의 Tricaine 0.4 mM의 Tricaine을 사용하여 고통을 최소화하기 위해 만들어졌다. 해당위원회 (MDI 생물 실험실 동물 코어 IACUC 번호 13 ~ 20)에 의해 승인 된 제브라 피쉬 배아 및 유충의 동물 관행에 엄격한에 따라 처리되었다. 본 연구는 프로토콜 # 14-09에서 국립 인간 게놈 연구소 동물 관리 및 사용위원회, MDIBL 기관 보증 # 1 A-3562-01에 의해 승인되었다.
주 : 다음 단계에 요약되어 애벌레 제브라 피쉬의 지느러미 재생을 캡처 이미지를 만드는 절차를 :
애벌레 단계에 제브라 피쉬의 1. 제기
- 계란을 수집하고 0.00004 %의 메틸렌 블루 보충 탈 이온수에 0.03 % 인스턴트 오션 염을 포함하는 100 × 25mm 페트리 접시에 약 50 알을 놓습니다. 28.5 ° C 배양기에서 O / N을 품어. <리> 다음 날 아침 유리 피펫 죽은 배아를 제거하고 탈 이온수 (라고 배아 매체)의 0.03 % 즉시 바다 소금 스트레이너에 계란을 씻어.
- SUP> 접시에 신선한 배아 매체를 추가합니다. 착색 된 균주를 사용하는 경우 PTU 멜라닌 및 유생 따라서 착색을 방지하는 바와 같이, 임의로, 0.2 mM의 1- 페닐 -2- 티오 우레아 (PTU)를 추가한다. 배아가 더 이일 게시물 수정 또는 기타 원하는 애벌레 단계까지 인큐베이터에서 개발 보자.
주 : 바람직한 될 수도있다 링거 18 행크스 18, 19 E2, E3 (20), (21) 및 Danieau 매체.
이미징 회의소 2. 준비
- 방법 1 : PVC 또는 테프론 튜브로 만든 영상 챔버 (그림 1)
참고 :이 방법은 조개와 아담스 (1998) (22)과 유사하다.- 25mm 외부와 하드웨어 상점에서 음용수 등급 플라스틱 또는 테플론 튜브 획득다 20mm 내경. 양쪽에 편평한 표면과 약 10mm 두께의 고리를 만들 튜브를 잘라. 가장자리를 부드럽게하기> 200 사포를 사용합니다.
- 따뜻한 물과 70 % 에탄올로 반지를 청소하고 그들에게 자연 건조를 할 수 있습니다.
- 피펫 팁과 함께, 링의 절반에 실리콘 그리스를 적용하고 75mm X 25mm 유리 커버 슬립에 반지를 연결합니다. 또한, 실리콘 그리스 대신 피펫 팁 가득 3 ML의 주사기를 사용합니다.
참고 :이, 3 ML의 주사기로 실리콘 그리스를 삽입 먼저 30 ML의 주사기에 실리콘 그리스를 추가하고 3 ML의 주사기를 채우기이를 사용하는 어렵 기 때문에.
- 방법 2 : 영상 실 등의 페트리 접시의 준비.
- 뚜껑 (그림 2A)에 부착 된 유리 커버 슬립 35 또는 60 mm 직경의 배양 접시를 획득. Distel & Koester는 (2007) (23)의도 3에 도시 된 바와 같이 선택적으로, H, 충분히 작은 개구부를 드릴오래된 작은 페트리 접시의 뚜껑에 커버 슬립과 3 ML의 주사기와 외부에 실리콘 그리스를 적용합니다. 깨끗한 피펫 팁을 사용하여 조심스럽게 외부 (그림 2B)에 원형 또는 원하는 두께의 사각형 커버 슬립을 연결합니다.
- 아가로 오스 단단히 이미징 절차를 수행하는 동안 부착 숙박을 장착에 사용되는 것을 보장하기 위해, 반지 안쪽 미세 플라스틱 메쉬를 연결합니다. 우선, 각 미세 가위를 사용 내륜 직경의 크기로, 철물점 수득 윈도우 화면으로 이루어지는 메시를 잘랐다. 그 후 메시의 중앙으로> 유충의 두 배 크기의 작은 사각형을 잘라 (도 1, 2).
- 커버 슬립과 챔버 링 (그림 1A) 사이의 인터페이스에 비 독성 실리콘 그리스의 4 개의 작은 점을 적용합니다.
- 유리 커버 슬립의 바닥에 단단히 메쉬를 연결하는 집게를 사용합니다.
3. 설치 및 사전 INJ의 영상어인 유충 (이 단계는 선택 사항입니다)
참고 : 지느러미 재생 후 절단 평면 제브라 피쉬 애벌레에서 인식 할 수없는 것처럼이 단계는, 절단 및 재생 핀 길이 사이의 비교에 적합합니다.
- 시편의 고정을위한 배아 매체에서 0.5 ~ 1.2 % 낮은 용융 아가로 오스 솔루션을 준비합니다.
- 전자 레인지에서 아가로 오스를 가열하고 가열 블록에 42 ° C로 미리 예열되어 1.5 ml의 튜브에 액체 아가로 오스를 전송합니다.
- 뜨거운 아가로 오스는이 온도에서 몇 주 동안 유지 될 수 42 ° C로 냉각 보자. 이 동물에 해가 될 수있는 바와 같이, 아가로 오스 위 42 ° C에 유충을 피펫 팅하지 않도록하십시오.
- 직경 60mm 페트리 접시에 배아 배지에서 0.4mm의 Tricaine (pH가 7) 10 ㎖을 사용하여 여러 유충 마취. Zebrafish의 책 조리법 (18)에 따라 Tricaine을 준비합니다.
- 99 1000 희석 : 대안 적으로, 한 10 ㎖를 사용하여60mm 직경 페트리 접시에 % 2- 페녹시 에탄올. 진행하기 전에 자신의 터치 반응을 평가하기 위해 출장 microloader 피펫 팁과 유충을 들여다 봅니다. 만 응답하지 유충을 사용합니다.
- 유리 파스퇴르 피펫을 사용하여 42 ° C 아가로 오스 솔루션으로 하나의 유충을 전송합니다. 그렇지 않으면 아가로 오스가 너무 희석 응고되지는 않습니다, 아가로 오스에 과도한 액체를 전송하지 마십시오.
- 피펫에 남아있는 액체를 버리고 작은 페트리 접시 (35 또는 60 mm 직경)에 아가로 오스의 한 방울과 유충을 전송합니다. 꼬리 지느러미의 이미징 측면에 유충을 배치합니다.
- 아가로 오스가 응고 허용합니다. 플라스틱 피펫 팁과 아가로 오스를 평가; 너무 액체의 경우 팁 아가 침수된다. 아가로 오스가 확정되면, 작은 들여 쓰기 피펫 팁과 접촉시 볼 수 있습니다. 응고에 이어, Tricaine 솔루션을 추가하고 시간 경과 영상 나중에 사용되는 실체를 진행합니다.
주 :이 단계는 또한 배아 배지에서 1.5 % 아가 로스 코팅 페트리 접시에 마취 된 유충을 배치함으로써 수행 될 수있다. - 시간 경과 소프트웨어 실체 현미경을 사용합니다. 시간 경과 영상 나중에 사용되는 적절한 객관적이고 배율을 선택합니다. 여기에, 실체 현미경에 3.5 X, 16mm 작동 거리 대물 렌즈를 사용합니다. 원하는대로, 대안 현미경의 대물 렌즈를 사용하지만 이미지를 만드는 절차시 발생할 수있는 XY 드리프트와 지느러미의 성장을 고려하여 적절한 배율을 선택합니다.
- 현미경에 카메라 탐지 모드를 선택합니다.
- 소프트웨어에서 화면의 애벌레를 보려면 '라이브'모드를 선택합니다.
- 자동으로 밝기를 감지하는 '등록 정보'창을 엽니 다.
- 수동 현미경 트랜스 조명 기지에서 명암을 조정합니다.
- 시야에서 유충을 이동 및 배경 없음을 최소화하기 위해 음영 보정 기능을 선택이세.
- 다시보기의 필드에 유충을 놓고 스냅 샷을. 이미지를 저장합니다.
- 먼저 머리에서 아가로 오스를 긁어 유충에서 아가로 오스를 제거합니다. 유충 부드럽게 덮인 microloader 피펫 팁 또는 곤충 핀 남아있는 아가로 오스에서 떨어져 머리를 당겨 아가로 오스에서 미끄러 수있는 방법.
- 유리 파스퇴르 피펫으로 신선한 Tricaine 용액에 유충을 전송합니다.
4. 절단 수술 분석
- 배아 매체를 이용하여 1.5 % 아가 용액을 준비하고, 페트리 접시에 얇은 층을 붓는다. 아가로 오스가 응고 보자.
- 실체 현미경 하에서 응고 아가로 오스에 유충 옆으로 배치하고 약간의 압력 (그림 3A)와 23 G 주사기 바늘 꼬리 지느러미를 절단.
5. 시간 경과 이미징을위한 유충 설치
- 3.5 (그림 3B) - 단계 3.1에 설명 된대로 진행합니다.
- , 영상 실 링 (2.1 단계)에 유충을 포함하는 42 ° C에서 0.5 ~ 1.2 % 액 아가로 오스의 드롭을 전송 유충의 방향과 아가로 오스 응고 수 있습니다. Tricaine 솔루션 반지를 입력합니다. 페트리 접시 챔버 (2.2 단계) 사용하는 경우 또는, 뚜껑 커버 슬립 위에 유충을 탑재하고 Tricaine 솔루션 뚜껑을 입력합니다.
- 발생하는 적절한 상처 치유 또는 조직 재생을 허용하려면, 조심스럽게 출장 microloader 피펫 팁 또는 곤충 핀을 사용하여 말초 꼬리 지느러미를 둘러싼 아가로 오스를 긁어. 핀 반복 (그림 3C)를 다치게하지보십시오.
- 아가로 오스 제거가 포함 된 Tricaine 솔루션을 가만히 따르다와 신선한 Tricaine 솔루션을 실 반지를 입력합니다.
- 챔버 링의 상단에 실리콘 그리스를 적용하고 75mm X 25mm 유리 슬라이드를 연결합니다. 그들이 시야 이미징에 방해가 될 수 있고, 시간이 지남에 유충을 건조하는 바와 같이, 챔버에 공기 주머니를 피하기 위해보십시오.
- 페트리 접시 등을 사용하는 경우촬상 챔버는 하부 챔버의 상부 림에 실리콘 그리스를 도포하고 Tricaine 용액과 하부 챔버를 채운다. 조심스럽게 뚜껑 Tricaine 솔루션을 가만히 따르다하고 공기 주머니를 방지하기 위해 약간의 각도로 아래쪽 챔버의 Tricaine 용액에 유충을 담가 뚜껑을 뒤집습니다. 챔버는 실리콘 그리스로 인해 봉인됩니다.
6 시간 경과 영상
- 23, 24 (그림 4) 현미경 주위 배양 챔버를 .Place과 열을 켜에 기술 된 바와 같이 가열 배양 챔버를 조립합니다. 20 분 또는 온도가 안정 될 때까지 - 10 28 ° C의 온도를 조정합니다.
- 가열 된 배양 챔버의 전면을 열고 목표를 향해 위로 향하게 커버 슬립과 현미경 스탠드에 영상 실을 배치합니다.
- 시야의 2/3이 비어 유지하는 방식으로 애벌레 핀을 배치합니다. 이것은 캡처 보장유충의 위치를 변경하지 않고 성장과 촬상 절차의 과정을 통해 핀의 재생.
- 이전 시야 강도 또는 아가로 오스의 잠재적 인 변화의 변화를 방지하기 위해 시간 경과 기록 작업을 시작하기 30 분 ~ 28 ° C에 탑재 된 유충을 조정합니다. 또한, 짧은 조정 시간 후 영상을 시작하는 미리 예열 버퍼를 사용한다.
- 시간 경과 기록 작업을 설정하려면를 AxioVision 소프트웨어의 6D 다차원 취득 창을 열고 Z-스택과 시간 경과 옵션을 선택합니다.
- Z-스택 탭과 슬라이스 모드에서) 선택, 슬라이스 두께를 선택하고 시작 / 정지 모드를 선택합니다.
- 스택의 상부 및 하부 위치를 정의한다.
- 경과 탭에서, 간격 및 동영상의 기간을 선택하고 시작 버튼을 누르면 동영상을 시작한다. 우리는 30 분 간격으로 충분하며,이 간격은 과도한 데이터를 생성하지 않는 것으로 나타났습니다; 그러나 shorteR 간격이 사용될 수있다.
- 유충은 사전 조정되지 않은 경우 첫 번째 시간 동안 위치 및 z 스택 크기를 확인합니다. 필요한 경우 유충이 이동 한 수 있으므로, 하루 만에 다시 유충의 위치를 변경.
- 시간 경과 기록 작업의 끝 부분에 파일을 저장하고 후 처리 및 Imaris 25 오픈 소스 소프트웨어 패키지 이미지 J (26)와 피지 (27)로 사용 가능한 이미지 분석 소프트웨어를 사용하여 정량화를 진행합니다.
7. 데이터 분석
- 지느러미의 길이를 결정.
- 이미징 소프트웨어에서 저속 동영상을 열고 소프트웨어 성능을 향상시키기 위해 독점적 인 파일 포맷의 파일을 저장한다.
- 예상 스택 개별 섹션을 표시하는 직교 뷰를 선택합니다. 드리프트 보정의 경우, 피지 메뉴에서, 플러그인, 다음 등록하고, '올바른 3D 드리프트'를 선택합니다. 이 피지 창을 열고 드리프트 보정을 수행합니다. 옳은Imaris 명소 함수의 회전 드리프트. 또한, 이미지 J의 StackReg과 TurboReg 플러그인을 설치하고 피지를 가져옵니다. StackReg 플러그인에서 원하는 변환 알고리즘을 선택합니다.
- 거리 (예를 들면, 상처 직경 또는 지느러미 길이)를 측정하기 위해, 왼쪽 상단 도구 모음에서 '추가 새로운 측정 포인트'옵션을 선택합니다.
- 왼쪽 하단 메뉴에서 '눈에 보이는 통계 값의 구성 목록'에서 통계 값을 표시 할 선택합니다.
- 설정 탭에서 '라인 모드'에서 '쌍 (AB, CD ...)'를 선택합니다.
- 선택 '이름'과 '거리' '속성 라벨'을에서 측정 라인 옆에 점 A와 B 사이의 거리를 표시합니다.
- '편집'모드로 전환하고, 척색의 끝에서 첫 번째 점을 선택 SHIFT 버튼을 누른 상태. 이어서 원위 핀 여백 번째 포인트를 선택하기 위해 동일한 구성을 사용한다.
- '통계'탭에서 표시하고 이미지의 거리를 내보낼 수있는 오른쪽 하단에있는 디스크 버튼 (모두 내보내기)를 선택합니다.
- 오른쪽 이미지 아래 슬라이더를 이동하여 선택된 시점의 측정을 반복한다. 대신 새로운 측정점을 생성 이전 것들 먼저 마우스 왼쪽 버튼 포인트를 선택하고 동시에 새로운 위치에서의 시프트 및 왼쪽 마우스 버튼을 눌러 다른 장소로 옮겨 질 수있다.
- 대안 측정점 옵션, 거리를 측정하는 슬라이스 뷰어를 이용한다. 슬라이스 뷰 모드에서 원하는 위치로 이동하고 마우스 왼쪽 버튼으로 제 1 및 제 2 위치를 클릭합니다. 거리가 표시됩니다. 이 옵션은 그러나 데이터 수출을 허용하지 않습니다.
- ImageJ에의 지느러미 길이와 면적을 결정.
- .zvi 파일 형식을 인식하는 플러그인을 사용하여 ImageJ에에서 시간 경과 영화를 엽니 다. 또한, 숨어에서로드ickTime 파일이나 TIFF 순서.
주 : 비 압축 TIFF 파일 형식을 사용하는 경우, 화상 사이즈가 지정 될 필요가 없다. - 파일 정보없이 다른 파일 형식을 열 경우, 먼저 이미지를 거리 단위를 정의하는 '분석'메뉴에서 '설정 규모'를 선택합니다. '픽셀의 거리'에 '집합 스케일 메뉴'형, 화소 값에 대한 '알려진 거리'에 입력 이하 (이는 화상에 가하고 스케일 바 화소 수를 측정함으로써 얻을 수있다 다음) 결과를 얻기 위해 측정을 클릭하고 '길이의 단위'(일반적으로 'μm의'). 그런 다음 확인을 클릭합니다.
- 핀 영역 측정 도구 모음의 '프리 핸드 선택'도구를 선택하고 마우스 왼쪽 버튼을 누르고 아래로 동안 핀의 윤곽을 따라 그려 핀 영역을 간략하게 설명하십시오. 지느러미 길이 측정을 위해 '스트레이트'줄 도구를 선택하고 수 원하는 점 사이에 선을 그립니다측정.
- 핀의 면적과 길이를 표시하는 '분석'에서 '측정'옵션을 클릭합니다. 영화의 여러 시점에 대한 필요한만큼 자주이 단계를 반복합니다.
- .zvi 파일 형식을 인식하는 플러그인을 사용하여 ImageJ에에서 시간 경과 영화를 엽니 다. 또한, 숨어에서로드ickTime 파일이나 TIFF 순서.
- 데이터를 통계 소프트웨어를 수 사용하는 것은 그래픽으로 표시 될 수있다.
결과
제시된 기술은 절단에 대한 응답으로 조직의 수리 역학을 규명하는 것이 적합하다. 영화는 지느러미 절단 처음에 존재하는 액틴 마이 오신 케이블을 통해 수축을 특징으로하는 지갑 문자열 효과, 트리거 것을 보여 28 핀을 배 (그림 5를, B). 부수적으로, 세포는 상처 (동영상 참조)에서 압출된다. 수축 따라서 가능성이 세포 사멸을 받아야하는 운명 세포를 추방 할 수있는 수단이 될 수있다. 우리의 결과는 더 지느러미 재생은 약 14 시간 포스트 절단 될 때까지 시작하지 않는 반면 (그림 5C 절단 다음 36 시간의 시간 과정을 통해 지느러미 길이와 면적으로 측정 된 유충의 발육 성장이 독립적으로 재생 (동영상)가 발생 것을 보여 , D). 1.5 일 후 총 회생 핀 성장은 원래 핀 길이 (도 5E)의 약 60 %였다. 함께 찍은, 이러한 결과는 절단의 TR을 보여 핀 수축, 상처, 및 시간적으로 지연된 응답에서 재생 세포의 압출 iggers. 압출 가능성 세포 세포 사멸을 겪는 향하는 동안, 이러한 세포의 성질은 더 명확하게 될 필요가있다.

그림 1. 이미징 챔버 링 어셈블리
표시됨 (A)은 실리콘 그리스로 커버 슬립에 부착되는 플라스틱 링이다. 플라스틱 메쉬 실리콘 그리스를 4 개의 작은 도트와 챔버의 내부에 부착된다. (B) 장착 유충을 포함하는 챔버 Tricaine 용액으로 채우고 유리 슬라이드는 상부에 부착된다. (C) 2 일 된 애벌레 (화살표) 메쉬 관련하여 크기를 묘사하기 위해 더 높은 배율로 표시됩니다 탑재."_blank">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 영상 실 어셈블리 배양 접시에서 만든. 표시됨 (A)는 유리 커버 슬립에 부착 된 플라스틱 메쉬 상업용 유리 상부 바닥 유리 페트리 접시. 표시됨 (B)은 뚜껑 및 실리콘 그리스로 외부에서 부착 된 커버 슬립에 뚫린 구멍에 자기 구성 페트리 접시 챔버이다. 메쉬 및 유충 Tricaine 용액을 포함하는 챔버 내부에 장착된다. 챔버를 밀봉하기 위해, 실리콘 그리스가 바닥 챔버와 연결된 상단 뚜껑의 상단, 외부 테두리에 적용된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

절단 및 이미징을위한 유충의 설치 3. 계획을 그림. (A) 절단의 경우, 아가로 오스 코팅 된 배양 접시에 마취 유충을 놓고 주사기 바늘로 꼬리 지느러미를 절단. 취부 (B)가, 42 ° C 액체 아가로 채워진 1.5 ㎖의 튜브에 전송 피펫으로 유충을 전송하고 촬상 챔버로의 유충을 포함하는 드롭 피펫 물고기의 방향 및 배아 배지로 오스 고형화 커버. (C) 출장 microloader 피펫 팁 또는 유사한 도구를 사용하여 꼬리 지느러미에서 아가로 오스를 긁어와 신선한 매체와 배아 매체를 교체합니다. (D) 영상 실체 현미경 아래 꼬리 지느러미. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

4. 자기 구성 가열 배양 챔버를 그림. 표시됨 (AC)는 판지, 버블 랩과 벨크로로 만든 가열 배양 챔버입니다. (원래 닭고기 달걀 배양을 위해 설계) 유선 돔 히터 알루미늄 테이프를 사용하여 챔버에 부착되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
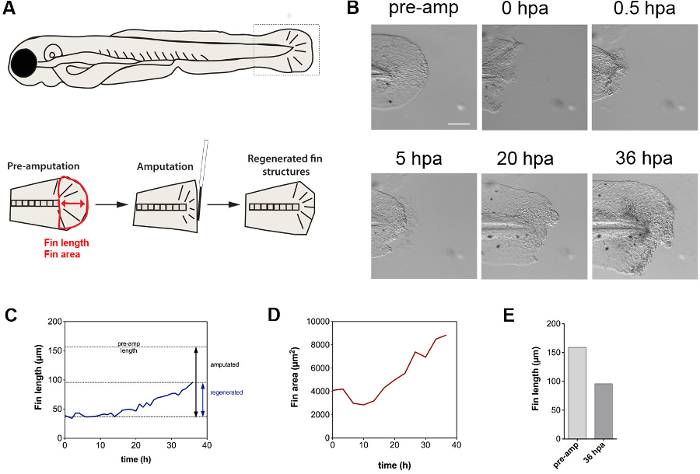
5. 핀 재생 역학 그림. 이용 꼬리 지느러미 절단 분석과 정량 방법 (A) 방식은 핀 길이 (빨간색 화살표)과 지역 (지느러미의 붉은 개요)를 결정합니다. (B) 꼬리 지느러미 절단는 처음에 지느러미의 수축, REGE 다음 트리거nerative 조직 파생물. 가로 치수의 증가에 의해 입증되는 바와 같이, 핀은 또한 발달 성장을 겪는다. 표시됨 (C)는 14 ~ 고전력 증폭기에 선형 회생 성장 초기 계시 시간의 함수로서 핀 길이이다. 핀 영역 (D) 부량은 초기에 핀의 수축에 기인 할 수있는 크기로 감소 보여준다. ~ 14 시간 후, 선형 속도로 핀 크기가 증가. 절단하기 전에 지느러미 길이의 36 시간 후 (E) 비교 ~ 60 %의 재성장을 보여줍니다. 스케일 바 : 100 μm의 약어 : 프리 앰프, 미리 절단; 시간은 절단, 고전력 증폭기를 게시; 회생, 재생; 앰프, 절단는 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
영화 . 36 시간 경과 위에 핀 재생시간. 표시됨은 재생의 과정 동안 2.5 일 이전 유충의 꼬리 지느러미입니다. 시작 30 분 후 절단 회생 성장은 3.5 배 대물 렌즈를 사용하여 실체 현미경에 30 분 간격으로 이미징된다.
토론
제시된 방법은, 시야의 실체에 생체 시간 경과 이미징 제브라 피쉬의 유충을 살고있는 비교적 간단한 셋업을 사용하여 상처 치유 및 조직 재생을 관찰 할 수 있습니다. 이 절차는 결과를 최적화 우리가 테스트 한 특정 중요한 측면이 필요합니다 : 지속적으로 성장하는 애벌레 제브라 피쉬의 성장 장애를 최소화 한) 저 아가로 오스 농도 (~ 0.5 %), 2) 핀 주위에 아가로 오스의 제거는 중요하지 않습니다 치유 과정을 불명료하게, 3) 플라스틱 메쉬 아가 트래핑 절차 내내 안정 위치에서 아가로 오스 및 동물을 유지하고, 4) 유충의 생존에 필수적인 적정 온도 제어 환경. 우리는 판지 위에 테이핑 버블 랩을 이용하는 가열 배양실 (23, 24), 및 기간 동안 최소한의 변동과 온도 및 적절한 공기 순환을 제어하는 유선 돔 히터를 적응이미지를 만드는 절차. 이 간단하고 비용 효율적인 챔버 어떤 현미경에 맞게 제조 할 수있다. 유사한 가열 배양 챔버는 이미징 마우스와 병아리 개발 24,29 활용되고있다.
우리는 미리 절단 애벌레 미리 절단 이미지를 장착하는 것이 좋습니다, 절단을 위해 탈착 및 시간 경과 이미징 다시 마운트. 이 최종 영상 실에서 하나의 단계에서 다음 단계를 수행 가능하지만, 우리의 경험에서 우리는 조직을 눈물 깨끗한 절단을 초래하지 않는 유리 커버 슬립에 꼬리 지느러미를 절단하는 것은, 최적이 아닌 것을 발견했다. 주사기 바늘을 이용하여 아가로 오스 계 절단 방법은 원래 카와카미 동료 (2004) 16에 의해 설명되고, 우리의 경험에서, 또한 절단을 수행하는 것이 적합했다. 따라서, 우리가 제시 단계 오히려 복잡한 일련의 잘 정당화하고 최적의 재생 결과를 보장한다.
우리는 larv을 보여 주었다2 DPF에서 알 제브라 피쉬는 아가로 오스와 Tricaine 솔루션 1.5 일 이미지화 할 수 있습니다. 우리는 촬상 제시된 기간 동안 시험편의 건강에 지장이없는 인스턴트 바다 염으로 제조 최적화 Tricaine 산도 (pH 7이었으며) 용액을 사용 하였다. 우리는 이전에 그러나 또한 Danieau 매체에 Tricaine을 사용하여 적어도 이일 (30) 공 초점 현미경에 애벌레 제브라 피쉬 DPF 2.5의 시간 경과 영상을 허용하는지 보여 주었다. 따라서, 최적의 버퍼 상태 유생 건강 및 이미징의 길이를 연장 할 수있다. 대안 적으로, 더 낮은 농도 Tricaine 우리가 아니라 적어도 60 시간 동안 28 ° C에서 유충 및 성체 단계에서 용납 발견 마취 또는 2- 페녹시에 사용될 수있다.
지느러미 재생의 결함을 방지하기 위해, 우리는 이미징 전에 꼬리 지느러미에서 아가로 오스를 제거했습니다. 우리의 데이터는 1.5 일 이내에 지느러미가 약 60 %로 거듭나 있음을 보여줍니다. 이 회복 속도 3 일을 정의 이전 연구와 일치16 DPF 6 제브라 피쉬의 유충 최대의 꼬리 지느러미 재생을위한 평균 시간이야. 아가 로스에 다른 방법은 그러나 영상의 물고기를 탑재하는 데에 이용 될 수있다. 예를 들어, 얇은 플라즈마는 빛 시트 현미경 (32) 추천 된 31 플루오르 에틸렌 프로필렌 (FEP) 튜브 메틸 셀룰로오스로 코팅 매우 낮은 아가로 오스 농도 (0.1 %)로 채워진를 혈전 우리의 제시 방법에 적합 할 수있다. 그들은 시편 인해 이러한 미디어의 응고의 부족으로 챔버의 하단에 장착해야하지만, 우리는, 메틸 0.1 % 아가 로스를하지 않는 것이 좋습니다. 메틸 매우 높은 농도는 또한 우리의 경험을 바탕으로 공기 주머니를 생성하고, 이러한 이미지를 만드는 절차를 방해 할 수 있습니다. 이들 배지는 하부 챔버를 사용하여 바람직한 경우, 대물 렌즈와 표본 사이에 적절한 작동 거리가 존재하는 것이 중요하다. 그것은 m 주목해야한다이 애벌레 건강 (32)을 방해 할 수 있으므로, 설치 매체로 에틸 셀룰로오스는, 단지 일일 최대 권장합니다.
뚜껑에 시편을 장착하는 것은 느린 중력 아래로 표류의 원인이 될 수 있습니다. 이 때문에 하나 하나의 평면 또는 최종 동영상을 조립 추출 될 수있다 초점면에있는 경우에만 이미지로 투사 할 수 있습니다 각 시점에서 이미지 여러 섹션에 좋습니다. 하부 측실에 표본을 이미지 하방 전위 드리프트를 피하기 위해 다른 방법 일 수있다. 플라즈마는 시편을 안정화 할 수있다, 따라서 외부 감싸는 층 (EVL, 주피) (31)에 충실 것 같은 플라즈마 혈전은 드리프트를 방지하는 데 유용 할 수 있습니다. 그러나, 이것은 물론 긴 유생 지브라 피쉬가 유생 건강 또는 지느러미 재생을 방해하지 않고 혈장 응고 유지 될 수있는 방법으로, 테스트를 할 필요가있다.
우리 영화가 개별 섹션을 이용하여 조립 한 (26 μm의)이미징 절차를 수행하는 동안 핀의 잠재적 인 Z-드리프트를 차지 핀 (~ 10 μm의)과의 전체 두께를 덮여 기록 Z-스택,의. 3-D 정보를 유지하기 위해, 단일 이미지로 Z-스택을 투영하는 것도 가능하다. 이것은 화상의 흐림이 발생할 수 있기 때문에, 브라이트 컨벌루션은 바람직 할 수있다. 이러한 Deconvolve 또는 Autoquant X3와 같은 소프트웨어가 이러한 목적으로 사용될 수있다. 대안 적으로, (Tadrous 33에 기재되어 있음)은 수학적 알고리즘 높은 신호 대 잡음비 (SNR)의 점 - 확산 함수를 얻기 위해 적용될 수있다. 높은 SNR을 얻기 시야 디컨 볼 루션의 주요 장애물 중 하나를 나타냅니다. 이 방법은 높은 콘트라스트와 얇은 샘플 두께가 필요하지만, 아마도 인해 감소 폭 꼬리 지느러미의 이미지에 적합 할 것입니다.
제시된 촬상 방법의 명백한 이점은 CCD 카메라를 갖춘 어떤 실체에 빠르게 적응할 수 있다는D 경과 소프트웨어 및 저비용 대안 고가 촛점 이미징 시스템을 제공한다. 이 방법은 세포 검출 용 형광을 이용하지 않는 반면, 셔터 제어 및 사후 컨벌루션 이미징 소프트웨어 (34)를위한 자동화 된 시스템을 이용하여 이러한 애플리케이션을 위해 확장 될 수있다. 이는 더 긴 시간주기에 걸쳐 단일 세포 또는 세포 내 해상도 상처 재생 및 수리 과정을 관찰 할 수 있도록한다.
광학 선명도와 쉽게 배아와 애벌레 제브라 피쉬와 함께 처리 할 수 있으며, 어떤 실체 현미경이 방법의 적응성은 교실에서 기본 척추 생물학을 가르치고에 적합합니다. 이 방법은 조직 수리 및 재생의 기초가되는 기본적인 생물학적 과정의 더 나은 이해를 학생들에게 제공 할 수 있습니다. 비슷한 방법으로 촬영 된 다른 생물학적 과정은 제브라 피쉬 배아 발달 23,34 심장이다기능 (미 출판). 이 방법은 유전자 및 약물 학적으로 조작 된 유충의 모니터링 상처 수리 및 재생을위한 가능성을 제공합니다.
공개
저자가 공개하는 게 없다.
감사의 말
We thank the MDI Biological Laboratory animal core service facility for zebrafish maintenance. Research reported in this publication was supported by Institutional Development Awards (IDeA) from the National Institute of General Medical Sciences of the National Institutes of Health under grant numbers P20GM104318 (for COBRE) and P20GM103423 (INBRE) and Department of Defense – USAMRAA (W81XWH-BAA-1) grant.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bullseye Agarose | MidSci | BE-GCA500 | |
| Low-melt agarose | Fisher BioReagents | BP1360-100 | |
| 1-phenyl-2-thiourea | Alfa Aesar | L06690 | |
| Instant Ocean Aquarium Salt | Pet store | ||
| Methylene Blue (0.1% solution) | Sigma | M9140 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | |
| 2-Phenoxyethanol | Sigma-Aldrich | 77699 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Petri Dish 60 x 15 mm | BD Falcon | 351007 | |
| Petri Dish 100 x 25 mm | BD Falcon | 351013 | |
| 5.75 inch boroschillate glass pipets | Fisher | ||
| 35 mm Glass Top Glass Bottom Dish (Glass: 0.085-0.115mm) | MatTek Corporation | D35-20-0-TOP | |
| Superfrost/Plus microscope slides | Fisherbrand | 12-550-15 | |
| Glass coverslips | Electron Microscopy Services | 72191-75 | |
| Glass coverslips | Warner Instruments | CS-18R15 | |
| Phifer Phiferglass Insect Screen Charcoal - 48" | Home Depot | ||
| High vacuum grease | Dow Corning | ||
| Microloader pipette tips 20 µl | Eppendorf | 930001007 | |
| Fine Scissors - Sharply Angled Up | Fine Science Tools | 14037-10 | |
| 3 ml Luer-Lok™ disposable syringe | BD | 309657 | |
| 60 ml Luer-Lok™ disposable syringe | BD | 309653 | |
| 23 G syringe needles | BD | 305145 | |
| Dumont #5 Forceps | Fine Science Tools | 11295-00 | |
| Equipment | |||
| LabDoctor Mini Dry Bath | MidSci | ||
| Discovery.V12 compound microscope | Zeiss | ||
| Plan Apo S 3.5X objective | Zeiss | ||
| AxioCam MRm | Zeiss | ||
| Axiovision software, Release 4.8.2SP1 (12-2011) | Zeiss | ||
참고문헌
- San Miguel-Ruiz, J. E., García-Arrarás, J. E. Common cellular events occur during wound healing and organ regeneration in the sea cucumber Holothuria glaberrima. BMC Dev Biol. 7, 115 (2007).
- Poss, K. D., Keating, M. T., Nechiporuk, A. Tales of regeneration in zebrafish. Dev Dyn. 226, 202-210 (2003).
- Akimenko, M. A., Marí-Beffa, M., Becerra, J., Old Géraudie, J. Old questions, new tools, and some answers to the mystery of fin regeneration. Dev Dyn. 226, 190-201 (2003).
- Slack, J. M. Regeneration research today. Dev Dyn. 226, 162-166 (2003).
- Seifert, A. W., et al. Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565 (2012).
- Goss, R. J., Grimes, L. N. Epidermal downgrowths in regenerating rabbit ear holes. J Morphol. 146, 533-542 (1975).
- Williams-Boyce, P. K., Daniel, J. C. Comparison of ear tissue regeneration in mammals. J Anat. 149, 55-63 (1986).
- Allan, C. H., et al. Tissue response and Msx1 expression after human fetal digit tip amputation in vitro. Wound Repair Regen. 14, 398-404 (2006).
- Borgens, R. B. Mice regrow the tips of their foretoes. Science. 217, 747-750 (1982).
- Han, M., Yang, X., Lee, J., Allan, C. H., Muneoka, K. Development and regeneration of the neonatal digit tip in mice. Dev Biol. 315, 125-135 (2008).
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Res C Embryo Today. 84, 265-280 (2008).
- Takeo, M., et al. Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232 (2013).
- Akimenko, M. A., Johnson, S. L., Westerfield, M., Ekker, M. Differential induction of four msx homeobox genes during fin development and regeneration in zebrafish. Development. 121, 347-357 (1995).
- Reginelli, A. D., Wang, Y. Q., Sassoon, D., Muneoka, K. Digit tip regeneration correlates with regions of Msx1 (Hox 7) expression in fetal and newborn mice. Development. 121, 1065-1076 (1995).
- Brien, G. S., et al. Coordinate development of skin cells and cutaneous sensory axons in zebrafish. Journal of Comparative Neurology. 520, 816-831 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231, 693-699 (2004).
- Yoshinari, N., Ishida, T., Kudo, A., Kawakami, A. Gene expression and functional analysis of zebrafish larval fin fold regeneration. Dev Biol. 325, 71-81 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Detrich, H. W., Westerfield, M., Zon, L. I. The Zebrafish: Cellular and Developmental Biology, part A. Preface. Methods Cell Biol. 100 (13), (2010).
- Dahm, N. -. V. a. . Zebrafish: A Practical Approach, Issue 975. , 303 (2002).
- Detrich, H., Westerfield, M., Zon, L. . The Zebrafish: 2nd Edition Genetics, Genomics and Informatics. , (2005).
- Concha, M. L., Adams, R. J. Oriented cell divisions and cellular morphogenesis in the zebrafish gastrula and neurula: a time-lapse analysis. Development. 125, 983-994 (1998).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Kulesa, P. M., Kasemeier-Kulesa, J. C. Construction of a Heated Incubation Chamber around a Microscope Stage for Time-Lapse Imaging. CSH Protoc. 2007, (2007).
- . Bitplane. Imaris V 6.1.0 Reference Manual. , (2008).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. . Image Processing with ImageJ. , 36-42 (2004).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Mateus, R., et al. In vivo cell and tissue dynamics underlying zebrafish fin fold regeneration. PLoS One. 7, e51766 (2012).
- Jones, E. A., et al. et al.Dynamic in vivo imaging of postimplantation mammalian embryos using whole embryo culture. Genesis. 34, 228-235 (2002).
- Rieger, S., Senghaas, N., Walch, A., Köster, R. W. Cadherin-2 controls directional chain migration of cerebellar granule neurons. PLoS Biol. 7, e1000240 (2009).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228, 464-474 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).
- Tadrous, P. J. A method of PSF generation for 3D brightfield deconvolution. J Microsc. 237, 192-199 (2010).
- Distel, M., Babaryka, A., Köster, R. W. Multicolor in vivo time-lapse imaging at cellular resolution by stereomicroscopy. Dev Dyn. 235, 1100-1106 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유