Method Article
라이브 셀 이미징 바실러스 subtilis과 연쇄상 구균 pneumoniae 자동 시간 저속 현미경을 사용하여
요약
이 프로토콜은 자동 형광 시간 경과 현미경을 사용하여 시간에 다른 박테리아의 단일 세포의 행동을 모니터하기위한 단계별 절차를 제공합니다. 또한, 우리는 어떻게 현미경 이미지를 분석하는 지침을 제공합니다.
초록
지난 몇 년 동안 과학자들은 미생물의 인구 기반의 실험에서 얻은 평균 데이터는 단일 세포의 동작, 상태 또는 표현형 대표하지 않는 점차 알게되었습니다. 때문에이 새로운 통찰력 단일 세포 연구의 번호는 (최근 리뷰를 1,2,3 참조) 지속적으로 상승합니다. 그러나, 적용된 단일 세포 기술을 많은 시간에 한 구체적인 하나의 셀 (예 : 유동세포계측법 또는 표준 현미경)의 개발 및 동작을 모니터링 허용하지 않습니다.
여기서 우리는 다음과 녹음 (의 형광) 바실러스 subtilis 많은 세대를위한 성장과 분열을 통해 연쇄상 구균의 pneumoniae의 개별 세균 세포 수있는 몇 가지 최근의 연구 4, 5, 6, 7,에 사용되는 현미경 방법에 대한 자세한 설명을 제공합니다. 그 결과 영화는 하나의 공통된 조상에서 유래 인구 이내에 단세포의 역사를 다시 추적하여 phylogenetic 가계 나무를 구성하는 데 사용할 수 있습니다. 이 시간 - 저속 형광 현미경의 방법뿐만 아니라 성장, 분할 및 개별 세포의 분화를 조사뿐만 아니라, 특정 세포의 행동에 세포의 역사와 조상의 효과를 분석하는 데 사용할 수 있습니다. 또한, 시간 경과 현미경은 이상적으로 세균 세포주기 동안 유전자 발현 역학 및 단백질 지방화를 검사 적합합니다. 방법은 박테리아 세포를 준비하고 microcolony에 단일 세포의 가지를 사용하는 현미경 슬라이드를 구성하는 방법에 대해 설명합니다. 즉, 하나의 세포들은 성장 온도 제어 환경 챔버 내에서 형광 현미경으로 분리하는 아가로 오스와 보충 성장 매체로 구성된 반 고체 표면에 발견됩니다. 이미지는 특정 간격으로 캡처하고 나중에 오픈 소스 소프트웨어 ImageJ를 사용하여 분석하고 있습니다.
프로토콜
1. B.의 준비 subtilis 문화
- -80에서 접종 세포 ° C 주식 10 ML 시간 경과 현미경 (TLM) 중간 (62 MM K 2 HPO 4, 44mM KH 2 PO 4, 15 MM (NH 4) 2 4, 6.5 MM 나트륨 구연 산염 SO, 0.8 MM에서 MgSO 4 0.02 % casamino의 지방산, 27.8 MM 포도당, 0.1 MM L - 트립토판은 산도가 필요한 경우 항생제로 보충 코 솔루션)를 사용하여 7로 설정되었습니다.
- 흔들 플라스크 (30 ° C, 225 RPM)에서 하룻밤 세포를 성장.
- 다음날 아침, 미리 예열 화학적으로 정의 매체 (CDM) (62 MM K 2 HPO 4, 44mM KH 2 PO 4, 15 MM (NH 4) 2 SO 4, 6.5 MM 나트륨 구연 산염, 0.8에서 1시 10분 세포를 희석 MM MgSO 4, 2.2mM 포도당, 2.1 당연 L - glutamic 산성, 6 μm의 L - 트립토판, 7.5 μm의 MnCl 2, 0.15 X 금속 믹스 (포함 50x MT 믹스 재고 (심판 8) 준비 : 0.2 M MgCl 2, 70 MM을 CaCl 2, 5 MM MnCI 2, 0.1 MM ZnCl 2, 0.2 MM 티아민 염산염 - 2 MM HCL, 항생제없이 0.5 MM FeCl 3 (마지막 추가).)
- B. 성장 중간 단계 지수 (30 ° C, 225 RPM)에 subtilis 세포. 보통, 이것은 약 4 시간 정도 소요됩니다. 세포 (섹션 2 참조) 중간 지수 단계를 도달하기 전에 중요한 아가로 오스 슬라이드 한 시간을 준비합니다.
- 600nm (600)에서 문화의 흡광도를 측정하고 대략 600 CDM을 사용하여 0.035의로 세포를 희석. 이 OD 적절한 간격과 하나의 세포가 시간이 경과 현미경에 대한 현미경 슬라이드에 발견되는지 확인합니다.
2. 현미경 샘플의 준비 (또한 그림 2 참조)
세포가 중간 기하 급수적인 성장에 도달 한 시간 전에, 다음과 같이 현미경 슬라이드를 준비 :
- 70 % 에탄올과 물을 두 개의 현미경 유리 슬라이드 (예 : Knittel 유리, 7.6 X 2.6 cm를) 제거합니다.
- 유전자 프레임 (ABgene, 1.7 X 2.8 cm)를 타고 조심스럽게 유전자 프레임의 반대편에있는 플라스틱 커버의 해체 유발하지 않고 유전자 프레임에서 플라스틱 포일 중 하나를 제거합니다.
- 손톱으로 남아있는 유전자 프레임의 안내 첨부 파일 다음에 한 쪽 첫째 촉진 연락하여 유리 슬라이드 중 하나의 중앙에있는 유전자 프레임을 연결합니다. 유리 슬라이드에 유전자 프레임을 부착하는 동안 공기 방울을 방지하십시오.
- 150 MG (1.5 %) 10 ML CDM 높은 해상도 낮은 용융 아가로 오스 (시그마)를 해산하기 위해 전자 레인지를 사용합니다. 아가로 오스는 시간 저속 현미경 실험에 필요한 최소한의 배경 지식을 얻기 위해 완전히 해산해야합니다. 필요한 경우,이 시간에 유도 또는 기타 물질로 아가로 오스 - CDM을 보완
- 유전자 프레임의 중간에 따뜻한 아가로 오스 - CDM 500 μl을 전송합니다. (국경)을 포함한 전체 면적이 완전히 덮여 있는지 확인하십시오.
다음 단계 (2.6-2.10)은 신속하게 아가로 오스 - CDM의 과도한 건조를 방지하기 위해 실시해야합니다. - 아가로 오스 - CDM 가득 유전자 프레임에서 두 번째 유리 슬라이드를 놓습니다. 공기 방울을 피하기 위해보십시오. 4 45 분에 대한 수평 위치에 끼워 넣으면 슬라이드 플레이스 ° C 아가로 오스 - CDM은 충분히 응고 수 있도록 냉장고 인치
- 조심스럽게 상단 유리 슬라이드를 밀어. 세포가 성장합니다되는 유전자 프레임 내에서 ~ 5mm 너비의 한천 스트립을 잘라 면도날을 사용합니다. 세 스트립의 최대 양쪽에 ~ 4mm의 공간으로 구분, 슬라이드마다 사용할 수 있습니다. 이러한 공간 B. 위해 필수적이며, 공기를 제공합니다 subtilis 성장. 네 가지 변종이 시간에 따라해야하는 경우 두 개의 스트립을 만들 수 있습니다 넷 작은 사각형의 결과로 반으로 수 있습니다. 잔여 고체 매체를 제거합니다.
- 조심스럽게 유전자 프레임의 끈끈한 면을 노출 유전자 프레임에서 두 번째이자 마지막 플라스틱 커버를 제거
- pipet 팁 그것을 건드리지 않고 고체 매체에 단일 세포를 (단계 1.5에서)로드합니다. 전체 스트립, 또는 작은 정사각형 1 μl 2.5 μl를 사용합니다. 항상 아가로 오스 패드 상단에서 시작하여 액체가 슬라이드를 돌려 아래로하여 할당된 성장 지역에 똑같이 분산 수 있습니다. 슬라이드를 돌려 때 슬라이드가 준비, 곧 액체의 가장자리는 액체의 골판지와 움직임이 증가함에 따라 더 이상 볼 수 없습니다.
- 한쪽에서 다른 유전자 프레임 (공기 방울을 방지)에 깨끗한 현미경 슬라이드 커버 슬립을 (24 X 50mm) 장소. 당신의 손톱으로 유전자 프레임을 따라 커버 슬립에 압력을 적용하여 전체 첨부 파일을 약속드립니다. 커버 슬립이 그들이 충분히 건조 수없이 세포에 배치되면, 세포는 실험 기간 동안 서로의 위에 성장하는 경향이있다. 또한 아가로 오스 그때 너무 건조되기 때문에 커버 슬립을 적용하기 전에 너무 오래 기다리지 않도록주의합니다.
- 30 1 H에 대한 사전 따뜻한 슬라이드 ° C. 경우 슬라이드 would 직접 현미경 (단계 3.1 참조) 미리 따뜻하게 환경 챔버에 배치, 온도 변동은 실험의 첫 번째 시간 자동 초점 문제가 발생할 수 있습니다.
3. 시간 경과 형광 현미경 (또한 그림 3과 영화 1 참조)
- 시간에 미리 따뜻한 환경 챔버 (우리 손에 실험의 시작하기 전에 최소한 2 시간) 실험을 시작한 후 자동 초점 문제를 방지하기 위해서. 소요 시간은 가열 시스템과 현미경뿐만 아니라 사용 환경 챔버에 따라 달라집니다.
- 귀하의 실험 설정에 따라 적절한 목표, 필터 및 이색성 거울을 선택합니다. 긴 실험은 UV 필터는 광원과 시료 사이에 위치되어 있는지 확인하십시오. 또한, 가능하면 노출을 최소화하기 위해 중립적인 밀도 필터를 사용하여 여기 빛의 일부를 차단합니다.
다음 장비 (DeltaVision, 영국에서 제공하는) 데 종 외 출판 시간 저속 현미경 실험에 사용되었다 2010 5. IX71 현미경 (올림), CoolSNAP HQ2 카메라 (프린스턴 인 스트 루먼트), 300W 제논 라이트 소스, 60x 밝은 필드 목표 (1.25 NA), GFP filterset (채도, 40분의 470 nm의 여기에서, 방출 50분의 525 NM), mCherry filterset (채도, 35분의 572 nm의 여기에서, 방출 60분의 632 NM). 자동 초점은 diascopic 조명을 사용하고 Deltavision의 Softworx 소프트웨어의 자동 초점 루틴 선물을 사용하여 수행되었습니다. 그것은 또한 자이스 혈구 확실한 초점, 니콘 완벽한 초점 시스템 및 Leica 적응 포커스 제어로 적합한 다른 오토포커스 시스템의 숫자가 지금있다는 것을 지적해야합니다.
- 귀하의 실험 설정에 따라 실험 프로그램. 그것은 전에 실제 실험을 다른 시간 저속 현미경이나 세균이 특정 구성에 필요한 빛의 양을뿐만 아니라 자동 초점 설정을 결정하는 것이 현명합니다. 짧은 노출 시간과 여기 빛이 적은 금액은 표백 및 phototoxicity을 최소화합니다. 오토포커스 루틴에 대한 diascopic 조명을 사용하십시오.
다음과 같은 설정이 데 종 외 출판 시간 저속 현미경 실험에 사용된 2010 5 :. 영화 스냅샷은 10% APLLC 화이트를 사용하여 8 또는 12 분 간격으로 찍은 것은 명시야 사진에 대한 조명과 0.05의 노출 LED, 10% 제논 라이트와 GFP 감지 및 32% 제논 라이트 각각 mCherry 감지를위한 0.8의 노출 0.5의 노출. 원시 데이터는 softWoRx 3.6.0 (응용 Presicion)를 사용하여 저장했습니다. 자동 초점은 0.06 μm의 단계 및 1.2 μm의 총 범위 프로그래밍했습니다.
- 현미경의 사전 예열 환경 챔버의 준비 슬라이드 (섹션 2) 장소 30에서 microcolony monolayer로 단일 세포의 가지 ° C. 모니터
특정 도움말 :
- 한천 패드의 중간에있는 단일 세포를 선택합니다. 한천의 가장자리가 더 쉽게 밖으로 건조 패드. 현미경의 소프트웨어를 사용하여 X, Y, Z의 위치를 저장합니다.
- X, Y 및 Z 방향으로 무대의 대형 움직임은 아가로 오스를 교란하고 따라서 자동 초점 루틴에 의해 세포의 식별을 방해 할 수도 있습니다. 슬라이드가 여러 변종을 포함하더라도 일반적으로, X, Y, Z의 움직임을 최소화하기 위해, 우리는 실험마다 10 개 이상의 위치를 선택하지 마십시오.
- 첫 번째 셀을 선택하는 데 후, 전용 소프트웨어와 함께 Z - 초점을 조정합니다. 이 시점에서, 이것이 디지털로 인코딩하지 않으면 "Z - 손잡이"를 사용하여 현미경 본체에 수동으로 초점을 변경하지 마십시오. 각 오토포커스 루틴 후 새 X, Y가, Z의 위치가 소프트웨어에 의해 저장됩니다 있는지 확인하십시오.
- 실행을 시작하기 전에 자동 초점 설정이 실험에 적합한지 여부를 확인합니다. 위상 대조 현미경의 사용은 향상된 반면에 의한 브라이트 또는 DIC 현미경을 사용하여 비교하여 오토포커스 루틴을 개선 있습니다. 그러나, 위상 대비 목표의 위상 반지가 형광 빛을 수집 (약 10 %) 그들이 덜 민감합니다. 그래서 약한 형광 샘플, 위상 반지없이 목적은 더 적합합니다.
- 실험이 안정적으로 실행 때까지 선택한 세포가 30 분 간격으로 초점을 아직 있는지 확인합니다. 이 시점에서 세포가 초점이 경우, 수동으로 조정합니다. 온도 변화뿐만 아니라, 제대로 건조 표본으로 인해이 처음 시간 동안 필요할 수 있습니다. 더 많은 세포가 볼 분야의 경우뿐만 아니라, 향상된 명암으로 인해 자동 초점 효과가 더 좋아.
- 실험이 끝난 후, 영화와 별도의 파일로 안전의 서로 다른 채널 (즉, 위상 콘트라스트, GFP, mCherry) 필요한 경우 (특정 인수 패키지는 하나의 스택 파일에 모든 채널을 배치합니다)를 구분합니다. 게시를 위해, 사진은 특히 우리는 2D deconvolution에 의해 향상된 수단백질 현지화 연구 eful. 당신의 현미경의 소프트웨어를 사용하여 이미지를 Deconvolve이나 호이겐스 (같은 상용 패키지 www.svi.nl ).
- ImageJ (사용하는 데이터 분석 http://rsbweb.nih.gov/ij/ ()이에 대한 원료, 처리되지 않은 이미지 파일을 사용) 및 Microsoft Excel 또는 시그마 플롯합니다. 스택 예를 들어 ImageJ에 ". AVI"동영상 파일로 저장할 수 있습니다. 시간 측정 방법 형광 단일 세포에 대한 자세한 설명이 아래에 제공됩니다.
4. ImageJ를 사용하여 발기인 활동 역학에 대한 데이터 분석
우리는 다른 좋은 소프트웨어 패키지가 이러한 BHV 소프트웨어 9, 4, Schnitzcell 10, PSICIC 11, 및 미생물 - 트래커 12 같은 시간 저속 현미경 이미지 분석을 전문으로하지만 여기서 우리가 자유롭게 사용할 수 ImageJ 패키지에 초점을있는 사용 가능합니다.
- 다운로드 ImageJ ( http://rsbweb.nih.gov/ij/ ) 및 (필요한 경우) (스택) 파일을 열 수있는 올바른 플러그인. 예를 들어, 영화 deltavision 현미경을 사용하여 기록은 deltavision 따개 플러그인과 ImageJ에서 열 수 있습니다. ImageJ 플러그인 폴더에 DV - 플러그인을 복사하여 프로그램을 시작합니다. 편집 1250에 / 옵션 / 메모리 및 스레드에 메모리 용량을 변경합니다. 이것은 시간 경과 영화에서 얻은 것과 같은 큰 파일을 작업하실 수 있습니다.
- 하나의 세포의 세포 기록을 평가하기 위해 한 microcolony과 영화에 대한 관심의 마지막 프레임에 스크롤의 원래 위상 콘트라스트 동영상을 엽니다. 메뉴에서 "분할 라인"선택 버튼을 선택합니다.
- 배경에 라인을 그릴 및 "Ctrl"+ "T"를 누르십시오. 이것은 관심 (ROI) 관리자의 영역이 열립니다. (해당 배경 형광 값이 수동으로 배경을 빼서하는 데 사용할 수 있습니다 -.. 아래 참조 또는 ImageJ 이내에 배경 제거 루틴 선물 사용) 또한 관심의 세포에 라인을 그릴 및 투자 수익 (ROI) 관리자에게 투자 수익 (ROI)를 추가합니다. 우리가이 사례 연구에서 프로 모터 - GFP의 fusions를 조사하고 GFP가 세포질 전반에 걸쳐 확산되기 때문에, 전체 세포는 세포의 길이에 걸쳐 각 단일 픽셀에 대한 유사한 형광 값이 있어야합니다. 다시 시간을 한 프레임을 스크롤하여 관심의 동일한 셀에 새로운 투자 수익 (ROI)을 선택합니다. 이 세 번째 투자 수익 (ROI)을 저장하고 동영상의 첫 번째 프레임에서 해당 투자 수익 (ROI)이 저장되었습니다 때까지 절차를 계속합니다.
딸 세포의 형광은 세포 분열 이후 크게 달라질 수있다는 점에 유의하십시오. 어느 심장 형성을 시각화하는 세포 (예 : 빨간색 멤브레인 염료 FM ® 5-95 (Invitrogen)와 GFP의 조합 등)에 의해 만들어진 형광 단백질과 함께 적용할 수있는 멤브레인 염료를 사용합니다. 이 경우에는 해당 형광 채널 아니라 위상 콘트라스트 영화는 시간에 세포를 수행하는 데 사용해야합니다. 또는, 하나는 세포의 한 반으로 투자 수익 (ROI)의을 선택하여 안전 측면에 머물 수 있습니다. - 투자 수익 (ROI) 관리자에서 "저장"을 클릭하십시오. 파일의 종료가. "투자 수익 (ROI) '경우, 다음 하나 투자 수익 (ROI)가 목록에서 선택되며, 오직이이 저장됩니다. 파일의 종료가. "우편 번호"있다면, 전체 집합 (필수) 저장됩니다.
- 위상 콘트라스트 동영상을 닫고 원래 형광 영화를 (예 : GFP)을 엽니다. 클릭 "모두 표시"와 투자 수익 (ROI) 관리자의 "측정". 새 창이 (결과)가 열립니다. 엑셀 시트에 결과를 복사하여 매체의 배경 형광에서 각 단일 세포에 대한 의미 형광을 뺍니다. 그 결과 네트워크 형광는 시간에 관심이 세포의 모터 활동을 공개하는 시간 역모를 꾸몄다 수 있습니다.
- 또는 microcolony의 모든 세포의 형광 시간이 점 특정에 분석할 수 있습니다. 이 선택하고 위에 설명된대로 한 프레임의 배경과 모든 단일 세포에 대한 투자 수익 (ROI)의 내용을 저장, Excel로 형광 값을 복사하고 "도구"메뉴의 "히스토그램"기능을 사용 histograms를 생산하기 위해서는.
- 게시를 위해 하나의 프레임에서 사진을 얻으려면, "이미지"를 선택, 관심의 프레임을 선택 - "이미지를 중복"와 "RGB"또는 "이미지"를 선택하여 "8 비트"로 이미지의 유형을 변경 - "유형"- "RGB 색상"또는 "8 비트". ". 티파니"로 중복 프레임을 저장합니다. RGB/8-bit 사진은 같은 CorelDraw 또는 Adobe 일러스트 레이터와 같은 기존의 그리기 프로그램에서 열 수 있습니다. ImageJ에서 "창 / 수준"- "조정"- - "밝기 / 대비"또는 "이미지"- "조정"필요한 경우, 그림은 "이미지"를 사용하는 적응 수 있습니다.
5. ImageJ과 함께 게시를 위해 영화를 생산
- 위에서 설명한 것처럼 ImageJ에서 원래 위상 대비하고 해당 형광 영화 (들)을 엽니다. 개발 microcolony는 투자 수익 (ROI) throu 둘러싸인 즉, 직사각형 선택 버튼 (왼쪽에서 1 일)을 선택하고 같은 방식으로 첫 번째 프레임에 사각형 투자 수익 (ROI)을 그려전체 영화 ghout. "자르기"하고 새 이름으로 영화의 안전이 작은 버전 - "이미지"를 선택하십시오. 형광 영화 투자 수익 (ROI) 관리자를 통해 동일한 투자 수익 (ROI)를 선택하고 같은 전에 진행합니다.
- 중 가로 또는 세로 동영상을 결합하려면, "플러그인"을 선택 - "스택 조합기"를. 원하는 경우, 시간 스탬퍼는 "플러그인"을 통해 추가할 수 있습니다 - "시간 스탬퍼"를. 일단 "DV가."또는 ". 티파니 '와 한번으로 통합 스택을 저장합니다."AVI "또는 QuickTime 동영상이.
연쇄상 구균 pneumoniae에 대한 대체 프로토콜 Adaptations (그림 4 영화 2) :
6. S.의 준비 pneumoniae 문화
- S. 그로 pneumoniae 세포 (변형 D39 13, 또는 37 C + Y 매체 15 서 문화로 unencapsulated 변형 R6 14 capsulated ° 약 0.4의 600nm에서 OD 때까지 C에 도달입니다. 14,000 rpm으로 2 분에 대한 세포를 원심 분리기와를 resuspend 신선한 C 정확히 0.4의 600nm 초래 하리라는 14.5 %의 글리세롤 (V / V)이있는 + Y 매체. 나누어지는 세포과 ° C 나중에 사용하기 위해 -80에서 그들을 저장소의 볼륨 세포 펠릿.
- 시간 경과 현미경 들어, 이전에 교양 S.의 나누어지는을 pneumoniae 세포. 4 ML의 예방 신선한 C -80 ° C의 나누어지는 세포와 + Y 매체 1:100. 0.2-0.1의 600nm의 OD 중순 지수 위상 때까지 세포를 성장. -80 ° C의 aliquots의 세포를 사용할 때 일반적으로이 과정은 약 2 시간 걸립니다.
7. 현미경 샘플의 준비
- B. 위에서 설명한 것처럼 현미경 슬라이드 준비 subtilis는하지만 아가로 오스는 복잡한 C + Y 매체 포함되어 있는지 확인합니다. S. 이후 pneumoniae가 microaerophile이며, 아가로 오스 스트립 사이의 공기 주머니는 B.에 대한보다 작아야한다 subtilis (양쪽에 ~ 1mm 공간).
- 600 NM (600)에서 문화의 흡광도를 측정, 대략 600 C + Y 매체를 사용하여 0.05의에 기하 급수적으로 증가 S. pneumoniae의 세포를 희석하고 아가로 오스 슬라이드를 로드할이 희석을 사용합니다.
8. 시간 경과 위상 대비 현미경
S. 대한 현미경 설정을 조정합니다 pneumoniae : S. 이후 사용 단계 - 대비 현미경 pneumoniae는 밝은 - 필드 현미경을 사용하여 식별하기 어렵습니다. B.에 대한 설명으로 프로토콜을 계속 subtilis (2.9 단계에 따라 - 3.7). S. pneumoniae 세포가 30도에서 성장 수 있습니다 ° C 또는 37 ° C (그들은 37 ° C에서 빠른 성장).
9. 대표 결과 :
박테리아가 완전히 (그림 5A - C 참조) 실험의 끝에 볼 분야 내에 위치한 microcolony monolayer로 자라면 시간 저속 형광 실험이 성공적으로 수행되었습니다. 세포가 서로의 위에 성장하면, 그것은이다뿐만 아니라 불가능한 정확하게 자신의 역사를 다시 추적뿐만 아니라 중복 세포의 형광 수준이 올바르게 측정할 수 없습니다. 매체 구성은 느린 성장을 얻기 위해 조정해야 할 경우 발견 세포가 충분히 건조 (단계 2.9) 또는이 없었다면 세포는 서로의 위에 성장하는 경향이있다. microcolony 볼의 작은 마을에서 자랐어요 경우, 다음 하나 콜로니 내에 형광 신호의 분배가 결정하실 수 없습니다. "microcolony 운동"에 대한 원인은 발견 세포의 부족 건조 (단계 2.9)이 될 수도 있고, 소프트웨어는 개발 기간 동안 microcolony를 추적하는 프로그램이 아니었다면. 또한, 이것은 세포 (그림 5D - F 참조)에서 나오는 형광 신호를 가린다로 증가 형광의 로컬 패치 매체 감지되지 않은 것이 중요합니다. 배경과 관련된 문제는 미디어 화합물, airbubbles 또는 소화 되 다만 아가로 오스의 대단히 짧은 시간에서 발생할 수 있습니다. 이것을 시각화하기 위해, 우리는 그림에 표시됩니다. 이미지가 적색 형광 염료에 대한 자극 / 방출 필터를 사용하여 찍은 특정 슬라이드의 배경 5F 신호. 본으로, 밝은 autofluorescent 명소 영상을 방해 수있는 존재입니다. 같은 반점을 방지하기 위해, 아가로 오스 완전히 해산과 현미경 슬라이드에 coverslip을 배치하면 더 airbubbles가없는 있는지 확인하십시오.
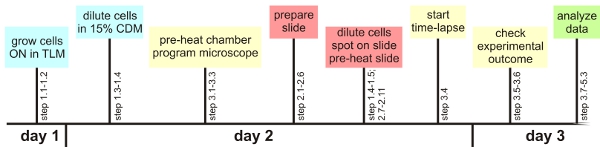
그림 1 : 실험 개요

그림 2 : 현미경 샘플의 준비
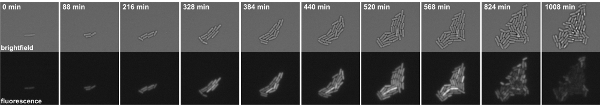
그림 3 : B.의 시간 경과 형광 현미경 P kinB - GFP 융합을 품고 subtilis 세포. 스냅샷은 영화 하나에서 가져옵니다. 상단 패널 : 명시야, 하단 패널 : GFP 채널.
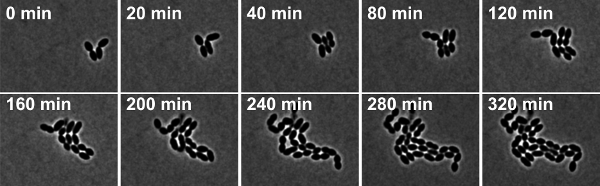
무화과우레 4 : S.의 시간 경과 위상 대비 현미경 pneumoniae 야생 유형 변형 R6. 스냅샷은 영화 2 촬영한 있습니다.

그림 5 : 가능 (시간 경과) 현미경의 결과의 일러스트. 교류 diascopic 조명 설정으로 얻은 데이터에 대해 생각해야 할 요소를 보여줍니다. B를 sporulating의 microcolony의 monolayer의 (A) 브라이트의 현미경 (긍정적인 결과) B. subtilis의 전지는 (B) 브라이트 이미지 sporulating B. 중 일부 세포가 서로의 위에 성장하는 subtilis microcolony (부정적인 결과는) (C) 브라이트 이미지 초점 분야 (부정적인 결과)의 작은 마을에서 자랐어요 subtilis의 microcolony. B.의 episcopic 조명 설정으로 얻은 데이터에 대해 생각해야 DF보기 요인 (D) 위상 콘트라스트 사진 E와 F의 형광 신호가 배경 신호가 각 픽셀 (긍정적인 결과)에서 유사 D. 참고에 표시된 전지의 (E) GFP 신호에서 발생한 위치를 시각화하는 그려져 지수 단계에서 subtilis 세포. 또한 세포 하나가 배경이 증가 적색 형광 수준 (과 영역을 포함하는 D. 참고에 표시된 세포의 붉은 채널을 통해 얻은 포화 신호 (부정적인 결과) (F) 신호를 보여주기 때문에 노출 시간이 너무 많이있을 수도 있습니다 부정적 결과).
B.의 영화 1. 시간 경과 형광 현미경 P kinB - GFP 융합을 품고 subtilis 세포. 스냅샷은 8 분 간격으로 찍은. 왼쪽 명시야, 오른쪽 : GFP 채널. 동영상을 감상하려면 여기를 클릭하십시오.
S.의 영화 2. 시간 경과 위상 대비 현미경 pneumoniae 야생 유형 변형 R6. 스냅샷은 10 분 간격으로 찍은 것은. 동영상을 감상하려면 여기를 클릭하십시오.
토론
많은 다른 단일 세포 기술에 대조적으로, 여기에서 설명한 시간 경과 형광 현미경 방법은 그 조상의 행동, 그리고 분열 이벤트에 관한 특정 세포의 역사를 수행하는 데 사용할 수 있습니다. 찬란 표시 대상 발기인 또는 단백질와 함께 구체적인 발달 경로의 활성화는 시간과 단백질 지방화뿐만 아니라 단백질 역학이 박테리아 개발되는 동안 모니터링할 수 있습니다에 따라 수 있습니다.
위에서 표시된 다른 세균 종에 집중 연구는 특정 세균에 대한 요구 사항에 따라 성장 조건을 적응하여 수행할 수 있습니다. 우리가 발생한 유일한 제한은 성장 조건과 샘플의 크기와 관련이 있습니다. 밀폐 환경으로 인해 중간 조건은 실험 기간 동안 변경할 수 없습니다. 또한, 실험 당 4 개의 변종이 최대가 효율적으로 모니터링할 수 있습니다.
몇 가지 중요한 단계를 고려, 단일 세포 분석 방법은 여기에 설명된 쉽게 어떤 자동화된 현미경을 사용하여 적용할 수 있습니다. 다음에서 이러한 중요한 단계의 개요가 주어집니다. 자세한 정보는 주요 텍스트에서 찾을 수 있습니다 일반 준비 사항 :. 그것은 이전 실험 특정 박테리아에 필요한 자동 초점 설정을 확인하는 것이 현명합니다. 가능하면 마찬가지로, 형광의 시각화에 대한 대략적인 최적의 설정은, 사전에 결정되어야합니다. 또한, 준비 시간 라인을 따라하는 것은 시간에 사용할 준비가 모든 자료 (사전 온난, 현미경 챔버를 현미경 설정을 프로그래밍, 세포가 원하는 성장 단계에되기 전에 슬라이드 한 시간 준비를 참조 그림 1)을하는 데 도움이 B.니다. 성장 TLM와 CDM에 subtilis : TLM과 CDM은 화학적으로 기아 미디어를 정의하는 B. subtilis은 천천히 자랍니다. 세포가 언론에서 재배되는 시간 기간은 특정 변형에 따라 연장 될 수도 있습니다. 느린 성장은 서로에 말뚝의 세포를 방지 현미경 샘플의 준비 :. 유전자 프레임, 유리 슬라이드와 커버 슬립 사이의 공기 방울은 아가로 오스 기반 매체의 광범위한 건조를 방지하기 위해 예방해야합니다. 동일 매체 / 커버 슬립 인터페이스 보유하고 있습니다. 그것은 수영 및 / 또는 여러 계층의 성장을 방지하기 위해, 세포가 충분히 건조하게하는 데있어 매우 중요합니다 시간 경과 형광 현미경 :. 슬라이드뿐만 아니라 환경 챔버 사전 온난 주요 오토포커스 문제를 방지하기 위해 중요합니다. 이들은 실험 (시료가 충분히 건조했습니다 제공) 중 분야와 초점을 유지하기 위해 최고의 기회를 갖고 있기 때문에 세포는 한천 패드의 중간에 선택되어야합니다. 실험 당 10의 위치 최대 여전히 제대로 작동합니다. 선택하는 데 후 관심의 첫 번째 셀은 (자세한 내용은 텍스트를 참조) 초점을 조정하는 소프트웨어를 사용합니다. . 세포가 30 분 간격의 실험 분석의 첫 번째 시간 동안 초점이 아직 있는지 확인하십시오 : 이것은 매체의 배경 형광 채널에서 유사한 가치를 가지고 있는지 사전에 연장 분석 절차를 확인하는 것이 중요합니다. . 작은 먼지 입자, 중간 부품, 더러운 렌즈 또는 작은 아가로 오스의 대단히 짧은 시간 문제 해결을 분석할 수있는 동영상이 어렵거나 불가능하게 만들었 로컬 증가 형광에 기여할 수 세포가 서로의 위에 성장하는 경우,이 중 coverslip가되었음을 나타내고 있습니다 너무 빨리 또는 매체가 microcolony monolayers의 성장에 적합하지 않습니다 첨부. 슬라이드에 다른 세포 행복 나누기 반면 관심 세포가 지속적으로, 일찍 죽으면, 당신은 위치에서 UV - 필터를 넣어 여부를 확인 할 수 있습니다. 또한 오랜 실험 중에 노출 시간이나 빛의 강도를 감소하는 데 도움이 있습니다.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
JWV의 그룹에 작업이 EU 마리 퀴리 합체 원정대, Sysmo2 그랜트 (NWO-ALW/ERASysBio), 호라이즌 부여 (ZonMW)와 VENI 친목 (NWO - ALW)에 의해 지원됩니다. OPK의 그룹은 여러 STW 보조금 (NWO), SYSMO1 (IGdeJ)와 SYSMO2 부여, ESF Eurocores SynBio 부여 (SynMod)와 산업 발효 및 식품 영양에 대한 최고 연구소의 게놈에 대한 Kluyver 센터에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| 진 프레임 | ABgene | AB - 0578 | 1.7 X 2.8 cm |
| 고해상도 낮은 용융 아가로 오스 | 시그마 | A4718 | |
| 큰 커버 슬립 | 여러 | 24 X 50mm | |
| 원하는 경우, 멤브레인 염료 예 : FM 5-95 | Invitrogen | T23360 | 다른 멤브레인 염료도 사용할 수 있습니다 : http://probes.invitrogen.com/media/pis/mp34653.pdf |
| 환경 챔버와 함께 시간 경과 현미경 | 여러 | 해당 섹션에있는 장치에 대한 세부 정보를 볼 |
참고문헌
- Veening, J. W., Smits, W. K., Kuipers, O. P. Bistability, epigenetics, and bet-hedging in bacteria. Annu. Rev Microbiol. 62, 193-193 (2008).
- Dubnau, D., Losick, R. Bistability in bacteria. Mol Microbiol. 61, 564-564 (2006).
- Locke, J. C., Elowitz, M. B. Using movies to analyse gene circuit dynamics in single cells. Nat. Rev. Microbiol. 7 (5), 383-383 (2009).
- Veening, J. W. Bet-hedging and epigenetic inheritance in bacterial cell development. Proc. Natl. Acad. Sci. U. S. A. 105 (11), 4393-4393 (2008).
- de Jong, I. G., Veening, J. W., Kuipers, O. P. Heterochronic phosphorelay gene expression as a source of heterogeneity in Bacillus subtilis spore formation. J. Bacteriol. 192 (8), 2053-2053 (2010).
- Veening, J. W., Murray, H., Errington, J. A mechanism for cell cycle regulation of sporulation initiation in Bacillus subtilis. Genes Dev. 23 (16), 1959-1959 (2009).
- Eberhardt, A. Cellular localization of choline-utilization proteins in Streptococcus pneumoniae using novel fluorescent reporter systems. Mol Microbiol. 74 (2), 395-395 (2009).
- Vasantha, N., Freese, E. Enzyme changes during Bacillus subtilis sporulation caused by deprivation of guanine nucleotides. J Bacteriol. 144 (3), 1119-1119 (1980).
- Stewart, E. J. Aging and death in an organism that reproduces by morphologically symmetric division. PLoS. Biol. 3, 45-45 (2005).
- Rosenfeld, N. Gene regulation at the single-cell level. Science. 307 (5717), 1962-1962 (2005).
- Guberman, J. M. PSICIC: noise and asymmetry in bacterial division revealed by computational image analysis at sub-pixel resolution. PLoS. Comput. Biol. 4 (11), 1000233-1000233 (2008).
- Montero, L. lopis P. Spatial organization of the flow of genetic information in bacteria. Nature. 466, 77-77 (2010).
- Avery, O. T., Macleod, C. M., McCarty, M. Studies on the chemical nature of the substance inducing transformation of pneumococcal types: Induction of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III. J Exp. Med. 79, 137-137 (1944).
- Hoskins, Genome of the bacterium Streptococcus pneumoniae strain R6. J Bacteriol. 183, 5709-5709 (2001).
- Martin, B. The recA gene of Streptococcus pneumoniae is part of a competence-induced operon and controls lysogenic induction. Mol Microbiol. 15, 367-367 (1995).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유