Method Article
Intravital 이미징을 사용하여 실시간으로 종양의 Nanoparticle의 이해 평가
요약
우리는 조류 배아 모델 동적, 실시간 intravital 이미지를 사용하여 인간의 xenografted 종양의 vasculature에 nanoparticle의 국제화를 수치 소설 접근법을 제시한다.
초록
이러한 초음파, MRI, PET 및 중부 표준시로 종양 이미징,에 대한 현재 기술은 적합한 이종 이식 모델의 유틸리티를 강조, 미세한 레벨 1,2,3에서 종양의 nanoparticle의 이해의 평가를위한 고해상도 이미지를 얻을 수 없습니다 자세한 이해 분석을 수행하는 인치 여기, 우리는 수정, 쉘 적은 닭고기 배아 모델에서 인간의 종양 xenografts에 nanoparticle의 이해를 평가하기 위해 고해상도 intravital 이미징을 사용합니다. 그것이 인간 종양의 성장을 지원하는 비교적 저렴하고 anesthetization 또는 수술 4,5 요구하지 않기 때문에 닭고기 배아 모델은 특히 생체내 분석에서 이러한에 적합합니다. chorioallantoic 멤브레인 (CAM) 6에 이식하면 종양 세포는 7 일 이내에 완벽하게 vascularized의 xenografts를 형성하고 있습니다. 그 결과 종양은 호스트 또는 종양 시스템 중 하나에 거의 영향을 최대 72시간까지 유지 수있는 비침습 실시간 고해상도 영상에 의해 시각입니다. 종양으로 말초 관리 크기와 공법의 다양한 Nanoparticles는 시각과 혈류를 통해 그들이 흐름으로 계량 수 있습니다 새는 종양의 vasculature에서 extravasate 및 종양 사이트에 축적. 우리는 여기서 가까운 적외선 형광 염료 및 / 또는 폴리에틸렌 글리콜 고분자 (PEG) 7, 8, 9,10,11으로 장식된 Cowpea 모자이크 바이러스 (CPMV)에서 파생 nanoparticles의 분석을 설명합니다. 정맥 주사 관리되면,이 바이러스 nanoparticles는 급속하게 외부 모두 vasculature의 글로벌 라벨과 종양 7,12 이내에 결과 내피 세포에 의해 internalized 있습니다. 바이러스 nanoparticles의 PEGylation들이 플라즈마 반감기를 증가, 순환에서 시간을 확장하고, 궁극적으로 향상된 투자율 및 유지 (EPR) 효과 7, 10,11를 통해 종양에서 축적을 향상시킵니다. 종양의 nanoparticles의 축적의 속도와 범위는 이미지 분석 소프트웨어를 사용하여 시간이 지남에 따라 측정됩니다. 이 기술은 모두 시각화와 인간의 종양에서 nanoparticle의 역학을 계량하는 방법을 제공합니다.
프로토콜
1. 조류 배아 CAM로 종양의 접종
- 8 설명된대로 쉘 - 덜 수정된 닭 배아를 준비합니다.
- 배아 발달의 날 9 일, 1 ML 주사기에 연결된 18 게이지 바늘을 사용하여 마이크로 인젝터 조립. Tygon 튜빙 (1 / 32 "내부 직경 32분의 3"외경, 1 / 32 "벽 두께)의 5-6인치 기사를 잘라 조심스럽게 튜브로 바늘의 베벨를 삽입합니다. 튜브의 약 4-5인치해야 바늘의 끝 (그림 1A)에서 연장.
- 세포 현탁액과 주사기와 튜브를 입력합니다. 그런 다음 튜브의 끝에 microinjection 유리 바늘을 삽입하고 신중하게 모든 공기 방울을 제거하십시오.
- CAM (그림 1C) 내에서 볼러스로 10,000-100,000 암세포와 조명기와 절개 범위에 따라 하루에 9 배아 (그림 1B)을 주사. 천천히 세포를 주입하고 조심스럽게 바늘이 CAM 내에서 볼 수 볼러스를 형성하는 세포에 대한 올바른 위치에 있는지 확인합니다. CAM 표면에 드립이 Kimwipe 또는 기타 작은 주걱을 사용하여 청소 수 있습니다 셀.
- 60 % 습도에서 38 ° C에서 humidified 배양기로 배아를 반환하고 성장하고 vascularize (최대 7 일)에 종양 수 있습니다.
2. nanoparticles의 준비
- 닭 배아에 주입에 대한 찬란 표시 CPMV의 nanoparticles을 준비한다. 바이러스 nanoparticles를 (물론 어떤을 제거 한 분만을 사용하고 원심 분리기 전에 100 μg / ML 소용돌이 혼합물의 농도로 PBS, pH를 7.4에서 8로 합성된 희석 합산. Sonication도 conjugates 및 집계의 정도에 따라 유용할 수 있습니다. 4 저장할 때 찬란 분류 CPMVs의 주식이 최소한 1 년 동안 안정 ° 어둠 속에서 C. 몇 넣어 주기적으로 주식을 체크 유리 슬라이드에 방울과 형광 검사. 전송 전자 현미경 (TEM)이 또한 입자가 결합 후 그대로 남아 있는지 확인하는 데 사용할 수 있습니다.
- 간단히, 바이러스 nanoparticles 중 1 마이크로 그램은 (2 μl의 최종 볼륨)을 구리 코팅 격자에 추가할 수 있습니다. 다음 전자 현미경에서 일분 (필립스 EM 410)에 대한 2 % uranyl 아세테이트의 동일한 볼륨을 추가합니다.
3. 찬란 - 라벨 바이러스 nanoparticles의 정맥 주사
- 주 16, 위에서 설명한 것처럼 마이크로 인젝터 조립. 주사기에 튜브 (> 200 μL)를 통해 바이러스 nanoparticle의 원하는 볼륨을 그립니다. 조심스럽게 모든 기포를 제거합니다. 튜브의 끝에 microinjection 유리 바늘을 삽입합니다. 바늘과 같이 길고 (그림 2A) 가능한 테이퍼 있는지 확인하십시오. 바늘이 너무 무딘 경우, 그것은 ectoderm 통해 피어스 수 없게됩니다하고 선박에 침투 실패합니다. 바늘이 너무 선명 경우 조직을 관통하면 도움말이 붕괴됩니다.
- 정맥 (그림 3D) 시각으로 원하는 사이트에서 말초 종양 베어링 배아로 1 MG / ML 플루오레신 dextran (MW 70,000 다, Invitrogen) 100 μl를 주입. CAM의 정맥의 성공 cannulation은 사출 흐름의 경로에있는 혈액의 비운 (그림 2B)에 의해 분명하다. 주사 후 혈관 누출 1 시간 평가합니다.
- 정맥으로 원하는 사이트에서 말초 혈관 누출과 함께 종양을 포함하는 배아로 1 MG / CPMV - 알렉사 플루어 647 (CPMV - AF 647) 또는 PEGylated CPMV - 알렉사 플루어 647 (CPMV - PEG - AF 647)의 ML 솔루션의 50 μl를 주입 시각 수 있습니다.
- 이미지 즉시 종양과 요코가 회전 디스크, 하마 마츠 ImagEM 9100-12 EM - CCD 카메라가 장착되어 자이스 혈구 심사관 Z1 똑바로 현미경을 사용하여 주사 후 매 시간마다.
4. 실시간 intravital 이미징
- 배아 이미징 장치를 조립하려면 배아 이미징 장치의 뚜껑의 아래쪽에있는 이미징 포트의 둘레 주위에 진공 그리스의 얇은 레이어를 적용하고, 항구에 18mm 유리 coverslip을 맞습니다.
- coverslip이 이미지에 원하는 영역을 다룰 것입니다 그러한 배아를 놓습니다. 천천히 coverslip 그냥 배아와 접촉하게 때까지 뚜껑을 낮게하고 (그림 2C) 제자리에 고정하는 장치로 뚜껑을 나사.
- ° C 배아가 들어있는 요리 이외의 배아 이미징 장치에 37 가열 물을 추가하고 37 equilibrated 안쪽 환경 챔버 ° C.와 직립 공촛점 현미경의 무대에 전체 단위를 장소
- 스피닝 디스크 공촛점 형광 현미경 (그림 2E)에서 배아를 포함하는 위치 이미징 장치. 이미징 장치 캡처하는 입체 Z 스택 및 시간 경과 이미지 모두 수 있도록 장소에서 배아를 잡고 이미지를 캡처하는 동안 고정 볼 분야를 유지합니다. 우리는 취득 및 퍼어킨 엘머의 (이전 순발력) Volocity 소프트웨어 패키지 (그림 3A)를 사용하여 입체 시간 경과 이미지를 분석합니다. 종양의 세 차원 스택 높은 해상도와 detaile 시각화하는 주변 vasculature을 습득특정 시간 지점에서 D 구조 분석합니다. 종양 vasculature에 설명된 구조적 변화를지도하기 위해 정기적으로 시간이 지점에서 세 차원 스택을 습득. 주사 후 이미지 종양 시간마다.
- 평균 알렉사 플루어 (AF) 종양이나 같은 Volocity 같은 기질 (비 종양 영역)를 사용하여 이미지 quantitation 소프트웨어 (퍼어킨 엘머)에서 선택한 지역 내에서 647 신호를 계산하여 바이러스 nanoparticles의 이해를 Quantitate. 기질 비율 종양은 기질의 의미 AF 647 신호를 통해 종양의 의미 AF 647 신호를 나누어 계산했습니다. 하나 이상의 종양 / 기질 비율은 nanoparticle이 종양에 의해 촬영되고있다는 것을 나타냅니다.
5. 대표 결과 :
예를 들어 여기에서 설명한, 우리는 일 9 닭 배아 (그림 1B)의 CAM 내에서 크기 볼러스 약 1mm를 형성 HT - 29 결장암 세포를 주입했다. 접종 후 태아는 충분한 종양의 성장과 vascularization (그림 1C)을 허용 humidified 배양기에서 7 일 동안 교양되었습니다. 배아는 종양 vascularization 확인을 낮은 분자량 dextran과 정맥 주입 있었고, 종양은 자이스 혈구 AxioExaminer Z1 직립 현미경 (그림 2D)에서 시각되었습니다.
CPMV - AF 647 또는 CPMV - PEG - AF 647 nanoparticles의 정맥 주사 관리 후 (그림 3A와 B), 고해상도 실시간 공촛점 이미징 (그림 2E)은 CPMV 및 CPMV - PEG 모두 빠른 속도로 전체 vasculature 라벨 nanoparticles 것으로 밝혀지만, 종양에 의해 CPMV - PEG의 이해 12 시간 (그림 3A) 이후 CPMV보다 약 3 배 이상되었다. nanoparticles의 상대 종양의 이해는 이미지 분석 소프트웨어 (퍼어킨 엘머에서 Volocity)를 사용하여 결정되었다. 관심 지역은 종양 내외 선정 (stromal 구획) 및 각각의 의미 형광 강도가 결정되었습니다. 데이터는 종양 / 기질 비율로 표시됩니다.
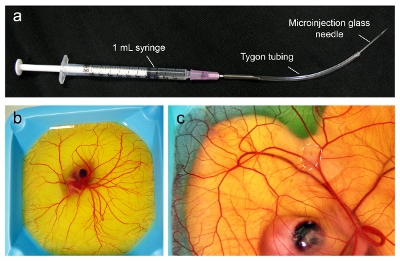
그림 1. 조류 배아의 CAM에 종양의 Microinjection. 표시된으로 (A) microinjection 장치는 구성 요소에서 조립합니다. (B) 일 9시 조류 배아는 CAM의 전체 표면을 커버하기 위해 확산되면 종양에 주사 준비하고 있습니다. (C) 16 일, 종양이 직경 1cm (점선)까지로 성장하고 nanoparticles와 함께 주입 준비가됩니다.

그림 2. Nanoparticle 주입 및 intravital 영상. 보여주는 해부 현미경 아래에 주입 (A) 캠 정맥에 주입되어야하고 (B) microinjector 바늘은 혈액 흐름에 주입 nanoparticles 정맥에 삽입 (화살표로 표시)와 준비 microinjector 바늘의 끝 (취소하여 본 혈액). (C) 이미징 유닛은 CAM과 직접 인터페이스 coverslip와 조류 배아를 포함. (D) nanoparticle 주입하기 전에, 종양 vascularization는 플루오레신 dextran의 주입 후 intravital 이미징을 사용하여 평가됩니다. (E) 이미징 장치는 37 ° C.에 온도 조절 인클로저 세트 내에서 직립 공촛점 현미경의 무대에 위치 배아를 포함하는
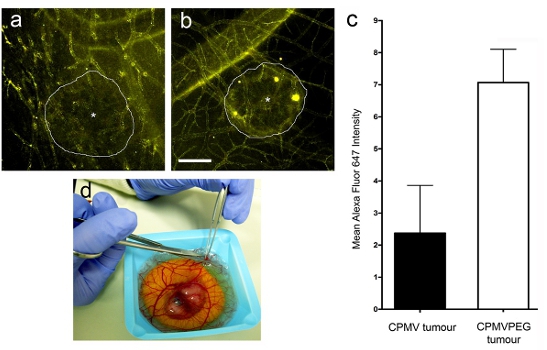
그림 3. 인간의 종양에서 nanoparticle의 이해의 Intravital 시각화. 종양 7 시간 (A) CPMV - AF647 및 (b) CPMV - PEG - AF647의 주사 후 시각입니다. 후속 분석을 위해 조류 배아에서 종양의 D) 절단.
토론
조류 배아의 chorioallantoic 막 (CAM)은 혈관 역학과 인간 종양의 pharmacokinetics을 평가하는 유용한 모델입니다. CAM의 구조와 위치는 고품질 이미지 수집을 허용 및 침입 수술 절차없이 암 xenografts 여러 가지 숙박이 가능합니다. 또한, 암 종양의 xenografts는 종양 조직의 nanoparticles의 축적을 평가하기 위해 신속, 저렴한과 준결승 높은 처리량 방법을 제공, 7 일 이내 vascularized 될 chorioallantoic 멤브레인에 심어. 쉘 적은 닭 배아의 CAM에 이식 암 xenografts는 종양 vasculature에 nanoparticle의 이해에 관한 직립 epifluorescence 또는 공촛점 현미경, 문맥과 시간적 정보의 고해상도 광학에 액세스할 수 있기 때문에 쉽게 구할 수 있습니다. 이 모델에서 암 xenografts은 깊이 미만 200m를 유지하면서 큰 종양의 결과로, CAM에 걸쳐 옆으로 성장하는 경향이있다. 표준 epifluorescence 현미경 효과적으로 전체 종양의 질량을 침투할 수 있기 때문에 이것은 그들이 특히 intravital 이미지에 적합합니다. 대조적으로, 마우스 내에서 표면 또는 orthotopic 사이트 중 하나에서 이식 종양은 어려운 정확하게 비침습 방법으로이 종양 내에 깊은 nanoparticles를 집중 수 있도록, 3 차원에 세포 분열 따위에 의해 번식. 우리는 nanoparticle 공법의 광범위한 범위의 생체내 분석에 적합이 모델에 대한 가능성을 강조, 양자 점, liposomes, 철 산화물은 인간 종양의 xenografts의 숫자 nanoparticles의 이해를 평가하기 위해이 모델을 활용합니다.
공개
감사의 말
이 연구는 CCSRI 부여 # 700537 및 CIHR 부여 JDL 및 NIH / NCI 부여 # CA120711 - 01A1 및 AZ로 CA120711 - 01A1에 # 84535에 의해 지원되었다. 모든 실험은 규정 및 기관 애니멀 케어의 지침에 따라 수행하고 캘리포니아 샌디에고 애니멀 케어 대학에서위원회를 사용하고 웨스턴 온타리오 대학에서 사용되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 이름 / 장비 | 회사 | 카탈로그 번호 | 댓글 |
|---|---|---|---|
| 수정된 레그혼 달걀 | 프라이`의 해처리, 세인트 제이콥스 | N / A | |
| Dremel 회전 공구 | Dremel | 어떤 모델을 사용할 수 | |
| 더 Dremel 커토프 바퀴 없습니다. 36 | Dremel | 409 | |
| 스포츠먼 해처 | 베리 힐 | 1550HA | |
| 스포츠먼 인큐베이터 | 베리 힐 | 1502EA | |
| 에탄올 | 70% (권 / 권) | ||
| 폴리스티렌은 보트를 달다 | VWR | 12577-01 | |
| 광장 배양 접시 | Simport, VWR | 25378-115 | |
| 뚜껑이있는 Rubbermaid 고무 용기 | Guillevin | RH3 - 228 - 00 - BLU | 구멍은 양쪽에 뚫고 |
| 수직 피펫 풀러 | 데이비드 Kopf 인 스트 루먼트 | 모델 720 | 설정 : 16.3 (히터) 및 2.3 (솔레노이드) |
나트륨 borosilicate 유리 모세관 튜브 | 서터 악기 | BF100 - 58-10 | (OD, 1.0 mm, 0.58 mm ID, 10 cm 길이) |
| 1X Dulbecco의 수정 이글 중간 (DMEM) | Invitrogen | 11995073 | |
| Dulbecco의 | Invitrogen | 14190250 | 산도 7.4 |
| 인산 버퍼 살린 (D - PBS) (1X), 액체 | |||
| 트립신, EDTA (에틸렌 다이아 민 테트라 초산) 4Na와 0.05 % (1X), 액체 | Invitrogen | 25300054 | |
| 태아 소 혈청 | Invitrogen | 12483-020 | inactivate 열 |
| Hemocytometer | Hausser 과학, VWR | 15170-090 | |
| 원심 분리기 | Eppendorf 모델 5810R | 5811 000.010 | |
| 파인 포인트 포셉 | VWR | 25607-856 | |
| Tygon R - 3603 튜브 | VWR | 63009-983 | 50피트 (1/32-inch 내경, 외경 3/32-inch, 1/32-inch 벽 두께 |
| 주사 18 게이지 바늘을 위해 피하 바늘 | BD | 305195 | 100 박스 |
| 주사 1 ML 주사기 | BD | 309602 | 100 박스 |
| 광섬유 현미경 조명기 | Amscope | HL250 - AY | 150W |
| kimwipes | VWR | 10805-905 | |
| V. unguiculata 씨앗 (캘리포니아 검은 눈 안돼. 5) | 버피 | 51771A | |
| 실내 성장 조명 | SunLite, 가드너의 공급 | ||
| 메틸 PEO4 - NHS 에스테르 | 찌르다 | PI22341 | |
| MPEG - NHS, PEG succinimidyl 에스테르, MW 2000 | NANOCS | PEG1 - 0002 | |
| 알렉사 플루어 647 카르복실산 (succinimidyl 에스테르) | Invitrogen | A20006 | |
| 오레곤 그린 488 succinimidyl 에스테르 * 6 - 이성질체 * | Invitrogen | O - 6149 | |
| 디메틸 sulfoxide (DMSO) | 시그마 | D8418 | |
| 이염 기성 인산 monohydrogen | 시그마 | 379980 | K2HPO4 (phopshate 버퍼에 대한) |
| 일염기의 dihydrogen 인산염 | P5655 | KH2PO4 (phopshate 버퍼에 대한) | |
| Superose 6 크기 배제 칼럼 | GE 헬스케어 생명 과학 | 17-0673-01 | |
| 악타 익스플로러 100 크로마토 그래프 | GE 아머샴 Pharmacia | WS - AKTA100 | |
| 악타 높은 흐름 키트 | GE 헬스케어 생명 과학 | 18-1154-85 | |
| 자당 | 시그마 | S0389 | |
| 초원 심 분리기 | 베크맨 | ||
| SW 28 티 로터 | 베크맨 | 342204 | 스윙 버켓 |
| 50.2 티 로터 | 베크맨 | 337901 | 고정 각도 |
| Amicon 울트라 - 15 원심 필터 유닛 | Millipore | UFC910008 | 100 KDA 컷 오프 |
| 그라데이션 전 | Biorad | ||
| dextran, 플루오레신, 70,000 MW, 음이온 | Invitrogen | D1823 | |
| 디스크 공촛점 형광 현미경 스피닝 | 쿼럼; 요코 CSU 10, 요코 | N / A | |
| Epifluorescence 넓은 분야 현미경 | 쿼럼; 자이스 혈구 Axio 심사관, 자이스 혈구 | N / A | |
| 하마 마츠 ImagEM 9100-12 EM - CCD 카메라 | 쿼럼; 하마 마츠 | N / A | |
| 현미경에 대한 온도 인클로저 단위 | 정밀 플라스틱 | N / A | |
| 진공 그리스 | VWR | 59344-055 | |
| 원형 유리는 coverslips 없습니다. 1 (18mm) | VWR | 16004-300 | |
| Volocity 소프트웨어 | 퍼어킨 엘머 | ||
| 칙 배아 인클로저 | 사용자가 조작된 | ||
| 섬세한 가위 | VWR | 25608-203 | |
| 포르말린 | Bioshop | FOR201.500 | fumehood에서 사용 |
| 최적의 절단 | 피셔; 조직 테크 | 1,437,365 | |
| 온도 (-10 월) | |||
| 플라스틱 금형 | 어부 | 22-038217 | |
| VWR VistaVision HistoBond 접착제 슬라이드 | VWR | 16004-406 | |
| DAPI로 금을 연장 | Invitrogen | P36931 | |
| 그라 이오 스탯을위한 일회용 블레이드 | 어부 | 12-634-2 | |
| 그라 이오 스탯 | Leica CM 3050 S | 14047033518 |
참고문헌
- Halin, C., Mora, J. R., Sumen, C., von Andrian, U. H. In vivo imaging of lymphocyte trafficking. Annu Rev Cell Dev Biol. 21, 581-603 (2005).
- Judenhofer, M. S. Simultaneous PET-MRI: a new approach for functional and morphological imaging. Nat Med. 14, 459-465 (2008).
- Weissleder, R., Pittet, M. J. Imaging in the era of molecular oncology. Nature. 452, 580-589 (2008).
- Chambers, A. F., Ling, V. Selection for experimental metastatic ability of heterologous tumor cells in the chick embryo after DNA-mediated transfer. Cancer Res. 44, 3970-3975 (1984).
- Cretu, A., Fotos, J. S., Little, B. W., Galileo, D. S. Human and rat glioma growth, invasion, and vascularization in a novel chick embryo brain tumor model. Clin Exp Metastasis. 22, 225-236 (2005).
- Zijlstra, A., Lewis, J., Degryse, B., Stuhlmann, H., Quigley, J. P. The inhibition of tumor cell intravasation and subsequent metastasis via regulation of in vivo tumor cell motility by the tetraspanin CD151. Cancer cell. 13, 221-234 (2008).
- Lewis, J. D. Viral nanoparticles as tools for intravital vascular imaging. Nature medicine. 12, 354-360 (2006).
- Leong, H. S. Intravital imaging of embryonic and tumor neovasculature using viral nanoparticles. Nature protocols. 5, 1406-1417 (2010).
- Chatterji, A. New addresses on an addressable virus nanoblock; uniquely reactive Lys residues on cowpea mosaic virus. Chemistry & biology. 11, 855-863 (2004).
- Brunel, F. M. Hydrazone ligation strategy to assemble multifunctional viral nanoparticles for cell imaging and tumor targeting. Nano letters. 10, 1093-1097 (2010).
- Steinmetz, N. F., Manchester, M. PEGylated viral nanoparticles for biomedicine: the impact of PEG chain length on VNP cell interactions in vitro and ex vivo. Biomacromolecules. 10, 784-792 (2009).
- Steinmetz, N. F., Cho, C. F., Ablack, A., Lewis, J. D., Manchester, M. CPMV nanoparticles target surface vimentin on cancer cells. Nanomedicine. , Forthcoming (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유