Method Article
胸腰椎転移におけるラジオ波焼灼術および骨セメント強化と組み合わせた分離手術の応用
要約
この研究では、胸腰椎転移性腫瘍の治療において、分離手術とラジオ波焼灼術および放射線療法を組み合わせることの有効性を調査します。
要約
脊椎は転移性腫瘍の一般的な部位であり、患者の5%〜10%が硬膜外脊髄圧迫(ESCC)を発症しており、これにより生活の質が大幅に低下し、死のプロセスが加速します。全一括脊椎切除術(TES)による根治手術で望ましい腫瘍制御が得られない場合、緩和ケアが依然として主要な治療選択肢です。従来の層流減圧術または腫瘍部分切除術では、局所的な圧迫を緩和することしかできません。外科的外傷や合併症は少なくなりますが、これらの方法では腫瘍の再発や二次圧迫に効果的に対処することはできません。そのため、胸腰部転移性腫瘍の治療には、ラジオ波焼灼術と骨セメント強化を組み合わせた分離手術が使用され、良好な臨床結果を達成することを目指しています。このプロトコルでは、胸腰椎転移性腫瘍に対するラジオ波アブレーションと骨セメント補強を組み合わせた分離手術の手順と重要なポイントが詳細に紹介されています。一方、当院における選択基準を満たす胸腰椎転移性腫瘍67例の臨床データを遡及的に解析した。治療方法の違いにより、分離手術とラジオ波焼灼術および骨セメント強化療法の併用療法(A群、33例)と放射線治療群(B群34例)の2群に分けられた。すべての患者は、治療前に改善された徳橋、富田、SINS、およびESCCスコアを使用して評価されました。2つの治療の異なる期間のVASスコア、フランケルグレーディング、およびカルノフスキースコアを比較して、臨床転帰を評価しました。研究によると、ラジオ波焼灼術および骨セメント強化と組み合わせた分離手術は、胸腰椎転移性腫瘍の治療における痛みを大幅に軽減し、神経機能の回復を促進し、可動性を高め、生活の質を向上させることが示されています。
概要
プレシジョンメディシンの発展により、悪性腫瘍患者の生存率は徐々に増加し、骨転移の発生率も大幅に上昇しています。脊椎転移は悪性腫瘍患者で最も多くみられる事象であり、約60%-70%を占める。これらのうち、患者の 5% から 10% が硬膜外脊髄圧迫 (ESCC) 1,2 に苦しむことになり、局所性疼痛、高カルシウム血症、脊椎不安定性、病的骨折、脊髄および神経根圧迫、およびその他の臨床症状などの骨関連イベントを引き起こす可能性があります。患者の約50%が神経機能障害3に苦しんでおり、これにより生活の質が劇的に低下し、死が加速します。
脊椎転移の診断と治療には、学際的な協力が必要です。原発腫瘍の治療は基本であり、外科的介入は脊椎転移の管理に重要な役割を果たします。外科的治療の目的は、痛みを和らげ、脊椎の安定性を再構築し、神経機能を改善し、局所腫瘍病変を制御し、患者の生活の質を向上させ、放射線療法、化学療法、免疫療法などのさらなる治療のための条件を提供し、さらには寿命を延ばすことです4。従来の椎弓切除術または腫瘍部分切除術は、局所的な圧迫を緩和するだけです。外科的外傷は軽微であり、外科的合併症の発生率は低いが、これらの方法では腫瘍の再発と二次圧迫に効果的に対処できない5。
分離手術では、圧迫された脊髄硬膜の周囲に360°の環状減圧を行い、放射線治療のために脊髄硬膜と腫瘍組織との間に約5〜8mmの安全な隙間を確保します。骨セメントは、前部の患椎、腫瘍体、および硬膜を分離するために使用されます。いくつかの臨床研究では、分離手術と定位放射線療法の組み合わせが脊髄転移性腫瘍の治療において満足のいく臨床効果を達成したことが示されている6,7,8,9。しかし、重大な外科的外傷、過剰な出血、切除後の椎体腫瘍の再進行などの問題があり、治療効果に影響を与えます。
臨床現場では、脊椎転移の分離手術中に、患者はその後の放射線治療のために切開が治癒するのを待っている間、脊椎腫瘍の局所進行と再発性神経圧迫症状を起こしやすいことが観察されました。ラジオ波アブレーション(RFA)は、臨床腫瘍温熱療法で広く使用されている低侵襲治療方法です。摩擦やイオン衝突時に発生する生体熱を利用して、局所的な腫瘍細胞を殺し、周囲の血管組織を凝固させて反応帯を形成し、血液供給を破壊する10。
したがって、胸腰椎転移性腫瘍の治療には、ラジオ波焼灼術および骨セメント補強と組み合わせた分離手術が使用されました。本テクニカルレポートでは、胸腰部転移性腫瘍に対するラジオ波焼灼術および骨セメント補強と組み合わせた分離手術のステップとポイントについて詳細に述べています。さらに、2019年1月から2023年1月にかけて、選択基準を満たし、寧夏医科大学総合病院に入院した胸腰椎転移患者67人の臨床データを遡及的に分析しました。これらの患者は、異なる治療アプローチに基づいて2つのグループに分類されました。胸腰椎転移性腫瘍におけるラジオ波焼灼術および骨セメント強化療法(グループA、33例)および放射線療法群(グループB、34例)と組み合わせた分離手術の臨床効果を、さまざまな観察指標を用いて評価した。この解析は、脊髄転移性腫瘍の臨床治療法を選択するための基礎となります。
2019年1月から2023年1月にかけて、選択基準を満たし、当院に入院した胸腰椎転移の患者67名を対象に、レトロスペクティブ解析を実施しました。患者は、ラジオ波焼灼術と骨セメント強化を組み合わせた分離手術(グループA、33例)と放射線治療グループ(グループB、34例)の異なる治療方法に基づいて2つのグループに分けられました。2つのグループは、年齢、性別、原発腫瘍、原発腫瘍の発生時期、影響を受けた椎体、ESCCスコア、SINSスコア、冨田スコア、および徳橋スコア4について評価されました。これらの変数には統計学的有意性(P > 0.05)はなく、臨床ベースラインデータが2つのグループ間で一貫していたことを示しています(表1)。
プロトコル
この研究は、ヘルシンキ宣言の原則に従って実施され、研究プロトコルは治験審査委員会(IRB)によって承認されました。すべての患者と保護者は、書面によるインフォームドコンセントを提供しました。包含基準: (1) 術前画像検査および穿刺生検によって確認された胸腰椎転移性腫瘍。(2)1aを超える脊髄圧迫のESCC分類。(3) 修正徳橋スコアと富田スコア4による患者の予想生存期間≥3ヶ月。除外基準: (1) 原発性脊髄腫瘍;(2) 全身状態が不良または重篤な疾患を有し、全身麻酔や手術に耐えられなかった患者(3) アドヒアランスが不良で臨床データが不完全な患者使用した試薬や機器は 、材料表に記載されています。
1. 術前準備
- 図1に示すように、術前画像検査、H&E染色、免疫組織化学染色11により胸腰椎転移の診断を行います。
注:CK7、TTF-1、Ki67、CKpan、およびP40のH&E染色および免疫組織化学染色は、標準操作手順11に従って実施した。 - 図2に示すように、術前のX線、CT、およびMRIを使用して病変部位を評価し、局所脊椎病変と隣接セグメントの解剖学的構造を完全に理解します。
- 手術前に、心電図、SPECT/CT、胸部CT(図3)を行い、手術や麻酔が禁忌の患者さんは除外してください。
注: 患者とその家族は、手術前に手術関連のリスクと合併症について十分に知らされるべきであり、手術関連の同意に署名する必要があります。
2. 治療手順
- ラジオ波焼灼術および骨セメント強化と組み合わせた分離手術の外科的プロセス
- 切開と露出:Cアーム透視法を使用して、患部の椎骨を特定します。縦方向に10cmの切開を行い、後正中切開を使用して皮下筋膜と腰部背筋膜を切開し、傍脊椎筋を両側に押して、 図4Aに示すように、影響を受けた椎骨を中心とした上部と下部の椎骨の棘突起、椎弓板、関節突起、および横突起を明らかにします。
- 椎弓根スクリューの移植:横方向中点法12を使用して、影響を受けた椎骨の上部と下部の2つの椎骨の椎弓根スクリューの挿入位置を特定し、壁に穴を開け、タッピングし、プローブすることにより、椎弓根スクリューを順番にねじ込みます(図4B)。
注:ネジの位置は、Cアーム透視法を使用して十分に確認されました。罹患した椎骨の上部および下部の椎骨の骨粗鬆症または微小転移性病変に対して、椎骨を強化するために椎弓根スクリューチャネルを通じて1.5〜2mLの骨セメントを注入しました。 - 高周波アブレーション: 超音波骨ナイフを使用して、圧迫セグメントの椎弓板と両側椎間関節を切除し、影響を受けた椎骨の椎弓根アプローチを通る作業経路を確立します。
- ラジオ波アブレーション器具とラジオ波針を接続し、患部の椎骨の病変にラジオ波針を挿入します。電極針の裸の領域を、腫瘍のサイズと椎体のサイズに応じて1〜1.5cmに設定します。
- 図4Bに示すように、無線周波数の中心温度を80〜100°Cに保ちながら、10〜15分間無線周波アブレーションを実行します。
注:無線周波時間は、術中の状態に応じて調整されました。
- 影響を受けた椎骨のセメント補強: 図 4C、D に示すように、ステップ 3.1.3 で確立された作業経路を介して、透視法下で骨セメントを椎骨に約 3 〜 4 mL 押し込みます。
注:脊柱管に入らなかった骨セメントは満足のいくものでした。 - 分離手術:椎弓根アプローチを通じて脊髄硬膜の前部を露出させ、硬膜の背側と腹側に付着した腫瘍組織を慎重に切除します。
- 患椎の上下に隣接する椎間板と後縦靭帯を切除し、超音波骨ナイフを使用して椎骨の一部を切除して、充填された骨セメントに到達します。
- 図4Eに示すように、脊髄の周囲に360°の環状減圧を行い、硬膜と腫瘍組織との間に5mm以上の安全な隙間を確保します。
- 放射線治療の手順
- 脊髄転移性腫瘍の位置と範囲に応じて、強化されたCTスキャンを実行して腫瘍を特定し、MRIで標的領域をマッピングします。3次元の計画設計を適用して、腫瘍が十分な放射線量を受け、脊髄やその他の重要な臓器が保護されるようにします。
注:対象領域には、転移性椎体、両側椎弓根、棘突起、および横突起が含まれ、0.5cmの外部拡張が計画目標体積(PTV)を形成します。図5に示すように、6本のMV-Xビーム12を備えた体積変調アーク療法(VMAT)を使用します。セッションあたり8Gyは、全身状態が悪い患者、運動が困難な患者、複数回の放射線療法を受けている患者、または平均余命が短い患者にも投与できます。乳がんや前立腺がんなど、予後が良好な単一骨転移の場合、原発腫瘍が十分に制御されている場合は、局所放射線量を効果的に増加させ、腫瘍制御率を向上させることができる定位放射線治療または強度変調放射線治療技術を可能な限り使用する必要があります。
- 脊髄転移性腫瘍の位置と範囲に応じて、強化されたCTスキャンを実行して腫瘍を特定し、MRIで標的領域をマッピングします。3次元の計画設計を適用して、腫瘍が十分な放射線量を受け、脊髄やその他の重要な臓器が保護されるようにします。
3. 術後管理
- 手術後24時間以内に抗生物質の予防を投与します。患者のバイタルサイン、および両下肢の感覚と動きを監視します。 図6に示すように、手術後のX線によるフォローアップ。
注意: ドレナージ量が50mL未満の場合は、ドレナージチューブを取り外してください。手術の1週間後、歩行運動のために胸腰椎固定装具を着用し、合併症を防ぐために安静時の機能的な運動に集中します。
4. 統計解析
- SPSSソフトウェアを使用してデータを分析します。正規分布を満たす測定データを、平均±標準偏差を使用して記述します。
- 一元配置分散分析を実施して、グループ間で測定データを比較します。Kruskal-Wallis Hノンパラメトリック検定は、正規分布を満たさないデータに使用します。
- カウントデータを率(%)として表し、カイ2乗検定を使用してグループ間で比較します。 p値<0.05を統計的に有意なものと考えます。
結果
この研究は、胸腰椎転移性腫瘍の治療において、分離手術とラジオ波焼灼術および放射線療法を組み合わせることの有効性を調査することを目的としています。治療手順の代表的な画像、および術前および術後の評価を 、図1、 図2、 図3、 図4、 図5、および 図6 に示します(詳細については、プロトコルステップを参照してください)。
アウトカム評価
治療前、治療1週間後、1か月後、3か月後のVASスコア13 、および治療前、治療1か月後、および最後のフォローアップ中のFrankel GradeおよびKarnofskyスコア12 を比較して、2つの治療の臨床効果を評価しました。
臨床アウトカム
すべての患者を14.05か月±5.21か月(6〜24か月)追跡しました。.ラジオ波焼灼術や骨セメント漏出に関連する合併症は、グループAでは発生しなかった。手術時間は250.97分±77.85分で、失血は700mL±342.67mLでした。
VASスコアは、治療前の2つのグループ間で有意差を示さなかった(P > 0.05)。治療前と治療1週間後、1か月後、および治療後3か月のグループAのVASスコアは有意に減少し、グループBと比較して統計学的に有意な差がありました(P < 0.01)。治療前と治療1週間後とB群の間でVASスコアに統計学的有意差は認められず(t = 1.538、 P = 0.129)、この外科的治療は脊髄転移患者の疼痛症状を有意に改善できるが、放射線療法では患者の疼痛症状を迅速に改善できないことを示している(表2)。
両群の神経学的機能は、追跡期間中にさまざまな程度で回復した( 表3を参照のこと)。治療の1か月後、フランケルのグレードが低から高に改善した患者の割合は、グループAの33人中27人、グループBの34人中7人でした。最後の追跡調査では、フランケルのグレードが低から高に改善した患者の割合は、グループAの33人中33人、グループBの34人中18人でした。手術後1ヶ月の時点で、グループAとグループBの間には統計学的に有意な差が認められました(χ2 = 25.119、 P = 0.000)。また、前回の追跡調査では、A群とB群の間に統計学的に有意な差(χ2 =17.895、 P =0.000)が認められ、外科的治療を受けた患者の神経機能は放射線治療を受けた患者よりも有意に良好であったことが示された。
治療前の両群間でKPSスコアに有意差は認められなかった(P > 0.05)。グループAのKPSスコアは、治療後の1週間、1か月、3か月、および最後のフォローアップで有意に増加し、グループBと比較して統計的に有意な差がありました(P < 0.01)( 表4を参照)。
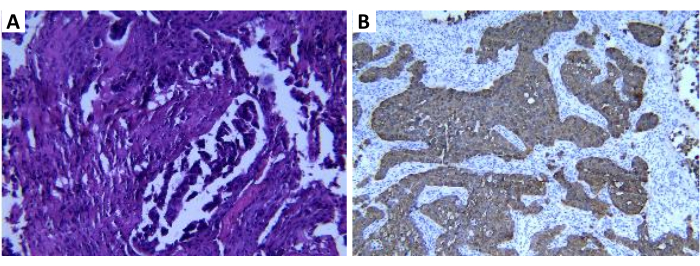
図1:代表的な術前穿刺病理 (A)免疫組織化学的結果と組み合わせた転移性腺癌と一致する上皮性悪性腫瘍を示す代表的な骨組織および過形成線維組織。(B)免疫組織化学的結果:癌組織CK7(+)、TTF-1(-)、Ki67(指数約70%)、CKpan(+)、および40(-)。倍率:200倍 この図の拡大版を表示するには、ここをクリックしてください。
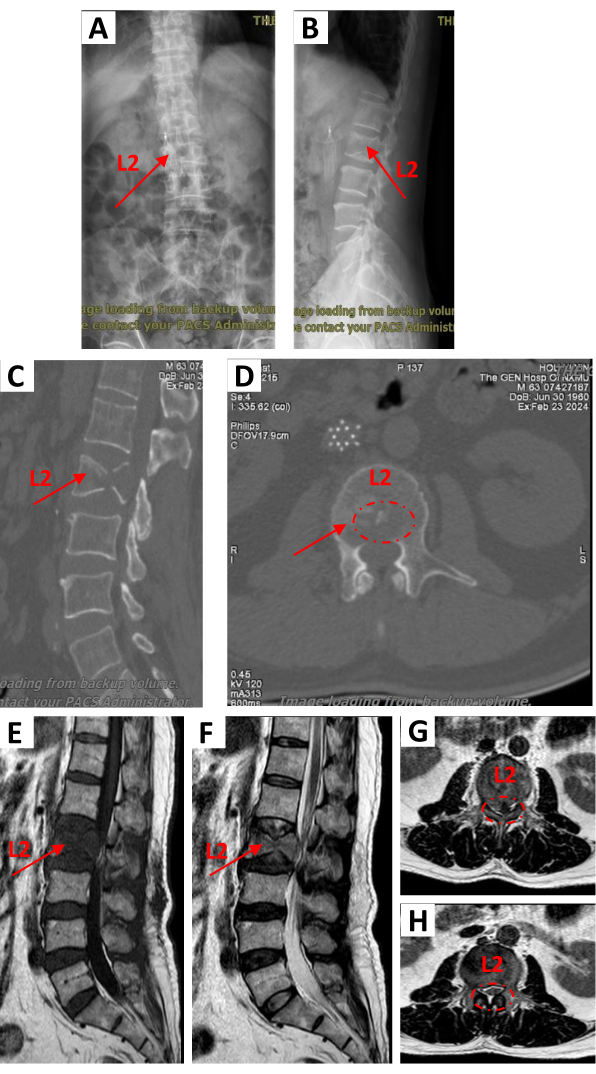
図2:術前の画像データ(A,B)代表的なX線写真、腰椎2椎骨のくさび形の変化を示唆。(C,D)-第2腰椎の骨破壊と病理学的骨折を示す術前CT画像(C、矢状、D、軸方向)。(E,F)腰椎MRI T1(E、矢状)は、第2腰椎に低信号でくさび形の椎体変化を示しました。腰椎MRI T2(F、矢状)は高い信号を示し、第2腰椎に新たな骨折を示しました。(G,H)腰椎MRI T2(軸方向)では高い信号を示し、脊髄が圧迫されました。L2は2番目の腰椎を表します。この図の拡大版を表示するには、ここをクリックしてください。

図3:術前定期検査。 (A)正常な心電図。(B)SPECT/CTでは、腰椎2椎骨に新たに活発な骨塩代謝が認められ、右腸骨は第2腰椎の病的骨折を含む骨転移とされた。L2は2番目の腰椎を表します。(C)肺がんの胸部CT検査。楕円形の破線は肺がんの病変部位を表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:外科的プロセス(A)術中切開部の露出。(B)椎弓根スクリューの埋め込みと高周波アブレーション。(C,D)影響を受けた椎骨のセメント補強。(E)分離手術。L2は2番目の腰椎を表します。この図の拡大版を表示するには、ここをクリックしてください。

図5:放射線治療の計画。 (A)放射線治療前のターゲットエリアの設計と計画。(B)腰椎転移性がんの他の領域における異なる放射線量。(C)腰椎転移性がんのさまざまな領域における放射線療法の他の方向。 この図の拡大版を表示するには、ここをクリックしてください。

図6:術後画像検査 (A,B) X線検査では、内固定位置は完璧で、骨セメントの充填は良好で、減圧は徹底していることが示された。L2は2番目の腰椎を表します。 この図の拡大版を表示するには、ここをクリックしてください。
表1:2つのグループ間の一般データの比較。この表をダウンロードするには、ここをクリックしてください。
表2:2つのグループ間の治療前と治療後のVASスコアの比較。.この表をダウンロードするには、ここをクリックしてください。
表3:2つの患者グループにおける治療前と治療後のフランケルの等級付けの比較。.この表をダウンロードするには、ここをクリックしてください。
表4:2つの患者グループにおける治療前後のKPSスコアの比較。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
徳橋スコア、冨田スコア、SINSスコア、ESCCスコアは、脊髄転移性腫瘍患者に対する外科的治療を選択するための確固たるエビデンスに基づく医学的根拠を提供しますが、患者に対する個別化された正確な治療計画を作成することは依然として複雑な問題です。従来の開腹手術、低侵襲手術、放射線療法、化学療法、免疫療法など、集学的で包括的な治療法が使用されます。Roy A. Patchell et al.14 は、脊髄転移性腫瘍による脊髄圧迫の患者にとって、術後放射線療法と組み合わせた直接減圧が放射線療法単独よりも優れていることを示す無作為化多施設非二重盲検研究を設計しました。従来の椎弓切除術または腫瘍部分切除術は、局所的な圧迫を緩和するだけです。外科的外傷は軽微であり、外科的合併症の発生率は低いですが、術後放射線療法から脊髄を保護するための放射線治療線量が不十分なために再発することが多く15、再発後の手術の可能性を大幅に減らします。したがって、一部の学者は、上記の2つの外科的方法13の利点を達成するために分離手術の概念を提案しています。
分離手術は、術後放射線治療のための十分なスペースを確保しながら、脊髄を効果的に減圧することができ、局所腫瘍の完全切除だけでなく、術後合併症の発生を最小限に抑えることができます。脊椎転移の治療には術後放射線療法が必要です。放射線治療感受性転移に対しては、優れた効果を発揮します。しかし、肝臓がんや非小細胞がんなどの転移性腫瘍に対する従来の放射線治療のコントロール率は30%程度にとどまっています。研究16 では、患者の約75%が放射線療法中に不完全な疼痛反応を示すと報告されました。放射線療法の完了後わずか10〜20週間で、緩和が最大限に発揮されますが、これは平均余命が短い患者の鎮痛効果を確保することが困難です。
高周波アブレーション(RFA)と椎体形成術を組み合わせると、脊椎腫瘍のある患椎骨の安定性と痛みの緩和が向上します17。脊椎後縁の皮質損傷または脊髄圧迫を伴う脊椎転移性腫瘍患者の治療では、RFAは単に椎骨の病変組織を圧迫するのではなく、影響を受けた椎骨に空間を作り出すことができる。この空間は、骨セメントの侵入を容易にし、骨セメントと椎骨の後皮質との間には特定の間隔があり、したがって、骨セメント漏出の合併症18を減少させる。しかし、脊髄神経の圧迫を効果的に緩和することはできず、その臨床的利益は限られています19。
RFAおよび骨セメント強化と組み合わせた分離手術は、脊椎転移の治療に明らかな利点があります。まず、ラジオ波焼灼術は、熱アブレーションによって腫瘍の微小血管を局所的に凝固させることができ、血管密度と術中出血を減らし、手術時間を短縮し、患者の術後疼痛症状を効果的に緩和します20。本研究では、治療後1週間、1ヶ月、3ヶ月後の時点で、A群のVASスコアはB群のVASスコアよりも有意に低かったことから、ラジオ波焼灼術や骨セメント強化と組み合わせた分離手術により、脊椎転移患者の疼痛症状を有意に改善できることが示されました。さらに、治療後1か月および最後のフォローアップ時に、グループAとグループBの間で神経機能の回復に統計学的に有意な差があり、手術で治療された患者は放射線療法で治療された患者と比較して有意に良好な神経機能を示した。
KPSスコアは主に患者の機能的能力を評価するために使用され、スコアが低いほど健康状態が悪いことを示します。この研究では、治療の1週間後、治療後3か月、および最後のフォローアップ時に、グループAとグループBの間のKPSスコアに統計学的に有意な差が示されました。これは、骨セメントと組み合わせた高周波焼灼術が手術領域の神経線維を破壊し、病変を減らし、炎症因子の産生を減少させることができるため、より良い痛みの緩和を達成し、生活の質を向上させることができるためである可能性があります21。
この手順には、次の主要なステップが含まれます: (1) 手術中のすべての患者に術中電気生理学的検査が必要です。(2)椎弓根スクリューの2つのグループを、影響を受けた椎骨の上部と下部の椎骨に埋め込む必要があります。上部と下部の椎骨に骨粗鬆症または小さな転移性病変がある場合は、椎弓根スクリューチャネルから1.5〜2 mLの骨セメントを注入して椎骨を強化するか、骨セメントスクリューを使用して椎弓根スクリューの生体力学的強度を強化する必要があります。(3)ラジオ波アブレーションが最初に行われ、次に骨セメントを使用してラジオ波チャネルを通じて椎骨を強化します。高周波範囲は、手術前の病変の大きさに応じて決定され、高周波アブレーション中に脊髄周囲の温度変化が監視されます。(4)分離手術の過程では、硬膜と腫瘍組織との間に5mm以上の安全な隙間を確保するために、脊髄の360°環状減圧を行う必要があります。
脊椎転移に対する手術と放射線療法の間隔は、切開治癒を可能にするために2週間以上であるべきである22。この研究では、グループAの患者は、術後放射線療法を待っている間、局所腫瘍の進行がありませんでした。腫瘍の進行を抑制するという点では、ラジオ波焼灼術および骨セメント強化療法と組み合わせた分離手術がより有利であった。著者らは、術前腫瘍進行の理由を次のように考えています:(1)手術領域での化学療法の長い間隔;(2)原発腫瘍の特性と密接な相関関係がある。(3)手術中に分離手術の基準を完全に満たさなかった。(4)患者は、脊椎転移手術または進行がん治療後の痛みや症状の緩和、回復、予後に対して過度に楽観的な期待を抱くことがよくあります23。
しかし、ラジオ波焼灼術と骨セメント強化を組み合わせた分離手術は、胸腰部転移性腫瘍の治療において満足のいく臨床結果を達成しています。それにもかかわらず、この研究にはまだいくつかの制限があることを認めなければなりません:(1)この研究は、証拠のレベルが低いレトロスペクティブ臨床研究です。(2)サンプルサイズが小さい単一施設研究です。(3)脊髄転移を有する患者における原発腫瘍の不均一性は大きく、これは研究の不均一性をさらに増加させます。(4) 脊髄転移を有する患者は、生存期間が短く、経過観察期間が短い。したがって、この研究の結果をさらに解明するには、前向き、多施設、大規模サンプル、無作為化比較試験を設計する必要があります。
開示事項
著者は何も開示していません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| Bone cement | Tecres S.P.A | 1230 | |
| CArm Xmedical equipment | Siemens Healthcare | Cios Spin | |
| CT machine | Siemens Healthcare | SOMATOM Force | |
| MRI machine | Siemens Healthcare | MAGNETOM Terra | |
| Pedicle screws | Shandong Weigao Medical Equipment Co., LTD | Premier-6.6mm*45mm | |
| Radio-frequency ablation instrument | Mianyang Leading Electronic Technology Co.,ltd. | LDRF-120S | |
| Radiofrequency ablation needle | Mianyang Leading Electronic Technology Co.,ltd. | RFDJ03 | |
| Radiofrequency Ablation Needle | Varian Clinac | IX | |
| Ultrasonic Osteotome System | Misonix INC | MXB-10 | |
| X-ray machine | Philips Investment Co., LTD. Medical system | XR/a |
参考文献
- Yang, T., et al. Clinical guidelines for microwave ablation of spinal metastases. J Cancer Res Ther. 18 (7), 1845-1854 (2022).
- Shah, S., et al. Management of metastatic spinal cord compression in secondary care: A practice reflection from Medway Maritime Hospital, Kent, UK. J Pers Med. 11 (2), 110 (2021).
- Wänman, J., et al. Metastatic spinal cord compression as the first sign of malignancy. Acta Orthop. 88 (4), 457-462 (2017).
- Sullivan, P. Z., et al. Evolution of surgical treatment of metastatic spine tumors. J Neurooncol. 157 (2), 277-283 (2022).
- Jones, M., et al. En Bloc resection of tumors of the lumbar spine: A systematic review of outcomes and complications. Int J Spine Surg. 15 (6), 1223-1233 (2021).
- Lockney, D. T., et al. Spinal stereotactic body radiotherapy following intralesional curettage with separation surgery for initial or salvage chordoma treatment. Neurosurgical Focus. 42 (1), 4 (2017).
- Barzilai, O., et al. Hybrid therapy for metastatic Epidural spinal cord compression: Technique for separation surgery and spine radiosurgery. Operative Neurosurg. 16 (3), 310-318 (2019).
- Kang, D. H., Chang, B. S., Kim, H., Hong, S. H., Chang, S. Y. Separation surgery followed by stereotactic ablative radiotherapy for metastatic epidural spinal cord compression: A systematic review and meta-analysis for local progression rate. J Bone Oncol. 36, 100450 (2022).
- Bate, B. G., Khan, N. R., Kimball, B. Y., Gabrick, K., Weaver, J. Stereotactic radiosurgery for spinal metastases with or without separation surgery. J Neurosurg-Spine. 22 (4), 409-415 (2015).
- Wallace, A. N., Greenwood, T. J., Jennings, J. W. Radiofrequency ablation and vertebral augmentation for palliation of painful spinal metastases. J Neurooncol. 124 (1), 111-118 (2015).
- Dave, B. R., Nanda, A., Anandjiwala, J. V. Transpedicular percutaneous biopsy of vertebral body lesions: A series of 71 cases. Spinal Cord. 47 (5), 384-389 (2009).
- Verma, K., Boniello, A., Rihn, J. Emerging techniques for posterior fixation of the lumbar spine. J Am Acad Orthop Surg. 24 (6), 357-364 (2016).
- Barzilai, O., et al. Integrating evidence-based medicine for treatment of spinal metastases into a decision framework: Neurologic, oncologic, mechanicals stability, and systemic disease. J Clin Oncol. 35 (21), 2419-2427 (2017).
- Patchell, R. A., et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: A randomised trial. Lancet. 366 (9486), 643-648 (2005).
- Hansen-Algenstaedt, N., et al. Comparison between minimally invasive surgery and conventional open surgery for patients with spinal metastasis: A prospective propensity score-matched study. Spine. 42 (10), 789-797 (2017).
- Lutz, S., et al. Palliative radiotherapy for bone metastases: An ASTRO evidence-based guideline. Int J Radiat Oncol Biol Phys. 79 (4), 965-976 (2011).
- Kam, N. M., et al. Combined vertebral augmentation and radiofrequency ablation in the management of spinal metastases: An update. Curr Treat Options Oncol. 18 (12), 74 (2017).
- Sandri, A., et al. Combined radiofrequency and kyphoplasty in painful osteolytic metastases to vertebral bodies. Radiol Med. 115 (2), 261-271 (2010).
- Shawky Abdelgawaad, A., Ezzati, A., Krajnovic, B., Seyed-Emadaldin, S., Abdelrahman, H. Radiofrequency ablation and balloon kyphoplasty for palliation of painful spinal metastases. Eur Spine J. 30 (10), 2874-2880 (2021).
- Clausen, C., et al. Preoperative embolization in surgical treatment of spinal metastases: Single-blind, randomized controlled clinical trial of efficacy in decreasing intraoperative blood loss. J Vasc Interv Radiol. 26 (3), 402-412 (2015).
- Sayed, D., Jacobs, D., Sowder, T., Haines, D., Orr, W. Spinal radiofrequency ablation combined with cement augmentation for painful spinal vertebral metastasis: A single-center prospective study. Pain Physician. 22 (5), E441-E449 (2019).
- Lee, B. H., et al. Perioperative complication and surgical outcome in patients with spine metastases: retrospective 200-case series in a single institute. Clin Neurol Neurosurg. 122, 80-86 (2014).
- Gal, R., et al. Pre-treatment expectations of patients with spinal metastases: What do we know and what can we learn from other disciplines? A systematic review of qualitative studies. BMC Cancer. 20 (1), 1212 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。