Method Article
低DNA断片化指数で高品質の精子を調製するためのU字型水平遊泳技術
要約
このプロトコルは、精子の運動特性とチグモタキシスを利用して、DNA断片化指数が低い高品質の精子をスクリーニングする方法を説明しています。U字型の水平スイミングレーンを採用しているため、死んだ精子や細胞残骸、不純物を排除しながら、バッファー液滴を通じて高品質な精子を反対側に届けることができます。
要約
ヒト精液は、漸進的に運動する精子、非漸進的に運動する精子、不確定な精子、細胞破片、および粘性精漿を含む複雑な混合物である。高品質の精子とは、正常な形態を持つ進行的に運動する精子を指し、多くの場合、DNA断片化指数(DFI)が低く、受精能が高いことを示しています。高品質の精子を準備することは、人間の生殖補助医療における重要なステップです。従来の精子調製方法である不連続密度勾配遠心分離法(DGC)は、時間と労力がかかります。遠心分離を繰り返すと、精子のDNAが損傷し、その後の受精や胚発生に影響を与える可能性があります。この研究では、細胞質内精子注入(ICSI)精子を調製するためのU字型水平遊泳(UHS)法を導入し、遠心分離が精子DNAに及ぼす悪影響を大幅に排除します。UHS法では、ICSI操作皿内に受精媒体を使用してUHSレーンを作成します。10μLの受精培地の微小液滴をUHSレーンの左側の起点に配置して、精液を保持します。さらに2つの10μL受精培地バッファー液滴がレーンの左中央セクションに沿って間隔を置いて配置され、すべての液滴が受精培地で接続されています。次に、皿を培養油で覆い、6%のCO2 で37°Cで一晩インキュベートして平衡化します。続いて、開始点の微小液滴に3μLの精液を添加します。高品質の精子はUHSレーンの右側に泳ぎ、ICSI注射針への吸引を促進します。死んだ精子、細胞の破片、およびその他の粘性不純物は、主に初期点またはバッファー液滴に残ります。UHSとDGCの両方の技術を使用して21の精液サンプルを同時に処理し、それらのDFIを比較しました。その結果、DGC群のDFIは5.5%±3.2%であったのに対し、UHS群のDFIは1.7%±1.1%でした。2群間の差は統計学的に有意であった(P < 0.05)。
概要
精液の最適化と精子調製技術は、構造的および機能的に優れた精子を豊富に含む細胞画分を得る上で重要な役割を果たします。これは、ヒト生殖技術1の重要なステップです。精液最適化の目的は、(1)精漿中のプロスタグランジン、免疫活性細胞、抗精子抗体、動かない低品質の精子、細菌、および破片を減少または除去することです。(2)精液の粘度を下げるか、または排除します。(3)精子の能力化を促進し、受精能力を高めます。理想的な精子調製技術は、DNAの完全性を維持し、精子と白血球による活性酸素種(ROS)の生成による機能不全を引き起こさない高機能な精子集団を回復させるべきである2。
現在最も広く使用されている精子調製技術はDGC法です。この方法の利点は、回収率が高いこと3 と標準化が容易であることです。実用化では、倍密度グラジエント法4、mini-DGC法、単層グラジエント遠心法5など、試料の品質に応じて柔軟に選択することができます。この方法は、細胞の破片、汚染された白血球、非生殖細胞、および変性生殖細胞を含まない、活力のある高品質の精子を準備するために使用できます。しかし、この方法の欠点は、遠心分離が必要であり、精子DNA6に損傷を与える可能性があることです。
ここで紹介した方法は、Baldiniらによる元の研究から適応されたもので、注射皿内の精子の水平移動に焦点を当てた7。この修正された方法は、U字型の水平レーンを組み込んで、生命力の強い高品質の精子を分離します。遠心分離によるDNA損傷を回避し、細胞質内精子注入(ICSI)手順中の死んだ精子、細胞破片、およびその他の粘性不純物の影響を最小限に抑えます。
具体的なアプローチでは、受精培地を使用して、ICSI操作皿にUHSレーンを作成します。10μLの受精培地マイクロ液滴をUHSレーンの左開始点に配置して、精液を保持します。さらに2つの10μL受精培地バッファー液滴がUHSレーンの左中央セクションに間隔を置いて配置され、すべての液滴が受精培地によって接続されます。培養油でセットアップを覆った後、皿を37°Cで一晩インキュベートし、6%CO2 で平衡化します。その後、3 μL の精液を UHS レーンの左側の開始点にある微小液滴に添加します。高品質の精子はUHSレーンの右側にあるトラックまで泳ぎ、ICSI注射針で収集を容易にします。死んだ精子、細胞の破片、およびその他の粘性不純物は、主に元の場所またはバッファー液滴に残ります。
マイクロ流体チップは、女性の生殖管での自然選択プロセスをシミュレートし、遠心分離なしで精液から高品質の精子を最適に分離することを可能にします。これは、精子の運動性8を改善し、精子DNA断片化指数9を減らし、妊娠結果10を向上させるために重要です。しかし、このようなデバイスの製造は複雑で、コストがかかり、広く実装することは困難です。
本明細書に記載されているプロトコルは、新規で、単純で、実行可能な代替手段を提供します。精子の運動特性を活用することで、マイクロ流体技術に匹敵する結果が得られます。調製された精子は、強い生命力と低いDNA断片化指数を示し、顕微授精での使用に適しています。
プロトコル
この研究は、南京医科大学の付属淮安第一人民病院の医療倫理委員会によって承認されました (承認番号: KY-2024-181-01)。インフォームドコンセントは、この研究でサンプルが使用された患者から得られました。この手順は、優れた実験室の実践と臨床ガイドライン11,12に従って、経験豊富な担当者が実施する必要があります。使用した試薬や機器の詳細は、資料表に記載されています。
1. ICSI手術皿の準備
- 20μLの施肥培地を使用して、ICSI操作皿にU字型のトラックを作成します(図1)。U字型のトラックの左トラックの長さは約30mmで、右トラックの長さも約30mmである必要があります。
- 10μLの受精培地をピペットで吸引し、U字型トラックの左開始点に円形の液滴を作成します。U字型トラックの左の始点に接続して、精液ストック溶液を追加します。
- UHSレーンの左中央部分に間隔を置いて2つの10μL施肥培地バッファー液滴を作成します。すべての液滴を受精培地に接続します。
- 2.5 μL ポリビニルピロリドン (PVP) を使用して、U 字型レーンの右側に長い液滴のストリップを作成します。PVPストリップがU字型レーンの右レーンと平行であることを確認します。
- PVPストリップの右側にある卵子プロセッシング培地を使用して、液滴あたり20μLの6つの微小液滴を作成します。
- 7 mLの培養油を皿に加え、油が液滴の最高点を覆うようにします。バランスを取るために、37°C、6%CO2 インキュベーターに一晩置きます。
2.精液サンプル収集
- 精液サンプルの収集に関して、患者に書面および口頭での明確な指示を提供します。サンプル収集が完了していることを確認し、収集の3〜7日前に射精を控えるように患者に指示します。
- オナニー で 精液を使い捨て、無菌、無毒の専門精子採取カップに集めます。射精全体が収集されていることを確認し、サンプルの任意の部分の損失を報告するように個人に指示します。
- 患者の配偶者の名前、有効な身分証明書、指紋を確認します。精子採取カップの本体と蓋に、患者の配偶者の名前と医療記録番号をマークします。
- 男性患者様が精液を採取した後、スタッフと患者様と対面して検体を手渡します。包装および貯蔵のための精液のサンプルの少量を取って下さい。患者が包装エリアで署名していることを確認してください。
- カプセル化された標本に番号を付けて2年間保管します。患者情報、識別番号、レシピエントと目撃者の署名を精液処理ログブックに記録します。
- 生殖センターの職員が不審な患者の身元を発見した場合は、検体の受け取りを中止し、患者の身元を再確認してください。同時に2つ以上の標本を受け取らないでください。標本に混同の疑いがある場合は、受け取りを中止してください。
3. 精液検体の解析
- 精液標本の色を観察します。
注:通常の精液は、液化後、均質で灰白色に見えます。精子濃度が非常に低い精液は透明に見えることがあります。赤血球が存在する場合、精液は赤褐色に見えることがあります。患者が黄疸を患っているか、特定のビタミンを摂取している場合、精液が黄色に見えることがあります。 - 0.1mLの精度で計量方法を使用して精液の量を測定します。
- 精液サンプルを37°Cで15〜30分間置きます。それを広口径(直径約1.5mm)のプラスチック製使い捨てピペットに吸引し、重力によって精液を落下させます。糸の長さを観察します。
注:通常の液化射精液は、小さな離散的な滴を形成します。粘度が異常な場合、液滴は2cmより長い糸を形成します。 - それでも精液が60分以内に液化しない場合は、同量の受精培地を追加します。次に、使い捨てのプラスチック移送ピペットを使用して、混合物が完全に液化するまで繰り返し吸い込みと吐き出を繰り返します。
- 精密pH試験紙(pH 6.0-10.0)を用いて精液のpH値を測定します。
- 10 μLの完全に液化した精液を取り、Makler計数チャンバーに滴下します。光学顕微鏡を使用して200倍フィールド下で精子の運動性を評価します。精子の凝集と非精子細胞の存在を観察します。
- 光学顕微鏡を用いて200倍フィールド下での精子濃度を評価します。
4. 卵子を拾う
- 卵子採取前日に卵子採取(OPD)用の皿を用意します。2.5 mLの卵子プロセッシング培地を35 mmの滅菌培養皿に加えます。次に、1.5 mLの油を加え、皿を37°Cのインキュベーターに一晩置いて平衡化します。
- 卵子培養(OCD)用の皿を2皿用意する:卵子回収の前日に。滅菌セントラルウェル培養皿の内側のリングに1mLの受精培地を加え、次に1mLの油を加えます。外輪に4mLの受精培地を加えます。ディッシュを37°C、6%CO2 インキュベーターに入れ、一晩平衡化します。
- すべてのヒーターと加熱プレートの電源を入れ、卵子回収の30分前に温度を測定します。
- 手指消毒剤で手を洗い、流水で十分にすすいでください。清潔で滅菌済みでほこりのない手袋を着用してください。
- 滅菌培養皿を37°Cの加熱プラットフォームで予熱します。
- 卵子を回収する前に、患者の身元を厳密に確認してください。
- 陰圧で卵胞液を滅菌試験管に吸入し、すぐに実験室の発生学者に引き渡します。
- すべての卵胞液を無菌培養皿に注ぎ、低倍率実体顕微鏡で卵母細胞コロナ卵丘複合体(OCCC)を検索します。ピペットを使用してOCCCをピックアップし、OPDに入れて37°Cで一時的に保管します。
- 卵胞液中のOCCCの量、色、卵胞の数、および数を記録します。
- 卵子の回収後、滅菌パスツールピペットを使用してOCCCをOCDに移します。それらを培養インキュベーター(37°C、6%CO2、5%O2、および飽和湿度)に2時間すばやく置きます。
- 4ウェル皿を調製し、最初のウェルに0.5 mLのヒアルロニダーゼ溶液を、残りの3つのウェルのそれぞれに1 mLの卵子プロセッシング培地を加えます。37°Cで1時間インキュベートします。
- パスツールピペットを使用して、ステップ4.10のOCCCをウェルコンセプンヒアルロニダーゼに30秒間移します。次に、OCCCをウェルコンセプティング卵母細胞処理培地に移します。
- 直径150μmの卵子ストリッピングチューブを使用してOCCCを吹き飛ばし、吸引して顆粒膜細胞を除去します。次に、新しいパスツールピペットを使用して、卵子を卵子処理培地に移し、洗浄します。それらを別の予め平衡化したOCDに移し、37°C、6%CO2 インキュベーターに入れます。
5. 精子選択と顕微授精の手術
- ステップ1.1からステップ1.6まで調製したICSI操作皿のU字型トラックの左開始点にある受精培地の微小液滴に5μLの精液を加えます。
- ICSI操作皿を37°C、6%CO2 のインキュベーターに30〜60分間入れます。
- 倒立顕微鏡、顕微鏡オペレーティングシステム、ステージ加熱ステージを開くと、すべての操作制御が元の制御可能な範囲に復元され、スムーズで快適な操作が可能になります。
- ICSI針を針ホルダーに取り付けます。ニードルホルダーをマイクロマニピュレーターに固定し、4倍対物レンズの保持針と注射針を調整し、2本の針がステージに対して相対的で平行になるように、それらの角度と位置を順次調整します。× 20対物レンズの下の操作針の可動範囲を確認してください。
- 4倍対物レンズの下の卵子保持針と注射針の角度と位置を調整して、2つの針の頭がステージに対して相対的で平行になるようにします。手術針を前後左右に動かします。10xおよび20x対物レンズの下での操作針の移動範囲を確認してください。
- 卵子保持針と注射針を持ち上げて、手術台と加熱台の間の高さが手術針に触れることなく手術血管を簡単に配置できるようにします。
- 再確認後、ステップ4.12で選択した卵子をICSI操作皿内の卵子処理培地微液滴に、液滴ごとに1つずつ移します。
- 卵子を含む手術皿を、準備した顕微鏡オペレーターのホットステージに置きます。
- 10倍対物レンズの下で顕微鏡の焦点距離を調整して、手術皿内の微小液滴の端をはっきりと見えるようにします。
- ICSI操作皿のPVPストリップに注射針を下げます。顕微鏡を調整して注射針がはっきりと見えるようにし、同時に少量のPVPを注射針に吸い込みます。
- U字型トラックの右側にある長いストリップに注射針を移動させ、良好な形態と進行性の運動性を持つ高品質の精子を抽出します。
- 精子を右側のPVPストリップに移し、手術皿の底に精子を置きます。
- 精子の尾の中央または下部にある注入針をそっと押し、注入針をすばやく引き戻し、精子を引っ掻いて止めさせます。
- 尾から頭までの精子を注射針に吸い込みます。
- 右側の卵子を含む卵子処理培地液滴に注射針を移します。
- 卵子保持針を下げ、卵子をゆっくりと動かして、最初の極体を12時の位置に配置し、卵子を固定します。
- 顕微手術針と卵母細胞膜を同じ水平面に調整します。精子を注射針先に押し込みます。
- 卵子の3時位置にある透明帯を垂直に通過し、注射針をわずかに引っ込めて、針が卵子の中心に到達するか、中心位置をわずかに横切るまで針を注入し続けます。
注:細胞質と精子で急速な逆流が起こると、卵母細胞の膜が壊れて吸引が止まったことを示します。 - 卵子の細胞質に精子をゆっくりと注入し、注射針を出します。細胞質への精子注入の深さは、卵母細胞の直径の約50%〜75%であるべきです。
- 注射針を抜いた後、卵子保持針の負圧を調整して卵子を解放します。
- すべての成熟卵子が注入されるまで、上記の手順を繰り返します。
- ICSIディッシュを顕微鏡ホットプレートから解剖顕微鏡に移します。
- 卵割培養皿をインキュベーターから取り出します。
- 注入した精子卵子を切断培養皿の微小液滴に移します。
- 切断培養皿を37°C、6%CO2、5%O2 インキュベーターに戻します。
6. DGC法による精子の調製
- 1.5 mLの45%密度グラジエント遠心分離溶液を15 mLの滅菌円錐底試験管に加えます。
- 2つの液体間の界面を維持しながら、1.5 mLの90%密度勾配遠心分離溶液を45%密度勾配遠心分離溶液の底にゆっくりと加えます。
- 液化した精液をグラジエント遠心分離溶液に穏やかに加え、300 x g で15分間(室温)遠心分離します。
- 上清を取り除き、残りの精子沈殿物約0.5mLを受精培地3mLに加えます。ブローしてよく混ぜます。
- 室温で200 x g を5分間遠心分離します。
- 上清をピペットで挟み、約0.2mLの沈殿物を残します。
- 適切な量の受精培地を追加して、沈殿物を再懸濁し、精子の濃度と活力をカウントし、記録します。後で使用するために、37°C、6%CO2インキュベーターに入れます。
7. 精子核DNAの完全性検出(Sperm Chromatin Dispersion Method, SCD)
- 実験を行う前に、室内温度を20〜28°Cに調整してください。試薬キットを取り出し、室温で30〜60分間平衡化します。
- 変性液を調製する:0.8 mLの濃縮変性液を取り、100 mLの蒸留水に加えます。
- 70%エタノール溶液を調製する:26.65 mLの蒸留水と70.35 mLの無水エタノールを使用して、70%エタノール溶液を調製します。
- 90%エタノール溶液を調製する:9.55 mLの蒸留水と90.45 mLの無水エタノールを取り、90%エタノール溶液を調製します。
- 低融点アガロースチューブ(25μLの低融点アガロース溶液を含む)を90〜100°Cのウォーターバスに1〜2分間入れ、アガロースゲルが完全に溶けるまで待ちます。次に、温度が一定になるまでチューブを37°Cのウォーターバスに5分間置きます。
- 最適化治療前に3〜10μLの精液を、最適化治療後に精子懸濁液を摂取します。それらを異なる低融点アガロースチューブに加え、十分に混合します。
- 精子を含む低融点アガロース懸濁液30μLを取り出し、前処理したスライドガラス上に水平に滴下します。
- カバーガラス(22mm×11mm)をスライドで優しく覆い、気泡の発生を極力避けます。
- 前処理したスライドガラスを2〜8°Cの冷蔵庫に4分間置き、プロセス全体を通してスライドを水平位置に保ちます。スライドガラスを冷蔵庫から取り出し、そっとスライドさせてカバーガラスを取り外します。
- 前処理したスライドガラスを変性溶液に素早く7分間浸漬します。
- 前処理したスライドガラスを取り外し、蒸留水に5秒間浸します。
- 前処理したスライドガラスを取り外し、直立させます。濾紙を使用してスライドの表面の水滴を吸収し、試料領域に触れないようにします。
- 前処理したスライドガラスを溶解バッファーに浸し、20分間正確に反応させます。
- 前処理したフラグメントを洗浄液に3分間浸して、溶解液を洗い流します。
- 前処理したスライドガラスを取り出し、70%エタノール溶液に2分間浸します。
- 前処理したスライドガラスを取り出し、90%エタノール溶液に2分間浸漬します。
- 前処理したスライドガラスを取り外し、無水エタノール溶液に2分間浸漬します。
- 前処理したスライドガラスを取り外し、自然乾燥させます。
- ライト染色液Aと溶液Bを茶色の空のボトルに1:1の比率で調製します。
- 前処理したスライドガラスを水平に置き、混合染料溶液をスライド上に加え、色素溶液がスライド全体(約0.5〜1mLの色素溶液)を覆うようにします。
- 5分間染色した後、ステンドグラススライドを蒸留水で10〜15回やさしくすすぎ、余分な汚れ剤を取り除きます。
- スライドガラスを自然乾燥させ、光学顕微鏡で400×観察します。200個以上の精子を数え、小さなハローリング、ハローリングなし、変性を伴う異常な精子の割合を決定します。
8. 統計分析
- 市販のソフトウェアを使用して統計分析を行います。
- フリードマン検定を使用して、元の精液、DGC、およびUHS間のDFI(%)を比較します。
注: 2 つの方法のペアワイズ比較では、Wilcoxon 符号順位検定を使用します。0.05 ≤ p 値を統計的に有意であると考えます。
結果
UHS法とDGC法を使用して、21のサンプルの処理を最適化し、2つの方法間で精子DNA断片化指数を比較しました。ICSIディッシュのUHSトラックを使用する方法は、DGCを置き換えることができ、精子に損傷を与える可能性があります。進行性の運動性が良好な高品質の精子は、U字型のトラックの端に沿ってスムーズに泳ぎ(図2)、ICSI針がそれらを個別につかみやすくなります。UHSトラックを使用して分離された高品質の精子は、DFIが低くなっています(図3)。
図3に示すデータを生成するために、DGC法とUHS法で分離した高品質の精子のDFIを精子クロマチン分散(SCD)法を使用して検出しました。その結果、DGCで分離した高品質精子のDFIは5.5%±3.2%と高かったのに対し、UHS法で分離した高品質精子のDFIは1.7%±1.1%であった(P < 0.05)(表1)。

図1:既製のICSI操作パネル。 左側はU字型の精子レーンで、精液を追加するための円形の液滴が始まります。2つのバッファー液滴が左側のレーンに配置され、動かない精子、細胞の破片、および粘性不純物をろ過します。中央には、精子の固定化に使用されるPVPの長いストリップがあります。右側には、6つの卵子プロセシング培地液滴が順番に並べられており、卵子の放出とICSI穿刺手術に使用されます。(A)概略図。(B)現実的な眺め。 この図の拡大版を表示するには、ここをクリックしてください。

図2:バッファ液滴とU字路の右トラック端の画像の比較 (A)バッファ液滴には、精液からの丸い細胞、動かない精子、細胞破片、不純物などが大量に含まれています。(B)高品質の精子がUHSトラックの右端に分散して前方に泳ぎ、ICSI針吸引を促進します。倍率:200倍。この図の拡大版を表示するには、ここをクリックしてください。
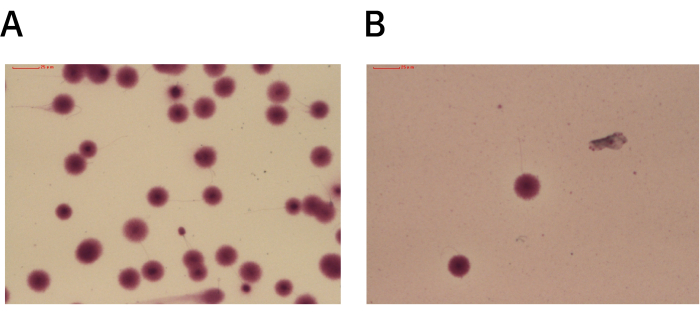
図3:DGCまたはUHSによって得られた高品質の精子のSCDアッセイからの代表的な画像。 (A)DGCを使用して処理されたSCDアッセイスライドで、ハローが最小限またはまったくない断片化された精子細胞を示しています。残りの精子細胞は、分散したDNAの大きなハローを示し、断片化がないことを示しています。(B)UHS法を用いて処理されたSCDアッセイスライドで、分散したDNAの大きなハローを有する非断片化精子細胞を実証。倍率:100倍 この図の拡大版を表示するには、ここをクリックしてください。
| アイテム | SD±平均 | 範囲 |
| 年齢(年) | 30±3.6 | 26-38 |
| 精液量(mL) | 3.50±1.27 | 1.6-5.9 |
| 精子濃度(×106/mL) | 65.91±24.65 | 38.76-146.63 |
| 漸進的な運動性(%) | 57.46±10.49 | 28.65-77.69 |
| 総運動性(%) | 78.1 ± 8.67 | 44.99-83.50 |
| オリジナル精液のDFI(%) | 8.0 ± 4.3 | 2.4-19.8 |
| DGCのDFI(%) | 5.5 ± 3.2* | 1.7-16.3 |
| UHSのDFI(%) | 1.7 ± 1.1* | 0-4.4 |
| 注:*オリジナル精液のDFI(%)と比較すると、 P <0.05です。 | ||
表1:研究母集団に関する一般情報(n = 21)。
ディスカッション
この記事で説明するUHS法を使用して高品質の精子を分離するための重要なステップは、バッファー液滴を備えたUHSレーンの確立です。UHSレーンとバッファー液滴はどちらも、洗浄して受け取った精液を使用して作成されます。UHSレーンは、高品質の精子が自由に泳ぎ、トラックの端に沿って蓄積するようにガイドするため、収集が容易になります。緩衝液滴は精液の粘度を下げ、死んだ精子、細胞の破片、その他の不純物をろ過します。UHSレーンの右側と平行なPVPストリップとの間の距離は、ICSI針全体の移動に必要な時間を短縮するために最小限に抑える必要があります。
不連続密度勾配法と比較して、UHSレーン法は実験室の人員の手動操作ステップが少なくて済むため、労働集約度を下げることができます。UHSレーン法で得られた高品質の精子は、遠心分離手順を繰り返さないため、DFIが低くなります。これは、受精、妊娠結果、および子孫の安全性により助長されます13。
ここで提示するプロトコルの主な制限は、高品質の精子の自己遊泳能力に大きく依存していることです。この方法は、精子が完全に動かない患者には適していません。極端な無精子症や極端な乏精子症の場合、正しい軌道まで泳ぐことができる高品質の精子が少ないため、高品質の精子の検索時間が長くなる可能性があります。場合によっては、左のトラックまたはバッファー液滴から高品質の精子を探す必要があるかもしれません。これらの領域にある死んだ精子、細胞の破片、および粘性不純物は、ICSI針の閉塞を引き起こし、ICSI手順全体を延長し、受精率に影響を与える可能性があります。
ここで紹介した方法は、Baldiniらによる元の研究から適応されたもので、注射皿内の精子の水平移動に焦点を当てた7。Baldiniらのアプローチでは、小さな培地で接続された3つの液滴が、第1の液滴(精子が追加される場所)から第3の液滴(精子が吸引される場所)への精子の水平移動を促進し、液滴をつなぐ2つの架橋を備えていました。しかし、このアプローチでは、高品質の精子が移動する距離が短いため、精液中の他の成分からまだ完全には分離されていません。特に粘性のある精液や不純物は、顕微授精の針の貼り詰まりを引き起こし、顕微授精の手術失敗につながる可能性があります。
DNAが無傷の運動性精子は、チグモタキシスの特徴を示し、境界壁14の近くを泳ぐ傾向があることを意味する。別の研究では、チグモタキシスが分離した精子の質に大きく影響することがわかりました15。これらの研究結果に基づいて、チグモタキシスは精子分離に重要な役割を果たしています。この方法のU字型軌道は境界が長いため、高品質の精子の自由な動きが容易になり、動かない精子、不純物、およびその他の成分から完全に分離できます。さらに、高品質の精子がトラックの端に蓄積するため、ICSI手順中の把握と操作が容易になります。
結論として、現在のプロトコルでは、ICSIディッシュでUHSレーンを使用して高品質の精子を分離することが示されています。この手順では、人員による手動の手順が少なくて済むため、分離された精子のDFIが低くなります。この方法は、 体外 受精研究室でのプロモーションと応用に適しています。
開示事項
著者は何も開示していません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| 7% Polyvinyl pyrrolidone Solution | Vitrolife Sweden AB | 10111 | ICSI |
| Aspirator | LABOTECT | - | Aspirator |
| Biological clean workbench | Suzhou Antai | - | Biological clean workbench |
| Blastocyst culture medium | Vitrolife Sweden AB | 10132 | Blastocyst culture medium |
| Cleavage culture medium | Vitrolife Sweden AB | 10128 | Cleavage culture medium |
| CO2 incubator | Thermo Scientific | - | CO2 incubator |
| Culture oil | Vitrolife Sweden AB | 10029 | OVOIL |
| Disposable plastic transfer pipette | BD Falcon | 357575 | disposable plastic transfer pipette |
| Fertilization medium | Vitrolife Sweden AB | 10136 | G-IVF PLUS |
| ICSI operating dish | BD Falcon | 351006 | Petri dish |
| Instant hyaluronidase | Vitrolife Sweden AB | 10017 | Instant hyaluronidase |
| Inverted microscope | NIKON | - | Inverted microscope |
| IVF Workstation | Denmark K-SYSTEM | - | IVF Workstation |
| Makler counting chamber | Sefi Medical Instruments | Makler counting chamber | |
| Micro operating system | NIKON | - | Micro operating system |
| Oocyte processing medium | Vitrolife Sweden AB | 10130 | G-MOPS PLUS |
| Optical microscope | OLYMPUS | - | Optical microscope |
| Phase contrast microscope | NIKON | - | Phase contrast microscope |
| Sperm Counting Board | Markler | - | Sperm Counting Board |
| Sperm gradient separation solution | Vitrolife Sweden AB | 10138 | SpermGrad |
| Sperm nucleus DNA integrity Kit | Shenzhen HuaKang | - | Sperm Nucleus DNA Integrity Kit (SCD) |
| Stereoscopic microscope | NIKON | - | Stereoscopic microscope |
| Tabletop centrifuge | HETTICH | - | Tabletop centrifuge |
| Thermostatic test tube rack | GRANT | - | Thermostatic test tube rack |
| Tri-gas incubator | ASTEC | - | Tri-gas incubator |
参考文献
- Villeneuve, P., et al. Spermatozoa isolation with Felix outperforms conventional density gradient centrifugation preparation in selecting cells with low DNA damage. Andrology. 11 (8), 1593-1604 (2023).
- World Health Organization. . WHO laboratory manual for the examination and processing of human semen. , (2021).
- Fernandes, N. S., et al. Comparative sperm recovery rate after density gradient centrifugation with two media for in vitro fertilization. JBRA Assist Reprod. 27 (1), 25-28 (2023).
- Dai, X., et al. Sperm enrichment from poor semen samples by double-density gradient centrifugation in combination with swim-up for IVF cycles. Sci Rep. 10 (1), 2286 (2020).
- Hoa, N. T., et al. The effectiveness of sperm preparation using density mini-gradient and single-layer centrifugation for oligospermia samples. Acta Inform Med. 30 (2), 100-104 (2022).
- Le, M. T., et al. Effects of sperm preparation techniques on sperm survivability and DNA fragmentation. J Int Med Res. 50 (5), 1-11 (2022).
- Baldini, D., et al. A fast and safe technique for sperm preparation in ICSI treatments within a randomized controlled trial (RCT). Reprod Biol Endocrinol. 18 (88), 1-9 (2020).
- Gode, F., et al. Comparison of microfluid sperm sorting chip and density gradient methods for use in intrauterine insemination cycles. Fertil Steril. 112 (5), 842-848.e1 (2019).
- Simchi, M., et al. Selection of high-quality sperm with thousands of parallel channels. Lab Chip. 21 (12), 2464-2475 (2021).
- Shapouri, F., et al. A comparison between the Felix electrophoretic system of sperm isolation and conventional density gradient centrifugation: a multicentre analysis. J Assist Reprod Gen. 40 (1), 83-95 (2023).
- De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories. Human Reproduction. 31 (4), 685-686 (2015).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing performance and outcomes. , (2017).
- Duan Li, F., Li, X., Ma, X. Sperm DNA fragmentation index affects pregnancy outcomes and offspring safety in assisted reproductive technology. Sci Rep. 14 (1), 356 (2024).
- Denissenko, P., Kantsler, V., Smith, D. J., Kirkman-Brown, J. Human spermatozoa migration in microchannels reveals boundary-following navigation. P Natl Acad Sci USA. 109 (21), 8007-8010 (2012).
- Ahmadkhani, N., Saadatmand, M., Kazemnejad, S., Abdekhodaie, M. Qualified sperm selection based on the rheotaxis and thigmotaxis in a microfluidic system. Biomed Eng Lett. 13 (4), 671-680 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved