Method Article
マルチチャネル薄膜電極を用いたマウスの視覚誘発電位の地形的脳波記録
要約
本プロトコルは、マウスの32マルチチャネル薄膜電極を用いて、頭蓋外視誘発電位のトポグラフィーを取得し分析するための簡単な手順を説明しています。
要約
視覚誘発電位(VEP)は、前臨床マウスモデルにおける視覚機能の特性評価を可能にします。マウスのVEPを測定するには、非侵襲的な脳波、皮下単一電極、ECoGから、完全侵襲的な皮質内マルチチャネル視覚野の記録まで、さまざまな方法が存在します。急性実験環境での局所的な皮質内微小電極測定の前に、視覚反応の全体的な地形的EEGレベルの特性評価を取得することは有用です。たとえば、1つのユースケースは、局所的な皮質内レベルでの影響を研究する前に、難聴モデルにおけるVEPトポグラフィーの全体的なクロスモーダル変化を評価することです。マルチチャネル頭蓋骨脳波は、皮質視覚活動のこのような概要測定を取得するための堅牢な方法です。マルチチャネル眼頭脳波は、標準化された一貫したアプローチを通じて、例えば、皮質視覚機能のクロスモーダル、病理学的、または加齢に伴う変化を特定するための同等の結果を提供します。本研究では、麻酔マウスの32チャンネル薄膜脳波電極アレイを用いたフラッシュ誘発VEPのトポグラフィー分布を取得する方法を提示しています。このアプローチは、時間領域と周波数領域での解析と組み合わせることで、マウスの皮質視覚機能のトポグラフィーと基本的な視覚特性の迅速な特性評価とスクリーニングを可能にし、さまざまな急性実験設定と組み合わせることができます。
概要
マウスは、視覚の変性過程と眼科疾患の前臨床モデルです1,2,3,4。視覚誘発電位(VEP)は、皮質視覚機能の測定や、例えば病理モデル5,6の視覚変性の評価に一般的に使用されます。皮質視覚誘発電位のVEP潜時、伝導時間、振幅、多焦点特性、または空間的視力は、視覚系の機能的完全性に関する診断情報を提供する7,8,9。
マウスでは、非侵襲的脳波、皮下針電極、頭蓋骨埋め込みスクリュー、皮外皮膜ECoGによる完全侵襲的頭蓋内アプローチ、皮質内電極記録10,11,12,13,14,15,16,17など、さまざまな複雑さの方法で皮質視覚誘発電位をさまざまな空間スケールで測定できます.これらの方法には、異なる長所と短所があります。例えば、電極の数が少ないと、皮質のVEP分布に関する情報が限られているのに対し、皮下針電極では記録位置の一貫性を確保できないことがよくあります。さらに、埋め込み型ネジや完全侵襲的な方法では、頭蓋骨の損傷、貫通、または除去が必要であり、多くの場合、局所的な情報しか提供されません。
急性実験では、皮質視覚機能の最初の全体的な概観がしばしば望まれ、最終的にはさらなる実験ステップが続き、局所的な皮質内記録と比較されます。例えば、1つの潜在的なユースケースは、まず、局所的な皮質内レベルへの影響を研究する前に、難聴または難聴の視覚的クロスモーダル再編成がVEPトポグラフィーおよび皮質視覚活動18,19に対するEEGレベルの影響を調査するために利用される。
薄膜多電極アレイを用いたマルチチャンネル脳波記録は、マウスの頭蓋骨20,21,22,23,24からの体系化されたVEPトポグラフィーを提供することができる。このようなエピクラニアル録音は、頭蓋骨の完全性をそのまま残し、皮質表面の直接的な操作を避けることにより、ECoG録音よりも利点がある。さらに、薄膜マルチ電極は、標準化された電極構成を提供し、ヒトの標準化されたEEGシステムと同様に、実験間で視覚的に誘発される時空間脳活動の比較を可能にする25。また、標準化されたフレームワークにより、一般的なEEG解析ツールボックス(Fieldtrip、Chronux、EEGLAB、ERPLABなど)を使用して、時間領域と周波数領域、または接続性の観点からマウスのEEGを解析することも容易になります26,27,28,29,30,31。
本プロトコルは、32チャンネル薄膜電極を用いたマウスにおけるトポグラフィーVEP記録の手順を説明するものである。これは、急性実験の一部として使用でき、その後、特定の脳領域からの皮質内微小電極記録などの追加の実験ステップが続きます。ここでは、マウスの32チャンネル薄膜電極を使用して、エピクラニアルフラッシュ誘発VEPを確実に記録する方法を示します。さらに、時間領域と周波数領域でのトポグラフィーVEP記録の例示的な分析を示します。
プロトコル
すべての動物は、ドイツ語(TierSchG、BGBl.I.S.1206、1313)および欧州連合(ETS 123;Directive 2010/63/EU)の動物研究に関するガイドライン。動物実験は、ドイツの州当局(ニーダーザクセン州消費者保護・食品安全局、LAVES)によって承認され、大学の動物福祉担当官によって監視されました。本研究では、生後3ヶ月の雄C57BL/6Jマウスを使用しました。
1.動物の詳細
- 特定の研究課題に適したマウスでVEP測定を実行します。
- 麻酔薬の感受性、発作感受性、年齢、または遺伝的背景の変化によって実験に影響を与える可能性のある生理学におけるマウス系統の特異性に注意してください。
注:異なる遺伝的背景を持つマウス系統は、しばしば他の感覚障害(例えば、C57BL/6進行性難聴)を発症する可能性があり、これは気付かれないかもしれないが、視覚処理に間接的に影響を与える(例えば、クロスモーダル影響19)。
2.全身麻酔の導入
- 記録部位に手術野を準備します。マウスの術前の体重を決定します。
- ケタミン/キシラジン、i.p.で麻酔を誘発し、100 mg / kgのケタミン塩酸塩、4 mg / kgのキシラジン塩酸塩、および5mg / kgのカルプロフェンの投与量で麻酔を誘発します( 材料の表を参照)。
- 注入後すぐに、マウスをケージに戻します。
- 赤外線加熱ランプ( 材料の表を参照)を適切な距離に置き、全身麻酔が完全に導入されるのを少なくとも5分間待ちます。
- 自発的な動きの停止と立ち直り反射の喪失を観察します。つま先つま先挟み反射の喪失がないか確認してください。
3. 全身麻酔の生理学的モニタリングと維持
- マウスを録音サイトの加熱パッドに移します。
- 体温調節器に取り付けた直腸温プローブを使用して、深部体温を37.6〜37.8°Cに保ちます。
- マウスの最適な体温を確保してください。加熱パッドに加えて、必要に応じて室温を上げて熱損失を最小限に抑えます。
- ECGモニタリングのために、2つの皮下銀線電極(直径0.2 mm、 材料表を参照)を右肩と左後肢の近くに配置します。
- 銀線のECG電極をECGに取り付けます amplifier。
- 実験中は、オシロスコープで心拍数と心電図波をモニターします( 材料の表を参照)。
注:適切なケタミン/キシラジン麻酔中、心拍数は160〜250 bpm32,33の範囲になります。心拍数は、マウスの系統、年齢、生理学的状態によって異なります。 - つま先つま先挟み反射とバイタルサインを確認してください。つま先つま先つまみ反射反応がないことは、十分なレベルの麻酔を示しています。
- 処置中は目の状態と質を注意深く監視し、点眼薬またはジェルを塗布します。
- 生理学的パラメータ、心拍数、反射神経、脳波活動を定期的にチェックすることにより、適切な麻酔レベルを監視します。
- 全身麻酔レベルが軽くなりすぎる場合は、ケタミン/キシラジン(i.p.)を追加投与します。.
- 全身麻酔の持続時間と、全身麻酔の維持に使用される追加のケタミン/キシラジンのその後の投与回数を最小限に抑えるために、実験手順を迅速に進めてください。
4. 電極の配置と記録のセットアップ
- 記録部位では、つま先つま先挟み反射を確認して、適切な麻酔の深さを再評価します。
- 電気シェーバーで頭のてっぺんを剃ります。
- 自由な視野を確保するために、実験中はマウスを定位フレームに固定しないでください。
- リドカインを塗布します(動物の世話に関する地元の施設のガイドラインでさらに必要な場合)。
- 頭皮の正中線を1cm切開します。
- 小さな血管クランプを使用して皮膚を両側に引っ込め、皮膚を所定の位置に保持し、頭蓋骨を露出させます。
- 綿棒と生理食塩水NaCl(0.9%)で頭蓋骨の表面をきれいにします。
- 脳波用の銀線参照電極(直径0.2mm)を鼻の上(鼻参照)または耳の後ろ(乳様突起)に皮下取り付けします。
- プローブコネクタを介してノーズリファレンスをヘッドステージ( 材料の表を参照)リファレンス出力に接続します。
- 次に、プローブコネクタを介してヘッドステージに取り付けられ、電極ホルダーに取り付けられたアダプターを使用して、EEG電極をヘッドステージに取り付けます( 材料の表を参照)。
- マルチチャンネル薄膜脳波電極( 材料の表を参照)を頭蓋骨に配置し、ブレグマを基準位置として、各実験の電極位置が標準化されるようにします。
- 生理食塩水を一滴垂らして、電極の位置を調整します。頭蓋骨の表面がまだ濡れている間、電極は簡単に移動できます。次に、綿棒で頭蓋骨を慎重に乾かします。
- 生理食塩水が乾き、電極が頭蓋骨にしっかりと付着するまで待ちます。
- 電極が上の皮膚に付着しないように、電極を少量のシリコーンオイルで覆います。このステップは、記録後に電極を簡単に取り外すのに役立ちます。
注意: 電極と頭蓋骨の接触が悪化しないように、シリコーンオイルを塗りすぎないように注意してください。 - 電極の上の皮膚を閉じて保護し、電気ノイズを最小限に抑えます。
- ティッシュ接着剤( 材料の表を参照)を皮膚に少量塗布して、皮膚切開部が再び開くのを防ぎます。
5. 脳波記録とVEP測定
- 取得中にEEG信号をフィルタリングするには、1〜9000 Hzのワイドフィルターを使用します。ノイズと適切なフィルタリングを後でオフライン処理中に実行します。
- 高周波の電気ノイズ、50/60 Hzのアーチファクト、およびECGのアーチファクトをチェックすることにより、進行中のEEGアクティビティの信号品質を確認します。動物と機器に適切なアース接続と参照接続を適用するか、適切なシールドを適用します。
- 脳波活動を観察して麻酔の深さを確認します。バースト抑制EEG活動の発生を特徴とする「深すぎる」麻酔状態を避けてください。実験の時間経過を考慮し、記録中に麻酔が軽くなりすぎないようにしてください。
- LEDストロボスコープ(またはその他の種類の視覚刺激)を使用して、超短時間のフラッシュを生成します( 材料の表を参照)(図1)。
- ストロボスコープを30cmの距離に置いて、マウスの前に両眼視刺激を加えます。
注:マウスとストロボスコープは、実験中、暗くて防音チャンバーに入れられます。 - マウスを5分間暗闇に順応させてから刺激します。
- ストロボスコープをトリガーしてストロボスコープをTTLパルスでトリガーすることにより、ストロボスコープが点滅します。
注:ストロボスコープの高電圧により、刺激アーチファクトが発生する可能性があります。これは、距離を長くするか、電極をシールドすることで減衰させることができます。 - 刺激PCによって制御される多機能I/Oデバイス( 材料の表を参照)を使用してハードウェアTTLトリガを生成し、光源(ストロボスコープなど)をトリガします。
- TTL信号をアクイジションシステムと並行して送信し、スティミュラス開始の高精度タイムスタンプを提供します。
- フラッシュと同期したTTL出力をLEDストロボスコープからフィードバックとして、また正確な刺激開始トリガータイムスタンプのセカンドコントロールとして送信します。これを録音と一緒に登録します。
- 刺激速度を設定します(例:刺激間間隔= 2秒)。刺激の繰り返し回数を設定します(例:n = 150回の繰り返し)
- ストロボスコープで強度を手動で調整します(たとえば、3000 lmの固定値で512 μsのフラッシュ持続時間)。
注:ただし、これは特定の実験問題に適合させる必要があります。 - 刺激プレゼンテーションを開始し、記録ソフトウェアでEEG信号を記録し( 資料の表を参照)、データを記録用PCに保存します。
6. 実験の完了、電極の取り外し、電極の洗浄
- 記録が長いプロトコルの一部である場合は、さらに実験手順を続行します。
- 実験の最後に、施設のガイドライン23,34に従って動物を安楽死させます。
- EEG電極は注意して取り外してください(再利用できるため)。
- 液体を塗布しながらゆっくりと頭蓋骨から電極を取り外します。
注:電極は頭蓋骨の表面にくっつくことがあります。取り外し中のプラチナ部位の損傷を避けてください。 - 実験後、等張性生理食塩水NaCl(0.9%)で電極を洗浄し、タンパク質除去剤および消毒液( 材料表を参照)に30分間浸漬します。
- 電極アレイは乾燥した保護された場所に保管してください。
7. 基本的なVEP信号処理:時間領域と周波数領域
- 生データファイルを分析ソフトウェアにインポートします( 材料表を参照)。
- 1〜100HzのバターワースバンドパスゼロフェーズフィルターでEEG信号をフィルタリングします。
注:それぞれの研究課題に応じて、適切なフィルタタイプとパラメータを選択してください27,35,36。 - 信号を 1000 Hz にダウンサンプリングします。
- EEG信号を試行に分割し、試行を平均化して視覚的誘発電位を生成し、N1ピーク遅延を決定します。
注:再参照は、必要に応じてオフラインで実行できます(たとえば、共通平均参照、バイポーラ参照、ローカル平均「ラプラシアン」参照)23。 - 特定の対象ポイントでの電圧値を決定し、解析ソフトウェアを使用して電圧分布マップをプロットします。
- 全電極チャネルの空間標準偏差を計算することにより、全球電界電力37 を計算する。
- マルチテーパー時間-周波数スペクトログラムを Chronux Toolbox28,31 で計算します。帯域幅積 TW = 3 および K = 5 テーパーを 300 ms のウィンドウ サイズと 30 ms のステップ サイズで使用します。
結果
マルチチャンネル脳波で視覚誘発電位を記録することで、マウスのVEP振幅、遅延、または周波数成分のトポグラフィーを評価できます。 図2A は、生後3か月の雄C57BL/6Jマウスの頭蓋骨32チャンネルEEGで記録されたフラッシュ誘発VEPトポグラフィーの例を示しています。最も強い視覚誘発活動は、視覚野の上の後頭部で発生します。
図2B は、フラッシュ発症前とフラッシュ発症後のさまざまな時点での頭蓋骨の電圧分布を示しています。VEPの最も強いN1振幅は、刺激後50ミリ秒で後頭部の中央領域より上に発生します。これに続いて、刺激後300ミリ秒で後頭部と前頭部に逆転の可能性と正のピークが現れます。 図1B のバタフライプロットは、VEP N1コンポーネントのピークレイテンシが46ミリ秒で、開始後約300ミリ秒が正のピークを示しています。
図2C は、すべてのEEGチャネル37、38から計算されたグローバルフィールドパワーを示しています。これを使用して、マルチチャネルEEGデータを分析し、ピーク遅延(46ミリ秒)を決定できますが、示されている例では刺激後300ミリ秒での変化は示されていません。さらに、一般的な変更から地形信号が空間的に変化する関心のある時点を評価できます。
図 2D は、異なる時点における 30 Hz から 45 Hz の電力分布における応答とガンマ電力の時間-周波数解析を示しています。ガンマパワーの地形も中央後頭部より上に配置され、後の時点でより前頭領域にシフトします。以下のグラフは、マルチテーパースペクトログラムを用いた後頭部の単一脳波チャネルの時間-周波数プロットで、応答中の活動が速いことを示しています。
VEP特性は、生後2〜3か月のC57Bl/6Jマウス間で同等です(図3A)。トポグラフィーは、3つの例のマウスで、異なる時点における後頭部と前頭部の上の一貫した時空間パターンを示しています(図3B)。時空間的な負電位は、刺激開始後50ミリ秒で後頭部より上で発生し、その後、すべてのマウスで約300ミリ秒後に前頭部に向かって陽性がシフトします。
レイテンシはマウス間でも一貫しており(図3B)、N1成分のレイテンシ(46ms、44ms、57ms)と振幅(0.14mV、0.12mV、0.13mV)があります。ただし、振幅は変数、電極インピーダンス、電極接触、および視覚状態の影響を受ける可能性があるため、より頻繁に異なります。同様に、全球電界パワー(すなわち、マルチチャネル脳波データの分析)は動物間の一貫性を反映しており、ピーク待ち時間(46ms、44ms、57ms)は皮質内の視覚反応待ち時間を反映している39。
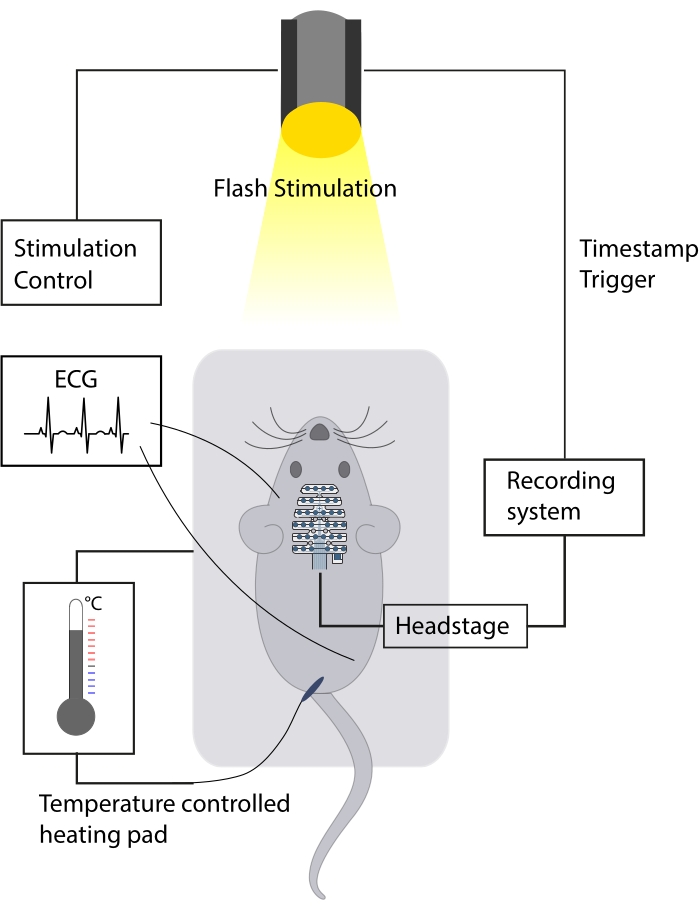
図1:実験セットアップの概略図。 マウスは、好ましくは防音室の中に置かれる。実験中、適切な体温を維持するために、温度制御された加熱パッドが使用されます。心電図記録は、銀線の心電図電極で評価され、心拍数のモニタリングが可能です。EEG信号は、LEDストロボスコープで誘発される視覚刺激中にマルチチャンネルEEG電極で記録されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:マウス脳波のVEPトポグラフィーと全球電界パワー (A)32チャンネル脳波電極(左)と刺激開始後500ms間隔のVEPのトポグラフィー(右)(右)。(B)両眼へのフラッシュ刺激(150回反復)後の異なる時点におけるVEPトポグラフィー(上)。視覚誘発電位の分布は、後頭部における最大の応答の集中を示しています。下:刺激開始前と刺激開始後500ミリ秒の間隔で、負のピークN1で32の脳波トレースを個別に記録。刺激アーチファクトによって生成されるたわみは、刺激の開始時に見ることができます。(C)EEG信号のグローバルフィールドパワー。(D)1つの後頭チャネル(下)の視覚的に誘発される活動の時間-周波数表現。異なる時点におけるガンマ線範囲(30-40Hz)の地形的電力分布。 この図の拡大版を表示するには、ここをクリックしてください。
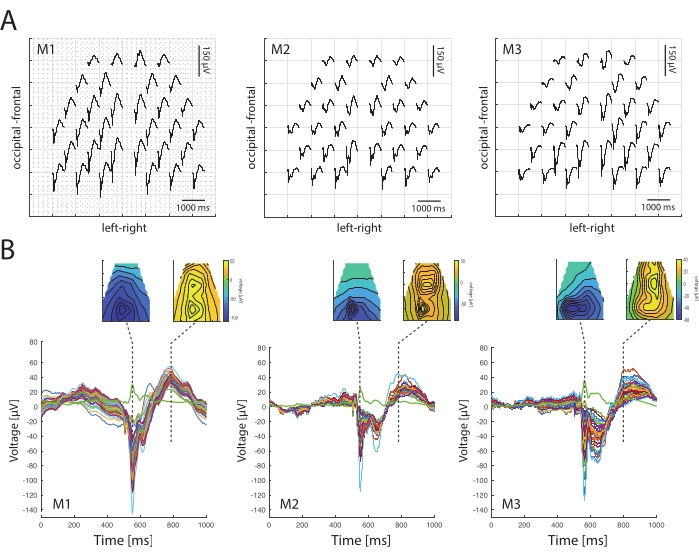
図3:3つの異なるマウス間の視覚誘発電位の時空間プロファイルの比較 (A)両眼へのフラッシュ刺激(平均150回の繰り返し)後の3匹のマウス(M1、M2、M3)のVEPトポグラフィー。トレースは、刺激開始後500ミリ秒の期間表示されます。視覚誘発電位の分布は、後頭部における最大の応答の集中を示しています。(B)時空間プロファイルは、ストロボスコープフラッシュに対してポスト50ミリ秒とポスト300ミリ秒で、3つの例のマウスの異なる時点で示されています。以下は、3匹のマウスに対する上記の応答のバタフライプロットです。VEPは顕著な負のピークN1を示します。緑の線は、応答のグローバルフィールドパワーを示し、EEGアクティビティの遅延を反映しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この記事では、薄膜電極を使用して頭蓋外マルチチャンネル脳波を記録する方法と、マウスの視覚誘発電位の一貫した地形表現を取得する方法について説明します。ここでは、両眼フラッシュ刺激を例示的に示しましたが、このアプローチは、たとえば、より大きなディスプレイを使用して、他のタイプの視覚刺激(すなわち、単眼、空間格子、焦点視野)にも適用できます。
プロトコールの重要なステップは、電極の位置決めです。実験間の比較可能性を可能にするために、正確で一貫した電極の位置決めを確保する必要があります。重要なのは、電極の位置を後で比較するために文書化する必要があることです(つまり、動作中の顕微鏡画像)。さまざまなタイプの薄膜電極と構成(他のディストリビューターから)を使用できますが、実験での逆比較可能性のために、1つの定義された電極構成を決定し、それに固執することをお勧めします。2番目の重要な側面は、頭蓋骨との良好な電極接触です。接触の品質は、電極インピーダンスと信号品質40に影響を与える。したがって、すべての電極部位の頭蓋骨に同様の接触をすることは、特に空間応答分布を分析するために重要です。電極チャネルにノイズの多い信号(高周波成分)が示される場合は、頭蓋骨との十分な接触を確保する必要があり、実験中にインピーダンスをテストする必要があります。ただし、現在のVEP録音は、全体的な信号品質に対して非常に堅牢です。
研究者が同じ電極を複数回再利用したい場合は、電極を取り外すことも重要なステップです。除去中に接点が損傷しないように、液体(生理食塩水など)を使用して電極を頭蓋骨から慎重にゆっくりと分離することが重要です。動物の健康状態と生理学的状態を監視することは、すべての動物実験の重要な側面です。生理学的状態は比較可能性に影響を与える可能性があります。プロトコールを速く(つまり、実験間のタイミングを同じようにする)進めることをお勧めします。生理的な体温を確保することは特に重要です(つまり、周囲の温度を上げたり、暖かい部屋で作業したりするのに役立ちます)。マウスの目は生理学的状態を反映しているため、特に注意を払う必要がありますが、多くの場合、手つかずのままにしておくのが最善の方法です。マウスの目が不透明になった場合、これはマウスの生理学的状態が悪化している兆候です。この状態は可逆的である41;ただし、動物の生理学的状態には特別な注意が必要です(深部体温が生理学的範囲内にあることを確認し、心拍数と心電図波をチェックし、過度に深い麻酔レベルを避ける必要があります)。
適切な麻酔深度を監視することが不可欠です。脳波信号のバースト抑制の存在を特徴とする、軽すぎる麻酔や深すぎる麻酔を避けることが重要です。これは、感覚反応性42,43,44の点で望ましくない影響をもたらす可能性がある。また、視覚反応の特性は、麻酔の深さと使用される麻酔薬の種類によって変化する45。
この方法の未解決の限界は、既製の薄膜電極が現在、マウスの脳の側方、時間領域をカバーしていないことです。これにより、時間領域(聴覚皮質など)、感覚相互作用、およびソースローカリゼーションからのEEG信号の評価が制限されます。具体的には、カスタマイズされたEEGアレイがここで解決策を提供できます。また、記録系によっては、実験中に電極のインピーダンスを評価して、同等の電極特性を得るのが難しい場合があります。この方法の3番目の制限は、完全に非侵襲的ではなく、皮膚の切開と全身麻酔が必要であることです。後者を解決するために、グリッドを慢性的に埋め込むことができます21,22または真の非侵襲的頭皮EEG13を適用することができます。
急性実験での有用性に関して、記載されているエピクラニアルEEG測定は、異なる方法間の良好なトレードオフを表しています。この手順では、皮質と頭蓋骨が無傷のままになり、操作が少なくなり、皮質表面への潜在的な機能的損傷を回避できます。これにより、皮質視覚活動のスクリーニングの一貫性が向上する可能性があります。
単純な記録方法とは対照的に、マルチチャンネルの薄膜脳波記録を使用すると、電極位置の比較可能性により、実験データの情報量が大幅に改善されます。これは、単一電極アプローチと比較して、再現性があり、トポグラフィーで、より完全な概要を提供します。さらに、このアプローチでは、EEGツールボックス(EEGLAB、ERPLAB、Fieldtrip、Chronux)の使用、電極構成の利用、および最終的にはデータ分析26,27,28,29,30の促進が可能になります。
マルチチャンネル薄膜脳波の潜在的な用途は、マウス株の視覚的表現型と皮質内記録前の視覚機能の評価です。また、最も重要なことは、マルチチャネルEEGアプローチを簡単に拡張して、それぞれ聴覚または体性感覚の電位を評価できることです。
開示事項
著者は、競合する金銭的利益またはその他の利益相反を宣言しません。
謝辞
この研究は、ドイツ研究財団(Deutsche Forschungsgemeinschaft, Cluster of Excellence 2177 "Hearing4all", Project number 390895286)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Bepanthen 5% Dexpantheol | Bayer | Ophtamic gel | |
| Cheetah software 5.11 | Neuralnyx | Version 5.11 | Recording software for neurophysiologcal signals |
| Digital Lynx SX | Neuralynx | Digital Lynx 16SX | Recording system |
| ECG differential amplifier | Otoconsult | WDA2 V1.0 | |
| Electric shaver | Aesculap | GT420 | |
| Electrode Holder | TSE Systems | 430005-HE | |
| Examination light | Heine | HL 5000 | Cold light source lamp |
| Heating Pad + Temperature Control system | CWE | TC-1000 Mouse | |
| Histoacryl 0.5 mL | B.Braun | Tissue adhesive | |
| Infrared heat lamp | Sanitas | SIL 06 | |
| Ketamine 10% | WDT | Ketaminhydrochlorid | |
| LED stroboscope | Monarch | Nova Strobe PBL | Visual stimulation |
| Matlab 2021a | The Mathworks | 2021a | Stimulus control and analysis |
| Moria Vessel Clamp | Fine Science Tools | 18320-11 | |
| Mouse EEG electrode | NeuroNexus | H32 (Reticular) | 32-channel EEG electrode. Thickness: 20 μm; length: 8.6 mm; width 6.8 mm. Platinum sites: 500 μm diameter |
| Mouse Frame | custom made | Information available on request | |
| Multifunction I/O device | National Instruments | PCIe-6353 with BNC 2090A | Analog stimulus generation, output, and trigger |
| NaCl 0.9% | B.Braun | Isotonic, sterile, nonpyrogenic | |
| Neuralynx HS36 | Neuralynx | HS-36 | Headstage |
| Neuronexus probe connector | Neuralynx | ADPT-HS36-N2T-32A | Electrode connector |
| Oscilloscope | Tektronix | TDS 2014B | |
| Progent Intensive Cleaner | Menicon | Protein remover and disinfecting solution for rigid gas permeable lenses | |
| Recording PC | HP | HP Z800 | Recording PC |
| Rimadyl (Carprofen) | Zoetis | Carprofen | |
| Silicon Oil M 1000 | Carl Roth | 4045.1 | |
| Silver wire | Science Products | AG-8W | Diameter 203 µm; ECG and reference electrode |
| Sound proof chamber | IAC acoustics | ||
| Stereotactic Micromanipulator | TSE Systems | 430005-M/P | For EEG electrode placement |
| Stimulation PC | Dell | Dell Precision T5810 | Stimulation PC |
| Surgical microscope | Zeiss | Op-Mi Focus | |
| Surgical tape | 3M | 1527-0 | 1.25 cm x 9.1 m |
| Thilo-Tears 3 mg/g | Alcon Pharma GmbH | Ophtamic gel | |
| Vaselin Lichtenstein | Winthrop | White vaselin ointment | |
| Xylazin 2% | Bernburg | Xylazinehydrochlorid | |
| Xylocaine Spray (10 mg/puff) | Aspen | Lidocaine |
参考文献
- Haider, N. B., Ikeda, A., Naggert, J. K., Nishina, P. M. Genetic modifiers of vision and hearing. Human Molecular Genetics. 11 (10), 1195-1206 (2002).
- Joiner, M. A., Lee, A. Voltage-gated Cav1 channels in disorders of vision and hearing. Current Molecular Pharmacology. 8 (2), 143-148 (2015).
- Krebs, M. P., et al. Mouse models of human ocular disease for translational research. PLOS One. 12 (8), 0183837(2017).
- Won, J., et al. Mouse model resources for vision research. Journal of Ophthalmology. 2011, 1-12 (2011).
- Peachey, N. S., Ball, S. L. Electrophysiological analysis of visual function in mutant mice. Documenta Ophthalmologica. 107 (1), 13-36 (2003).
- Tokashiki, N., et al. Reliable detection of low visual acuity in mice with pattern visually evoked potentials. Scientific Reports. 8 (1), 15948(2018).
- Creel, D. J. Visually evoked potentials. Handbook of Clinical Neurology. 160, 501-522 (2019).
- Sutter, E. E. Imaging visual function with the multifocal m-sequence technique. Vision Research. 41 (10-11), 1241-1255 (2001).
- Porciatti, V., Pizzorusso, T., Maffei, L. The visual physiology of the wild type mouse determined with pattern VEPs. Vision Research. 39 (18), 3071-3081 (1999).
- Makowiecki, K., Garrett, A., Clark, V., Graham, S. L., Rodger, J. Reliability of VEP recordings using chronically implanted screw electrodes in mice. Translational Vision Science & Technology. 4 (2), 15(2015).
- Tomiyama, Y., et al. Measurement of Electroretinograms and Visually Evoked Potentials in Awake Moving Mice. PLOS One. 11 (6), 0156927(2016).
- You, Y., Klistorner, A., Thie, J., Graham, S. L. Improving reproducibility of VEP recording in rats: electrodes, stimulus source and peak analysis. Documenta Ophthalmologica. 123 (2), 109-119 (2011).
- Yeon, C., Kim, D., Kim, K., Chung, E. Visual evoked potential recordings in mice using a dry non-invasive multichannel scalp EEG sensor. Journal of Visualized Experiments. (131), e56927(2018).
- Liu, S., et al. An optimized procedure to record visual evoked potential in mice. Experimental Eye Research. 218, 109011(2022).
- Ryu, S. B., et al. Spatially confined responses of mouse visual cortex to intracortical magnetic stimulation from micro-coils. Journal of Neural Engineering. 17 (5), 056036(2020).
- Słowiński, P., et al. Background EEG connectivity captures the time-course of epileptogenesis in a mouse model of epilepsy. eNeuro. 6 (4), (2019).
- Troncoso, E., Muller, D., Czellar, S., Zoltan Kiss, J. Epicranial sensory evoked potential recordings for repeated assessment of cortical functions in mice. Journal of Neuroscience Methods. 97 (1), 51-58 (2000).
- Land, R., et al. Cross-modal plasticity in higher-order auditory cortex of congenitally deaf cats does not limit auditory responsiveness to cochlear implants. Journal of Neuroscience. 36 (23), 6175-6185 (2016).
- Land, R., Radecke, J. -O., Kral, A. Congenital deafness reduces, but does not eliminate auditory responsiveness in cat extrastriate visual cortex. Neuroscience. 375, 149-157 (2018).
- Choi, J. H., Koch, K. P., Poppendieck, W., Lee, M., Shin, H. S. High resolution electroencephalography in freely moving mice. Journal of Neurophysiology. 104 (3), 1825-1834 (2010).
- Lee, M., Kim, D., Shin, H. S., Sung, H. G., Choi, J. H. High-density EEG recordings of the freely moving mice using polyimide-based microelectrode. Journal of Visualized Experiments. (47), e2562(2010).
- Jonak, C. R., Lovelace, J. W., Ethell, I. M., Razak, K. A., Binder, D. K. Reusable multi-electrode array technique for electroencephalography in awake freely moving mice. Frontiers in Integrative Neuroscience. 12, 53(2018).
- Land, R., Kapche, A., Ebbers, L., Kral, A. 32-channel mouse EEG: Visual evoked potentials. Journal of Neuroscience Methods. 325, 108316(2019).
- Kim, D., Yeon, C., Kim, K. Development and experimental validation of a dry non-invasive multichannel mouse scalp EEG sensor through visual evoked potential recordings. Sensors. 17 (2), 326(2017).
- Megevand, P., Quairiaux, C., Lascano, A., Kiss, J., Michel, C. A mouse model for studying large-scale neuronal networks using EEG mapping techniques. Neuroimage. 42 (2), 591(2008).
- Lee, C., et al. Dipole source localization of mouse electroencephalogram using the Fieldtrip toolbox. PLOS ONE. 8 (11), 79442(2013).
- Oostenveld, R., Fries, P., Maris, E., Schoffelen, J. M. FieldTrip: Open source software for advanced analysis of MEG, EEG, and invasive electrophysiological data. Computational Intelligence and Neuroscience. 2011, 156869(2011).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Lopez-Calderon, J., Luck, S. J. ERPLAB: An open-source toolbox for the analysis of event-related potentials. Frontiers in Human Neuroscience. 8, 213(2014).
- Bokil, H., Tchernichovsky, O., Mitra, P. P. Dynamic phenotypes: Time series analysis techniques for characterizing neuronal and behavioral dynamics. Neuroinformatics. 4 (1), 119-128 (2006).
- Ho, D., et al. Heart rate and electrocardiography monitoring in mice. Current Protocols in Mouse Biology. 1 (1), 123-139 (2011).
- Hart, C. Y. T., Burnett, J. C., Redfield, M. M. Effects of avertin versus xylazine-ketamine anesthesia on cardiac function in normal mice. American Journal of Physiology - Heart and Circulatory Physiology. 281 (5), 1938-1945 (2001).
- Land, R., Kral, A. Temporal acuity is preserved in the auditory midbrain of aged mice. Neurobiology of Aging. 110, 47-60 (2022).
- Widmann, A., Schröger, E., Maess, B. Digital filter design for electrophysiological data - A practical approach. Journal of Neuroscience Methods. 250, 34-46 (2015).
- Widmann, A., Schröger, E. Filter effects and filter artifacts in the analysis of electrophysiological data. Frontiers in psychology. 3, 233(2012).
- Skrandies, W. Global field power and topographic similarity. Brain Topography. 3 (1), 137-141 (1990).
- Hamburger, H. L., Michelle, M. A. G. Global Field Power measurement versus classical method in the determination of the latency of evoked potential components. Brain Topography. 3 (3), 391-396 (1991).
- Land, R., Engler, G., Kral, A., Engel, A. K. Response properties of local field potentials and multiunit activity in the mouse visual cortex. Neuroscience. 254, 141-151 (2013).
- Kappenman, E. S., Luck, S. J. The effects of electrode impedance on data quality and statistical significance in ERP recordings. Psychophysiology. 47 (5), 888-904 (2010).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Experimental Eye Research. 42 (4), 331-337 (1986).
- Land, R., Engel, A., Kral, A. Auditory influences in V1 of mice induced by varying anesthesia level. i-Perception. 2 (8), 755(2011).
- Land, R., Engler, G., Kral, A., Engel, A. K. Auditory evoked bursts in mouse visual cortex during isoflurane anesthesia. PLOS One. 7 (11), 49855(2012).
- Hudetz, A. G., Imas, O. A. Burst activation of the cerebral cortex by flash stimuli during isoflurane anesthesia in rats. Anesthesiology. 107 (6), 983-991 (2007).
- Imas, O. A., Ropella, K. M., Ward, B. D., Wood, J. D., Hudetz, A. G. Volatile anesthetics enhance flash-induced gamma oscillations in rat visual cortex. Anesthesiology. 102 (5), 937-947 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved