Method Article
軟骨再生を促進するための層ごとのヤヌスベースナノマトリックスの作製とキャラクタリゼーション
要約
このプロトコルは、ヤヌスベースナノチューブ(JBNts)、マトリリン-3、およびトランスフォーミング成長因子ベータ-1(TGF-β1)を順次追加することにより、層ごとのヤヌスベースナノマトリックス(JBNm)足場の組み立てを記述します。JBNmは製造され、特徴付けられました。さらに、優れた生理活性を示し、接着、増殖、分化などの細胞機能を促進しました。
要約
in vitroおよびin vivo使用のための特定の機能を促進することを期待して、細胞の接着および増殖を導くために様々な生体材料足場が開発されている。これらの生体材料足場への成長因子の添加は、一般に、最適な細胞培養環境を提供し、細胞分化およびその後の機能を媒介するために行われる。ただし、従来の生体材料足場の成長因子は、通常、移植時に放出されるように設計されており、周囲の組織や細胞に意図しない副作用をもたらす可能性があります。ここでは、DNAに触発されたヤヌスベースナノマトリックス(JBNm)が、自立可能な軟骨組織構築のための層ごとの構造を持つ高度に局在化した微小環境を実現することに成功しました。JBNmsは、ヤヌスベースナノチューブ(JBNts)、マトリリン-3、およびトランスフォーミング成長因子β-1(TGF-β1)から生体親和性を介して自己組織化されます。JBNmは、TGF-β1:マトリリン-3:JBNt比1:4:10で組み立てられましたが、これは、層ごとの構造への適切な組み立てが起こり得る決定された比率です。まず、マトリリン-3溶液にTGF-β1溶液を添加した。次に、この混合物を数回ピペットで移動して、JBNt溶液を添加する前に十分な均質性を確保しました。これにより、再び数回ピペッティングした後、層ごとのJBNmが形成されました。JBNm構造、JBNts単独、マトリリン-3単独、TGF-β1単独を層ごとに特徴付けるために、様々な実験を行った。JBNmの形成を紫外可視吸収スペクトルで調べ、透過型電子顕微鏡(TEM)でJBNmの構造を観察した。革新的な層ごとのJBNm足場が分子スケールで形成されるため、蛍光色素標識JBNmを観察することができました。TGF-β1は注射可能なJBNmの内層内に閉じ込められており、周囲への成長因子の放出を防ぎ、局所的な軟骨形成を促進し、抗肥厚微小環境を促進することができます。
概要
組織工学における足場は、細胞の付着とその後の組織発生の構造的サポートを提供する上で重要な役割を果たします1。典型的には、足場のない従来の組織構築物は、細胞培養環境に依存し、細胞分化を媒介するために成長因子を添加した。さらに、足場への生理活性分子のこの添加は、細胞の分化と機能を導く上でしばしば好ましいアプローチです2,3。いくつかの足場は、天然組織の生化学的微小環境を独立して模倣することができますが、他の足場は成長因子を介して細胞機能に直接影響を与えることができます。しかし、研究者は、細胞の接着、成長、分化にプラスの影響を与える可能性のある足場を選択する際に、長期間にわたって最適な構造サポートと安定性を提供するという課題に直面することがよくあります4,5。生理活性分子は足場に緩く結合していることが多く、移植時にこれらのタンパク質が急速に放出され、望ましくない場所に放出されます。これは、意図的に標的とされなかった組織または細胞への副作用で最高潮に達します6,7。
足場は通常、高分子材料でできています。ヤヌスベースナノマトリックス(JBNm)は、自立可能な軟骨組織構築物のための新しい層ごとの方法で作成された生体模倣足場プラットフォームです8。これらの新しいDNAに触発されたナノチューブは、細胞外マトリックス(ECM)に見られるコラーゲンの構造と表面化学を適切に模倣しているため、ヤヌスベースナノチューブ(JBNts)と呼ばれています。マトリリン-3やトランスフォーミング成長因子β-1(TGF-β1)などの生理活性分子を添加することで、JBNmは最適な微小環境を作り出すことができ、それが所望の細胞および組織の機能を刺激することができる9。
JBNtsは、核酸塩基アデニンとチミンの合成バージョンに由来する新しいナノチューブです。JBNtsは自己組織化10によって形成されます。6つの合成核酸塩基が結合して環を形成し、これらの環はπ-πスタッキング相互作用を受けて、長さ200〜300μmのナノチューブを形成します11。これらのナノチューブは、コラーゲンタンパク質と構造的に類似しています。JBNtsは、天然の軟骨微小環境の側面を模倣することにより、軟骨細胞およびヒト間葉系幹細胞(hMSC)に好ましい付着部位を提供することが示されています11,12,13,14。ナノチューブは自己組織化され、いかなる種類のイニシエーター(UV光など)も必要としないため、到達困難な欠陥領域の注射可能な足場として刺激的な可能性を示します15。
マトリリン-3は、軟骨に見られる構造的な細胞外マトリックスタンパク質です。このタンパク質は、軟骨形成および適切な軟骨機能において重要な役割を果たしている16,17。最近、それは生体材料足場に含まれており、肥大を伴わない軟骨形成を促進する9、18、19。このタンパク質をJBNmに含めることにより、軟骨細胞は、その天然の微小環境と同様の成分を含む足場に引き付けられます。さらに、マトリリン-3は、軟骨細胞20内の適切なTGF-β1シグナル伝達に必要であることが示されています。成長因子はシグナル伝達分子として機能し、特定の細胞または組織の特異的成長を引き起こします。したがって、最適な軟骨再生を達成するためには、マトリリン-3とTGF-β1がJBNm内の必須成分です。TGF−β1を層ごとの足場に添加すると、組織構築物における軟骨再生をさらに促進することができる。TGF-β1は、骨軟骨欠損の治癒過程を促進するために使用される成長因子であり、軟骨細胞およびhMSCの増殖および分化を促進する21,22。したがって、TGF-β1は軟骨再生JBNm(J/T/M JBNm)23において重要な役割を果たし、特にJBNm層内に局在している場合に適切な増殖を促進します。
前述のように、成長因子は通常、足場の外側に組み立てられ、特定の取り込み方法はありません。ここでは、生体材料の正確に設計されたナノアーキテクチャにより、JBNmは目的の細胞や組織を特異的に標的とするために開発されました。JBNmは、内層のJBNt表面に付着したTGF-β1と、外層のJBNt表面に付着したマトリリン-3とから構成される24,25。層ごとの構造の内層にTGF-β1を組み込むことで、JBNm繊維に沿って高度に局在化した微小環境が可能になり、タンパク質12の放出がはるかに遅い恒常性組織構築物が作成されます。JBNmの注射性は、将来のさまざまな生体材料用途に理想的な軟骨組織構築物になります26。
プロトコル
1. JBNtsの合成
- JBNtモノマーを調製するには、既報の方法を利用して、種々の化合物12を合成することを含む。
- 精製後の粗JBNtモノマーは、逆相カラムを用いた高速液体クロマトグラフィー(HPLC)で精製します。溶媒A:100%水、溶媒B:100%アセトニトリル、および溶媒C:pH=1のHCl水溶液を使用してください。3 mL/分の流量を使用してください。HPLCで得られた最大のピークを7.2分で収集します。
2. JBNt/Matn1/TGF-β1の作製(動画1)
注: ビデオ1 は、JBNmが生理学的環境(水溶液、紫外線なし、化学添加物なし、加熱なし)で形成された注射可能な固体であり、生物学的にも触発されていることを示しています。
- H2 Oに懸濁した1 mg/mL TGF-β1を8 μLからH2O.ピペットに懸濁した1 mg/mLマトリリン-3 32 μLを加えて、これらのタンパク質が適切に混合されるようにします。
- H2Oに懸濁した1 mg/mL JBNtsを80 μL添加し、TGF-β1/マトリリン-3溶液に加えます。適切なブレンドを確実にするために繰り返しピペットします。JBNtsを添加した直後に白い凝集体の存在が観察され、JBNmの形成を示しています(ビデオ1)。
3. 紫外可視(UV-Vis)吸収による試料の観察
注:UV-Vis吸収スペクトルは、JBNmのアセンブリを特徴付けるために研究されました。この測定値は、JBNts単独、マトリリン-3単独、TGF-β1単独、および3つの部分すべてで構成される完全な層ごとのJBNmの4つのカテゴリーについて分析されました。全ての初期濃度はH2Oに懸濁されている。
- JBNtグループの場合、50 μLのH2Oに5 μLの1 mg/mL JBNtsを加えて、90.9 μg/mLの溶液を作ります。
- マトリリン-3群の場合、40 μLの10 μg/mLマトリリン-3を15 μLのH2Oに加え、7.3 μg/mLの溶液を作ります。
- TGF-β1群の場合、10 μLの10 μLのTGF-β1を45 μLのH2Oに加え、1.8 μg/mLの溶液を作ります。
- JBNm群の場合、10 μg/mLのマトリリン-3を10 μL/mL TGF-β1の10 μLに加えます。適切な混合を確実にするために攪拌し、次に5 μLの1 mg/mL JBNtsを溶液に加え、ピペッティングを繰り返してサンプルを混合します。
- 分光光度計を用いて、各群の吸収スペクトルを測定する。
4. 試料のゼータ電位測定
注:ゼータ電位を分析して、JBNmが in vivo 組織とどのように相互作用するかをより適切に予測しました。マトリリン-3単独、TGF-β1を含むマトリリン-3、および全層JBNmの3つのグループが測定されました。
- マトリリン-3群の場合、10 mg/mLのマトリリン-3を640 μLのH2Oに加え、800 μLの溶液を作ります。
- マトリリン-3/TGF-β1化合物については、10 μg/mLのマトリリン-3を10 μg/mLのTGF-β1の40 μLに加えます。適切な均質性を確保するために繰り返しピペットします。次に、それを600μLのH2Oに加え、800μLの溶液を得る。
- JBNmグループの場合、10 μg/mLのマトリリン-3を10 μg/mLのTGF-β1の40 μLに追加します。ピペットを複数回使用してタンパク質を混合します。次に、20 μLの1 mg/mL JBNtsを溶液とピペットに加え、均質性を確保します。最後に、JBNm溶液を580 μLのH2Oに加え、800 μLの溶液を生成します。
- 3つのグループのゼータ電位値を測定します。
5. 透過型電子顕微鏡(TEM)のためのJBNt/マトリリン-3ナノマトリックスの作製
注:TEMの特性評価は、JBNtsおよびJBNmの形態を特徴付けるために実行されます。
- 2つのグリッドをプラズマクリーナーに挿入して、公開されているプロトコルとメーカーのプロトコルに従ってJBNtsとJBNmがネガティブに染色される前にグリッドを適切にクリーニングします12。
- 10 μLの1 mg/mL JBNtsと40 μLの蒸留水を混合して、200 μg/mLのJBNt溶液を作成します。
- 30 μLの100 μg/mLマトリリン-3と20 μLの100 μg/mL TGF-β1とピペットを数回混合します。マトリリン-3/TGF-β1混合物に10 μLの1 mg/mL JBNtsを加えて、JBNmサンプルを調製します。繰り返しますが、ピペットを繰り返します。
- 3 μLのJBNt溶液(200 μg/mL)と3 μLのJBNm溶液を別々のグリッドに加え、2分間放置します。
- 各グリッドを100μLの酢酸ウラニル溶液(0.5%)ですすぐ。ろ紙を使用して余分な溶液を取り除き、グリッドを風乾させます。
- 透過型電子顕微鏡を操作して、以前に公開されたように、サンプルを適切に観察および特性評価します11,12。
6. 蛍光標識タンパク質の吸収スペクトル測定
注:JBNmの構造は、吸収スペクトル分析でJBNmの構造を観察することによって検証されます。
- TGF-β1は、製造元の指示に従ってタンパク質標識キットを使用して標識します。20 μLの標識TGF-β1を25 μLのH2Oに加え、8.9 μg/mLのテスト溶液を作ります。
- 別のラベリングキットを使用してマトリリン-3にラベルを付けます。20 μLの80 μg/mL標識マトリリン-3を25 μLのH2Oに加え、36 μg/mLのテスト溶液を作ります。
注:TGF-β1の蛍光色素標識の最終濃度は20 μg/mLでしたが、マトリリン-3の標識は80 μg/mLの最終濃度でした。 - 20 μLの80 μg/mL標識マトリリン-3と20 μLの20 μLの標識TGF-β1および5 μLのH2Oを混合し、標識TGF-β1/マトリリン-3化合物を得る。混合物を数回ピペットで混合する。
- 40 μLのH2Oに5 μLの1 mg/mL JBNtsを加えると、111 μg/mLの溶液が得られます。
- 20 μLの20 μLの標識TGF-β1を20 μLの80 μg/mLの標識マトリリン-3とピペットを数回加えます。標識したTGF-β1/マトリリン-3溶液に5 μLの1 mg/mL JBNtsを加え、ピペットで繰り返し化合物を適切に混合します。
注:JBNt、標識TGF-β1、および標識マトリリン-3サンプルの最終濃度は、それぞれ111 μg / mL、8.9 μg / mL、および36 μg / mLでした。 - 各サンプルグループ(すなわち、標識TGF-β1(ステップ6.1)、標識マトリリン-3(ステップ6.2)、標識TGF-β1/マトリリン-3(ステップ6.3)、JBNts(ステップ6.4)、JBNm(ステップ6.5))を黒色384ウェルプレートの自身のウェルに移します。
- 黒色の384ウェルプレートをマルチモードマイクロプレートリーダーにロードし、メーカーのプロトコルに従って488 nmおよび555 nmの励起波長で測定を行います。
7. インビトロ 生物学的機能アッセイ
- プレコートカバーガラスチャンバーでの細胞接着試験
- 各セルタイプに1つのカバーガラスが使用されるため、5つのサンプルグループを含む2つのチャンバーカバーガラスを準備します。
- 198.75 μLの蒸留水に1.25 μLの1 mg/mL JBNtsを加えると、6.25 μg/mLの溶液が得られます。
- 10 μLの10 μg/mLマトリリン-3を190 μLの蒸留水に加え、0.5 μg/mL溶液にします。
- 10 μg/mLのTGF-β1を197.5 μg/mLの蒸留水2.5 μL加えると、0.125 μg/mL溶液が得られます。
- JBNm群の場合、10 μg/mLのマトリリン-3を10 μg/mLTGF-β1の2.5 μLに加え、ピペットを繰り返し加えます。1.25 μLの濃度のJBNtsを混合溶液とピペットに加えます。最後に、186.25 μLの蒸留水を加えて、200 μLのJBNm溶液にします。
- 対照群には、200μLの蒸留水を使用してください。
- 各サンプルグループをNo.1.5チャンバーカバーガラスの独自のウェルに追加します。カバーガラスを-80°Cの冷凍庫に1時間入れた後、凍結乾燥機で凍結乾燥します。
- ヒト間葉系幹細胞(hMSC)およびヒト軟骨細胞(ウェルあたり10,000細胞)を、準備したチャンバー付きカバーグラスの各ウェルに播種します。
- 2つのカバーグラスを37°Cのインキュベーターで4時間インキュベートします。その後、細胞培養培地を吸引し、PBSで2回すすぐ。
- 細胞を4%パラホルムアルデヒドで5分間固定した後、サンプルを除去してPBSですすいでください。サンプルをもう一度すすぎ、4%パラホルムアルデヒドを完全に除去します。
- 細胞を100 μLの0.1%Triton-Xで10分間インキュベートし、PBSで洗浄します。100 μLの0.165 μMローダミン-ファロイジンを各ウェルに加えます。30分待ってから、もう一度PBSで洗ってください。
- 0.1 μg/mL DAPIを各ウェルに加え、核を染色します。5分間待ってから、PBSでウェルを2回すすいでください。
- 分光共焦点顕微鏡を使用して細胞の形態を観察し、蛍光画像をキャプチャします。
- また、画像処理ソフトを用いて細胞数や形態を解析する。ソフトウェアを開き、画像をロードします。縮尺記号を追加し、ソフトウェアを調整します。各サンプルの特定の領域内のセルの数をカウントします。次に、測定ツールを使用して、各サンプルの細胞形態に関するデータを収集します。
- 細胞増殖
- 3つの未処理の96ウェルプレートを準備し、それぞれに5つのサンプルグループを追加します。
- JBNtグループの場合、596.25 μLの蒸留水に3.75 μLの1 mg/mL JBNtsを加えると、濃度6.25 μg/mLの600 μLのJBNt溶液が得られます。
- TGF-β1群の場合、592.5 μLの蒸留水に7.5 μLの10 μg/mL TGF-β1を加えると、0.125 μg/mLの試験液が得られます。
- マトリリン-3グループの場合、30 μLの10 μg / mLマトリリン-3を570 μLの蒸留水に加えると、0.5 μg / mLのテスト溶液が得られます。
- JBNm群では、7.5 μLの10 μg/mL TGF-β1と30 μLの10 μg/mLマトリリン-3とピペットを数回混合した後、3.75 μLの1 mg/mL JBNtsを溶液に加えます。
- JBNt、TGF-β1、およびマトリリン-3サンプルの最終濃度をそれぞれ6.25 μg/mL、0.125 μg/mL、および0.5 μg/mLの最終濃度を得るために、JBNm溶液を558.75μLの蒸留水で希釈します。
- 対照群には、600μLの蒸留水を使用してください。
- 各サンプルグループを6つのウェルに分割します(ウェルあたり100 μLサンプル)。
- すべてのサンプルを含む3枚のプレートを-80°Cの冷凍庫に1時間入れた後、凍結乾燥装置で凍結乾燥します。
- これらのプレートにhMSCをシードし、それぞれに5,000個の細胞を含む100 μLの細胞懸濁液(ウェルあたり)を受け取ります。3枚のプレートを37°Cで5%CO2で1日、3日、または5日間インキュベートします。
- 細胞を含む各ウェルに10 μLのCCK-8溶液を加え、37°Cでさらに2時間インキュベートします。
- 450 nmのマルチモードマイクロプレートリーダーで各ウェルの吸収値を測定します。
- 既知の勾配のhMSCを96ウェルプレートに播種し、4時間インキュベートします。CCK-8アッセイを使用して、既知の細胞数の吸収値を測定し、検量線を生成します。
- 吸収検量線を用いて細胞増殖を計算します。
- 3つの未処理の96ウェルプレートを準備し、それぞれに5つのサンプルグループを追加します。
- 安定性試験
注:ヒトTGF-β1標的ELISAキットを使用して、アガロースヒドロゲル中のJBNmからのTGF-β1の放出率を決定しました。- 20 mLのPBSに400 mgのアガロース粉末を加え、100°Cまで加熱してアガロース粉末を完全に溶解することにより、2%アガロースを調製します。
- 冷却した2%アガロースヒドロゲル内にJBNmを準備します。
- 10 μg/mL TGF-β1 10 μL、10 μg/mL マトリリン-3 40 μL、1 mg/mL JBNts5 μL、PBS 195 μLを組み合わせます。この溶液を250 μLの2%アガロースと混合し、JBNmヒドロゲルを作成します。
- 500 μLのPBSを放出溶液として使用し、必ず3日ごとに交換してください。放出されたすべての溶液を保持し、サンプルを15日間放置します。
- ELISAキットを使用して、製造元の指示に従って、キャプチャされた各リリースソリューションをテストします。
注:理論負荷値100%からPBSに放出されたTGF-β1の量を差し引くことにより、TGF-β1の残りの量を決定することができます。
- PCR26による細胞分化解析。
- 20 μLの細胞懸濁液(4 x 104 細胞)、30 μLの特異的溶液(またはサンプルグループによってはPBS)、および50 μLの2 wt%アガロースを含む7つのサンプルグループを調製します。
- TGF-β1群の場合、10 μg/mLのTGF-β1を25 μLのPBSに加えると、1.6 μg/mLの溶液が得られます。
- マトリリン-3群の場合、20 μLの10 μg/mLマトリリン-3を10 μLのPBSに加えると、6.7 μg/mLの溶液が得られます。
- JBNtグループの場合、27.5 μLのPBSに2.5 μLの1 mg/mL JBNtsを加えると、83.3 μg/mLの溶液が得られます。
- J/T/M JBNm群の場合、10 μLの10 μLのマトリリン-3を10 μL/mLのTGF-β1の5 μLに加え、ピペットで上下に混合します。その後、2.5 μLの1 mg/mL JBNtsを加え、再度ピペットでピペットします。最後に、2.5 μLのPBSで希釈します。
- 各対照群について、サンプルとして30 μLのPBSを使用します。
- 0.5 mLの細胞培養培地を各ウェルに加え、3日ごとに交換してください。
- 陽性対照群については、TGF-β1を添加した市販のhMSC軟骨形成培地を使用する。この追加のTGF-β1は、TGF-β1およびJ/T/M JBNmグループの両方の量に等しい。
- 陰性対照群の1つには、TGF-β1を含まない市販のhMSC軟骨原性培地を使用してください。他の陰性対照群には、10%ウシ胎児血清(FBS)を含むDMEM細胞培養培地を使用してください。
- 他のすべてのグループについては、TGF-β1を含まない市販のhMSC軟骨形成細胞培養培地を使用してください。
- サンプルを15日間培養します。
- サンプルのRNAを抽出し、PCRを実行して、前述のようにサンプルの分化を研究します26。
- 20 μLの細胞懸濁液(4 x 104 細胞)、30 μLの特異的溶液(またはサンプルグループによってはPBS)、および50 μLの2 wt%アガロースを含む7つのサンプルグループを調製します。
- X型コラーゲン発現アッセイのための免疫染色
- PCR法による細胞分化と同様の方法でアガロース系サンプル7種を調製する(ステップ7.4)。
- サンプルを15日間培養します。
- サンプルを4%ホルムアルデヒドで1日間固定し、30%ショ糖溶液に一晩浸した後、液体窒素で-80°Cで一晩凍結します。水溶性グリコールと樹脂のブレンドである最適な切断温度の化合物試薬(OCT)を使用して、-10°Cでサンプルを固定します。
- クライオスタットミクロトームを操作して、各サンプルの厚さ20 μmの凍結切片を取得します。
- メーカーのプロトコルに従って、1:800希釈の抗コラーゲンX抗体とPBSで希釈した蛍光標識二次抗体で各セクションを染色します。
- 接眼レンズ上で488 nmの励起と40倍の倍率を使用して、共焦点顕微鏡で各切片を観察します。
結果
プロトコルに従って、JBNtsの合成に成功し、UV-Vis吸収とTEMで特徴付けられました。JBNmは、迅速な生体模倣プロセスを経る注射可能な固体足場です。生理的環境でTGF-β1/マトリリン-3溶液の混合物にJBNtsを添加した後、 図1に示すように、JBNmの組み立てが成功したことを示す固体の白いメッシュの足場が形成されました。これは、特性評価方法で実証されました。
生理学的条件下では、マトリリン-3はその等電点27 のために負に帯電します(図2A)。TGF-β1溶液をマトリリン-3溶液に添加した後、TGF-β1/マトリリン-3化合物のゼータ電位は中性に近い値に増加し、2つのタンパク質が電荷相互作用 を介して 結合していることを示しています。 図2Aに見られるように、JBNmのゼータ電位は、リジン側鎖の等電点が生理的環境で約9.74であるため、JBNtsのために3つのグループの中で最も高くなっています。JBNmのゼータ電位値の増加は、その層ごとの構造の組み立てが成功したことを示しています。
紫外可視吸収スペクトル(図2B)は、JBNmの階層的な内部構造の形成を明らかにしています。リジン側鎖とJBNtsの芳香環は、それぞれ220 nmと280 nmの2つの吸収ピークに寄与しました。TGF-β1添加後に吸収値の低下が認められ、TGF-β1とJBNtsとの間に結合が生じていることを示している。マトリリン-3にJBNtsを添加した後、ピークの吸収強度のより明白な減少が観察され、これもまたマトリリン-3とJBNtsの間の結合が成功したことを示しています。同様に、TGF-β1/マトリリン-3の混合物にJBNtsを添加した後、JBNmが形成され、吸収ピークの強度が低下した。JBNmの吸収ピークはTGF-β1/JBNts線よりもマトリリン-3/JBNts線に近く、JBNtsはマトリリン-3に結合することを好み、マトリリン-3と層ごとの外構造を形成し、TGF-β1は内層に存在することを示しています。TEMは、JBNtsおよびJBNmの形態を特徴付けるために使用されます(図2C)。タンパク質と結合した後、JBNmの厚い束が足場構造を形成するのが観察された。
蛍光顕微鏡は、層ごとの構造の存在を確認し(図3A)、JBNmの断面を実証しました。TGF-β1とマトリリン-3を標識した後、赤色蛍光マトリリン-3がJBNtバンドルを包み込み、JBNmの外層を形成することが観察されました。 図3Bでは、緑色蛍光TGF-β1が内層を形成し、成長因子を貯蔵する能力に寄与し、TGF-β1の局在を可能にしました。 図3C は、蛍光スペクトルによって特徴付けられる蛍光色素標識タンパク質間の蛍光共鳴エネルギー移動(FRET)プロセスを示しており、標識されたTGF−β1およびマトリリン−3基についてそれぞれ520nmおよび570nmに発光ピークを有する28。プロトコルに従ってJBNtsを追加した後、層ごとの構造が形成されます。JBNmグループの520 nmと570 nmの両方でピークが観察され、タンパク質とJBNtsの結合と組み立てが成功したことを示しています。
さらに、hMSCの接着と細胞増殖に対するJBNmの効果を調べました。 図4に示すように、チャンバー付きカバーガラスの表面にコーティングされたJBNmの細胞接着密度を測定した。JBNmは、hMSCがそれ自体に沿ってクラスター化していることを示しましたが(図4A)、JBNtsに接着する細胞は少なかった。しかし、他のグループでは、hMSCはJBNmグループと比較して整列せずに均等に分布していました。JBNm上の細胞の配列と細胞のサイズは、JBNtsが細胞接着に役割を果たし、JBNm中のタンパク質が細胞接着の親和性を増加させることを示しました(図4B、C)。
JBNm、JBNts、マトリリン-3単独、TGF-β1単独、および陰性対照による細胞培養の1日目後、JBNmおよびTGF-β1群は他の群と比較して有意な細胞増殖を示した。細胞培養期間を3日および5日に延長すると、図5に示すように、JBNmおよびTGF-β1グループはさらに細胞増殖の増加を示しました。JBNmの有無によるhMSCの分化を決定するために、長期機能研究が実施されました(陰性対照)。15日後、増強されたアルシアンブルー染色が観察され、JBNm26とともに増殖するhMSCの軟骨形成が示されました。したがって、細胞はJBNmのJBNtsを好んだ。これは、そのDNA模倣構造と低分子ユニットに分解する能力によるものと考えられ、後者は低pHまたは十分な酵素活性(細胞による取り込みなど)によって引き起こされる可能性があります14,29。
ビデオ1:JBNmアセンブリのビデオ録画。この記録は、JBNts、マトリリン-3、およびTGF-β1がJBNmに形成される様子を示しています。この図は、Zhou et al. (2021)26から修正されています。このビデオをダウンロードするには、ここをクリックしてください。
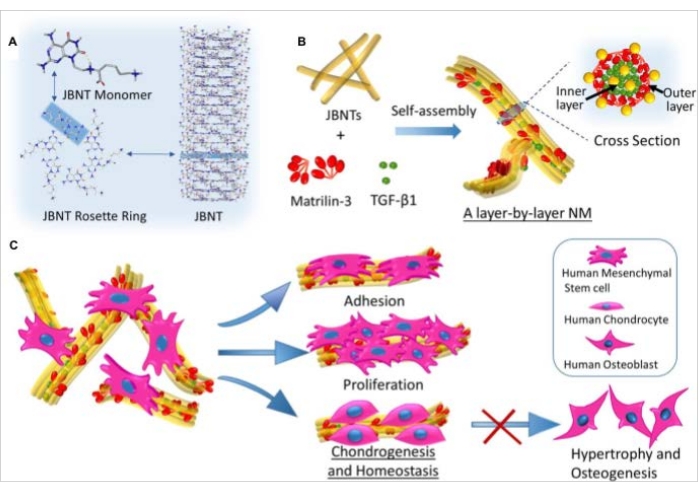
図1:JBNtsの化学構造、 J/T/M JBNm、およびJ/T/M JBNmの軟骨形成能力の模式図。 (A)JBNtsの化学構造、モノマーからロゼット環、JBNtへの形成を強調しています。 (B)J/T/M JBNmを構成するコンポーネント、およびそれらがJBNmにどのように組み立てられるか。 (C)J/T/M JBNm上でヒト間葉系幹細胞を培養する模式図。この図は、Zhou et al. (2021)26から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:J/T/M JBNmの材料特性評価。 (A)マトリリン-3単独、TGF-β1/マトリリン-3化合物、およびJ/T/M JBNmのゼータ電位スペクトル。 (B)JBNts単独、マトリリン-3単独、TGF-β1単独、マトリリン-3/JBNts化合物、TGF-β1/JBNts化合物、およびJ/T/M JBNmの紫外-Vis吸収スペクトル。)JBNtsのみの画像と透過型電子顕微鏡(TEM)から得られたJ/T/M JBNm。この図は、Zhou et al. (2021)26から修正されています。この図の拡大版を表示するには、ここをクリックしてください。

図3:J/T/M JBNmの蛍光共焦点イメージングと蛍光スペクトル。 (A)赤色蛍光標識マトリリン-3および緑色蛍光標識TGF-β1を用いたJ/T/M JBNmの3D共焦点画像。(B)J/T/M JBNmの2D共焦点画像、赤色蛍光標識マトリリン-3、緑色蛍光標識TGF-β1、およびマージバージョン。(C)標識タンパク質間のFRETプロセスを特徴付けるための様々な化合物の蛍光スペクトル。この図は、Zhou et al. (2021)26から修正されています。この図の拡大版を表示するには、ここをクリックしてください。
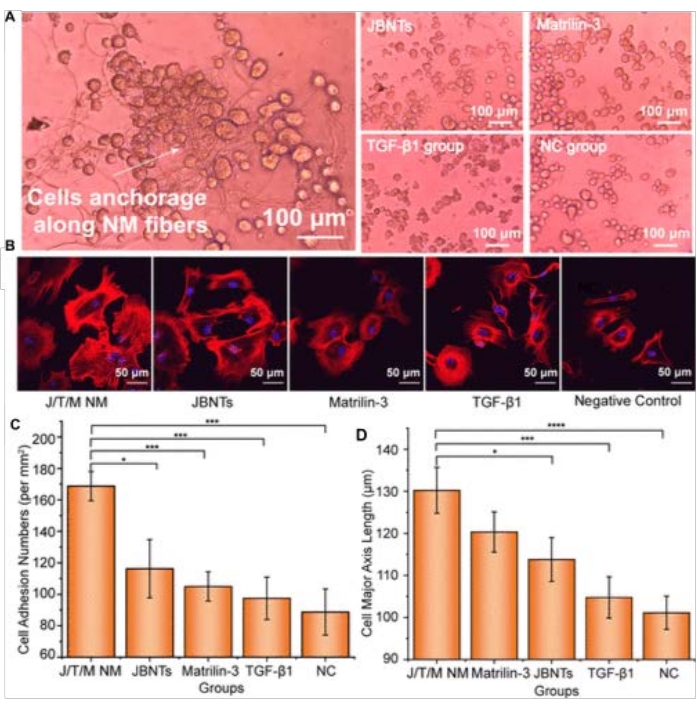
図4:ヒト間葉系幹細胞(hMSC)培養の解析 。 (A)アガロースゲル上で培養したTGF-β1、マトリリン-3、およびJBNtsを含むhMSCの光学顕微鏡画像。(B)様々なJBNm成分をコーティングしたチャンバーカバーガラス上で培養したhMSCの共焦点顕微鏡画像。(c)各群の平方ミリメートル当たりの細胞接着数のグラフ。エラーバーは標準偏差を示します。(d)細胞長軸長を1群あたりのμmで表したグラフ。エラーバーは標準偏差を示します。注: N ≥ 3, *P< 0.05, **P< 0.01, ***P< 0.001, ****P< 0.0001(陰性対照、NCとの比較)。この図は、Zhou et al. (2021)26から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
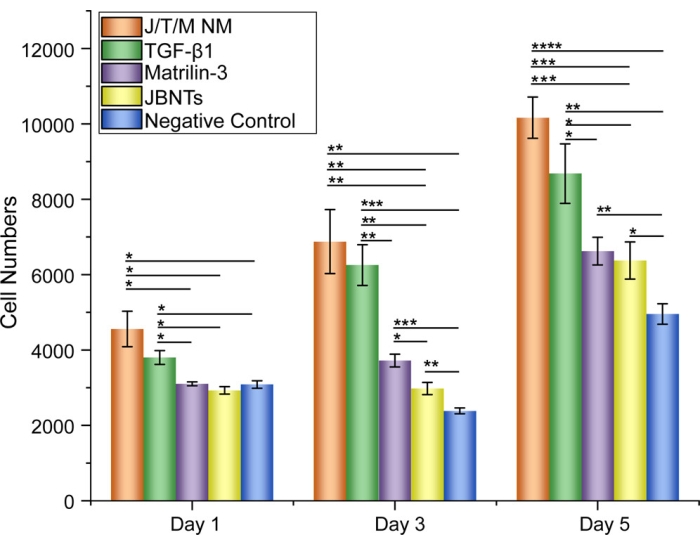
図5:1、3、5日目のさまざまなグループの細胞数の比較 。 1、3、5日目に異なる材料で培養した後のhMSCの細胞数統計。エラーバーは標準偏差を示します。注: N = 6, *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.0001.この図は、Zhou et al. (2021)26から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
この研究の目標は、細胞分化を媒介するために細胞培養環境に依存する従来の組織構築物の限界を克服するために、生体模倣足場プラットフォームであるJBNmを開発することです。JBNmは、自立可能な軟骨組織構築のための層ごとの構造足場です。革新的なデザインは、DNAに触発された新しいナノ材料であるJBNtsに基づいています。JBNts30、TGF-β1、マトリリン-3からなるJBNmは、足場の自己組織化を分子レベルで制御する新しい層ごとの技術によって組み立てられます。JBNmのアセンブリを観察し、ゼータ電位測定、UV-Vis吸収、TEM、および蛍光スペクトル分析で特徴付けました。
図2B(ステップ3)のUV-Visスペクトルは、JBNmの階層的な層ごとの内部の形成を実証しています。結合親和性の違いにより、吸光度ピークの違いが観察されます。JBNtsとマトリリン-3の間では、JBNtsとTGF-β1の間よりも大きな相互作用が起こり、JBNtsが線維形態とリジン表面化学の点でコラーゲンタンパク質を模倣していることを示しています。この技術は、TGF-β1ではなくマトリリン-3へのJBNtsの結合を観察するために必要であり、TGF-β1のカプセル化を可能にし、したがってTGF-β1の周辺組織への徐放を提供する。JBNmの開発における最も重要なステップは、タンパク質とJBNtsの組み合わせであり、標識されたマトリリン-3とTGF-β1の間のFRET現象の完全な効果を観察するために、JBNtsを添加する前にTGF-β1およびマトリリン-3を添加する必要があります。この手法の限界は、タンパク質とナノチューブの誤った添加シーケンスに起因し、その結果、さまざまな測定が行われます。これは、将来の研究のためのJBNmの形成にとって重要なステップであり、したがって、将来のJBNmの製造と研究に適用されます。
図2Aに示すように、マトリリン-3は非常に陰性のタンパク質ですが、TGF-β1はわずかに中性のタンパク質です。電荷差を観察して、これらのタンパク質の結合を決定した。マトリリン-3の負に帯電した状態から、ゼータ電位はTGF-β1の添加後にほぼ中性値に増加しました(図2A)。このステップは、生体模倣足場の第1の内層を決定し、両方のタンパク質の組み合わせが電荷相互作用によるものであることを示すために重要である。JBNm作製の第2段階であるJBNts添加後、JBNmのゼータ電位は~10 ± 5 mVで測定されました(図2A)。JBNtsは非常にポジティブであるため、JBNmの電荷は予想通りに増加することが観察されました。したがって、ゼータ電位を持つ電荷の決定は、電荷相互作用を介してJBNmの形成を段階的に観察するために重要です。UV-Vis分光法と同様に、このステップでは添加の順序が重要であり、添加順序が正しくないと測定値が異なる場合があります。同様に、測定前に混合物を上下にピペットで固定することが重要です。
次に、TGF-β1とマトリリン-3を標識し、共焦点顕微鏡とマルチモードマイクロプレートリーダーによる蛍光スペクトル分析でJBNmの発達を観察できるようにします。サンプルを488 nmレーザーで励起し、520 nmと570 nmに発光ピークを示しました(図3)。JBNtsのみでは標識されていないため、発光ピークは観察されませんでした。TGF-β1ドナーからマトリリン-3アクセプターへのFRETが発生し、それによって520 nmの発光ピークが減少し、570 nmの発光ピークが増加しました。2つの成分は距離が10nm離れているため、FRET現象が発生します。したがって、JBNmのアセンブリは、電荷相互作用とともに空間(すなわち物理的距離)プロセスに基づいている。JBNmの開発における最も重要なステップは、追加シーケンスです。TGF-β1およびマトリリン-3は、FRET現象の完全な効果を観察するために、JBNtsを添加する前に添加する必要があります。蛍光JBNmを観察するには、接眼レンズ上で少なくとも40倍の倍率が必要です。この手法の限界は、JBNtsが標識されていないため、共焦点顕微鏡では観察できないことです。ただし、タンパク質標識技術は、将来のアプリケーションのためにいくつかの変更を加えてJBNtを標識するために適用できます。
JBNmは、細胞接着や細胞増殖などの細胞機能を助けることができます。この研究では、hMSCを異なる材料(JBNm、JBNts、TGF-β1、マトリリン-3、および無添加のネガティブコントロール)で培養し(5,000細胞から開始)、CCK-8溶液を使用して1、3、および5日間インキュベートした後の細胞数を比較し、細胞増殖を決定するための正確なメーカーのプロトコルに従いました。JBNmは、特にTGF−β1の存在下で、TGF−β1単独と他の3群と比較して有意な細胞増殖を示した。JBNtsはECMのコラーゲンを形態学的に模倣しますが、マトリリン-3は軟骨特異的タンパク質であり、37°Cで3日間および5日間インキュベートした後、細胞増殖活性が増加します(図5)。JBNmは、生体材料としての様々な将来の用途のための従来の細胞構築物の限界を克服するための注射可能および生体模倣組織工学の足場として機能する大きな可能性を示しています29,31。JBNmは軟骨ECMを形態学的に模倣し、接着部位を提供し、TGF-β132,33などの軟骨形成促進分化因子の微小環境への放出を可能にします。JBNmは、TGF-β1を足場の内層に組み込むことで、足場が不要な領域に漏れるのを防ぎ、足場の有効性を向上させます(図4、図5)。多くのhMSCはJBNm足場に沿ってクラスター化しているのが観察されますが、細胞はマトリリン-3、TGF-β1、および陰性対照群にまばらに分布しています(図4)。細胞の形態も観察され、JBNm表面との優れた親和性を示した。これらの精密に設計された生体材料は、取り込まれた生理活性分子の細胞培養環境への急速な放出を防止し、マトリックス34内の組織構築物の自己持続性を改善する。この手法の制限は、開始細胞数が細胞の増殖を決定するために重要であることである。5,000の開始細胞数が、この研究に最も最適であることがわかりました。既知の細胞数をプロットし、マルチモードマイクロプレートリーダーで測定することにより、細胞数を決定するためにも標準曲線が必要です。この手法は、JBNmスキャフォールドに関連するすべての研究で細胞増殖を決定するための標準化された方法として将来適用することができます。
hMSCをJBNmの有無にかかわらず3Dアガロースペレットで培養し、15日間の長期機能研究を決定しました。15日後、アガロースペレット中のhMSCから全RNAを抽出し、ポジティブコントロール(培地を交換するたびにペレットに新鮮なTGF-β1を供給した)、JBNm、JBNts、マトリリン-3、TGF-β1、および無添加を含む。遺伝子解析のためにリアルタイムqPCRを実施し、軟骨形成分化マーカー、アグリカン(ACAN)、および肥大マーカーX型コラーゲン(COL X)をテストしました。JBNm群のACAN発現は他の群と比較して有意に増加し、JBNmがCOL Xを阻害しながら幹細胞軟骨形成分化を有意に促進することを示しています。一方、陽性対照は、軟骨形成を亢進しており、ACANの増加、および分化細胞の肥大も指摘している26。この研究のさらなる制限は、RNA抽出がヒドロゲルに埋め込まれた細胞からのものであることである。したがって、このプロトコルで得られた全RNAは、濃度および純度が低かった。この制限を克服するために、次のステップであるリアルタイムqPCRに最適な濃度と純度を得るために、より多くのサンプルを培養および抽出しました。qPCRは研究にとって重要ですが、多数のサンプルを犠牲にすることなく効率的なサンプル抽出を確実にするために、将来の研究ではこの手法を少し変更する必要があります。
JBNmヒドロゲルからのタンパク質の放出をテストするために、ヒトTGF-β1 ELISAキットを使用して安定性試験を実施しました。本研究では、TGF-β1はJ/T/M JBNmに封入されることが予想されるため、TGF-β1の放出は観察されない(理論負荷値は100%)。このステップの制限は、全てのTGF−β1がJBNm層ごとの足場に封入されることである。15日後、ヒドロゲルから放出された溶液を収集し、製造業者のプロトコルに従ってキットで試験する。そして、理論負荷量値からPBS中に放出されたTGF-β1の量を差し引いてTGF-β1の量を算出した。TGF-β1はJBNmの内層に封入されていたため、タンパク質の徐放が予想された。この研究は、TGF-β1がJBNm足場内に局在し、周囲に急速に放出しないことを実証した26。
この革新的な層ごとのJBNm軟骨組織構築物は、分子レベルで高度に組織化および制御された自己組織化によって実現されました。TGF-β1はマトリックス繊維の内層に閉じ込められ、望ましくない場所への漏出を防ぎ、同時に局所的な軟骨形成を促進します。さらに、マトリリン-3はマトリックス繊維の外層に局在し、抗肥厚微小環境35を作り出す。JBNtsは、構造的な足場骨格として機能するだけでなく、幹細胞の固定および接着を強化して、マトリックス繊維に沿って細胞を局在させることも示されています30,36。将来の作業に関しては、JBNtベースの足場の層ごとの設計は、さまざまな組織37、38、39でのアプリケーションに合わせてカスタマイズされます。
開示事項
Yupeng Chen博士は、Eascra Biotech, Inc.とNanoDe Therapeutics, Inc.の共同創設者です。
謝辞
この研究は、NIH助成金7R01AR072027および7R03AR069383、NSFキャリアアワード1905785、NSF 2025362、およびコネチカット大学のサポートを受けています。この作業は、NIH助成金S10OD016435によっても部分的にサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 10 % Normal Goat Serum | Thermo Fisher | 50062Z | Agent used to block nonspecific antibody binding actions during staining. |
| 24-well plate | Corning | 07-200-740 | 24-well plate used for comparative cell culture. |
| 384-Well Black Untreated Plate | Thermo Fisher | 262260 | 384-well plate used for absorption measurements. |
| 8-well chambered coverglass | Thermo Fisher | 155409PK | 8-well coverglass used for comparative cell culture. |
| 96-well flat bottom | Corning | 07-200-91 | 96-well plate used for comparative cell culture. |
| 96-Well Plate non- treated | Thermo Fisher | 260895 | 96-well plate used for comparative cell culture and analysis. |
| Agarose Gel | Sigma-Aldrich | A9539 | Hydrogel used for cell culture. |
| Agarose Gel | Sigma Aldrich | A9539 | Hydrogel used as an environment for cell culture. |
| Alexa Fluor Microscale Protein Labeling Kit | Thermo Fisher | A30006 (488) and A30007 (555) | Fluorescent dye used to label proteins. |
| Anti-Collagen X Antibody | Thermo Fisher | 41-9771-82 | Antibody used to stain collagen-X. |
| Bio-Rad PCR Machine | Bio-Rad | Equipment used to perform PCR on samples. | |
| C28/I2 Chondrocyte Cell Line | Cells used to analyze proliferative abilities of various samples. | ||
| Cell Counting Kit 8 | Milipore Sigma | 96992 | Cell proliferation assay. |
| Cell Profiler | Broad Institute | Software used to analyze cell images. | |
| Cryostat Microtome | Equipment used to produce thin segments of samples for use in staining and microscopy. | ||
| DAPI | Invitrogen | D1306 | Blue fluorescent stain that binds to adenine-thymine DNA regions. |
| Disposable cuvettes | FISHER Scientific | 14-955-128 | Container used for spectrophotometry. |
| DMEM Cell Culture Medium | Thermo Fisher | 10566032 | Media used to support cellular growth. |
| Fetal Bovine Serum | GIBCO | A4766801 | Serum used in cell culture medium to support cell growth. |
| Fluoromount-G Mounting Medium | Thermo Fisher | 00-4958-02 | Solution used to mount slides for immunostaining. |
| Formaldehyde | Compound used to fix samples prior to microtoming. | ||
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody | Thermo Fisher | A16110 | Antibody used for protein staining. |
| Human Mesenchymal Stem Cells | LONZA | PT-2501 | Cells used to analyze differentiative abilities of various samples. |
| Human Mesenchymal Stem Chondrogenic Medium | LONZA | PT-3003 | Cell medium used to promote chondrogenic differentiation. |
| ImageJ | National Institutes of Health | Image analysis software used in conjunction with microscopy. | |
| itaq Universal SYBR Green One-Step Kit | BioRad | 1725150 | Kit used for PCR. |
| Janus-base nanotubes (JBNts) | Nanotube made from synthetic nucleobases to act as cell scaffolding tool. | ||
| LaB6 20-120 kV Transmission Electronic Microscope | Tecnai | Equipment used to perform transmission electron microscopy on a sample. | |
| MATLAB | MathWorks | Statistical software used for modeling and data analysis. | |
| Matrilin-3 | Fisher Scientific | 3017MN050 | Structural protein used as adhesion sites for chondrocytes. |
| NanoDrop Spectrophotometer | Thermo Fisher | Equipment used to measure absorption values of a sample. | |
| Nikon A1R Spectral Confocal Microscope | Nikon | A1R HD25 | Confocal microscope used to analyze samples. |
| Number 1.5 Chamber Coverglass | Thermo Fisher | 152250 | Environment for sterile cell culture and imaging. |
| Optimal Cutting Temperature Compound Reagent | Compound used to embed cells prior to microtoming. | ||
| Paraformaldehyde | Thermo Scientific | AAJ19943K2 | Compound used to fix cells. |
| PDC-32G Plasma Cleaner | Harrick Plasma | Cleaner used to prepare grids prior to transmission electron microscopy. | |
| penicillin-streptomycin | GIBCO | 15-140-148 | Antibiotic agent used to discourage bacterial growth during cell culture. |
| Phosphate Buffered Saline | Thermo Fisher | 10010023 | Solution used to wash cell medium and act as a buffer during experimentation. |
| Rhodamine-phalloidin | Invitrogen | R415 | F-Actin red fluorescent dye. |
| Rneasy Plant Mini Kit | QIAGEN | 74904 | Kit used to filter and homogenize samples during RNA extraction. |
| Sucrose Solution | Solution used to process samples prior to microtoming. | ||
| TGF beta-1 Human ELISA Kit | Invitrogen | BMS249-4 | Assay kit used to determine the presence of TGF-β1 in a sample. |
| TGF-β1 | PEPROTECH | 100-21C | Growth factor used for the stimulation of chondrogenic differentiation and proliferation. |
| Triton-X | Invitrogen | HFH10 | Compound used to lyse cells not fixed during staining process. |
| TRIzol Reagent | Thermo Fisher | 15596026 | Reagent used to isolate RNA. |
| Zetasizer Nano ZS | Malvern Panalytical | Equipment used to measure zeta-potential values of a sample. |
参考文献
- Chan, B. P., Leong, K. W. Scaffolding in tissue engineering: general approaches and tissue-specific considerations. European Spine Journal. 17, Suppl 4 467-479 (2008).
- Heo, D. N., et al. 3D bioprinting of carbohydrazide-modified gelatin into microparticle-suspended oxidized alginate for the fabrication of complex-shaped tissue constructs. ACS Applied Material Interfaces. 12 (18), 20295-20306 (2020).
- Almeida, H. V., et al. Anisotropic shape-memory alginate scaffolds functionalized with either type i or type ii collagen for cartilage tissue engineering. Tissue Engineering. Part A. 23 (1-2), 55-68 (2017).
- Vinatier, C., Guicheux, J. Cartilage tissue engineering: From biomaterials and stem cells to osteoarthritis treatments. Annals of Physical and Rehabilitation Medicine. 59 (3), 139-144 (2016).
- Filardo, G., Kon, E., Roffi, A., Di Martino, A., Marcacci, M. Scaffold-based repair for cartilage healing: a systematic review and technical note. Arthroscopy. 29 (1), 174-186 (2013).
- James, A. W., et al. A review of the clinical side effects of bone morphogenetic protein-2. Tissue Engineering. Part B, Reviews. 22 (4), 284-297 (2016).
- Blaney Davidson, E. N., vander Kraan, P. M., vanden Berg, W. B. TGF-beta and osteoarthritis. Osteoarthritis Cartilage. 15 (6), 597-604 (2007).
- Chen, Y., Yang, K. Intra-articular drug delivery systems for arthritis treatment. Rheumatology Current Research. 2, 106(2012).
- Liu, Q., et al. Suppressing mesenchymal stem cell hypertrophy and endochondral ossification in 3D cartilage regeneration with nanofibrous poly(l-lactic acid) scaffold and matrilin-3. Acta Biomaterialia. 76, 29-38 (2018).
- Song, S., Chen, Y., Yan, Z., Fenniri, H., Webster, T. J. Self-assembled rosette nanotubes for incorporating hydrophobic drugs in physiological environments. International Journal of Nanomedicine. 6, 101-107 (2011).
- Zhou, L., et al. Self-assembled biomimetic Nano-Matrix for stem cell anchorage. Journal of Biomedical Materials Research. Part A. 108 (4), 984-991 (2020).
- Zhou, L., Yau, A., Zhang, W., Chen, Y. Fabrication of a biomimetic nano-matrix with janus base nanotubes and fibronectin for stem cell adhesion. Journal of Visualized Experiments. (159), e61317(2020).
- Chen, Y., Song, S., Yan, Z., Fenniri, H., Webster, T. J. Self-assembled rosette nanotubes encapsulate and slowly release dexamethasone. International Journal of Nanomedicine. 6, 1035-1044 (2011).
- Chen, Y., et al. Self-assembled rosette nanotube/hydrogel composites for cartilage tissue engineering. Tissue Engineering. Part C, Methods. 16 (6), 1233-1243 (2010).
- Yu, H., Chen, Y. Advanced biomedical techniques for gene delivery. Recent Patents on Biomedical Engineering (Discontinued). 5 (1), 23-28 (2012).
- Muttigi, M. S., Han, I., Park, H. K., Park, H., Lee, S. H. Matrilin-3 role in cartilage development and osteoarthritis). International Journal of Molecular Sciences. 17 (4), 590(2016).
- Pei, M., Luo, J., Chen, Q. Enhancing and maintaining chondrogenesis of synovial fibroblasts by cartilage extracellular matrix protein matrilins. Osteoarthritis Cartilage. 16 (9), 1110-1117 (2008).
- Bello, A. B., et al. Matrilin3/TGFbeta3 gelatin microparticles promote chondrogenesis, prevent hypertrophy, and induce paracrine release in MSC spheroid for disc regeneration. NPJ Regenerative Medicine. 6 (1), 50(2021).
- Muttigi, M. S., et al. Matrilin-3 codelivery with adipose-derived mesenchymal stem cells promotes articular cartilage regeneration in a rat osteochondral defect model. Journal of Tissue Engineering and Regenerative Medicine. 12 (3), 667-675 (2018).
- Jayasuriya, C. T., et al. Matrilin-3 chondrodysplasia mutations cause attenuated chondrogenesis, premature hypertrophy and aberrant response to TGF-beta in chondroprogenitor cells. International Journal of Molecular Sciences. 15 (8), 14555-14573 (2014).
- Poniatowski, L. A., Wojdasiewicz, P., Gasik, R., Szukiewicz, D. Transforming growth factor Beta family: insight into the role of growth factors in regulation of fracture healing biology and potential clinical applications. Mediators of Inflammation. 2015, 137823(2015).
- Sun, Y., Lu, Y., Hu, Y., Ma, F., Chen, W. Induction of osteogenesis by bovine platelet transforming growth factor-beta (TGF-beta) in adult mouse femur. Chinese Medical Journal (English). 108 (12), 914-918 (1995).
- Sun, X., et al. Anti-miRNA oligonucleotide therapy for chondrosarcoma). Molecular Cancer Therapeutics. 18 (11), 2021-2029 (2019).
- Jayasuriya, C. T., Chen, Y., Liu, W., Chen, Q. The influence of tissue microenvironment on stem cell-based cartilage repair. Annals of the New York Academy of Sciences. 1383 (1), 21-33 (2016).
- Chen, Y., et al. Deficient mechanical activation of anabolic transcripts and post-traumatic cartilage degeneration in matrilin-1 knockout mice. PLoS One. 11 (6), 0156676(2016).
- Zhou, L., Zhang, W., Lee, J., Kuhn, L., Chen, Y. Controlled self-assembly of DNA-mimicking nanotubes to form a layer-by-layer scaffold for homeostatic tissue constructs. ACS Applied Material Interfaces. 13 (43), 51321-51332 (2021).
- Belluoccio, D., Schenker, T., Baici, A., Trueb, B. Characterization of human matrilin-3 (MATN3). Genomics. 53 (3), 391-394 (1998).
- Yau, A., Yu, H., Chen, Y. mRNA detection with fluorescence-base imaging techniques for arthritis diagnosis. Journal of Rheumatology Research. 1 (2), 39-46 (2019).
- Lee, J., Sands, I., Zhang, W., Zhou, L., Chen, Y. DNA-inspired nanomaterials for enhanced endosomal escape. Proceedings of the National Academy of Sciences. 118 (19), (2021).
- Zhang, W., Chen, Y. Molecular engineering of DNA-inspired Janus base nanomaterials. Juniper Online Journal Material Science. 5 (4), 555670(2019).
- Yau, A., Sands, I., Chen, Y. Nano-scale surface modifications to advance current treatment options for cervical degenerative disc disease (CDDD). Journal of Orthopedic Research and Therapy. 4 (9), 1147(2019).
- Mello, M. A., Tuan, R. S. Effects of TGF-beta1 and triiodothyronine on cartilage maturation: in vitro analysis using long-term high-density micromass cultures of chick embryonic limb mesenchymal cells. Journal of Orthopaedic Research. 24 (11), 2095-2105 (2006).
- Shi, Y., Massague, J. Mechanisms of TGF-beta signaling from cell membrane to the nucleus. Cell. 113 (6), 685-700 (2003).
- Sands, I., Lee, J., Zhang, W., Chen, Y. RNA delivery via DNA-inspired janus base nanotubes for extracellular matrix penetration. MRS Advances. 5 (16), 815-823 (2020).
- Zhou, L., Rubin, L. E., Liu, C., Chen, Y. Short interfering RNA (siRNA)-based therapeutics for cartilage diseases. Regenerative Engineering and Translational Medicine. 7 (3), 283-290 (2020).
- Bi, H., et al. Deposition of PEG onto PMMA microchannel surface to minimize nonspecific adsorption. Lab on a Chip. 6 (6), 769-775 (2006).
- Chen, Y., Webster, T. J. Increased osteoblast functions in the presence of BMP-7 short peptides for nanostructured biomaterial applications. Journal of Biomedical Materials Research. Part A. 91 (1), 296-304 (2009).
- Sun, M., Lee, J., Chen, Y., Hoshino, K. Studies of nanoparticle delivery with in vitro bio-engineered microtissues. Bioactive Materials. 5 (4), 924-937 (2020).
- Yau, A., Lee, J., Chen, Y. Nanomaterials for protein delivery in anticancer applications. Pharmaceutics. 13 (2), 155(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved