Method Article
生体膜力プローブ分光法による分子ばね定数解析
要約
バイオメンブレン力プローブ(BFP)は、イン ・ス・ ダイナミック・フォース分光法(DFS)の技術です。BFPは、生細胞上の分子相互作用のばね定数を測定するために使用することができる。このプロトコルは、BFPによって検出された分子結合に対するばね定数分析を提示する。
要約
生体膜力プローブ(BFP)は、最近、単一分子結合性キネティクスを測定し、リガンド-受容体相互作用の機械的特性を評価し、タンパク質の動的構造変化を視覚化し、よりエキサイティングに受容体媒介細胞メカノセンシング機構を解明することができる、ネイティブ細胞表面または その場 動的力分光(DFS)ナノツールとして出現しました。最近では、BFPは分子結合のばね定数を測定するために使用されています。このプロトコルは、分子ばね定数DFS分析を実行するためのステップバイステップの手順を説明する。具体的には、2つのBFP動作モード、すなわちビードセルとビードビードモードについて説明します。このプロトコルは、DFS生データから分子結合と細胞のばね定数を導き出することに焦点を当てています。
概要
ライブセルDFS技術として、BFPはヒト赤血球(RBC;)図1)0.1-3pN/nm1、2、3で互換性のあるばね定数範囲を持つ超高感度で調整可能な力トランスデューサーに。リガンドと受容体の相互作用をプローブするために、BFPは、約1pN(10-12 N)、〜3nm(10-9 m)、および〜0.5 ms(10-3 s)の力、空間、および時間分解能4、5でDFS測定を可能にする。その実験的構成は、2つの対向するマイクロピペット、すなわちプローブとターゲットで構成されています。プローブマイクロピペットはRBCを吸引し、ビーズはビオチンとストレプトアビジンの相互作用を介して頂点に接着されます。ビーズは、目的のリガンドでコーティングされている(図1A)。標的マイクロピペットは、対象の受容体を担う細胞またはビーズのいずれかを吸引し、ビーズ細胞(図1B)およびビーズビーズ(図1C)モードにそれぞれ対応し、それぞれ5。
BFP の構築、アセンブリ、DFS 実験プロトコルについては、前に1,6を詳しく説明しました。簡単に言えば、BFPタッチサイクルは、アプローチ、インピンジ、接触、後退および解化の5つの段階で構成されています(図1D)。水平 RBC 頂点位置は ΔxRBCと示されます。冒頭で、無ストレス(ゼロフォース)RBC変形ΔxRBCは0(表1)である。ターゲットは、ピエゾトランスレータによって駆動され、プローブビードを押さえ、引き込まれるようにします(図1D)。RBCプローブは、まず負のRBC変形ΔxRBC<0でターゲットによって圧縮されます。ボンドイベントでは、リトラクトステージは、正のRBC変形ΔxRBC>0(図2CおよびD)を有する圧縮相から引張り相に移行する。フックの法則によれば、BFP軸受力は、F = kRBC×Δ xRBCとして測定することができ、k RBC(表1)はBFPのRBCばね定数である。ボンド破裂と1回のタッチサイクルの完了時に、プローブビーズはΔxRBC = 0(図1D)でゼロフォース位置に戻ります。
kRBCを決定するために、プローブマイクロピペット内オリフィス(R p)、RBC(R0)、およびRBCとプローブビーズの間の円形接触領域(Rc)の半径を測定し、記録する(図1A)。次いで、KRBCは、BFP(図S1A)8,9を操作する仮想計測器(VI)として機能するLabVIEWプログラムを用いて、Evanのモデル(Eq. 1)7,8に従って計算される。
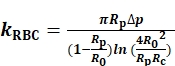 (Eq. 1)
(Eq. 1)
BFPが確立され、DFS生データが得られたことで、リガンドとレセプターの対または細胞のばね定数を分析する方法を紹介します。グリコシル化タンパク質Thy-1とK562細胞を持つインテグリンの相互作用に関するDFS生データα 5 β 1 (thy-1-α5β1;図3A及び3B)10及びフィブリノーゲン及びビーズ αのそのとIIb β 3(FGN-α IIb β 3; 図3C)11,12は、ビーズセルおよびビードビーズ分析モードをそれぞれ実証するために使用されています。
BFP実験準備
BFP実験の準備と計測の詳細については、前に公開したプロトコル3を参照してください。簡単に言えば、ヒトRBCは、炭素/重炭酸塩緩衝液中のビオチン-PEG3500-NHSを用いてビオチン化されている。目的のタンパク質は、リン酸緩衝液中のMAL-PEG3500-NHSを用いてホウケイ酸ガラスビーズに共有結合されている。ビオチン化RBCに付着するために、プローブビーズはまた、MAL-SAを使用してストレプトアビジン(SA)でコーティングされています。 資料表 と 表2を参照してください。
BFP(図1、左)を組み立てるには、プローブビーズを送達し、RBCの頂点1、3に接着するために「ヘルパー」と呼ぶ3番目のマイクロピペットを使用します。SAコーティングプローブビーズとビオチン化RBCの共有結合相互作用は、対象のリガンド-受容体結合よりもはるかに強い。したがって、解離ステージは、RBCからのプローブビーズの剥離ではなく、リガンド-受容体結合破裂と解釈することができる。
プロトコル
1. 分析可能な DFS イベントの取得
- BFPコントロールとパラメータ設定(図S1A)のソフトウェア(例えば、LabVIEW VI)で実験を開始します。
- BFP モニタ用ソフトウェアで、反復プローブビーズ ターゲット ビーズ/セル タッチを観察します (図 S1B)。
- 衝突力と接触時間を調整することにより、最初の50タッチ以内に20%の接着周波数≤を試験し、達成し、それによってDFS接着イベントの≥89%が単一結合12、13、14によって媒介されることを保証する。
注: 各ビーズセル/ビーズペアに対して、200反復的なタッチサイクルを実行します。パブリッシュ可能なデータ品質を得るために、我々は通常、n ≥3ビードビーズまたはビードセルペアを実行します。- BFP コントロールとパラメータ設定のソフトウェアによってプロンプトが表示され、各ペアの最後までに、Force vs. Time という形式で、データをユーザーが指示したフォルダーに保存します。
- BFP 取得プラットフォームを使用して、図 2Aに示すように、ボンド イベントのフォース対時間の生データを収集します (図 S1C)。
- BFP データ解析ソフトウェアを開きます。黄色のフォルダアイコンをクリックし、それらをダブルクリックして、対応する生データファイルを選択します。
- プログラムを実行し、上ボタンと下向きボタンをクリックしてイベントを切り替えます。外れ値除外条件 (図 S2) を使用して、無効なイベントを表示します。[強制対時間]形式として書き出すデータ タイプを選択し、[ プロット データをエクスポート ]ボタンをクリックします。
2. フォース対時間カーブをフォース対変位曲線に変換
- リトラクトステージに対応するデータセグメントを、ばね定数分析に関連するスプレッドシート(図2A、四角いマーキー)にエクスポートします。
- スプレッドシート ソフトウェアを使用して、フォースとタイム カーブをプロットします。フォースと変位曲線を取得するには、時間値(図2A、x-軸)を、ピエゾ移動速度(プリセットで4,000 nm/s)で時間値を乗算して、合計変位値(Δxtot)に変換します。
- 取得した各変位値から最小の変位値を引いて、最初のデータ点をゼロにします。この水平変換は、リトラクト ステージの上昇勾配や後続のばね定数計算には影響しません。
- 特に、BFPは、RBC、Δx RBC(表1)の総変形をΔx、分子結合、Δxモル(表1)、標的細胞Δx細胞(表1)、Eq2として表したシリアルスプリングシステムと考えられている。
 (Eq. 2)
(Eq. 2) - 図 2Bに示すように、力 (F) と変位 (Δxtot) カーブをプロットします。
3. ビーズ-セルモードのスプリング・クネスタント解析
- フォース対変位曲線では、2 つの異なるスロップを識別でき、それぞれが圧縮フェーズと引張フェーズを表すことができます。回帰直線を各データグループ(図2B)に適合し、より大きな線形適合勾配が圧縮相(図2B、赤色)における総ばね定数を表す(k1(表1)として示される)。そしてより小さい線形フィット勾配は、テンズリール相(図2B、青)でのスプリングの合計定数を表し、k2(表1)と示す。
- ステップ2.2の説明ごとに直列に接続されたばねについては、全ばね定数の逆数を表し、ktot(表1)、RBCのバネ定数逆数の和として、kRBC、kRBC(表1)、分子結合、kモル(表1)、および標的細胞、kセル(表1)を表す。ビーズ細胞モードの圧縮相の間、分子結合は伸張されず、従ってkモルは考慮されない。このシナリオでの kトートの逆数 (1/k1) は次のように表現されます。
 (Eq. 3)。
(Eq. 3)。
サンプルデータでは、kRBCが事前に決定されています(デフォルトでは0.25 pN/nm)。kセルは、取得したk1およびk RBCを有するEq. 3から導出することができる(図3B)。 - 引張段階の間、リガンドと受容体の対の間に接着が形成される。このシナリオでkトートの逆数を表現する (1/k2)
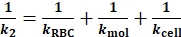 (Eq. 4)
(Eq. 4)
ここで k2 ( 表1) は、引張フェーズ中のばね定数の合計を表します。 - 1/ k1を1/ k2から1/k1を引いてkモルを導出する(Eq. 3対Eq. 4を比較する)。
4. ビーズビーズモードのスプリング定数分析
- 回帰直線を圧縮相データに合わせて k 1 (図 2B、赤に似ています) を得る。なお、ビーズ・ビードモードでは、標的細胞は目的の受容体でコーティングされたガラスビーズに置き換えられる(図1C)。ビードの変形は無視できるので、1/k細胞項は、それに応じてEq. 3およびEq. 4から除去することができる。圧縮相(1/k1)の逆数kトートは、次のように表現できます。
 (Eq. 5)
(Eq. 5) - 引っ張り相データに回帰直線を合わせてk2を得る(図2B、青に似ている)。引張フェーズの逆数kトート(1/k2) は、次のように表現できます。
 (Eq. 6)
(Eq. 6) - 1/ k1を1/k2から減算から kモルを導出する (Eq. 5 対 Eq. 6)。
結果
この研究では、BFPばね定数分析のプロトコルを実証しました。ビーズ細胞解析モードでは、プローブビーズ上でコーティングされたグリコシル化タンパク質Thy-1と、標的K562α細胞上で発現するインテグリンα 5 β 1との間の分子結合のkモルを解析β 1 β。図 3A)10. kセルもビーズセルモードから派生します (K562 セル;図 3B)。ビード・ビードモードでは、フィブリノーゲンとインテグリンの間に形成される分子結合α IIbβ 3(FGN-インテグリンα IIbβ 3;図3C)11,12は、ビーズビーズ解析モードを示すために使用されます。
ビーズセルモードでは、27のスクリーニング済み分析可能イベントから、thy-1-integrin α5β1結合、K562セルの kモル= 0.45 ± 0.28 pN/nm (図 3A)およびkセル= 0.18 ± 0.07 pN/nm (図 3B)を測定しました。ビードビードモードでは、FGN-インテグリンα IIb3結合 βをkモル=0.53±0.29 pN/nm(図3C)として、33個の事前スクリーニング分析可能イベントから測定しました。
| 記号 | 定義 | 記号 | 定義 |
| Δxtot | ピエゾの総変位は、RBC、標的細胞および分子結合の総変形としても解釈することができる。 | ΔxRBC | RBC 変形は、プローブビードの変位としても解釈できます。 |
| kトート | BFPシリアルスプリングシステム全体の総ばね定数。 | kRBC | プローブマイクロピペットによる吸引RBCのばね定数。 |
| kモル | BFP検出分子結合のばね定数 | kセル | ターゲット セルのばね定数。 |
| k1 | リトラクト段階での圧縮段階のkトート。 | k2 | 引き込み段階における引張段階のkトート。 |
| ΔF1 | 圧縮フェーズでプローブビードによって感知される力の増分。 | ΔF2 | 引張フェーズでプローブビードによって感知された力の増分。 |
| Δx1 | 圧縮フェーズの変位の増分。 | Δx2 | 引張フェーズの変位の増分。 |
表 1.BFP分子ばね定数解析のシンボル定義。すべてのオブジェクトの水平位置はxとして定義され、Δx [nm] は元の位置に対する変形を表します。ΔF[pN]は、BFPで測定される力増分を意味する。k [pN/nm] はばね定数を指します。添字 1 と 2 はそれぞれ、圧縮相と引張フェーズに対応しています。分子ばね定数は、力(F)対に由来する。変位 (Δxtot)カーブ。

図1: BFP 構成と DFS タッチ サイクル(A) BFP システムは、2 つの対向するマイクロピペット、すなわちプローブ (左) とターゲット (右) を組み立てます。プローブマイクロピペットは、フォーストランスデューサとして機能するために、その頂点に接着ガラスビーズとRBC(赤)を吸引します。標的マイクロピペットは受容体を持つ細胞を吸引する(青)。RBCばね定数(kRBC)は、吸引圧力(Δp)と吸引RBCの半径(R0)、プローブマイクロピペット(Rp)およびRBCとプローブビーズの間の円形接触領域(Rc)によって決定される。(BとC)ビーズセル(B)とビードビーズ(C)BFPモードの顕微鏡写真。スケールバー = 5 μm. (D)アプローチ、インピンジ、コンタクト、リトラクト、および解化ステージで構成されるBFPタッチサイクル。ΔxRBC = 0のダッシュ線は、BFPがストレスなし、ゼロフォースの位置を示します。リトラクト段階は、圧縮相(ΔxRBC <0、赤色)、ゼロフォース位置(ΔxRBC = 0、黒)および引張位(ΔxRBC >0,青)を順に含む。黒矢印はボンドイベントの位置を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:DFS生データから分子ばね定数を導出する。 (B) 退避ステージを表す、変換力(F)と変位 (Δxtot)曲線を変換した場合。k1及びk2は、連続した圧縮相及び引張相の適合勾配をそれぞれ表す。ΔF1および ΔF2は、それぞれ圧縮相の力の増分と引張位相データを表し、ここで、Δx1および Δx2は、それぞれ圧縮相データと引張位相データにおける変位の増分を表します。圧縮段階(R12)および引張相(R22)の間のばね定数のR2値は、良好な統計的適合性を示すためにグラフ上にラベル付けされる。(C および D)ビーズセル(C)およびビーズビーズ(D)実験モードにおけるリトラクトステージの図。kRBCは RBC のばね定数を表します。k細胞とkモルはそれぞれ標的細胞と分子結合のばね定数を表す。引張相の間、リガンドとレセプターの対の間に接着が形成され、RBCは、ピエゾがゼロフォース位置を超えて後退する(ΔxRBC>0)と同じ方向に偏向する。この図の大きなバージョンを表示するには、ここをクリックしてください。
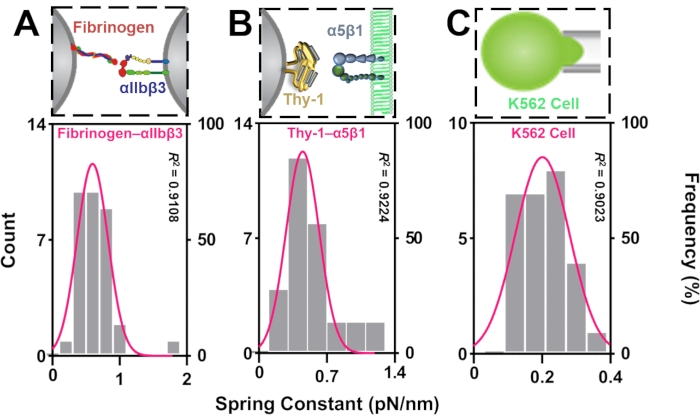
図3:BFPの代表的なヒストグラムはばね定数を測定した。ビード・ビード・モードのαビード・セル・モードにおける5 β 1結合(A)およびK562ターゲット・セル(B)およびビード・ビード・モードのFGN-インテグリンα IIbβ結合(C)の測定スプリング定数の事象番号(左y軸)および周波数分布(右y軸)。ヒストグラムはガウス分布曲線(ピンク)に適合し、統計パラメータR2は、適合度の強さを示すために使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
図 S1: 自家製の BFP インターフェイス。(A) BFP制御とパラメータ設定インターフェース。RBCばね定数を決定するためのパラメータは、生物物理学的パラメータのパネルから入力されます。(B) BFP モニタリング。ライブBFPのタッチサイクルは、このカメラビューから観察されます。(C) BFP DFS 解析インターフェースで、フォース(F)と時間 (t) の曲線をオフラインで確認し、その後の分子ばね定数分析のために前処理を行う。このファイルをダウンロードするには、ここをクリックしてください。
図 S2.BFP分析可能なデータ品質管理と事前審査基準。 (A) 高品質の良好な DFS イベント: (i) ビードセル破裂力イベント;(ii) ビーズセル生涯イベント;(iii) ビーズビーズ破裂力イベント;(iv) ビーズビーズ生涯イベント。(B) ある程度のノイズのある許容可能な DFS イベント: (i) データがドリフトするが、拡大表示リトラクト ステージは有効なままである。(ii)結合解離後にわずかなデータが流れる;(iii) ゼロフォース体制におけるデータキンク(iv) 保持力が小さい(<10 pN)。(C)破棄すべき低品質のイベント: (i) 接着なし;(ii) データの振動(iii) データが常にドリフトする。(iv) 不連続データ(v) 圧縮力が小さすぎる(≈0 pN)。(vi) 複数の結合(vii) kmol 由来のデータが無効< 0;(viii) シグナルエラー。ゼロフォースは灰色の断続線で示されます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
要約すると、BFPビーズビーズおよびビードセル解析モードでDFS生データを前処理し、分子ばね定数を導出するための詳細なデータ分析プロトコルを提供しました。分子および細胞のばね定数を決定するために必要な生体力学的モデルと方程式が提示される。異なるインテグリンが研究されているにもかかわらず、ビーズ・ビーズ・モードとビーズ・セル・モードで測定された kモル は有意な範囲差を有する(図3A 対 図3C)。注目すべきは、ビードビーズモードでは、受容体はガラスビーズに共有結合している。これに対して、ビーズ細胞モードでは、表面受容体は、基になる原形質膜および細胞骨格によって適応され、測定された kモルに影響を与える可能性が最も高い。
データ品質管理は、再現性を確保するために重要です。このため、フォースプロットと時間プロットに対するDFSデータの事前スクリーニングと外れ値除外基準を実装しました。これを実証するために、代表的なデータセットを選択し、DFS生データを3つの品質レベルに分類しました: 良い (図 S2A) ノイズで許容される (図 S2B) と悪い許容できない ( 図S2C) 。BFPを使用する初心者には、良質(図S2A)でデータを事前にスクリーニングするための厳格な基準をお勧めします。なお、データ事前スクリーニング基準に基づいて、圧縮相の回帰適合線は引張相のそれよりも急であるべきであり、具体的にはk1>k2(図S2C、vii)。 k1図S2C、vii)を測定した場合、導出kモル<0は、ステップ4における計算当たりの理論に反する。このようなイベントは、無効な外れ値と見なされ、破棄されます。
データ取得中の単一分子レベルでのBFP測定を優先するため、従来の研究12に従って複数の実験構成が実施されている。まず、ビーズ上のタンパク質コーティング密度は、通常、溶液濃度、タンパク質量および反応条件15を厳密に制御することによって最小限のレベル(例えば60μm-2)まで滴定される。ビード上のタンパク質間の平均空間距離は、それによってタンパク質の線形寸法よりもはるかに大きく推定され、単一分子レベル12、13、14の測定を支持する。第二に、我々は、各リガンドと受容体の対≤20%の接着頻度を制御し、その下で分子結合事象は、≥89%の事象が単一分子結合であるであろうと予測するポアソン分布に従う14、15である。そのためには、衝突力と接触時間がこれに応じて設定され、実験12全体を通して一貫している必要がある。それにもかかわらず、複数の結合が連続して発生する可能性があります(図S2C、vi)。このような場合は、複数の債券の署名を持つイベントを破棄します。最後に、陰性対照実験は、非特異的接着頻度が2%16、17≤であることを保証するために、牛血清アルブミン(表)またはSA単独でコーティングされたビーズで行われる。
BFPは生きている細胞表面10、11、12のタンパク質ダイナミクスを調査するのに強力であるが、技術的な制限がある。BFPでは、一度に1つのリガンドと受容体のペアのみを調査することができます。統計的に有意なデータを十分に得るのに時間がかかります。また、実験的な手順は、急な学習曲線を伴う労働集約的です。実装は、現在のBFPシステムは、環境漂流と周囲の機械的振動の影響を受けやすい。その結果、DFS データ品質を確保するためには、継続的な手動調整が必要になります。この目的のために、我々の最近の研究の一つは、BFP力クランプDFSアッセイ4の安定性を向上させるために超安定BFPフィードバック制御アルゴリズムを導入した。この技術の進歩により、超長結合寿命(>50s)との抗原と抗体の結合などの分子相互作用の測定が可能になります。それにもかかわらず、我々は、BFPデータ収集とDFS分析を自動化して1つのコンピュータ化されたプログラムに統合し、BFPの操作とデータ分析全体をよりユーザーフレンドリーで高スループットにするための将来の努力が行われると予見しています。
開示事項
著者らは、本研究に関して報告する競合する利益はないと宣言している。
謝辞
ギヨーム・トロアデックは、有益な議論、ハードウェアコンサルテーションのためのZihao Wang、シドニー・マニュファクチャリング・ハブ、グレッグ・スアンイン、サイモン・リンガーのラボスタートアップのサポートに感謝します。この研究は、オーストラリア研究評議会ディスカバリープロジェクト(DP200101970 - L.A.J.)、NSW心血管能力構築プログラム(早期キャリア研究者グラント - L.A.J.)、シドニー研究アクセラレータ賞(SOAR - L.A.J.)、ラマシオッティ財団によって支援されました 健康投資助成金(2020HIG76 - L.A.J.)、国民保健医療研究評議会アイデアグラント(APP2003904 - L.A.J.)、シドニー大学工学部スタートアップファンドと主要機器スキーム(L.A.J.)。ライニングアーノルドジュは、オーストラリア研究評議会DECRAフェロー(DE190100609)です。
資料
| Name | Company | Catalog Number | Comments |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct, Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| BFP data acquisition VI | LabVIEW | BFP control and parameter setting | |
| BFP data analysis VI | LabVIEW | BFP raw data analysis | |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Borosilicate Glass beads | Distrilab Particle Technology, Netherlands | 9002 | Glass bead functionalization |
| Bovine serum albumin | Sigma-Aldrich | A0336 | Ligand functionalization |
| Camera VI | LabVIEW | BFP monitoring | |
| D-glucose | Sigma-Aldrich | G7021 | Tyrode’s buffer preparation |
| Hepes | Sigma-Aldrich | H3375 | Tyrode’s buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Glass bead functionalization |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tyrode’s buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation; Tyrode’s buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tyrode’s buffer preparation |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4•H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Streptavidin-Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
参考文献
- Chen, Y., et al. Fluorescence Biomembrane Force Probe: Concurrent Quantitation of Receptor-ligand Kinetics and Binding-induced Intracellular Signaling on a Single Cell. The Journal of Visualized Experiments. (102), e52975(2015).
- Su, Q. P., Ju, L. A. Biophysical nanotools for single-molecule dynamics. Biophysics Reviews. 10 (5), 1349-1357 (2018).
- Ju, L. Dynamic Force Spectroscopy Analysis on the Redox States of Protein Disulphide Bonds. Methods in Molecular Biology. 1967, 115-131 (2019).
- An, C., et al. Ultra-stable Biomembrane Force Probe for Accurately Determining Slow Dissociation Kinetics of PD-1 Blockade Antibodies on Single Living Cells. Nano Letters. 20 (7), 5133-5140 (2020).
- Chen, Y., Ju, L., Rushdi, M., Ge, C., Zhu, C. Receptor-mediated cell mechanosensing. Molecular Biology of the Cell. 28 (23), 3134-3155 (2017).
- Ju, L., Chen, Y., Rushdi, M. N., Chen, W., Zhu, C. Two-Dimensional Analysis of Cross-Junctional Molecular Interaction by Force Probes. Methods in Molecular Biology. 1584, 231-258 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical Journal. 68 (6), 2580-2587 (1995).
- Ju, L., Zhu, C. Benchmarks of Biomembrane Force Probe Spring Constant Models. Biophysical Journal. 113 (12), 2842-2845 (2017).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysical Journal. 68, 2580(1995).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature Communications. 5, 4886(2014).
- Passam, F., et al. Mechano-redox control of integrin de-adhesion. Elife. 7, (2018).
- Chen, Y., et al. An integrin alphaIIbbeta3 intermediate affinity state mediates biomechanical platelet aggregation. Nature Materials. 18 (7), 760-769 (2019).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60, 70-85 (2017).
- Liu, B., Chen, W., Zhu, C. Molecular force spectroscopy on cells. Annual Review of Physical Chemistry. 66, 427-451 (2015).
- Piper, J. W., Swerlick, R. A., Zhu, C. Determining force dependence of two-dimensional receptor-ligand binding affinity by centrifugation. Biophysical Journal. 74 (1), 492-513 (1998).
- Ju, L., Dong, J. -f, Cruz, M. A., Zhu, C. The N-terminal flanking region of the A1 domain regulates the force-dependent binding of von Willebrand factor to platelet glycoprotein Ibα. Journal of Biological Chemistry. 288 (45), 32289-32301 (2013).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. Elife. 5, 15447(2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved