Method Article
出生後マウス脳からの一次ミクログリア単離
* これらの著者は同等に貢献しました
要約
初代細胞培養は、in vitroでミクログリアの生物学を研究するために主に使用されるアプローチの1つです。本研究では、マウスの生後1日目(P1)からP4まで、ミクログリアを簡便かつ迅速に単離する方法を開発しました。
要約
ミクログリアは、中枢神経系(CNS)の単核食細胞であり、恒常性を維持し、CNSの炎症過程を調節する上で重要な役割を果たします。in vitroでミクログリアの生物学を研究するために、初代ミクログリアは不死化ミクログリア細胞株と比較して大きな利点を示しています。しかし、出生後のマウス脳からのミクログリアの分離は、比較的効率が悪く、時間がかかります。このプロトコルでは、新生児マウスの脳から一次ミクログリアを分離するための迅速でわかりやすい方法を提供します。このプロトコルの全体的なステップには、脳の解剖、初代脳細胞の培養、およびミクログリアの分離が含まれます。このアプローチにより、研究者は高純度の初代ミクログリアを得ることができます。さらに、採取した初代ミクログリアは、リポ多糖の挑戦に応答することができ、免疫機能を保持していることが示されました。私たちは、高純度の初代ミクログリアを効率的に単離するための簡素化されたアプローチを開発し、in vitroでの幅広いミクログリア生物学研究を促進しました。
概要
中枢神経系(CNS)に常在する免疫細胞であるミクログリアは、神経病理学的課題に応答する恒常性の維持に極めて重要な役割を果たしています1。近年、アルツハイマー病2などにおけるミクログリアの生理学的機能を把握するための集中的な研究が行われています。現在、中枢神経系の発生、老化、および疾患中に得られた単一細胞分解能でのミクログリアの転写プロファイルは、健康な脳と病気の脳におけるミクログリア機能の理解を深めるのに役立ちます3。以前の研究では、ADおよびその他の神経変性疾患における疾患関連ミクログリアサブタイプが特定されました4,5,6。この亜集団は、アミロイドβ(Aβ)沈着に近接しています。食作用と脂質代謝に関連する遺伝子(例:Apoe、Tyrobp)は、これらの集団でアップレギュレーションされていることがわかりました6,7。しかし、ミクログリアの動的分子プロファイルの変化を制御する細胞内プロセス、細胞外および細胞内シグナル伝達経路は完全には理解されていません。特に、神経変性疾患における慢性ミクログリアの活性化の根底にあるメカニズムは、まだ解明されていません。したがって、ミクログリアの応答が脳の発達と神経変性の進行に明らかに寄与しているため、ミクログリアが関与する細胞メカニズムを理解することは非常に重要です。
ミクログリアを研究するためのin vivoおよびin vitroツールがいくつかありますが、まだいくつかの制限があります。ウェスタンブロットなどの実験を日常的に実施して細胞内シグナル伝達経路を解明するのに十分な高純度のミクログリア細胞を十分に多く得ることは技術的に困難です。初代ミクログリア培養は、ミクログリアの生物学を研究するための代替手段を提供します。培養した初代ミクログリアは、遺伝子操作後のミクログリア食能の解析や、炎症刺激に応答した炎症誘発性サイトカインおよび抗炎症性サイトカイン産生の評価など、脳内でのミクログリアの役割を理解するための生物学的側面への応用が可能である8。ここでは、新しいプロトコルを提示し、新生仔マウスの脳からの初代ミクログリアの単離と培養のための段階的な指示について説明します。これには、健康で純粋な初代ミクログリア細胞を得るために重要なステップに重点が置かれています。
プロトコル
すべての動物実験手順は、上海交通大学の動物研究委員会と実験動物管理の施設管理委員会によって承認されました。動物の苦しみを最小限に抑えるためにあらゆる努力が払われています。
1. 培養バッファー、フラスコ、カバースリップの調製
- 培地およびミクログリア培地:DMEMに10%FBSを添加して培地を作製します。ミクログリア培地は、DMEMに10%のFBSと20%のLADMACコンディショニング培地を添加して作製します。両方の培地に1%ペニシリン/ストレプトマイシンを追加します。.
- 20% LADMAC馴化培地を調製するには、LADMAC細胞から培地を回収し、200 x g で10分間遠心分離し、0.22 μmの細胞ストレーナーを使用してろ過し、アリコートを-80°Cで保存します。
- 消化バッファー:8 U/mL パパインと 125 U/mL DNase を DMEM に添加して、消化バッファーを調製します。
注:最良の結果を得るには、消化バッファーを新たに調製する必要があります。子犬の数に基づいて希望の量を計算します(子犬2匹につき1mLの溶液)。 - コーティングフラスコ:T25またはT75フラスコを使用して、単離された脳細胞にプレプレーティングします。脳解剖の前に、T25フラスコに2 mL(T75フラスコの場合は4 mL)の0.1 mg/mL Poly-D-リジン(PDL)をコーティングし、37°Cで少なくとも1時間インキュベートします。PDL溶液を吸引し、1x PBSで2回洗浄した後、細胞培養フード内でフラスコを風乾させます。
注:実験で使用されたフラスコのサイズと数は、出生後の子犬の数に依存していました。細胞をコンフルエントアストロサイト細胞層に短時間で到達させるには、3〜5個の脳用に1つのT25フラスコを、または5つの脳用に1つのT75フラスコを準備します。未使用のコーティングされたフラスコは、4°Cで最大1か月間保存できます。時間を節約するために、実験開始前にPDLの10倍(1 mg/mL)のストック溶液を調製し、シングルユースアリコートとして-20°Cで保存することができます。使用直前にアリコートを滅菌済みの1x PBSで希釈してください。 - カバースリップの準備:市販のガラスカバースリップを0.1 M HClで1時間洗浄し、オートクレーブ水で2回すすぎた後、100%エタノールで保存します。使用する前に、バーナーランプで細かい鉗子を使用してカバーガラスを炎上させ、残留エタノールを除去します。8 mmのガラスカバースリップは48ウェルプレートに、12 mmのガラスカバースリップは24ウェルプレートに配置できます。
- 解剖ツールの準備:細かいはさみ、鉗子、ステンレス鋼のマイクロスプーンを75%エタノールに少なくとも20分間浸します。次に、これらのツールを紫外線を紫外線下に置き、組織培養フードに30分間置きます。
2. マウス脳の解剖
注:プロトコールの有効性を評価するために、ここではCX3CR1GFP ノックインマウスを使用してミクログリア9を追跡しました。CX3CR1GFP/GFPマウスと野生型C57BL/6Jの雌を2ヶ月から8ヶ月で交配してCX3CR1+/GFP マウスを作製しましたが、どちらももともと市販のソースから入手しました。マウスは、上海交通大学の特定の病原体フリー(SPF)環境で12〜12時間の明暗サイクルの下で飼育されました。出生後1日目から4日目までの子犬をこのプロトコルに使用できます。
- 手術用ハサミですべての子犬の首を切り落とします。汚染を最小限に抑えるために、すべてのヘッドを75%エタノールですすぎ、氷冷した1x PBSにすばやく入れます。その間、消化バッファーと共培養培地を37°Cのウォーターバスで温めます。
注:構造的完全性を維持するために、一度に1匹の子犬から脳組織を切断して分離します。汚染を防ぐために、すべての手術器具は斬首の間に75%エタノールに入れる必要があります。 - 細かい解剖ハサミを使用して、延髄と一緒に頭蓋骨を切断します。切断部位から脳組織の下にステンレス製のマイクロスプーンを置き、頭部腔から脳を絞り出します。ウェルあたり2 mLのプレコールド1x PBSが入った新しい冷却6ウェルプレートに移します。
- 小脳球と嗅球を切り取り、廃棄します。残りの脳組織を、2 mLの予冷1x PBSを含む冷却した6ウェルプレートに穏やかに移します。
注:4〜5個の脳組織を1つのウェルに入れます。 - すべての組織が収集されるまで、残りのヘッドに対して同じ手順を繰り返します。
3.混合初代細胞を播種します
- 1x PBSを6ウェルプレートに1.5 mLで吸引し、スプリングハサミを使用して脳組織を小片(約1 mm2)に完全にミンチします。
注意: 細かい破片の量を減らすために、ティッシュを細かく刻みすぎないでください。 - ウェルに所望の量の消化バッファー(脳あたり0.5 mLの消化バッファー)を加え、プレートを5% CO2, 37°C加湿インキュベーターに20分間置きます。プレートを10分ごとに回転させます。
注:インキュベーション時間中に、70 μmの細胞ストレーナーを培養培地(DMEM中の10% FBS)で湿らせ、次に細胞ストレーナーを新鮮な50 mLコレクションチューブに置きます。 - プレートをインキュベーターから取り出し、各ウェルに3 mLの培地を加えてパパイン消化を終了します。1mLピペットを使用して、細胞を10回上下に穏やかにピペットします。混合物を15mLチューブに移し、1分間静置します。底に曇った細胞ペレットが見えます。大きな塊や細胞の破片を取り除くには、細胞懸濁液を70 μmの細胞ストレーナーに慎重に通し、フロースルーを50 mLの収集チューブに集めます。
- 15 mLチューブ内の未解離細胞ペレットに、加温した培地(DMEM中の10% FBS)3 mLを加えます。ステップ3.3のように10回三回して、解離を続けます。組織を1分間静置した後、細胞懸濁液をストレーナーに通して50 mLコレクションチューブに通します。この手順を繰り返して、残りのセルの破片を廃棄します。
- 細胞懸濁液を50 mLコレクションチューブから15 mLチューブに移し、細胞を200 x g で室温で10分間遠心分離します。
- 上清を吸引し、細胞を5 mLの培地に再懸濁します。T25またはT75フラスコで初代細胞を約5 x 106 の細胞密度で播種し、加湿インキュベーター(5%CO2、37°C)で培養します。これは、このカルチャ スケジュールの 0 日目です。
注:T25フラスコに細胞を播種する場合、フラスコあたり5 mLの培地の最終容量で十分です。T75フラスコに播種する際に、各フラスコに5 mLの培地を追加で加えます。
4. 初代ミクログリアの採取
- 翌日(1日目)に混合細胞のコンフルエンシーを評価します。混合細胞はかなり高密度で播種されているため、アストロサイトがコンフルエントに達するまでに3〜4日かかり、1〜2日後にミクログリアを採取することができます。
注:翌日に細胞がフラスコの底に付着していない場合は注意してください。これは、過剰消化や過酷な取り扱いによる細胞汚染や細胞死が原因である可能性があります。 - 2日目に、フラスコを3mLの温かい1x PBSで2回洗浄し、各T25フラスコに3〜5mLの新鮮な培地(T75フラスコの場合は7〜10mL)を加えて培地を交換します。廃棄された培地には、細胞の破片や、ニューロン、オリゴデンドロサイト、ミクログリアなどのさまざまな種類の細胞が含まれています。
- 4日目に、フラスコの底に付着した星状細胞が100%のコンフルエントにあることを確認します。一方、ミクログリアの亜集団は混合細胞の表面層に緩く付着しており、ハンドシェイクによって表面から容易に剥離して培地に浮かぶことができます。培地を新鮮な6ウェルプレートに移し、このプロセス中に培地に濃縮された初代ミクログリアが収集されます。次に、元の6ウェルプレート上の細胞に新鮮な培地を提供し、さらなる細胞収集を行います。
注:培地を移す前に、テーブル上のフラスコを軽くたたくか、実験室のシェーカーでフラスコを180rpmで30分間振ることが、より多くの細胞を生成するのに適切です。 - 6ウェルをインキュベーターに慎重に置き、細胞が付着できるようにします。インキュベーション後約2時間で、すべての細胞がプレートに付着します。細胞が付着したら、温かい1x PBSで2回優しく洗浄し、細胞凝集体と細胞の破片を取り除きます。次に、3 mLの新鮮なミクログリア培地を細胞に供給します。単離されたミクログリア細胞は、2日ごとにミクログリア培地をリフレッシュすることにより、in vitroで1か月以上維持できます。
注:コロニー刺激因子1(CSF1)は、in vitroでのミクログリアの生存をサポートする重要な成長因子です。これまでの研究では、CSF1はマウスの骨髄細胞に由来する形質転換細胞株であるLADMAC細胞株から分泌されることが報告されています。LADMAC馴化培地は、LADMAC培養物を200 x g で10分間遠心分離することで回収できます。次に、上清を0.22μmのセルストレーナーに通します。ミクログリア培地は、20%LADMAC馴化培地(10%FBS、DMEM)を培地に添加して調製しました。 - 2〜3日ごとに、ステップ4.4のように混合細胞培養培地からミクログリアを採取し続けます。残りの混合細胞をフラスコで培養し、それらを最大1ヶ月間、2〜3日ごとに一貫してミクログリアを収穫するために使用します。
注:ミクログリアは、培地の混合培養細胞を最大50日間収集することにより、成功裏に収穫できます。毎回、収集された共培養培地は、T75フラスコあたり約1~3 x 10個の5 ミクログリア細胞を生成します。必要に応じて、ミクログリア細胞を組み合わせます。 - 初代ミクログリア細胞を目的の機能アッセイに使用します。
結果
図1では、細胞播種後7日目と35日目にCX3CR1+/GFPから採取した一次ミクログリアを示しています。ミクログリア/マクロファージ細胞マーカーIBA1の免疫蛍光染色で示されたように、IBA1陽性細胞は全てGFPシグナル陽性、S100β(アストロサイトマーカー)およびCC1(オリゴデンドロサイトマーカー)陰性であり、精製されたGFP陽性細胞は確かにミクログリアであることが示唆されます。次に、単離された細胞の95%以上がGFP陽性細胞であることが判明し、単離されたミクログリアは高純度であることを示しています10。さらに、初代ミクログリア細胞の機能をin vitroでさらに特徴付けるために、単離されたミクログリアを10 ng/mLおよび100 ng/mLのLPSで24時間処理しました(図2を参照)。対照と比較して、LPS曝露は、CD68の発現をアップレギュレートし、長く分岐したプロセスを持つアメーバ形態への変換を含む、活性化された表現型を誘導しました。この知見は、このプロトコルで単離された初代ミクログリア細胞が、少なくとも成功した炎症研究を可能にすることを示唆しました。
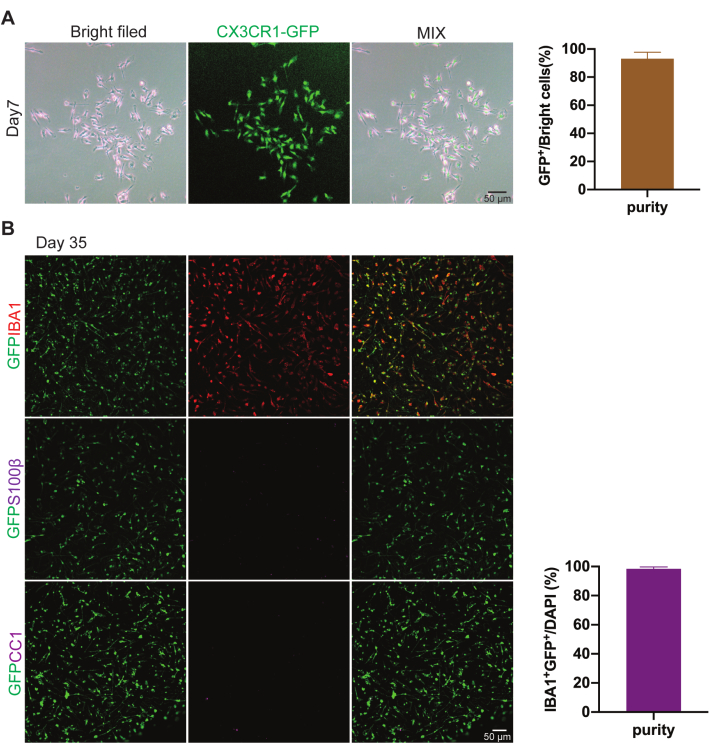
図1:p2マウスの仔から単離された細胞は高純度です。 代表的な画像は、混合細胞培養後の7日目(A)と35日目(B)に採取した初代ミクログリアの純度を示していました。細胞をIBA1(赤)、S100β(紫)、CC1(紫)で染色します。スケールバー 50 μm. この図の拡大版を表示するには、ここをクリックしてください。

図2:単離された一次ミクログリアはLPS曝露によく反応します。 代表的な共焦点画像は、LPS処理後の単離されたミクログリア細胞におけるCD68(灰色)およびIBA1(赤)の発現を示した。スケールバー 50 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、前に説明した方法に基づいており、いくつかの変更が加えられている11。単離されたミクログリアの生存率と純度を向上させるためのヒントを以下に示します。まず、組織単離や細胞培養に使用するバッファーを調製する際には、コンタミネーションを避けるように注意してください。手術器具、容器、プラスチック機器が無菌であることを確認してください。通常、脳の解剖は、交差汚染を避けるために、一般的な細胞培養用の細胞培養フードとは別に、別の組織培養フードで行います。第二に、組織の解剖と播種のステップは、経験豊富な研究者が10〜12匹の子犬に対して約1.5〜2時間かかる必要があります。大規模な調製は可能ですが、特に組織解剖の時間を確実に延長します。しかし、低酸素および虚血誘発性の細胞活性化を最小限に抑えるために、損傷シグナルへの細胞曝露を減らすために、細胞単離を適時に終了する方がよい。第三に、アストロサイト単層の破壊を避けるために、混合細胞培養を穏やかに取り扱う必要があります。さらに、分離プロセス中にフラスコを激しく振らないでください、過度のミクログリアの活性化を最小限に抑えます。
その後の収集ステップでは、以前のプロトコルでは、機械的解離がミクログリアの収量を増加させることが強調されています。例えば、玉城らは、アストロサイト層からのミクログリアの剥離を促進するために、培養フラスコを100rpmで1時間振ることを推奨した12。Lianらは、細胞を採取する際にフラスコを軽くたたくことが必要であることを示唆した11。ただし、ミクログリアの収量は機械的な力を導入することで増加させることができますが、追加の機械的操作もオリゴデンドロサイトとアストロサイトの解離を増加させ、細胞純度の低下につながることを考慮に入れる必要があります。また、振ったり、激しく叩いたりすると、培地に大量の気泡が発生することが多く、コンタミネーションのリスクが高くなります。また、気泡を除去し、細胞の汚染を最小限に抑えるためにも、さらに時間が必要になります。
このプロトコルでは、ビデオで示したように、ミクログリアの形態と機能を記録するための生細胞画像にまだ適していた40日目の混合培養細胞から健康なミクログリアを分離することができました。ただし、 異なる時点から分離されたミクログリアの特性は異なる場合があることに注意する必要があります。Caldeiraらは、一次ミクログリアがin vitroで16日間培養すると、無反応で老化した表現型を示すことを発見しました13。したがって、初代ミクログリアの細胞状態を評価して、in vitro培養システムによってもたらされるアーティファクトを最小限に抑えることが重要です。同じ時点で単離された初代ミクログリア細胞で逐次実験を行い、独立した単離に由来するミクログリアで三重実験を行うことを強く推奨します。
開示事項
すべての著者は、利益相反がないことを明らかにしました。すべての著者は、競合する金銭的利益を宣言していません。
謝辞
著者は、COVID-19の発生と戦う英雄たちに敬意を表したいと思います。著者は、優れた研究室運営を提供してくれたFang Lei氏(復旦大学)、ミクログリアの分離について議論してくれたZikai Zhou博士、Jing Li博士、Shanghai Mental Health CenterのGuiqing He博士に感謝します。最後になりましたが、著者は、この研究で犠牲になったすべての動物に感謝と敬意を示しています。本研究は、National Key R&D Program of China(Grant No. 2017YFC0111202)(B.P.)、National Natural Science Foundation of China(Grant No. 31922027)(B.P.)および(Grant No. 32000678)(Y.R.)、およびShenzhen Science and Technology Research Program(Grant No.JCYJ20180507182033219およびJCYJ20170818163320865)(BP.)および(グラント番号。JCYJ20170818161734072)(S.X.)。
資料
| Name | Company | Catalog Number | Comments |
| Cell strainers, 40 µm | ThermoFisher Scientific | 22-363-547 | |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco by Life Technologies | C11995500BT | |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Gibco by Life Technologies | 14190-144 | |
| Fetal Bovine Serum (FBS) | Gibco by Life Technologies | 10099141 | |
| Papain, Suspension | Sangon Biotech | Papain, Suspension | |
| Penicillin-Streptomycin 100X solution | Hyclone | SV30010 | |
| Poly-D-Lysine | ThermoFisher Scientific | A3890401 |
参考文献
- Prinz, M., Jung, S., Priller, J. Microglia biology: one century of evolving concepts. Cell. 179 (2), 292-311 (2019).
- Perry, V. H., Nicoll, J. A., Holmes, C. Microglia in neurodegenerative disease. Nature Reviews. Neurology. 6 (4), 193-201 (2010).
- Parker, K. R., et al. Single-cell analyses identify brain mural cells expressing CD19 as potential off-tumor targets for CAR-T immunotherapies. Cell. 183 (1), 126-142 (2020).
- Tay, T. L., Dautzenberg, J. S., Grun, D., Prinz, M. Unique microglia recovery population revealed by single-cell RNAseq following neurodegeneration. Acta Neuropathologica Communications. 6 (1), 87 (2018).
- Deczkowska, A., et al. Disease-associated microglia: a universal immune sensor of neurodegeneration. Cell. 173 (5), 1073-1081 (2018).
- Keren-Shaul, H., et al. A unique microglia type associated with restricting development of Alzheimer's disease. Cell. 169 (7), 1276-1290 (2017).
- Krishnaswami, S. R., et al. Using single nuclei for RNA-seq to capture the transcriptome of postmortem neurons. Nature Protocols. 11 (3), 499-524 (2016).
- Timmerman, R., Burm, S. M., Bajramovic, J. J. An overview of in vitro methods to study microglia. Frontiers in Cellular Neuroscience. 12, 242 (2018).
- Huang, Y., et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nature Neuroscience. 21 (4), 530-540 (2018).
- Garcia, J. A., Cardona, S. M., Cardona, A. E. Analyses of microglia effector function using CX3CR1-GFP knock-in mice. Methods in Molecular Biology. 1041, 307-317 (2013).
- Lian, H., Roy, E., Zheng, H. Protocol for primary microglial culture preparation. Bio-protocol. 6 (21), (2016).
- Tamashiro, T. T., Dalgard, C. L., Byrnes, K. R. Primary microglia isolation from mixed glial cell cultures of neonatal rat brain tissue. Journal of Visualized Experiments: JoVE. (66), e3814 (2012).
- Caldeira, C., et al. Microglia change from a reactive to an age-like phenotype with the time in culture. Frontiers in Cellular Neuroscience. 8, 152 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved