Method Article
嚢胞性線維症肺における 緑膿菌 および 黄色ブドウ球 菌バイオフィルムのEx生体モデルにおける抗生物質有効性試験
要約
このワークフローは、嚢胞性線維症の個人の肺に細菌バイオフィルムの確立されたex vivoモデルを使用して抗生物質感受性試験を行うために使用することができる。このモデルの使用は、MBEC(最小バイオフィルム根絶濃度)アッセイの臨床有効性を高めることができる。
要約
嚢胞性線維症(CF)を有する個人の肺内に存在する細菌バイオフィルムに対する抗生物質の効果的な処方は、標準的な診断方法(例えば、ブロス微小希釈、ディスク拡散、またはEtest)および抗生物質治療後の臨床結果との間の不十分な相関関係によって制限される。既製のバイオフィルム成長プラットフォームを使用してASTを改善する試みは、結果の改善をほとんど示さない。インビトロバイオフィルムシステムの限られた能力は、CF肺の生理化学的環境を模倣し、したがって細菌生理学およびバイオフィルムアーキテクチャは、CF感染のための新しい治療法の発見のブレーキとしても機能する。ここでは、ブタ気管支組織と合成CF痰(ex vivo pig肺、EVPL)で構成されるex vivo CF肺モデルにおいて、成熟したCF病原体のASTを実施するプロトコルを提示する。
バイオフィルム感受性試験には、標準的な実験室媒体またはマイクロチタープレートの合成CF痰の様々な製剤を使用して、いくつかのインビトロアッセイが存在します。成長培地とバイオフィルム基材(ポリスチレンプレート対気管支組織)の両方がバイオフィルム抗生物質耐性に影響を与える可能性があります。我々は、ex vivoモデルにおける臨床的 な緑膿菌 および 黄色ブドウ球菌 分離株の耐性の強化を示す。バイオフィルムの抗生物質治療の効果は、標準的なマイクロ希釈アッセイにおける最小阻害濃度(MIC)またはディスク拡散アッセイにおける感受性/耐性分類と相関していない。
ex vivoプラットフォームは、患者サンプルのオーダーメイドバイオフィルムASTや、医薬品の研究開発中に潜在的な抗バイオフィルム剤の強化されたテストプラットフォームとして使用できます。より多くの生体内のようなテストプラットフォームを使用して抗バイオフィルム創薬の処方または加速を改善することは、CFを持つ個人の健康結果を大幅に改善し、臨床治療および発見研究のコストを削減する可能性があります。
概要
慢性バイオフィルム感染は、正常な免疫防御が損なわれる個人に影響を与える。危険にさらされているグループには、嚢胞性線維症(CF)1の遺伝的状態を有するものが含まれる。乳児期初期に気道内で異常に厚く粘液が形成されたコロニー形成は、気管支2,3の難治性バイオフィルム感染を招く。広範なマトリックスカプセル化バイオフィルムとしての細菌の増殖は、免疫不全患者の慢性感染を健康な宿主の急性感染と区別する1つの要因であり、バイオフィルム状態は共に抗生物質暴露から細菌を保護し(マトリックスを通した拡散の減少による)、抗生物質の感受性を低下させる(例えば、静止の誘導または流出ポンプのアップレギュレーションを通じて)しかし、宿主組織生理学および化学における疾患特異的変化は、急性感染または標準的な実験室の成長条件で観察された細菌生理学をさらに変化させる。CFの主な例としては、肺界面活性剤から放出される脂肪酸やアミノ酸などの異常な炭素源の使用、およびムチンの微生物分解によって産生される、損傷した組織からの鉄などの微量栄養素の放出、および微小空気ビオシス6、7、8が含まれる。
したがって、特定のバイオフィルム感染コンテキストにおける特定の物理化学的条件は、抗生物質に対する応答に影響を与える可能性があります。まず、細胞外マトリックスの構造と深さは、栄養素やせん断力などの局所的な環境条件に依存します。第二に、環境の手がかりは、特定の抗生物質耐性遺伝子の発現を引き起こす可能性がある。例えば、CF病原体シュードモナス・エルギノーサは、β-ラクタマーゼの発現の増加と、CF痰対インビトロ9におけるポリンの発現の減少を示し、一方、別のCF病原体であるバークホルデリア・セノセパシアは、CF痰10で増殖した場合にβ-ラクタマーゼおよび流出ポンプをアップレジュレーションする。第三に、宿主内の状態は、インビトロで再現するのが難しい抗生物質耐性型への生理学的または遺伝的切り替えをキューに入れることができます。これらには、CF病原体黄色ブドウ球菌11,12の小コロニー変異体が含まれる。
これらのデータはすべて、診断ラボが個々のクローンを病原性バイオフィルムから分離し、標準的な実験室メディア(ブロスマイクロ希釈、ディスク拡散またはEtest)でプランクトンまたは寒天プレート栽培培養物にASTを実行する場合、結果は実際に生体内で働く抗生物質を予測しないことが多いことを示しています。インビトロバイオフィルムアッセイが使用されている場合でも、使用される媒体と付着面の違いのために生体様バイオフィルム表現型をキューに入れることができない可能性があるため、フローセルまたはハイスループットマイクロプレートプラットフォームを使用したアッセイは、抗生物質感受性13を過大評価することができる。フローセル、マイクロタイタープレート、疾病管理バイオフィルム反応器センターなどのインビトロプラットフォームを使用して薬物ポテンシャルをテストし、バイオフィルム有効性バーを低く設定し、研究、開発パイプラインで偽陽性を生み出す可能性があります。
CFにおける抗生物質治療後のAST結果と臨床結果との間の相関が低いことはよく知られている。多くの臨床医は、これらの結果を解釈するための統一されたCF固有のガイドラインがないため、診断ラボASTを無視するだけで、処方のためのケースバイケースの意思決定を行います。カルガリーバイオフィルム装置を使用してCF ASTを改善する試みがなされており、標準的なAST培地(例えば、カチオン調整されたミュラー・ヒントン・ブロス)14,15を含むマイクロプレートのウェル内にセットされたプラスチックペグの表面に成長したバイオフィルムを使用する。このアッセイは、標準的なプランクトニックAST16よりも、どの抗生物質が生体内で働くかを予測するのに適していません。CF患者への影響は明らかです。抗生物質投与を繰り返す(定期的な吸入抗生物質と英国のCFを持つ個人のための静脈内抗生物質を受け取る27日/年の中央値)にもかかわらず、急性肺増悪の頻繁かつ予測不可能なエピソードは進行性肺損傷をもたらし、症例の約90%では呼吸不全による死亡を引き起こす。最近の分析では、細菌性肺感染症はCFの投薬コストの最も強力な予測者であり、平均€3.6K/患者/年を追加して医療費18,19を指示した。
それ以外の健康な個人の急性感染に関しては、例えば、ポイント・オブ・ケアゲノム予測に基づく急速なASTに焦点を当てた現在の研究および政策は理想的である20である。しかし、慢性CF感染の場合、インビボ環境と病原体代謝状態をよりよく再現し、現実的なバイオフィルム構造の形成を可能にするホスト模倣モデルにおけるASTの実装という、異なるアプローチが必要であることは明らかです。
我々は以前に、合成CF痰でインキュベートされ、P.緑内科またはS.アウレウスに感染したブタ気管支のセクションで構成されるCFバイオフィルムモデルを開発した。未感染のEVPLは、7日間正常な組織病理学を保持するが、P.緑内膜およびS.アウレウスのラボまたは臨床分離株は、組織の周りの生体様凝集体で再現的に形成され、CF感染21、22、23の病因を模倣する。この高妥当性、ハイスループットモデルをCF用の合わせたバイオフィルムASTプラットフォームとして使用するためのプロトコルを提示し、モデルで成長させたときに臨床用抗生物質に対する病原体バイオフィルムの高い耐性を示す例示的な結果を提示する。このモデルは、バイオフィルム形成の管理または予防のための研究、開発パイプラインに容易に組み込むことができ、診断ASTに組み込まれる可能性があります。使用されるほとんどの機器(材料表を参照)は、ビーズビーターが不可欠であるが、典型的な微生物学の実験室で容易に見つけることができますが、我々は適切な紫外線殺菌キャビネットも調達する必要があるかもしれないことを共同研究者との研究から発見しました。肺は商業肉屋やアバトワールから供給されるため、このモデルは倫理的な懸念を示さない。
プロトコル
このプロトコルは、人間の消費のために肉を供給する商業的なアバトワールから供給される豚の肺を使用しています。英国の法律では、肉のために虐殺された動物からの残った組織を使用することは倫理的な承認を必要としません。作業を開始する前に、関連する現地の法律や制度上のガイドラインを確認するよう読者にアドバイスします。
1. 合成CF痰培地(SCFM)の作成
- SCFMをEVPL組織で使用するために、Palmerら24 によって概説されたレシピに従って、グルコースがレシピから除去されるという修飾を行う。
注:Palmerらのレシピには、CF患者からの痰サンプルの選択に見られる平均濃度を表す濃度で遊離アミノ酸、カチオン、陰イオンおよび乳酸塩が含まれています。P. 緑化症 PA14によるクォーラムセンシングシグナルの発現と、凍結乾燥した患者痰24から作られた培地での増殖に対する同等の炭素使用経路およびクォーラムセンシングシグナルの発現をキューに出すことを示した。1 L 変更 SCFM のレシピは 、表 S1に提供されています。 - フィルターは、準備後すぐにSCFMを殺菌し、4°Cで最大1ヶ月間保管してください。
2. 外生豚肺(EVPL)組織の解剖と感染
- 解剖する前に 、P.緑素吸草/S.アウレウス (例えば、リソゲニーブロス+1.2%寒天)の実験室で標準的な寒天を使用して、感染に必要な細菌株/sの寒天プレートを準備する。
- 未感染の対照組織片を含む、実験に必要なブタ気管支組織の部分の数を計算します。この数に2を掛けて、2つの複製肺で実験を繰り返し、結果の再現性を確認します。
- 400 μL/組織片に十分な培地を作るのに必要なSCFMアガロース(mL)の量を決定するために必要な組織片の総数を0.5倍にし、準備中のピペットエラーや蒸発を考慮するのに予備のSCFM寒天を作ります。
- 0.8%の重量/体積アガロースでSCFMの所望の総容積を作るために必要なSCFMの15 mLごとに0.12 gのアガロースを加える。
- アガロースが完全に溶解するまでSCFMアガロース溶液を加熱します。低電力の国内電子レンジをお勧めします。所要時間は、マイクロ波のワット数によって異なります。アガロースを約50°C(触れるまで暖かいが、持ち心地が良い)まで冷却します。これ以上冷却しないでください。
- ピペットを使用して、必要な組織片ごとに24ウェルプレートの1ウェルにSCFMアガロースの400 μLを加えます。
- SCFMアガロース含有24ウェルプレート/sを紫外線で10分間殺菌します。
- 無菌ダルベッコの改変イーグル培地(DMEM)の20 mLに加えて、無菌ロズウェルパーク記念研究所(RPMI)1640の20 mLに50 μg/mLアンピシリンを加えて、解剖されるすべての無傷の肺に対して3回の反復すすを用意します。
- 解剖されるすべての無傷の肺のための最終洗浄として40 mL SCFMのアリコートを作る。すべてのスワッシュは、4°Cで一晩保存するか、すぐに使用することができます。
- 殺処分後できるだけ早く指定された供給源から肺を入手し、国内のクールボックス内の実験室に輸送することによって冷たく保たれていることを確認する。
注:殺処分日に近い肺は、貯蔵からの打撲傷が少ないことを示していますが、殺処分から最大4日間冷蔵保存に保管された組織も使用することができます。クールボックスは肉屋やアバトワールに持ち込む必要がありますので、使用後に地元のラボガイドラインに従って除染し、使用していないときに微生物学の研究室の外に保管して、汚染のリスクと封じ込めの違反を減らす必要があります。 - 殺菌された表面で働き、炎の下で、オートクレーブアルミニウムホイルで覆われたきれいなプラスチック製のまな板の上に肺を置きます。気管支がそのまま残っていることを確認してください。アバトワールや輸送中に何らかの損傷があった場合、肺は使用に適していません。
- パレットナイフを炎の下に熱し、気管支を取り巻く肺の領域にナイフを非常に短時間触って組織の表面を殺菌します。
- 滅菌取り付けられたカミソリの刃を使用して、気管支を取り巻く表面組織を切り取ります。切開を気管支に平行にして、損傷を防ぎます。
- 気管支が露出したら、気管支を解放するために見える最高点で気管支を通して断面切開を行います。
- 滅菌鉗子を使用して、気管支の自由端を軽く保持し、滅菌取り付けられたカミソリの刃を使用して残りの不要な組織を切り取ります。肺から気管支を取り除くために分岐が見える前に、気管支を横切って最終的な断面切開を行います.
- 最初のDMEM/RPMI 1640洗浄に気管支を入れる。洗浄に気管支を残し、計画実験のための十分な組織切片を得るために必要と同じ肺から気管支の追加のセクションを収穫するためにステップ2.11-2.14を繰り返します。
- 同じ肺から任意の追加気管支切片を洗浄に入れる(ステップ2.16)。洗濯に2分以上放置します。
- 最初のDMEM/RPMI 1640洗浄から気管支を取り除き、滅菌ペトリ皿にサンプルを入れます。
- 滅菌鉗子を使用して各気管支を軽く保持し、組織に損傷を与えないようにします。できるだけ多くの残りの軟部組織を取り除き、滅菌解剖はさみを使用して、組織を〜5mm幅のストリップに切断します。
- 気管支組織ストリップをすべて第2 DMEM/RPMI 1640洗浄に入れる。洗濯に2分以上放置します。
- 滅菌鉗子を使用して2回目の洗浄から組織ストリップを取り除き、組織に損傷を与えないように注意してください。清潔で無菌のペトリ皿に組織を入れます。
- 気管支に付着した残りの軟部組織を取り除き、滅菌解剖用はさみを使用してストリップを正方形(約5mm x 5mm)に切ります。
- 3番目のDMEM / RPMI 1640ウォッシュをペトリ皿に加えます。皿を渦巻いて、洗浄中のティッシュピースを軽く混ぜます。
- ペトリ皿から3回目の洗浄を行い、ティッシュピースを取り除かずに注ぎます。
- 最後のSCFM洗浄を組織含有ペトリ皿に加え、すべての組織片が覆われていることを確認します。
- 5分間UV光下でSCFMの組織片を殺菌する。
- 滅菌された鉗子を使用して、各滅菌された気管支組織片を、SCFMアガロースパッドを含む24ウェルプレート/sの個々の井戸に移します。
- 所望の細菌株で各組織片に感染するには、無菌0.5mLインスリン注射器に付着した29G針の先端を持つ寒天プレート上で成長したコロニーに触れる。その後、組織片にコロニーを触り、組織表面を軽く刺します。
注:29 G針を装備したインスリン注射器を使用すると、針と肺の両方の組織から指を安全に保ちながら、針を正確かつ快適に保持することができます。注射器に取り付けられていない29G針を使用してこのステップを実行することは可能ですが、これはより大きな器用さを必要とし、針刺し損傷のリスクを高めます。インスリン注射器は容易に入手できる。 - 感染していないコントロールの場合、滅菌0.5 mLインスリン注射器に取り付けられた29G針の先端で各組織片の表面をそっと刺す。
- ピペットを使用して、各ウェルに500 μLのSCFMを追加します。
- 紫外線の下で24ウェルプレートごとに通気性シール膜を10分間殺菌する(材料表)。
- 24ウェルプレート/sから蓋を取り外し、通気性のある膜に交換します。
- 37 °Cでプレートをインキュベートし、必要なインキュベーション(感染)時間を振らずに行います。感染していないコントロールピース(汚染制御)に接種病原体の目に見える成長がないことを確認してください。
注:必要に応じて、手順2.5でSCFMアガロースパッドにアンピシリンを添加し、ステップ2.30でSCFMを最終濃度20μg/mLに覆います。これは、P.緑内症またはS.アウレウスの成長に影響を与えることなく、肺上のほとんどの内因性細菌の増殖を抑制しますが、アンピシリンの存在は他の抗生物質に対する感受性に影響を与える可能性があるため、リーダーは、彼らがテストしたい株や抗生物質に応じてこの選択を行うために残されています。
3. 抗生物質の効能の決定
注: このアッセイの手順を詳しく説明する回路図を 図 S1に示します。
- EVPL上に形成されたバイオフィルムの抗生物質耐性を測定するには、少なくとも2つの独立した肺からの肺片のセットを複製し、解剖および感染の間にセットアップしなければならない。1組の部分は陰性対照(抗生物質治療なし)に必要であり、抗生物質の濃度ごとに1セットがテストされる必要があります。
- 48時間のインキュベーションの後、感染していない組織片を目視で検査する。豚肺に内在性細菌の増殖が起こった可能性があり、これらのセクションの周りのSCFMは濁っている。選択した研究種の典型的な成長が観察される場合(例えば、 緑内膜の青緑色色素沈着診断)、新鮮な肺で実験を再開する。
- 感染していない組織切片が細菌の増殖を示さないか、または最小限の細菌増殖しか示さない場合は、24ウェル洗浄プレートと1つの24ウェル治療プレートを準備し、それぞれに抗生物質なしで、または肺組織片あたり1つの適切な抗生物質で500μLの新鮮なSCFMを含む。
- 各感染した組織片を炎殺菌鉗子でインキュベーションプレートから取り出し、洗浄板の新鮮な井戸で短時間旋回し、非バイオフィルム関連細菌細胞を除去し、治療プレートの適切なウェルに移します。
- 新鮮な通気性の膜で処理プレートを密封します。
- 処理プレートを37°Cで18~24時間振盪せずにインキュベートします。
- 炎殺菌鉗子を使用して、24ウェルプレートから各肺片を取り出し、1 mLのリン酸緩衝生理食塩基(PBS)および1gの金属ビーズを含む滅菌2 mL均質化チューブに入れる(材料表)。
- ビーズは4 m /sで40秒間ビートを打った。
注:材料表で示唆されている特定のビーズとホモジナイザーでビードビートは、細菌の有意なリシスを引き起こさないが、プロトコルを使用して各ラボは、ASTアッセイを始める前に、彼らの選択したビーズとホモジナイザーの効果をチェックする必要があります。 - PBSとプレートを使用して肺ホモゲンをリソジェニーブロス(LB)寒天で連続して希釈し、標準的なめっき法に従って個々の未処理および抗生物質処理組織片におけるコロニー形成単位(CFU)を決定する。
注:オプション:コロニーのアイデンティティを確認するために、選択メディア上の重複プレートを準備します。例えば 、S.アウレウス用マンニトール塩寒天を使用する。
結果
EVPLモデルは高スループットアッセイプラットフォームを提供し、一度に抗生物質感受性のために多数の細菌分離株をスクリーニングすることを可能にする(図1および2)、または1回の実験で抗生物質濃度の範囲に対する株をスクリーニングすることを可能にする(図3)。練習では、約200の気管支組織切片が2時間で肺から準備できることを発見しました。ASTの実験全体は、通常の労働時間内に完了することができます。シュードモナス・エルギノーサおよび黄色ブドウ球菌の成長は、モデル内の48時間のバイオフィルムの確立を分離し、信頼性が高く、生存細胞数によって監視されると、一貫した細菌負荷を生成する(図1および2)。EVPLで成長した緑膿菌および黄色ブドウ球菌の組織関連バイオフィルムの画像は、光顕微鏡検査および組織染色の準備のためのプロトコルと共に、我々の出版物21,23に見られるかもしれない。しかし、CFU数の再現性は細菌種によって異なります。これは、ANOVA25の後の標準の繰り返し性計算を使用して定量化することができます。我々は、P.アフルギノーザよりもS.アウレウスの複製肺サンプル中のCFU間に典型的に大きな変動があることを発見した。実験実験でモデルを採用する際には、実験技術を最適化し、最終実験で使用するサンプルサイズを決定するために、試験実験で繰り返し計算を行うことを推奨します(この例は、Sweeneyら26のデータ補足に記載されています)。
EVPLで成長すると、P.緑素吸皮症およびS.アウレウスのバイオフィルムは、標準の感受性と比較して抗生物質に対する耐性の増加を示し、業界公認のブロスMIC(図1)および標準的な培地を用いたディスクアッセイ(図2)。EVPL確立バイオフィルムに対する異なる抗生物質の様々な効果は区別可能であり、例えばP.緑素吸死は4-16X MICシプロフロキサシンでEVPLで達成されるが、4-8X MICクロラムフェニコールでは達成されない(図1)。600mgのリネゾリドの2回の1日用量は、感受性の病原体(4μg/mL)27に対してMIC90より上の血清濃度を達成し、副作用28を伴わない十分な暴露とみなされる。図2に示すデータは、ディスクアッセイでリネゾリドの影響を受けやすいS.アウレウス集団が、EVPLにおいて標的血清濃度以上(12μg/mL)を生存できることを示しています。P.緑素吸除のためのEVPL成長バイオフィルムに対するMICと抗生物質の効果との間には明確な相関関係はない(図1)。抗生物質の最適でない投与は慢性感染症における耐性の選択のリスクを高める可能性があるため、生体内抗生物質耐性のより正確な尺度を得ることは重要である。
バイオフィルムの成長モードは、抗生物質に対する細菌感受性を有意に低下させることができることはよく知られている。これは、多くのインビトロバイオフィルムアッセイの開発と慢性感染症における感受性のより正確な予測因子としてMICの代わりに最小バイオフィルム根絶濃度(MBEC)14、15の使用につながっています。SCFM (様々な製剤での) の使用は、MIC または MBEC テスト29での使用にも推奨されています。ここでは、最適化されたインビトロアッセイでさえ、EVPLにおけるコリスチンに対するP.緑分化症感受性を正確に予測できないことを示す。EVPL増殖菌の3ログ10の殺死を達成するために必要な抗生物質の量は、SCFMがこれらのアッセイに使用される場合でも、標準的なインビトロアッセイから計算されたMICまたはMBECよりも有意に高いことが多い(図3)。これは、インビトロバイオフィルム感受性試験の現在の実施は、標準的な感受性検査16と比較してCF処方における抗生物質処方のための増加した予測力を提供しないことを報告したコクランレビューと一致している。
また、このモデルを使用して、抗生物質が時間の経過とともにバイオフィルム細菌に及ぼす影響を評価することも簡単であり、肺の十分なレプリカ部分を接種して破壊的なサンプリングを可能にすることができる。抗菌剤間の違いを区別することに加えて、モデルは、異なる細菌増殖段階またはバイオフィルムの年齢および異なる抗生物質投与間隔における感受性の変化を強調することができる。 図4 は、それらが成熟するにつれて 、P.緑素吸い 生物膜のメルペネムに対する耐性の増大を示す。これは、新規薬剤の有効性、例えば急速な細胞分裂中により効果的であるかどうかの判断に有用であり得る。また、結果に影響を与える年齢を避けるためにバイオフィルムの年齢を標準化し、検証する必要があるため、実験の制約を設定する際に重要な考慮事項になる場合があります。
図5では、S.アウレウス生存率をフルクロキサシリンへの曝露後4時間および24時間で測定し、時間および分離株間の細菌細胞数の減少の違いを観察することが可能であった。これは、薬物の開発に有用であり得る, 薬力学のパラメーターを定義するときや、新規薬剤の作用様式を解明するときなど.
細菌負荷の変動は、培養時間の延長に伴って増加することが多い。これは、48時間のバイオフィルム開発後の 図5 の未処理制御および抗生物質投与間隔を考慮してさらに24時間曝露して見ることができる。バリエーションはモデルに固有です。各肺サンプルは他のものとは独立しており、肺の自然な変化を反映しています。したがって、検証と結果の正確な解釈を可能にするために、十分な数のレプリケートが含まれていることを確認することが重要です。堅牢なサンプルサイズの選択を可能にするために、データに対して繰り返し計算を行う推奨に読者を参照します。
簡単にするために、我々は各実験で肺の単一のペアから取得した複製組織切片から採取された代表的なデータを提示したが、実際には複製動物から採取した組織切片に対して繰り返し実験を行う必要がある。これは、個々のブタ間の生物学的変動を考慮するために行われるべきであり、我々は、複製豚から採取された組織間の結果がどのように一貫してなることができるか、および分散分析(ANOVA)/一般線形モデル(GLM)21,26を用いたデータの統計分析においてこの変動がどのように考慮されるかについて、公開された研究に読者を参照する。
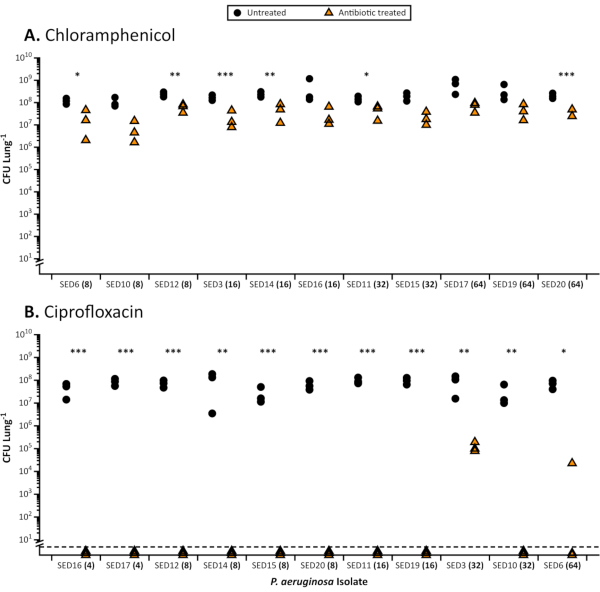
図 1.抗生物質による治療後にEVPLモデルから回収された11CFシュードモナス緑膿症臨床分離株の総CFU。EVPLモデルにおけるP.緑素吸蔵の抗生物質治療の代表的な結果各株はEVPL組織上で48時間増殖し、その後、抗生物質(三角形)またはPBSに18時間の対照(円)として移され、CFU/肺が決定した。標準的なカチオン調整MHBで決定された適切な抗生物質のMICは、各株(x軸)の隣に括弧で示されています。株は MIC 値を増やすことによって順序付けられます。適切な場合は t 検定を使用してデータを分析し、非パラメトリック データセットの Mann-Whitney U テストを使用しました。抗生物質治療と未治療組織の有意差は、アスタリスク(P<0.05)で示される。A.EVPLモデルで成長し、64 μg/mLクロラムフェニコール(記録された最高のMIC値)で処理されたP.緑素吸い物症バイオフィルムから回収可能な数。各単離について、クロラムフェニコール処理および未治療組織切片の間のCFUの標準化平均差を、Cohenのdを用いて計算した。標準試験におけるMIC値と、コーエンのd(スピアマンの順位相関、rs = 0.45、p = 0.16)Bで測定されたEVPLモデルにおける生存可能な細胞数の減少との間に相関はなかった。EVPLモデルで成長し、64 μg/mLシプロフロキサシン(記録された最高のMIC値)で処理されたP.エルギノーザバイオフィルムの結果。破線より下の値は検出限界を下回っていました。この図の大きなバージョンを表示するには、ここをクリックしてください。
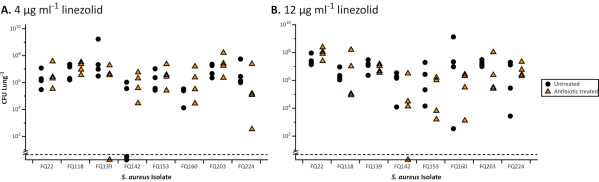
図 2.8黄色ブドウ球菌CFの全CFUは、リネゾリドによる治療後にEVPLモデルから回収されたCF臨床分離株。各株はEVPL組織上で48時間増殖し、その後24時間ラインゾリド(三角形)に移されるか、または対照(円)として未処理であった。全ての株は、EUCASTガイドライン30(阻害のゾーン21mm)に従って標準的なディスク拡散アッセイを用いてリネゾリドに感受性>見つかった。適切な場合は t 検定を使用してデータを分析し、非パラメトリック データセットの Mann-Whitney U 検定(P < 0.05) を使用して分析しました。いずれの株にも、治療された抗生物質と未治療の間に有意な差は見つからなかった。破線より下の値は検出限界を下回っていました。A.4 μg/mL ラインゾリド(EUCAST分類31に従って感受性/耐性のための臨床的ブレークポイント)で治療されたEVPLモデルにおけるS.アウレウスバイオフィルムの結果。B.12 μg/mL リネゾリドで処理したEVPLモデルにおけるS.アウレウスバイオフィルムの結果(スウィーニーら23から再現されたデータ)。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 3.コリスチンの濃度を増加させる治療後にEVPLモデルから回収された実験室株PA14および4 CF臨床分離株の実行可能 な緑 膿菌細胞数。 各株をEVPL組織上で48時間増殖させ、その後18時間コリスチンにさらした。標準のカチオン調整 MHB メディアで決定された MIC は、各ひずみ名の横に括弧で示されています。垂直線は、MHB(ソリッド)とSCFM(破線)で決定されたMBEC値を示しますが、SED6を除いて、両方のメディアで値が同じでした。未充填データポイントは、未治療サンプル(0 μg/mLコリスチン)と比較してCFU/肺の≥3ログ10 減少をもたらした試験したコリスチンの最も低い濃度を表す(Sweeneyら26から複製されたデータ)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
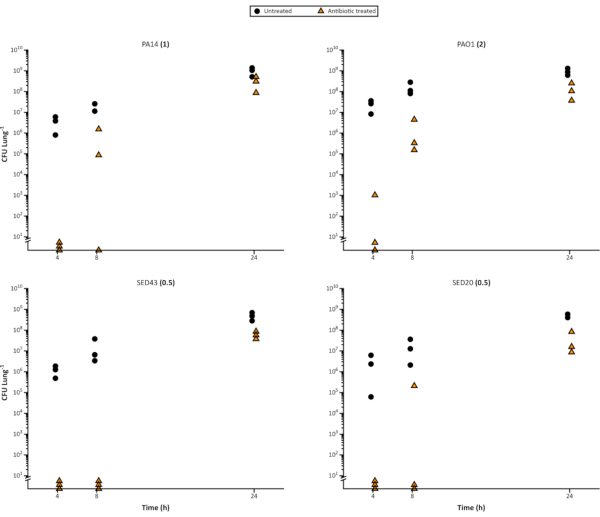
図 4.代表的な実行可能な 緑膿 菌細胞は、24時間にわたるEVPLモデルの成長の時間経過から数え、その後64μg/mLメロペネムでの治療を行います。 実験室株 P.緑素吸診 PA14および3 CF臨床分離株は、X軸に示された時間のためにEVPL組織上で成長させ、その後、24時間メロペネム(三角形)に移されるか、またはコントロール(円)として未処理のままにした。その後、CFU/肺が決定された。カチオン調整 MHB メディアで決定された MIC は、各ひずみ名の横に括弧で囲んで示されています。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 5.代表的な生き生きした 黄色ブドウ球菌 細胞は、EVPLモデルの成長後、24時間の時間経過で5μg/mLフルクロクサシリンで処理された。 コントロール株ATCC29213および2つのCF臨床分離株は、48時間EVPL組織上で増殖し、その後フルクロキサシリン(三角形)に移管されたか、またはCFU/肺が決定される前に、コントロール(円)として無処置(円)に残された(Sweeney et al23からデータを複製した)。この図の大きなバージョンを表示するには、ここをクリックしてください。
図 S1. こちらをダウンロードしてください。
表 S1. こちらの表をダウンロードしてください。
ディスカッション
ex vivo肺モデルは高いスループットと安価であり、食肉産業からの消費者後の廃棄物を使用するため、倫理的な懸念はありません。これは、現在利用可能な体外ASTプラットフォームよりも優れた慢性的に感染したヒトCF気道を模倣するように設計されています。ここで示された結果は、このような状況下での抗生物質感受性をより正確に予測する可能性があることを示している。
プロトコルの重要な手順は、信頼性が高く、再現性のある結果を保証します。
- 肺サンプルの屠殺、採取、処理の間に一貫した時間と貯蔵方法を使用します。殺処分後できるだけ早く肺を使用し、汚染の可能性を最小限に抑えることも重要です。可能な限り新鮮でない場合、実験培養物が肺で成長する能力の違いが観察されている。
- SCFMの産生における無菌性の維持および肺部分の解剖は必須である。健康な肺は無菌ではないので、コメンサルバクテリアの存在は慢性感染のための「自然な」環境を反映している可能性があります。それにもかかわらず、前述のように、多種集団内の細菌相互作用は、結果および抗生物質に対する感受性を変える可能性があるため、汚染は避けるべきであり、肺は使用前に滅菌されるべきである。我々は、スズ組織の完全性の変化を引き起こさないように見え、必要に応じて追加の抗生物質の使用を提唱する。しかし、抗生物質は選択的圧力を導入して結果に影響を与え、試験細菌集団の遺伝子発現を変化させる可能性があるため、注意して使用する必要があります。
- 非選択的で豊富な培地上で増殖した模擬感染、陰性対照組織サンプルおよび細胞カウントプレートを使用して、滅菌中に除去されていない汚染物質または同位細菌の増殖を強調する。これは、ASTにこれらの細菌の影響を軽減するために不可欠です.また、重複プレートがコロニー同定と細胞列挙をスピードアップするので、目的の生物に固有の重複した選択的寒天、細胞数プレートを生成することも有用である。
- 最初にモデルを使用する場合、および新しい株または細菌の遺伝子型で使用して組織切片間のバイオフィルムCFU変動を評価する場合にパイロット実験を行い、電力計算を使用して最適な実験サンプルサイズ(例えば、複製肺の数から取得する反復組織切片の数)を選択できるようにします。
- このアッセイは非標準化接種を使用し、48時間のインキュベーション後の急速な接種と比較的一貫したバイオフィルム負荷の形成(特に P.緑素吸砂の場合)を可能にする。初期のバイオフィルム増殖段階で抗菌効果をアッセイするために、ASMに懸濁したコロニー成長細菌の標準化されたCFUを接種することを検討する。我々は、プランクトニック細菌を接種することはお勧めしません:初期のパイロット実験は、これが信頼性の高いバイオフィルム形成ではなく、急性、侵襲的な成長につながることを示しました。
このプロトコルは 、P.aeruginosaで使用するための堅牢なプロトタイプモデルを生成し 、S.アウレウスで使用するための開発のための大きな可能性を持っていますが、将来的に特定のアプリケーションに対処する必要があるいくつかの制限があります。組織は、クローン集団の開発を可能にするために、単一のコロニーから接種された。結果は 、P.緑分化症の場合、これは48時間の細胞数にほとんど影響を与えかからずであることを示している。しかし 、S.アウレウス に対して細菌負荷の変動性が大きく認められ、異なる細菌がモデル内で異なる成長を生じる可能性があることを考えると、標準化された開始接種および同一の大きさと重量の組織サンプルの厳格な生産は、研究の生物に依存する可能性がある。また、正確な解剖/感染技術や地元の豚の品種/陸上の違いのために、ラボ間の違いがあるかもしれません。モデルの個々の実装に対する細菌集団の再現性を評価するために、結果25 の統計解析の一部として反復性計算を使用し、パイロット実験に基づく反復性/電力計算を使用して、最終実験で使用する最適なサンプルサイズを計算することを提案する。
従来のプレートアッセイに比べてEVPLの主な利点の1つは、プランクトン的または非生物的表面上で増殖する細菌を試験するのではなく、宿主環境内および細胞分化で細菌バイオフィルムの空間構造を可能にすることです。これは、抗菌剤の活性に及ぼす生理化学的および栄養勾配の影響、ならびに慢性感染および細菌間の細胞間相互作用における異なる微小環境における活性療法の送達および利用可能性を考慮する上で重要な意味を持つ。この後者の点は、CFで多種感染が日常的に観察され、喘息や慢性閉塞性肺疾患などの他の呼吸器疾患に関連する感染症にとってますます重要になっているため、特に重要である。臨床診断における個別の患者痰のサンプリングのためのASTのためのこのモデルを開発する可能性がある。慢性創傷による創傷模倣インビトロモデルと、慢性創傷からの破片バイオフィルムのAST(テキサス州ラボックのサウスウエスト地域創傷ケアセンター、R.ウォルコット博士)を使用して、同様の試験がすでに進行中です。
さらに、モデルは死後の組織を使用するので、宿主の免疫応答が抗生物質感受性に及ぼす影響は限られている。現在のin vitroモデルは、ホストの免疫応答も考慮していないので、ASTアプリケーションにおけるモデルの将来の使用の障壁としては考えていない。しかし、薬物動態および薬力学パラメータおよび抗生物質投与ガイドラインが決定される場合には、免疫応答が考慮される。我々の研究は、組織23 内の残留免疫細胞および応答の証拠を示しているが(およびS.アジミ、個人的なコミュニケーション)、これはインビボ条件に対するより大きな一致が望まれるならば、モデルのさらなる最適化および開発のための主要な領域である。
CFに対してより臨床的に有効なASTを提供することは、「慎重な処方と抗菌スチュワードシップを確保するための手順が整われるべきである」という英国の健康、ソーシャルケア法2008の重要な勧告を満たすのに役立ちます。EVPLは、このニーズを満たすのに理想的な候補モデルであると考えています。
開示事項
著者らは開示するものは何もない。
謝辞
私たちは、模範的な結果を得た元の論文に関する私たちの共同執筆者のすべてに感謝します。この作品は、FHに授与されたMRC新調査官研究助成金(助成金番号 MR/R001898/1)によって資金提供されました。BBSRCミッドランズ統合バイオサイエンストレーニングパートナーシップ(MIBTP)の博士課程の学生がNEHとIAに授与した。そして、夏休みの研究プロジェクトを実施するためにFAにワーウィック大学学部研究支援スキームの賞によって.私たちは、スティーブ・クイグリー、サンズ(カビントン、ウォリックシャー)とジョン・テイラー、息子(アールズデン、コベントリー)が肺を供給してくれたことに感謝します。また、ウォリック大学生命科学部のメディア準備施設の助けを借りて、セリス・ハリーズとキャロライン・スチュワートに特別な感謝を、ワーウィック抗菌スクリーニング施設のアニタ・キャサウッドの助けを借りて認めたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 0.5 mL insulin syringes with 29G needle attached | |||
| 24-well culture plates | |||
| 70% ethanol or similar for surface sterilizaton and flamin gof dissection equipment | |||
| Agar plates to prepare streaks of P. aeruginosa/S. aureus (any suitable medium) | |||
| Agarose | |||
| Aluminum foil - pre-sterilised by autoclaving - to cover the chopping board on whcih you wil dissect lungs. | |||
| Bead beater designed to take 2 mL tubes | MP Biomedicals | 116004500 | FastPrep-24 Classic bead beating grinder and lysis system |
| Breathe-easy or Breathe-easier sealing membrane for multiwell plates | Diversified Biotech | BEM-1 or BERM-2000 | |
| Bunsen burner | |||
| Chopping board - we recommend a plastic board to allow for easy decontamination with alcohol. | |||
| Coolbox to transport lungs to lab | |||
| Dissection scissors in different sizes | |||
| Dulbecco’s modified Eagle medium (DMEM) | |||
| Fisherbrand 2 mL reinforced tubes | Thermo Fisher | 15545809 | |
| Fisherbrand 2.38 mm metal beads | Thermo Fisher | 15505809 | |
| Germicidal UV cabinet | |||
| Insulin syringes - 0.5 mL with 29G needle attached. | VWR | BDAM324892 | |
| Large pallet knife | |||
| LB agar plates to assess CFU in lung biofilm homogenate | |||
| Mounted razor blades | |||
| Nalgene RapidFlow PES 75 mm x 0.1 µm x 500 ml sterile filter unit | Thermo Fisher | 10474415 | For filter-sterilizing SCFM |
| Petri dishes | |||
| Phosphate-buffered saline | |||
| Plastic chopping board and aluminium foil to create a sterile and cleanable dissection surface | |||
| Roswell Park Memorial Institute (RPMI) 1640 medium | |||
| SCFM ingredients as listed in Table S1 | |||
| Selection of forceps (blunt tips recommended) | |||
| Selective agar plates to specifically assess P. aeruginosa / S. aureus CFU in lung biofilm homogenate, if required. | |||
| Suitable containers for disposing of contaminated sharps and pig ung tissue, according to your institution's health & safety policies. |
参考文献
- Elborn, J. S. Cystic fibrosis. The Lancet. 388 (10059), 2519-2531 (2016).
- Høiby, N., et al. Diagnosis of biofilm infections in cystic fibrosis patients. APMIS. 125, 339-343 (2017).
- Bjarnsholt, T., et al. Pseudomonas aeruginosa biofilms in the respiratory tract of cystic fibrosis patients. Pediatric Pulmonology. 44 (6), 547-558 (2009).
- Høiby, N., Bjarnsholt, T., Givskov, M., Molin, S., Ciofu, O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents. 35 (4), 322-332 (2010).
- Penesyan, A., Gillings, M., Paulsen, I. Antibiotic discovery: Combatting bacterial resistance in cells and in biofilm communities. Molecules. 20 (4), 5286(2015).
- Son, M. S., Matthews, W. J., Kang, Y., Nguyen, D. T., Hoang, T. T. In vivo evidence of Pseudomonas aeruginosa nutrient Acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity. 75 (11), 5313-5324 (2007).
- Flynn, J. M., Niccum, D., Dunitz, J. M., Hunter, R. C. Evidence and role for bacterial mucin degradation in cystic fibrosis airway disease. PLoS Pathogens. 12 (8), 1005846(2016).
- Stites, S. W., Plautz, M. W., Bailey, K., O'Brien-Ladner, A. R., Wesselius, L. J. Increased concentrations of iron and isoferritins in the lower respiratory tract of patients with stable cystic fibrosis. American Journal of Respiratory and Critical Care Medicine. 160 (3), 796-801 (1999).
- Cornforth, D. M., et al. Pseudomonas aeruginosa transcriptome during human infection. Proceedings of the National Academy of Sciences. 115 (22), 5125-5134 (2018).
- Drevinek, P., et al. Gene expression changes linked to antimicrobial resistance, oxidative stress, iron depletion and retained motility are observed when Burkholderia cenocepacia grows in cystic fibrosis sputum. BMC Infectious Diseases. 8, 121(2008).
- Goerke, C., Wolz, C. Regulatory and genomic plasticity of Staphylococcus aureus during persistent colonization and infection. International Journal of Medical Microbiology. 294 (2-3), 195-202 (2004).
- Wolter, D. J., et al. Staphylococcus aureus small-colony variants are independently associated with worse lung disease in children with cystic fibrosis. Clin Infect Dis. 57 (3), 384-391 (2013).
- Roberts, A. E. L., Kragh, K. N., Bjarnsholt, T., Diggle, S. P. The limitations of in vitro experimentation in understanding biofilms and chronic infection. Journal of Molecular Biology. 427, 3646-3661 (2015).
- Ceri, H., et al. The Calgary biofilm device: New technology for rapid determination of antibiotic susceptibilities of bacterial biofilms. Journal of Clinical Microbiology. 37 (6), 1771-1776 (1999).
- Moskowitz, S. M., Foster, J. M., Emerson, J., Burns, J. L. Clinically feasible biofilm susceptibility assay for isolates of Pseudomonas aeruginosa from patients with cystic fibrosis. Journal of Clinical Microbiology. 42 (5), 1915-1922 (2004).
- Smith, S., Waters, V., Jahnke, N., Ratjen, F. Standard versus biofilm antimicrobial susceptibility testing to guide antibiotic therapy in cystic fibrosis. Cochrane Database of Systematic Reviews. (6), (2020).
- Trust, C. F. Annual Data Report 2019. , (2019).
- Angelis, A., et al. Social and economic costs and health-related quality of life in non-institutionalised patients with cystic fibrosis in the United Kingdom. BMC Health Services Research. 15 (1), 428(2015).
- Eidt-Koch, D., Wagner, T. O. F., Mittendorf, T., von der Schulenburg, J. M. G. Outpatient medication costs of patients with cystic fibrosis in Germany. Applied Health Economics and Health Policy. 8 (2), 111-118 (2010).
- Longitude Prize. , Available from: http://longitudeprize.org (2020).
- Harrington, N. E., Sweeney, E., Harrison, F. Building a better biofilm - Formation of in vivo-like biofilm structures by Pseudomonas aeruginosa in a porcine model of cystic fibrosis lung infection. Biofilm. 2, 100024(2020).
- Harrison, F., Diggle, S. An ex vivo lung model to study bronchioles infected with Pseudomonas aeruginosa biofilms. Microbiology. 162, 1755-1760 (2016).
- Sweeney, E., et al. An ex vivo cystic fibrosis model recapitulates key clinical aspects of chronic Staphylococcus aureus infection. Microbiology. , DOI: 10.1099/mic.0.000987 (2020).
- Palmer, K. L., Aye, L. M., Whiteley, M. Nutritional cues control Pseudomonas aeruginosa multicellular behavior in cystic fibrosis sputum. Journal of Bacteriology. 189 (22), 8079-8087 (2007).
- Nakagawa, S., Schielzeth, H. Repeatability for Gaussian and non-Gaussian data: A practical guide for biologists. Biological Reviews. 85 (4), 935-956 (2010).
- Sweeney, E., Sabnis, A., Edwards, A. M., Harrison, F. Effect of host-mimicking medium and biofilm growth on the ability of colistin to kill Pseudomonas aeruginosa. Microbiology. 166 (12), 1171-1180 (2020).
- Stalker, D. J., Jungbluth, G. L., Hopkins, N. K., Batts, D. H. Pharmacokinetics and tolerance of single- and multiple-dose oral or intravenous linezolid, an oxazolidinone antibiotic, in healthy volunteers. Journal of Antimicrobial Chemotherapy. 51 (5), 1239-1246 (2003).
- Ager, S., Gould, K. Clinical update on linezolid in the treatment of Gram-positive bacterial infections. Infection and Drug Resistance. 5, 87-102 (2012).
- Kirchner, S., et al. Use of Artificial Sputum Medium to Test Antibiotic Efficacy Against Pseudomonas aeruginosa in Conditions More Relevant to the Cystic Fibrosis Lung. Journal of Visualized Experiments: JoVE. (64), e3857(2012).
- The European Committee on Antimicrobial Susceptibility Testing. EUCAST Disk Diffusion Method for Antimicrobial Susceptibility Testing - Version 8.0. , Available from: www.eucast.org (2020).
- The European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 10.0. , Available from: http://www.eucast.org (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved