Method Article
小さいテレオストモデル日本メダカにおけるゴナデクトミーと血液サンプリング手順 (オリジアス ラティプ )
要約
この記事では、動物生理学における性ステロイドの役割を調べるため、小型テレオスト魚から血液を血液に血液をサンプル化するクイックプロトコルについて説明し、日本のメダカ(Oryzias latipes)をモデルとして使用する。
要約
性ステロイド, 生殖腺によって生成, 脳と下垂体組織の可塑性と脳と下垂体にフィードバックを提供することにより、すべての脊椎動物の生殖の神経内分泌制御に不可欠な役割を果たしています。.テレオストの魚は、哺乳類と比較して生殖戦略の組織可塑性と変動の高い程度を持っており、性ステロイドの役割とそれらが作用するメカニズムを調査するのに有用なモデルであるように見える。ステロイドのレベルを測定する血液サンプリングと一緒にゴナデクトミーを使用してセックスステロイド生産の主なソースの除去は、確立されており、大きな魚でかなり実現可能であり、性ステロイドの役割と効果を調査するための強力な技術です..しかし、これらの手法は、小型テレオストモデルで実装する場合の課題を引き起こします。ここでは、男性と女性の両方の日本式メダカにおけるゴナデクトミーのステップバイステップの手順と、血液サンプリングについて述べています。これらのプロトコルは、高い生存率、魚の寿命および表現型の安全性、およびセックスステロイドクリアランスの点で再現性によって示されるメダカにおいて非常に実現可能であることが示されている。これらの手順をこの小さなテレオストモデルを使用する他の利点と組み合わせることで、脊椎動物のセックスステロイドによって提供される生殖および組織可塑性の神経内分泌制御におけるフィードバック機構の理解が大幅に向上する。
概要
脊椎動物において、主に生殖腺によって産生される性ステロイドは、様々なフィードバック機構1、2、3、4、5を介して脳下垂体-性腺(BPG)軸の調節において重要な役割を果たす。さらに、性ステロイドは脳内のニューロンの増殖と活動に影響を与える6,7,8およびゴナドロープを含む内分泌細胞, 下垂体9,10,したがって、脳および下垂体の可塑性において重要な役割を果たす.哺乳類における比較的良い知識にもかかわらず、性ステロイドによって媒介されるBPG軸調節のメカニズムは、非哺乳類種において理解されるどころか、進化的保存原理11の理解が不十分に至る。脳と下垂体の可塑性に対する性ステロイドの役割を文書化する研究はまだ限られています, したがって、多様な脊椎動物種に対するセックスステロイドの役割と効果のさらなる調査の必要性を高めます.
脊椎動物の中でも、テレオストは、ストレス応答12、13、成長14、15、栄養生理学16、17および再生2を含む多数の生物学的および生理学的な質問に対処する上で強力なモデル動物となっている。テレオスト, セックスステロイドは、主にエストラジオール (E2) 女性と 11-ケトテストステロン (11-KT) 男性で18,19,長い間、種間の再生の一般的な原則を調査するための信頼性の高い実験モデルとなっています。テレオストは視床下部下垂体の接続20、21および別個のゴナドロープ細胞22に固有性を示し、調節機構の解明に便利な場合もある。さらに、実験室および現場実験の両方に対する彼らのアノニアビリティのために、テレオストは他の生物と比較して多くの利点を提供する。彼らは購入し、23、24を維持するために比較的安価です。特に、ゼブラフィッシュ(Danio rerio)や日本のメダカ(Oryzias latipes)などの小型テレオストモデルは、非常に高い胎児性と比較的短いライフサイクルを有する種であり、遺伝子機能と疾患機構の迅速な分析を可能にする23の、したがって、これらの多くのよく発達したプロトコルおよび生理学的な質問に対処する上でさらに大きな利点を提供する。
多くの研究において、血液採取技術とともに生殖腺(ゴナ16分法)の除去は、哺乳類26、27、28、鳥29および両生類における脊椎動物生殖生理学におけるその影響を含む多くの生理学的な問題を調査する方法として用いられてきた。生殖生理学に対するゴナ16次切開効果は、タモキシフェンやクロミフェンなどの性ステロイド拮抗薬によって代替的に模倣することができるが、薬物の効果は、バイモーダル効果31、32のために矛盾しているように見える。セックスステロイド拮抗薬への慢性暴露は、卵巣の拡大につながる可能性があります33,34, 不健康な表現型のために長期的な目的のためのその効果の観察を無効にする可能性があります..さらに,セックスステロイドアンタゴニスト治療後の回復実験を行うことは不可能であり,特定の性ステロイドの特定の効果を保証する。これらの前述の点と共に、セックスステロイド拮抗薬使用の他のトレードオフは広範囲にレビューされています31,32.したがって, ゴナ十二分法はまだセックスステロイドの役割を調査するための強力な技術として今日表示されます。.
ゴナ16次切毛と血液サンプリング技術は、より大きな種では比較的簡単に行うことができますが、 ヨーロッパのシーバス(ディセントラーチ・ラブラクス)35、ブルーヘッド・ラッセ(タラソマ・ビファシアタム)36、ドッグフィッシュ(シリオリヌス・カニクル)37)、ナマズ(ヘテロプノウステス化石とクラリアス・バトラカス)など、小さな魚にmedkaとして適用すると課題を提起します。例えば,魚類麻酔デリバリーシステム(FADS)40の使用は実現可能性が低く、小魚に対して過度の物理的損傷を受けやすいようです。さらに、大きな魚40に一般的に使用されるゴナデクトミーの手順は、過度の損傷を避けるために高精度を必要とする小さな魚には適していません。最後に、血液採取は、血管へのアクセスが限られており、それらの動物の血液量が少ないため、困難です。したがって、小さなテレオストにおけるゴナ16次除術と血液サンプリングのあらゆるステップを示す明確なプロトコルが重要である。
このプロトコルは、東アジア原産の小さな淡水魚である日本のメダカでの血液サンプリングに続いて、ゴナデクトミーのステップバイステップの手順を示しています。日本のメダカは、配列ゲノム、いくつかの分子および遺伝的ツールを利用できる25、および二次性徴または生殖腺が十分に発達する前に性的差異の調査を可能にする遺伝的性決定システムを有する。興味深いことに、日本のメダカは、他の多くのテレオスト種42に反して融合性腺を持っています。これらの2つの技術を組み合わせると合計で8分しかかからず、血管43の標識、下垂体セクション44 および脳神経細胞45のパッチクランプ、および一次細胞培養46を含むこの種のために既に存在するビデオプロトコルのリストを完成させる。これらの技術は調査し、よりよく、将来的に脳と下垂体の可塑性と同様、フィードバックメカニズムでセックスステロイドの役割を調査し、理解する研究コミュニティを可能にします。.
プロトコル
すべての実験と動物の取り扱いは、ノルウェー生命科学大学の実験動物福祉に関する勧告に従って行われました。ゴナデケーションを用いた実験は、ノルウェー食品安全局(FOTS ID 24305)によって承認されました。
※実験は、成人男性と女性(生後6~7ヶ月、体重ca.0.35g、長さ2.7cm)を用いて行いました。性別は、42,47に記載されているように背部と肛門ひれの大きさや形などの二次性徴を区別することによって決定した。
1. 機器およびソリューションの準備
- 麻酔ストック溶液(0.6%トリケーヌ)を準備します。
- 100 mL の 100 mL のトリケーヌ (MS-222) の 0.6 g を 10x リン酸緩衝塩水 (PBS) で希釈します。
- トリケーヌストック溶液1 mLを複数の1.5mLプラスチックチューブに分配し、使用するまで-20 °Cで保管します。
- 水槽水の2 LにNaClの18 gを加えることによって回収水(0.9%NaCl溶液)を準備します。使用するまで室温で溶液を保管してください。
- 鋭い点を得るために斜めにカミソリを破って切開ツールを準備します(図1A)。
- 25 μLのヘパリンを1x PBSの500 μLに希釈して、血液抗凝固液溶液(0.05 U/μLのヘパリンナトリウム)を調製します。使用するまで4°Cで抗凝固液を保管してください。
- 長さ90mmのガラスキャピラリーから、針の引き手でガラスの毛細管を引っ張って2本のガラス針を準備します(図1B)。メーカーの指示に従ってください。
注:ガラス針の外径は1mm、内径は0.6mmです。 - 蓋を切って1.5mLのプラスチックチューブ蓋を用意し、針の外径に合った穴を作ります(図1C)。穴を作るために、9 mm ガラスキャピラリーの一方の端を加熱し、蓋を通して加熱されたガラスの毛細管を刺します。あるいは、穴の直径が9mmガラスキャピラリーに収まるまで、針を使用して蓋を通します。
2. ゴナデケーションの手順
- 水槽水の30 mLにトリケーヌストック(0.6%)の1チューブを希釈することにより、麻酔液の0.02%を調製します。
- ステップ1.3で説明したように、1つの超微細および2つの細かい鉗子(1つは比較的広い先端を持つもの)、小さいはさみ、ナイロン糸およびカミソリを含む解剖用具を準備する。
- 30-60秒間0.02%麻酔液に入れて魚を麻酔します。
注:麻酔の持続時間は、魚の大きさと重量に依存し、適応する必要があります。魚が完全に麻酔されていることを確認するために、魚の体は鉗子を使用して穏やかにつまむことができます。魚が反応しない場合は、ゴナデカトミーを開始することができます。 - 麻酔液から魚を取り出し、魚を横に水平に置き、解剖顕微鏡の下で水を出します。
- 女性の卵巣切り下切れ(OVX)
- 卵(女性の体の外にぶら下がっている卵)があれば取り除き、切開部の鱗を削り取る(図2A)。
- かみそり刃を使用して、骨盤と肛門フィン(図2A)の間の長さ約2〜2.5mmの長さを穏やかに切開します。その後、細かい鉗子を使って少しずつ卵巣を取り出しながら、魚の腹部を優しくつまみます。
- 細かい鉗子を使って卵巣の端を切り取り、卵巣を脇に置く(図2B)。
注:可能であれば、卵巣嚢を壊さないことに注意してください。卵巣嚢が壊れている場合は、非排卵卵卵を残すことなく、可能な限り完全に生殖腺の痕跡を取り除きます。
- 男性の蘭十次体
- アヌスの上の肋骨の間を静かに切開し(図2A)、細かい鉗子を使ってゆっくりと切開を切開する。
- 細かい鉗子を使って精巣をそっとつかみ、ゆっくりと精巣を取り出します。その後、精巣の終わりを切って精巣を完全に取り除きます(図2B)。男性の蘭十二次切開術の場合、すべての製剤は、切開部まで女性に似ています。精巣をつかむと、精巣に似た脂肪が得られることもある。しかし、脂肪を復元した後、再度精巣を見つけようとすることが可能です(図2B)。
注:男性と女性の両方にとって、死亡率につながる過度の損傷を防ぐために、腹部の切開サイズを最小限に抑えることが重要です。時には、腸はまた、生殖腺と一緒に切開を通して現れることがありますので、閉鎖前に切開の中で適切に戻されていることを確認してください。卵巣と精巣の位置に関する事前の知識は、メダカ腹部に不可欠です。
- 男性と女性でも同様に切開を縫合する(図3)。
- ナイロン糸を切開領域の横に置き、細かい鉗子で糸を取り込むために超微細な鉗子を使用して内体腔を通して切開の右側から皮膚を刺す(図3;1-2)。
- 切開の左側から外側の体腔を通して皮膚を刺して糸を取り出す(図3;3-4)。
- 切開口を閉じ、2つの結び目を作り、過度の糸を切ります(図3;4-6)。
注:縫合糸は十分にタイトでなければならず、魚の残りの糸は縫合糸の緩み防止に十分な長さでなければなりません。麻酔から縫合までの手順全体は、一般的に最大6分かかります。長い時間は、死亡率につながる可能性があります。 - 魚を回収水に入れ、少なくとも24時間放置してから、水槽システムに移します。
注:ゴナデクトマイズ化された魚は、通常、回復水の1〜2時間後に正常な行動を示します。したがって、実験目的に応じて、この時間間隔の後に魚をサンプリングすることができる。
3. 血液採取手順
- 工具を準備する:ガラス針、シリコーンキャピラリー、穴付きのプラスチックチューブ、空の1.5 mLプラスチックチューブ、ミニセントリフュージとテープ。
- ステップ2.1で説明したように0.02%の麻酔液を使用して魚を麻酔し、魚を垂直位置の解剖顕微鏡の下に置く(図4A)。尾栓穿刺静脈の可視化を容易にするために、明るい表面に魚を置きます。
- シリコンキャピラリーにガラスの針を取り付けて、血液引き出しを取り付けます(図4B)。広い先端鉗子で針の先端を破り、吸引と吹き付けによって抗凝固液溶液で針の内側をコーティングします。
注:吸盤と少なくとも50 cmの長さのシリコーンキャピラリーの使用は、吸引時に血液の直接接触を避けるために安全対策のために推奨されます。また、針先の開口が血液を引き出すのに十分な大きさであることを確認してください。 - 針を魚のペダンクルク領域に向け、尾大ペダンク静脈(図5A)を目指し、針の総体積が少なくとも4分の1になるまで口を使って血液を引き出す(図5B)。
注:魚の体から針を取り外す前に吸引を停止することが重要です。 - 針を放し、針の鋭い側の近くにテープを置きます。蓋に穴を開けて、針を外側の針先に入れて穴に通します(図5C)。
- 魚を回収水に入れ、少なくとも24時間放置してから、水槽システムに移します。
注:同じ魚から2回目の血液サンプリングを行う場合は、最初の血液サンプリングの1週間後に血液をサンプリングします。 - フラッシュは、チューブ内の血液を収集するために室温で1,000 x gで1〜2秒間収集した血液をスピンダウンします。
- 下流の用途に直接進むか、使用するまで-20 °Cで血液を保存します。
注:全血48からの性ステロイド抽出のための以前の研究を参照してください。
結果
このプロトコルは、小さなサイズのモデルテレオスト、日本のメダカでゴナ12次と血液サンプリングを行うためのすべてのステップを記述します。女性の卵巣切り抜き(OVX)後の魚の生存率は100%(10匹中10匹)、オスの94%(18匹中17匹)が11次切り出し後に生存した。一方、血液採取手順が行われた後、すべての(38匹の魚)魚が生き残った。
シャム手術の女性は卵位を示し(図6A)、すべての卵子は受精し、胚発生を許された(図6B)。シャム手術を受けた雄もわずか1~2週間後に卵子を受精することができた。部分的にゴナデクトマイズされた雄で飼育された6人に2人の部分的に12億ト減菌された雌も、2ヶ月後に受精卵の100%で卵位を示した。対照的に、4ヶ月後でさえ、完全にゴナデクトン化された魚では、雌の卵位やオスによる受精は認められなかった。
正常に行うと、魚の体型はわずかに変化し(図7A)、生殖腺は、生殖腺の一部が、生殖腺の手順の後に残ってはならない(図7B)。一方、4週間後のゴナ12次切除術、切開および縫合は完全に消失し(図8)、4ヶ月後には、すべてのゴナデクトン化された魚は依然として健康な表現型を示し、性腺組織は見つからなかった。
女性のE2血中濃度(表1)は、メーカーの指示に従ってELISAで測定し、OVX魚のE2レベルが手術後24時間のシャム操作魚よりも有意に低いことを明らかにした(p <0.00001)。4ヶ月後、OVX魚のE2レベルも、シャム操作魚(p<0.00001)よりも有意に低く、OVX魚(p>0.05)の24時間に比べて有意差を示さない。最後に、部分的に、生殖腺の1/3〜1/2のみが除去されたOVX魚は、シャム操作魚(p = 0.0437)よりも有意に低いE2レベルを示し、完全なOVX魚(p<0.00001)(図9A)よりも有意に高いE2レベルを示す。
同様に、オス(表1)では、11-KTの整形化魚の11-KT濃度は、手術後24時間のシャム操作魚よりも有意に低い(p<0.00001)。4ヶ月後の蘭十二分化された魚の11-KTのレベルも、シャム操作魚(p<0.00001)よりも有意に低く、24時間の蘭式魚(p>0.05)と比較して差を示さない。最後に、部分的に蘭十二分化された魚は、シャム操作魚(p = 0.0428)よりも11-KTの有意に低いレベルを示し、完全に蘭式化された魚よりも11-KTの有意に高いレベルを示す(p < 0.00001) (図9B)。

図 1.器械の準備。(A)ゴナ16次切開術用のカミソリ刃、血液抽出用のガラス針、および(C)は、採血用穴のある蓋と一緒にプラスチックチューブを使用する。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2.切開部の位置A) 肋骨の間に位置する切開領域の描画, 骨盤と肛門のひれの間 (左パネル) 男性 (右パネル);B)女性(左パネル)および男性(右パネル)の生殖腺除去、関節部分を示す白い円、精巣を示す白い矢印、脂肪を示す黒い矢印。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 3.縫合の手順。 1) 超微細鉗子を用いて、切開の右側に穴が開きます。2) ナイロン糸は1で作られた穴を使用して皮膚を通る。3) 切開の左側に穴が開きます。4)ナイロン糸は3で作られた穴を通る。5)切開を閉じるためにオーバーハンド結び目を2回作ります。6) 余分な糸が切断されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 4.採取中の魚の位置(A)は、シリコン毛細管(B)を有するガラス針の設置である。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 5.血液採取(A)の吸引領域は、血液(B)および採血工程(C)を採取した。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 6.シャム操作魚は、白い矢印(A)と受精卵(B)によって指さされた卵の卵位を示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
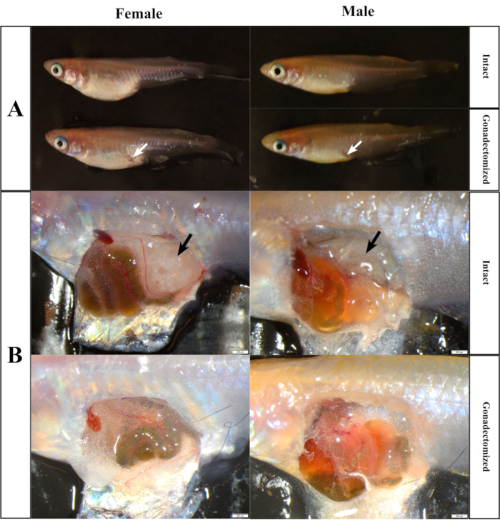
図 7.形態学的(A)および解剖学的(B)無傷およびゴナデクトン化された魚の出現。白い矢印(上のパネル)は、ゴナトマイズ化された魚の手術マークを示しています。 黒い矢印(下のパネル)は、無傷の魚の生殖腺を示しています。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図 8.4週間後にオスとメスの魚の手術マーク。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 9.女性(A)および11-KTの男性(B)日本式メダカにおけるE2の血中濃度、恥の手術(対照)の24時間後、部分的に腺十二次切除術または16次切除術、および五十二次切除術(OVX、女性の卵巣切除術)の4ヶ月後男性のCas、蘭十次化術)。 統計分析は、一方向ANOVAを使用して実行され、続いてTukey ポストホックテストが 行われました。異なる文字 (a-c) は有意差を示します(p-値< 0.05)。グラフのデータは、平均 + SD、 n = 5 として提供されます。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| E2レベル(女性) | 11-KT レベル (男性) | |
| シャム操作 | 4.15 ± 0.5 (n = 5) | 10.38 ± 1.32 (n = 5) |
| 部分的にゴナデクトン化 | 3.37 ± 0.6 (n = 5) | 8.37 ± 1.92 (n = 5) |
| 24時間後ゴナデカトミー | 0.36 ± 0.2 (n = 5) | 0.4 ± 0.2 (n = 5) |
| ゴナ12次後4ヶ月 | 0.54 ± 0.28 (n = 5) | 0.74 ± 0.22 (n = 5) |
表 1.恥を操作し、11種の魚のメスと男性のE2および11-KTレベル(ng /mL)。
ディスカッション
前の文献で報告されているように, ゴナ16>と血液サンプリングは、BPG 軸の調節における性ステロイドの役割に関連する質問を調査するために、他のモデル種で長い間使用されています。.しかし、これらの技術は、より大きな動物に対してのみ適しているようです。一般的に使用されるテレオストモデルの小さなサイズを考慮して、我々は、この種のために実現可能であるゴナデクトミーと血液サンプリングのための詳細なプロトコルを提供します。
ゴナデクトン化された魚の生存率がほぼ100%に達したという事実は、メダカに対して、その十二次切除法が可能であることを示している。同様に、血液採取の手順は、この手順を受けた後の100%生存率によって示されるように、魚の生存率に影響を与えない。さらに、シャム操作の男性と一緒に飼育されたシャム操作の雌は、卵位および100%受精卵を示し、切開および縫合手順が魚の繁殖に影響を与えないことを示す。言い換えれば、彼らは産卵するのに十分な健康でした。さらに、部分的にゴナデクトン化された魚は、シャム操作魚に対する性ステロイドの同等の濃度を示し、一部の女性の卵子ならびに男性による卵の受精は部分的にゴナトマイズ化された魚で観察された。これらの結果は、ゴナデクトミーの手順を高精度に行うべきであることを示唆しています, 卵巣や精巣を完全に除去する必要があることを意味します.
図8に示すように、魚の切開と縫合線の跡は、4週間後に完全に消え、魚は手術後4ヶ月で健在に見えます。これらは、操作手順が長期的な目的のために魚のために安全であり、魚の寿命に影響を与えないことを示しています。さらに、4ヶ月後、生殖腺は認められない。これは、24時間後にゴナデクトン化された魚に見られるものとまだ類似しているE2と11-KTの低レベルによって確認されます。
ゴナデクトン化された魚のE2および11-KTのレベルは、すでに24時間後にゴーナ12次切除後に、偽魚よりも有意に低く、ゴナ12月切除後4ヶ月後にサンプリングされた魚で低いままである。対照と比較して、性ステロイドレベルが対照と比較して有意に低いセックスステロイドレベルは、ドッグフィッシュ37、ナマズ39 およびメダカ48の以前の研究で観察されている。これらの一貫した証拠は、プロトコルに記載されているゴナ16次体法は、循環性ステロイドをクリアするための信頼性の高い技術であることを示唆しています。
この手順は、40で示されるようにFADSに依存していないので、手術中の死亡率を防ぐために、できるだけ早く行うべきである。実際、FADSの使用は、このツールは、空気にさらされているにもかかわらず、魚に連続麻酔状態を可能にするので、操作のリズムを維持することができます。それにもかかわらず、メダカのような小さなテレオストの実現可能性が低いため、FADSの使用はその大きさの魚では実行できません。さらに、広い切開が生殖腺に到達することを可能にする大きな魚の以前の生殖腺切開プロトコルとは異なり、この原稿に記載されているプロトコルは、小さな魚への過度の損傷を避けるために広い切開を可能にしません。したがって、魚の体腔内の他の組織の損傷を防ぐために鉗子を使用して生殖腺にアクセスしようとするときには、非常に注意する必要があります。
プロトコルは、迅速かつクリーンな手順に依存しています。したがって、高い成功率に達するまでのトレーニングは、高い成功率に達するまで強く推奨され、生殖腺の完全な除去と同様に、魚の高い生存率と生殖腺の完全な除去によって示される( 図7の正常な生殖器の前および後の魚の形態学的および解剖学的外観の違いを参照してください)。実際には、多くの要因は、麻酔期間、切開の広さ、縫合糸の精度と正確さ、および手順中の魚の取り扱いを含む、手順の成功率に影響を与えることができます。もう一つの重要なポイントは、プロトコルを実行する前に魚を最適に維持することによって、健康な魚を準備する必要があります。
血液採取法に関しては、以前の研究では、メダカ48とゼブラフィッシュ49、50、51から血液をサンプリングしようとしましたが、魚を安楽死させた後に血液を採取するため、同じ魚の血液サンプリングを繰り返す必要はありません。別の研究52ではゼブラフィッシュを用いて繰り返し血液サンプリングが実証されているが、この種のプロトコルをメダカで初めて報告する。
性ステロイド濃度の評価は、一般的に酵素結合免疫吸着測定法(ELISA)キットを用いて行われ、さまざまな種類の性ステロイドに対して市販されている多くのELISAキットが存在する。血液のサンプリング中に採取された血液量が少ないため、下流アッセイは全血を対象としています。これまでの研究では、全血と血漿53、54から抽出された循環ステロイドレベルの測定レベルに差があることを示している。したがって、全血と血漿からの性ステロイドレベルの差は、プロトコルを使用して実際の実験を行う前に検証する必要があります。
異なる動物モデルを用いた以前の研究で文書化されているように、ここで説明するプロトコルは、モデルとして小さなサイズのテレオストを使用して生殖生理学に関連する質問を調査することを可能にする。実際、これらの技術は、BPG軸の調節とそのフィードバックメカニズムに関する質問に既に寄与しており、例えば、kiss1(キスペプチン遺伝子1型)の関与が陽性フィードバックループ55、神経核内のkiss1発現ニューロンのエストロゲン媒介性調節(NVT)、およびkiss2(キスペプトジェネイン2)の前視神経領域(POA)の前の神経細胞領域における 57は、女性の日本のメダカ58におけるfsh発現レベルの下方制御におけるエストロゲン受容体β1(Esr2a)の関与の可能性と、雌魚48におけるE2の概日リズムのプロファイルを示す。さらに, 以前の研究は、セックスステロイドもテレオストの下垂体におけるゴナドロープ細胞の増殖に影響を与えることを実証したので59,60,下垂体可塑性に対する性ステロイドクリアランスの後のセックスステロイドクリアランスの影響を調査することは興味深い.
血液サンプリング技術は、セックスステロイド分析だけでなく、血糖値を含む他の血液含有量分析にも使用できます。実際に、このプロトコルは、ゼブラフィッシュ52 およびメダカ61に示されるように、血糖値測定にも適用することができる。したがって、この技術は、生理学の他の分野での研究の質問に対処するために拡大することができます。
最後に、ここで説明するプロトコルは、日本の成人メダカ向けに設計および最適化されており、手順中に使用される魚や材料のサイズが異なる場合があります。さらに、メダカ左右の卵巣/精巣が融合し、ゴナデケーションにとって重要な利点を提供する可能性があるため、このプロトコルはゼブラフィッシュのような他の種で使用される前にいくつかの適応が必要になる可能性があります。したがって、これらのプロトコルをテストする前に、実験機器と魚のサイズの選択に応じて最適化を考慮する必要があります。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ルルド・カリアンGタンさんが魚の畜産を支援してくれたことに感謝している。本研究は、日本科学振興会(JSPS)の助成金援助(助成金番号18H04881、18K19323)、住友財団からS.K.に対する基礎科学研究プロジェクトの助成金を受け、NMBUが出資しました。
資料
| Name | Company | Catalog Number | Comments |
| Glass capilary | GD1 | Glass Capillary with Filament GD-1; Narishige | |
| Heparin sodium salt | H4784-1G | Sigma-aldrich | |
| Needle puller | P97 | Flaming/Brown Micropipette puller Model P-97; Sutter Instrument | |
| Nylon thread | N45VL | Polyamide suture, 0.2 metric; Crownjun | |
| Plastic tube | T9661 | Eppendorf Safe-lock microcentifuge tube 1.5 ml, Sigma-aldrich | |
| Razor blade | - | Astra Superior Platinum Double Edge Razor Blades Green, salonwholesale.com | |
| Silicone capillary | a16090800ux0403 | Uxcell Silicone Tube 1 mm ID x 2 mm OD, amazon.com | |
| Tricaine | WXBC9102V | Aldrich chemistry |
参考文献
- Weltzien, F. -A., Andersson, E., Andersen, Ø, Shalchian-Tabrizi, K., Norberg, B. The brain-pituitary-gonad axis in male teleosts, with special emphasis on flatfish (Pleuronectiformes). Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology. 137 (3), 447-477 (2004).
- Yaron, Z., Levavi-Sivan, B. Encyclopedia of Fish Physiology. Farrell, A. P. 2, Academic Press. 1500-1508 (2011).
- Goldman, B. D. The circadian timing system and reproduction in mammals. Steroids. 64 (9), 679-685 (1999).
- Taranger, G. L., et al. Control of puberty in farmed fish. General and Comparative Endocrinology. 165 (3), 483-515 (2010).
- Messinis, I. E. Ovarian feedback, mechanism of action and possible clinical implications. Human Reproduction Update. 12 (5), 557-571 (2006).
- Diotel, N., et al. The brain of teleost fish, a source, and a target of sexual steroids. Frontiers in Neuroscience. 5, 137(2011).
- Diotel, N., et al. Steroid Transport, Local Synthesis, and Signaling within the Brain: Roles in Neurogenesis, Neuroprotection, and Sexual Behaviors. Frontiers in Neuroscience. 12, 84(2018).
- Larson, T. A. Sex Steroids, Adult Neurogenesis, and Inflammation in CNS Homeostasis, Degeneration, and Repair. Frontiers in Endocrinology. 9, 205(2018).
- Fontaine, R., et al. Gonadotrope plasticity at cellular, population and structural levels: A comparison between fishes and mammals. General and Comparative Endocrinology. 287, 113344(2020).
- Fontaine, R., Royan, M. R., von Krogh, K., Weltzien, F. -A., Baker, D. M. Direct and indirect effects of sex steroids on gonadotrope cell plasticity in the teleost fish pituitary. Frontiers in Endocrinology. , (2020).
- Kanda, S. Evolution of the regulatory mechanisms for the hypothalamic-pituitary-gonadal axis in vertebrates-hypothesis from a comparative view. General and Comparative Endocrinology. 284, 113075(2019).
- Schreck, C. B. Stress and fish reproduction: The roles of allostasis and hormesis. General and Comparative Endocrinology. 165 (3), 549-556 (2010).
- Wendelaar Bonga, S. E. The stress response in fish. Physiological Reviews. 77 (3), 591-625 (1997).
- Mommsen, T. P. Paradigms of growth in fish. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 129 (2), 207-219 (2001).
- Won, E., Borski, R. Endocrine Regulation of Compensatory Growth in Fish. Front. Endocrinol. 4, 74(2013).
- MacKenzie, D. S., VanPutte, C. M., Leiner, K. A. Nutrient regulation of endocrine function in fish. Aquaculture. 161 (1), 3-25 (1998).
- Rønnestad, I., Thorsen, A., Finn, R. N. Fish larval nutrition: a review of recent advances in the roles of amino acids. Aquaculture. 177 (1), 201-216 (1999).
- Borg, B. Androgens in teleost fishes. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology. 109 (3), 219-245 (1994).
- Rege, J., et al. Circulating 11-oxygenated androgens across species. The Journal of Steroid Biochemistry and Molecular Biology. 190, 242-249 (2019).
- Blázquez, M., Bosma, P. T., Fraser, E. J., Van Look, K. J. W., Trudeau, V. L. Fish as models for the neuroendocrine regulation of reproduction and growth. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology. 119 (3), 345-364 (1998).
- Zambrano, D. Innervation of the teleost pituitary. General and Comparative Endocrinology. 3, 22-31 (1972).
- Weltzien, F. -A., Hildahl, J., Hodne, K., Okubo, K., Haug, T. M. Embryonic development of gonadotrope cells and gonadotropic hormones - Lessons from model fish. Molecular and Cellular Endocrinology. 385 (1), 18-27 (2014).
- Harris, M. P., Henke, K., Hawkins, M. B., Witten, P. E. Fish is Fish: the use of experimental model species to reveal causes of skeletal diversity in evolution and disease. Journal of applied ichthyology. 30 (4), 616-629 (2014).
- Powers, D. Fish as model systems. Science. 246 (4928), 352-358 (1989).
- Naruse, K. Medaka: A Model for Organogenesis, Human Disease, and Evolution. Naruse, K., Tanaka, M., Takeda, H. , Springer. Japan. 19-37 (2011).
- Green, P. G., et al. Sex Steroid Regulation of the Inflammatory Response: Sympathoadrenal Dependence in the Female Rat. The Journal of Neuroscience. 19 (10), 4082-4089 (1999).
- Pakarinen, P., Huhtaniemi, I. Gonadal and sex steroid feedback regulation of gonadotrophin mRNA levels and secretion in neonatal male and female rats. Journal of Molecular Endocrinology. 3 (2), 139(1989).
- Purves-Tyson, T. D., et al. Testosterone regulation of sex steroid-related mRNAs and dopamine-related mRNAs in adolescent male rat substantia nigra. BMC Neuroscience. 13 (1), 95(2012).
- Adkins-Regan, E., Ascenzi, M. Sexual differentiation of behavior in the zebra finch: Effect of early gonadectomy or androgen treatment. Hormones and Behavior. 24 (1), 114-127 (1990).
- McCreery, B. R., Licht, P. Effects of gonadectomy and sex steroids on pituitary gonadotrophin release and response to gonadotrophin-releasing hormone (GnRH) agonist in the bullfrog, Rana catesbeiana. General and Comparative Endocrinology. 54 (2), 283-296 (1984).
- Clark, J. H., Markaverich, B. M. The agonistic-antagonistic properties of clomiphene: a review. Pharmacology & Therapeutics. 15 (3), 467-519 (1981).
- Mourits, M. J. E., et al. Tamoxifen treatment and gynecologic side effects: a review. Obstetrics & Gynecology. 97 (5), 855-866 (2001).
- Wallach, E., Huppert, L. C. Induction of Ovulation with Clomiphene Citrate. Fertility and Sterility. 31 (1), 1-8 (1979).
- Moradi, B., Kazemi, M. A., Rahamni, M., Gity, M. Ovarian hyperstimulation syndrome followed by ovarian torsion in premenopausal patient using adjuvant tamoxifen treatment for breast cancer. Asian Pacific Journal of Reproduction. 5 (5), 442-444 (2016).
- Alvarado, M. V., et al. Actions of sex steroids on kisspeptin expression and other reproduction-related genes in the brain of the teleost fish European sea bass. The Journal of Experimental Biology. 219 (21), 3353-3365 (2016).
- Godwin, J., Crews, D., Warner, R. R. Behavioural sex change in the absence of gonads in a coral reef fish. Proceedings of the Royal Society of London. Series B: Biological Sciences. 263 (1377), 1683-1688 (1996).
- Jenkins, N., Dodd, J. M. Effects of ovariectomy of the dogfish Scyliorhinus canicula L. on circulating levels of androgen and oestradiol and on pituitary gonadotrophin content. Journal of Fish Biology. 21 (3), 297-303 (1982).
- Manickam, P., Joy, K. P. Changes in hypothalamic catecholamine levels in relation to season, ovariectomy and 17β-estradiol replacement in the catfish, Clarias batrachus (L.). General and Comparative Endocrinology. 80 (2), 167-174 (1990).
- Senthilkumaran, B., Joy, K. P. Effects of ovariectomy and oestradiol replacement on hypothalamic serotonergic and monoamine oxidase activity in the catfish, Heteropneustes fossilis: a study correlating plasma oestradiol and gonadotrophin levels. Journal of Endocrinology. 142 (2), 193-203 (1994).
- Sladky, K. K., Clarke, E. O. Fish Surgery: Presurgical Preparation and Common Surgical Procedures. Veterinary Clinics of North America: Exotic Animal Practice. 19 (1), 55-76 (2016).
- Hori, H. Medaka: A Model for Organogenesis, Human Disease, and Evolution. Naruse, K., Tanaka, M., Takeda, H. , Springer. Japan. 1-16 (2011).
- Murata, K., Kinoshita, M., Naruse, K., Tanaka, M., Kamei, Y. Medaka: Biology, Management, and Experimental Protocols. Murata, K., et al. 2, John Wiley & Sons. 49-95 (2019).
- Fontaine, R., Weltzien, F. -A. Labeling of Blood Vessels in the Teleost Brain and Pituitary Using Cardiac Perfusion with a DiI-fixative. Journal of Visualized Experiments. (148), e59768(2019).
- Fontaine, R., Hodne, K., Weltzien, F. -A. Healthy Brain-pituitary Slices for Electrophysiological Investigations of Pituitary Cells in Teleost Fish. Journal of Visualized Experiments. (138), e57790(2018).
- Zhao, Y., Wayne, N. L. Recording Electrical Activity from Identified Neurons in the Intact Brain of Transgenic Fish. Journal of Visualized Experiments. (74), e50312(2013).
- Ager-Wick, E., et al. Preparation of a High-quality Primary Cell Culture from Fish Pituitaries. Journal of Visualized Experiments. (138), e58159(2018).
- Wittbrodt, J., Shima, A., Schartl, M. Medaka - model organism from the far east. Nature Reviews Genetics. 3 (1), 53-64 (2002).
- Kayo, D., Oka, Y., Kanda, S. Examination of methods for manipulating serum 17β-Estradiol (E2) levels by analysis of blood E2 concentration in medaka (Oryzias latipes). General and Comparative Endocrinology. 285, 113272(2020).
- Eames, S. C., Philipson, L. H., Prince, V. E., Kinkel, M. D. Blood sugar measurement in zebrafish reveals dynamics of glucose homeostasis. Zebrafish. 7 (2), 205-213 (2010).
- Velasco-Santamaría, Y. M., Korsgaard, B., Madsen, S. S., Bjerregaard, P. Bezafibrate, a lipid-lowering pharmaceutical, as a potential endocrine disruptor in male zebrafish (Danio rerio). Aquatic Toxicology. 105 (1-2), 107-118 (2011).
- Jagadeeswaran, P., Sheehan, J. P., Craig, F. E., Troyer, D. Identification and characterization of zebrafish thrombocytes. British Journal of Haematology. 107 (4), 731-738 (1999).
- Zang, L., Shimada, Y., Nishimura, Y., Tanaka, T., Nishimura, N. Repeated Blood Collection for Blood Tests in Adult Zebrafish. Journal of Visualized Experiments. (102), e53272(2015).
- Taves, M. D., et al. Steroid concentrations in plasma, whole blood and brain: effects of saline perfusion to remove blood contamination from brain. PloS one. 5 (12), 15727(2010).
- Holtkamp, H. C., Verhoef, N. J., Leijnse, B. The difference between the glucose concentrations in plasma and whole blood. Clinica Chimica Acta. 59 (1), 41-49 (1975).
- Kanda, S., et al. Identification of KiSS-1 Product Kisspeptin and Steroid-Sensitive Sexually Dimorphic Kisspeptin Neurons in Medaka (Oryzias latipes). Endocrinology. 149 (5), 2467-2476 (2008).
- Kanda, S., Karigo, T., Oka, Y. Steroid Sensitive kiss2 Neurones in the Goldfish: Evolutionary Insights into the Duplicate Kisspeptin Gene-Expressing Neurones. Journal of Neuroendocrinology. 24 (6), 897-906 (2012).
- Mitani, Y., Kanda, S., Akazome, Y., Zempo, B., Oka, Y. Hypothalamic Kiss1 but Not Kiss2 Neurons Are Involved in Estrogen Feedback in Medaka (Oryzias latipes). Endocrinology. 151 (4), 1751-1759 (2010).
- Kayo, D., Zempo, B., Tomihara, S., Oka, Y., Kanda, S. Gene knockout analysis reveals essentiality of estrogen receptor β1 (Esr2a) for female reproduction in medaka. Scientific Reports. 9 (1), 8868(2019).
- Fontaine, R., Ager-Wick, E., Hodne, K., Weltzien, F. -A. Plasticity in medaka gonadotropes via cell proliferation and phenotypic conversion. Journal of Endocrinology. 245 (1), 21(2020).
- Fontaine, R., Ager-Wick, E., Hodne, K., Weltzien, F. -A. Plasticity of Lh cells caused by cell proliferation and recruitment of existing cells. Journal of Endocrinology. 240 (2), 361(2019).
- Hasebe, M., Kanda, S., Oka, Y. Female-Specific Glucose Sensitivity of GnRH1 Neurons Leads to Sexually Dimorphic Inhibition of Reproduction in Medaka. Endocrinology. 157 (11), 4318-4329 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved