Method Article
クライオスライシングBN-MS解析による高解像度複合プロファイリング
要約
マイクロトームを用いて汎用性の高い解起性BN-MSプロトコルを高解像度の複合プロファイリング用に提示する。
要約
タンパク質は、一般に、動的タンパク質アセンブリまたは安定形成複合体の一部として、他のタンパク質との相互作用を通じて生物学的機能を発揮します。後者は、天然ポリアクリルアミドゲル電気泳動(BN-PAGE)を用いて分子サイズに従ってエレガントに解決することができる。このような分離を敏感な質量分析(BN-MS)に結合することは十分に確立されており、理論的には生物学的サンプル中の抽出可能な錯体の徹底的な評価を可能にする。ただし、このアプローチはかなり面倒で、複雑なサイズの解像度と感度が限られています。また、その適用は豊富なミトコンドリアおよびプラスチドタンパク質に限定されたままである。したがって、大多数のタンパク質では、安定タンパク質複合体への統合に関する情報はまだ不足しています。ここでは、準備スケールのBN-PAGE分離、凍結ミクロトームスライスによる広範なゲルレーンのサブミリメートルサンプリング、ラベルフリータンパク質定量による質量分析を含む複合体プロファイリングに最適化されたアプローチを示します。重要な手順の手順とツールについて詳しく説明します。このアプリケーションとして、マウス腎臓からの可溶化エンドソーム富化膜画分の複合体解析について説明し、合計で2,545個のタンパク質をプロファイリングした。この結果は、細胞内イオンチャネルなどの均一で低ふさわしい膜タンパク質の同定と、グリコシル化アイソフォームを含む高解像度で複雑なタンパク質アセンブリパターンの同定を実証した。結果は独立した生化学的分析と一致している。要約すると、この方法論は、タンパク質(スーパー)複合体とそのサブユニット組成の包括的かつ公平な同定を可能にし、任意のタンパク質複合体の修行法、組み立て、および相互作用ダイナミクスを調査するための基礎を提供します。生物学的システム。
概要
BN-PAGE分離は、まず、BN-PAGEゲルレーンの手動スライスを使用してマジェラン1およびウェッセル2研究グループによってLC-MS分析(BN-MS)に直接結合されました。彼らの分析は、植物プラスティドとHEK細胞ミトコンドリアから既知のサブユニット組成を有する豊富な膜タンパク質複合体の数を同定した。しかし、これらの分析は包括的なものではなく、新しいアセンブリの公平な識別を可能にしませんでした。質量分析計とラベルフリー定量法の性能は、それ以来大幅に向上し、包括的なBN-MS分析を可能にしました。これは「コンプレックスプロファイリング」という用語を造語しました。例えば、ハイデと共同作業者は、ラット心臓ミトコンドリアを同定し、464個のミトコンドリアタンパク質をクラスタリングし、それによって多くの既知のアセンブリを確認した。さらに、彼らはTMEM126Bが特定のアセンブリ複合体3の新しい、重要なサブユニットであることを発見しました。同等の結果(437ミトコンドリアタンパク質プロファイルを有する)は、HEK細胞ミトコンドリア4の並列研究で得られた。
これらの改善にもかかわらず、複合プロファイリングのためのBN-MSの可能性を完全に抑制するいくつかの問題が残っています。主な制限は、2つの要因によって決定される複合体の有効なサイズ分解能です:(i)ゲルマトリックス細孔勾配の均一性とサンプル複合体の安定性/溶解性に依存するBN-PAGE分離の品質、および(ii)ゲルサンプリングのステップサイズは、従来の手動スライス5、6を使用する場合に最高の1mmである。サイズの解像度が低いだけでなく、微妙な複雑なアイソフォームや不均一性を見逃すだけでなく、偏りのない、de novo サブユニットの割り当てと定量化のダイナミックレンジと信頼にも悪影響を及ぼします。
その他の課題としては、タンパク質定量の精度と、質量分析によるサンプル中のタンパク質の豊富さの実際の動的範囲のカバレッジが含まれます。したがって、BN-MS錯体プロファイリングの適用は、より低い複雑性、標的複合体の高発現、および良好な可溶化特性(すなわち、プラスチド、ミトコンドリア、およびおよび有利な可溶化特性を有する生物学的試料に大きく制限されたままであった。微生物)6,7,8,9,10.
最近では、BN-PAGEゲルレーンの精密なサブミリメートルサンプリングと包括的なMS解析を組み合わせたクライオミクロトームスライスアシストBN-MS(csBN-MS)を導入し、高いタンパク質プロファイルの決定のための精巧なMSデータ処理を行いました。自信11.ラット脳からのミトコンドリア膜製剤への応用は、以前に満たされていない効果的な複合体サイズ分解能および酸化呼吸鎖複合体(OXPHOS)サブユニットの最大カバレッジ(すなわち、90 MSアクセス可能な90)を実証した。この例では、多数の新規タンパク質アセンブリも同定した。
ここでは、タンパク質複合体(特定の生物学的源に限定されない)の準備スケールBN-PAGE分離、大規模な準備BN-PAGEゲルの鋳造、広いゲルレーンのクライオミクロトームスライス、およびMSデータの最適化された手順を示します。処理。高解像度プロファイリングの性能は、マウス腎臓エンドソーム富化膜からのタンパク質複合体製剤について実証される。最後に、質量分析定量の分解能と精度を高めることによる利点について説明します。
プロトコル
1. 準備BN-PAGE
- ゲル製剤
- 中から大判の縦型ゲル電気泳動システム(>10 cmゲル分離距離、14 cm x 11 cm、1.5 mm スペーサー)を使用し、効果的な冷却を10°Cに設定します。
- ポンプによって駆動される攪拌2チャンバー勾配ミキサーを使用して、線形または双曲線細孔勾配ゲル(1.5〜3.0 mmスペーサー)を鋳造します(材料と試薬の表を参照)。提示された例(線形勾配ゲル1%-13%):
- 13%のアクリルアミド(30%ストック溶液から、37.5:1.0アクリルアミド:ビサクリラム化物)、0.75Mアミノカプロン酸、50mMビストリス(pH= 7.0)、および10%のグリセロールからなる前部(混合)チャンバのための13 mL溶液を調製します。
- 1%のアクリルアミド(30%のストック溶液から、37.5:1.0アクリルアミド:ビサクリラム化物)、0.75Mアミノカプロン酸、50 mMビストリス(pH =7.0)、および0.2%CL-47からなる貯留室のための10 mL溶液を調製します。
- 攪拌機を開始し、30マイクロリットルのAPS(ペルキソジスチル酸アンモニウム、10%ストック溶液)とTEMEDの2.5 μL(N,N',N',N'テトラメチルエチレンジアミアミン)とTEMEDの2.5マイクロリットルを前房の溶液に加えます。ポンプを開始し、フロントバルブを開きます(フローは10分で鋳造を完了するように調整する必要があります)。1分後、90 μLのAPSと5μLのTEMEDを貯留室の溶液に加え、チャンバ接続を開きます。
- ゲルをゆっくりと完全に重合させて、室温(RT)で少なくとも24時間、均質な細孔サイズの勾配を生成します。しっとりとした状態に保つと、重合ゲルを4°Cで直立して1週間保存できます。
注:意図的に、ゲルの上部は柔らかい/ぬるぬるした一貫性を持つことになります。これは後で除去されますが、ゲルへのタンパク質のスムーズな侵入を可能にし、それ以外の場合は遊離アーティファクト(すなわち、ストリーキングまたはタンパク質沈殿)につながる可能性のあるタンパク質沈殿のリスクを最小限に抑えます。
- サンプルの準備と積み込み
- 0.5~2.0mgのタンパク質を分離するためのガラス板の間に適切なスペーサー(例えば、シリコンチューブ)を挿入してローディングスロットを準備します。スロットは、少なくとも3センチメートル幅(またはより良い、5〜6センチメートル幅)にする必要があります。
- 1%(w/v)非脱進性洗剤(ComplexioLyte CL-47)を含む可溶化バッファーの2mLで2mLの膜(マウス腎臓エンドソーム濃縮製剤)を30分間氷上で〜2.5mg可照化する。超遠心分離機(堆積遮断=200S以下、ここでは130,000 x g/11分)を使用する。
- 400,000 x gで1時間の超遠心分離によるスクロースステップ勾配を短い50%/20%(w/v、0.3 ml)に濃縮する。最終的なタンパク質収率は、少なくとも1 mgでなければなりません。
- 0.05%(w/v)のクマシーG-250を可溶化物に加え、サンプルをゲルにロードします。タンパク質の負荷を 10-15 μg/mm2ゲルレーン断面に制限して、高分解能を得て、タンパク質沈殿に起因するアーティファクトを回避します。
- BN-PAGE 実行条件
- 実行バッファーの場合は、50 mM トリシン、15 mM ビストリス、および 0.01% Coomassie G-250 からなる標準陰極バッファーを準備します。50 mM Bis-Tris(pH = 7.0)で構成される標準アノードバッファを準備します。
- 100Vで30分の平衡フェーズ、最大電圧(40-50V/cmゲル長)に遅い(40-50 V/cmゲル長)を使用して、10°Cで一晩で準備BN-PAGEを実行します。タンパク質のエンドポイントフォーカス。
注:移行前面がゲルの中央に達したときに電気泳動を一時停止し、Coomassie G250なしで新鮮なバッファとカソードバッファを交換することをお勧めします。これは、マトリックス細孔構造の局所的な崩壊に起因するゲル内の沈殿アーティファクトを回避するのに役立ちます。
2. ゲルのサンプリングと消化
- ゲルレーンの切除
- 実行後、ガラス板の間に保ちながら、文書化のためにゲルをスキャンします。
- プレートを分解し、目的の車線セクションを切除します。
- 2D BN/SDS-PAGEとタンパク質染色またはウェスタンブロッティング(図1Bに示すように)による分析のためにレーンのサンプルストリップを取り、対象領域、有効な複雑なサイズ分解能、およびタンパク質の豊富さを決定します。
- 30%(v/v)エタノールと15%(v/v)酢酸で、選択したゲルレーンを少なくとも30分間2回固定します。
- サンプルを埋め込み媒体に移し、4°Cで少なくとも2時間浸漬し、平衡化しながら、軌道シェーカー上でゲルスラブをスローモーションに保ちます。
注: ゲルの分離は、全体的な分離品質と移行アーティファクトを慎重に検査する必要があります。支配的なタンパク質を表すゲルバンドは、歪みのない強度で均質でなければなりません。ゲル上の局所的なアーティファクトは、切除するか、分析から除外する必要があります。
- 埋め込みおよび凍結ミクロトームスライス
注:これは、8 cm11までのより広いゲルレーンの埋め込みとスライスを可能にする、以前に説明され、写真文書化された埋め込み手順の改良版です。- まず、固定ゲルレーンをタンパク質移行フロント/バンドパターンと正確に平行なセクション(ここでは3cm)にカットします。取り扱いを容易にするために、同じ寸法のプラスチックフィルムサポートに各セクションを配置します。
- ストッパー付きの開いたチューブにレーンを転送します(底面に閉じ、上部に中央に穿通され、ゲルセクションの上下両端に正確に位置合わせ)。
- シリンダーを液体窒素に短時間浸し、固化を迅速に開始します。透明な埋め込み媒体は数秒以内に固化し、色が白くなります。
- 埋め込み媒体で空洞を満たし、液体窒素に一時的に浸し、-20°Cで数時間凍結する。
注:液体窒素に浸すことによってシリンダーを急速に冷却することは、チューブ内のゲルスラブの変位を避けるのに役立ちます。次の MS 分析で高解像度を確保するには、歪みを避ける必要があります。 - 分解後、プラスチックフィルムを取り外し、埋め込みゲル部でブロックを冷却し、直径が大きく、平らな支持面(ペトリ皿)に置き、シリンダーの外側に埋め込み媒体で密封する。シリンダーを埋め込み媒体で充填し、完全に凍結します。
- この手順をシリンダの反対側で繰り返し行い、同一平面を持つソリッド ブロックを取得します。
- シリンダーからブロックを取り出し、あらかじめ冷却された金属ホルダーに埋め込み媒体で接着し、ホルダーをクライオシングマシン(クライオトーム)に挿入します。ブロックの表面は、スライス平面に対して慎重に位置合わせする必要があります。スライスプロセスに最適な温度で平衡化します(ここでは、-15 °C)。
注:正しい位置を確保するために、埋め込まれたゲルセクションの表面に当たるまで、0.1 mmステップサイズのゆっくりと進行する手動スライスサイクルを使用してください。 - ゲルスライスを次々に収穫し、最終的に所望の厚さ0.25mmのステップサイズで、低タンパク質結合特性を有する反応管に個別に移す。
注:このセットアップでは、均一なゲルスライスは0.1ミリメートルと0.5ミリメートルの厚さで容易に得ることができます。
- トリプティック消化
- ゲルスライスの広範な洗浄後にゲル内消化を行う(少なくとも3回の洗浄の追加ラウンドは、埋め込み媒体のポリマー成分を除去することが推奨される)標準的な手順11に従って。
- 真空乾燥溶出ペプチドと0.5%(v/v)トリフルオロ酢酸を37°C(10分)で振盪し、続いて浴日量(5分)と短い遠心分離を行います。
3. 質量分析
- ナノHPLCとMSセットアップ
- 消化されたサンプルをC18プレカラム(粒径=5μm;直径=300μm)にロードし、(スプリットフリー)ナノHPLCを高分解能の質量分析計に結合して0.05%(v/v)トリフルオロ酢酸を使用します。
- 水性有機勾配(溶出性A)を用いて捕捉したペプチド(溶出性A):5分3%B、3%Bから30%Bまでの120分、30%Bから99%Bまで20分、5分99%B、5分から99%B、15分3%B(流量)。。
注:csBN-MSゲルスライスは、通常、低~中間ペプチドの豊富さと限られた程度の複雑さのサンプルをもたらす。したがって、nanoLC-MS/MS分析は、合理的な感度とシーケンシング速度、高質量分解能(>100,000)と最大ダイナミックレンジ(実質的に3〜4桁)を提供するセットアップで行う必要があります。ただし、長いカラム寸法や溶出グラデーションを 3 時間を超えて拡張する必要はありません。 - エミッタ内の別々の放出ペプチド(i.d. 75 μm; tip = 8 μm) を C18 材料で約 20 cm(粒度 = 3 μm)で手動で梱包します。質量分析計の加熱転写毛細血管(250°C)に2.3kV(正イオンモード)でサンプルをエレクトロスプレーします。
- 次の計測器設定11: 最大 MS/MS 射出時間 = 400 ミリ秒で解析を実行します。除外期間 = 60 s;最小信号しきい値 = 5,000 カウント、フラグメント化された上位 10 個の前駆体。絶縁幅 = 1.0 m/z)。
注: 大量、保持時間、および多数のデータセットまたは測定におけるペプチド信号の割り当てを容易にするために、パラメータおよびハードウェア((すなわち、同じC18カラム/エミッタ上で)。
- タンパク質同定(前述の11として評価されるMSデータ)
- 「msconvert.exe」ツール(ProteoWizardの一部)を使用して、フラグメントイオンスペクトルからピークリストを抽出します。
- 50 ppm ペプチド質量公差を持つ予備データベース検索で、タンパク質に割り当てられたすべてのペプチドの中央値 m/z オフセットによって、各データセットのすべての前駆体 m/z 値をシフトします。
- UniProtKB/スイス-Prot データベースのすべてのマウス エントリに対して、適切な検索エンジン (ここではマスコット 2.6.2) で修正されたピーク リストを検索します (リリース 2018_11)。
- 「アセチル(タンパク質N項)」、「カルバミドメチル(C)」、「Gln」を選択します。パイログル(N期Q)、グル |パイログル(N-タームE)、「酸化(M)」、「プロピオナミド(C)」を可変修飾として用いる。
- ペプチドとフラグメント質量公差をそれぞれ±5ppmと±0.8 Daに設定し、1回の見逃したトリプティック切断を可能にする。ペプチド同定の予想値カットオフを0.5以下に設定します。おとりデータベース検索を使用して、偽陽性検出率 (FDR) を判別します。FDR を 1% に設定するか、追加の品質基準を適用して信頼性の高い識別を確保します。
注:提示された実験では、3,500以上のタンパク質を同定し、平均ペプチドFDRは4.4±0.77%(n= 101スライスサンプル)、またはペプチドFDRを1%に設定した場合は3,000個のタンパク質を同定した。重要なことに、プロファイリングされたタンパク質の選択に、より厳しい基準が用いられた(2,568)。それは、少なくとも2つのペプチドで同定されたすべてのタンパク質を含み、そのうちの少なくとも1つはタンパク質特異的である、少なくとも101のスライスサンプルのうちの少なくとも1つであった。
- タンパク質定量
- FTフルスキャンから得られるタンパク質定量にはペプチド信号強度(ピークボリューム[PV])を使用し、適切なソフトウェア(ここではMaxQuant v1.6.3)を使用して保持時間と質量シフトを修正します。
- LOESS回帰を使用して、MSデータセットを1つずつ並べ合わせて(合計平均)ペプチド溶出時間を参照します。PVをペプチドに直接(MS/MSベースの同定)または間接的に割り当てます(すなわち、非常に狭い許容範囲内で一致するm/zと溶出時間に基づいて)。
注: このプロトコルは、「挿入された」ペプチドの割り当てに社内ソフトウェアを使用します。パラメータを設定すると、有効な m/z と溶出時間が±2 ppm と ±1 分の許容値にそれぞれ一致します (図 2A,Bを参照)。 - 隣接するスライスサンプル間の相対ペプチド強度の中央値差から算出したペプチド強度再スケーリングによるペプチド負荷およびイオン化効率の系統的な実行変動に対して正しい(図2C)。
- 内部 PV 整合性分析によって識別された外れ値および残りの偽割り当ての PV データをフィルター処理します。
- 相対的なペプチド豊富プロファイルを得るすべてのスライスデータセット上の最大値に各ペプチドのPVを正規化します。
- 最後に、相対タンパク質の豊富なプロファイルを、3 つの連続したスライスのウィンドウ上で最も相関するペプチド プロファイルの少なくとも 2 つ (および 6 または 50% 以上の値)の平均として計算します。これにより、欠落したPV値のブリッジングとノイズの低減が可能になります。
注:最終的に2,545(2,568の事前選択された)タンパク質プロファイルが得られた(図2D)。
- タンパク質複合体の特性特性
- 局所マキシマ法を用いて最初にピーク検出を行い、これらのピークに連続して正規分布を適合させ、最大値とFWHMの位置(スライスインデックスまたは明らかな複雑なサイズ)を得ることによってタンパク質プロファイルを分析する(全幅)半分の最大強度)値(図4のインセット)。
注: データセットでは、カスタム スクリプトを使用してプロファイルが自動的に分析されます。FWHM の最小値は、アプローチの有効なサイズ分解能を示します (ここでは、6 x 0.25 = 1.5 mm)。 - log10(予測分子量)値の線形回帰解析に定義された分子質量(UniProtKB/スイス-Protデータベースで報告されている)を持つ参照タンパク質複合体ピークを使用して、スライス数指数を見かけの分子サイズに変換します(すなわち、kDaで明らかに複雑なサイズ)。
注:試料中の23のマーカー複合体を、(i)プロファイルピークの単分散形状、(ii)分子量の実験的支持、および(iii)調査されたBN-PAGEゲルセクションに沿った分布に基づいて、本試験(図4)で選択した。
- 局所マキシマ法を用いて最初にピーク検出を行い、これらのピークに連続して正規分布を適合させ、最大値とFWHMの位置(スライスインデックスまたは明らかな複雑なサイズ)を得ることによってタンパク質プロファイルを分析する(全幅)半分の最大強度)値(図4のインセット)。
結果
従来のBN-MS研究の大半と最近確立された高解像度csBN-MSアプローチは、(i)容易に入手可能なミトコンドリアおよびプラスチド製剤に適用され、(ii)は複雑さが限られており、(iii)発現高密度の標的(膜)タンパク質複合体。このプロトコルは、低豊富なタンパク質を発現する非ミトコンドリア膜への高解像度複合体プロファイリングの適用を拡張し、複合体への統合に関する情報はほとんど入手できない。デモンストレーションのために、密度勾配遠心分離により得られたマウス腎臓からエンドソーム富化膜製剤を選択しました。
この調製物の最適化は、主に初期およびリサイクルエンドソーム12に局在する細胞内イオンチャネルを形成するマーカータンパク質TPC1によって導かれた。また、腎近位管状細胞においても高発現しており、腎組織切片の免疫組織化学的分析によって示されているように(図1A)。これらの膜を穏やかに可溶化(低タンパク質でComplexioLyte 47:1:8の洗剤比)し、超遠心分離によりスクロースクッションに濃縮した。後者は、予備のBN-PAGE分離の分解能に悪影響を及ぼす傾向がある過剰な低分子量成分(洗剤、脂質、塩、有機ポリマー、代謝産物)を除去するための重要なステップであることが判明した。
天然の1%〜13%(w/v)ポリアクリルアミド勾配ゲル(図1B、中間パネル)の複雑な分離は、非常に少ない遊離アーティファクトを伴う強く染色されたタンパク質バンドを示した。狭いBN-PAGEゲルストリップのSDS-PAGE分離(図1B、フレームは赤でボックス化)を第2次元として、続いてウェスタンブロット解析は、明確なTPC1関連複合集団の十分に解決されたパターンを示した(図1B)。、上部パネルは、赤い矢印でマークされ、最も可能性の高い追加のタンパク質サブユニットおよび/または翻訳後修飾(グリコシル化12など)との関連から生じる。対象の3cmセクションを切除し、固定し、記載の11のようにクライオミクロトームスライスのために処理した。サンプリング中の解像度を維持するために非常に重要であるこの手順の個々の手順(特に、広いゲルセクションの正確な位置合わせ)は、付属のビデオに記載されています。埋め込みゲル部は最終的に0.25mm(図1B、下パネル)の均一な厚さの101ゲルスライスに切断し、高性能LC結合質量分析によって別々に消化され、分析された。
サイズ分解能に加えて、タンパク質定量の品質は、複合体プロファイリングを成功させるための鍵となります。MSのセットアップと設定を使用すると、サンプルの分析は非常に包括的であり、1スライスあたり1,000以上のタンパク質と10,000ペプチド(うち8,200個がタンパク質特異的)、約3,000個のタンパク質と43,000個のタンパク質の平均同定が得られました。ペプチド(そのうち38,500個はタンパク質特異的であった)。それにもかかわらず、データ依存性MS/MSシーケンシングの確率的性質とダイナミックレンジの限界のために、強度情報は、より豊富なタンパク質のために断片的であった。そこで、一連のデータセット全体にわたってペプチド信号(ピーク量[PV]=ペプチド関連信号強度)の正確な割り当てに基づく精巧なMSデータ処理手順11が行われた。
図2A,Bに示すように、キャリブレーション後に残った質量および保持時間におけるペプチド信号の偏差は、MS配列と間接的に割り当てられたPV(<1 ppmの非常に狭い公差と<0.5分の95%の)に対して同一であった。PV)は、偽陽性PV割り当てに対する非常に低いレートを示す。残りの外れ値は、他の関連 PV との一貫性に基づいてフィルター処理されました。すべてのMS測定は、パラメータやハードウェアコンポーネントを変更することなく、同じLC-MSセットアップ上で連続して実行されたため、実行可能なバリエーション(隣接するスライスに対するサンプル内のすべてのPV強度の中央値として決定されます)。PVデータセットの再スケーリングによって小さく、簡単に排除されました(図2C)。得られたペプチド強度情報を使用して、2,545タンパク質相対存在表プロファイルを再構築した。図2Dに示すように、これらのタンパク質プロファイルの75%以上は、少なくとも3つの独立したタンパク質特異的ペプチドに基づいていた。
次に、プロトコルは、タンパク質複合体の分解能に対するBN-PAGEゲルサンプリングのステップサイズの関連性を評価した。この目的のために、スライス データセットは、2 つ、3 つ、または 4 つの連続したスライスから PV 情報を合計して結合し、0.5 mm、0.75 mm、および 1 mm のステップ サイズの結果をシミュレートしました (元のサンプリング 0.25 mm と比較)。図3は、例としてタンパク質TPC1に対する得られた豊富なプロファイル(A-D)を示す。0.25 mmでは、TPC1関連複合集団の相対強度とサイズの分離(図3A)は、ウェスタンブロット解析の結果と良好に一致した(図1B、上パネル)。しかし、プロファイルは、主に定量に使用されるPVマトリックスの欠損値(「ギャップ」)に起因するいくつかのノイズを示しました。
0.5 mm に対応する 2 つのスライスの結合は、TPC1 関連複合体の正しい強度と分離を維持し、定量ノイズを除去しました (図 3B)。対照的に、0.75 mmおよび1 mm(図3C,D)の大きなステップサイズは、サイズ分解能の喪失につながり、TPC1複雑な亜集団の差別を廃止した。公表された従来のBN-MS分析の大部分は、手動で2mmスライスをカット(ゲルレーン全体をカバーするために約60)7、8、9、10を使用することに留意すべきです。
遊発距離またはスライス指数を分子サイズに変換することは、一般に、市販の天然標準タンパク質または既知のサブユニット組成を有する良好な内因性タンパク質複合体のいずれかのマーカーに基づいている(主に[super]ミトコンドリア酸化呼吸鎖[OXPHOS]の複合体13.しかし、BN-PAGE分離は、分子量だけでなく、3D構造と関連脂質、洗剤、およびクーマッシー分子の数によって決定される有効な分子断面に基づいているため、個々のタンパク質が示す可能性があります。より大きな偏差。そこで、マーカー11としてより大きなタンパク質錯誤物を用いることを選択した。図4のプロットは、代表的なサブユニットを黒い円で示す23個の選択されたマーカーを示し、予測分子量のlog10値を示す(UniProtKB/スイス-Protデータベースによる)対。対応するプロファイルのピーク最大のスライスインデックス。後者は、シャペロンBCS1を用いた例を示す図4のインセットに示すように、相対的な豊富なデータに適合する自動化ガウスフィットから得られた。線形回帰(赤線)は、スライスインデックス値を、調査されたゲルセクションに沿って160〜630 kDaの範囲の明らかな分子サイズに変換する機能を提供しました。
最後に、分析は、よく特徴付けられた複合体に関する情報を提供し、新しいサブユニットと複雑なアセンブリの存在を実証しました。錯体の異なる側面を強調する例は、図5に示されている(A-C:発現または好ましくはエンドソーム区画に位置するタンパク質;D-F:他の細胞内局在化からの複合体)。鉄輸送タンパク質フェリチンは、24光(FRIL1)および重(FRIH)サブユニットから複合体を形成することが知られており、総分子量は440 kDa14(図5A、充填矢印)である。サブユニットプロファイル(図5A)は、異なる重/軽鎖のストイチオメトリー(の再スケーリング後に見える)を持つ複合体の少なくとも2つの小さな形態(360 kDaと340 kDa;開いた矢印)の存在を示唆しています。エンドソームに豊富に存在する図5Aのインセット。
これに対し、ニカリンノモ1複合体15(図5D)、ガンマ・セクレマゼスコア複合体16(図5B)、及びGPI-トランサミドース機械17(図5E)が固定を示す。全体のサイズ範囲にわたって彼らのコアサブユニットの豊富な比率と追加のタンパク質との関連から独立しています。これは、サブユニットが互いに排他的であることを示します。Vacuolar H+-ATPasesは、約900 kDaの総分子量を有するモジュラー様式で20以上のサブユニットのプールから組み立てられた多タンパク質複合体である。図5Cは、少なくとも17のサブユニットから異なる組成を有するサブ複合体を明らかにし、生物学的(dis)アセンブリ中間体または実験条件によって生成されたサブコンプレックスのいずれかを表し、そのうちのいくつかはまた、最近のBN-MS研究18で観察された。もう一つの多タンパク質複合体例は、プロテアソーム19(図5F)である。20Sプロテアソームコアを形成するαとベータサブユニットの豊富なプロファイルを詳しく調べると、サイズの微妙な違いを持つ2つの主要な複合体(590 kDaと575 kDa、灰色の矢印で示される)と3つのベータサブユニットの統合が示唆されています。
要約すると、エンドソーム富化腎膜のcsBN-MS複合体プロファイリングは、(i)均一で低豊富な標的タンパク質を複合体に統合し、(ii)一般的な複合体サブユニット組成およびストイチオメトリー、および(iii)複雑な異種、サブ構造、および(dis)アセンブリ中間体。
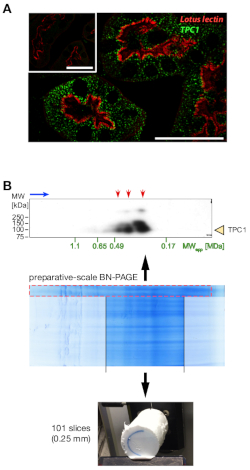
図1:細胞内チャネルTPC1をマーカーとして用いたマウス腎臓からの可溶化エンドソーム富化膜の予備BN-PAGE分離。(A)共焦点顕微鏡による腎近位管におけるTPC1タンパク質の免疫組織化学的局在化緑:抗TPC1抗体12染色は、二次Cy3-ビオチン化ヤギ抗ウサギIgGで可視化;赤色:近位管状細胞の輝度表面をマーキングする生体化ロータステトラゴノバスレクチン(LTL、10μg/mL、FITC-共役)。インセットは、TPC1-KO腎臓からの対応するセクションの染色を陰性対照として示す。白いスケールの棒は20 μmである。また注意すべきは、細胞内小胞における強いTPC1発現であり、初期およびリサイクルエンドソーム12を表す独立した実験から知られている。(B)1%-13%(w/v)ポリアクリルアミド勾配ゲル上の可溶化エンドソーム濃縮膜の2.5mgの予備BN-PAGE分離。その後のSDS-PAGE/ウェスタンブロット解析(上パネル)のために狭い車線(赤色で囲まれた)をカットし、異なるTPC1関連複合体とグリコシル化パターン(赤色矢印:抗TPC1/抗ウサギHRP/ECLプライム;緑:位置と予測)ブロットの全タンパク質染色[SYPRO Rubyブロット染色])によって同定されたマーカータンパク質複合体の塊[MDa]。右から:Na+/K+-輸送ATPase、シトクロムb-c1複合ダイマー、ATPシンターゼ、NADH:ユビキノンオキシドレクターゼ。ゲルレーンからの目的の3cmセクションを切除し、組織埋め込み媒体に埋め込み、取り付け、凍結マイクロトームを用いてタンパク質移動前部に沿って101のセクション(0.25mm)にスライスした(下パネル;ビデオリンクを参照)。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:MS信号の割り当てと定量の精度と解析の深さを決定する主要パラメータ。(A)MS/MS配列(赤いバー)と間接的に割り当てられたm/zキャリブレーション後の相対質量誤差(ppm)の分布(すなわち、密接に一致する質量と保持時間に基づいて、プロトコル;青いバーを参照)ペプチド信号。これは、<1 ppm(信号/割り当てられたPVの95%)の最終質量誤差と、偽陽性割り当ての非常に低い率を示唆しています。(B)ペプチド信号の溶出時間アライメント後の全平均からのナノHPLC保持時間偏差の分布、Loess回帰(プロトコル参照)および(A)で使用される色分法を用いる。時間誤差は、ペプチド信号/割り当てられたPVの95%の>95%に対して30秒未満です(C)隣接する2つのサンプルの平均に対してプロットされた総MS強度の実行対実行変動。これらのスケール係数は、系統的な技術的エラーを最小限に抑えるために、生の PV テーブルに適用されました。(D)タンパク質の相対的な豊富なプロファイルを計算するために使用されるペプチド情報。外れ値、不十分なスコア、または単一同定(プロトコル参照)に対するタンパク質特異的ペプチドを濾過した後、2,545個のタンパク質豊富なプロファイルが決定され、そのうちの75%が合理的な自信を持って少なくとも3つのペプチドに基づいていた。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:TPC1の錯体分解能に対するゲルサンプリングにおけるステップサイズの重大な影響データセットは、1、2、3、および 4 つの連続するスライス (A-D) のグループで信号強度を合計して結合し、示されているようにゲルスライスの異なるステップ サイズをシミュレートするために同じように処理されました。TPC1 プロファイルは、0.25 mm の (オーバーサンプリング) ノイズを示しますが、3 つの複雑な母集団の良好なサイズ解像度 (図 1Bも参照) で、主に 0.5 mm のステップ幅で保持されます。これらの集団の差別は、1mmが近づくにつれて失われる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
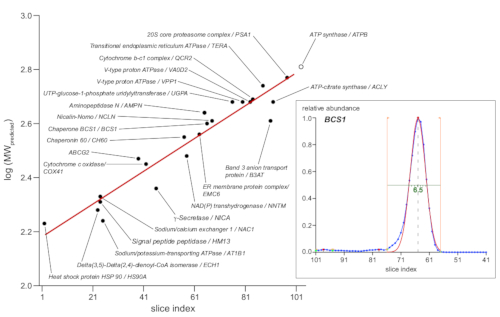
図4:明らかな分子量の決定。定義された分子組成を有する23のマーカー複合体(UniProtKB/スイス-Protによると示されているように)をサイズマーカーとして使用した。彼らの予想分子量(kDa)の対数値は、対プロットされた。示された代表的なタンパク質サブユニット(黒で塗りつぶされた円)のプロファイルピーク最大スライス指数。このデータに対する線形回帰フィッティング(赤い線)は、スライスインデックス値を見かけの分子量に変換する関数を提供しました。ピークマキシマは、シャペロンタンパク質BCS1のインセット(右)に示すようにタンパク質プロファイルピークに自己自動化されたガウスフィットによって決定された(青色の一次データ、オレンジ色の線で示される適合境界、赤でフィット機能)。さらに、これらは、1.5 mm ゲルの周りに及ぶ最もシャープな焦点複合体で、ピーク半最大幅(緑色の線、6.5 スライス、または 1.6 mm)を決定します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
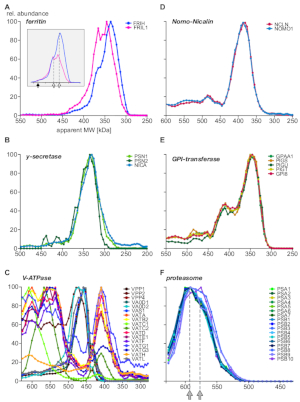
図5:タンパク質複合体サブユニットプロファイルの例。相対タンパク質の豊富さと.フェリチン(A)の重くて軽い鎖に対してプロットされた明らかな分子量は、フェリチンサブユニットの系統の分子不均一性を明らかにし、存在量(インセット)の再スケーリング後により明確に見える。塗りつぶされた矢印と開いた矢印は、それぞれ完全な複合体(440 kDa)と2つのサブコンプレックスを示します。ガンマクレコーゼ(B)サブユニットは、定量的に単一コア複合体集団に統合される。真空H+-ATPases(C)のサブコンプレックスは、全てエンドソームで表される明確なサブユニット組成を持つ複数のアセンブリを示した。ノモ1およびニカリンタンパク質(D)は、いくつかの複合体を形成するマルチサブユニット酵素機械である排他的複合体(GPI-トランスアミダーゼ)を形成した。(E)20Sプロテアソームコア複合体(F)は、他の細胞内局在に起因する灰色の矢印で示される2つの集団を持つ微妙なサブ複合体パターンを示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本研究は、以前にミトコンドリア調製11でベンチマークしたcsBN-MS技術に基づいて構築された研究で、サンプル調製、ゲル処理、およびMSデータ評価の改善を組み込んだ。大規模分離BN-PAGEゲルのセクションの焦点を絞った分析は、ミトコンドリア膜との研究に匹敵する品質測定を示す包括的なデータセットを提供した。質量および保持時間の誤差および実行可能なバリエーションは非常に低く保たれ、信頼できるタンパク質の豊富なプロファイルを決定するための基礎を提供した。サイズの解像度は良好に見え、半分の最大ピーク幅は6枚(1.5mm、図4に相当)、相対的なサイズ差は10%未満です(図3、図5A)。これらの値は、ミトコンドリアの以前のcsBN-MS分析のサイズ分解能品質を完全に満たしていなかった(選択された小さいゲルサンプリングステップサイズにもかかわらず)が、従来のBN-MSまたはサイズ排除MSの性能よりも有意に優れている最近人気となっているアプローチ20。
高い有効な複雑なサイズ分解能の重要性は、図3のシミュレーション実験(TPC1関連複合体を用いて)によって強調され、2D BN/SDS-PAGEウェスタンブロット解析ではほとんど解決できない(図1B)。これらの結果は、この場合の0.25mmスライスがオーバーサンプリングをもたらしたことを示唆していますが、これは有効なサイズ分解能を損なうことなく「定量ノイズ」の除去に有用であることが判明しました。したがって、前の結果11に沿って、〜0.3mmのサンプリングステップサイズが一般的に推奨される。
特に、TPC1関連複合体の判分は、従来のBN-MS5、6で手動スライスによって提供される最小のステップサイズである1mmゲルサンプリングによって完全に失われます。これは、強力なMS技術が利用可能であるにもかかわらず、非常に少数のタンパク質複合体とサブユニットが複合体プロファイリングによってde novoを同定したという事実を説明するかもしれません。csBN-MSはよい解決力に加えて、高い多様性を提供する。50 kDaから複数のMDaに及ぶ膜結合複合体および可溶性タンパク質複合体は、最小バイアス11を用いて単一の実験で効果的に解決することができる。これは、サイズ排除やイオン交換クロマトグラフィーなどの複合体プロファイリングに使用される代替分離技術とは対照的であり、特定のサイズ範囲または電荷特性を有する可溶性タンパク質のサブセットで動作します。欠点として、csBN-MSはスケーラビリティが低く(ゲル当たり約3mgのタンパク質の最大負荷)、技術的に困難であり、自動化することはできません。
全体として、csBN-MSベースの錯体プロファイリングが非ミトコンドリアターゲットに正常に適用できるだけでなく、関連するいくつかの課題を示す結果が示されています。したがって、タンパク質複合体の効率的な抽出および生化学的安定性は、より多くの最適化を必要とし、洗浄工程は依然として制限されてもよい。調査されたサイズウィンドウ内では、ミトコンドリアサンプルと比較して、よく焦点を当てた単分散タンパク質複合体の数は実際にかなり低かった(図示されていないデータ)。また、許容可能なゲル分離を得るためにBN-PAGEサンプル負荷を下げることをお勧めします。負荷が高いほど、スライスのために適切に処理するのがより困難な、より広いゲルレーンが必要になる場合があります(付属のビデオを参照)。さらに、サンプルのタンパク質の複雑さは、ミトコンドリア由来のスライスダイジェストよりも高く(約2倍)、より多くの欠落したPV値と減少したダイナミックレンジにつながりました。実際、図5に示す複合体の一部であると予想されるいくつかの小さなタンパク質は、分析に欠けていました。これらの問題は、より高速で機密性の高い MS 計測器またはデータに依存しない取得モードを使用することで、将来的に解決できます。
サンプル調製は、タンパク質複合体の検索、安定性、およびゲル分離品質に非常に重要です。パラメータと手順は、各ソース組織、細胞リサート、膜(画分)、および目的のタンパク質複合体ごとに最適化する必要があります。csBN-MS のアプリケーションの拡張に役立つ一般的な推奨事項を次に示します。
(i) サンプルを新鮮に準備し、温暖化/凍結、強い希釈、バッファー条件の変化、および不必要な遅延を避ける。
(ii) 塩を本質的に欠損しているバッファー(500~750 mMベタインまたはアミノカプロン酸に置き換える)、中性pHについて、非型化洗剤(タンパク質:1:4-1:10の間の洗剤比1:1:10)を含有するタンパク質複合体、可溶性タンパク質複合体に必要な洗剤なし);
(iii) 分析BN-PAGEによる洗剤条件の慎重な試験と調整は、複雑な可溶化の効率、試料中の膜タンパク質複合体の表現、安定性、および均質性に強く影響を与える可能性があるため、タンパク質洗剤ミセル。後者は、タンパク質がBN-PAGEゲル上の異なるバンド/複合体集団として焦点を合わせるための前提条件です。以前の文献は、中性洗剤の広い範囲を提供しています。しかし、DDM(n-ドデシルβ-d-マルトシド)1、2、4、5、6およびデジボニン3、5、7、8、 9、10、13、18は、これまでのBN-MS分析のための最も人気のある選択肢となっています。洗剤の状態は、必ずしも溶化効率とタンパク質相互作用の保存との間の妥協を表し、すべてのタイプの標的タンパク質およびソース材料に等しく適していない可能性があることを強調する必要があります。
(iv)フィブリル、フィラメント、ポリリシン、DNA、および豊富な低分子量成分(すなわち、代謝産物、脂質、またはペプチド)のような帯電したポリマーを除去する。これは、超遠心分離、ゲル濾過、または透析によって達成されてもよい。これは、総細胞または組織のリサテスのために特に重要です。
(v) クマシーG-250の添加(最終濃度0.05%-0.1%)スクロース(積載密度を高めるために、最終濃度10%-20%[w/v])を装填直前のサンプルに、短い超遠心分離によってクリアし、摂動することなくサンプルをロードし、その直後に実行を開始する。
将来の視点として、csBN-MSベースの複合体プロファイリングは、タンパク質複合体のダイナミクスや特定の生物学的条件に関連する変化を研究するための多重化のためのオプションを提供します。サイズ除外ベースのプロファイリング21のために提案された代謝ラベル付きサンプルの組み合わせ分離は簡単に見えますが、使用された分離とは独立して起こる複合体における自発的なサブユニット交換によって妨げられる可能性があります。メソッド。あるいは、ラベル付きサンプルは隣接するゲルレーンで解決することができ、高感度と堅牢性を持つ差動分析のために消化後にコスライスまたは組み合わせることができます。
開示事項
著者Uwe Schulteは、この研究で使用されるComplexioLyte 47を生産するLogopharm GmbHの従業員と株主です。同社は、非営利団体にComplexioLyte試薬を非営利で提供しています。
謝辞
この研究は、ドイツのフォルシュンゲミンシャフト(DFG、ドイツ研究財団)-プロジェクトID 403222702 – SFB 1381およびドイツのエクセレンス戦略CIBSS - EXC-2189 - プロジェクトID 390939984によってサポートされました。私たちは、技術支援のためにカジャザッペに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 30% Acrylamide/Bis Solution, 37.5:1 | Bio Rad | #1610158 | Recommended for acrylamide gradient gel solutions up to 13% |
| 30% Acrylamide/Bis Solution, 19:1 | Bio Rad | #1610154 | Recommended for acrylamide gradient gel solutions >13% |
| SYPRO Ruby Protein Blot Stain | Bio Rad | #1703127 | Total protein stain on blot membranes; sensitive and compatible with immunodetection |
| Coomassie Brilliant Blue G-250 | Serva | no. 35050 | Centrifugate stock solutions prior to use |
| ComplexioLyte 47 | Logopharm | CL-47-01 | Ready-to-use detergent buffer (1%) for mild solubilization of membrane proteins |
| Embedding Medium / Tissue Freezing Medium | Leica Biosystems | 14020108926 | Embedding medium for gel sections to be sliced by a cryo-microtome |
| Immobilon-P Membrane, PVDF, 0,45 µm | Merck | IPVH00010 | |
| ECL Prime Western Blotting Detection Reagent | GE Healthcare | RPN2232 | |
| Plastic syringe with rubber stopper, 20-30 ml | n.a. | n.a. | any supplier, important for making gel section embedding tool |
| broad razor blade | n.a. | n.a. | any supplier, for BN-PAGE gel trimming / excision of lanes |
| metal tube / cylinder, ca. 4 cm long | n.a. | n.a. | mold for embedding and freezing of gel samples |
| Protein LoBind Tubes, 1.5 ml | Eppendorf | Nr. 0030108116 | highly recommended to minimize protein/peptide loss due to absorption |
| sequencing-grade modified trypsin | Promega | V5111 | |
| C18 PepMap100 precolumn, particle size 5 µm | Dionex / Thermo Scientific | P/N 160454 | |
| PicoTip emitter (i.d. 75 µm; tip 8 µm) | New Objective | FS360-75-8 | |
| ReproSil-Pur 120 ODS-3 (C18, 3 µm) | Dr. Maisch GmbH | r13.93. | columns packed manually |
| rabbit anti-TPC1 antibody | Gramsch Laboratories | custom production | described in Castonguay, et al., 2017 (Reference 12) |
| Cy3-biotinylated goat anti-rabbit IgG | Vector Laboratories | CY-1300 | described in Castonguay, et al., 2017 (Reference 12) |
| biotinylated Lotus tetragonolobus lectin, FITC-conjugated | Vector Laboratories | #B1325 | described in Castonguay, et al., 2017 (Reference 12) |
| cryo-microtome Leica CM1950 | Leica Biosystems | 14047743905 | |
| Mini Protean II Cell with wetblot unit | Bio Rad | n.a. | for SDS-PAGE and Westernblot (not sold any more) |
| Penguin Midi Gel Electrophoresis System | PeqLab | n.a. | for BN-PAGE (not sold any more) |
| Zeiss Axiovert 200 M microscope + Photometrics Coolsnap 2 digital camera | Zeiss / Photometrics | n.a. | |
| peristaltic pump (IP high precision multichannel) | Ismatec | ISM940 | for casting of gradient polyacrylamide gels |
| gradient mixer with stirring (two chambers) | selfmade, alternatively Bio Rad | 1652000 or 1652001 | for casting of gradient polyacrylamide gels, manual provides instructions to cast linear or hyperbolic gradient gels (http://www.bio-rad.com/webroot/web/pdf/lsr/literature/M1652000.pdf) |
| ultracentrifuge Sorvall M120 with S80 AT3 rotor | Sorvall / Thermo Scientific | n.a. | for sample preparation (not sold any more) |
| UltiMate 3000 RSLCnano HPLC | Dionex / Thermo Scientific | ULTIM3000RSLCNANO | |
| Orbitrap Elite mass spectrometer | Thermo Scientific | IQLAAEGAAPFADBMAZQ |
参考文献
- Majeran, W., et al. Consequences of C4 Differentiation for Chloroplast Membrane Proteomes in Maize Mesophyll and Bundle Sheath Cells. Molecular & Cellular Proteomics. 7, 1609-1638 (2008).
- Wessels, H. J., et al. LC-MS/MS as an alternative for SDS-PAGE in blue native analysis of protein complexes. Proteomics. 9 (17), 4221-4228 (2009).
- Heide, H., et al. Complexome profiling identifies TMEM126B as a component of the mitochondrial complex I assembly complex. Cell Metabolism. 16 (4), 538-549 (2012).
- Wessels, H. J., et al. Analysis of 953 human proteins from a mitochondrial HEK293 fraction by complexome profiling. PLoS ONE. 8 (7), e68340 (2013).
- Wöhlbrand, L., et al. Analysis of membrane-protein complexes of the marine sulfate reducer Desulfobacula toluolica Tol2 by 1D blue native-PAGE complexome profiling and 2D blue native-/SDS-PAGE. Proteomics. 16 (6), 973-988 (2016).
- Takabayashi, A., et al. PCoM-DB Update: A Protein Co-Migration Database for Photosynthetic Organisms. Plant and Cell Physiology. 58 (1), e10 (2017).
- Senkler, J., et al. The mitochondrial complexome of Arabidopsis thaliana. The Plant Journal. 89 (6), 1079-1092 (2017).
- de Almeida, N. M., et al. Membrane-bound electron transport systems of an anammox bacterium: A complexome analysis. Biochimica et Biophysica Acta. 1857 (10), 1694-1704 (2016).
- Anand, R., Strecker, V., Urbach, J., Wittig, I., Reichert, A. S. Mic13 Is Essential for Formation of Crista Junctions in Mammalian Cells. PLoS ONE. 11 (8), e0160258 (2016).
- Eydt, K., Davies, K. M., Behrendt, C., Wittig, I., Reichert, A. S. Cristae architecture is determined by an interplay of the MICOS complex and the F1FO ATP synthase via Mic27 and Mic10. Microbial Cell. 4 (8), 259-272 (2017).
- Müller, C. S., et al. Cryoslicing Blue Native-Mass Spectrometry (csBN-MS), a Novel Technology for High Resolution Complexome Profiling. Molecular & Cellular Proteomics. 15 (2), 669-681 (2016).
- Castonguay, J., et al. The two-pore channel TPC1 is required for efficient protein processing through early and recycling endosomes. Scientific Reports. 7 (1), 10038 (2017).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Banyard, S. H., Stammers, D. K., Harrison, P. M. Electron density map of apoferritin at 2.8-A resolution. Nature. 271 (5642), 282-284 (1978).
- Dettmer, U., et al. Transmembrane protein 147 (TMEM147) is a novel component of the Nicalin-NOMO protein complex. The Journal of Biological Chemistry. 285 (34), 26174-26181 (2010).
- Kimberly, W. T., et al. Gamma-secretase is a membrane protein complex comprised of presenilin, nicastrin Aph-1, and Pen-2. Proceedings of the National Academy of Sciences of the United States of America. 100 (11), 6382-6387 (2003).
- Hong, Y., et al. Human PIG-U and yeast Cdc91p are the fifth subunit of GPI transamidase that attaches GPI-anchors to proteins. Molecular Biology of the Cell. 14 (5), 1780-1789 (2003).
- Van Damme, T., et al. Mutations in ATP6V1E1 or ATP6V1A Cause Autosomal-Recessive Cutis Laxa. The American Journal of Human Genetics. 100 (2), 216-227 (2017).
- Budenholzer, L., Cheng, C. L., Li, Y., Hochstrasser, M. Proteasome Structure and Assembly. Journal of Molecular Biology. 429 (22), 3500-3524 (2017).
- Heusel, M., et al. Complex-centric proteome profiling by SEC-SWATH-MS. Molecular Systems Biology. 15 (1), e8438 (2019).
- Kristensen, A. R., Gsponer, J., Forster, L. J. A high-throughput approach for measuring temporal changes in the interactome. Nature Methods. 9 (9), 907-919 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved