Method Article
細胞質 siRNA 送達のための、中立的充電された pH 応答性高分子ナノ粒子の調製
要約
中立的の物理化学的性質および生理活性を調製および特徴付ける方法は、pH 応答性 siRNA ナノ粒子が提示される。サイズ、形態、表面電荷、siRNA ローディング、および遺伝子サイレンシングなどの siRNA 品を正常に行うための基準が議論されています。
要約
対象となる分子薬としての siRNA の成功は、病理組織内の細胞へのその効率的なセルゾル送達に依存する。SiRNA を用いて以前に「undruggable」肝疾患を治療するための臨床的成功が達成された。しかしながら、効率的な腫瘍 siRNA 送達には、長い循環時間、クリアランス器官 (例えば、肝臓および腎臓) の回避、および腫瘍の浸透および保持を含むさらなる薬物動態学的設計の考慮が必要性がある。ここでは、効率的な siRNA 送達、特に腫瘍などの非肝組織に対して設計されたポリマーナノ粒子の調製およびインビトロ物理化学/生物学的特性評価について説明する。SiRNA ナノ粒子は、siRNA の静電ビスホスホンとジブロック共重合体ポリ (エチレングリコール-b-[2-(dimethylamino) エチルメタクリレート-共ブチルメタクリレート]) (PEG-DB) によって調製され、ポリイオン錯体を形成します (polyplexes) は、siRNA がポリプレックスコア内に隔離されており、PEG は親水性の中立的を帯びたコロナを形成します。さらに、DB ブロックは、endolysosomal 経路酸性化 (< pH 6.8) の小胞として膜溶菌となり、siRNA のエンドソームのエスケープおよび細胞質送達をトリガする。サイズ、表面電荷、粒子形態、および siRNA ローディングなどの siRNA ナノ粒子の物理化学的特性を特徴付ける方法について説明する。SiRNA ナノ粒子の生理活性は、迅速かつハイスループットな遺伝子サイレンシングアッセイにおけるモデル遺伝子としてのルシフェラーゼを用いて測定される。これらの初期試験 (PEG − DB ベースの polyplexes など) を通過する設計は、腫瘍または他の病理部位への siRNA の送達を評価する前臨床動物研究への翻訳に適していると考えられる。
概要
Sirna は、mRNA 配列からのタンパク質の翻訳を阻害するので、理論的にはすべての既知の病理1、2、3、4、5に薬物を使用することができます。しかし、薬における sirna の使用は、sirna 分子6、7の包括的に貧弱な薬物動態学的プロファイルによって制限される。静脈内に注射すると、sirna は腎臓を通して急速に取り除かれ、ヌクレアーゼ8,9によって劣化します。大きいサイズおよび否定的な充満が原因で、siRNA は細胞質10、11、12に常駐する RNA 誘発性サイレンシング複合体 (RISC) にアクセスするためにセルに入るか、または endolysosomal 経路を逃れることができません。 13.したがって、広範な努力は、siRNA 送達戦略14の設計および実施に焦点を当ててきた。この取り組みは、siRNA をパッケージングする脂質およびポリマーベースのナノ粒子の開発に主に焦点を当てており、それをインビボでのクリアランスおよび分解から保護し、ionizable、カチオンアミン基を介して細胞取り込みおよびエンドソームエスケープを開始する。多くの臨床上の成功が報告されており、最近では、遺伝性 transthyretin 媒介性 (hATTR) アミロイドーシス15を治療するためのナノ粒子系肝 siRNA 送達について最初の臨床的成功が報告されている。
従来の薬理学 (すなわち、低分子薬) によって現在「undruggable」されている多くの癌原因遺伝子があり、癌16を治療するために高分子 siRNA ナノ粒子 (Si-NPs) の設計を動機付ける。ただし、非肝性 siRNA 送達について考慮しなければならない設計パラメータの別個のセットがあります。送達システムは、体循環17、18、19内に凝集を引き起こすポリプレックスのカチオン電荷を遮蔽しなければならない。腫瘍送達のために、具体的には、si − NP 安定性は、長期循環を見識するために不可欠であり、したがって、増強された透過性および保持 (EPR) 効果を介して腫瘍内で蓄積を増加する作用20、21。さらに、si-NP サイズに対する制御は、約20〜 200 nm の直径のサイズをレバレッジ EPR22、およびより小さい Si-NPs (〜 20-50 nm の直径) より大きいサイズのナノ粒子上の腫瘍の浸透を改善し、微粒子23。
静脈内投与後の siRNA の全身性腫瘍送達のためのこれらの追加的な設計制約に対処するために、中立的、pH 応答性 si − NPs が開発されている (図 1)24。これらの si NPs は、ペグ化、または最も最近では、Zwitterionated25、中性表面電荷および循環におけるタンパク質吸着および opsonization に対する耐性のためです。細胞内送達を駆動するためにカチオン性の特性だけに頼ることができないため、強力な遺伝子サイレンシングを達成するためには非常に効率の良いエンドソームエスケープが不可欠です。したがって、これらの si NPs のコアは、細胞外 pH (7.4) で不活性である高 endosomolytic コアで構成されていますが、endolysosomal 経路の酸性化条件でスイッチ状にトリガされます [pH 6.8 (初期エンドソーム)-5.0 (リソソーム)]。最後に、si-NPs のコア内のカチオンと疎水性の含有量の混合物は、静電とファンデルワールスの両安定化力を提供し、単なるカチオン系と比較して、血液中の si-NPs の安定性を改善します。
比較的単純な設計への多くの機能の統合は、可逆的な追加-フラグメンテーション連鎖伝達 (ラフト) 制御された重合を使用して、複合建築と精密組成でポリマーを生成することが可能である。中性表面電荷、pH 応答性、および NP 安定性を備えた si-NPs を生成するために、筏は、ポリ (エチレングリコール-b-[2-(dimethylamino) エチルメタクリレート-共ブチルメタクリレート]) (PEG-DB を合成するために使用されます。図 1a)。PEG-DB は siRNA と複合化された静電的で、PEG 化コロナと DB/siRNA コアを有する si-NPs を形成します (図 1b)。PEG は、si-NP コロナ上に不活性で中立的に帯電した親水性層を形成します。DB ブロックは、2-(dimethylamino) エチルメタクリレート (DMAEMA) およびブチルメタクリレート (BMA) の50:50 モル比で構成されています。カチオン性 DMAEMA 静電的複合体負荷電 siRNA。BMA はファンデルワールス相互作用によって NP コア内で自己アソシエートし、NP 安定性を増加させます。共に、DMAEMA および BMA は DB ポリマーブロックに pH 依存性脂質二重膜溶菌挙動を付与する。細胞外 pH では、DB ブロックは si-NP コアに隔離され、脂質りんに対して不活性です。Endolysosomal 経路内のもののような酸性条件下では、DB ブロック内の ionizable DMAEMA はプロトンスポンジ効果を促進し、そこでエンドソームバッファリングは浸透圧膨潤および破裂26につながる。さらに、DB ブロック内の疎水性の BMA 部分は、溶解脂質りんに積極的に統合し、強力な endosomolysis をもたらす。したがって、siRNA は PEG-DB と複合化され、細胞外 pH では中立的で非常に安定であり、酸性 pH でりん脂質を破壊し、siRNA ペイロードの質細胞送達を確実にします。
ここでは、PEG-DB から si-NPs を製造するための実験的手順について説明する。Si-NPs の物理化学的パラメーターと生理活性を特徴付ける方法を紹介し、議論します。Si-NP 生理活性を迅速に評価するため、ノックダウン研究のためのモデル遺伝子としてルシフェラーゼを使用しています。ホタルルシフェラーゼは、ホタル27の「輝き」の原因となるタンパク質です。したがって、ホタルルシフェラーゼ遺伝子を導入した哺乳動物細胞は、ルミノメーターを用いて捕捉できる生物発光「グロー」を生成し、ルシフェラーゼ発現のレベルを定量化することができます。ここではルシフェラーゼを用いてルシフェラーゼの生理活性を評価し、それに対して、スクランブル siRNA を受ける細胞と比較して、ルシフェラーゼ発現細胞における生物発光の減少を定量化しています。
プロトコル
1. si-NPs の準備と特性評価
- si-NP 準備
- 10 mM クエン酸緩衝液 (pH 4.0) で 3.33 mg/mL でポリマーを溶解させます。ポリマーは、まず溶解を確実にするためにエタノール中の10倍濃度で溶解することができる。
注: ポリマーは、より低い濃度で溶解することができますが、3.33 mg/mL 以上の濃度で使用すると、均質な NP 形成を防ぐことができます。 - SiRNA (diH の50μ m) を加えて、N+:P-比が10になるようにします。ピペットでポリマーと siRNA 溶液を徹底的に混合し、30分間インキュベートします。N+:P 比は、siRNA 上の負電荷リン酸基の数に対する、ポリマー上の正電荷アミン基の数を表し、以下の式によって計算されます。
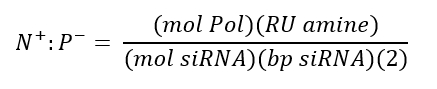
ここで、モル数はポリマーのモル量であり、RU アミンはポリマー当たりの正電荷アミンの繰り返し単位の数であり、mol sirna は siRNA のモル量であり、bp siRNA は siRNA 分子あたりの塩基対の数である。 - 5倍の過剰リン酸緩衝液 (pH 8.0) を加え、ピペッティングまたはチューブを反転させることによって、軽く混ぜる。最終的な pH が中性 (~ 7.2-7.5) であることを確認するには、si-NP 溶液の10μ l を pH テストストリップにピペットで移します。
注: クエン酸およびリン酸バッファーは、Millipore シグマバッファーリファレンスセンターチャートに従って作成されます。
- 10 mM クエン酸緩衝液 (pH 4.0) で 3.33 mg/mL でポリマーを溶解させます。ポリマーは、まず溶解を確実にするためにエタノール中の10倍濃度で溶解することができる。
- Si-NPs の物理化学的特性
- 動的光散乱 (DL) を使用して得られた si-NPs のサイズと表面電荷を記録します。1 mL の si-NPs (0.1-1.0 mg/mL) を0.45 μ m の細孔サイズシリンジフィルターを通して、正方形の石英またはポリスチレンキュベットに濾過することにより、DLS サンプルを準備します。製造元の仕様に従って、DLS インストゥルメントを使用してサイズとサーフェスの電荷の測定値を記録します。
- 透過型電子顕微鏡 (TEM) によるイメージング解析により、si-NPs のサイズと形態を確認します。
- TEM の格子に1つの mg/mL で si-NP 解決の5つのμ l を加え、60 s. ブロットのために3つの s のためにインキュベートしなさい。
- 3% ウラニル酢酸塩溶液5μ l を加え、20秒間インキュベートします。乾燥の下で一晩乾燥したグリッドで乾燥させます。
- 使用される特定の顕微鏡のために確立される議定書に従うイメージの格子。
- アガロースゲル遅延を用いて様々な N+:P 比で si-NPs における siRNA のローディングを特徴付けます。
- 2% のアガロースゲルを製造するには、pH 8.0 で 2 g の電気泳動グレードアガロース粉末を 100 mL (トリス-アセテート-EDTA) バッファーに追加します。アガロースを懸濁させる。すべてのアガロースが溶解するまで、マイクロ波で熱が漏れた (1-3 分)。
- 一度冷却し、5μ l の臭化エチジウム (H2o/mL) を加え、よく混ぜる。アガロースをゲルトレイに注ぎ、蓋をして井戸を生産し、30分間乾燥させます。慎重に負荷ウェルの後ろに残して櫛を取り外し、1x テコンドーバッファーで最大充填ラインにゲルトレーを充填します。
- (上記の手順に従って) 0、1、2、5、7、10、20、および 40 N+:P 比で Si- NPs を生成します。各 si-NP 製剤についてパラフィン皮膜上に2μ l のローディング染料 (SDS および還元剤なし) を配置する。ピペットによってパラフィンフィルムのローディングの染料との si-NP 解決の10μ l を混合しなさい。
- Si-NP/ローディング色素溶液をアガロースゲルウェルに添加します。35 min のための 100 V の電圧源を動かしなさい (またはサンプルがゲルの長さの 80% を横断するまで)。
- 製造元の仕様に従って、UV トランスイルミネータの siRNA バンドを可視化します。
- 透過型電子顕微鏡 (TEM) によるイメージング解析により、si-NPs のサイズと形態を確認します。
2. si-NPs のインビトロ生理活性の測定
- モデル遺伝子ルシフェラーゼのノックダウン
- (上記の手順に従い)、スクランブル siRNA 配列をコントロールとして使用して、ルシフェラーゼ siRNA とスクランブルされた si-NPs を使用して、ルシフェラーゼ si-nps を生成します。Formualte は、同じ最終 N+:P 比で、およびアガロースゲル遅延研究によって同定された最適比率で両方の si NPs を検出します。SiRNA 配列の例は、材料の表に含まれています。
- 96の種子ルシフェラーゼ発現細胞「MDA-MB-231/ルシフェラーゼ (Bsd) 安定した細胞」は、ウェルあたり2000細胞の密度で、十分に黒い壁プレートを備えています。インキュベーター内でフルメディア (DMEM、10% FBS) に一晩付着させることができます (37 °c、5% co2、95% 湿度)。
- 1ウェルあたり100μ l、100 nM の siRNA 濃度の最終体積で、si-NPs を完全な血清培地に希釈します。Si-NPs と24時間のセルを扱います。
- 24時間後、処理を除去し、150μ g/mL ルシフェリンを含む完全な血清培地で培地を交換します。メーカーの仕様に従ってプレートリーダーまたはインビボ光学イメージングシステムで発光を測定する前に、細胞を5分間インキュベートします。
- ルシフェリンを含む培地を新鮮な完全血清培地に交換し、24時間以上インキュベートします。上記の手順を繰り返し、培地を除去し、150μ g/mL D-ルシフェリンを含む完全な血清培地に交換し、48 h timepoint で発光を測定する前に5分間インキュベートする。
- 長手方向の研究のために、発光を測定しながら無菌条件下で細胞を維持します。ルシフェリンを取り替えた後、測定の間で新鮮な、完全な媒体の文化に続けてください。
注: 適切な siRNA 濃度は、異なる si-NPs および siRNA 分子によって変化します。Endosomolytic コア (例えば、中立的) と polyplexes を使用する場合、100 nM は、通常、細胞によって十分に許容され、> 75% のルシフェラーゼノックダウンを生成します。10 N+:P 比および 100 nM sirna 処理における PEG- DB と sirna の質量比 (26 bp siRNA を想定) は23.3、すなわち 1.0 ng の siRNA ごとに 23.3 NG の peg-db を加えます。例えば、166.5 ng の siRNA に 3.33 mg/mL ポリマーの1.16 μ l を加え、100 nM の96ウェルプレートで1ウェルを治療します (100 mL メディアボリュームウェルあたり)。
結果
インビボ siRNA 送達に対する有効な si-NPs のいくつかの本質的特徴は、適切なサイズ (〜20〜 200 nm の直径)、siRNA パッケージング、および生物活性の遺伝子サイレンシングである。これは完全なリストではありませんが (議論で説明されているように)、これらの基本的な特性は、製剤のさらなるテストを検討する前に確認する必要があります。
図 2は、製剤時の SI-NP サイズおよび表面電荷の特徴付けを図示する。DL および TEM は、si − NP サイズ (両方)、多分散 (DL)、および形態 (TEM) を観察するための相補的な方法として使用される。DLS 測定は、si-NP 1 が平均直径 35 nm、かつ少々歪ん分布が1つのピークの存在によって示され、低い多分散が比較的狭いピーク幅で示されることを示しています (図 2a)。TEM 測定は、DL からサイズ測定を確認し、si-NPs の均一な集団の存在を示唆し、si-NPs の球状形態を明らかにする (図 2c)。Si-NP 2 の DL および TEM 測定は、平均直径 1500 nm の望ましくないサイズ (> 100nm の直径)、マルチモーダルおよび種々集団、および凝集体を有することを明らかにし、明確な粒子形態を形成しない (図 2b、D).Si-NPs 1 と2の両方の表示中立面電荷、ゼロに近い平均ゼータ電位値で示されています (図 2e)。
Si-NPs への siRNA のローディング効率は、アガロースゲル遅延アッセイを用いることが特徴です。非複合体 siRNA は、アガロースゲルを通って移動し、ゲル底部で (臭化エチジウムの結合のために) 視覚化されます。SiRNA をポリマーと複合化して si-NPs を形成すると、アガロースゲルを介した遊走が妨げられ、siRNA がゲルトップ (またはウェルに装填された場所) で可視化します。PEG-DB ベースの si-NPs では、ビスホスホンは、完全なビスホスホンが ~ 10-20 n+:P 比で達成されるまで、 n+:P 比の増加に伴って増加します (図 3)。
ルシフェラーゼは、生物活性をサイレンシングする si-NP 遺伝子の迅速な評価のためのモデル遺伝子として使用されます。プレートリーダーまたはインビボ光学イメージングシステムを介した生物発光測定は、ウェルプレート形式でのルシフェラーゼタンパク質発現の迅速でハイスループットな定量化を可能にします。この技術は、PCR (遺伝子発現) やウェスタンブロット (タンパク質発現) などの従来の分子分析によって遺伝子サイレンシングを分析するよりも、かなり速く、安価で、負担が少ないです。この方法により、ルシフェラーゼを発現する細胞をルシフェラーゼやスクランブルした si-nps (コントロールとして) で処理し、発光シグナルと未処理細胞を比較して% ルシフェラーゼ活性を算出します。生物活性ルシフェラーゼ si-NPs は、図 4の SI-np 1 で見られるように、スクランブルされた SI-np 制御と直接比較すると、% ルシフェラーゼ活性が著しく低下します。これに対して、スクランブル si-NP 制御と比較して% ルシフェラーゼ活性を低下させないルシフェラーゼ si-np (si-NP 2 など) は生理活性とは見なされません (図 4)。多くの場合、48 h は最大遺伝子サイレンシングの時間です (図 4) が、我々は24時間から 240 h の後処理までの時点で重要な遺伝子サイレンシングを観察した。

図 1.ポリマー化学および si-NP 回路図。(A) Si-NPs および賦与中性表面電荷 (peg ブロック) および pH 応答挙動 (DB ブロック) を構成する PEG-DB ジブロック共重合体の化学組成。(B) Si-NPs の自己組織化。PH 4.0 では、DMAEMA の三次アミンが非常にプロトン化されているため、DB ブロックは水溶性です。正電荷 DB ブロック静電的複合体否定的に荷電した siRNA 分子.次いで、pH は、5 pH 8.0 リン酸緩衝液の添加によって〜7.4 に調整され、その結果、si-NPs のコア内の siRNA および DB の DB ブロックおよび隔離の「hydrophobization」がもたらされる。こちらをクリックして、この図の大規模なバージョンをご覧ください。
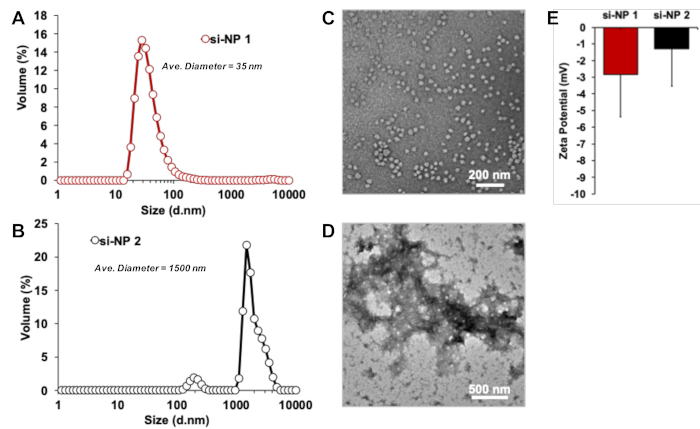
図 2.Si-NP サイズ、表面電荷、形態の DLS と TEM の特性評価。(A、C) SI − np 1 は、適切な大きさ (〜 50-100 nm の直径) を有する均一な試料を表し、一方 (B, D) si − np 2 は望ましくない、大規模で種々凝集体を形成している。(E) 両方の Si-NPs は、ほぼ中立の表面電荷 (ゼータ電位) を表示します。誤差バーは標準誤差を表します。この図の大規模なバージョンを表示するには、ここをクリックしてください。
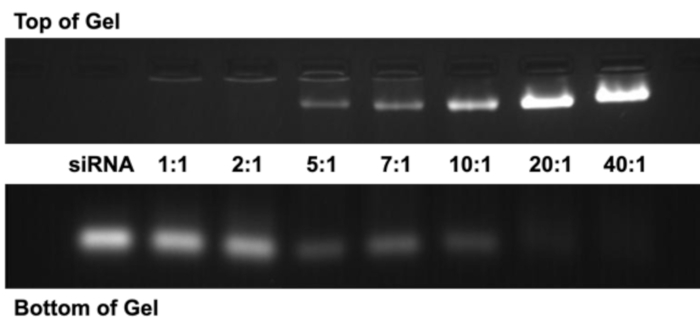
図 3.アガロースゲル遅延アッセイは、si-NP siRNA のローディング効率を評価します。ゲル底部における siRNA バンドの消失は、ポリマーに対する siRNA のビスホスホンを示す。ポリマー複合型 siRNA は、ゲルを介して移行することができず、したがって、負荷ウェルの近くのゲルの上部に可視化される。N+:P 比が増加するにつれて、sirna ビスホスホンは、ゲル底部での sirna バンドの強度の低下によって示されるように増加する。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 4.Si −ルシフェラーゼ MDA-MB-231 細胞におけるモデル遺伝子ルシフェラーゼの a-NP 媒介ノックダウン。(A) 24 h および (B) 48 h でのルシフェラーゼ活性は、10 N+:P 比および 100 nM の siRNA 用量でスクランブルした si -nps またはルシフェラーゼ si-nps のいずれかで処理します。% ルシフェラーゼ活性は、治療試料 (スクランブルとルシフェラーゼ) の発光信号を未処理の細胞の発光シグナルによって割ることによって計算される。注: si − NP 1 は、生物活性の遺伝子サイレンシングを伴う有効な製剤を表し、一方 si-NP 2 は、生物活性を抑制する遺伝子のない製剤を表す。(*) は、所与の timepoint における製剤についてスクランブルされた群と比較して統計的に有意な差 (p < 0.05) を示す。誤差バーは標準誤差を表します。この図の大規模なバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで説明する si NPs は、アニオン性 siRNA とカチオン化ポリマーの静電的な関連によってポリイオン複合体 (polyplexes) に形成される。SiRNA の静電錯化、および PEG − DB ポリマーのカチオン DB ブロックは、低 pH (4.0) で混合することにより促進される。PH 4.0 では、DMAEMA は高度にプロトン化されており、その結果、DB ブロックが高充電されます。これにより、ポリマーが unimers として溶解し、ミセルおよびその DB 複合体を siRNA で効率的に形成するのではなく、溶液中で分解されます。続いて、溶液の pH を中性 (pH 7.4) に調整し、DB ブロックの ' hydrophobization '、ミセル形成、および得られた polyplexes のコア内での複合体化 siRNA の捕捉を引き起こす。これらの polyplexes は、PEG が DB/siRNA コアの周囲に親水性、不活性シェルを形成するように設計されており、全身投与に必要な中性表面電荷をもたらす。ポリマー化学とポリプレックス形成プロセスは図 1に概説されています。
Si-NPs の厳密な物理化学的特性評価は、製剤が生物試験への移行に適しているかどうかを判断するために不可欠です。サイズ、表面電荷、および粒子形状/形態は、生物学的性能に影響を与えることができるすべての重要なパラメータです。腫瘍への全身送達のために、si − NP サイズは、20〜 200 nm の直径22の間に入るべきであり、そして、最も最近の研究は、20〜 50 nm の直径の粒子が理想的である23を示唆している。表面電荷は、タンパク質吸着と opsonization28を最小限に抑えるために中性またはわずかに負でなければなりません。研究は、粒子形状と薬物動態/粒子クリアランスとの間の接続を調査しており、高アスペクト比を有する粒子が球状粒子29、30、31にわたって望ましいことを示唆している。しかし、今日まで球状粒子は依然として最も一般的に採用されており、我々の知識には、腫瘍学においてヒトの研究に翻訳された唯一の粒子形状である。
ここで提示される si NPs のような polyplexes の均一で一貫した形成は、物理化学的パラメータの範囲に依存していることに注意することが重要です。我々は経験的に、ポリプレックス濃度、溶液の pH、およびポリマーと siRNA (N+:P 比) の比率がポリプレックス形成に大きく影響することを経験的に発見しました。私たちの手では、siRNA 濃度はポリプレックス形成に大きな影響を与えませんが、3.33 mg/mL を超えるポリマー濃度を使用すると、大きな凝集体を形成し、ポリプレックスサイズに一貫性がなくなります。これらの si NPs は pH 応答性であるため、si-NP 溶液の最終 pH が酸性 (< pH 7.2) になると、さまざまな問題が発生する可能性があります。これらの合併症を予防する2つの方法は、純粋な diH2O でポリマーを lyophilize することであり、溶解時にバッファー組成を変化させる塩がなく、バッファーを頻繁に再作成して、時間の経過に伴う緩衝 pH の「ドリフト」を防止することです。慎重にするために、バッファーの pH は、si-NPs を作成する前に、毎回確認する必要があり、si-NP ソリューションの最終的な pH は常に検証する必要があります。最後に、si-NPsの N+:P 比は、siRNA のローディング効率とポリプレックス物理化学的パラメータに影響を及ぼします。一般的に、すべての siRNA がロードされる理想的な N+:P 比が存在しますが、ミセルの別々の集団を形成し、細胞毒性を増加させる非複合体化ポリマーの過剰はありません。ここで紹介する si-NPs の N+:P- 10-20 は、最適な整合性とパフォーマンスが観察された範囲です。
ルシフェラーゼレポーター細胞株は、si-NP 生物活性の迅速かつ高スループットの分析のためにここで使用されています。ルシフェラーゼレポーター細胞株は、生物活性分析を開始する前に生成または購入する必要があるため、時間と費用の初期投資が必要です。しかしながら、遺伝子サイレンシングを評価するためにルシフェラーゼレポーター細胞を使用することは、より速く、ハイスループット分析により適しており、RT − PCR (mRNA 発現を測定するため) またはウェスタンブロット (タンパク質発現を測定する) を行うよりも時間をかけて安価である。たとえば、このアッセイでの発光の測定は、RT-PCR またはウェスタンブロットの実行に必要な終日または複数日のプロセスとは対照的に、通常はわずか数分で行われます。さらに、発光測定をウェルプレート上で行うことができ、多くのサンプルを同時に定量することが可能です (96 ウェルプレートが著者によって使用されています)。最後に、ルシフェリンは、上記および典型的な細胞培養試薬を超えて必要とされる唯一の試薬であり、RT-PCR またはウェスタンブロットよりもはるかに安価です。なお、前記ルシフェラーゼレポーター細胞アッセイは、モデル遺伝子ルシフェラーゼの遺伝子サイレンシングのみを評価することに限定されており、対象となる他の「治療遺伝子」の遺伝子サイレンシングを測定することはできません。したがって、著者らは、目的の治療遺伝子の遺伝子サイレンシングを評価するために RT − PCR および/またはウェスタンブロットが使用されたいくつかの研究を読者に紹介しています24、32、33、34。
生物活性に加えて、研究者は、理想的には、si-NP 性能を特徴付けるために、インビトロ生体試験の包括的な域を検討すべきである。上記のルシフェラーゼアッセイは、スクランブルされた si-NP 処理細胞の発光シグナルと未処理の細胞とを比較することによって、細胞の生存率を評価するために使用することもできます。SiRNA は非標的配列であるため、発光の変化は細胞生存率に対する si-NPs の非特異的影響に起因する可能性があり、この効果は通常、ポリマー化学およびモル量に依存します。フローサイトメトリーおよび蛍光顕微鏡の技術は、蛍光標識された Sirna、ポリマー、またはその両方を使用して、si-NPs の細胞の取り込みを評価するために使用できます。さらに、ステムループ PCR やアルゴノウト2免疫沈降などの分子技術を使用して、細胞内の siRNA レベルを正確に測定することができます。SiRNA は、それが RISC にロードされた細胞質に送達する場合にのみ、生物活性であるため、si-NPs は、セルによって内在化した siRNA のエンドソームを誘発する必要があります。エンドソームエスケープを実験的に測定するために用いられるアッセイは、赤血球溶血アッセイ (エバンス et al.35によって詳細に説明される)、蛍光標識された SI-NP 貨物の共局在と LysoTracker36最も最近では、ガレクチン8の動員の蛍光画像化はエンドソーム小胞37、38に穿刺した。データを収集し、細胞の生存率、細胞の取り込み、エンドソームの脱出、および生物活性のためのインビトロの実験からの結果を合成することは、解釈を描画するための情報の研究者相補的な部分を提供しますsi-NP (in) の有効性についての洞察。
要するに、siRNA を効率的に送達できるナノ粒子は、疾患を治療する大きな可能性を秘めています。例えば、腫瘍学では、癌の進行を引き起こす多くの遺伝子、治療に対する耐性、および転移は従来の薬理学による「undruggable」であるが、siRNA を使用して治療することができた。しかしながら、疾患の動物モデルにおけるそれらの使用のための前提条件は、siRNA 品 (ここでは si-NPs として) は、その安全性および有効性の両方を保証するために広範な物理化学的および生体特徴付けを必要とする。この目的のために、本明細書において、インビトロで si − NPs を生成および特徴付けるための方法を、si − NPs が動物試験に繰り越すための適合性について評価することができることについて説明した。
開示事項
著者らは利益相反の可能性を明らかにしていない。
謝辞
著者たちは、クレイグ・デュヴァルとレベッカ・クックに感謝し、この研究を行うためのデータとラボ・リソースへのアクセスを担当している。著者たちは、ヴァンダービルト研究所 (VINSE) に DL および TEM (NSF EPS 1004083) 装置へのアクセスを感謝している。著者は、大学院研究フェローシッププログラム (NSF # 1445197) を支援するための全米科学財団に感謝しています。著者は、財政支援のための国立衛生研究所 (NIH R01 EB019409) に感謝しています。著者たちは、Congressionally の金融支援研究プログラム (DOD CDMRP OR130302) の国防総省に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 0.45 μm pore-size syringe filters | Thermo Fisher Scientific | F25133 | 17 mm diameter, PTFE membrane |
| 0-14 pH test strips | Millipore Sigma | P4786 | |
| 10x TAE buffer | Thermo Fisher Scientific/Invitrogen | AM9869 | |
| 6-7.7 pH test strips | Millipore Sigma | P3536 | |
| 96-well black walled plates | Corning | 3603 | Tissue-culture treated |
| Agarose Powder | Thermo Fisher Scientific/Invitrogen | 16500 | |
| Citric acid monohydrate | Millipore Sigma | C1909 | |
| dibasic sodium phosphate dihydrate | Millipore Sigma | 71643 | |
| D-luciferin | Thermo Fisher Scientific | 88294 | Monopotassium Salt |
| DMEM | Gibco | 11995065 | High glucose and pyruvate |
| Ethanol | Millipore Sigma | 459836 | |
| ethidium bromide | Thermo Fisher Scientific/Invitrogen | 15585011 | |
| FBS | Gibco | 26140079 | |
| loading dye | Thermo Fisher Scientific/Invitrogen | R0611 | |
| Luciferase siRNA | IDT | N/A | Antisense Strand Sequense: GAGGAGUUCAUUAUCAGUGC AAUUGUU Sense Strand Sequense: CAAUUGCACU GAUAAUGAACUCCT*C* *DNA bases |
| MDA-MB-231 / Luciferase (Bsd) stable cells | GenTarget Inc | SC059-Bsd | Luciferase-expressing cells sued to assess si-NP bioactivity |
| monobasic sodium phosphate monohydrate | Millipore Sigma | S9638 | |
| Scarmbled siRNA | IDT | N/A | Antisense Strand Sequense: AUACGCGUAUU AUACGCGAUUAACGAC Sense Strand Sequense: CGUUAAUCGCGUAUAAUAC GCGUA*T* *DNA bases |
| square polystyrene cuvettes | Fisher Scientific | 14-955-129 | 4.5 mL capacity |
| TEM grids | Ted Pella, Inc. | 1GC50 | PELCO Center-Marked Grids, 50 mesh, 3.0mm O.D., Copper |
| Trisodium citrate dihydrate | Millipore Sigma | S1804 | |
| uranyl acetate | Polysciences, Inc. | 21447-25 |
参考文献
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Elbashir, S. M., et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 411 (6836), 494-498 (2001).
- Soutschek, J., et al. Therapeutic silencing of an endogenous gene by systemic administration of modified siRNAs. Nature. 432 (7014), 173-178 (2004).
- Hannon, G. J. RNA interference. Nature. 418, 244 (2002).
- Dykxhoorn, D. M., Palliser, D., Lieberman, J. The silent treatment: siRNAs as small molecule drugs. Gene Therapy. 13 (6), 541-552 (2006).
- Wittrup, A., Lieberman, J. Knocking down disease: a progress report on siRNA therapeutics. Nature Reviews Genetics. 16 (9), 543 (2015).
- Li, H. E., Nelson, C. C., Evans, B., Duvall, C. Delivery of Intracellular-Acting Biologics in Pro-Apoptotic Therapies. Current Pharmaceutical Design. 17 (3), 293-319 (2011).
- Bartlett, D. W., Davis, M. E. Effect of siRNA nuclease stability on the in vitro and in vivo kinetics of siRNA-mediated gene silencing. Biotechnology and Bioengineering. 97 (4), 909-921 (2007).
- Zuckerman, J. E., Choi, C. H., Han, H., Davis, M. E. Polycation-siRNA nanoparticles can disassemble at the kidney glomerular basement membrane. Proceedings of the National Academy of Sciences USA. 109 (8), 3137-3142 (2012).
- Dominska, M., Dykxhoorn, D. M. Breaking down the barriers: siRNA delivery and endosome escape. Journal of Cell Science. 123 (Pt 8), 1183-1189 (2010).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle–mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638 (2013).
- Sahay, G., et al. Efficiency of siRNA delivery by lipid nanoparticles is limited by endocytic recycling. Nature Biotechnology. 31 (7), 653-658 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nature Biotechnology. 33 (8), 870-876 (2015).
- Kanasty, R., Dorkin, J. R., Vegas, A., Anderson, D. Delivery materials for siRNA therapeutics. Nature Materials. 12 (11), 967-977 (2013).
- Adams, D., et al. Patisiran, an RNAi Therapeutic, for Hereditary Transthyretin Amyloidosis. New England Journal of Medicine. 379 (1), 11-21 (2018).
- Dang, C. V., Reddy, E. P., Shokat, K. M., Soucek, L. Drugging the 'undruggable' cancer targets. Nature Reviews Cancer. 17 (8), 502 (2017).
- Alexis, F., Pridgen, E., Molnar, L. K., Farokhzad, O. C. Factors affecting the clearance and biodistribution of polymeric nanoparticles. Molecular Pharmaceutics. 5 (4), 505-515 (2008).
- Verbaan, F. J., et al. The fate of poly(2-dimethyl amino ethyl)methacrylate-based polyplexes after intravenous administration. International Journal of Pharmaceutics. 214 (1-2), 99-101 (2001).
- Lv, H., Zhang, S., Wang, B., Cui, S., Yan, J. Toxicity of cationic lipids and cationic polymers in gene delivery. Journal of Controlled Release. 114 (1), 100-109 (2006).
- Shi, J., Kantoff, P. W., Wooster, R., Farokhzad, O. C. Cancer nanomedicine: progress, challenges and opportunities. Nature Reviews Cancer. 17 (1), 20 (2016).
- Torchilin, V. Tumor delivery of macromolecular drugs based on the EPR effect. Advanced Drug Delivery Reviews. 63 (3), 131-135 (2011).
- Duncan, R. The dawning era of polymer therapeutics. Nature Reviews Drug Discovery. 2 (5), 347 (2003).
- Tang, L., et al. Investigating the optimal size of anticancer nanomedicine. Proceedings of the National Academy of Sciences USA. 111 (43), 15344-15349 (2014).
- Nelson, C. E., et al. Balancing Cationic and Hydrophobic Content of PEGylated siRNA Polyplexes Enhances Endosome Escape, Stability, Blood Circulation Time, and Bioactivity in vivo. ACS Nano. 7 (10), 8870-8880 (2013).
- Jackson, M. A., et al. Zwitterionic Nanocarrier Surface Chemistry Improves siRNA Tumor Delivery and Silencing Activity Relative to Polyethylene Glycol. ACS Nano. , (2017).
- Akinc, A., Thomas, M., Klibanov, A. M., Langer, R. Exploring polyethylenimine-mediated DNA transfection and the proton sponge hypothesis. The Journal of Gene Medicine. 7 (5), 657-663 (2005).
- de Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Aggarwal, P., Hall, J. B., McLeland, C. B., Dobrovolskaia, M. A., McNeil, S. E. Nanoparticle interaction with plasma proteins as it relates to particle biodistribution, biocompatibility and therapeutic efficacy. Advanced Drug Delivery Reviews. 61 (6), 428-437 (2009).
- Geng, Y., et al. Shape effects of filaments versus spherical particles in flow and drug delivery. Nature Nanotechnology. 2 (4), 249 (2007).
- Chauhan, V. P., et al. Fluorescent nanorods and nanospheres for real-time in vivo probing of nanoparticle shape-dependent tumor penetration. Angewandte Chemie International Edition. 50 (48), 11417-11420 (2011).
- Chu, K. S., et al. Plasma, tumor and tissue pharmacokinetics of Docetaxel delivered via nanoparticles of different sizes and shapes in mice bearing SKOV-3 human ovarian carcinoma xenograft. Nanomedicine. 9 (5), 686-693 (2013).
- Werfel, T. A., et al. Selective mTORC2 Inhibitor Therapeutically Blocks Breast Cancer Cell Growth and Survival. Cancer Research. 78 (7), 1845-1858 (2018).
- Sarett, S. M., et al. Lipophilic siRNA targets albumin in situ and promotes bioavailability, tumor penetration, and carrier-free gene silencing. Proceedings of the National Academy of Sciences USA. 114 (32), E6490-E6497 (2017).
- Williams, M. M., et al. Intrinsic apoptotic pathway activation increases response to anti-estrogens in luminal breast cancers. Cell Death and Disease. 9 (2), 21 (2018).
- Evans, B. C., et al. Ex Vivo Red Blood Cell Hemolysis Assay for the Evaluation of pH-responsive Endosomolytic Agents for Cytosolic Delivery of Biomacromolecular Drugs. Journal of Visualized Experiments. (73), e50166 (2013).
- Werfel, T., et al. Combinatorial Optimization of PEG Architecture and Hydrophobic Content Improves siRNA Polyplex Stability, Pharmacokinetics, and Potency In vivo. Journal of Controlled Release. , (2017).
- Kilchrist, K. V., Evans, B. C., Brophy, C. M., Duvall, C. L. Mechanism of Enhanced Cellular Uptake and Cytosolic Retention of MK2 Inhibitory Peptide Nano-polyplexes. Cellular and Molecular Bioengineering. 9 (3), 368-381 (2016).
- Kilchrist, K. V., et al. Gal8 Visualization of Endosome Disruption Predicts Carrier-Mediated Biologic Drug Intracellular Bioavailability. ACS Nano. , (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved