Method Article
肺葉切除: 形態学的肝再生手術モデル
要約
新生児 (0 日) マウス肝左葉部分切除の新しい方法を紹介します。この新しいプロトコルは、急性肝障害や新生児の設定で傷害応答勉強に適しています。
要約
形態学的器官再生急性組織の損失は下等脊椎動物の間で共通ですはめったに生後哺乳類で観察。70% 肝部分切除後の成人の肝再生の残り葉の代謝活性の回復が負傷した葉の形態と建築の永久的損失のいくつかのレプリケーションによって肝細胞肥大の結果します。ここでは、生理学的環境の再生に資する葉新生児の新しい手術法を詳しく説明します。このモデルは、左葉の頂点と後続の保守的な管理療法の切断を含む、主要な血管と肝臓の化学損傷、再生が発生する生理学的環境を残して結紮術の必要性を欠いています。我々 は、切断中に負傷した肝臓は肥大による臓器再生から代償成長する遷移の少年 (P7-14) マウスでこのプロトコルを拡張します。提示された、簡単な 30 分プロトコルは、再生、哺乳類で、加齢に伴う減少と推定される肝幹・前駆細胞評価のメカニズムを研究するためのフレームワークを提供します。
概要
臓器を再生するまたはの形と機能を復元する能力は、進化の過程で失われる主と考えられています。肥大の波および機能が、その結果、細胞分裂のいくつかのラウンドに終ってすべての残存肝細胞の動員を含む化学または物理的な外傷の急性期後大人の哺乳類の肝臓の再生の可能性が見つかってください。アーキテクチャの異なる器官1,2,3,4,5。最近、研究は生命6,7,8の最初の週内の傷害に新生児の哺乳類の器官の再生応答特性を始めています。これらの研究では、新生児の開発中に負傷したとき特定の哺乳類の臓器が代わりに代償的な成長または線維症7,8形態再生対応を示しています。
最近の研究では、グローバルな構造と機能の両方の再生が早期新生児期6,7,8中に発生することを示しています。確立された肝障害プロトコルを含む化学傷害またはエタノール9,10,11, アセトアミノフェン12,13,14,15 の管理、四塩化炭素16,17,18,1970% 肝部分切除4,20,21, または左の除去と中央の葉。化学管理肝細胞死につながるが、しばしばミクロ構造とマクロ構造はそのまま残ります。形態学上の再生は、肝全体のアーキテクチャが消失しないよう容易にこのコンテキストで勉強できません。70% 肝部分切除は出血を止めるために必要な主要な血管の縫合結紮を伴いますが、血管の永久的な停止、非生理的な環境を残します。さらに、このメソッドは、大人の齧歯動物にのみ使用されています、新生児への応用が技術的に非常に困難であります。これを念頭において、新生児の P0 マウスで左葉の頂点の 20-30% を除去する手法を開発した (図 1 a-1 b)。このメソッドは、手術に保守的な低侵襲、技術的に挑戦し、総発生する再生のための部屋を去る血管の結紮せず形態の損失に 。以下に示す結果のステップバイ ステップ プロトコルできます出生後の人生の初期段階で新生児再生は哺乳類を研究するために新生児マウスに肺葉切除を行う研究者。このメソッドの人生の後の段階の間に、肝臓で使用されることができます再生医療と幹細胞生物学、比較研究に明確なアプリケーションも備わっています。
最も一般的な急性肝障害の研究は、化学的に誘発された損害、成人の肝臓切断または 70% 肝部分切除です。化学的損傷はしばしばアセトアミノフェン、四塩化炭素、またはエタノール、静脈内投与、腹腔内や口腔管理を含み、比較的簡単かつ非侵襲的損傷モデルです。前述したように、肝細胞の細胞死が多くの場合葉質と柔組織構造形態再生についての主張をするが難しく、そのまま化学的損傷の結果。化学的損傷しばしば肝血管を中心にサイトや特定の細胞傷害を研究する有用な手法となって、また困難、血管から遠いことに位置しています可能性があり、可能性があります他の集団全体の臓器レベルで調査するには再生に貢献します。これらの制限にもかかわらず化学的損傷では、有用で関連性高い生理学的損傷モデルがまだ残っています。
大人 70% 肝部分切除は、肝血管の結紮左と中央の葉の除去を含みます。肝切除への応答はよく特徴付けられる: 切断された肝臓 14 日ポスト 70% 肝部分切除は、残り右と尾状葉の肝細胞として元の無傷の葉の著しく異なるアーキテクチャを開発肥大と細胞分裂4、5のいくつかのラウンドを受けます。これは、質量の喪失や機能、構成しますが、2 つの切断された葉を再生成する失敗し、したがって総形態を置き換えません。その結果、70% 肝部分切除への傷害応答は限られた再生と代償成長機構の研究に有用です。
ここでは、我々 は完全に新生児の肺葉切除のためのプロトコルをについて説明します。手順には、適切な動物の選択と準備、手術フィールドの準備、手術と回復が含まれます。最適化、これらの各手順の適応プロトコルのさまざまなアプリケーションの必要があります。
ただし、異なる細胞集団と再生のメカニズムを研究する我々 も使用様々 な Cre をかくまっているマウスを含む様々 なトランスジェニック動物、広く実行して野生型 c57bl/6 j 子犬 (JAX 000664) 上でこのプロトコルを最適化し、CreERT2 遺伝子および/またはノック アドイン (018867, Axin2CreERT2 JAX とSox9CreERT2 JAX 018829) 虹と mTmG システム (R26VT2/GK3などの蛍光レポーターとの組み合わせでR26mT/mG)22,23します。 異なるマウス系統のこの方法を変更する必要が見つかりません、存続の結果または再生の可能性に差は認められなかった。
系統の異なる動物の使用、に加えてまた 4-ヒドロキシ タモキシフェンや 5-エチニル-2 '-デオキシウリジン (EdU) などの小分子を投与した新生児マウスに部分的な小葉肝切除を実行しました。ジメチルスルホキシド (DMSO) とエタノールは、そのコーン油は罹患率の重要な原因が分かった、溶剤として使用されました。それ以外の場合、小分子の腹腔内投与は生存率や再生結果を与えないことがわかった。このプロトコルが再生のさまざまな側面を調査する他の小さな分子用適応されると見込んでいます。
新生児マウス手術は技術的に困難なことができ、動物取り扱いと顕微解剖に特別な専門知識を必要があります。畜産専門知識が母体の共食いを避けるために必要手術後、即時回復期間中に。
プロトコル
すべての動物実験は、評価と認定の研究所動物ケア国際 (AAALAC) とスタンフォード大学実験動物管理パネルのための協会のガイドラインに厳密に従って行われました。ケア (APLAC) (プロトコル番号 #10266) アメリカ合衆国やヨーロッパの動物福祉法ディレクティブ 2010年/63/EU。プロトコルはドイツ、バイエルン州政府の動物実験の倫理委員会によって承認され、ない許可を受け取った: 55.2-1-54-2532-150-2015。
1. 動物の準備
- 加熱パッドの適切な寝具を備えた空のケージを準備します。
- 手袋で動物に触れる、前に手袋の上に母親の寝具をこする。
- 空のケージに、母親との場所からすべての子犬を削除します。母のベッドの一部を取り外し、子犬と空の檻の中。
- 手術野から独立した、きれいな、乾燥のケージに母親を配置します。
- 外科分野の準備の前にドン新しい、クリーンな滅菌手袋。
2. 手術フィールドの準備
- 10 mL のピペットを使用して、10 cm シャーレにリン酸緩衝生理食塩水 (PBS) 10 mL を追加します。
- 10 cm シャーレに betadine またはそれと同等の反腐敗溶液 2 mL のピペットします。
- 外科領域に切り裂くスコープを配置します。スコープ ランプを解剖し、外科医の快適さに光のレベルを調整します。子犬は、解離の範囲ランプの下に手術のフィールドに配置できます。子犬の腹側表面に影の有無によっては、十分な光を確認できます。
- イソフルラン麻酔室を準備 (材料表参照) 鼻の円錐形の。商工会議所は、尿または糞便の証拠せず洗浄する必要があります。外科領域に切り裂くスコープ下鼻の円錐形と関連付けられているチューブを配置します。酸素と鼻の円錐形にのみイソフルランのフローをそらします。
- およそ 37 ° c. に設定されて加熱パッドと術後回復領域を準備します。術後の回復は、加熱パッドの上に置かれたガーゼの 4 個ので構成されます。可能であれば、母の香りを維持するために尿、糞便、寝具母のガーゼをこする。
注: それは温度を制御しにくく、熱ランプを使用する無分別です。高温は、新生仔マウスの死になります。 - 準備し、オートクレーブとすべての手術器具を滅菌します。必要なツールが含まれて: ミクロ解剖はさみ、ミクロ解剖鉗子、ガーゼ、止血、任意 6-0 モノフィラメント非吸収性縫合糸です。手術器具は、任意のガラス ビーズ滅菌装置と resterilzed をすることができます。
3 肺葉切除
- その戻ると軽くテーピングの場所にその手足鼻の円錐形に置くことで子犬を麻酔します。子犬は、酸素濃度が 5% イソフルランを受け取るべき。
- つま先ピンチ テストによって検証することができますに座って 5 分または適切に麻酔まで子犬を許可します。
- カルプロフェン皮下切開前の 5 mg/kg を注入します。
注: 30 分より貧しい結果を 30 分以上の全身麻酔下での新生児で生じることよりも、全体の手術する必要がありますもはやかかります。縫合糸による皮膚涙を最小限に抑えるため閉鎖前に皮膚の濡れと徹底的なフィールドの準備から手術の長さを最小限に抑えるための対策を講じる。
- 優しく betadine で濡れている小さいガーゼパッドと後部の腹部壁をきれいに。1 分の乾燥に betadine を許可します。
- ミクロ解剖はさみ鉗子と胸郭のすぐ下に左鎖骨 0.5 cm 切開を確認します。優しく鉗子を使用して肌を離すし、腹腔 (参照してください図 1左とセンター) に 2 番目のより深い切開を作る
- 優しく腹腔の左葉の頂点を強制的に戻って、ミクロ解剖ハサミ、鉗子の鈍端を使用して腹部の両側から側圧を適用します。左葉の左の頂点をする必要があります簡単に可視化された (図 1右)。
-
根尖切断し、削除する組織の量の重量を量る。
- 左葉の頂点から組織の希望の金額を切断し微小解剖はさみを使って優しく。
- 1.5 mL チューブに切断された組織の場所は、PBS でいっぱい。分析用天秤を使用して切断された組織の重量を量る (材料の表を参照してください)。
注: はバランスにガーゼや紙の作品を置き、それを風袋します。ガーゼや紙の切断された組織を配置し、その質量を測定します。 - ドライアイス凍結切片の分析のために最適な切削温度 (OCT) 化合物の室温 1 時間で 2% パラホルムアルデヒドで切断領域と場所を修正します。任意の標準のクライオスタットを用いた切断 7-10 μ m セクションによって凍結切片を分析します。
- 腹腔内に左葉を置き換えるガーゼの圧延ピースを使用して、優しく。出血が止まるまでの空洞にガーゼを残してください。
- ガーゼを外し、PBS を浸したガーゼで手術の部位とその周辺を濡れています。
- 実行しているステッチと非吸収性縫合糸、6-0 のモノフィラメント外科サイトを閉じます。腹膜と皮膚は別々 に閉じる必要があります。
注: は、縫合糸による涙を最小限に抑える PBS を浸したガーゼで優しく皮膚をぬれ可能性があります。 - 優しくは徹底的に PBS を浸したガーゼで子犬をきれいにし血液や betadine の遺体がないことを確認します。浸したガーゼのパッドと傷印血や betadine をきれいにやさしくスクラブします。
注: これは、母は不十分な清掃される場合子犬を共食いが特に重要です。 - 鼻の円錐形から子犬を外し、母の糞便および尿中にさらされているガーゼのパッドを含むリカバリ領域の上に置きます。子犬が回復、空の檻の中の子犬を母のベッドに置き換えます。
注: は、熱ランプを使用しないでください。熱ランプの使用は、過熱する新生児を可能性があります。 - 子犬の必要な数の手順を繰り返します。すべての子犬を使用できますが、一般的に運営の子犬と一緒に交換する床上でないいくつかの子犬を残すことをお勧めです。
- 母親の檻の中で母親の寝具で同時にすべての子犬を置き換えます。
4. 回復と分析
-
マウスを毎日フォロー アップ。
- 傷口が閉じられてを確認し、存在する場合任意の死んだ子犬を削除します。
- 傷が再開する場合、以前記述、および繰り返し手順 3.12 3.8 として外科サイトとリカバリ領域を準備します。
- 手順 carpofen 皮下 24、48 h の 5 mg/kg を注入します。
- 56 日以上の子犬に従ってください。
- 安楽死は二酸化炭素 (CO2) 露出と頚部転位によって術後日の必要な量の後。
- 誘導にマウスを配置/安楽死室とマウスまで CO2の有効化は、呼吸を止めます。
- 頚部転位により安楽死を確保します。前面の指と親指を使ってマウスの背首に押し下げ、尾にプルダウン他の手を使用して。
-
全体肝en のブロックを削除し、それの重量を量る。
- 慎重に各葉を分離し、個別に重量を量る。
注: は、横隔膜と肝とポータルの血管を細かくして肝臓を削除します。その近位添付ファイルで各葉を慎重に解剖して互いの葉を区切ります。
- 慎重に各葉を分離し、個別に重量を量る。
- 肝臓全体の質量に切断された左葉の質量を比較することにより再生の範囲を決定します。無傷の左葉は肝臓全体の約 30% です。
結果
図 1 aの詳細 (図 1 bの図)、新生児の部分的な肺葉切除の一般的なタイムラインと再生が観察されるまでに待機する時間の長さの予想値。左葉の微妙な再生は、観測された 7-14 日ポスト手術をすることができます。56 日後に手術後、完全に再生がしばしば観察されました。マウスは、生理学的異常の兆しを手術後見る必要があります。
部分的な小葉肝切除を受けているマウスは 2、7、14、35 のためのリカバリと 56 日を許可されました。ヘマトキシリンとエオシン (H & E) 回復後これらのマウスから負傷した左葉の図 2のとおりです。特に、56 日後切断された左葉はコントロール、無傷の葉と区別がつかない見えるかもしれません。P14 若年マウスを比較のため行われ、7 の回復を許可でできている外科、14、56 日ポスト手術 (図 S1)。
45 マウス新生児再生を特徴付ける、0 日目に肺葉切除を施行したし、その葉は、56 日間を撮影したすべての大衆ポスト手術。負傷した左葉の質量は、他の無傷の中央、右と尾状葉 (図 3 a)、P56 で無傷の左葉の塊に近づいている無傷のコントロールと比較した場合の質量増加変化を遂げた。これは次の新生児肝左葉をローカライズするとその再生を示します。若年マウスを左葉と無傷の葉 (図 3 b) から増加補正減少再生を示した、比較のため行った P14 でできている外科は 14 日、急性切除する傷害応答ことを示す葉の特定の再生からグローバル補償に切り替えました。さらに特性は、細胞膜 (図 4 a) を視覚化するアクチン (アクチン) と術後 56 日に負傷したマウスから左の葉の部分を染色によって行われました。エリアの遠位部と近位部損傷の領域には 70% 部分肝切除の後 14 日無傷コントロールと大人の葉と比較されました。無傷のコントロールとしてについて同様の分野を持っている発見された肝細胞再生 (図 4 b) 古典的な 70% 切除を受けている成体未満 × 1.5-2。その肥大しない再生の役割を果たしていないが示唆されました。最後に、新生仔マウスは、0.025 mg 5-エチニル-2'-デオキシウリジン (EdU) 90% の PBS と 10% のエタノールおよび 1、3、5、7、の術後 14 日を注入しました。マウスは 7 日後まで手術 (図 4) を回復させてから EdU 陽性細胞数を数えました。エドゥ陽性細胞数の大幅な増加は、細胞増殖が新生児の再生に寄与することを示す、無傷のコントロールと比較して負傷した再生の左葉で発見されました。
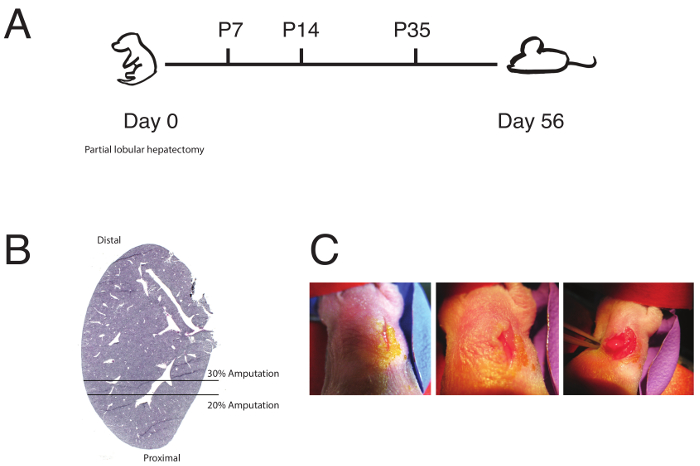
図 1: 部分的な肺葉切除概要。(A) P0 で新生児肝切除と一般的な回路図と肺葉切除のタイムラインが表示されます。P7、P14、P35、または P56 で解析が行われました。切除は、P7、P14 も試みられました。読み手 20 と 30% 切除境界を定める、左葉切除範囲の (B) の回路図を示します。(この図は、ツァイらから変更されている)6。 新生児手術を見せてから (C) の画像: 右サイド鎖骨切開 (左、中央) と左葉頂 (右) の露出。この図の拡大版を表示するのにはここをクリックしてください。
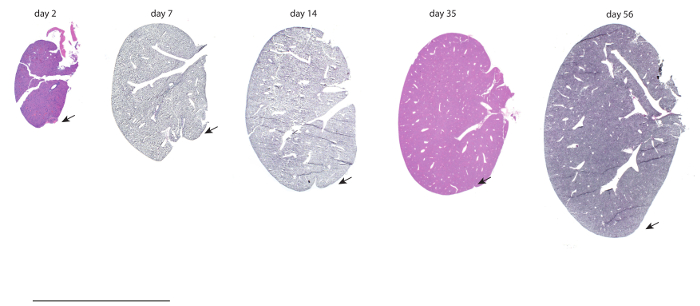
図 2: 肺葉切除後再生します。P0 で部分的な小葉肝切除を受けているマウスは 2、7、14、35、56 日間続いていた。肝臓は固定され、H & E 染色し、左尖部の再生の範囲を認めた。矢印は、P0 マウスで再生が起こった区域を示します。スケール バーは、1 cm です。Tsaiらからこの図が変更されました。6この図の拡大版を表示するのにはここをクリックしてください。

図 3: 次の肺葉切除葉ごと再生します。(A) マウス P0 で受けている部分的な小葉肝切除手術後 7、35、56 日間で行った。マウスを安楽死させ、負傷したマウス (レッド) からすべての葉の塊の撮影されたし、無傷コントロール (赤) の一致した大衆を年齢と比較しています。(B)P14 で部分的な小葉肝切除を受けているマウスを術後 7、35、56 日間で行った。負傷したマウス (レッド) からすべての葉の塊の撮影されたし、無傷コントロール (赤) の固まりと比較しています。* = p < 0.05 * * p < 0.005 を = * * * p < 0.0005、NS を = = 重要ではないです。この模様入りは Tsaiらから変更されています。6この図の拡大版を表示するのにはここをクリックしてください。

図 4: 再生ポスト肝の特性。(A) マウス P0 で受けている部分的な小葉肝切除を切除後、56 日を分析し、F-アクチンのステンド グラスします。70% 肝部分切除後 14 日近位と年齢をマッチさせた無傷コントロールから切断、同様の領域に遠位領域からは成体マウスの汚れの画像のとおりです。スケール バーは、100 μ m (B) 地域肝切除術サイトへの近位または遠位区域での負傷、次の無傷のコントロールおよび大人の 70% の部分的な hepatectomies.* から肝細胞の領域に比較したp < 0.05 = * * = p< 0.005、* * * = p < 0.0005 * * * p < 0.00005、NS を = = 重要ではないです。P0 で小葉肝切除を受けている (C) マウスはエドゥと扱われ、術後 7 日間行った。左葉のエドゥ+のセルが表示されます。(スケール バー、100 μ m)。(D) EdU 定量化+は、EdU 7 と次のコントロールと比較して肺葉切除 14 日投与したマウスのセルします。値は、平均 ± SEM.これを理解されて、Tsaiらから変更6この図の拡大版を表示するのにはここをクリックしてください。
S1 を図: 若年マウスの不完全な再生します。P14 で部分的な小葉肝切除を受けているマウスは 7、35、56 日間続いていた。肝臓は固定され、H & E 染色し、左尖部の再生の範囲を認めた。矢印は、P0 マウスで再生が起こった区域を示します。スケール バーは、1 cm です。これを理解した Tsaiらから6このファイルをダウンロードするここをクリックしてください。
ディスカッション
急性肝障害は、化学 (アセトアミノフェン、エタノール、四塩化炭素)、または外科的モデル (70% 肝部分切除) を使用して伝統的に研究されています。70% 肝部分切除後再生応答は、グローバル肝細胞肥大や複数回の細胞分裂4,5の特徴づけられています。出血を止め、しかし、このモデルに制限が再生のための異常な環境を残した主要な血管を結紮する必要があります。多くの研究はそのために発生する再生のための場所の総建築を残して、化学的損傷を外傷急性期の他の低侵襲モデルを採用しています。最近、Porrelloらとチャンらは、心、桁のヒント、および耳7,8急性傷害後著しく異なって新生児再生応答を実証しています。彼らの結果を並列表示の結論は、肝がまた新生児の生活6の異なる再生現象を受けます。主要臓器における複数同じような所見と出生後の開発の初期の段階で再生幹細胞生物学のための潜在的な意味を持つ新興分野であります。
新生児部分的な小葉肝切除から早期死亡はしばしば不十分な回復、主要な出血、または母親の怠慢から来ています。述べたように以前は、回復のための熱ランプなど高強度熱ソースの使用、術後死につながる可能性があります。新生仔マウスは、人生の最初の 2 週間、少なくとも母親に依存しています。同時に母がしばしば無視や彼女の感覚異常 (血液または他の化学薬品の香り) など24,25場合彼女の若者を共食い。したがって、新生児が徹底的に手術後掃除され、任意の不快な香りをマスクする母体の寝具でこすったこと非常に重要です。これらの問題を適切に対処、生存率は 100% を達することができます。母体の共食いが問題になる場合、子犬は彼女自身の子犬いくつかの代理母とケージに配置できます。この場合は、前の手順で代理母の寝具を使用します。
新生児の左葉とそれに続く再生の 20-30% の切除はほとんどない左葉のみに固有のものです。現在、このメソッドは、中央値を公開すると、左側にのみテストされていますより多くの後部右と尾状葉大きな開腹手術を施行し、出血のリスクが高いと、間接的に母体の共食いのリスクが高い結果が必要になる、新生児。ただし、新生児の再生のメカニズムが肝臓内で異種かどうかは重要な問題に対処すると他の肝葉を尋問するこの議定書手術調整を行ってくださいので。
これらの新生児肝切除の調査からの結果は、再生が発生することができる期間 (P0 P7) を示しています。同様の肝切除は若年マウス (P7、P10、P14) に行われているし、実証傷や線維化、マーキング、切断が発生した明確な領域と完全に再生で起因しません。肺葉切除した若年マウスの傷害応答は初期の研究では、新生児と若年マウスと臓器や組織を再構成する能力の損失との間の再生の可能性に疑義の焦点ではないが建築はどの機構幹または前駆細胞による新生児の再生が発生するを理解するため不可欠になります。
以前新生児再生肝臓だけでなく建築と構造で同じように表示、また関数によって区別されていないを確認しました。蛍光は、グルタミン合成酵素 (GS)、carbamoylphosphate 合成酵素 (CPS)、チトクローム p450 2E1 無傷の葉と比較して再生領域内で似たような分布を示すよう機能肝酵素の汚れ。ただし、再生成された新生児の二次再生可能性がテストされていません。56 日間の回復を許可する新生児マウス、無傷のコントロールから生理学的区別大人 70% 肝部分切除に続く古典的な再生応答が起こるそうです。しかし、この肝再生は、しばしば肝細胞枯渇による制限、したがってシリアル肝切除部分の小葉肝切除に続く重要な研究になります。
開示事項
著者の開示があります。
謝辞
我々 は H & E と組織; 実行するため P. 朱に感謝します。C. 王と役に立つ議論のため A. マッカーティ。研究は、がん研究のためのバージニアと d. k. ルートヴィヒ基金から資金をサポートされていました国立心臓、肺、血液研究所 (R01HL058770 および U01HL099999)。フジテ Y.R. 再生医療 (RC1 00354) 助成金のためのカリフォルニア協会に支えられた人間フロンティア科学プログラム キャリア開発賞 (CDA00017)、ドイツ研究振興協会 (RI 2787/1)、Siebel の幹細胞研究所と、トーマスとステイシー Siebel 財団 (1119368-104-GHBJI)。J.M.T. は、新しいアメリカの NIH (T32GM007365)、国立研究サービス賞 (1F30DK108561) とポールとデイジー ソロス交わりによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Animals | |||
| Mother with litter of day 0 neonatal pups (any strain) | |||
| Surrogate mother and surrogate litter (optional) | |||
| Name | Company | Catalog Number | Comments |
| Standard Reagents | |||
| Phosphate Buffered Serum (PBS) | |||
| Providine-iodine or equivalent antiseptic solution | |||
| Name | Company | Catalog Number | Comments |
| Surgical Equipment | |||
| Dissecting microscope | Zeiss | ZEMSDV4L MFR # 435421-9901-000 | |
| 3mm straight spring micro scissors | Vannas | 72932-01 | |
| 5SF Forceps | Dumont | 11252-00 | |
| Straight Kelly forceps | Grainger | 17-050G | |
| Heating pad | Sunbeam | 000771-810-000 | |
| Isoflurane | Abbott Labs | 0044-5260-05 | |
| Rodent Anesthesia System | Kent Scientific | 1205S | |
| Gauze, 10.16 x 10.16cm | Fisher Scientific | 13-761-52 | |
| Name | Company | Catalog Number | Comments |
| Standard Equipment | |||
| 1.5ml microcentrifuge tube | Eppendorf | 22363204 | |
| 6-0 monocryl sutures | Ethicon | MCP489G | |
| Petri dish | Fisher Scientific | S35839 | |
| Pipet-Aid, Plain, 110V | Drummond | 4-000-110 | |
| Mettler Toledo NewClassic ME Analytical Balances | Fisher Scientific | 01-912-402 | |
| Low Cost Induction Chamber | Kent Scientific | SOMNO-0730 |
参考文献
- Michalopoulos, G. K., DeFrances, M. C. Liver Regeneration. Science. 276 (80), 60-66 (1997).
- Ponfick, V. A. Surgery of the Liver. Lancet. 1, 881(1890).
- Higgins, G., Anderson, R. M. Experimental Pathology of the liver. Restoration of the liver of the white rat following partial surgical removal. Arch. Pathol. 12, 186-202 (1931).
- Miyaoka, Y., et al. Hypertrophy and unconventional cell division of hepatocytes underlie liver regeneration. Curr. Biol. 22, 1166-1175 (2012).
- Miyaoka, Y., Miyajima, A. To divide or not to divide: revisiting liver regeneration. Cell Div. 8, 8(2013).
- Tsai, J. M., et al. Localized hepatic lobular regeneration by central-vein-associated lineage-restricted progenitors. Proc. Natl. Acad. Sci. U. S. A. 114, 3654-3659 (2017).
- Porrello, E. R., et al. Transient regenerative potential of the neonatal mouse heart. Science. 331, 1078-1080 (2011).
- Shyh-Chang, N., et al. Lin28 enhances tissue repair by reprogramming cellular metabolism. Cell. 155, 778-792 (2013).
- Yin, M., et al. Essential role of tumor necrosis factor alpha in alcohol-induced liver injury in mice. Gastroenterology. 117, 942-952 (1999).
- Gao, B., Bataller, R. Alcoholic liver disease: pathogenesis and new therapeutic targets. Gastroenterology. 141, 1572-1585 (2011).
- Uesugi, T., Froh, M., Arteel, G. E., Bradford, B. U., Thurman, R. G. Toll-like receptor 4 is involved in the mechanism of early alcohol-induced liver injury in mice. Hepatology. 34, 101-108 (2001).
- Coen, M., et al. An integrated metabonomic investigation of acetaminophen toxicity in the mouse using NMR spectroscopy. Chem. Res. Toxicol. 16, 295-303 (2003).
- Oz, H. S., et al. Diverse antioxidants protect against acetaminophen hepatotoxicity. J. Biochem. Mol. Toxicol. 18, 361-368 (2004).
- Ruepp, S. U., Tonge, R. P., Shaw, J., Wallis, N., Pognan, F. Genomics and proteomics analysis of acetaminophen toxicity in mouse liver. Toxicol. Sci. 65, 135-150 (2002).
- Gunawan, B. K., et al. c-Jun N-terminal kinase plays a major role in murine acetaminophen hepatotoxicity. Gastroenterology. 131, 165-178 (2006).
- Manibusan, M. K., Odin, M., Eastmond, D. a Postulated carbon tetrachloride mode of action: a review. J. Environ. Sci. Health. C. Environ. Carcinog. Ecotoxicol. Rev. 25, 185-209 (2007).
- Recknagel, R. O., Glende, E. a, Dolak, J. a, Waller, R. L. Mechanisms of carbon tetrachloride toxicity. Pharmacol. Ther. 43, 139-154 (1989).
- Sell, S. Heterogeneity and plasticity of hepatocyte lineage cells. Hepatology. 33, 738-750 (2001).
- Malato, Y., et al. Fate tracing of mature hepatocytes in mouse liver homeostasis and regeneration. J. Clin. Invest. 121, 4850-4860 (2011).
- Greene, A. K., Puder, M. Partial hepatectomy in the mouse: technique and perioperative management. J. Invest. Surg. 16, 99-102 (2003).
- Kan, N. G., Junghans, D., Belmonte, J. C. I. Compensatory growth mechanisms regulated by BMP and FGF signaling mediate liver regeneration in zebrafish after partial hepatectomy. FASEB J. 23, 3516-3525 (2009).
- Red-Horse, K., Ueno, H., Weissman, I. L., Krasnow, M. A. Coronary arteries form by developmental reprogramming of venous cells. Nature. 464, 549-553 (2010).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A Global Double-Fluorescent Cre Reporter Mouse. Genesis. 605, 593-605 (2007).
- Poley, W. Emotionality related to maternal cannibalism in BALB and C57BL mice. Anim. Learn. Behav. 2, 241-244 (1974).
- Smotherman, W. P., Bell, R. W., Starzec, J., Elias, J., Zachman, T. A. Maternal responses to infant vocalizations and olfactory cues in rats and mice. Behav. Biol. 12, 55-66 (1974).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved