Method Article
高圧低温電子トモグラフィー法によるシアノ バクテリアの DNA 締固めの可視化
要約
このプロトコルでは、シアノ バクテリアの一時的な DNA の締固めを可視化する方法について説明します。同期の栽培、蛍光顕微鏡、急速凍結、高によって監視電圧低温電子断層撮影法を使用します。これらの方法のためのプロトコルを提案し、, 将来のアプリケーションや開発を議論しました。
要約
このプロトコルでは、シアノ バクテリアの一時的な DNA の締固めを可視化する方法について説明します。Dna は、細胞分裂に先立って一部のシアノ バクテリアで発生する最近発見した劇的な細胞質イベントです。ただし、大細胞サイズと過渡の文字のための詳細構造を調べることは困難です。難しさを克服するために最初に、dna は再現性をもってプロデュース シアノ バクテリアにおけるイネカメムシPCC で 7942 各明暗サイクル 12 h を使用して同期の文化。第二に、dna を蛍光顕微鏡による監視および急速凍結によってキャプチャされました。第三に、DNA の詳細な構造最適化セルは高電圧低温電子トモグラフィー法による 3 次元 (3 D) で可視化します。この一連のメソッドは細菌、例えば細胞分裂、染色体分配、ファージ感染などで一時的な構造の調査に広く適用できる、蛍光顕微鏡による監視し直接可視化した。適切な時点で低温電子断層撮影。
概要
Dna は、一部のシアノ バクテリアで確認された劇的な細胞質イベントです。各明暗サイクルで、他の時間で、その外観から明らかに異なっていた光の期間の終わり頃に凝縮 DNAにおける細菌が 12 時間未満を培養したときの1 をポイントします。このプロセスは、Kai タンパク質2に基づく体内時計によって制御されていると言われています。関らは、DNA Hoechst 33342 でステンド グラスが光の期間の終わりの方のs. 細菌細胞で圧縮され、蛍光顕微鏡下で波状棒形状を示した報告しています。圧縮された DNA は、細胞分裂し、最終的に各娘細胞3標準一様分布に戻ったとしてロッドのセンターで 2 つに分けられます。しかし、その一時的な性質と電子顕微鏡用大型構造解析を阻害しました。村田らが同調培養、蛍光顕微鏡、急速凍結、高など、いくつかの方法を組み合わせて電圧電子低温電子トモグラフィー (クライオ HVET)、一時的な DNA 圧縮の構造を同定することに成功しポリリン酸体 (計画)4の動態を含みます。原稿は、実験の手順を組み合わせることにより詳細にこのような難削材の視覚的な説明を提供します。
S. イネカメムシカプセルの形、2 に 5 μ m、0.5 μ m の幅、完璧な DNA 圧縮の長さが非常に短い時間のためにだけ生きているセルに表示されます。したがって、シアノ バクテリアの DNA 成形における構造変化は詳細に知られていなかった。電子顕微鏡によるこれらの構造を調査するために 2 つの主要な技術的な問題を克服するために必要です。近いネイティブ条件で全体の細菌のような厚い標本の観察と他の動的構造の高速の固定です。最初の問題では、電子の非弾性平均自由行程 (平均) は5電子顕微鏡の加速電圧に依存します。300 の透過電子顕微鏡 (TEM) の kV だ未満 350 nm。たとえばときに、氷包埋シアノ バクテリア (試験片厚さ ≒ 600 nm) 200 kv の TEM で観察される (平均 ≒ 250 nm)、細胞内構造が観察することは困難。対照的に、1 MV TEM (平均 ≒ 500 nm) を与えるし、イメージすることができます細胞 (図 1) 全体の細胞質構造の。1 の加速電圧での高電圧電子顕微鏡 (圧電) ソリューションの一部として、このプロトコルでは MV が採用されました。しかし、圧電を実装設備、限られた世界です。可能な代替ソリューションは、またディスカッション セクションで説明します。2 番目の問題は、クライオ電子顕微鏡 (Cryoem) によって解決しました。これに近いネイティブ条件、試料が急速に急速凍結装置を使用して液体のエタンの凍結、瞬間冷凍は修正6の最小値で直接観測で動的な構造を可視化するための強力なツールです。断層撮影と組み合わせることで、傾きシリーズ7から三次元 (3 D) 構造のスナップショットを再構築できます。この実験では、 S のイネカメムシ未満 12 h ごとの明暗サイクル、同期のカルチャを使用して再現した dna と試料の凍結のタイミングは、蛍光顕微鏡下で監視によって決定されました。
ここで説明したアプローチは、細菌細胞、例えば細胞分裂、染色体分配、ファージ感染における動的構造の研究にも広く適応と微生物学的研究に新たな道を開く可能性を秘めています。
プロトコル
1. 同調培養シアノ バクテリアの
- S. イネカメムシPCC 7942 1.5% (w/v) 寒天と 0.3% (w/v) チオ硫酸ナトリウム8を含む (9 cm 滅菌プラスチック シャーレ) での滅菌の BG 11 皿の上の文化.
- 照度 50 Με/m2/s 12 h 光/12 h 明暗周期の対象と成長室 23 ° c のプレートを配置します。
- 週に一度新鮮な BG11 寒天プレートの上にセルを転送します。
注: 寒天の文化の緑バンドとして表示されますこの培養条件下で 1 週間後に積極的に増殖細胞。 - 緑の火炎滅菌ワイヤー ループとストリーク細胞の塊に新鮮な BG11 寒天培地プレート上に細胞を取る。クリーン ベンチでこれを行います。
2. 蛍光顕微鏡による監視
- 6 日間寒天プレート上で培養した細胞を使用して、dna を観察します。細胞を収集板から光の期間の終わりに 0.2 M ショ糖溶液の 1 mL を注ぐによってセルを。繰り返すように、細胞の大部分を集めるセル上に溶液を注ぐします。DNA 染色用マイクロ チューブに中断セル ソリューションを転送します。
- DNA 染色染料 (例えばヘキスト 33342) 500 μ L を最終濃度 1 μ g/mL のマイクロ チューブに細胞懸濁ソリューションのソリューションを追加します。その後、10 分間暗闇の中にチューブをしてください。
- セルを土砂に 2,000 × gで 1 分間遠心します。上澄みを廃棄し、密な細胞懸濁液を取得する 0.2 M ショ糖溶液 10 μ L を追加します。
- スライド ガラスにステンド グラスの細胞を含む溶液 1 μ L を転送、カバー スリップを入れて、100 X と液浸オイルの倍率と対物レンズを使用して UV フィルターを搭載した蛍光顕微鏡で観察。
- DNA 圧縮がこの時点でほとんどの細胞で観察されることを確認し、次に凍結サンプルを準備します。
3. 低温 HVET の凍結サンプル
- 思い切って凍結装置を設定します。液体窒素でタンクを満たすし、テフロン チューブとタンクとチャンバーを接続した後の低温電子顕微鏡室の冷却を開始します。
- 液体窒素温度チャンバー内冷却後、チャンバー内の小さな銅鍋に液体エタンを入力します。液体エタンは爆発的なので操作中に眼鏡を着用します。
- グロー放電ホーリーファイバー炭素コーティング EM の炭素側 30 のグリッド (ホーリーファイバー グリッド) 50 s mA プラズマ イオン被を使用します。
- BSA ゴールド トレーサーの 1 μ L を適用 (15 nm) 画像マーカとしてホーリーファイバーのグリッドに。
- DNA 圧縮段階で細胞の 2.5 μ 因数をホーリーファイバーのグリッドに適用されます。フィルター ペーパーで余分な溶液をしみ。グリッドをすぐに急落の凍結装置でプランジャーを使用して液体のエタンに突入します。
- 彼らが検査されるまで液体窒素で冷凍のグリッドを格納します。
4. クライオ HVET
- 設定 1 の高電圧圧電 MV。
- 圧電クライオ ワークステーションの内部液体窒素で-150 ° C に冷却用低温試料ホルダーの固定グリッドをマウントし、圧電に読み込みます。氷による汚染を避けるように注意します。
- 1、低倍率で撮像領域を選択 000 X。ユーセン トリック z 軸高さを調整します。
- チルト-60 ° 試料ステージ、傾斜回転のバック ラッシュを取り外します。
- 10 の倍率でターゲット場所の近くフォーカスを調整 000 X。設定、焦点画像からの偏差によって 6 に 10 μ m の焦点の下。イメージング、用量を 2 e-/Å-2に設定または事前の試料が少ない。
- 圧電のイメージ画面で電流密度電子線量を測定します。電子フィルムまたはデジタル カメラのフォーカシングのプロセスのように同じ倍率でイメージを取る。
- 傾斜からの画像収集手動で (4.5) と同様に同じプロシージャによって-60 ° 2 ° から 4 ° の傾斜角度の増分で +60 ° に。
注: 多くの近代的な電子顕微鏡傾斜シリーズの買収はデジタル カメラの組み合わせで自動化します。その場合は、取扱説明書に従ってください。ネガフィルム、完全な強度の開発を使用して開発者のタンクに 20 ° C で 12 分のフィルムを開発し、10 分が 4,000 dpi (0.635 nm/画像をピクセル) の解像度でフィルムをデジタル化の定着で修正フラット ベッド スキャナーを使用しています。デジタル カメラの場合に、次の画像処理手順に直接収集した画像を対象します。必要な場合は、2 〜 4 ビニング (サイズ削減係数) および適切なソフトウェア (例えばImageJ) を用いた中央値フィルターによるイメージのサイズを削減します。
5. トモグラフィー再構成
- 個人から IMOD ソフトウェア9のコマンド"tif2mrc"または"newstack"を使用して画像を傾斜スタックのイメージ ファイルを作る。
- IMOD に絵鞆 GUI ソフトウェアを起動し、画像のパラメーターを設定:ピクセル サイズ、基準径、画像の回転など。スクリプトを作成します。
- 材料のテーブルに記載されているソフトウェアによると個々 のプログラムを実行 (、平均残留誤差 0.5 未満) とマーカを使用してフルティルト シリーズを配置場所。最後に、IMOD で SIRT アルゴリズムを用いた 3 D 断層像を再構築します。
- 断層から利益 (率 ROI) の領域を抽出し、ノイズ除去フィルターを用いたノイズ除去: IMOD、エーモン川10、バイラテラル フィルターまたは数理形態学に異方性拡散フィルター フィルター11,等, 適切なパラメーターを持つコントラストを高めるため。
6 興味の機能の分割
注: 以下の手順は、ソフトウェアに使用される (見なさい材料表) に固有、他のソフトウェア パッケージを代わりに使用することができます。彼らのユーザー ガイドを参照してください。
- 3 D ビューアー ウィンドウでアミラ ソフトウェアに断層ファイルを開き、OrthoSlice を生成します。
- セグメンテーション エディター ウィンドウで新しい「ラベル フィールド」を選択して分割ファイルを作成します。
- 関心がある (FOI) 機能の枠線を手動でトレースします。すべての断層スライスを通じて FOI に従ってください。2 番目の FOI の新しい「物質」を作成し、、同じ操作を繰り返します。
- 「SurfaceGen」メニューを選択することによって表面のレンダリングをを生成します。セグメント化されたボリュームを視覚化するには、「SurfaceView」メニューをを選択します。移動、回転、および 3 D ボリュームでズーム、3 D ビューアーのウィンドウのツールを使用します。
- 自動セグメンテーションは、魔法の杖ツールを使用します。オブジェクト、クリックし、表示とマスキング オブジェクトが完全にその機能によって選択されるように値の範囲をカバーするためにスライダーを調整します。
結果
正確な同調培養下 12 h ごとの明暗サイクル、ヘキストの付いた DNA は暗条件 (図 2 a) で標準一様分布を示しています。しかし、それは徐々 に光の期間中にセル内で圧縮、光の期間の終わりに波状棒のような構造 (図 2 b) として表示されます。最後に、ロッドがセンター (図 2 の cの矢印) で分割し、2 つの部分が娘細胞 (図 2 d) に配分されています。細胞分裂後、圧縮された DNA が、すぐに消えるし、DNA が標準一様分布を返します。
Dna の最終段階のセルを含むセルのすぐに転送されたホーリーファイバー グリッド上に、急速な液体エタンの凍結し、冷凍のグリッドは 1 MV クライオ-圧電、シアノ バクテリアなどの内部構造で観察されました。DNA、チラコイド膜層、細胞壁、事業予算、(図 3 a) を凍結の時点で、スナップショットのように登場。多くの細胞は細胞 (図 3 aの白い矢印)、異なる DNA の圧縮を示し正常細胞 (図 3bの白い矢印) から簡単に区別することができます。いくつかは細胞分裂 (図 3 aの黄色い矢印) する前に期待どおりにセルの中央にくびれを出展しました。
3 D 断層の細胞の主要な細胞小器官を分割可能性があります。細胞壁、チラコイド膜層、DNA および事業予算があることができる (図 4) を区別します。特に、圧縮された DNA は、細胞、DNA が低密度材料によって囲まれ、チラコイド膜層が圧縮された DNA の波状棒に沿って歪曲された明確なギャップで区切られました。事業予算の動的挙動が観察された新しく: DNA の細胞を圧縮が大きいに対し、DNA に付着する見られたは多くの小さな事業予算と正常細胞の数が少ない。また、事業予算のほとんどのペアとして登場し、いくつかの DNA が、事業予算からの分離のプロセスのように見えた。これは、DNA 合成に対するリン酸のサプライヤーとして事業予算自体が DNA 複製と機能によって 2 つに分かれていることを示唆しました。
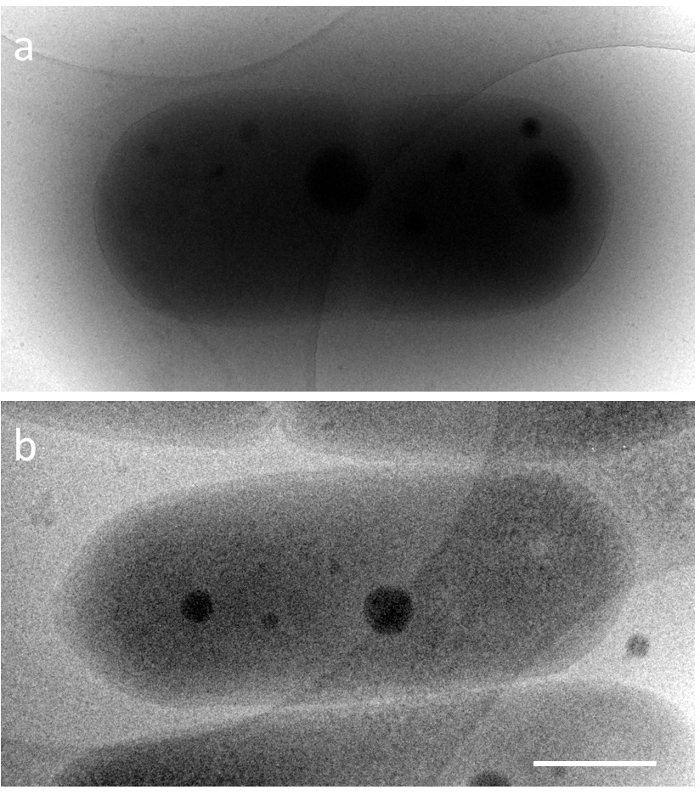
図 1。氷に埋め込まれた通常の藍藻、 S. イネカメムシPCC 7942 加速電圧の低温電子顕微鏡画像。a) 200 kv とb) 1000 kv。スケール バー = 500 nm。この図の拡大版を表示するのにはここをクリックしてください。
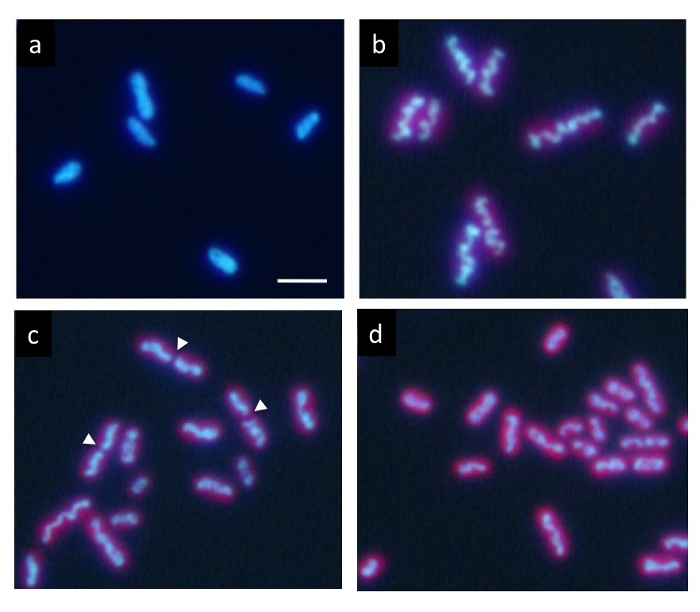
シアノ バクテリアs. 細菌細胞の図 2: 蛍光顕微鏡。同調培養 12 時間の下それぞれの明暗サイクル後、細胞はヘキスト 33342 でよごれていた。(a)セル暗い状態の始まりの 2 h 後表示均一な DNA の分類します。多くの細胞の DNA には、光の期間中に徐々 に凝縮。それは最終的に dna の典型的な太い波状棒(b)を形成しました。このステージの後すぐに細胞分裂(c)、および 2 つのフラグメント間の中心 (矢印) で分割圧縮された DNA の構造は娘細胞に分離(d).娘細胞は均一な DNA は、暗い時代に再びの分類に返されます。スケール バー = 2 μ m.この図の拡大版を表示するのにはここをクリックしてください。
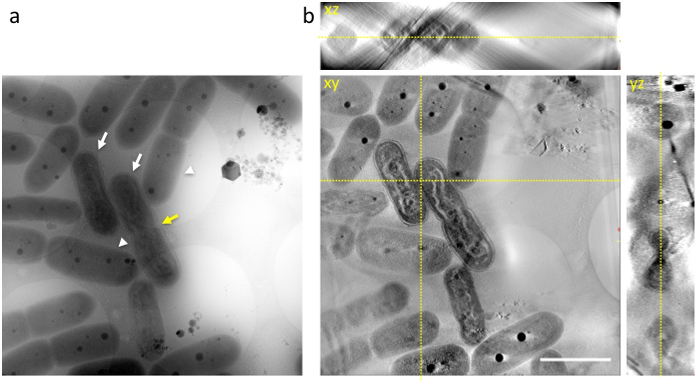
図 3: 非晶質氷に埋め込まれたシアノ バクテリアの低温高圧電子顕微鏡画像0 ° の傾きで raw 画像は(、)示します。画像は、光の期間の終わりに撮影されました。いくつかのセルで表示波状ロッド型 DNA 体真核生物凝縮染色体 (白い矢印) に似ています。正常細胞では、シアノ バクテリアは (白い矢印) 細胞質内で識別可能な DNA の構造を表わします。一部は細胞分裂 (黄色の矢印) する前に期待どおりにセルの中央にくびれを表わします。(b) xy、xz、3 D 断層の yz スライス。黄色の点線は、スライスの交差を表示します。スケール バー = 2 μ m.この図の拡大版を表示するのにはここをクリックしてください。
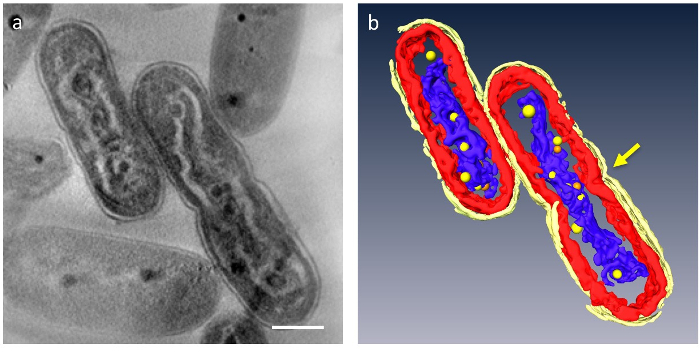
図 4: を含む細胞の微細構造は DNA を圧縮します。主要なコンポーネントは、セグメント化: 細胞壁 (明るい黄色)、(赤)、チラコイド膜、DNA (青)。(a)の 3 D 断層の z スライスを示しています。(b)すべてのセグメント。収縮細胞分離を示すことは、(矢印) のセルの中央に表示されます。事業予算は、黄色またはオレンジ色の球としてモデル化します。それぞれのオレンジ色の球体は、最も近いイエロー球の対応を表します。スケール バー = 500 nm。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
私たちは、シアノ バクテリアの一時的な DNA 締固めを可視化するためのプロトコルの順序を発表しました。基本的な概念は相関光と電子顕微鏡 (クレム)12のそれと似ています。さらに、この方法ではライブのシアノ バクテリア監視され蛍光顕微鏡による、EM グリッド上で急速凍結された、直接高電圧低温電子断層撮影法に可視化します。最初のアプリケーションは、DNA の詳細な構造最適化細菌細胞と正常に 3 D で視覚化されていった。現在、この手順は、このテーマに固有、いくつかのケースで変更された方法論をもっと広く適用されます。ここでは、利点、制限、およびこのメソッドの将来の可能性を説明します。
この方法の利点の 1 つは、セル全体の 3次元可視化です。1 MV 圧電は正常に、動的を可視化した DNA の細胞小器官の構造最適化細胞。ただし、通常細胞内微細構造は、低コントラストのため区別しませんでした。非弾性増加と厚い標本における多重散乱画像13をぼかします。エネルギー フィルターによるフィルター処理ゼロ損失とほとんど考えられる損失のイメージは、非弾性散乱14,15を減らすことによって画像のコントラストを向上できますが、標本平均よりも厚いが動きません。ゼロ損失とほとんど考えられる損失のピークは試料厚さを大幅に減少させます。特に電子機密氷包埋標本の十分な信号対雑音比を得ることが困難です。村田ら示されているその 1 mv 走査透過プラスチックで明視野イメージよりも高いイメージ コントラスト 5 μ m の厚さと酵母細胞を埋め込まれた顕微鏡 (STEM) を与える画像のコントラストが振幅コントラスト13 で与えられる主に.ただしより高い加速された電子に及ぼす波及被害が損傷に敏感な低温電子顕微鏡標本16の線量を照射する別の制限を作成することが期待されます。圧電のボルタとゼルニケ位相板17,18のアプリケーションは、今後、総投与量を減らすことによって波及被害を軽減することがあります。厚い標本の圧電を使用する別の制限は、圧電を提供ユーザー設備が世界的な不足しているという事実から来ています。
300 でクライオ幹トモグラフィ厚い標本を観察する別の方法を使用して kV は厚さ数百ナノメートル19を超える冷凍水和標本でコントラストの高い描写を実証しています。クライオ幹の位相コントラストを取得するには、電子 pthychographic 顕微鏡も導入されています、集光レンズで位相板がピクセル化された 2次元検出器20位相変調回折を入れ替えますを。画像は複数の回折から計算によって取得されます。画像完全に水和凍結試料の凍結試料、クライオ FIB SEM 大規模なネイティブの直接および高速 3 D 低温電子顕微鏡イメージングすることができますも使用21、集束イオンビームを伴うセクショニング シリアルどこと顔画像をブロックが適用されます。これらの技術は、生体試料の表示範囲を拡大、それは、細菌のターゲットの場所を見つけるは難しいのでターゲットは完全に氷の下で、トリミングの前に識別することはできません例えば、細菌というラベルの付いた。
Dna は、シアノ バクテリアの異なる構造体を生成します。DNA は、細胞を圧縮されていない正常細胞に存在する細胞内で大きな密度バイアスによりステンド グラスがなくても容易に区別されます。ただし、セル内のより多くのローカル イベントを視覚化するためには、電子顕微鏡に蛍光に分類された投資収益率を転送する必要です。相関光と電子顕微鏡 (クレム) は、光顕微鏡像と電子顕微鏡像が一般的に相関蛍光ラテックス ビーズや量子ドットを用いた EM ファインダー グリッド12。ラベリングの粒子は蛍光に加えて高電子密度のある必要があります。正確かつ確実に 2 つの画像間の位置を関連付ける彼らができます。さらに、2 つの顕微鏡の間、低温光顕微鏡によるラベル領域を確認することにより ROI の完全な重複を実現できます。Dna の詳細構造イベントの特性より堅牢で正確な相関関係、将来的に必要不可欠なツールこれらの粒子と低温光顕微鏡なります。
この記事は、同調培養、蛍光顕微鏡と高電圧低温電子断層撮影法の組み合わせによるシアノ バクテリアの DNA 締固めの一時的な構造を特徴付ける方法を示しています。このプロトコルは、圧縮された DNA の観察に焦点を当てください。上記その他の新しい技術とこの方法を組み合わせて、さらに詳しく DNA 圧縮のプロセスを調査することが可能であろうし、適切に修正されたメソッドは細菌の他の動的構造のイベントに広く適用されます。
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
著者の原稿、および両方の真子林と慎重に栽培のさゆり萩原批判的・ シアノ バクテリア、画像処理用孝キモリ、Chihong 曲、宮崎直幸、美代子の観測 Tammo Reisewitz に感謝します。構造体の分割を助けるため長吉。この作品は、社長交代するに、生理学的な科学 (生理) の国立研究所の共同研究プログラムによって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Hoechst 33342 solution | Dojindo | 346-07951 | 1mg/mL in H2O |
| Agar Powder (for plant culture) | Wako | 016-11875 | |
| Boric acid | Wako | 027-02192 | 99.5% |
| Manganese chloride tetrahydrate | Wako | 139-00722 | 99% |
| Zinc sulfate heptahydrate | Wako | 264-00405 | 99.5% |
| Sodium molybdate | Wako | 196-02472 | 99% |
| Copper sulfate pentahydrate | Wako | 039-04412 | 99.5% |
| Cobalt nitrate hexahydrate | Wako | 031-03752 | 99.5% |
| Sodium nitrate | Wako | 191-02542 | 99% |
| Magnesium sulfate heptahydrate | Wako | 131-00405 | 99.5% |
| Calcium chloride dehydrate | Wako | 031-00435 | 99.5% |
| Citric acid | Wako | 036-05522 | 98% |
| EDTA-2Na | Dojindo | 343-01861 | 99.5% |
| Sodium carbonate | Wako | 197-01581 | 99.8% |
| Potassium phosphate dibasic | Wako | 164-04295 | 99% |
| TES (Good’s buffer) | Dojindo | 344-02653 | 99% |
| Ferric ammonium citrate | Wako | 092-00802 | 1st Grade |
| Sodium thiosulfate pentahydrate | Wako | 197-03585 | 99% |
| BSA gold tracer 15nm | Aurion | 215.133 | |
| Quantifoil EM grid | Quantifoil MicroTools | R3.5/1 Copper grid | |
| Electron films | Kodak | SO-163 | |
| Developer | Kodak | D19 | |
| Fixer | Kodak | Rapid fixer | Solution |
| Filter paper | Whatman | Grade 1 | |
| Growth chamber | NKsystem | LH-100SP | |
| Fluorescent microscope | Nikon | ECLIPSE 50i | |
| High voltage TEM | HItachi | H1250M | |
| Cryo-specimen holder for HVEM | Gatan | ||
| plunge-freezing device | Leica | EM CPC | |
| Plasma Ion bombarder | Vacuum device | PIB-10 | |
| Liquid nitrogen storage | Taylor-Wharton | 25LDB | |
| Developing tank | Dosaka EM | TB-3-75 | |
| flatbed scanner | Nikon | Coolscan 9000ED | |
| Segmentation software | FEI | Amira | https://www.fei.com/software/amira |
| Tomographic Reconstruction software | eTOMO | http://bio3d.colorado.edu/imod |
参考文献
- Smith, R. M., Williams, S. B. Circadian rhythms in gene transcription imparted by chromosome compaction in the cyanobacterium Synechococcus elongatus. Proc. Nat. Acad. Sci. USA. 103 (22), 8564-8569 (2006).
- Kondo, T. A cyanobacterial circadian clock based on the kai oscillator. CSHS Quant. Biol. 72, 47-55 (2007).
- Seki, Y., Nitta, K., Kaneko, Y. Observation of polyphosphate bodies and DNA during the cell division cycle of Synechococcus elongatus PCC 7942. Plant biol. 16 (1), 258-263 (2014).
- Murata, K., Hagiwara, S., Kimori, Y., Kaneko, Y. Ultrastructure of compacted DNA in cyanobacteria by high-voltage cryo-electron tomography. Sci. Rep. 6, 34934 (2016).
- Koster, A. J., et al. Perspectives of molecular and cellular electron tomography. J. struct. boil. 120 (3), 276-308 (1997).
- Lučić, V., Rigort, A., Baumeister, W. Cryo-electron tomography: The challenge of doing structural biology in situ. J. Cell Biol. 202 (3), 407-419 (2013).
- Murata, K., et al. Visualizing Adsorption of Cyanophage P-SSP7 onto Marine Prochlorococcus. Sci. Rep. 7, 44176 (2017).
- Rippka, R., Deruelles, J., Waterbury, J. B., Herdman, M., Stanier, R. Y. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. J. Gen. Microbiol. 111, 1-61 (1979).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. J. struct. boil. 116, 71-76 (1996).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. J. Struct. Biol. 144, 114-122 (2003).
- Kimori, Y. Morphological image processing for quantitative shape analysis of biomedical structures: effective contrast enhancement. J. Sync. Rad. 20, 848-853 (2013).
- Jun, S., Zhao, G., Ning, J., Ga Gibson, ., Watkins, S. C., Zhang, P. Correlative microscopy for 3D structural analysis of dynamic interactions. J. Visual. Exper. 76, e50386 (2013).
- Murata, K., Esaki, M., Ogura, T., Arai, S., Yamamoto, Y., Tanaka, N. Whole-cell imaging of the budding yeast Saccharomyces cerevisiae by high-voltage scanning transmission electron tomography. Ultramicros. 146, 39-45 (2014).
- Kortje, K. H., Paulus, U., Ibsch, M., Rahmann, H. Imaging of thick sections of nervous tissue with energy-filtering transmission electron microscopy. J. Microsc. 183, 89-101 (1996).
- Bouwer, J. C., et al. Automated most-probable loss tomography of thick selectively stained biological specimens with quantitative measurement of resolution improvement. J. Struct. Biol. 148 (3), 297-306 (2004).
- Egerton, R. F., Li, P., Malac, M. Radiation damage in the TEM and SEM. Micron. 35 (6), 399-409 (2004).
- Danev, R., Buijsse, B., Khoshouei, M., Plitzko, J. M., Baumeister, W. Volta potential phase plate for in-focus phase contrast transmission electron microscopy. Proc. Nat. Acad. Sci. USA. 111 (44), 15635-15640 (2014).
- Murata, K., et al. Zernike phase contrast cryo-electron microscopy and tomography for structure determination at nanometer and subnanometer resolutions. Structure. 18 (8), 903-912 (2010).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of biological cells. Nat. Methods. 11 (4), 423-428 (2014).
- Ophus, C., et al. Efficient linear phase contrast in scanning transmission electron microscopy with matched illumination and detector interferometry. Nat. Comm. 7, 1-7 (2016).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. J. Struct. Biol. 184 (2), 355-360 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved