Method Article
同定と新規リップ-タグ; に遺伝子導入による転移因子の解析RIP tvaマウスモデル
要約
リップ-タグを利用した体細胞遺伝子の転送システムを実証するためのプロトコルを提案します。RIP tvaマウス モデル転移遺伝子の機能を研究します。鳥のレトロ ウイルスは、成体マウスの膵 β 細胞の前癌性、非侵襲的病変への遺伝子導入を確保するため intracardiacally が配信されます。
要約
転移がんは、固形腫瘍患者の死亡の 90% を占めています。がん転移のドライバーを理解して新たな治療標的を識別するために緊急の必要性があります。転移する癌から進行を駆動する分子のイベントを調査して、bitransgenic マウス モデル、リップ-タグを開発します。RIP tva。このマウス モデルでラットのインスリン プロモーター (RIP) は、膵 β 細胞における SV40 T 抗原 (タグ) およびサブグループ (tva) トリ白血病ウイルスの受容体の発現を駆動します。マウスは、過形成、血管新生、腺腫、浸潤癌などの段階で人間の腫瘍に類似している明確に定義された段階で 100% の浸透度を持った膵神経内分泌腫瘍を開発します。リップ-タグ;RIP tvaマウスは、転移性疾患を発症しない、転移を促進する遺伝の変化を簡単に識別することができます。体細胞遺伝子の tva 表現に、前癌病変は膵 β を増殖目的遺伝子変異をかくまっている鳥でレトロ ウイルスの心腔内注射によって実現されます。力価 > 1 x 108感染単位 ml は生体内で感染症の適切なと見なされます。さらに、鳥のレトロ ウイルスリップ-タグで腫瘍由来細胞株に感染します。RIP tva高効率を持つマウス。細胞は、転移性の要因を明らかにも使用できます。ここで我々 はこのマウス モデルを利用し細胞の腫瘍の転移で候補者の遺伝子の機能を評価する方法を示します。
概要
ほとんどの癌は、体細胞変異1から発生します。従来の遺伝子組み換えマウス モデル (ジェム) は、腫瘍2に特定の遺伝子変異の貢献に重要な洞察力を提供しています。ただし、彼らはいくつかの制限があります。これらのモデルの主な欠点は、組織内の一部のセルだけが遺伝の変化を取得する人間の腫瘍の形成の散発的性質を複製しないこと。トランスジェニック、ノックアウト マウスの突然変異生殖開発に影響を与える可能性があります。また、これらマウス モデルの生成は高価で時間がかかるです。
転移は、がんの分野で重要な問題です。転移のモデリングはジェムで難しくなっています。自然転移は、マウスではまれです。浸透度は可変して転移3のジェムで長い待ち時間です。転移の翼列の初期の手順が排除されますので、実験的転移モデルはマウスの循環にセルの直接注入を採用しています。
Bitransgenic マウス モデル、リップ-タグ マウス モデルにおける転移因子を勉強の上記の制限の一部を克服するために開発しました。RIP tva4。戦略は、高い同期腫瘍進行マウス モデル、 RIP タグ5、および受容体サブグループ A トリ白血病ウイルス、tva 6、7の使用を組み合わせることに基づいています。このリップ-タグ;RIP tvaマウス モデルにより、単一の bitransgenic マウス緊張体細胞染色体導入する遺伝子。SV40 T 抗原 p53 および Rb の腫瘍抑制機能を抑制、マウスは過形成、血管新生、腺腫、浸潤癌などの段階で人間の腫瘍と同様の方法で膵神経内分泌腫瘍を開発します。このRIP タグモデルは、がん、膵神経内分泌腫瘍に限定されないの認刻極印の私達の理解に非常に有益されています。また、前臨床試験8で使用されています。
体細胞遺伝子伝リップ-タグに鳥レトロ ウイルス intracardiacally の注入のためのプロトコルを提案します。RIP tvaマウス。RCASBP 由来鳥レトロ ウイルスを感染ターゲットの積極的に増殖の細胞が必要です。したがって、我々 はリップ-タグを選んだRIP tva 7 週齢、膵島の約 50% に過形成を開発するときにマウス。高力価ウイルスの左心室心腔内注射は、10-20 4の感染効率を達成するために必要です。この配信方法は、ウイルス膵島に到達する前に循環内のウイルスの粒子の重要な希釈を低減します。
このアプローチを使用すると、以前 Bcl-xl がその抗アポトーシス機能4,9の独立したがんの転移を促進することを確認しました。Bcl xLリップ-タグに発癌性個体中すべての膵 β 細胞での遺伝子を介して発現していたときこの抗アポトーシス独立転移機能は観察されなかったRIP Bcl xLモデル10をマウスします。したがって、マウス モデルは、ユニークな機会を識別し、特徴付ける腫瘍形成の後の段階で表現される場合に遺伝子の機能を提供しています。小島の 2-4%リップ-タグで腫瘍に発展するのでRIP tvaウイルス感染とすべての前癌病変なし bitransgenic マウスは、RCASBP 由来の鳥のレトロ ウイルスに感染している、癌の自然経過の選択的優位性を与える要因のみを識別できます。特に、転移要因最も簡単に認識されますこのメソッドによって膵リンパ節や他の臓器への転移はリップ-タグで通常発生しませんのでRIP tvaマウス。
プロトコル
倫理ステートメント: 動物実験ガイドラインと動物ケアおよび使用委員会のワイル コーネル医学のための協会によって定められた規則に従って行われた
。1。 鳥 Retroviral ベクトルの選択 (RCASBP A ベースまたは RCANBP(A)-based)
- ベクトルは、ラウス肉腫ウイルス 11 から派生しました。鳥 retroviral ベクトルの Cdna を提供できる (≤ 2.5 kb)、短いヘアピン Rna (Shrna)、マイクロ Rna (Mirna) と他の Rna。市販のベクトルは、資料 に記載されて、他は著者から直接要求する必要があります 。 ノザン興味の遺伝子を 使用して、次のベクトルの 1 つ
- RCASBP(A) 12 ( 図 1 a)、代替服務研究委-X ( 図 1 b) 代替服務研究委 Y 13 ( 図 1)、RCASBP Y DV 14、または他の ALV のベクトル (https://home.ncifcrf.gov/hivdrp/RCAS/mice.html) です 。
- ShRNA が興味の遺伝子をノックアウトする、次のベクトルのいずれかを使用: 〉 X DV 15 または代替服務研究委 RNAi 16.
- ノザン miRNAs に、 17 で説明するように、代替服務研究委・ ミール ベクターを生成します 。
- エシェリヒア属大腸菌 および DNA の要件への変換 。 できれば
- が DNA を直接繰り返し、レトロ ウイルス シーケンスを安定させるためにユニークな遺伝子型がある、Stbl2 または Stbl3 の有能なセルに変換します。浄化、純粋なを生成するメソッドを使用してプラスミッド DNA トランスフェクション グレード DNA。最小濃度 0.1 μ g/μ l の DNA の 5 μ g が必要です 。
2。鶏線維芽細胞 DF1 細胞におけるウイルス増殖
- フィルター ピペット チップの使用細胞培養は、クロス汚染ウイルスを防ぐために必要な株式 18.
- 成長と 6 cm 皿に維持 DF1 細胞培地 (DMEM 高グルコース, 10% 牛胎児血清 6 mM (最終濃度) と L-グルタミン、10 単位/ml ペニシリン、10 μ g/ml ストレプトマイシン) 37 o C と 5% CO 2 で。DF1 細胞が凍結する在庫から解凍が新鮮な場合、トランスフェクション前に少なくとも 3 日間それらを文化します 。
- 、トランスフェクション前日 6 cm 培養皿に DF1 セルを渡すという、トランスフェクションの時点で 30-50% の合流をなります 。
- ティッシュ文化フードの中微量遠心チューブに 150 μ l の総ボリュームに DMEM (血清、ペニシリンやストレプトマイシン) なしに純粋なウイルス DNA の希釈 5 μ g.
- 希薄 DNA チューブに直接 Superfect の追加 30 μ L; 渦この混合物 10 s; トランスフェクション複合体の形成を許可する組織培養で 5-10 分間室温で混合フードを残す 。
- 複合体形成が行われる、優しく DF1 細胞培養ディッシュから成長培地を吸引し、慎重に洗う 4 ml PBS -/- 細胞 。 (血清と抗生物質を含む);
- 成長のピペット 5 ml 中に次のステップのためのファルコン管 4 ml を保存し、トランスフェクション複合体に成長培地 1 ml の残りの部分を追加。上下 2 回、ピペッティングで混ぜるし、DF1 細胞にトランスフェクションの全体の複合体をすぐに転送。渦巻き模様の細胞層が覆われていることを確認するには37 o c 以上で 2-3 時間インキュベート
- トランスフェクション混合物を吸引洗浄 4 ml PBS -/- でセル、新鮮な成長媒体 (血清および抗生物質を含む) の 4 つの ml を追加; 37 o C インキュベーターにセルを返す 。
- 細胞密度に到達、通路 (一過性発現が試金する 48 に 72 h トランスフェクション後) セル 。
- 約 7 日間までのすべてのセルがおそらく感染している細胞を通過、PCR によってウイルスの DNA の統合をテスト; ウェスタンブロット法でタンパク質の発現を確認し続けるし、10 %dmso と 20% 牛胎児血清を DMEM 培地で細胞を凍結します 。
3。生体内でRIP-タグの感染RIP tva マウス
- ウイルス回収・濃縮
使用新鮮な 生体内で 感染症のウイルスを集中。一週間以内 4 o C に保持ウイルスの力価が大幅に減っていません。ただし、ウイルス ストックの冷凍の因数は、融解時に 10 倍の低価を表示します。- 展開ウイルス プロデューサー DF1 細胞に必要なウイルス量に応じて 15 cm 料理。マウス感染 体内 マウスあたり一皿の平均を準備します 。
- 中古ローター (たとえば、SW28)、スイング バケツ、4 o c 以上に遠心機を冷やす
- 収集合流 15 cm 皿から上清。1,650 x g 4 o c 以上で 10 分間で低速の遠心分離によって細胞の残骸を削除
- は、ウイルス上清を超遠心機チューブ (Polyallomer 遠沈管) に転送します。95,400 x g 4 o c 以上で 1.5 時間、超遠心機でスピンします。ベックマン XL 100 超遠心機マシンのアクセルを使用: 1;減速: 1 設定します 。 可能な限り
- 削除遠心上清のチューブ。カルシウムとマグネシウム (PBS -/-) なし一 15 cm 皿から最終的な 100 μ l ウイルス懸濁液を作るための遠心管に PBS を追加します。パラフィルムでチューブをカバーします。ボルテックス、遠心管中速で 2 分間で目に見えないウイルス ペレットを再懸濁します 。
- 4 o C の 1 時間から一晩で超遠心機チューブをロックします 。
- は、ウイルスの懸濁液を遠心チューブに転送します。マウスへの注入前に室温にウイルス懸濁液を温めています 。
- ウイルス力価測定
。 すべての新しいウイルスの構成ウイルス力価は、生体内で 感染前に決定する必要があります。- 12 ウェル培養プレートのすべての井戸の種子 DF1 セル (提案: 2 x 10 4 細胞/ウェル、1 ml/井戸)、感染症の時に 30% の合流すること。1 つ 12 ウェル プレートが 1 つウイルス力価を決定するため必要です 。
- 次として培地に一連のウイルス上清の 10 倍希釈液を作る: 微量遠心チューブに 10 2 希釈用
- 495 ミックス 5 μ l のウイルス上清 μ l 成長媒体。簡単に数秒間渦 。 10 3 希釈用遠心管の 360 μ l 成長培地に
- を 40 μ l、10 から 2 希釈。簡単に数秒間渦 。
- フォロー ステップ 3.2.2.2 10 の 4 と 10 の 5 希釈します 。 最大 6 ml ポリスチレンの 5 セット
- チューブ。2.25 ml を分注チューブとラベルそれら 10 6、10 あたり培 7 10 8 10 9 10 10、それぞれ 。
- ミックス 10 から 0.25 ml 5 希釈 10 6 希釈用 6 ml ポリスチレン管の 2.25 ml 成長培地。簡単に数秒間渦 。
- フォロー ステップ 3.2.2.5 10 7 10 8 10 9、および 10 の 10 倍希釈液 。
- は、12 ウェル プレート上の DF1 のセルから元培を削除します。1 ml の希釈もそれぞれに複製するウイルスを置く (感染、10 10 10 6 IU/ml).
- セルを少なくとも 7 日間 (必要なとき trypsinzation を実行) を育てるようにします。説明するように DNA および PCR によるウイルス DNA の存在を確認するを分離する細胞を収集 " 6。PCR のプロトコル "。場合このウイルス力価10 8 感染単位 (IU/ml) は、10 の細胞から DNA を使用して RCASBP から正 398 bp PCR の製品を観察する 8 10 6 IU/ml ウイルスがないから、感染していない細胞、または細胞 10 10 10 9IU/ml ウイルス。力価 > 1 x 10 8 感染単位 ml 体内 感染される 。
- 心腔内注入
Hemizygous RIP タグ マウス、ないホモ接合体マウスは本研究で使用されます。Hemizygous RIP タグ マウス開発膵神経内分泌腫瘍約 10 〜 12 週齢、ホモ接合体マウスが腫瘍待ち時間が短い。細胞増殖ウイルスの cDNA のホストへの取り込みに必要なためゲノム、7 週齢 RIP-タグ;RIP tva hyperplasic 膵 β 細胞を持つマウスを使用します。成体マウスのほとんどの通常の β 細胞が増殖していないことに注意してください。- 使用 7 週齢 RIP-タグ;RIP tva マウス実験のための純粋な C57BL/C の背景にします 。
- 麻酔マウス ケタミン ・ キシラジンの組み合わせ (150 mg/kg; 15 mg/kg) を使用しています。麻酔の全期間を通してマウスの体温を維持する熱のサポートを使用します 。
- 角膜の乾燥を防ぐために両方の目に目の潤滑剤を適用します 。 RIP-タグの胸の空洞から
- ひげをそる、髪RIP tva マウス。上向きの胸と背中にマウスの位置。完全麻酔効果を確認するための非応答性の動物の観察につま先ピンチを実行します 。
- は、前肢を拡張し、テープで固定します。マークのマウス ' 注射用 s 胸。胸骨切痕と、胸膜の上部中間の場所をマークし、やや左胸骨 ( 図 2) の (解剖学的) です 。
- スクラブ ポビドン ヨード ・ スクラブまたはクロルヘキシジン ・ スクラブで前胸壁に続いて 70% イソプロピル アルコールまたは 70% エタノールに浸したガーゼ スポンジ 。
- 描画 50 μ l 滅菌 28 g ½ インスリンへの空気のシリンジのプランジャーと 500 μ L のシリンジの半月の間にスペースを作成するし、ウイルスの 100 μ l を描きます。壁に任意の液体なし空気スペースが心臓パルスを見るために重要です 。
- 続ける針アップライト。マウスの皮を片方の手で張りつめた握り、マークの場所に針を挿入します。血の明るい赤のパルスは、注射器に表示されたら、針を進めるを停止し、片方の手でマウスで針の深さを修正します 。
- にもう一方の手を慎重に使用して 〜 60 秒の間にウイルス懸濁液 (~ 100 μ l のボリューム) を提供するプランジャーをゆっくりと。注射器で表示される血の明るい赤のパルスを見るたびに、10-20 μ l を提供します。透明な針ハブに赤い酸素血の継続的な入り口は左心室に針の適切な位置を示します 。
- ウイルスの懸濁液を提供し、血の次の赤いパルスを見る前にすぐに胸腔内から針を撤回するプランジャーの最後のプッシュ後 。
- 少なくとも 1 分の出血を減らすために注射部位に穏やかな圧力を適用
- は、慎重に加熱パッドまたは完全に意識するまでの熱ランプの下でマウスを移動します。彼らは刺激から離れて歩くことができるので、麻酔が切れるまで、マウスを見て、約 1 時間が通常持続期間。そのままコートの動作における変更マウスを毎日監視されます 。
4。腫瘍の病理組織学的解析
- 9 週間投与では、16 週齢を安楽死させる RIP-タグ;RIP tva マウス。サイズと主な膵腫瘍とも総転移の数を記録します 。
- 10% の他の臓器、肝臓や膵臓修正バッファー ロッキング プラットフォームに室温でのホルマリン一晩 。
- は、次の日に、70% エタノールに固定組織を転送します。パラフィン埋め込まれたセクションに組織を処理します 。
- 実行免疫組織化学的染色シナプトフィジン (神経内分泌マーカー) またはインスリン (β 細胞特異マーカー) 次のメーカーの ' の膵 β 細胞膵リンパ節の転移を識別するために指示または、肝臓。ただし、脱分化型腫瘍細胞や分化腫瘍細胞インスリン発現を失う可能性があります、シナプトフィジン免疫染色でのみ検出することができます 。
5。体外Tva 発現細胞の感染
の in vitro 感染に集中してウイルスを使用する必要はありません。下記プロトコルは、感染症の 2 つのラウンドです。感染症のさらなるラウンドは次のプロトコルを繰り返すことによって実行できます
。- 収集合流 DF1 細胞からウイルス上清。4 o C が一週間以内の感染でウイルス上清をしてください。感染前にウイルス上清を携帯無料のウイルスを取得する 0.45 μ m のフィルター通過します。 。
- 簡単にリンス tva 表現ターゲット細胞 (すなわち N134 膵 β 細胞腫瘍細胞株 RIP-タグからRIP-tva マウス) トリプシン阻害剤を含む PBS -/- 血清中のすべてのトレースを削除すると。(0.25% トリプシン 2.21 mM EDTA) などトリプシン EDTA 溶液を用いた標的細胞を tva 表現を簡潔にすすいでください。トリプシン EDTA 溶液を追加し、2 分間インキュベートします。プレートを軽くタップします。倒立顕微鏡下で細胞を観察します。セル通常デタッチ 2 に 3 分でシード標的細胞 6 cm プレートに。3 ~ 4 ml は、成長培地としてウイルス上清をフィルタ リングします
。 注: ウイルス上清の栄養は DF1 細胞によって消費される、従って媒体に次の日を変更します 。
- 次の日暖かい室温にウイルス上清の十分な量を。標的細胞からメディアを削除して 3-4 ml ウイルス上清を置き換えます 。
- 3 日目、必要に応じて細胞の通路。細胞継代するのに十分な密度の高い場合は、ウォーム アップ通常培 〜 4 ml (DMEM 高グルコース, 10% 牛胎児血清 6 mM (最終濃度) と L-グルタミン、10 単位/ml ペニシリン、10 μ G/ml ストレプトマイシン) ウイルス上清を交換する 。
- 展開感染細胞とウエスタンブロット 19 による候補タンパク質発現を調べる。Transwell アッセイの候補者の遺伝子の移行および侵入に及ぼす影響を分析できます。これらの細胞は転移の尾静脈アッセイで肝臓への転移能にもテストできます 。
6。PCR のプロトコル
ソリューションは、氷の上できるだけすぐに組み立てられる必要があります。サンプルと検体 PCR チューブに多数のテンプレートを使用しないマスター ミックスが可能です。サンプル数で必要な各試薬の量を乗算します。打つ前に試薬を混ぜるし、マスター ミックスを加えるためのいくつかを取る前にピペット先端部の渦します。マスター ミックス管、ピペット ヒント内の残差を提供する、上下に各試薬を追加した後
。- 感染または transfected セルに RCASBP の存在を検出します
。 次のプロトコルは 11.5 μ L、マスター ミックスのおよび各サンプルの DNA の 1 μ L を求めます。各試薬を追加する前に旋回してください。- 25 mM dNTP の 0.125 μ l、25 mm MgCl 2、1.375 です μ l 1.25 μ 10 x バッファー II AmpliTaq DNA ポリメラーゼの 0.75 μ L DMSO 7.68 μ L ヌクレアーゼ フリー水マスター ミックスを準備します 。
- 100 μ M 前方プライマー RCAS5626F の 0.125 μ L を追加: (5 ' - ACCGGGGGATGCGTAGGCTTCA - 3 ') と逆プライマー RCAS6023R 100 μ M の 0.125 μ L: (5 ' - CCGCAACACCCACTGGCATTACC - 3 ')、マスター ミックスする 。
- 0.075 μ L を追加、マスター ミックスの AmpliTaq DNA ポリメラーゼ 。
- は、指でチューブをフリックすることで、マスター ミックスをミックスします。スピン ・遠心機 briefl の matermix ダウンy 3 〜 5 秒 。
- 個々 のそれぞれに、マスター ミックスから割り切れる 11.5 μ L PCR チューブします。旋回毎に新しい管へ早かった 。
- 旋回し各 PCR チューブに 1 μ L のゲノム DNA のテンプレートを追加します。ゲノム DNA を準備する:
- Lyse 細胞ペレットに 0.05 M NaOH を 200 μ l 添加します。ペレットを溶解するために上下にピペットで移しなさい 。
- 25 に冷却し、細胞 PCR マシンで 20 分 98 ° C までライセートを熱 ° C
- 追加 20 μ L 1.0 M トリス-HCl (pH 7.5) DNA サンプル 4 に格納してもチューブ、° C
- 3 〜 5 秒のフリックと遠心分離機でサンプルを簡単にミックスします。PCR 機にチューブを入れて 。
- PCR 条件を初期変性、30 の 40 のサイクルに続いて 92 ° C で 2 分に設定が s 30 変性 94 ° C で熱処理、30 67 ° c s の拡張のための 72 ° C と最後の拡張のための 72 ° C で 10 m で s 。
- PCR の終了後は、各サンプルに 3 μ L の DNA 読み込み染料 × 6 を追加します。フリックと 3 に簡単に遠心分離機によってミックス 〜 5 秒 。
- PCR の製品は、1 x TAE のバッファーに 2% (w/v) agarose のゲルの電気泳動によってチェックされます。その PCR の製品のサイズは 398 跪く
- タグ ジェノタイピング
。 次のプロトコルをマスター ミックスの 10.5 μ L と 2 μ L の DNA サンプルごとに呼び出します。各試薬を追加する前に旋回してください。- MyTaq DNA ポリメラーゼの 4.5 μ L ヌクレアーゼ フリー水と 4.00 μ L 5 x MyTaq 反応バッファーのマスター ミックスを準備します 。
- 100 μ M 前方プライマー TagF2 0.4 μ を追加: (5 ' - GGACAAACCACAACTAGAATGCAGTG - 3 ') と逆プライマー TagR2 100 μ m 0.4 μ L: (5 ' - CAGAGCAGAATTGTGGAGTGG - 3 ') マスター ミックス 。
- は、10 μ M ベータ 2 ミクログロブリン前駆体 (B2m) プライマー ミックス内部制御のための 0.8 μ L を追加します。PCR のプライマー内部統制、ベータ 2 ミクログロブリン前駆体 (B2m) は、B2m B2 F (5 ' - CACCGGAGAATGGGAAGCCGAA - 3 ') と B2 R (5 ' - TCCACACAGATGGAGCGTCCAG - 3 ').
- 0.4 μ L を追加、マスター ミックスの MyTaq DNA ポリメラーゼ 。
- は、指でチューブをフリックすることで、マスター ミックスをミックスします。マスター ミックス 3 の遠心機でスピンダウン ~ 5 s.
- 個々 のそれぞれに、マスター ミックスから割り切れる 10.5 μ L PCR チューブします。旋回毎に新しい管へ早かった 。
- 旋回し各 PCR チューブに 2 μ L ゲノム DNA のテンプレートを追加します。ゲノム DNA は、前述のように用意しています 。
- は、フリックと遠心分離機によってソリューションを 3 ~ 5 秒間軽く混ぜます。PCR 機にチューブを入れて 。
- PCR 条件 15 35 サイクルに続いて、初期変性 95 ° C で 3 分間設定されて変性、15 95 ° C で s 焼鈍、30 65 ° c s の拡張のための 72 ° C と最後の拡張のための 72 ° C で 10 分間で s 。
- PCR の終了後は、各サンプルにローディングの染料 × 6 の 3 μ L を追加します。フリックと 3 に簡単に遠心分離機によってミックス 〜 5 秒 。
- PCR の製品は、1 x TAE のバッファーに 2% (w/v) agarose のゲルの電気泳動によってチェックされます。タグと B2m PCR の製品のサイズは 450 ~ bp と 300 bp、それぞれします 。
- tva ジェノタイピング
。 各サンプルの試薬ミックス 10.5 μ に対して次のプロトコルを呼び出します。各試薬を追加する前に旋回してください。- 5.6 μ L ヌクレアーゼ フリー水、0.5 μ L DMSO、1.25 μ L バッファー II AmpliTaq DNA ポリメラーゼの x 10 と 25 mM MgCl 2、1.375 です μ、25 mM dNTP の 0.125 μ L のマスター ミックスを準備します 。
- 100 μ M tva 3 の 0.125 μ L を追加 (5 ' - GCCCTGGGGAAGGTCCTGCCC - 3 ') と 100 μ M tva 5 の 0.125 μ L (5 ' - CTGCTGCCCGGTAACGTGACCGG - 3 ')、マスター ミックスにします 。
- 10 μ M B2m プライマー ミックス、マスター ミックスする内部制御のための追加の 1.275 μ L.
- 0.125 μ L を追加、マスター ミックスの AmpliTaq DNA ポリメラーゼ 。
- は、指でチューブをフリックすることで、マスター ミックスをミックスします。簡単に 3 ~ 5 秒間遠心機でマスター ミックスがスピンダウンします 。
- 個々 のそれぞれに、マスター ミックスから割り切れる 10.5 μ L PCR チューブします。旋回毎に新しい管へ早かった 。
- 旋回し各 PCR チューブに 2 μ l ゲノム DNA のテンプレートを追加します。ゲノム DNA は、前述のように用意しています 。
- フリックすることでソリューションをミックスし、遠心分離機に簡潔に 3-5 s. のチューブを入れて PCR マシンにします 。
- PCR 条件を初期変性、30 の 35 サイクルに続いて 92 ° C で 2 分に設定が s 30 変性 94 ° C で熱処理の拡張のための 72 ° C で 30 秒と最後の拡張のための 72 ° c 10 分の 60 ° C で s 。
- PCR の終了後は、各サンプルにローディングの染料 × 6 の 3 μ L を追加します。フリックと 3-5 s. の簡潔に遠心分離機によってミックス
- PCR の製品は、1 x TAE のバッファーに 2% (w/v) agarose のゲルの電気泳動によってチェックされます。Tva と B2m PCR の製品のサイズは 500 bp と 300 bp、それぞれします 。
結果
リップ-タグの生体内および生体外での感染率RIP tva RCASBP ベースのウイルスによる腫瘍細胞は ~ 20% 〜 80% とそれぞれ20。RIP-タグ;RIP tvaマウス モデル、各マウス 400 の膵島の約 4% に腫瘍20; 開発自然したがってウイルスによって遺伝子の潜在的な効果の組織学的表現型分析の各マウスにおける腫瘍細胞の十分な量があります。このシステムを使用して、転移 Bcl-xl の新規核関数は識別された9だった。RIP の-タグです。RIP tva RCASBP-Bcl xL感染マウス発生率が高い癌のコントロール ウイルス感染マウスよりも RCASBP-ALPP (対 74% 96%) を出展しました。さらに、RCASBP-Bcl-xlの 47%-リップ-タグを感染RIP tvaマウス コントロール マウス20に転移は見つかりませんでした、16 週齢 (図 3 a)、安楽死させたとき膵臓のリンパ節転移を開発しました。
さらに、スクリーニングがん遺伝子リップ-タグのライブラリRIP tvaマウス膵リンパ節および肝21 (図 3 b 、 3 C) への転移を促進する最初の遺伝子を識別し、。この遺伝子は、ヒアルロン酸を介した運動アイソ フォーム B (RHAMMB) タンパク質の受容体をエンコードし、EGFR シグナル伝達21がアクティブになります。我々 は、その特定の肝臓転移は、N134 腫瘍細胞が当初21受信者免疫不全マウスの肺毛細血管床を通る循環実験的転移の尾静脈アッセイで締めくくっていることが実証。

図 1: RCASBP(A)、代替服務研究委-X、および代替服務研究委 Y 構造の概略図。クローニング サイトは青、太字のフォントで表示されます。この図の拡大版を表示するのにはここをクリックしてください。
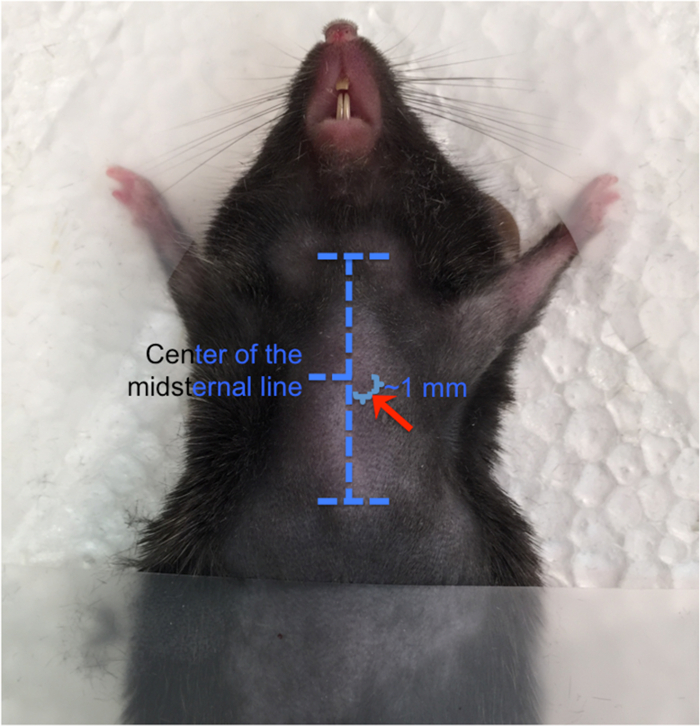
図 2: 心腔内注入を配置します。解剖学的ランドマークは、(白で記載) 胸骨上水平の破線で表示されます。マウスの皮膚に胸骨切痕と胸膜のランドマークとなると針は半ばに胸骨から 1 mm を挿入され、わずかに左胸骨の (解剖学的)。この図の拡大版を表示するのにはここをクリックしてください。
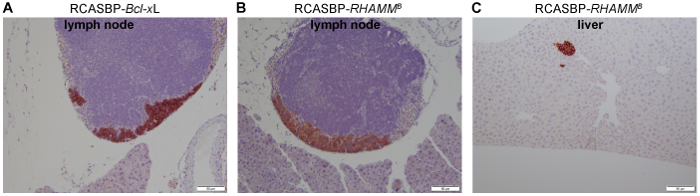
図 3: 免疫染色による転移性膵 β 細胞します。写真は、代表的なシナプトフィジン膵リンパ節 (A、B) または (C) 肝臓転移性膵神経内分泌腫瘍の染色を見せます。RIP の-タグです。RIP tvaマウスが 7 週齢で示された RCASBP レトロ ウイルスに感染しているし、16 週齢で安楽死させた。スケールバー = 50 μ m. 元の倍率 = 20 X。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本研究ではマウスの強力なモデル、リップ-タグについて述べるRIP-tva鳥レトロ ウイルスの同定と転移の要因の解析を介して体細胞遺伝子配達を達成するために。ただし、リップ-タグ;RIP tvaマウス膵神経内分泌腫瘍を発症、このマウス モデルにおける転移因子も他の種類のがんの転移を促進するかもしれません。
我々 のアプローチの導入したがって散発的な人間の腫瘍の開発をより忠実に模倣時間制御方法で膵 β 細胞の前癌病変に体細胞の遺伝的変化を具体的には利点があります。このアプローチは、開発中の興味の遺伝子の異所性発現のため従来のトランスジェニック モデルでしばしば観察された正常組織形成の任意の潜在的な摂動を回避できます。さらに、トランスジェニック マウスを生成するよりも興味のある遺伝子を運ぶ鳥 retroviral ベクトルを生成するはるかに高速です。RCASBP から派生した鳥レトロウイルスベクターは tva を表現する細胞in vitroとin vivoに Cdna (≤2.5 kb)、Shrna、Mirna、他の Rna を配信できます。感染症 (および複数の感染) の効率、標的細胞の増殖率と細胞のアクセシビリティによって決まります。力価 > 1 x 108感染単位 ml体内感染に必要です。効率的なウイルス配信達成できる生体外で誘導される細胞増殖とウイルスに感染するすべてのセルの反復暴露の可能性のためです。
マウスの生存率の正確な心臓内注射法が欠かせません。まず、ウイルスの懸濁液を描画する前にインスリン注射器で空気のスペースを 50 μ l 添加は心臓パルスを見て重要です。第二に、血の赤い脈が表示されたら、注射器の位置を修正して、注射器で血の明るい赤のパルスを見て表示されるたびにゆっくりと 10-20 μ l ウイルス懸濁液を提供することが重要です。血の明るい赤パルス停止 10-20 μ l ウイルス懸濁液の出産後、少し針を再配置、役立ちます。第三に、最後のプッシュはウイルスの懸濁液を提供するプランジャーのや血パルスを見る前に後を胸腔からすぐに取り消す必要がある針と注射部位に適用される穏やかな圧力は内部の出血を減らすを助けます。最後になりましたが、別のマウスではインスリン注射器を再使用しないでください。
将来のアプリケーションは、このRIP の-タグです。RIP tvaマウス モデル他のトランスジェニック、ノックイン、ノックアウト マウス モデルと組み合わせて使用できます。さらに、このリップ-タグを組み合わせることを思い描いてください。RIP tva単一の点突然変異、削除、逆位や転座22などゲノムを生成する CRISPR Cas9 ゲノム編集ツールでマウス モデル。
開示事項
著者が明らかに何もありません。
謝辞
ハロルドバーマス、ブライアン c. ルイス、腫瘍形成の各、ダニー黄、シャロン パン、ミーガン ・ ウォン、Manasi m. Godbole を感謝いたします。Y.C.N.D. をサポートするには、DOD グラント W81XWH-16-1-0619 と NIH グラント 1R01CA204916。
資料
| Name | Company | Catalog Number | Comments |
| RCASBP-Y DV plasmid | Addgene | 11478 | |
| RCAS-RNAi plasmid | Addgene | 15182 | |
| DMEM | Corning | 10-013-CV | |
| fetal bovine serum | Atlanta Biologicals | 25-005-CI | |
| L-glutamine, 100x | Corning | 25-005-CI | |
| Penicillin-Streptomycin solution, 100x | Corning | 30-002-CI | |
| PBS-/-, 1x | Corning | 21-040-CV | |
| Superfect | Qiagen | 301305 | |
| Polyallomer centrifuge tube | Beckman Coulter | 326823 | |
| 0.45 mm Nalgene Syringe Filters with PES Membrane | Thermo Scientific | 194-2545 | |
| Insulin Syringes | BD | 329461 | |
| synaptophysin | Vector Laboratories | VP-S284 | |
| VECTASTAIN Elite ABC HRP Kit (Peroxidase, Rabbit IgG) | Vector Laboratories | PK-6101 | |
| AmpliTaq DNA Polymerase with Buffer II | Life Technologies | N8080153 | |
| MyTaq DNA Polymerase | Bioline | BIO-21106 |
参考文献
- Vogelstein, B., Kinzler, K. W. The multistep nature of cancer. Trends Genet. 9 (4), 138-141 (1993).
- Walrath, J. C., Hawes, J. J., Van Dyke, T., Reilly, K. M. Genetically engineered mouse models in cancer research. Adv Cancer Res. 106, 113-164 (2010).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Du, Y. C., Lewis, B. C., Hanahan, D., Varmus, H. Assessing tumor progression factors by somatic gene transfer into a mouse model: Bcl-xL promotes islet tumor cell invasion. PLoS biology. 5 (10), e276 (2007).
- Hanahan, D. Heritable formation of pancreatic beta-cell tumours in transgenic mice expressing recombinant insulin/simian virus 40 oncogenes. Nature. 315 (6015), 115-122 (1985).
- Fisher, G. H., et al. Development of a flexible and specific gene delivery system for production of murine tumor models. Oncogene. 18 (38), 5253-5260 (1999).
- Orsulic, S. An RCAS-TVA-based approach to designer mouse models. Mamm Genome. 13 (10), 543-547 (2002).
- Tuveson, D., Hanahan, D. Translational medicine: Cancer lessons from mice to humans. Nature. 471 (7338), 316-317 (2011).
- Choi, S., et al. Bcl-xL promotes metastasis independent of its anti-apoptotic activity. Nat Commun. 7, 10384 (2016).
- Naik, P., Karrim, J., Hanahan, D. The rise and fall of apoptosis during multistage tumorigenesis: down-modulation contributes to tumor progression from angiogenic progenitors. Genes Dev. 10 (17), 2105-2116 (1996).
- Hughes, S. H., Greenhouse, J. J., Petropoulos, C. J., Sutrave, P. Adaptor plasmids simplify the insertion of foreign DNA into helper-independent retroviral vectors. J Virol. 61 (10), 3004-3012 (1987).
- Petropoulos, C. J., Payne, W., Salter, D. W., Hughes, S. H. Appropriate in vivo expression of a muscle-specific promoter by using avian retroviral vectors for gene transfer [corrected]. J Virol. 66 (6), 3391-3397 (1992).
- Dunn, K. J., Williams, B. O., Li, Y., Pavan, W. J. Neural crest-directed gene transfer demonstrates Wnt1 role in melanocyte expansion and differentiation during mouse development. Proc Natl Acad Sci USA. 97 (18), 10050-10055 (2000).
- Loftus, S. K., Larson, D. M., Watkins-Chow, D., Church, D. M., Pavan, W. J. Generation of RCAS vectors useful for functional genomic analyses. DNA Res. 8 (5), 221-226 (2001).
- Bromberg-White, J. L., et al. Delivery of short hairpin RNA sequences by using a replication-competent avian retroviral vector. J Virol. 78 (9), 4914-4916 (2004).
- Harpavat, S., Cepko, C. L. RCAS-RNAi: a loss-of-function method for the developing chick retina. BMC Dev Biol. 6 (2), (2006).
- Huse, J. T., et al. The PTEN-regulating microRNA miR-26a is amplified in high-grade glioma and facilitates gliomagenesis in vivo. Genes Dev. 23 (11), 1327-1337 (2009).
- Ahronian, L. G., Lewis, B. C. Generation of high-titer RCAS virus from DF1 chicken fibroblasts. Cold Spring Harb Protoc. 2014 (11), 1161-1166 (2014).
- Green, M. R., Sambrook, J., Sambrook, J. . Molecular cloning: a laboratory manual. , (2012).
- Du, Y. C., Lewis, B. C., Hanahan, D., Varmus, H. Assessing tumor progression factors by somatic gene transfer into a mouse model: Bcl-xL promotes islet tumor cell invasion. PLoS Biol. 5 (10), 2255-2269 (2007).
- Du, Y. C., Chou, C. K., Klimstra, D. S., Varmus, H. Receptor for hyaluronan-mediated motility isoform B promotes liver metastasis in a mouse model of multistep tumorigenesis and a tail vein assay for metastasis. Proc Natl Acad Sci USA. 108 (40), 16753-16758 (2011).
- Guernet, A., Grumolato, L. CRISPR/Cas9 editing of the genome for cancer modeling. Methods. , (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved