Method Article
共焦点肉眼検査を使用した生後小脳顆粒細胞の移動のex vivoイメージング
要約
During postnatal cerebellum development, immature granule cells originating from the germinal zone exhibit distinct modalities of migration to reach their final destination and to establish neuronal networks. This protocol describes the preparation of cerebellar slices and the confocal macroscopic approach used to investigate the factors that regulate neuronal migration.
要約
生後発達の間に、未成熟顆粒細胞(興奮介在)外顆粒層中の接線方向の移行を示し、その後、分子層とプルキンエ細胞層内の半径方向の移動は、小脳皮質の内部顆粒層に到達します。渡り鳥のプロセスでのデフォルトは、多様な小脳の機能の欠損につながる、ニューロンの細胞死や紛失のいずれかを誘導します。求心顆粒細胞の遊走は、その最終位置に向かって細胞を誘導するために、走化性および細胞外マトリックスの分解のようないくつかのメカニズムを含むが、それぞれの皮層における細胞遊走を調節する因子は、部分的にしか知られています。我々の方法では、急性小脳スライスはP10ラットから調製される、顆粒細胞は、蛍光細胞質マーカーで標識され、組織を37℃で共焦点肉眼によって細胞移動のリアルタイム監視を開始する前に、4から10時間に膜インサート上で培養されますでCO 2の存在。小脳の異なる皮質層での移行時には、顆粒細胞は、神経細胞の遊走の調節におけるそれらの可能な役割を調査するために、神経ペプチドのアゴニストまたはアンタゴニスト、プロテアーゼ阻害剤、細胞内エフェクターやアルコールやメチル水銀のようであっても有害物質のブロッカーに露出させることができます。
概要
開発小脳では、ニューロンの8つの異なるタイプがげっ歯類1における第二胚週と第二出生後の週の間に順次生成されます。最初に一次胚ゾーンから発信、未成熟顆粒細胞(GC)は、外顆粒層(EGL)、二次胚ゾーン2から生成される最後のニューロンです。第3生後数週間の間に、小脳皮質は、EGL、分子層(ML)を含む4つのレイヤーで構成葉状構造であり、プルキンエ細胞層(PCL)と内部顆粒層(IGL)( 図1)。求心移行、未熟のGC、グルタミン酸介在を通じ、約2日以内にIGLに達します。第生後一週間では、EGLが消え、IGLは、大人の小脳における顆粒層(GL)と呼ばれるものを構成しています。 GLは、GCは苔状繊維及び単極性ブラシ細胞からの興奮性シナプス入力を受け取る、およびゴルジ細胞軸索からの抑制性シナプス入力。 MLでは、GCの軸索は、プルキンエ細胞、バスケット細胞、星状細胞、およびゴルジ細胞2を含むGABA作動性ニューロンと興奮性シナプスを作ります。
生後初期のげっ歯類から得られる急性小脳切片における細胞運動のリアルタイム観察がGCのは、小脳皮質3での経路の間の移動の様相と速度の変化に付随してその形状を変更することを示しています。最初の2週間の間に出生後、GCの前駆体は、積極的にEGLの上部に増殖します。 EGLの中央部では、有糸分裂後のGCは、それらのより大きなプロセスの方向に接線方向に移動します。 EGL-MLの境界に、GCのは、彼らの動きを遅く、細胞はMLに短い垂直下降プロセスを入力し始めます。 MLでは、GCは縦長の細胞体、薄い後のプロセス、より多量の主要なプロセスがあり、バーグマングリア繊維に沿って半径方向に移動します。でPCLは、GCはその動きを止めるが、長期の固定相(2時間)の後、彼らはPCL-IGLの国境を越えます。 IGLでは、GCはグリア繊維支持の非存在下での層の底部に向かって移動します。主要なプロセスの先端たらIGL-白質(WM)ボーダー、GCの遅い近づくとその移動を停止。矢状スライスはML、PCLおよびIGLでマイグレーションを放射状に専用されている間、小脳の横断面は、EGLで接線移行研究のために好ましいです。神経ペプチド( 例えば 、ソマトスタチン、PACAP)を含むGCの動きのいくつかの調節因子は、これまでに同定されているが、各皮層におけるGCの移行の時空間制御に関与する完全なメカニズムはまだほとんど不明1,4,5,6-です。
GCの移行は、ACUのため、単離された培養細胞または蛍光検出のための透過光照明のいずれかを使用して、ビデオ、共焦点顕微鏡を介して過去20年の間に研究されてきましたTE小脳スライス。最初に、親油性のDiI、最近で「セルトラッカー」染料および細胞発現蛍光タンパク質を共焦点または二光子顕微鏡7,8に使用しました。成功した実験では、プロトコルはシンプルだが容易ではない作る具体的な手順の数によって異なります。具体的には、急性スライスは自家製ナイロンメッシュネットワーク9と、一般の観察中に安定化されなければなりません。光照射の強度は、多点走査型共焦点顕微鏡法によって提案されているように光毒性および光退色を避けるためにできるだけ低くなければなりません。さらに、温度およびCO 2は、ニューロンの遊走に影響を与える可能性が不安定ので重要な環境パラメータです。実験手順を容易に絞り込むために、我々は、スライスの動きを制限し、共焦点肉眼プロトコルを開発した、一定の環境パラメータを保証する、(milimeters程度)の視野を増加させる、光退色を軽減し、consequ画像解析によって追跡することができる細胞(数十)の数をまったく別。従って、180ミクロンの厚さのスライスを膜インサート上で培養し、6ウェルプレートに直接2X電動大インキュベーションチャンバーを備えた商用共焦点マクロスコープの目的、温度およびCO 2のコントローラと振動制御システムの下で転送されます。時間経過およびZスタックその後数時間的および薬理学的ツールまたは生物活性分子を介して行われるが、インキュベーション培地に添加し、または送達することができます。この方法は、異なる発達段階における小脳または大脳ニューロンの他のタイプの遊走を研究するために適合させることができます。
プロトコル
動物(雄または雌Wistarラット)は、実験動物の管理と使用のためのフランスのガイドによると、認定動物施設(承認B.76-451-04)で生まれ、飼育しました。実験は、欧州共同体理事会指令(2010年9月22日の63分の2010 / UE)と農業のフランスの省に応じて、許可された研究者(MB、DVとLG)の監督の下で行われました。
メディアとツールの作製
- 生物学的安全キャビネットでは、MgCl 2をせずに塩化カルシウム(1.85グラム/リットル)/ 硫酸マグネシウム(0.9767グラム/リットル)を含む10×ストック溶液から滅菌水で1×ハンクスBSS(HBSS)を準備します。 HBSSの1×溶液に、 炭酸水素ナトリウム(350 / mlの)を追加します。
- 生物学的安全キャビネットでは、(100×ストック溶液から)N2サプリメントを追加し、ペニシリン(100単位/ ml)(0.1 mg / mlの)ダルベッコ改変イーグル培地を解決(DMEM)栄養ミックス-streptomycinチャーF-12(1:1)。
- 無菌状態では、DMSO中の細胞トラッカーグリーン(1 mgのための1.075ミリリットル)と呼ばれる細胞質の蛍光色素のアリコート(25μL、2 mm)を用意します。 15ミリリットルコニカルチューブに5mlのDMEM中の1つのアリコートを希釈します。
- 4℃でのメディアを維持するために充填された氷のバケツを準備します。
- 70%エタノールで実験室のベンチトップとツールを除染。
P10ラットから小脳の2解剖
- 急速に脊髄の開始を取得するために、耳の後ろに湾曲操作ハサミで仔ラット(P10)を首を切ります。
- 断頭頭の後ろ側では、微細なアイリスハサミで鼻に首から皮膚の正中切開を行い、微細なアイリスはさみとデュモン#3鉗子を用いて頭蓋から皮膚を分離します。
- 微妙頭蓋骨の吻側領域にベースから2横切開を作るために細かいアイリスはさみを使用してください。 2#3鉗子で切開し、頭蓋骨を削除します。ブラジャーを外し同じ鉗子を使用して頭蓋骨を持つ任意の密着性からです。
- 氷冷HBSS培地2mlを含むペトリ皿(Ø35ミリメートル)にへらのスプーン端に脳を転送します。
- 実体顕微鏡のステージへの氷と転送のフル大きなペトリ皿(Ø100ミリメートル)で、脳を含むペトリ皿を置きます。
- 実体顕微鏡下では、2#3鉗子を使用して引き裂くことによって、脳から小脳を分離します。同様に、残留脊髄および軟膜 - 膜を除去します。
- へらのスプーン端に新しいHBSSで満たされたペトリ皿(Ø35ミリメートル、2ml)に小脳を移し、氷上に保持します。
急性小脳切片の調製
- 二つのヘッドによって示されるように実体顕微鏡下では、虫部と右半球間の小脳をカット標準のメスハンドル#3固体と#15の外科用ブレードを用いて、図2Aに矢印。
- シアンの一滴を入れビブラトーム試料ディスク上oacrylate接着剤や毒性溶媒蒸気を除去するために15〜25秒待ってください。
- へらのスプーンの端がカット小脳を収集し、清潔なペーパータオルで余分なHBSSを除去します。
- 試料ディスクに近い小脳を持参してください。検体ディスクにカットエッジを修正し、10秒待ってください。
- マニピュレータでバッファトレイに試料ディスクを挿入し、小脳の横軸は、ナイフホルダーに垂直であるので、それを回転させます。アレンキーで試料ディスクを修正し、小脳がカバーされるまでHBSS培地で穏やかにバッファートレイを埋めます。
- 負荷は、冷却槽に氷を砕い。
- 任意の油を除去するために70%エタノールでブレード3回清掃してください。
- ナイフホルダーにブレードを挿入し、ネジを締め付けで固定します。
- 標本の(ユーザーのビューから)後縁の後ろに刃先を右に置き、出発点として定義します。前方を使用し、Tを定義するコマンド彼は、試料の前縁の後にポイントを終了します。
- 2.5でセクショニング速度を選択し、180ミクロンの厚さでトリミング8. [頻度を切片。組織切片を開始します。
- HBSS含有ペトリ皿(Ø35ミリメートル)に広口径ガラス切断されたパスツールピペット、転送を使用して、各セクションをピックアップし、氷上に維持。
- ブレードと干渉するときに、2つの#5鉗子を使用して、小脳から慎重髄膜を除去します。小脳あたり5スライス( 図2B、C)の最大値を収集します。
- 実体顕微鏡下で2#5ピンセットで慎重に小脳スライスから髄膜を除去し、より優れたプローブ負荷穏やかに小葉を分離します。
リビング介在4.蛍光染色
- 6ウェルプレート(ウェルあたり最大3スライス/)に広口径ガラス切り捨てパスツールピペットで小脳スライスを転送します。 HBSS培地を吸引除去します。
- L 5ml中のスライス(3 MAX)をインキュベート蛍光染料のoading溶液(10μM)。
- 光から保護するために、アルミホイルでマイクロプレートをカバーしています。細胞標識を容易にするために、室温で10分間、35 rpmでジャイロ移動テーブルの上に置きます。
- 広口径ガラス切り捨てパスツールピペットで、トランスウェルの膜に転写スライスが( 図2D3.0μmの細孔サイズ)を挿入します。ピペットでロード媒体を吸引。
- インサートを取り外し、DMEMの1.9ミリリットルとよくを埋めます。インサートを交換し、組織をカバーするために、スライスの上のDMEM 100μlを添加します。
- MLでのGCを観察するのに十分である2時間インキュベーター室(37℃、5%CO 2)で培養インサートを含むプレートを置きます。インサート膜( 図2E)で添付ファイルを許可するようにフラットな組織をうそ。スライスが乾燥していないことを確認してください。
共焦点肉眼検査を通じて5. エクスビボイメージング
- なしプレートを転送しますインキュベーターにプラスチック製のふたは、共焦点マクロスコープのスタンドに取り付けられています。マクロスコープのプレートインサート上にガラスカバーを置きます。 37.0℃のチャンバーの温度を維持するには、0.5℃、±、および一定のガス流(95%O 2、5%CO 2)プレートインサートを介してpHを一定に維持するためにスライスを提供します。タイムラプス実験の前に、さらに2時間待ちます。
- 組織切片でGC移動を可視化X2乾燥対物レンズ(作動距離を備えた共焦点レーザー走査マクロスコープを介してレーザダイオードを用いて488nmの波長光で準備を照明するために39ミリメートル、直径58ミリメートル、NA = 0.234)、500から530 nmの蛍光発光を検出します。
- 微のGCの動きを解決するには、1.5から2.0の追加の光学ズーム倍率で画像を取得します。最大12時間30分ごとに単一の焦点面内のGNの画像を収集またはz軸に沿って最大10個の異なる焦点面。
- 必要な場合には、ガラスのカバーを取り外して、GCの移行に及ぼす影響を研究するために10μlのピペットを含むDMEM中の生物学的活性剤または阻害剤の小容量(1〜10μl)を追加します。
6.細胞追跡
- 映画のたびに、ImageJの中ecart型スルーモードzスタック投影を行います。コントラストを調節し、連続した画像の輝度レベルは、識別および標識のGCの追跡を容易にすること。手動(t = 0で)を基準スナップショット上の各位置の地図。
- Analyseを粒子メニューの「手動トラッキング」プラグインを使用し、時間の経過中に各細胞体の重心点をクリックして決定します。スプレッドシート内の生の追跡データをエクスポートします。
- 各セルと関連した位置を特定する(PHPコードで書かれhttp://primacen.fr、)スマートホームメイドのプログラムをImageJのからエクスポートされた生の追跡データを再編成してください。プログラムを使用して、calculat総走行距離と各セルの移動の平均速度を電子。分類し、同じプログラムを使用して、適切なフィルタの下で制御し、治療条件で細胞移動の特性を比較します。
結果
彼らは異なる皮質層1( 図1)を横切るように出生後早期の小脳では、GCはそのモードと移動の速度の大幅な変化を示します。このセクションでは、それらの天然の細胞環境にGC遊走を研究することによって得られる結果の例を示します。緑色蛍光色素で標識されたP10のラット小脳組織切片は、共焦点マクロスコープ( 図3A)で検査していると我々は、GCのは、18ミクロン/ hrの平均速度( 図3B、C)とMLに放射状に移動することを示しています。現在までに、調節因子と各皮質層に細胞遊走の制御に関与する分子機構を含む神経細胞とグリア細胞間の相互作用/通信の役割は不明な点が多いです。したがって、主な問題は、これらの皮質の層特異において役割を果たし得る神経ペプチド、神経伝達物質、神経栄養因子および細胞外マトリックス成分を同定することですその移行プロセス時の速度のFIC変化。下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)は、げっ歯類7,10,11の最初の2週間の間、主に生後PCLではなく、MLおよびIGLに検出されます。培地へPACAP38(10 -6 M)の適用は、MLにおけるGCの79%の速度減少をもたらしました。たとえば、MLでのGCの移動速度は、PACAP38( 図4A)の投与後2.5ミクロン/時の制御条件で11.9ミクロン/時から低下しました。組織型プラスミノーゲン活性化因子(tPA)、細胞外マトリックス(EM)は、細胞接着分子またはラミニン12,13などの構成部品の劣化につながるタンパク質分解カスケードのメンバーです。 tPAおよびプラスミノーゲン、tPAの基板は、出生後の小脳14,15,16の開発中に皮質層で検出されます。 PAI-1(10 -7 M)、内因性tPAの阻害剤の投与は、78%GCによって減少しますMLでの移行。例えば、GCはPAI-1( 図4B)の添加後に4.2ミクロン/時間に制御条件で19.2ミクロン/時からMLに移動速度を減少させました。これらの結果は、PACAPは、GCの動きに直接的な阻害効果を発揮し、セリンプロテアーゼのtPAは、現像ラット小脳のMLでのGCの移動を容易にすることことを示しています。
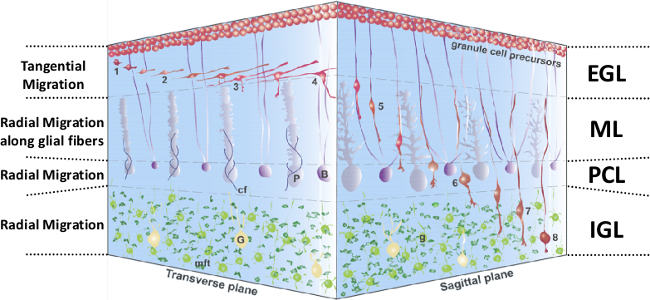
図1:生後小脳皮質でのGCの移行の3D表現。 IGL 1-4、EGLでGCプロセスおよび接線方向の移行の拡張。5、バーグマングリア繊維に沿ってMLで放射状の移行。6、PCLで一時固定相。7、グリアに依存しないラジアル移行。8、完成。赤でIGL GCでGCの移行、顆粒細胞、の、EGL、外顆粒層、濃い紫色でB、バーグマングリア、; G、ゴルジ細胞、黄色で、CF、登山繊維、青、G、postmigratory顆粒細胞、ライトグリーンで、IGL、内部顆粒層、MFT、苔状線維端末、暗緑色で、PCL、プルキンエ細胞層、薄紫でP、プルキンエ細胞、; ML、分子層。この図は、5から変更されています。

図2:P10小脳スライスのex vivo培養物(A)P10ラットから切開小脳。スケールバー= 6ミリメートル。 (B)実体顕微鏡を介して180ミクロン厚の小脳スライスの生活の顕微鏡写真。スケールバー= 3ミリメートル。 (ネコ小脳の高倍率、4皮質層(EGL、ML、PCL、IGL)が既に識別可能です。スケールバー= 1ミリメートル。 (D)蛍光標識した後、組織切片を、6ウェルプレートに培養インサート(直径24mm)上に配置されています。 (E)組織培養処理ポリエステル膜で培養インサートの概略図。 この図の拡大版を表示するには、こちらをクリックしてください。

図3:ラットP10小脳の皮質層でのGCの動的移行 GCのグリーン細胞質蛍光色素で標識されたP10ラット小脳スライスの(A)Macroconfocalビュー(XYZ、2D投影)。 =75μmのスケールバー。 GCを示す(B)タイムラプスイメージング対照条件で4時間共焦点肉眼によるMLの動き。アスタリスク(*)記号は、GCのソーマをマーク。 (分単位)経過時間は、各顕微鏡写真の下部に表示されます。 =10μmのスケールバー。 (C)GCのソーマが移動した距離で順次変化。
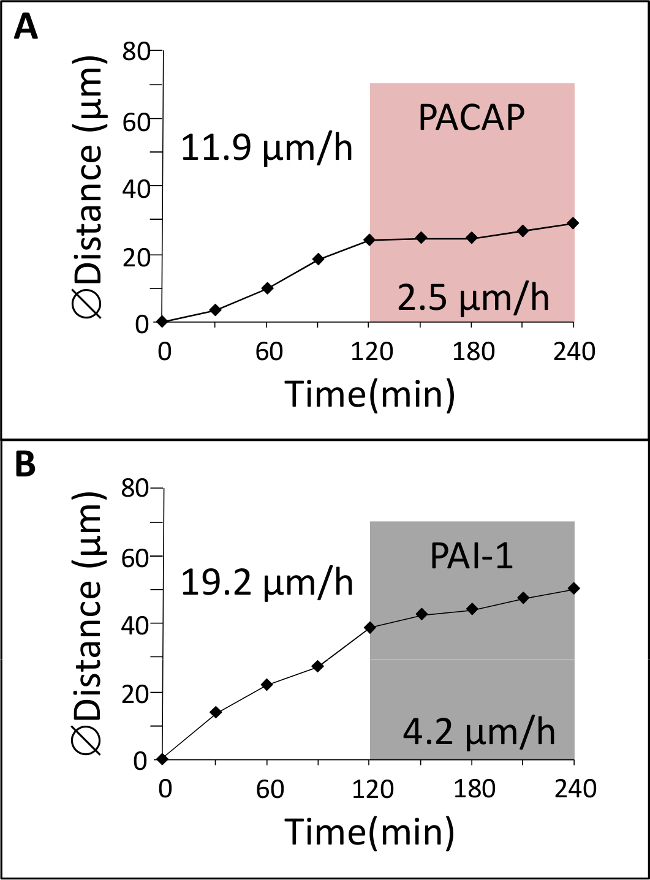
図4:GCの移行の神経ペプチドおよびプロテアーゼ阻害剤の効果(A)GCは、下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)の存在下で2時間後、制御条件で2時間共焦点肉眼によってMLで追跡してました。 (B)GCは対照条件で2時間共焦点肉眼によってMLで追跡した後、プラスミノーゲン活性化因子インヒビター1(PAI-1)の存在下で2時間。
ディスカッション
このプロトコルは、トランスウェルシステムと共焦点肉眼を通して生後発達中に細胞遊走を研究するための緑色蛍光色素を持つGCの蛍光標識の急性P10ラット小脳スライスの文化を説明します。このプロトコルは、12時間と実験中アゴニストまたは神経ペプチドのアンタゴニスト、酵素阻害剤、細胞シグナル伝達調節物質または有毒物質を含む移動の要因を調節可能な役割の試験までの期間の細胞遊走の観察を可能にします。ピペットの先端を有する膜インサートの小さな穴は、インキュベーション培地中の化合物の投与を容易にすることが必要です。自家製の湾曲した先端は、ピペット溶液の送達を促進するために使用することができます。
生体組織切片における細胞移動の研究の1つの問題は、組織自体の動きが細胞追跡を困難にすることができることです。以前のアプローチは、穏やかにSLIを安定化させるために提案したのに対しナイロンメッシュまたはラット尾コラーゲン7,17の薄層でCES、この技術の主な利点は、対物レンズの下にCO 2インキュベーターから膜インサート上小脳スライスを含む6ウェル培養プレートの簡単かつ直接的な移動であります共焦点マクロスコープの。統合された温度とCO 2のコントローラはまた、細胞遊走9に必須の適切かつ一定の環境パラメータを提供します。従って、培養条件は、スライスがよく、膜インサートに取り付けられているので、最小限に抑えられる観察及び組織の動きの間に保持されます。組織の安定化は、取得時に参照を修正する必要があり、スライスエッジやプルキンエ細胞の位置を追跡することによって検証されます。また、プレートの6ウェルに分散小脳スライス(12〜18)は、迅速に電動ステージと、光学ズームして詳細に観察することができます。による乾燥対物レンズ、エピの大きな作動距離(X2、39ミリメートル)に-observationは、培養培地中の化合物の浸漬および投与の自由であるはるかに簡単です。したがって、CO 2インキュベーター、共焦点の環境パラメータと培養支持体の類似性は、生物学的サンプルの最大保全につながる肉眼。
プロトコルの別の利点は、広い視野とを同時に観察することができる細胞の結果として多数あります。例えば、我々は以前にMLで放射状の移行と蛍光のGCの密度は1124±138細胞/ mm 2で18であったと判断しました。共焦点肉眼(X2、NA = 0.234)は、共焦点顕微鏡(40X、NA = 1.25)に比べて低い横方向の解像度を持っていますが、GCのの細胞体は、容易に追跡することができ、移動の平均速度は、二つの技術的アプローチ7,18間で同等であり、 。
画像収集、組織切片と番目の品質のための技術的な改善に加えて標識のE品質が成功した実験のための重要なポイントです。常に解剖プロセスの間、氷上でメディアや組織を維持し、ビブラトーム刃に油を除去し、接着剤と接触して組織の切片を利用しません。矢状及び横断面は、それぞれ半径方向および接線方向の移行に適合されます。小脳の異なる皮質層に適切な検出のためのインキュベーションの異なる長さを使用してください。 (8時間まで)長いインキュベーション時間は、PCLおよびIGLに多数のGCの移行を検出するために必要です。 GCの移行は、特定の時空間的な窓の間の生理学的プロセスであるため、正の対照は、細胞が正常に移行しなければならないことです。特に、MLには多くのスピンドルGCは矢状小脳切片のための主要な健康指標の一つです。実験を開始するため、MLでのGCの動きの観察が示唆されています。実際には、縦長のセル本体とGCの形状は、交流を開始するための基準点として考慮されるべきです連続的な制御(2時間)と治療(2時間)を容易MLで実行することができる期間でquisition。
遺伝子構築物を介して発現する細胞トラッカーファミリーまたは蛍光タンパク質などの蛍光色素は、細胞遊走の研究のためのトレーサーとして使用することができます。 4レーザーは(405、488、532および633 nm)をビームのでによるGCの移行の遅い速度(1スタックごとに30分)に、多色実験も順次モードで実行することができるシステムで利用できます。求心性と遠心半径方向の移動を考慮すると、他の介在の追跡も18を実現することができます。具体的には、以下の多数の細胞型は、より容易に大きな視野に局在化することができます。最後に、このプロトコルは、小脳発達の他の段階だけでなく、他の脳領域に細胞遊走を研究するために使用することができます。
開示事項
著者らは、開示することは何もありません。
謝辞
- この作品は、生物医学における研究とイノベーション研究所(IRIB)、ノルマンディー(PRIMACEN)、INSERM、IBiSA、ルーアン大学、欧州地域開発基金(PeReNE、INTERREG 4A ERDF)の細胞イメージングプラットフォームでサポートされていましたLARC-神経科学ネットワークと地域オートノルマンディー。
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified eagle medium (DMEM) nutrient mixture F-12 | Sigma-Aldrich | D8437 | |
| Hank's balanced salt solution 10X | Sigma-Aldrich | H1641 | |
| PACAP38 | INRS, Canada | Bourgault et al., 200919 | |
| PAI-1 | Calbiochem | 528208 | |
| N-2 supplement | Fisher Scientific / Gibco/ invitrogen | O973 | |
| cyanoacrylate glue | Loctite | ||
| Cell Tracker Green CMFDA | Invitrogen | C2925 | |
| Polyester Transwell-Clear inserts | Corning | 3452 | |
| Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| 6-well cell culture cluster | Corning | 3516 | |
| DMSO | Fisher Scientific | BP231-100 | |
| Tissue culture dish 35 mm diameter | BD Falcon | 353004 | |
| Tissue culture dish 100 mm diameter | Thermo SCIENTIFIC | 130182 | |
| Polypropylen tube (15 ml) | BD Falcon | 352096 | |
| Ethanol 70% | Fisher Chemical | E/0800DF/21 | |
| biological safety cabinet fume hood | Thermo Scientific | MSC9 Class II A2 | |
| adjustable-volume pipette (0,5-10 µL) | Eppendorf | 4910 000.018 | |
| gyro-rocker, SSL3 | Stuart | ||
| CO2 incubator, Hera Cell 150 | Thermo Scientific | ||
| vibrating blade microtome, VT1000S | Leica Microsystems | ||
| confocal macroscope, TCS LSI | Leica Microsystems | ||
| temperature controller | PeCon | ||
| CO2-controller | PeCon | ||
| Stereomicroscope, M205 C | Leica Microsystems | ||
| Operating scissors, curved, blunt/blunt | Medicon | 03.03.17 | |
| Hardened fine iris scissors, straight, sharp/sharp | FST | 149090-11 | |
| Dumont #3 and #5 forceps | FST | 11293-00 and 11252-20 | |
| Vibratome injector blades/single edge | Leica Microsystems | 39053250 | |
| standard scalpel handle #3 solid | FST | 10003-12 | |
| surgical blade #15 | Swann-Morton | 205 |
参考文献
- Komuro, Y., Kumada, T., Ohno, N., Foote, K. D., Komuro, H. Migration in the Cerebellum. Cellular Migration and Formation of Neuronal Connections: Comprehensive Developmental Neuroscience. 2, 281-297 (2013).
- Altman, J., Bayer, S. A. . Development of the cerebellar system in relation to its evolution, structure, and functions. , (1997).
- Komuro, H., Rakic, P. Distinct modes of neuronal migration in different domains of developing cerebellar cortex. Journal of Neuroscience. 18 (4), 1478-1490 (1998).
- Komuro, H., Yacubova, E. Recent advances in cerebellar granule cell migration. Cellular and Molecular Life Sciences. 60 (6), 1084-1098 (2003).
- Fahrion, J. K., et al. Rescue of neuronal migration deficits in a mouse model of fetal Minamata disease by increasing neuronal Ca2+ spike frequency. Proceedings of National Academy of Sciences USA. 109 (13), 5057-5062 (2012).
- Raoult, E., et al. Pituitary adenylate cyclase-activating polypeptide (PACAP) stimulates the expression and the release of tissue plasminogen activator (tPA) in neuronal cells: involvement of tPA in the neuroprotective effect of PACAP. Journal of Neurochemistry. 119 (5), 10-1111 (2011).
- Cameron, D. B., et al. Cerebellar cortical-layer-specific control of neuronal migration by pituitary adenylate cyclase-activating polypeptide. Neuroscience. 146 (2), 697-712 (2007).
- Renaud, J., et al. Plexin-A2 and its ligand, Sema6A, control nucleus-centrosome coupling in migrating granule cells. Nature Neuroscience. 4, 440-449 (2008).
- Komuro, H., Rakic, P. Dynamics of granule cell migration: a confocal microscopic study in acute cerebellar slice preparations. Journal of Neuroscience. 15 (2), 1110-1120 (1995).
- Nielsen, H. S., Hannibal, J., Fahrenkrug, J. Expression of pituitary adenylate cyclase activating polypeptide (PACAP) in the postnatal and adult rat cerebellar cortex. Neuroreport. 9 (11), 2639-2642 (1998).
- Hannibal, J. Pituitary adenylate cyclase-activating peptide in the rat central nervous system: an immunohistochemical and in situ hybridization study. Journal of Comparative Neurology. 453 (4), 389-417 (2002).
- Garcia-Rocha, M., Avila, J., Armas-Portela, R. Tissue-type plasminogen activator (tPA) is the main plasminogen activator associated with isolated rat nerve growth cones. Neuroscience Letters. 180 (2), 123-126 (1994).
- Ware, J. H., DiBenedetto, A. J., Pittman, R. N. Localization of tissue plasminogen activator mRNA in the developing rat cerebellum and effects of inhibiting tissue plasminogen activator on granule cell migration. Journal of Neurobiology. 28 (1), 9-22 (1995).
- Friedman, G. C., Seeds, N. W. Tissue plasminogen activator mRNA expression in granule neurons coincides with their migration in the developing cerebellum. Journal of Comparative Neurology. 360 (4), 658-670 (1995).
- Seeds, N. W., Siconolfi, L. B., Haffke, S. P. Neuronal extracellular proteases facilitate cell migration, axonal growth, and pathfinding. Cell and Tissue Research. 290 (2), 367-370 (1997).
- Basham, M. E., Seeds, N. W. Plasminogen expression in the neonatal and adult mouse brain. Journal of Neurochemistry. 77 (1), 318-325 (2001).
- Bourgault, S., et al. Molecular and conformational determinants of pituitary adenylate cyclase-activating polypeptide (PACAP) for activation of the PAC1 receptor. Journal of Medical Chemistry. 52 (10), 3308-3316 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved