Method Article
組織の変性/再生と癌の研究におけるマウス誘導テロメラーゼ対立遺伝子を利用
要約
Telomere and telomerase play essential roles in ageing and tumorigenesis. The goal of this protocol is to show how to generate two murine inducible telomerase knock-in alleles and how to utilize them in the studies of tissue degeneration/regeneration and cancer.
要約
テロメア老化中の組織の変性を引き起こす十分に確立されたドライバは、ゲノムの完全性およびその関連DNA損傷シグナル伝達およびチェックポイント応答の喪失である機能障害が誘発される。発生率が大幅に年齢とともに増加した癌は、短いテロメアの長さおよび高テロメラーゼ活性によって特徴付けられる。老化や癌におけるテロメア機能不全とテロメラーゼ活性化の役割を研究するために、プロトコルは、2つのマウス誘導性テロメラーゼを生成する方法を示しノックイン対立遺伝子4-ヒドロキシ(4-OHT)誘導性TERT-エストロゲン受容体(mTERT-ER)および LOX -Stopper-LOX TERT(LSL-mTERT)。プロトコルは、テロメア機能不全を誘導し、 生体内でmTERT-ERとLSL-mTERTマウスにおいて、テロメラーゼ活性を再活性化する手順について説明します。代表的なデータは、テロメラーゼ活性の再活性化は、テロメア機能不全によって誘発される組織の変性表現型を改善することができることを示している。 ORDで小胞体は腫瘍形成におけるテロメラーゼ活性化の影響を決定するために、我々は、前立腺を生成した腫瘍モデルG4のPB-Cre4のPten L / Lである p53 L / L LSL-mTERT L / Lおよび胸腺T細胞リンパ腫モデルG4 気圧- / - mTERT ER / ER 。代表的なデータは、テロメア機能不全により誘発されるゲノムの不安定性の背景におけるテロメラーゼの再活性化が大幅に腫瘍形成を増強することができることを示している。プロトコルは、mTERT-ERとLSL-mTERTマウスから神経幹細胞(NSCの)を分離し、in vitroでのNSCでテロメラーゼ活性を再活性化するために使用する手順について説明します。代表的なデータは、テロメラーゼの活性化は、インビトロで自己再生能及び神経発生を増強できることを示している。最後に、プロトコルは、両方のマウスFFPEにテロメアFISH(in situハイブリダイゼーション蛍光)を実行するための手順を説明します(ホルマリン固定し、パラフィンフィン組み込み)は、脳組織および培養細胞の中期染色体。
概要
テロメラーゼは、テロメアの維持に関与する酵素である。これらは、それらの完全性を保護する染色体の末端での反復配列である。テロメラーゼホロ酵素のコアコンポーネントは、テロメア1,2を繰り返し追加するための鋳型として働く逆転写酵素触媒サブユニット(TERT)及びRNAサブユニット(TERC)である。一般に、分化した体細胞では抑制されている間、テロメラーゼは、堅牢な活性を示し、生殖細胞において重要な役割を果たし、癌細胞および幹細胞。
mTERCとmTERTノックアウトマウスは、幹細胞および癌の両方におけるテロメラーゼの機能を研究するためのin vivoモデル系で大きな提供する。 mTERCとmTERTノックアウトマウス(G1)は、マウス3におけるテロメアの長い準備のために、明白な表現型を示さなかった。しかし、連続的に後半世代(G5-G6)にmTERCとmTERTノックアウトマウスをインターは、以下のような結果に最終的には進歩的なテロメアの侵食とは、高度に増殖性の組織4の深刻な変性を引き起こした。後期世代(G5-G6)mTERC - / -マウスは、精巣および生殖細胞枯渇におけるアポトーシスの高い率に不妊である。 G5、G6 mTERC - / -マウスはまた、アポトーシスおよび組織幹/前駆細胞コンパートメント4内の欠陥の自己再生能力の高い速度に骨髄、小腸および皮膚を含む高度に増殖性の組織における変性表現型を示す。後期世代mTERCの骨髄中の造血幹細胞- / -マウスの増殖能の低下を示すので、妥協自己再生能力、強化されたアポトーシスと、最終的に機能的な枯渇5,6。 - / -マウス7,8同様に、腸の陰窩において徐々に増加アポトーシス小体は、G1-G6 mTERCの各連続世代で観察された。 T機能不全のテロメアの彼悪影響インビトロにおいて成体神経幹細胞の増殖及びin vivoでの神経新生の両方が厳しく後期世代で損なわれたためmTERC(G4、G5)の高代謝回転の組織に限定していないように見える- / -マウス9 。幹細胞におけるテロメラーゼの役割は、いくつかの点で10,11老化時期尚早に似ている稀なヒトの遺伝性疾患の先天性角化異常症(DKC)における知見によって支持される。 DKCはジスケリン、コアテロメラーゼサブユニット、およびその他のジスケリン関連タンパク質12をコード化TERC、TERT、及び遺伝子の変異によって引き起こされる。平均では、DKC患者のテロメアは、年齢をマッチさせた対照の短い99%以上である。疾患の主な罹患率は、造血幹細胞の欠陥の維持によって引き起こされる再生不良性貧血、によるものである。そのような口腔白板症、爪ジストロフィー、精神retardati疾患の他の態様すべての精巣萎縮および肺合併症には、テロメラーゼノックアウトマウスの後期世代のものと密接に一致した所見を組織幹細胞および前駆細胞10の機能障害を示唆する。 DKC患者は、骨髄異形成症候群になりやすいですし、悪性の粘膜新生物の有病率の増加を持っている。従って、ヒト患者におけるテロメラーゼの欠乏は、後期世代テロメラーゼノックアウトマウスで観察された幹細胞の機能および腫瘍の素因の欠陥を再現する。
短いテロメアと高テロメラーゼ活性は、癌の特徴である。正常または前癌細胞が分裂するように、DNA二本鎖切断(DSB)13によって引き起こされるものと同様のテロメアおよび細胞チェックポイントの活性化の最終的な浸食が低いかまたは存在しないテロメラーゼ活性をもたらす。古典的なDSBは同様に、テロメア機能不全は、p53などの老化および/またはapoptosiなどの関連細胞応答を誘導することが示されている14,15だ。 p53の変異による不活性化されると、細胞周期と細胞の生存は、転座および地域の増幅および欠失16,17によって特徴づけプロ発癌性ミューテーターメカニズムを提供テロメア機能不全、を持つ細胞で増強されている。同時に、テロメア機能不全を続け、(さえp53ヌル細胞において)に関連横行染色体不安定性は、そのような癌の完全な悪性の進行を制約するように思われる。例えば、後期の世代のG4-G5 mTERC - / - INK4A / Arfの- / -マウスは、テロメアの消耗にINK4A / Arfの欠損マウスと比較して有意に減少したリンパ腫の発生率を示した。別の研究では、より高度な腺腫性病変G4 mTERTに- / - APCの分マウスは大幅に起因する大幅な増殖停止およびアポトーシス18,19へのAPC 分のマウスと比較して抑制された。ザ·テロメア機能不全によって誘発されるゲノムの不安定性は、腫瘍の進行はテロメラーゼの活性化は、癌細胞の生存および/またはp53依存性または非依存性チェックポイント機構を中和すると互換性のレベルにゲノムの不安定性を鎮圧によって部分的に悪性の進行を可能にし得るという推測を促す阻害することを観察。
テロメラーゼの再活性化を停止する、あるいは幹細胞の老化を逆転し、テロメラーゼ活性化は、ゲノムの不安定性を背景腫瘍形成を促進することができるかどうかことができるかどうかを調べるために、我々は2つの誘導性マウステロメラーゼ対立遺伝子を生成した。最初の1は4-ヒドロキシ(4-OHT)誘導性TERT-エストロゲン受容体(mTERT-ER)融合はノックイン対立遺伝子である。 4-OHTの非存在下では、mTERT-ER(指定mTERT ER / ER)についてホモ接合性のマウスは、テロメラーゼ活性が欠損している、従来のmTERT又はmと同じ細胞遺伝学と細胞表現型を維持するTERCノックアウトモデル。 4-OHTの処理の際に、TERT-ERタンパク質の活性とは、天然TERTタンパク質20、21に匹敵するレベルに復元することができる。第二 の対立遺伝子は、新規な誘導性TERTノックインイントロンのLoxP-ストッパー-のLoxPカセットを含有する対立遺伝子(LSL-あるmTERT); LSLの切除をCre介在時に、mTERTは内因性発現制御機構22で再表現される。
プロトコル
注:このプロトコルのすべてのステップは、UT MDアンダーソンがんセンターによって承認されている。
mTERT-ER対立遺伝子の1世代
- マウスのES細胞に液体酸素断片( 図1A) - PGK - - ネオノックインERT2-LBD(リガンド結合ドメイン)を含むベクトル上流とmTERTゲノム配列(イントロン2を通じてエクソン1) および LOXとインフレームでをターゲットに紹介エレクトロポレーションを持つ。
- 6-10日間の培養のネオマイシンでES細胞。ネオマイシン耐性クローンをピックアップし、48ウェルプレートで展開します。市販のキットを用いてゲノムDNAを抽出し、サザンブロットによってノックイン対立遺伝子を確認する。
- 倒立顕微鏡下でマイクロマニピュレーションキットをC57BL / 6胚盤胞に95%以上の正常な核型を持つ2のESラインを注入します。代理母23の子宮に胚盤胞を移植。 C57BL / 6 FEにハイグレード男性キメラ(70から90パーセント)をメイト男性。
- サザンブロットによってヘテロ接合mTERT-ERneo動物の遺伝子型判定を確認してください。
- のNeoRカセットを削除するには、ヘテロ接合mTERT-ERneo動物とEIIA-CRE動物メイト。ホモ接合を生成するために少なくとも3倍、さらにインターブリードヘテロ接合mTERT-ERの動物C57BL / 6動物にヘテロ接合性動物を交尾。
LSL-mTERT対立遺伝子の2世代
- トリプルストッパー - - ネオ -エレクトロポレーション23と、マウスのES細胞へのLoxP断片と(エクソン1およびイントロン2の間に、 図1B)mTERTゲノム配列ノックインのLoxPを含むベクトルをターゲットを導入する。
- 6-10日間の培養のネオマイシンでES細胞。ネオマイシン耐性クローンをピックアップし、48ウェルプレートで展開します。市販のキットを用いてゲノムDNAを抽出し、サザンブロット23でノックイン対立遺伝子を確認する。
- 麟蹄倒立顕微鏡下でマイクロマニピュレーションキットをC57BL / 6胚盤胞へのCTの95%以上が正常な核型を持つ2のESラインを。代理母23の子宮に胚盤胞を移植。 C57BL / 6雌ハイグレード男性キメラ(70から90パーセント)をメイト。
- サザンブロットによってヘテロ接合LSL-mTERT動物の遺伝子型判定を確認してください。
- ホモ接合性を生成するには、少なくとも3回のC57BL / 6匹、さらにインターブリードヘテロ接合LSL-mTERT動物とヘテロ接合動物メイト。
インビボでのmTERT-ERとLSL-mTERTマウスにおけるテロメラーゼの3。再活性化
mTERT-ERの場合
- 注射の前に、すべての手術器具を滅菌する。
- 50%(v / v)の酸素/ 50%(v / v)の一酸化二窒素のガス混合物中のイソフルラン室(誘導に4%、維持に2%)を有するマウスを麻酔。またはケタミン - キシラジン混合物(100メートルによりマウスを麻酔グラム/ kg体重+は10mg / kg体重)。
- 深い麻酔に達した後、誘導室から麻酔した動物を削除し、イソフルラン室(2%)に接続されたチューブの内側に頭を維持する。
- 動物が深く麻酔していることを確認するために、マウスの足のパッドをピンチ。乾燥から目を防ぐために、両眼に軟膏を入れてください。ポビドンヨード溶液を用いてマウスの背中を拭いてください。
- 背中の皮膚の下に精密トロカール(10g)でペレット化し、すべての方法2肩の間正中線にペレットをプッシュ遅い放出4-OHTを注入。
- 創傷クリップアプライヤーとの切開を密封し、麻酔からの回復のためのマウスを監視します。 10日後にクリップを削除します。手順がまもなく終了したので、補足熱は必要ありません。
- 4-OHTのペレットを用いた治療の期間は、研究の目的に応じて最適化されるべきである。
LSL-mTERTの場合
- タモキシフェン(10mg / mlの、コーン油に溶解した)(200μlの/ 25 g /日)を腹腔内に2日間連続注入する。
4.神経幹細胞の単離およびインビトロでテロメラーゼの再活性化
- マウスは二酸化炭素で安楽死させ、脳を除去する。メーカーごとのような市販の神経組織解離キットのプロトコールに従ってください。
- ボルテックスしないソリューション4.のための細胞培養培地1mlで溶液4ラベルバイアル中に凍結乾燥粉末を再懸濁ください。次いで、この溶液を分注し、後の使用のために-20℃で保存されるべきである。
- プレヒート使用前に15分間37℃で混合物。
- 溶液1(50μL)と溶液2(1900μL):酵素ミックス1を加えます。解決策3(20μL)および溶液4(10μL):酵素ミックス2を加えます。
- 最大400 mgの組織と渦のために1,950μlの酵素混合物1を準備します。 37℃で混合物を予備加熱する使用前に15分。
- 1日のマウスの脳を取り出し、そして嗅球と小脳を除去することによって、前脳を保つ。 4℃で除去し、店舗以来、冷たい培養液1ml中の前脳組織にしてください。 1時間以内に神経組織を処理することを確認してください。
- 消化あたり400 mgの限界を超えていないことを確認するために組織の重量を決定します。直径35mmのペトリ皿の蓋の上に脳を置き、メスを用いて脳をつぶす。
- を1mlピペットチップを用いて、バック15mlチューブにHBSS(ワット/ oののCa / Mg)をピペット片を1ml加える。 HBSS(W / OのCa / Mg)ので洗い流してください。室温で2分間、300×gで遠心し、慎重に上清を吸引。
- 予熱された酵素混合物1の1950μlを加える(ソリューション1および2)、400 mgの組織まで当り。 5分ごとに反転するか、チューブを振とうすることにより混合し、37℃で15分間、15mlチューブ中でインキュベートする。
- 20&#を追加することによって、組織サンプルあたり30μlの酵素ミックス2を準備956;溶液4の10μlに解決策3のlはその後に追加するサンプル。混合する優しく反転。ボルテックスしないでください。
- 機械的にゆっくりと上下にピペッティング10倍ワイド先端、火災研磨パスツールピペットを用いて組織を解離。気泡を形成することは避けてください。
- チューブを3分毎に反転し、10分間37℃でインキュベートする。
- ステップ4.11を繰り返し、組織が200ミリグラムより大きくしている場合は、4.12ステップ。
- 50mlチューブに載置された70μmのセルストレーナーに細胞懸濁液を適用する。セルストレーナーを通して10mlのPBSを適用します。室温で20分間300gで細胞濾過、遠心細胞懸濁液を破棄する。完全に上清を吸引。
- さらなる用途のために必要な体積の幹細胞培地で細胞を再懸濁する。
- LSL-mTERTのNSCでテロメラーゼを有効にするには、2日間の100μM4-OHTで細胞を処理する。 100μM4で培養液中で細胞を維持し、mTERT-ERのNSCにおけるテロメラーゼを有効にするには-OHT。
5.テロメアFISH
- 培養細胞からの中期染色体を準備します。
- FFPE(ホルマリン固定およびパラフィン包埋)組織切片を、キシレンで脱パラフィン化し、5分間エタノール系で再水和する各(100%、90%、70%、50%エタノール)およびPBSで5分間。
- メタノールでポストフィックス:酢酸(3:1)1〜2時間のために。各5分(70%、90%、100%エタノール)、空気乾燥、冷エタノールシリーズで脱水する。 5分間37℃で1×PBSで洗浄します。
- 2分間37℃にて4%ホルムアルデヒド中で染色体を変性させる。冷たいエタノール系列で5分間ずつ(70%、90%、100%エタノール)及び空気乾燥を脱水。
- 各スライドにPNAのハイブリダイゼーション混合物の12〜25μLを適用します。 (ハイブリダイゼーション混合物:70%ホルムアミド、0.06xのSSC、0.2%のBSA、0.5 ng /μLでのtRNA、0.5 ng /μLでテロメアまたはセントロメアプローブ)
- ラバーセメントでカバースリップをシール。 4メートル、80℃で後変性の染色体の調製物及び組織切片インチ湿潤チャンバーで2-4時間室温または37℃でハイブリダイズする。
- 洗浄バッファー2×15分間、室温で洗浄する。 (洗浄緩衝液:70%ホルムアミド、0.06xのSSC、pHは7.2)。 PBSTで室温で3×5分を洗ってください。顕微鏡検査のためのDAPIまたは遠赤色蛍光で対比染色スライド。
結果
ノックイン対立マウスmTERT-ERおよびLSL-mTERTを生成するための戦略は、 図1Aおよび1Bに記載した。具体的には、 のLoxP - トリプルストッパー - ネオ - LoxP配列フラグメントはLSL-mTERT対立遺伝子を生成するためにエクソン1およびmTERT遺伝子座のエクソン2の間に挿入した。 mTERT-ER対立遺伝子を生成するために、mTERT遺伝子とインフレームでERT2-LBDドメインはエキソン1のN末端 に挿入した我々は、テロメラーゼ一過4、4-OHTペレットで処理することにより、テロメア機能不全マウスにおいて再活性化されたときことを示した週間、退行性の表現型は、脳( 図2A)および精巣( 図2B)などの複数の臓器に改善することができた。後期世代G4 LSL-mTERT及びG4 mTERTからインビトロで培養細胞にテロメラーゼ活性化の影響を決定するために、我々は、単離された神経幹細胞(NSC)-ERマウス。我々は、テロメラーゼはテロメア機能不全のNSCで再活性化されたときに、NSCの自己再生能力は非常に有意に( 図3B)増強された( 図3A)の増加、およびインビトロで神経発生にされたことを示した。 - / - mTERT ER /テロメア機能不全との関連で腫瘍形成におけるテロメラーゼの再活性化の影響を決定するために、我々は、PB-Cre4のPten L / Lである p53 L / Lの LSL-mTERT L / L(前立腺腫瘍モデル)と気圧を生成後半世代コホート(胸腺T細胞リンパ腫モデル)ER。テロメラーゼは、8週間( 図4B)が注入( 図4A)又は4-OHTのペレットと、これらのマウスにタモキシフェン処理によって再活性化されたときに、腫瘍形成が大幅に両方の前立腺腫瘍モデル( 図4A)および胸腺T細胞リンパ腫モデルにおいて増強された( 図4B)。最後に、FFPEマウス脳組織にテロメアFISHを行うプロトコル( 図5)、中期染色体( 図5の挿入図)を報告した。

図1:(A)mTERT-ERノックイン戦略を。ターゲティングベクターテレビ; WT、野生型対立遺伝子。 KI、ノックイン対立遺伝子。 LA、左腕。 RA、右腕。 E1、エクソン1。 E2、エクソン2;ネオ、PGKプロモーター駆動ネオマイシン耐性遺伝子; ER、修正されたエストロゲン受容体(ERT2)リガンド結合ドメイン; DT、dyphteria毒素遺伝子。 (B)LSL-mTERTノックイン戦略。ターゲティングベクターテレビ; WT、野生型対立遺伝子。 KI、ノックイン対立遺伝子。 LA、左腕。 RA、右腕。 E1、エクソン1。 E2、エクソン2;ネオ、PGKプロモーター駆動ネオマイシン耐性遺伝子;ストッパー、3反復的な転写停止配列; DT、dyphteria毒素遺伝子。
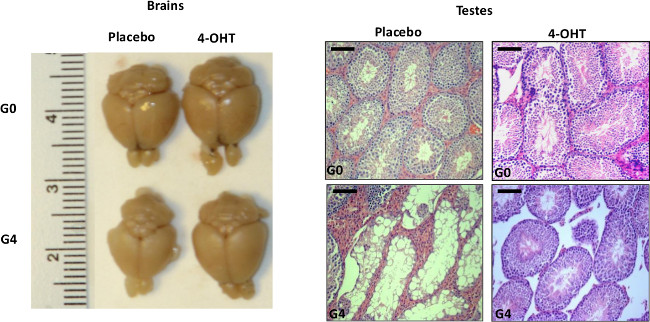
図2:代表的なデータは、テロメラーゼ活性化を表示するには、臓器の退行性の表現型を改善する脳の代表的な画像(左)。 4週間のプラセボまたは4-OHTで処置したG0とG4 mTERT-ERマウスの精巣(右)。スケールバーは、50μmを示す。再印刷20から許可を得て。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:神経幹細胞の代表的なデータは、テロメラーゼの再活性化は、インビトロで神経幹細胞の自己再生および神経発生を増強示す(A)代表的な画像G4のLSL-mTERTから分離S(上パネル) そしてG4 mTERT-ER(下パネル)は、車両または4-OHTで処理した幹細胞培地中で増殖する。神経幹細胞のin vitroでの神経新生(のTuj1 +)の(B)代表的な画像は、車両または4-OHTで処置した(1%FBSを含む)、分化培地で培養G4 mTERT-ERから単離した。スケールバーは、100μmを示す。
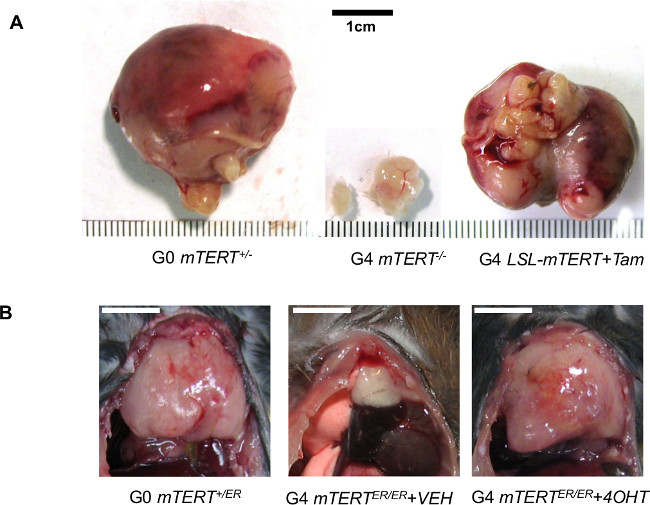
図4:テロメラーゼ活性化を表示する代表的なデータは、ゲノム不安定性を背景に腫瘍形成を強化する (A)/ Lの p53のL / L LSL-mTERT G0 PB-Cre4のPten Lから切開前立腺腫瘍の代表的な画像+/-、G4 PB- Cre4のPten L / Lである p53 L / Lの LSL-mTERT- / - 、およびG4 PB-Cre4のPten L / L p53 をタモキシフェンで処置したL / Lの LSL-mTERT L / L。 22から許可を得て再印刷。 (B)G0 気圧から切除胸腺T細胞リンパ腫の代表的な画像- / - mTERT + / ER、G4現金自動支払機- / - mTERT ER / ERは、ビークルで処理し、G4 現金自動支払機- / - mTERT ER / ERは 、4-で処理8週間OHT。スケールバーは1cmに示している。
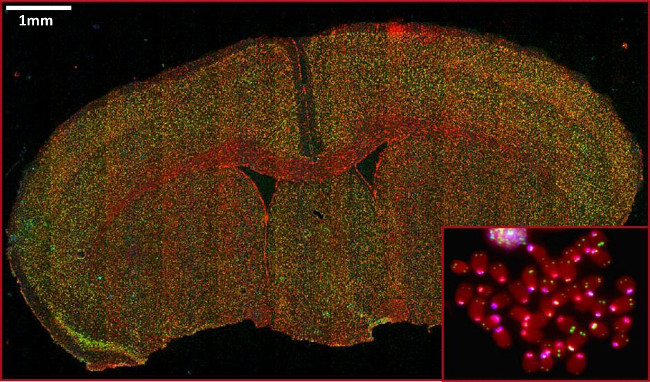
図5:FFPEマウス脳組織および中期にテロメアとセントロメアFISHの代表的な画像(挿入図)。赤緑テロメア染色を示し、DNAを示し、シアンのceを示しntromere染色。スケールバーは1ミリメートルを示している。
ディスカッション
ここで、我々は2つの誘導性マウステロメラーゼアレルとどのようにインビボおよびインビトロでテロメラーゼを再活性化するの生成を報告している。 mTERT-ER活性を再活性化するための重要なステップは、タモキシフェンの継続的な濃度を維持することですので、我々はアメリカの革新的な研究によって製造4-OHT時間放出ペレットを使用することを選択。ペレットは最大60日間、1 ng / mlの定常状態血中レベル4OHTを放出保つ。以前の研究では、この戦略にテロメラーゼ活性を再活性化は、そのような幹細胞の消耗、G4 mTERT ER / ERにおいてテロメア機能不全によって誘導された複数の器官における組織損傷応答および臓器不全の障害などの変性表現型を改善することができることを示したマウス20。
老化テロメラーゼの機能を研究する以外には、これらの2つの誘導性テロメラーゼ対立遺伝子はまた、癌を研究するために使用することができる。これまでの研究では、かかったこれらの対立遺伝子の利点は、ゲノムを成形し、T細胞胸腺リンパ腫21と前立腺癌22の生物学に影響を与えるにテロメア消耗とテロメラーゼ活性化の役割を探求する。 - / - mTERT ER / ERおよびG4 PB-Cre4のPten L / Lである p53 L / Lの LSL-mTERT L / Lマウスについての早期の変異原性のイベントの取得を給油の機構を提供するこれらの二つの研究は遅れて世代G4 気圧におけるテロメア機能不全があることを示した腫瘍の開始、まだ完全に悪性腫瘍の進行を予防する。テロメラーゼは、テロメア機能不全によって誘発されるゲノム不安定性、DNA損傷チェックポイントおよび横行染色体不安定性との関連で再活性化されたときに、前立腺癌21の骨転移および胸腺の脳の浸潤などの新しい生物学的特性を有する悪性腫瘍の完全な進行を可能にした、抑制されたCリンパ腫21。同様の現象はまた、大腸癌および膵臓癌(DRS。Haoqiang英、アダムBoutinとロナルドDePinhoとの個人的なコミュニケーション)を含む他の癌種で観察された。
TERT-ERタンパク質が容易に動物タモキシフェンまたはビヒクルで処置されているかに応じて、オン状態とオフ状態との間で切り替えることができるので、mTERT-ER対立遺伝子によって生成された腫瘍モデルは、抗テロメラーゼ療法を試験するために利用することができる。以前の研究では、G4 気圧で生成された腫瘍は、 - / - mTERT ER / ER動物は、4-OHTから解放された。テロメラーゼ枯渇すると、腫瘍は最終的に起因するテロメア機能不全誘発性のチェックポイント21の復職に縮小した。しかし、応答に耐性を獲得した腫瘍の一部は、テロメア(ALT)機構の代替長くすると活性化することによって消滅をテロメラーゼ。これらのALT +耐性腫瘍のさらなる特徴は、Tことを示したちょっとミトコンドリアの合成と酸化的防御PGC-1βのマスターレギュレータを含むミトコンドリアの生物学と酸化的防御に関与する遺伝子の異常な転写を持っている。テロメラーゼ+腫瘍細胞は21比較的無傷のまま維持しながら、PGC-1βまたはSOD2(酸化的防御の別のレギュレータ)のノックダウンは大幅にALT +腫瘍細胞を排除する。
これら二つのノックイン対立遺伝子の1つの制限は、彼らがテロメラーゼ遺伝子の天然の遺伝子座にあるため、彼らは唯一の内因性レベルのテロメラーゼの再活性化を余裕ができることです。ほとんどのヒト癌において、テロメラーゼは、実際にははるかに高いレベルで過剰発現される。テロメラーゼのレベルを高めるために、我々は考えることができるつの改変は、Rosa26遺伝子座へのPGK(ホスホグリセリン酸キナーゼ)プロモーターなどの強力なプロモーターを有するmTERT-ERコンストラクトを挿入することである。
結論として、これらの2つの新規な誘導性マウステロメラーゼ対立遺伝子は、前例のないジェネットを提供特に事前取得テロメア機能不全によって誘発されるゲノム不安定性の背景の下で、加齢および組織恒常性ならびに腫瘍進行におけるテロメラーゼの機能を研究するためのツールでIC。 mTERT-ER対立遺伝子はまた、他の腫瘍を起こしやすいマウスモデルに交差することにより、抗テロメラーゼ治療を研究するために使用することができる。
開示事項
The authors have nothing to disclose.
謝辞
J.H. is supported by NIH K99/R00 Pathway to Independence Award (5K99CA172700) and NCI Brain Cancer SPORE Career Development Award (2P50CA127001).
資料
| Name | Company | Catalog Number | Comments |
| Leica AM6000 Micromanipulation Kit | Leica | Per quote | |
| Leica DMI6000 B inverted microscope | Leica | Per quote | |
| Neomycin | Life technologies | 21810031 | |
| isoflurane vaporizer | Veterinary Anesthesia Systems | 911103 | |
| isoflurane | Henry Schein | 1005796 | |
| ketamine-xylazine mixture | Sigma-Aldrich | K113-10ML | |
| 4-OHT powder | Sigma-Aldrich | H7904-5MG | |
| Tamoxfien | Sigma-Aldrich | T5648-1G | |
| 4-OHT pellet | Innovative Research of America | Custermized | |
| Precision Trochar (10 Gauge) | Innovative Research of America | MP-182 | |
| wound clip applier | Fischer Scientific | 01-804 | |
| clip | Fischer Scientific | 01-804-5 | |
| Neural Tissue Dissociation Kit | Miltenyi Biotec | 130-092-628 | |
| HBSS | Life technologies | 14025092 | |
| PBS | Life technologies | 10010023 | |
| xylene | Fischer Scientific | X3P-1GAL | |
| methanol | Fischer Scientific | A-433S4 | |
| acetic acid | Fischer Scientific | A38-500 | |
| ethanol | Fischer Scientific | 22-032-104 | |
| formamide | Fischer Scientific | F84-1 | |
| PNA telomere probe | Panagene | F1001-5 | |
| PNA centromere probe | Panagene | F3003-5 | |
| 20X SSC | Fischer Scientific | BP1325-4 | |
| BSA | Sigma-Aldrich | A2153-10G | |
| tRNA | Sigma-Aldrich | R5636-1ML | |
| Tween 20 | Fischer Scientific | BP337-100 | |
| rubber cement | Walmart | Elmer's | |
| DAPI | Sigma-Aldrich | D9542 |
参考文献
- Bass, A. J., et al. Genomic sequencing of colorectal adenocarcinomas identifies a recurrent VTI1A-TCF7L2 fusion. Nat Genet. 43, 964-968 (2011).
- Beroukhim, R., et al. The landscape of somatic copy-number alteration across human cancers. Nature. 463, 899-905 (2010).
- Blasco, M. A., et al. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell. 91, 25-34 (1997).
- Lee, H. W., et al. Essential role of mouse telomerase in highly proliferative organs. Nature. 392, 569-574 (1998).
- Rossi, D. J., et al. Deficiencies in DNA damage repair limit the function of haematopoietic stem cells with age. Nature. 447, 725-729 (2007).
- Wong, K. K., et al. Telomere dysfunction and Atm deficiency compromises organ homeostasis and accelerates ageing. Nature. 421, 643-648 (2003).
- Rudolph, K. L., et al. Longevity, stress response, and cancer in aging telomerase-deficient mice. Cell. 96, 701-712 (1999).
- Wong, K. K., et al. Telomere dysfunction impairs DNA repair and enhances sensitivity to ionizing radiation. Nat Genet. 26, 85-88 (2000).
- Ferron, S., et al. Telomere shortening and chromosomal instability abrogates proliferation of adult but not embryonic neural stem cells. Development. 131, 4059-4070 (2004).
- Savage, S. A., Alter, B. P. Dyskeratosis congenita. Hematol Oncol Clin North Am. 23, 215-231 (2009).
- Armanios, M. Syndromes of telomere shortening. Annu Rev Genomics Hum Genet. 10, 45-61 (2009).
- Vulliamy, T., et al. The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita. Nature. 413, 432-435 (2001).
- Harley, C. B., Harley, S. W. Telomerase, checkpoints and cancer. Cancer surveys. 29, 263-284 (1997).
- Karlseder, J., Broccoli, D., Dai, Y., Hardy, S., de Lange, T. p53- and ATM-dependent apoptosis induced by telomeres lacking TRF2. Science (New York, N.Y.). 283, 1321-1325 (1999).
- Steensel, B., Smogorzewska, A., de Lange, T. TRF2 protects human telomeres from end-to-end fusions. Cell. 92, 401-413 (1998).
- Chin, L., et al. p53 deficiency rescues the adverse effects of telomere loss and cooperates with telomere dysfunction to accelerate carcinogenesis. Cell. 97, 527-538 (1999).
- Artandi, S. E., et al. Telomere dysfunction promotes non-reciprocal translocations and epithelial cancers in mice. Nature. 406, 641-645 (2000).
- Rudolph, K. L., Millard, M., Bosenberg, M. W., DePinho, R. A. Telomere dysfunction and evolution of intestinal carcinoma in mice and humans. Nat Genet. 28, 155-159 (2001).
- Greenberg, R. A., et al. Short dysfunctional telomeres impair tumorigenesis in the INK4a(delta2/3) cancer-prone mouse. Cell. 97, 515-525 (1999).
- Jaskelioff, M., et al. Telomerase reactivation reverses tissue degeneration in aged telomerase-deficient mice. Nature. 469, 102-106 (2011).
- Hu, J., et al. Antitelomerase therapy provokes ALT and mitochondrial adaptive mechanisms in cancer. Cell. 148, 651-663 (2012).
- Ding, Z., et al. Telomerase reactivation following telomere dysfunction yields murine prostate tumors with bone metastases. Cell. 148, 896-907 (2012).
- Nagy, A. Manipulating the mouse embryo : a laboratory manual. , 3rd Edn, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, N.Y. (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved