Method Article
HIV-1感染CD4の生得センシングを評価
要約
無細胞HIV-1粒子とは異なり、感染したCD4 + T細胞を効果的に形質細胞様樹状細胞(pDC)によって感知されます。この原稿は、I型IFNの放出によって評価した末梢血単核細胞(PBMC)または単離されたpDCは、pDCにすることにより先天的センスを評価するためにHIV-1感染T細胞と共培養する方法が記載されています。
要約
HIV-1先天性感知は形質細胞様樹状細胞(pDC)に感染したCD4 + T細胞の直接接触を必要とします。このプロセスを研究するために、ここで説明するプロトコルは、T細胞株(MT4)または異種の一次CD4 + T細胞のいずれかでの感染を検出するために新たに単離されたヒト末梢血単核細胞(PBMC)または形質細胞様樹状細胞(pDC)を使用します。適切な感知を保証するためには、PBMCを直ちに採血後に分離されて、感染T細胞の最適な割合を使用することが必須です。また、マルチパラメトリックフローサイトメトリー染色は、PBMCサンプルが、生理学的比率で異なる細胞系統が含まれていることを確認するために使用することができます。コントロールの数ものpDCの生存率および機能性を評価するために含めることができます。これらは、Toll様受容体(TLR)経路の既知のアゴニストに対する細胞応答を評価し、そしてSPONの欠如を確認し、特定の表面マーカーの存在を含みますtaneous I型インターフェロン(IFN)生産。このシステムでは、新たに単離されたPBMCまたはpDCには18-22時間、96ウェルプレート中のHIV-1感染細胞と共培養されます。これらの共培養物からの上清は、その後HEK-ブルーIFN-α/β細胞におけるISGF3経路の活性化をモニターすることによって、生物活性、I型IFNのレベルを決定するために使用されます。事前および共培養条件の間に、標的細胞を感染させた細胞の割合、特定の表面マーカーのレベルは、感染細胞の差動殺傷を含むパラメータの数を決定するために、フローサイトメトリー分析に供することができます。これらのプロトコルは、最初のI型IFN産生を追跡するために開発されたが、それらは潜在のpDCから放出され、他のimuno-調節分子を研究し、HIV-1生得センシングを支配する分子メカニズムへのさらなる洞察を得るために使用することができます。
概要
I型IFN産生のpDCは、ウイルス感染に対する防御の最初の行を表し、そのように自然免疫と適応免疫1の間に不可欠なリンクとして機能します。無細胞HIV-1粒子が乏しい生得の免疫系によって検出されているが、HIV-1感染CD4 + T細胞を効果的にpDCに2によって検出されます。感知機構は、その後のpDCによるウイルス捕捉および内在化が続いているのpDC、上の感染したT細胞およびCD4分子の表面でのウイルスエンベロープ糖タンパク質(gp120の)との間の最初の接触を必要とします。 TLR7によって転送されたHIV-1 RNAのその後の認識はMYD88 / IRF7経路の活性化を誘発し、最終的には、IFN産3-I型につながります。重要なことに、TLR9によって媒介されたpDC中に存在する第2検知経路は、PDC-特異的表面マーカーBDCA2 4に、ウイルス糖タンパク質、gp120の相互作用によって阻害されます。
のpDCの経路を感知TLR7およびTLR9は、潜在的に負ILT7 5と呼ばれる別のPDC-比表面積阻害受容体とBST2の係合(またTetherinまたはCD317と命名)によって調節することができます。 BST2のpDCは、いくつかの癌細胞の表面に、そのようなB細胞、マクロファージ、およびT細胞のような他の細胞型では比較的低いレベルで高レベルで発現されます。重要なことには、BST2は、形質転換された細胞株の数ならびにヒトおよびマウス起源6の初代細胞培養においてI型IFNによって誘導され得ます。離れて、その免疫調節機能から、BST2は最近HIV-1の放出を阻害することが見出され、他方は、感染細胞表面7上に架橋新生ウイルス粒子によってウイルス粒子エンベロープ。 HIV-1の場合には、ウイルスにコードされアクセサリータンパク質U(のVpu)はBST2アンタゴニストとして作用することが示されました。それのVpuは、HIV-1感染細胞の細胞表面からのテザーの部位BST2をダウンレギュレートすると考えられています活動をると、この概念が8,9に挑戦してきたが、結果として、ウイルスの放出を促進し、7を広げます 。 Vpuの非存在下で、完全に形成され、成熟した子孫のHIV-1の多数の粒子が細胞表面に保持されています。これらつながれた粒子は、免疫検出のために有効な標的を表すことができるかどうかはまだ未解決の問題のまま。さらに、それは、表面のVpu BST2レベルを調節することによってのpDCからのI型IFN産生を調節不全にすることができるかどうかは不明です。
HIV-1のセンスを評価するために設計された初期の研究は、一般的にI型IFN 3,10-12の悪い誘導物質と考えられている無細胞HIV-1粒子を用いて行きました。最近の研究では、PBMCおよびpDC には、効率的にHIVに感染したCD4 + Tリンパ球2,13,14を感知することを示唆していることを考えると、我々はここで、in vitroでのHIV-1感染細胞の認識の際のpDCによってトリガー生得的応答を測定するための簡単な方法を説明します。
プロトコル
一般的な注意事項
それも、細菌感染を制御したPBMCによって感知することができるので、任意の抗生物質なしに培養中の細胞を維持することが重要です。細菌成分の、このような検出は、特定のHIV-1検知によりトリガーとは区別することができない背景インターフェロン産生を誘導します。さらに、全ての細胞は、日常的にマイコプラズマ汚染の非存在について試験されなければなりません。
可能な限り、常にエンドトキシンフリーソリューションを使用しています。
異なる細胞のフローサイトメトリーの特徴付けは、共培養に使用される(PBMCが、pDCに、MT4及びCD4 + T細胞)はオプションのステップであるが、それは所定の実験の適切な解釈のために必要な貴重な情報を提供することができるので、非常にお勧め。
感染した標的細胞の調製
- RPMI 1640メディにヒトCD4 + T細胞株MT4を維持RPMI-1640完全培地としてこれから参照される10%ウシ胎児血清(FBS)を補充しました。
- 一次CD4 + T細胞の単離。
- 密度勾配遠心分離によりヒト末梢血から単核細胞を単離します。
- 製造業者の推奨に従って、CD4 + T細胞の陰性選択キットを用いてCD4 + Tリンパ球を単離します。
- 48時間PHA-LのCD4 + Tリンパ球 (5μg/ mlの)を有効にして、組換えIL-2(100 U / ml)を補充したRPMI-1640完全培地中で細胞を維持します。一次T細胞の5日後の分離に感染します。
- 標的細胞(MT4 T細胞株または異種の一次CD4 + T細胞)の感染。
- 共培養の前に二日は、HIV-1ウイルスをT細胞に感染します。ここに記載された特定の例ではpNL4.3-GFP_ires_Nef野生型(WT)またはpNL4.3-GFP_ires_NefデルタのVpu(dVpu)ウイルスが使用されました。これらのウイルス株は、GREを表します蛍光タンパク質(GFP)専用のVpuを表現する能力のみが異なる同質遺伝子型感染性分子クローンを-marked。
- 感染の異なる多重度(MOIで)を使用し、共培養のための感染症の同様のレベルでの文化を選択します。共培養の日、感染のマーカーとしてフローサイトメトリーによりGFP +細胞のパーセンテージを決定します。共培養のために20〜50%に感染した細胞の範囲でのみの文化を使用してください。
オプションのステップ:そのようなBST2、およびCD4のような目的の分子/リガンドの表面発現を評価するために、この時点でフローサイトメトリー染色を実行します。細胞表面染色のために、抗CD4_PerCP / Cy5.5の1μLのと抗BST2_A660の1μlを添加、洗浄溶液100μlの0.5×10 6 T細胞を再懸濁します。フローサイトメトリーの洗浄溶液で洗浄する前に、4℃で45分間チューブをインキュベートします。研究はのVpu媒介BST2拮抗作用の役割を評価することを目的としている場合は、HIV-1粒子を行いますこの時の放出アッセイは、以前に15を説明しました。
検出セル(全体のPBMCまたは濃縮のpDC)の2単離と濃縮
注:PBMCを感知するために使用される場合、血液採取後30分以内に分離を開始し、タイムリーな方法でそれを行います。共培養またはpDCの濃縮のためにすぐのPBMCを使用してください。
- 密度勾配遠心分離によりヒト末梢血から単核細胞を単離します。
オプションの手順:その新たに単離したPBMCを、生理学的比率で異なる細胞系統を含んで確認するために、マルチパラメトリックフローサイトメトリー染色を実行します。細胞表面染色のためには、Fcブロッキング溶液100μlで10 6のPBMCを再懸濁し、4℃で15分間インキュベートします。ブロッキング後、抗CD3_Pacificブルー、(骨髄細胞)抗CD14-PE_Texasレッドの1μL、抗BDCA2_APC4μlのと(pDCに用)抗ILT7_PEの1μL(T細胞)の1μlを添加します。インキュベートフローサイトメトリーの洗浄溶液で洗浄する前に、4℃で45分間チューブ。 - メーカーの推奨次のpDC陰性選択キットを使用したpDCを、豊かに。これは、高速に動作冷たい細胞を維持し、予め冷却したソリューションを使用することをお勧めします。これは最大のpDCの活動を確保するだけでなく、細胞表面と非特異的な細胞標識に対する抗体のキャッピングを防ぐことができます。
- 純度、濃縮の割合、および(例えばILT7とBDCA2など)pDC-特定の表面マーカーの相対量を確認するために、新たに単離したpDCのマルチパラメトリックフローサイトメトリー分析を実行します。細胞表面染色のためには、Fcブロッキング溶液100μlで10 4のpDCを再懸濁し、4℃で15分間インキュベートします。ブロッキング後、抗CD3_Pacificブルーの1μL、抗CD14_PE_Texas赤、抗BDCA2_APCの4μLおよび抗ILT7_PEの1μLの1μlを添加します。フローサイトメトリーの洗浄溶液(PBS、5で洗浄する前に、4℃で45分間チューブをインキュベートmMのEDTA、5%FBS)。 40%のpDC純度の最小値は(出発物質が0.4%のpDCを持っている場合、これは100倍の濃縮に相当します)をお勧めします。
感染したCD4 + T細胞および検出セル(全体のPBMCまたは濃縮のpDC)の3共培養
- にウェルあたり(10 6細胞 / mlに希釈した)感染したT細胞の30μlの(100,000〜500,000個の細胞/ mlの範囲の濃度で)(85万細胞/ mlに希釈した)PBMCの220μlあるいはたpDCの220μLを混合U底96ウェルプレート。
- 単独でコントロールプレートのPBMCまたはのpDCおよびT細胞など。 RPMI 1640完全培地でウェルに250μlの音量を調整します。
- TLR7およびTLR9経路の既知のアゴニストに対する細胞応答を評価します。この目的を達成するために、PBMCのプレート220μlをU底96ウェルプレートにウェル当たりまたは(10万〜500,000細胞/ mlの範囲の濃度で)pDCに200μlの(85万細胞/ mlで希釈した)および(TLR7アゴニストを追加イミquimod、最終濃度は2.5μg/ ml)またはTLR9アゴニスト(ODN 2216のCpG-A、最終濃度:5μM)。 37℃で細胞をインキュベートし、5%CO 2で 18-22時間、下記の共培養と同様の方法でそれらを処理します。
- 18-22時間37℃で共培養し、5%CO 2でインキュベートし、その後、V底96ウェルプレートに移します。 400×gで5分間遠心。
- 平底96ウェルプレートに上清を移します。上清を-80℃で貯蔵するか、即座にI型IFNの検出に使用することができます。
- 2%パラホルムアルデヒド中で共培養した細胞を再懸濁し、フローサイトメトリーを用いてそれらを分析。サイズと顆粒化の違いによる、MT4細胞は、前方散乱(FS)プロファイル対それらの側方散乱(SS)に基づいたPBMCまたはpDCを容易に区別しています。一次T細胞を対象に感染した細胞として使用される場合、これらは、共培養の前に、例えば、CSFEとして、任意の細胞追跡色素で染色することができます。
- HEK-ブルーIFN-α/βレポーター細胞を用いた生物活性I型IFNを測定します。
注:これらの細胞は、Iシグナル伝達経路IFN完全に活性型を得るために、ヒトおよびSTAT2 IRF9遺伝子をHEK293細胞の安定なトランスフェクションによって作製しました。彼らはまた、IFN-α/β誘導性ISG54プロモーターの制御下で分泌型アルカリホスファターゼ(SEAP)レポーター遺伝子を含みます。 I型IFNとのこれらの細胞の刺激は、JAK / STAT / ISGF3経路を活性化し、SEAPの産生を誘導します。- 10%FBSを補充したDMEM中で、HEK-ブルーIFN-α/β細胞を維持します。 180μlの最終体積で、平底96ウェルプレート中ウェルあたり50,000細胞の密度で、それらをプレート。
- 重複して各ウェルに共培養上清の20μlのを追加します。各プレートは、内部標準コントロール(ヒトIFNα、2500 U / mlの100 U /からの最終濃度)のセットが必要です。 18のために37℃でプレートを、5%CO 2でインキュベート-22時間。
- 酵素の存在下で紫/青にピンクから変更定量化・ブルー溶液を用いて、アルカリホスファターゼ活性のレベルを決定します。製造元の推奨に従って定量化・ブルーを用意。平底96ウェルプレートの各ウェルに、この溶液180μLを加えます。それぞれによくも誘発されたHEK-ブルーIFN-α/β細胞上清20μlのを追加し、色を標準IFN対照ウェルに発症するまで、37℃のインキュベーターでプレートをインキュベートします。
- 620から655 nmで分光光度計を用いてSEAPのレベルを評価し、IFN標準曲線の直線部分から外挿してI型IFNの濃度を決定します。
結果
図1で説明した共培養系は、HIV-1、先天性感知の対照研究を可能にします。一次細胞の可変性のために、それは、骨髄及びT細胞(それぞれCD14 +およびCD3 +)の通常の比は、図2Aに示す例のように、観察されることが重要です。また、活性化T細胞(非活性化T細胞と比較してより高いFS、高CD3レベル)だけ低い数は、新たに単離したPBMC培養物において望ましいです。様々な細胞型の間の異常な比率のPBMCを、しばしば、進行中の感染の結果としてすでに有効化表現型への可能性がin vitroでの適切な先天性免疫応答を、マウントすることができません。最も重要なことは、のpDCの相対的な割合は 、図2Bに示すように評価される必要があります。この割合は0.2から1.2%に変化させることができるが、異常検知表現型はまた、extreの両方で観察されましたこの範囲のMES。 図2B(92%および72%)での二つの例に見られるように、負の選択を使用したpDCの濃縮は、多くの場合、50から95まで%のpDCの純度が得られます。全体的な実験のための典型的な例は、 図3と図4に示されています。この例では、MT4細胞を共培養( 図3A)の時には30%の感染を達成するために、pNL4.3-GFP_ires_Nef WTまたはデルタのVpuを感染させました。前述のように、WTウイルスの感染のみが表面BST2( 図3B)の有意なダウンレギュレーションをもたらしました。サイズおよび粒度におけるそれらの違いに、MT4細胞を、フローサイトメトリー( 図4A)によりPBMCから容易に区別することができます。共培養のインキュベーションの後、I型IFN( 図4B)を大量に放出されたHIV-1感染細胞と接触している既知のTLR7またはTLR9アゴニストとのPBMCと接触しているだけのPBMC。いいえ、IFNは、PBMCを共同立方で、PBMC単独で検出されませんでした模擬感染MT4細胞とltured、単独感染MT4細胞( 図4B)です。ここに示す例では、PBMCによるHIV-1感染MT4細胞の生得的な検出は著しくのVpuの存在下で還元されることが見出されました。

図1:実験計画の概略図 SUP:上清を拡大画像を表示するには、ここをクリックしてください 。

図2:新たに単離したPBMCとENRの表現型の特徴iched pDCに。(A)骨髄細胞およびPBMCにおいて観察されたT細胞の正規分布は、(骨髄細胞の割合が55から65までパーセントの間で10〜20%とT細胞との間の範囲であるべきである)健康なドナーから単離しました。 PBMCを試料表面のCD14(骨髄系マーカー)およびCD3(T細胞マーカー)を認識する蛍光体結合抗体を用いて染色しました。 (B)のpDCの表現型の特徴。濃縮のpDCの前にしたPBMC中の細胞の合計数(図示の例では0.99%)の0.2から1.2パーセントの間で表します。これらの細胞は、細胞表面に存在するようなBDCA2とILT7などの特定のマーカーの発現に基づいて同定することができます。ネガティブ選択は、かなりのpDCの数を豊かにし、そのようなCD14 +骨髄細胞(濃縮は2つの例では92%と72%に達する)ように、潜在的に有害な汚染物質を除去するために使用することができる。CLI拡大画像を表示するには、こちらのCK。
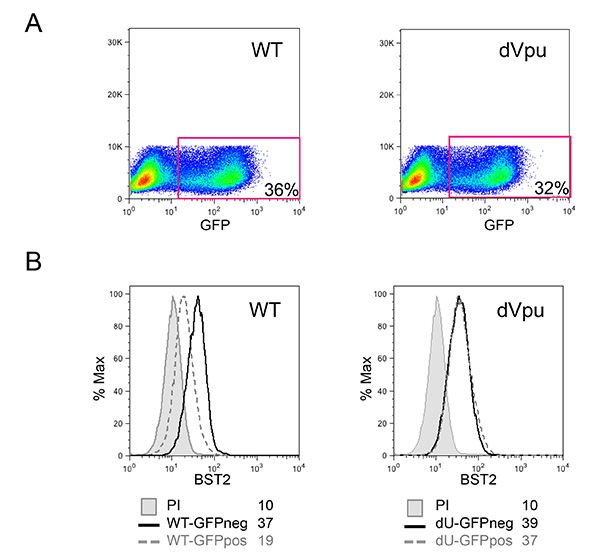
図3:pNL4.3-GFP_ires_Nef WTまたはdVpuに感染したMT4培養中で感染細胞のHIV-1感染の標的MT4細胞の特徴付け(A)の割合GFP陽性細胞の割合によって決定されます。感染細胞における(B)BST2の細胞表面発現は、表面染色後に評価しました。灰色のヒストグラムは、充填された免疫前ウサギ血清(非染色対照)で染色したモック感染細胞を表します。残りのヒストグラムは、抗BST2ポリクローナルウサギ血清で染色された細胞を表します。実線とヒストグラムは、コントロールのGFP陰性(NEG)細胞を表します。点線のヒストグラムは、感染したGFP陽性(POS)のセルに対応します。インフルエンザの平均orescenceの強度(MFI)値は、各試料について示されています。フローサイトメトリー図2で説明したように行い、分析した。 画像をクリックすると大きく見 。
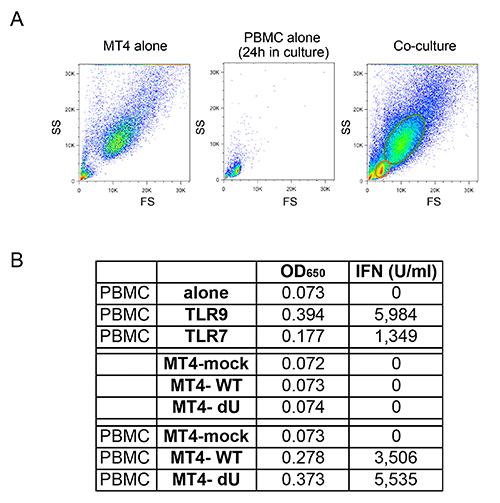
図4:新たに単離されたPBMCおよび感染MT4 T細胞の共培養 PBMCおよびMT4のT細胞との間だけでMT4 T細胞について観察されたFS / SSプロファイル、PBMC単独、または共培養のフローサイトメトリー(A)の比較。サイズおよび粒度の違いに、MT4 T細胞は、フローサイトメトリーを用いた共培養物におけるPBMCから容易に区別することができます。 (B)、TLRとのPBMCの刺激の後にリリースされたI型IFNの量の代表例7またはTLR9アゴニスト(前)、またはモックまたはpNL4.3-GFP_ires_Nef WTまたはdVpuに感染し、指示MT4細胞との共培養後。 IFN濃度-Iを入力するためのOD 650の値とそれに対応するconverseionはU / mlで表した。示した生データ画像をクリックすると大きく見 。
ディスカッション
プロトコルは、ここで我々の最近の報告18に記載されるように、のVpuを発現する能力においてのみ異なるGFPタグ化HIV-1ウイルスに感染したT細胞の指標を検出します。しかしながら、これらの方法は、容易にタグが付いていないウイルスの検知を研究するために変更することができるだけでなく、ウイルスは、潜在的に生来のセンシングを調節することができ、他のウイルス遺伝子を欠いています。 GFPを発現していない使用されるウイルスは、感染した標的細胞の割合は、P24(カプシド)などの、細胞内染色を共培養し、フローサイトメトリーまたはP24 ELISAによって流動する前に他の手段によって決定されるべきである場合。さらに、これらのプロトコルは、利用可能な細胞株および初代細胞の種々含む異なる標的T細胞と共に使用することができます。
HIV-1の感知を研究するために使用される初期の方法と比較すると、この原稿に記載された方法は、多数の利点を有します。まず第一に、それは、グループの数、無細胞HIV-1 pで確立されています記事は、I型IFN 2,13,14の悪い誘導物質です。さらに、初期の研究は、IFNが生産I型の量を定量化するために、古いIFNαELISAに基づく方法に依存していました。この検出技術の限界は、IFNα及びIFNβの他のタイプを眺めながら、古いIFNαELISAキットのほとんどは唯一、IFNαのいずれかのタイプを測定することです。ヒトI型IFNの全ての生物活性な形態の濃度を一度に測定することができるように説明したレポーター細胞株の使用は、この制限を克服します。技術は、IFN ELISAキットの新世代よりも安価で高感度であり、多くのドナーのためにI型IFNの多量を容易に検出することができます。それにもかかわらず、このプロトコルは、簡単にそのようなELISAのような他のI型IFN読み出し方法に使用するために適合させることができます。
重要なステップ:それはすべての細胞成分(ターゲットとエフェクターの両方)の品質を厳密に制御することが重要です。潜在的な汚染もasymptomaticは、監視し、制御する必要があります。我々は先に述べたように、無症候性細菌汚染を抗生物質は、制御され、そのようなマイコプラズマなどの潜在的な他の細胞内病原体は、HIV-1感染、I型IFNのすなわち製造後に観察したものと類似した免疫応答を生成することができます。また、全ての試薬は、LPSまたは他の潜在的な内毒素を含まないようにする必要があります。ヒトサンプルは、多くの場合、通常のセンシングに影響を与える可能性があり、基礎となる進行中の感染症、によってプライミングすることができるので同様に、PBMCおよびpDCを監視も重要です。我々は常に提案陰性対照、模擬感染細胞と、そのような標的細胞の欠如だけでなく、共培養を含むことをお勧めします。感染した細胞の生存率も、I型IFNは、アポトーシス細胞2,14との共培養後に産生されていないため、適切なのpDC検知のために重要です。
技術の一つの重要な制限は、新たに単離した初代細胞のために必要です。この手順ではありませんでしたいずれかの以前に凍結または培養中に維持したPBMCを、またはpDCにを使用してテスト。 PBMCの単離は、労働集約的であり、これらの細胞は、非常に限られた寿命を有しています。ヒト血液を操作しながらさらに、血液媒介病原体に対して保護するための標準プロトコルを使用する必要があります。新たに単離されたヒト細胞を伴う作業に関連する変動のいくつかの原因は、多くの場合があります。その中でも異なる手順では、これらの細胞を単離するために実装され、継承された変動は、ドナー・ツー・ドナーから発生しました。それはドナー間のばらつきを回避することは不可能であるが、例えば、TLR7およびTLR9経路の既知のアゴニストに対する応答を測定するように提案した陽性対照の使用は、これらの実験のための重要な内部対照を提供するであろう。私たちは応答TLR7経路がHIV-1 3に対する適切な対応のために必要とされている間、TLR9経路のアゴニストに対する強固な応答は、健康のpDC応答と相関させることができたことを観察しました。
2に基づいて、SS = "jove_content">。実験計画が必要とする場合、細胞が選択プロセスの後に抗体のないまましかし、負の選択(特定のpDC表面マーカーの枯渇が必要とされているコンテキスト内のインスタンスのために)、正の選択を超えることが好ましいです。単離したpDCは、文化の急速なアポトーシスを受けます。これらの細胞は長期間培養する必要が実験のために、培養培地は、IL-3を補充することができます。このサイトカインは、PDCの増殖を誘導し、そのアポトーシスを阻害する16。しかしながら、IL-3の使用は、それがPDC成熟または分化につながる可能性があるため、厳密に制御する必要があります。
ここで説明する方法は、先天性の検知時に関係する最初のステップを再現するために、新たに単離されたPBMCまたはpDCを有する標的HIV-1感染細胞を兼ね備えています。この方法は、間違いなくEXPLORに有用であろうHIV感染に関連した電子早期先天性免疫のイベント。関連するプロトコルは、I型IFNを測定することを目的としているが、それらは容易に感染細胞の認識の際のpDCから放出される他の生物活性分子を測定するように修正することができます。これらを含めることができます:III型IFN(IFN-λ)、およびケモカインCXCL10、CCL4、およびCCL5 17(TNF-αおよびIL-6など)、炎症性サイトカイン。
謝辞
我々は、フローサイトメトリーおよび細胞選別実験中の専門的な技術支援のために、E MassicotteとJ.主に感謝します。また、我々は、血液サンプルを提供するためのIRCMクリニックのスタッフとすべてのドナーに感謝したいと思います。末梢血サンプルは、研究所デRecherches Cliniquesモントリオール(IRCM)の研究倫理審査委員会によって承認された研究プロトコルの下で、ヘルシンキ宣言に従って書面によるインフォームドコンセントを与えた健康な成人ドナーから得ました。以下の試薬は、NIH AIDS試薬プログラム、エイズ、NIAID、NIHの事業を通じて得られた:博士ダグラスリッチマンからMT4細胞;人間のrIL-2博士モーリス・ゲートリー、ホフマンから - ラ・ロシュ社
博士コーエンは人間Retrovirologyカナダリサーチチェアの受信者です。この作品は、博士コーエンへとフォンデRECHERCHEケベック・サンテ(FRQ-S)エイズネットワークから博士BEGO博士コーエンにCIHR(CIHR 111226)からの助成金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| MT4 cells | NIH AIDS Reagent Program | 120 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: MT-4 from Dr. Douglas Richman. |
| HEK-Blu IFN-α/β reporter cells | Invivogen | HKB-IFNAB | |
| RPMI | Wisent | 350-000-CL | |
| DMEM | Wisent | 319-005-CL | |
| FBS | Wisent | 080-150 | |
| Ficoll-Pâque Plus | Myltenyi | 17-1440-03 | |
| CD4+ T cell isolation kit II | Myltenyi | 130-091-155 | |
| Diamond Plasmacytoid Dendritic Cell Isolation Kit II | Myltenyi | 130-097-240 | |
| PHA-L | Sigma-Aldrich | O2769 | |
| Human rIL-2 | NIH AIDS Reagent Program | 136 | This reagent was obtained through the NIH AIDS Reagent Program, Division of AIDS, NIAID, NIH: Human rIL-2 from Dr. Maurice Gately, Hoffmann - La Roche Inc. |
| Imiquimod | Invivogen | TLRL-IMQS | |
| ODN 2216 CpG-A | Hycult Biotec | HC4037 | |
| Human IFNα | PBL Interferon source | 11100-1 | |
| QUANTI-Blue | Cedarlane | REP-QB2 | |
| Flow cytometry (Antibodies/reagents) | |||
| Fc blocking solution (composition below): | Note: make in washing solution (PBS, 5mM EDTA, 5% FBS) | ||
| 10% Goat serum | Sigma-Aldrich | G 9023 | |
| 10% Rabbit serum | Sigma-Aldrich | R 9133 | |
| 10% Mouse serum | Sigma-Aldrich | M 5909 | |
| 2.5 mg/ml human IgG | Sigma-Aldrich | I 4506 | |
| anti-CD3_Pacific Blue | Biolegend | 300417 | |
| anti-CD14_PE-TxRed | Life Technologie | MHCD1417 | |
| anti-BDCA2_APC | Myltenyi | 130-090-905 | |
| anti-ILT7_PE | Biolegend | 326408 | |
| anti-CD4_PerCP/Cy5.5 | Biolegend | 317427 | |
| anti-BST2_Alexa 660 | eBioscience | 50-3179 | |
| Paraformaldehyde | Sigma-Aldrich | P 6148 | |
| Cell strainer | BD Falcon | 352340 | |
| Cyan ADP instrument | Beckman Coulter | CY20030 |
参考文献
- Colonna, M., Trinchieri, G., Liu, Y. J. Plasmacytoid dendritic cells in immunity. Nature immunology. 5, 1219-1226 (2004).
- Lepelley, A., et al. Innate sensing of HIV-infected cells. PLoS pathogens. 7, e1001284 (2011).
- Beignon, A. S., et al. Endocytosis of HIV-1 activates plasmacytoid dendritic cells via Toll-like receptor-viral RNA interactions. The Journal of clinical investigation. 115, 3265-3275 (2005).
- Martinelli, E., et al. HIV-1 gp120 inhibits TLR9-mediated activation and IFN-{alpha} secretion in plasmacytoid dendritic cells. Proceedings of the National Academy of Sciences of the United States of America. 104, 3396-3401 (2007).
- Cao, W., et al. Regulation of TLR7/9 responses in plasmacytoid dendritic cells by BST2 and ILT7 receptor interaction. The Journal of experimental medicine. 206, 1603-1614 (2009).
- Bego, M. G., Mercier, J., Cohen, E. A. Virus-activated interferon regulatory factor 7 upregulates expression of the interferon-regulated BST2 gene independently of interferon signaling. Journal of virology. 86, 3513-3527 (2012).
- Neil, S. J., Zang, T., Bieniasz, P. D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu. Nature. 451, 425-430 (2008).
- Miyagi, E., Andrew, A. J., Kao, S., Strebel, K. Vpu enhances HIV-1 virus release in the absence of Bst-2 cell surface down-modulation and intracellular depletion. Proceedings of the National Academy of Sciences of the United States of America. 106, 2868-2873 (2009).
- McNatt, M. W., Zang, T., Bieniasz, P. D. Vpu binds directly to tetherin and displaces it from nascent virions. PLoS pathogens. 9, e1003299 (2013).
- Manel, N., et al. A cryptic sensor for HIV-1 activates antiviral innate immunity in dendritic cells. Nature. 467, 214-217 (2010).
- Yan, N., Regalado-Magdos, A. D., Stiggelbout, B., Lee-Kirsch, M. A., Lieberman, J. The cytosolic exonuclease TREX1 inhibits the innate immune response to human immunodeficiency virus type 1. Nature immunology. 11, 1005-1013 (2010).
- Fonteneau, J. F., et al. Human immunodeficiency virus type 1 activates plasmacytoid dendritic cells and concomitantly induces the bystander maturation of myeloid dendritic cells. Journal of virology. 78, 5223-5232 (2004).
- Ankel, H., Capobianchi, M. R., Frezza, F., Castilletti, C., Dianzani, F. Interferon induction by HIV-1-infected cells: a possible role of sulfatides or related glycolipids. Virology. 221, 113-119 (1996).
- Schmidt, B., Ashlock, B. M., Foster, H., Fujimura, S. H., Levy, J. A. HIV-infected cells are major inducers of plasmacytoid dendritic cell interferon production, maturation, and migration. Virology. 343, 256-266 (2005).
- Bego, M. G., Dube, M., Mercier, J., Cohen, E. A. Effect of calcium-modulating cyclophilin ligand on human immunodeficiency virus type 1 particle release and cell surface expression of tetherin. Journal of virology. 83, 13032-13036 (2009).
- Grouard, G., et al. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand. The Journal of experimental medicine. 185, 1101-1111 (1997).
- Fitzgerald-Bocarsly, P., Jacobs, E. S. Plasmacytoid dendritic cells in HIV infection: striking a delicate balance. Journal of leukocyte biology. 87, 609-620 (2010).
- Bego MG, ., Côté, &. #. 2. 0. 1. ;., Aschman, N., Mercier, J., Weissenhorn, W. Cohen ÉA. Exploits the Cross-Talk between BST2 and the ILT7 Receptor to Suppress Anti-HIV-1 Responses by Plasmacytoid Dendritic Cells. PLoS Pathog. 11 (7), e1005024 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved