Method Article
植物タンパク質複合体の翻訳後修飾の同定
要約
ここでは植物性タンパク質複合体の精製および特性評価のためのプロトコルを記述します。私たちは、複雑な内部に単一のタンパク質を免疫沈降によって、私たちはその翻訳後修飾とその相互作用パートナーを識別できることを実証している。
要約
植物は認識を精巧に起因する環境の変化やシステムのシグナルに迅速に適応する。病原体の攻撃中に、植物は急 速に免疫複合体の動員および活性化を介して感染に応答します。免疫複合体の活性化は、例えば、リン酸化、グリコシル化、もしくはユビキチン化などのタンパク質の翻訳後修飾(PTMを)、関連付けられている。これらのPTMが振り付けしているか理解することは、抵抗が達成されるかのより良い理解につながる。
ここでは、ヌクレオチド結合ロイシンリッチリピート(NB-LRR)相互作用タンパク質を、それらの翻訳後修飾(PTMは)のその後の同定のためのタンパク質精製方法を記載している。小さな変更を加えて、プロトコルは、他の植物タンパク質複合体の精製に適用することができる。方法は、その後、部分bは精製される目的のタンパク質のエピトープタグ化バージョンの発現に基づいているyの免疫沈降およびタンパク質と相互作用するのPTMの同定のための質量分析に供した。
このプロトコルは、それを示しています。i)。リン酸化などのPTMの動的変化は、質量分析によって検出することができると、ii)。これは、目的のタンパク質の十分な量を有することが重要であり、これは免疫沈降物の純度の不足を補うことができると、iii)。目的のタンパク質のPTMをを検出するために、このタンパク質は、タンパク質の十分な量を得るために免疫沈降されなければならない。
概要
免疫経路は急速にシグナルを伝達し、1免疫応答を活性化するタンパク質の種々の翻訳後修飾(PTMは)に依存する。のPTMは、急速な可逆性、およびタンパク質コンホメーション、活性、安定性、局在化、タンパク質-タンパク質相互作用2-4に影響を与えることができるタンパク質構造の高度に特異的な化学的変化である。植物では、PTMを300以上のタイプは、ユビキチン化、SUMO化、硫酸化、グリコシル化、およびリン酸化2,5を含む同定されている。証拠の成長体は、植物免疫1,5,6の異なる側面にあるのPTMの重要性を強調しています。タンパク質リン酸化は、セリンへのリン酸基の可逆的な取り付けは、スレオニン又はチロシン残基が多くの細胞機能の調節因子であり、驚くべきことではないが、最も高度にカスケードを5月11日のシグナル植物防御にPTMを学ぶ。リン酸化依存性のシグナル伝達は、植物DEFEの不可欠な部分であるNSEの活性化は、膜貫通型受容体による微生物の細胞外知覚、またはマルチドメイン耐性タンパク質5,8による細胞内認識後に開始された。
植物に侵入すると、微生物はパターン認識受容体(PRR)12と呼ばれる原形質膜受容体によって検出される。公知のPRRは、受容体様タンパク質(たRLP)または受容体様キナーゼ(RLKs)、リガンド結合細胞外ドメイン、単一の膜貫通ドメインを担持する両方のいずれかである。のRLPとは対照的に、RLKsは、細胞内キナーゼドメイン13-15を有する。のPRRの細胞外ドメインは、細胞内ドメイン6、16内の自己リン酸化およびトランスリンに、RLKs例で病原体関連分子パターン(PAMP)をリードする、と呼ばれる保存された微生物エリシター分子に結合する。 PRRは知覚により誘導されるリン酸化の下流で、キナーゼ17を含む細胞質タンパク質のその後のリン酸化、 18 pは、E3は19リガーゼ、マイトジェン活性化プロテインキナーゼ(MAPK)20、21、カルシウム依存性タンパク質キナーゼ(CDPK)PAMPトリガ型免疫(PTI)の22,23、および転写は24因子、25のリード。
のPRRによる細胞外の認識に加えて、病原体の細胞内認識は、細胞質の受容体を介して実現されます。これらのマルチドメイン抵抗(R)タンパク質は、中心ヌクレオチド結合(NB)モチーフおよびC末端ロイシンリッチリピート(LRR)、変数N末端 ドメインを含有し、したがって、NB-LRRタンパク質26、27と呼ばれる。 Rタンパク質は、直接的または間接的にものPRRおよび免疫系の他のノードを対象とすることが知られているエフェクターと呼ばれる病原体由来の病原性の分子を認識する。認識はエフェクタートリガ免疫(ETI)28〜31につながる強力な防御を誘導する。 NB-LRRタンパク質はrequisiを持っているTE NBドメイン30、32内のATP結合モチーフが、それらは、キナーゼドメインを欠いている。 NB-LRRをの保存されたドメインのリン酸化は、大規模なプロテオーム調査33に報告されているが、ETIに対するその関連性は不明である。 PTI同様に、NB-LRRタンパク質の活性化は、MAPKは34-37及び38-40 CDPKsを含む細胞質タンパク質のリン酸化をもたらす。最も重要なのは、エフェクター認識はNB-LRRタンパク質41と直接対話するアクセサリータンパク質のリン酸化につながることができます。いくつかの例は、NB-LRRタンパク質と相互作用するタンパク質をRIN4( シロイヌナズナ )とPtoの(トマト、トマト ) が含まれ、RPM1 42、43にそれぞれPrfを44、。 野火細菌による感染時に、エフェクタータンパク質AvrBは、受容体様キナーゼRIPK 45である可能性が最も高く、RIN4リン酸化を誘導 46。同様に、トマト、P.シリンエフェクター AvrPtoとAvrPtoBはPtoの47のリン酸化を誘導する。キナーゼドメインを欠き、トランス-リン酸化されなければならないRIN4とは対照的に、PTOは自己リン酸化48と基板49,50のトランスリン酸化することができる活性キナーゼである。 PTO作動シグナリングのエフェクター依存開始のため、そのキナーゼ活性を必要とするが、キナーゼデッドのPTOの変異体は、まだエフェクターに依存しない方法51に通知することができます。我々は最近、複数のPrfをしてPtoの52の分子や、同じコンプレックス内のPTO分子が47互いをトランスリン酸化することができることを含む、Prfを/ PTO系複合体がオリゴマーであることを実証することにより、これらの観察結果を説明した。我々は、順番に第Ptoの分子を活性化することをNB-LRRタンパク質(PRF)のコンフォメーション変化(ヘルパー)ウィットを引き起こし、Ptoの(センサ)の一分子は、エフェクタータンパク質と相互作用するモデルを提案しコンプレックスをhinの。その後、ヘルパーPTOは、分子センサーPtoのは、複雑な抵抗47の完全な活性化につながるトランスリン酸化する。
これらの例は、エフェクターを認識すると、免疫複合体の構成要素とそれらの潜在的なPTMの同定は、信号が下流の標的にエフェクター感覚から形質導入されるかのより良い理解につながる可能性があることを示している。ここでは、NB-LRR相互作用タンパク質およびそれらのPTMのその後の同定のためのタンパク質精製方法を記載している。我々はモデルとしてベンタミアーナとトマトPrfを/ PTO系の複合体を使用していますが、同じプロトコルを簡単にNからRLKsに適用することができベンサミとA.小さ な変更を加えたシロイヌナズナ 53我々はプロトコル内で説明するように。
プロトコル
注:特に断りのない限り、すべてのステップは、室温で行われる。
1。植物材料およびバッファの準備
- Nのベンサミ
- 28時(適切な抗生物質を含むL培地)液体培養中で(200 rpm)を振ることにより、一過性発現(この例では、PRF-FLAG、PRF-3xHA、のPTO FLAG対照として空ベクター)のための目的のアグロバクテリウム·ツメファシエンス株を成長させる定常期までCと°。
- 収集し、遠心分離(5分間3000×gで)でアグロバクテリウムペレット。上澄み液を捨て、浸透液中でペレットアグロバクテリウムを再懸濁。
- 600nmの吸光度での光学密度(OD)値(Absを600 nm)を求めることによりアグロバクテリウムの量を測定する。 0.1〜0.8への細菌の外径を調整します。
- 4週齢のN.潜入ハンによるアグロバクテリウムとのベンサミ植物 (22℃、16時間明)D(1-mlのニードルレス注射器を用いて)、または真空によって(0.02%v / vの界面活性剤を添加)。
注意:最初にほぼ完全に展開された葉を使用し、最も効果的なタンパク質発現のための2すぐに古い葉。ユビキチン化やアセチル化タンパク質の検出のために100 nMのMG-132または100 ng / mlのトリコスタチンAは、それぞれ、1時と2日後に浸潤した葉に浸潤する。 - 浸潤した葉2〜5日後の浸潤し、液体窒素中で凍結を収穫。 -80℃の冷凍庫でサンプルを格納。
注意:事前に5日間の時間経過にわたってサンプルを採取し、免疫ブロッティングによりタンパク質レベルを検出することで、目的のタンパク質の発現の最高のレベルを決定します。
- Aのシロイヌナズナ安定したトランスジェニック系統
- A.を育てる6ウェルプレート中のシロイヌナズナ種子を、ウェル当たりの液体MS培地5ml(w / vショ糖1%)を補足した。トランスジェニック系統の5種子(滅菌して成層)に3を入れて観光スポットまたはウェルあたり非形質転換コントロールラインの。成長室にプレートを転送する前に、2日間、200 rpmで振とうすると2週間(22℃、10時間明)に向けて出発。
- 収穫試料および液体窒素中で凍結。
注:コントロールとして、目的のタンパク質と同じタグで関連のないタンパク質を発現するトランスジェニック系統を使用することができます。
- バッファ
- 1〜2時間緩衝液A脱ガスのバッファを準備します(RLKsのため、他の膜結合タンパク質や核タンパク質は1%v / vのIGEPAL CA-630 53を追加)。
注意:あなたはいつまでも4℃で緩衝液Aを維持することができます。あなたは、トリトンの代わりに、IGEPAL CA-360 V / V 1%を使用することができます。 - 抽出の前に冷たい緩衝液Bは少なくとも1〜2時間の80ミリリットルを用意します。
注:抽出緩衝液対組織の理想的な比は1:4(w / v)である。
- 1〜2時間緩衝液A脱ガスのバッファを準備します(RLKsのため、他の膜結合タンパク質や核タンパク質は1%v / vのIGEPAL CA-630 53を追加)。
2。タンパク質抽出
- ただ、抽出前に冷たい緩衝液Cの80ミリリットルを用意
注意:ユビキチン化タンパク質の検出のために、10μMのMG-132を追加します。 - Nの20グラムを挽くベンサミ組織(約15葉)またはA乳鉢と乳棒を用いて液体窒素中でシロイヌナズナ実生(6ウェルプレート当たり2〜4グラム)。
- 、地上組織20gに冷たい緩衝液Cの80ミリリットルを追加し、よく混ぜて、氷の上で解凍する。
注:同じ時間(関心と制御のタンパク質)ですべてのサンプルを挽く。 - (4℃で予冷)組織ホモジナイザーフルスピードで10秒ずつの3バーストによって均質化する。 4で30分間、30,000×gで22〜25ミクロン組織及び遠心分離機でろ過 ℃、
注:または、新鮮な予冷乳鉢と乳棒で均質化する。 - アフィニティーマトリックスのブロッキングおよび洗浄工程のために、バッファD. 20mlのを準備
- ブロック4で5分間、1%BSAを含有する冷緩衝液Dを500mlを使用して、適切なアフィニティーマトリックスを100ml ℃、
注:優先AFfinity行列は、抗FLAG M2アガロース、ストレプトアビジンアガロース、GFP-Trap_Aおよび抗HAアガロースを含む。 - 1ミリリットル冷たい緩衝液Dで洗浄3X
- 氷上の新しいチューブに0.45μmのシリンジフィルターを通して葉エキス、フィルタの上澄みを取り除きます。
注:抽出液の色が緑または黄色である必要があります。サンプルが茶色になっている場合は、破棄して最初からやり直す。 - イムノブロットのために粗抽出物のアリコートを取り、5×SDS-PAGEローディング緩衝液を追加し、ボルテックスし、80〜10分間、サンプルを煮沸することにより変性させる ヒートブロックのCを°。
3。タンパク質免疫沈降
- 2 50ミリリットルチューブにタンパク質抽出物を分割し、各チューブに緩衝液Dに懸濁親和性マトリックスの50μlを加える。 4℃で2時間穏やかに回転させながらインキュベートします
注意:インキュベーション時間が長いほど、歩留まりを高めることが見出されていない。 - を添加することによって溶出緩衝液の600μlの(親和性マトリックスの6倍ビーズ容量)を調製緩衝液D(最終濃度):0.5%BSA、(抗FLAG M2アガロース用)0.25 mg / mlのFLAGペプチド、または(ストレプトアビジンアガロース用)10 mMのD-ビオチン。
溶出は、GFP-Trap_Aおよび抗HA行列の場合には推奨されませんので、1×SDS-PAGEローディング緩衝液中で煮沸することに直接進む、ステップ3.11:注意してください。 - 4℃(千×gで5分)で遠心分離してアフィニティーマトリックスを沈殿させる。
- イムノブロットのために結合していない抽出物のアリコートを取り、上澄み液の残りを廃棄し、チューブの底に約500μLを残す。
- ワイドボアチップ付きスラリー溶液を再懸濁します。
- シングル1.5ミリリットルチューブに両方の管からの混合スラリー溶液を転送します。
今後は、1.5ミリリットルの低タンパク質結合マイクロチューブを使用します。注意してください。 - 親和性マトリックスを沈殿させ、上澄みを除去するための卓上遠心機を用いて5秒間のパルス3X。
- 洗浄の間に1ミリリットル冷緩衝Dで3-5Xを洗浄し、親和性matriを沈殿させるX、前述のように、上清を捨てる。最後の洗浄では、注射器の針を用いて過剰の緩衝液Dを削除します。
注:0.1%IGEPALによりバッファDを使用して、最終洗浄は、さらに、非特異的結合を低減するために使用することができる。 - 振盪しながらその都度、適切な溶出バッファー(抗FLAG M2またはストレプトアビジンアガロースステップ3.2を参照してください)3X、5分200μlで溶出する。
- 単一のチューブ内の3溶出液をプール。吸収性樹脂の30μLを使用してタンパク質を集中。渦は、5分間放置し、樹脂(10,000×gで2分間)沈殿させてみましょう。上清を捨てる。
注意:GFP-Trap_Aおよび抗HAアガロースの場合は、ステップ3.9および3.10をスキップします。 - 沈殿した親和性マトリックスまたは吸収樹脂に1X SDS-PAGEローディング緩衝液50μlを追加します。 80〜100℃で10分間ボルテックスし、沸騰 ヒートブロックのCを°。
- 遠心万×gで2分間煮沸アフィニティーマトリックスまたは樹脂。 supernatanの分量5μLイムノブロットのためのT、および約10センチ、SDS-PAGEゲル( 図2)の上に他の画分で実行されます。
- 余分な分離が必要な場合は、質量分析によるリン酸化タンパク質の分離および同定のために、( 図2)〜19センチ、長SDS-PAGEゲル上に残りの45μLをロードします。
注:ブランク、レーンは、サンプルの汚染を低減するために、すべてのサンプルとの間に含めることができる。
4。タンパク消化
- コロイド状クマシーブリリアントブルー(CCBB)染色でのSDS-PAGEゲルを染色。
注:ケラチンによる汚染を減らすために、ゲルの取り扱いを最小限に抑えます。機器やツールのいずれもイムノブロット法や残留タンパク質の混入を残している可能性のある他の活動に使用されていないことを確認してください。 - 水に大量の洗浄、好ましくはO / Nを有するゲル脱色清潔なかみそりの刃でゲルから目的のバンドをカットします。
注意:イムノブロットを有するゲルを合わせた場合necessa正しい地域を特定するRY。リン酸化は、SDS-PAGEでタンパク質の移動を遅らせることができるように、すぐに目的のバンドの上下の領域をカット。 - 2〜4ミリメートルの立方体にゲルスライスをDICE(これはゲルがピペットチップをブロックすることなく、チューブ内の溶液でカバーされることを保証する)。チューブ内に配置します。
- よく水没ゲルを維持するために必要な容量を見積もります。誘導体化、タンパク質分解酵素およびペプチドの抽出とのインキュベーションのためにこの金額を使用し、洗浄のためのトリプルボリュームに二重を使用しています。
注:標準では、切断されたゲル片を約100μlのダイジェスト洗浄に500μlのソリューションを使用して、脱水のための2×180μL、還元、アルキル化のために120μL、および消化のために120μL、150μL。 - (50 mM重炭酸アンモニウム、ABC)で50%アセトニトリルを添加してゲル片を2×20分間(または脱色するまで)を洗浄する。ゲル片を除去しないように注意しながら解決策をオフにピペット。
- 100%アセトで脱水5分間のニトリルと無料の液体を除去。
注:ゲルが収縮し、白表示されます。青色が解決しない場合は、アセトニトリル/ ABCおよび/または高温(45〜55℃)で長くインキュベートする。 - 水に10のDTTを追加することによって、タンパク質ジスルフィド結合を還元し、振とうしながら56ºCで30〜45分間インキュベートする。自由な液体を除去する。
- 20〜30分(室温、暗)のために(50 mMのABC)で55 mMのクロロアセトアミドを添加することによりアルキル化するシステイン残基。自由な液体を除去する。
- (50mMのABC)で50%アセトニトリルで洗浄ゲル片を2×10分間。自由な液体を除去する。
- 5分間、100%アセトニトリルでゲル片を脱水し、自由な液体を除去する。
- トリプシン消化のために、使用液(50 mMのABC、平均クマシー染色バンドのための5%アセトニトリル消化緩衝液中のトリプシン100ngの)トリプシンの40μlを加える。ゲル片を10分間再水和することができます。必要に応じて、ゲル片を覆うように消化緩衝液を十分に入れる。 37ºCでインキュベートするO / N
- 消化を停止し、ゲル片からペプチドを抽出し、5%ギ酸(50%アセトニトリル中)(消化容量と同じ容量を追加する)を追加する。 5〜10分間超音波処理。上清を新しいチューブに移します。抽出3回繰り返します。
- 凍結乾燥(推奨)または(そのようなスピード-VACまたはサヴァンなど)、真空濃縮装置によりペプチドを乾燥させます。 -20ºCで通販
- 質量分析のためにサンプルを提出してください。
注意:我々は、セインズベリー研究所(ノリッジ、英国)での質量分析施設に当社のサンプルを提出した。質量分析施設のプロトコルはかなり異なるが、典型的には、ペプチドはタンデム質量分析法 - エレクトロスプレーのために結合された液体クロマトグラフィーシステム上にロードする前に、2%アセトニトリル、0.2%トリフルオロ酢酸に溶解する。
結果
ここでは、安定したトランスジェニックAからのタグ付きタンパク質の精製の ためのプロトコルを記述シロイヌナズナ系統またはNのタンパク質の一過性発現後ベンサミ 。 図1に示されるように、標的タンパク質の精製は、相互作用タンパク質と標的蛋白質のPTMの同定を可能にするために質量分析と連結されている。プロトコルは、植物免疫およびそれらのPTMの同定に関与するタンパク質の精製のために設計されているが、任意のタグ化植物性タンパク質の精製に適用することができる。
一例として、我々はNからPrfを/のPTO複合体の精製を使用ベンサミアナ。トランスジェニックN.ベンサミライン38から12 54、35Sを表現:PRF-FLAGおよび複合体は、抗FLAG M2アガロース( 図2A)で免疫沈降した:PTO、一過35Sで形質転換した。 図2(a)のイムノブロット(IB)標的タンパク質(PRF)の大部分は免疫沈降したことを示している。 PTOと相互作用するエフェクタータンパク質AvrPtoBはPrfを用いて同時精製抗体および質量分析( 図2Aおよび2B)を用いて検出した。 AvrPtoおよび35S:AvrPtoB( 図2A)私たちは、エフェクターと共発現させた場合にPrfをと同時精製PTO作動35Sを構築SDS-PAGEゲル上で遅く移行することを見出した。両方のエフェクタータンパク質は、PRF-Ptoの相互作用( 図2A)のより遅い移動を誘導した。それは、ホスファターゼ44での処理によって除去することができるように、このエフェクターPtoの認識に依存する遅い移動は、以前にリン酸化に起因するものであった。 Ptoのが遅い移行に寄与するリン酸化部位を検出するために、我々は、質量分析にPtoのをPrfを同時精製を行った。 Ptoのを高発現し、免疫ブロットとの容易な検出にもかかわらず、我々はペプチドCを取得することができ前記PTOシーケンスの唯一の57%overing、我々はいかなるリン酸化部位( 図2B)を識別することができなかった。
その後、我々は抗FLAGでのPTOタンパク質をターゲットに戦略を変更しました。N. PRF-3HAおよび35S:のPTO FLAG、または35Sなし:AvrPtoおよび35S:ベンサミのWT植物は一過35Sで形質転換した。AvrPtoB PRF-複合体を形成し、自由な形態の両方を含む前記PTOタンパク質、の総量は免疫沈降させた抗FLAG M2アガロースとSDS-PAGEで分画し、ゲル内トリプシン消化および質量分析( 図2C)を有する。このアプローチでは、我々はその配列の約80%に及ぶのPTOペプチドおよび未知の100kDaの相互作用するタンパク質を同定した。我々は、前記PTOペプチド187から202と188から202のための単一および二重リン酸化部位のセット( 表1)を同定した。のSer-198およびThr-199が優勢のリン酸化部位が、他のフォーでしたsphorylation部位も検出された( 表1)。最も重要なことのSer-198およびThr-199上の二重リン酸化のみエフェクタータンパク質( 表1)のいずれかの存在下で同定された。我々は最近のPTOリン酸化部位の同様のセットを特定し、47に信号を送るための二重リン酸化イベントの重要度が示されている。ここで述べた手順に従って、我々は、標的タンパク質のリン酸化状態の動的変化を識別することができた。
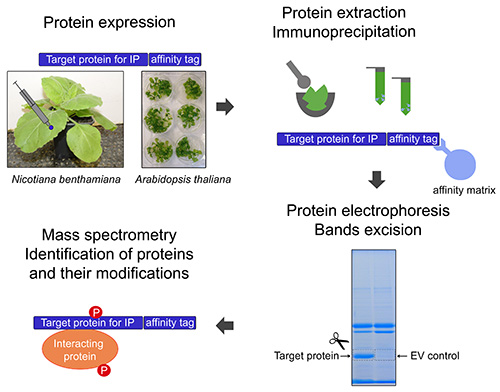
図1。一般的な実験計画。標的タンパク質の免疫沈降(IP)のための一過ベンサミアナタバコや安定的シロイヌナズナにおいて、 植物体でタグ付けされ、発現されている。以下のタンパク質抽出標的タンパク質は、親和性マトリックスを用いて免疫沈降される。タンパク質を電気泳動によりアクリルアミドゲル上で分離する。ゲルのバンドを切除している。タンパク質は、ゲルのバンドから抽出し、質量分析に供される。リン酸化部位と相互作用するタンパク質を同定する。 拡大画像を表示するにはここをクリックしてください。

図2。Prfをし、前記PTO免疫沈降。A)。構文35S:AvrPtoまたは35S:AvrPtoB空のベクター(EV)、35Sと一緒に:PRF-FLAGを一過38から12行(PTO 35S)で発現させた。三日後の浸潤をPrfを、抗FLAGアフィニティーマトリックスを用いて免疫沈降させた。免疫Prfを、AvrPtoBとPtoのためnoblots(IB)が実施された。前記PTOイムノパネルの下部にある矢印で指摘したように、AvrPtoとAvrPtoBはPtoの。、Bのいずれか遅い方の移動を誘発する)。構文35S:AvrPtoまたは35S:AvrPtoB空のベクター(EV)、35Sと一緒に:PRF-FLAGを一過38から12行(PTO 35S)で発現させた。三日後の浸潤をPrfを、抗FLAGアガロースを用いた免疫沈降し、SDS-PAGEで分離した。ゲルをコロイド状クーマシーブリリアントブルー(CCBB)で染色し、可視Prfを、PtoのとAvrPtoBタンパク質バンドをゲルから切り出し、質量分析によって分析した。質量分析により同定PtoのとPrfをシーケンスの割合ペプチドカバレッジが表示されます。C)。コンストラクト35S:PRF-3xHAおよび35S:のPTOフラグは一過35Sと一緒に発現させた:AvrPtoB、35S:AvrPtoまたはNに空のベクター(EV) ベンサミ 。三日後の浸潤総額PTO-FLAGは、抗FLAGアガロースを用いて免疫沈降し、SDS-PAGEで分離した。 Ptoの可視およびPtoの相互作用タンパク質バンドをゲルから切り出し、質量分析によって分析した。のPRF(矢印で示されているように)わずかに小さく表示されているのに対し、PTOおよび100kDaののPTO相互作用するタンパク質のバンドは、コロイド状クマシーブリリアントブルー(CCBB)染色ゲル上ではっきりと見える。 IP:免疫沈降、IB:イムノブロット; CBB:クマシーブリリアントブルー染色、CCBB:コロイド状クマシーブリリアントブルー染色。 拡大画像を表示するにはここをクリックしてください。
| PRF | |||
| EV | AvrPto | AvrPtoB | |
| PTOペプチド188から202 | |||
| GTELDQ [P T が 195] HLSTVVK | 1 | 1 | 0 |
| GTELDQTHL [P S 198] TVVK | 10 | 7 | 5 |
| GTELDQTHLS [P T が 199] VVK | 8 | 3 | 4 |
| G [P tは 190] ELDQTHLS [P T が 199] VVK | 0 | 1 | 2 |
| GTELDQTHL [P S は 198] [P T は 199] VVK | 0 | 8 | 4 |
| GTELDQTHLSTVVK | 46 | 26 | 48 |
| PTOペプチド187-202 | |||
| KGTELDQ [P T が 195] HLS TVVK | 0 | 1 | 0 |
| KGTELDQTHL [P S 198] TVVK | 17 | 17 | 12 |
| KGTELDQTHLS [P T が 199] VVK | 4 | 2 | 2 |
| KGTELDQ [P T 195] HLS [P T が 199] VVK | 0 | 1 | 1 |
| KGTELDQTHL [P S は 198] [P T は 199] VVK | 0 | 7 | 5 |
| KGTELDQTHLSTVVK | 21 | 37 | 18 |
| ペプチド187から202と188から202 | 83 | 88 | 50 |
| 2のリン酸化事象を有するペプチドの割合 | 0% | 26.9% | 11.2% |
| PTOシーケンスカバレッジ | 78パーセント | 79パーセント | 82パーセント |
表1のシグナル伝達の活性化時のPTOペプチドの二重リン酸化35S:PRF-3xHAおよび35S:のPTOフラグは一過EMと一緒に発現させたPTYベクトル(EV)、35S:AvrPtoまたは35S:NにAvrPtoBベンサミ 。三日後Ptoの浸潤-FLAGタンパク質の総量を、抗FLAGアフィニティーマトリックスを用いて免疫沈降し、SDS-PAGE上で分離した。コロイド状クマシーブリリアントブルー染色ゲルPTO入りの可視バンドを質量分析で切除し、分析した。前記PTO 0で同定されたペプチド、1、および2のリン酸化事象の数が示されている。
| バッファの表 | ||
| L培地 | トリプトン | 10g / Lの |
| 酵母エキス | 5g / Lの | |
| NaClを | 5g / Lの | |
| D-グルコース | 1g / Lの | |
| アグロ浸潤バッファー | 塩化マグネシウム | 10 mMの |
| MES | 10 mMの | |
| pH5.5に調整 | ||
| シリンゴン(オプション) | 150μMの | |
| バッファA | トリス-HCl pH7.5の | 150 mMの |
| NaClを | 150 mMの | |
| EDTA | 5 mMの | |
| EGTA | 2 mMの | |
| グリセロール | 5%(v / v)の | |
| 緩衝液B | バッファA | |
| PVPP | 2%(w / v)の | |
| 緩衝液C | 緩衝液B | |
| ジチオスレイトール(DTT) | 10 mMの | |
| 植物プロテアーゼインヒビターカクテル | 1%(v / v)の | |
| フッ化フェニルメチルスルホニル(PMSF) | 0.5 mMの | |
| カリクリンA | 50 nMの | |
| フッ化ナトリウム(NaFから) | 50 mMの | |
| モリブデン酸ナトリウム( 硫酸ナトリウムのMoO 4) | 10 mMの | |
| ナトリウムオルトバナデート | 1 mMの | |
| オカダ酸 | 100 nMの | |
| 緩衝液D | PVPPのない緩衝液C | |
| 5×SDS-PAGEローディングバッファー | トリス塩酸pH6.8で | 60 mMの |
| SDS | 2% | |
| グリセロール | 0.15% | |
| ブロモフェノールブルー | 0.10% | |
| DTT(使用直前に追加します) | 50 mMの |
表2。バッファとメディアのレシピ。
ディスカッション
のPAMPとエフェクターによる受容体活性化のメカニズムを解明することは、植物の免疫の我々の理解に大きく貢献することができます。過去20年間では、遺伝的および酵母ツーハイブリッドスクリーニングは、PRRはとNB-LRRタンパク質の発見のために尽力してきた。より最近では、質量分析ベースのプロトコルは、それらのPTMは、免疫複合体61とエフェクターの組成物62を標的とする、11,33,59,60、55-58シグナル伝達、免疫時に示差的に調節されるタンパク質の同定のために確立されている。ここでは、免疫複合体の活性化を調節するのPTMを同定するための簡単なプロトコルを記述します。
以前に記載されたプロトコルと比較すると、このプロトコルは、PTMを動的に変更点の詳細同定を可能にする。大規模なプロテオミクスアプローチのプロトコルは、タンパク質のPTMをを特定するが、制限が原因のPTMのサイトの可塑性を明らかにすることができませんすることができますEDは、タンパク質の量。タンパク質リン酸化の場合には、大規模なプロテオミクスアプローチは、通常、支配的なリン酸化部位11,33,59を識別する。タンパク質のリン酸化状態の詳細な特徴は、標的タンパク質47の部分精製により得ることができるタンパク質のかなりの量を必要とする。プロトコルは、精製されたタンパク質の質量分析により、結合をここで標的タンパク質の実質的な量をもたらすタンパク質精製法を記載した。このプロトコルに続いて、Ptoの単一のリン酸化事象は、以前に52を説明したようにのSer-198に主に起因するが、いくつかの質量分析スペクトルものThr-195またはThr-199上の単一のリン酸化イベントをサポートされていました。 Ptoの二重リン酸化現象が観察された場合には他のサイトでの組み合わせも観察されたが、リン酸化されたアミノ酸の主な組み合わせは、(のSer-198およびThr-199だった表1)。これらの結果は、タンパク質キナーゼのリン酸化部位の可塑性および詳細において可能なすべてのリン酸化部位を特徴づけるために記載されたプロトコルの能力を実証する。
このプロトコルの最も重要なステップは次のとおりです。タンパク質の1)十分な抽出;のPTMの2)保護、および標的タンパク質の3)十分な量。まず、タンパク質の十分な抽出のためには、液体窒素中で組織を粉砕し、続いて、プロトコルに記載のように組織ホモジナイザーを使用することが重要である。組織ホモジナイザーを使用できない場合は、乳鉢と乳棒を使用することができる。これは、3つ(又は4つ)の抽出緩衝液の体積に対する組織のグラムに一つの割合を使用することも重要である。比と我々が提案する高強度緩衝液をバッファリングするためにこの組織は、pHは、抽出工程中に中性のままであることを保証します。これはA.ために特に重要であることがわかっシロイヌナズナ 、トマト、余分なctions 52。 PTMを保護することは、すべてのバッファのPTMを削除することができ、酵素の適切な阻害剤に含めることによって達成することができます。これは、4℃で、すべての手順を実行すると、バッファや楽器をprechillことも重要です。標的タンパク質のより高い収率が十分な量でタンパク質を発現する植物を用いて、組織(約20g)を多量に使用することによって達成することができる。標的タンパク質の十分な量を得るための最も重要なステップは、直接免疫沈降によって、標的タンパク質を濃縮する。このステップの重要性に起因免疫沈降Ptoの( 図2B)の限られた量にのPRF免疫沈降後PtoのののPTMを識別するために、私たちの失敗によって強調されている。対照的に、Ptoの直接の免疫沈降は、タンパク質配列とのPTM( 表1)の同定の約80%の被覆をもたらす実質的に複数の測定可能なペプチド( 図2C)を得た。また、STronglyタンパク質免疫沈降のためのエピトープ - タグの使用をお勧めします。天然タンパク質エピトープタグアフィニティーマトリックスに対して産生された抗体と比較して、部分的に精製されたタンパク質のより高い量を得ることができる。免疫沈降用のネイティブのPTOタンパク質51( 図2A)に対する抗体を用いて、我々は、Ptoの二つの主要なリン酸化部位の単一のリン酸化を識別することができた。
このプロトコルは、主にNの部分的な精製の ために開発されているベンサミアナタバコ細胞質タンパク質及びそれらのリン酸化部位のその後の同定したが 、本明細書に記載の修飾を用いて、このプロトコルは、A.容易に適合させることができるシロイヌナズナタンパク質および膜結合タンパク質。このプロトコルの主な目的は、PTMを同定するための標的タンパク質の十分な量を得るために、複雑な最高の純度を達成することではない。もし高純度複合体の精製の 第二工程は、このプロトコル52に添加することができる必要とされる。その場合、最初のステップは、高い塩または酸を使用することなくアフィニティーマトリックスから標的タンパク質の溶出を可能にし、次のステップで、厳しい溶出条件を必要とする行列を伴ってもよい。それは我々が唯一のリン酸化部位の同定のために、このプロトコルをテストし、我々は現在、追加のPTMの詳細な識別のための能力をテストしていることをしていることを強調することは重要である。
我々の代表的な結果は、明らかに、タンパク質キナーゼのリン酸化部位の可塑性およびリン酸化部位を特徴づけるために記載されたプロトコルの能力を実証する。最も重要なことは、それらが質量分析によって、自動リン酸化部位の単一点変異によるタンパク質の少量に依存するリン酸化部位の同定は紛らわしい結果を与えることができることを強調している。ここでは、以前に示して47 のSer-198およびThr-199 PTO入りの二重リン酸化はPrfを/のPTO複合体の活性化と関連していること。これとは対照的に、以前に発表された結果47,63は、これらのサイト上でリン酸化を防止するためのアラニンへのSer-198およびThr-199の単一点突然変異は、これらの部 位のリン酸化は、複雑な活性化のための前提条件ではないことを示唆しているシグナル伝達が可能であることが示されている。これらの結果は、現在セカンダリサイトのThr-195のリン酸化によって説明することができる。他のプロテインキナーゼのリン酸化部位の可塑性に類似の洞察は、このプロトコルに従って得ることができる。さらに、リン酸化部位を使用して結合アプローチは変異は、タンパク質キナーゼのリン酸化部位の可塑性の進化的重要性のより良い理解につながるタンパク質の免疫沈降と質量分析と組み合わせ、特定のキナーゼ(エフェクター)を阻害することができるタンパク質を指す。
開示事項
著者は、彼らが競合する利益(財務またはその他)を持っていないことを宣言します。
謝辞
VNは王立協会によってサポートされています。 JPRは、オーストラリアの研究評議会今後のフェロー(FT0992129)です。私たちは、批判的に原稿を読み取るための博士ミリアムギフォードに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| MgCl2 | Sigma | M8266 | |
| MES | Sigma | M8250 | |
| Acetosyringone | Sigma | D134406 | toxic - 1 M stock in DMSO |
| Syringe 1 ml sterile | Terumo | ||
| Syringe needle | Terumo | NN-2525R | |
| Silwet L-77 (surfactant) | Lehle Seeds | VIS-01 | toxic |
| MG-132 (Z-Leu-Leu-Leu-al) | Sigma | C2211 | 1 M stock in DMSO, store at -80 °C |
| MS salts | Sigma | M5524 | oxidizing, toxic |
| Sucrose | Sigma | 16104 | |
| Trizma base | Sigma | T1503 | adjust pH with 1 N HCl to make 1 M Tris-HCl buffer |
| NaCl | Sigma | S3014 | 5 M stock |
| EDTA | Sigma | E6758 | toxic - 0.5 M stock |
| EGTA | Sigma | E4378 | |
| Glycerol | National Diagnostics | EC-606 | |
| IGEPAL CA-630 | Sigma | I8896 | corrosive |
| PVPP (polyvinylpolypyrrolidone) | Sigma | P5288 | do not confuse with PVP |
| DTT (DL-dithiothreitol) | Sigma | 43815 | toxic - 1 M stock, store at -20 °C |
| Plant protease inhibitor cocktail | Sigma | P9599 | do not freeze/thaw too many times |
| PMSF (phenylmethylsulfonyl fluoride) | Sigma | P7626 | corrosive, toxic |
| Calyculin A | Cell Signaling Technology | 9902 | |
| Sodium Fluoride (NaF) | Sigma | S7920 | toxic - 1 M stock |
| Sodium Molybdate (Na2MoO4) | Sigma | S6646 | 0.5 M stock |
| Sodium orthovanadate (Na3VO4) | Sigma | 450243 | toxic - Prepare a 200 mM solution of sodium orthovanadate. Adjust the pH to 10.0 using either 1 N NaOH or 1 N HCl. The starting pH of the sodium orthovanadate solution may vary with lots of the chemical. At pH 10.0 the solution will be yellow. Boil the solution until it turns colorless (approximately 10 min). Cool to room temperature.Readjust the pH to 10.0 and repeat steps 3 and 4 until the solution remains colorless and the pH stabilizes at 10.0. |
| Okadaic acid | Santa Cruz Biotechnology | sc-3513 | |
| Kinematica Polytron tissue homogeniser | Fisher Scientific | 08-451-320 | |
| Miracloth | Merck Millipore | 475855-1R | |
| anti-FLAG M2 agarose | Sigma | A2220 | this matrix is recommended |
| Streptavidin-agarose | Thermo-Scientific | 20347 | this matrix is recommended |
| GFP-Trap_A | Chromotek | gta-20 | this matrix is recommended |
| Anti-HA-Agarose | Sigma | A2095 | this matrix is recommended |
| 0.45 μm filter | VWR | 513-1902 | |
| BSA | Sigma | A7906 | |
| FLAG peptide | Sigma | F3290 | |
| D-biotin | Sigma | 47868 | |
| StrataClean resin | Agilent | 400714 | this absorption resin is recommended for protein precipitation |
| Mini-PROTEAN Tetra Cell | Biorad | ||
| PROTEAN II XL Cell | Biorad | ||
| SimplyBlue SafeStain | Invitrogen | LC6060 | this stain is recommended |
| Protein low-binding tubes (LoBind) | Eppendorf | 0030 108.116 | these tubes are recommended |
| Ammonium bicarbonate (ABC) | Sigma | 9830 | toxic |
| Acetonitrile | VWR | 83639 | toxic, flammable |
| 2-chloroacetamide | Sigma | 22790 | toxic |
| Trypsin | Promega | V5280 | irritant, sensitizing |
| Formic acid | Sigma | 14265 | toxic, corrosive |
| Water-bath sonicator | Ultravawe | Ultra BT Ultrasonic Bath | |
| LTQ-Orbitrap XL | Thermo-Scientific | ||
| Trichostatin A | Sigma | T8552 | toxic |
参考文献
- Jones, A. M., Monaghan, J., Ntoukakis, V. Editorial: Mechanisms regulating immunity in plants. Front. Plant Sci. 4, 64 (2013).
- Jensen, O. N. Modification-specific proteomics: characterization of post-translational modifications by mass spectrometry. Curr. Opin. Chem. Biol. 8, 33-41 (2004).
- Cohen, P. The regulation of protein function by multisite phosphorylation-a 25 year update. Trends Biochem. Sci. 25, 596-601 (2000).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Curr. Opin. Struct. Biol. 19, 156-163 (2009).
- Stulemeijer, I. J., Joosten, M. H. Post-translational modification of host proteins in pathogen-triggered defence signalling in plants. Mol. Plant Pathol. 9, 545-560 (2008).
- Park, C. J., Caddell, D. F., Ronald, P. C. Protein phosphorylation in plant immunity: insights into the regulation of pattern recognition receptor-mediated signaling. Front. Plant Sci. 3, 177 (2012).
- van Bentem, S. D., Hirt, H. Using phosphoproteomics to reveal signalling dynamics in plants. Trends Plant Sci. 12, 404-411 (2007).
- Peck, S. C. Early phosphorylation events in biotic stress. Curr. Opin. Plant Biol. 6, 334-338 (2003).
- Thurston, G., Regan, S., Rampitsch, C., Xing, T. Proteomic and phosphoproteomic approaches to understand plant-pathogen interactions. Physiol. Mol. Plant P. 66, 3-11 (2005).
- Xing, T., Ouellet, T., Miki, B. L. Towards genomic and proteomic studies of protein phosphorylation in plant-pathogen interactions. Trends Plant Sci. 7, 224-230 (2002).
- Nuhse, T. S., Bottrill, A. R., Jones, A. M., Peck, S. C. Quantitative phosphoproteomic analysis of plasma membrane proteins reveals regulatory mechanisms of plant innate immune responses. Plant J. 51, 931-940 (2007).
- Boller, T., Felix, G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors. Ann. Rev. Plant Biol. 60, 379-406 (2009).
- Wang, G., et al. A genome-wide functional investigation into the roles of receptor-like proteins in Arabidopsis. Plant Physiol. 147, 503-517 (2008).
- Wang, G. D., et al. The Diverse Roles of Extracellular Leucine-rich Repeat-containing Receptor-like Proteins in Plants. Crit. Rev. Plant Sci. 29, 285-299 (2010).
- Schwessinger, B., Ronald, P. C. Plant innate immunity: perception of conserved microbial signatures. Ann. Rev. Plant Biol. 63, 451-482 (2012).
- Schulze, B., et al. Rapid heteromerization and phosphorylation of ligand-activated plant transmembrane receptors and their associated kinase BAK1. J. Biol. Chem. 285, 9444-9451 (2010).
- Lu, D., et al. A receptor-like cytoplasmic kinase, BIK1, associates with a flagellin receptor complex to initiate plant innate immunity. Proc. Natl. Acad. Sci. U.S.A. 107, 496-501 (2010).
- Zhang, J., et al. Receptor-like cytoplasmic kinases integrate signaling from multiple plant immune receptors and are targeted by a Pseudomonas syringae effector. Cell Host Microbe. 7, 290-301 (2010).
- Lu, D., et al. Direct ubiquitination of pattern recognition receptor FLS2 attenuates plant innate immunity. Science. 332, 1439-1442 (2011).
- Asai, T., et al. MAP kinase signalling cascade in Arabidopsis innate immunity. Nature. 415, 977-983 (2002).
- Rasmussen, M. W., Roux, M., Petersen, M., Mundy, J. MAP Kinase Cascades in Arabidopsis Innate Immunity. Front. Plant Sci. 3, 169 (2012).
- Boudsocq, M., et al. Differential innate immune signalling via Ca2+ sensor protein kinases. Nature. 464, 418-422 (2010).
- Dubiella, U., et al. Calcium-dependent protein kinase/NADPH oxidase activation circuit is required for rapid defense signal propagation. Proc. Natl. Acad. Sci. U.S.A. 110, 8744-8749 (2013).
- Ishihama, N., Yamada, R., Yoshioka, M., Katou, S., Yoshioka, H. Phosphorylation of the Nicotiana benthamiana WRKY8 transcription factor by MAPK functions in the defense response. Plant Cell. 23, 1153-1170 (2011).
- Mao, G., et al. Phosphorylation of a WRKY transcription factor by two pathogen-responsive MAPKs drives phytoalexin biosynthesis in Arabidopsis. Plant Cell. 23, 1639-1653 (2011).
- Dangl, J. L., Jones, J. D. G. Plant pathogens and integrated defence responses to infection. Nature. 411, 826-833 (2001).
- Eitas, T. K., Dangl, J. L. NB-LRR proteins: pairs, pieces, perception, partners, and pathways. Curr. Opin. Plant Biol. 13, 472-477 (2010).
- Jones, J. D., Dangl, J. L. The plant immune system. Nature. 444, 323-329 (2006).
- Boller, T., He, S. Y. Innate immunity in plants: an arms race between pattern recognition receptors in plants and effectors in microbial pathogens. Science. 324, 742-744 (2009).
- Bonardi, V., Dangl, J. L. How complex are intracellular immune receptor signaling complexes. Front. Plant Sci. 3, 237 (2012).
- Bonardi, V., Cherkis, K., Nishimura, M. T., Dangl, J. L. A new eye on NLR proteins: focused on clarity or diffused by complexity. Curr. Opin. Immunol. 24, 41-50 (2012).
- Takken, F. L., Albrecht, M., Tameling, W. I. Resistance proteins: molecular switches of plant defence. Curr. Opin. Plant Biol. 9, 383-390 (2006).
- Nakagami, H., et al. Large-scale comparative phosphoproteomics identifies conserved phosphorylation sites in plants. Plant Physiol. 153, 1161-1174 (2010).
- del Pozo, O., Pedley, K. F., Martin, G. B. MAPKKKalpha is a positive regulator of cell death associated with both plant immunity and disease. EMBO J. 23, 3072-3082 (2004).
- Ekengren, S. K., Liu, Y., Schiff, M., Dinesh-Kumar, S. P., Martin, G. B. Two MAPK cascades, NPR1, and TGA transcription factors play a role in Pto-mediated disease resistance in tomato. Plant J. 36, 905-917 (2003).
- Romeis, T., et al. Rapid Avr9- and Cf-9 -dependent activation of MAP kinases in tobacco cell cultures and leaves: convergence of resistance gene, elicitor, wound, and salicylate responses. Plant Cell. 11, 273-287 (1999).
- Zhang, S., Klessig, D. F. Resistance gene N-mediated de novo synthesis and activation of a tobacco mitogen-activated protein kinase by tobacco mosaic virus infection. Proc. Natl. Acad. Sci. U.S.A. 95, 7433-7438 (1998).
- Romeis, T., Piedras, P., Jones, J. D. G. Resistance gene-dependent activation of a calcium-dependent protein kinase in the plant defense response. Plant Cell. 12, 803-815 (2000).
- Romeis, T., Ludwig, A. A., Martin, R., Jones, J. D. G. Calcium-dependent protein kinases play an essential role in a plant defence response. EMBO J. 20, 5556-5567 (2001).
- Romeis, T. Protein kinases in the plant defence response. Curr. Opin. Plant Biol. 4, 407-414 (2001).
- Dodds, P. N., Rathjen, J. P. Plant immunity: towards an integrated view of plant-pathogen interactions. Nat. Rev. Genet. 11, 539-548 (2010).
- Grant, M. R., et al. Structure of the Arabidopsis RPM1 gene enabling dual specificity disease resistance. Science. 269, 843-846 (1995).
- Mackey, D., Holt, B. F., Wiig, A., Dangl, J. L. RIN4 interacts with Pseudomonas syringae type III effector molecules and is required for RPM1-mediated resistance in Arabidopsis. Cell. 108, 743-754 (2002).
- Mucyn, T. S., et al. The tomato NBARC-LRR protein Prf interacts with Pto kinase in vivo to regulate specific plant immunity. Plant Cell. 18, 2792-2806 (2006).
- Chung, E. H., et al. Specific threonine phosphorylation of a host target by two unrelated type III effectors activates a host innate immune receptor in plants. Cell Host Microbe. 9, 125-136 (2011).
- Liu, J., Elmore, J. M., Lin, Z. J., Coaker, G. A receptor-like cytoplasmic kinase phosphorylates the host target RIN4, leading to the activation of a plant innate immune receptor. Cell Host Microbe. 9, 137-146 (2011).
- Ntoukakis, V., et al. The Tomato Prf Complex Is a Molecular Trap for Bacterial Effectors Based on Pto Transphosphorylation. PLoS Pathog. 9, (2013).
- Sessa, G., D'Ascenzo, M., Martin, G. B. Thr38 and Ser198 are Pto autophosphorylation sites required for the AvrPto-Pto-mediated hypersensitive response. EMBO J. 19, 3157-3157 (2000).
- Ntoukakis, V., et al. Host Inhibition of a Bacterial Virulence Effector Triggers Immunity to Infection. Science. 324, 784-787 (2009).
- Zhou, J. M., Loh, Y. T., Bressan, R. A., Martin, G. B. The Tomato Gene Pti1 Encodes a Serine/Threonine Kinase That Is Phosphorylated by Pto and Is Involved in the Hypersensitive Response. Cell. 83, 925-935 (1995).
- Wu, A. -. J., Andriotis, V. M. E., Durrant, M. C., Rathjen, J. P. A Patch of Surface-Exposed Residues Mediates Negative Regulation of Immune Signaling by Tomato Pto Kinase. Plant Cell. 16, 2809-2821 (2004).
- Gutierrez, J. R., et al. Prf immune complexes of tomato are oligomeric and contain multiple Pto-like kinases that diversify effector recognition. Plant J. 61, 507-518 (2010).
- Ntoukakis, V., Schwessinger, B., Segonzac, C., Zipfel, C. Cautionary notes on the use of C-terminal BAK1 fusion proteins for functional studies. Plant Cell. 23, 3871-3878 (2011).
- Rommens, C. M., Salmeron, J. M., Oldroyd, G. E., Staskawicz, B. J. Intergeneric transfer and functional expression of the tomato disease resistance gene Pto. Plant Cell. 7, 1537-1544 (1995).
- Jones, A. M., et al. Specific changes in the Arabidopsis proteome in response to bacterial challenge: differentiating basal and R-gene mediated resistance. Phytochemistry. 65, 1805-1816 (2004).
- Widjaja, I., et al. Combining subproteome enrichment and Rubisco depletion enables identification of low abundance proteins differentially regulated during plant defense. Proteomics. 9, 138-147 (2009).
- Keinath, N. F., et al. PAMP (pathogen-associated molecular pattern)-induced changes in plasma membrane compartmentalization reveal novel components of plant immunity. J. Biol. Chem. 285, 39140-39149 (2010).
- Elmore, J. M., Liu, J., Smith, B., Phinney, B., Coaker, G. Quantitative proteomics reveals dynamic changes in the plasma membrane during Arabidopsis immune signaling. Mol. Cell. Proteom. 11, (2012).
- Benschop, J. J., et al. Quantitative phosphoproteomics of early elicitor signaling in Arabidopsis. Mol. Cell. Proteom. 6, 1198-1214 (2007).
- Maor, R., et al. Multidimensional protein identification technology (MudPIT) analysis of ubiquitinated proteins in plants. Mol. Cell. Proteom. 6, 601-610 (2007).
- Elmore, J. M., Coaker, G. Biochemical purification of native immune protein complexes. Methods Mol. Biol. 712, 31-44 (2011).
- Win, J., Kamoun, S., Jones, A. M. Purification of effector-target protein complexes via transient expression in Nicotiana benthamiana. Methods Mol. Biol. 712, 181-194 (2011).
- Sessa, G., D'Ascenzo, M., Martin, G. B. Thr38 and Ser198 are Pto autophosphorylation sites required for the AvrPto-Pto-mediated hypersensitive response. EMBO J. 19, 2257-2269 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved