Method Article
液晶セルの透過型電子顕微鏡を使用して液体の材料の動的過程を明らかにする
要約
我々は、透過型電子顕微鏡を用いて液体を介して撮像を可能にする自己完結型の液晶セルを開発した。液体中のナノ粒子の動的なプロセスは、サブナノメートルの分解能でリアルタイムに明らかにすることができる。
要約
高空間分解能を有する液体を介して撮像を可能にするその場透過型電子顕微鏡での最近の開発は、材料科学、物理学、化学、生物学の研究分野に大幅な利益を集めている。鍵となる技術は、液晶セルである。我々は、シリコン窒化膜の成膜、フォトリソグラフィパターニング、ウェハエッチング、セル結合なども含めて、正規TEMグリッドの次元をもつ液体セルは任意の標準的なTEM試料ホルダーに収まることができ、連続微細加工プロセスを経薄い視野窓付きの液体セルを製造。約100ナノリットルの反応液をリザーバーにロードされ、約30ピコリットルの液が毛管力による閲覧ウィンドウに描画されます。その後、細胞は、in situイメージングのための顕微鏡に封入され、ロードされます。 TEMの内部では、電子ビームが2窒化シリコン膜の間に挟まれた薄い液体の層を通過します。ダイナミックPROCこのようなナノ結晶の核生成と成長、ナノ粒子の拡散や組立などの液体中のナノ粒子のessesは、サブナノメートルの分解能でリアルタイムに撮影された。我々はまた、他の研究分野、 例えば 、水の撮像タンパク質にこの方法を適用している。液体セルのTEMは、作業環境における材料の動的なプロセスを明らかにする上で大きな役割を果たすように態勢を整えています。また、それらのネイティブ環境での生物学的プロセスの研究に大きな影響をもたらす可能性があります。
概要
それらのネイティブ環境でのリアルタイムイメージングと生体物質の液体の化学反応の研究では、研究分野の1から5間で有意な利益のであった。透過型電子顕微鏡(TEM)の高空間分解能のために、TEMを用いて液体を介して撮像は、4,5、多くの注目を集めている。従来の顕微鏡は、高真空環境下で運営されていますので、しかし、それは、TEMを用いて画像液体試料に大きな課題となっている。また、液体試料は、電子ビームが通過するのに十分な薄さでなければなりません。ウィリアムソンら 6は、Cuの電気化学堆積のイメージングは、TEMで動作電気化学液体セルを用いて、5 nmの分解能を達成することができることを報告した。デヨら 1は、スキャン(S)TEMを用いてのserveralマイクロメートル厚の水を介してイメージ生体試料をすることができました。生体試料の低コントラストではありませんでした金ナノ粒子を撮像するためのマーカーとして使用されていたので、問題として提起した。厚い液体試料は、幹撮影モードが使用され、ナノメートルの分解能が達成されたので、どちらかの問題ではありませんでした。我々は最近、サブナノメートル分解能5,7と液体にコロイド状ナノ粒子の実時間TEMイメージングを可能にする自己完結型の液晶セルを開発しました。改善された解像度と高速のTEM像(高分解能STEMイメージングによって達成されていない1秒あたり30フレーム)を提供し、これらの新たに開発された液体の細胞は、それが可能な液体中にコロイドナノ粒子のダイナミクスを研究するために作った。液体セルは標準TEMホルダーにフィットし、定期的なTEM試料として動作させることができる。少量の液体(約30ピコリットル)を拡張化学反応でその場で調べることができます。さまざまなイメージングおよび分析( すなわち 、エネルギー分散型X線分光法)技術を適用することができる。観察窓(膜などの厚さの合計以来と液体層)100nm以下に制御することができ、金ナノ粒子マーカーなし液体水における生体試料の直接イメージング( すなわちタンパク質 )が8も達成されています。
過去20年間で、コロイド状ナノ結晶9-11の合成と応用に大きな成果がありました。しかし、液体中でお互いに成長し、どのように相互作用するかをナノ粒子の核生成し、理解することは、主として経験、ほとんど11月13日域外分析に基づいています。液晶セルTEMの我々の開発は 、in situ 5,7,14,15 で液体中のナノ粒子の動的なプロセスを研究するためのユニークなプラットフォームを提供します。
我々は、順次微細加工プロセスによる極薄シリコンウエハ(100μm)を使用して、自己完結型の液晶セルを作製する。これは、シリコン窒化膜の成膜、フォトリソグラフィパターニング、ウェハエッチング、スペーサー堆積し、セルが含まれています反応液を50ナノリットルについてボンディングなどが毛細管力によって細胞内に引き込まれる貯水池にロードされます。我々は、液体の別の50ナノリットルと他のリザーバを埋める。その後、細胞は 、in situイメージングのための顕微鏡に封入され、ロードされます。顕微鏡の中では、2窒化シリコン膜(30ピコリットル合計約)の間に挟まれた液体を調べることができます。電子ビームは薄い液体の層を通過する際に、液体中のナノ粒子の動的なプロセスをリアルタイムにモニタリングすることができます。ナノ粒子の核生成と成長が外部加熱源14,16によってトリガすることができますいくつかの例5,7または反応で電子ビームによって誘導することができる。電子ビームによる損傷が懸念される場合には、低電子ビーム電流(線量)を使用する必要があります。
液体セルは、シリコン微細加工プロセスから、大規模なバッチ、膜または液体の変動で製造されているので、個々のセル間の液膜厚は、SmalのL6することができます。基本的な微細加工の訓練を持つすべての研究者が成功した細胞液を作ることができます。リキッドハンドリング技術とTEMその場で動作も練習後に習得することができます。これは、閲覧ウィンドウとしてシリコン窒化膜を用いた以外、二酸化シリコン、シリコンや炭素(グラフェンを含む)のような他の材料を膜ウィンドウだけでなく、17から19として使用することができることに留意されたい。以来、無膜の膨らみ小さな視野の窓、 すなわち 、1×50μmを用いて、我々の液体細胞が観察されている。そして、液体セルにも動作するように堅牢で、液体の細胞の1%以下、すなわち実験中に窓を壊してしまった。また、液体層の厚さも柔軟に堆積インジウムスペーサーの厚さを変えることによって調整することができる。試料調製時には、密封された液体セルは、漏出無しとの数日間液体を維持することができます。少量の液体ができますリアルタイムで拡張された化学反応の研究を可能にする電子ビームの下で数時間調べられる。
これまでのところ、我々は、薄い液体中のナノ粒子の拡散20,21、例えば、Ptの成長と合体が5,15のナノ粒子は、Biナノ粒子14およびPt 3の成長の成長変動を液体中のナノ粒子の可視化され、多くのユニークなダイナミックなプロセスを持っているさらに、ナノ粒子のビルディング·ブロック7等からFeナノロッドは、我々はまた、 例えば 、他の領域に2.7 nmの分解能8と液体の水のイメージングタンパク質をこの方法を適用している。要約すると、我々の液体セルのTEM技術は、材料科学、物理学、化学、生物学の基本的な問題の広い範囲の研究のための非常に貴重な開発であることが証明されています。我々は、液体TEMの今後の技術の進歩とアプリケーションのための大規模な余地があると信じて、それは確かに高いIMPAなります科学研究の広いスペクトルのCT。
プロトコル
1。液体セルの微細加工
- シリコンウェーハ(p-ドープ、厚さ100μm、直径4インチ)を準備して、手順を標準ウエハ洗浄浴を用いてウェーハを洗浄してください。
- 低圧化学蒸着法(LPCVD)法によるシリコンウェーハの両側に堆積物の低応力窒化シリコン薄膜(厚さ20nm)。カスタム開発されたレシピは、(罪のx、x <4/3)シリコンリッチ窒化物の成長を可能に堆積のために使用されます。
- 観察窓(1×50μm)を使って、覗き窓(1×50μm)とトップチップ(直径3ミリメートル2.6×2.6 mm)で、底部チップ(直径3ミリメートル2.6×2.6 mm)を作製と2貯水池(0.6×1.2×0.1mm)をフォトリソグラフィパターニングを含む標準的な製造プロセスは、SiN x膜のプラズマエッチング(活性ガスとしてSF 6を使用して )、KOHウエットetchinの順序に従って露出されたシリコンウェーハのグラム、等我々はそのようなフォトレジストのスピンコーティングとして、最も一般的なフォトリソグラフィ·プロセスを使用します(1分間3000 rpmの回転速度とのポジ型フォトレジスト、フォトレジストの厚さは約1μmである)、UV露光現像液と定着液(脱イオン水)などを用いた液体セル、リソグラフィパターニングのCrマスクの下でスピンコーティングし、パターニングするための開発者用のフォトレジストの異なる選択肢があります。そして、プロセスの対応するパラメータも異なる場合があります。パターンの特徴は、(1μm以上の数百)が比較的大きいので、プロセスが達成することが容易です。 1:2の水の重量比:KOH溶液を水酸化カリウムで脱イオン水に水酸化カリウムパワーを溶解することによって調製される。 KOH溶液は、エッチング中に80℃に維持される。毎分1μmのエッチング速度を達成することができる。 のSiN x膜は、シリコンのKOHエッチングするための理想的な保護マスクです。 etchin以来グラム線が使用され、個々のチップは、KOHエッチング後にエッチングされたウェハの細い線に接続されている。チップの部分は簡単にその後の処理のための鋭いピンセットを用いて、ウエハから分離することができる。いいえダイシング工程は必要ありません。
- 底部チップの平らな面上に堆積インジウムスペーサー。まず、1.3で同様のプロセスに従うことによってチップのリソグラフィパターニングを行う。チップの処理を支援するために、フォトレジストを用いて薄いガラス板上の個々のチップ(複数のチップのピースを指定できます)固執し、スピンコーティング、UV暴露の前に5分などセカンド用に乾燥した空気を聞かせて、によってパターニングチップを清掃O 2プラズマは、1分間50ワットで洗浄、エバポレーターを用いて、チップ上に厚さ100nmの第三に、預金インジウム薄膜、第三に、リフトオフプロセスは、インジウムスペーサーを生成するために行われている。
- 一緒に結合する下部と上部のチップ。まず光microsco下底部と頂部のチップの2窒化ケイ素の表示ウィンドウを整列させるPEおよびクランプを使用して約0.1MPaの圧力を適用します。それは正確に互いの上にウィンドウを整列させるために練習が必要です。その後、液体セルは1時間120℃の真空オーブンで焼いています。最後に、我々は、細胞を収集し、将来の使用のための真空デシケーター中で調製された細胞を格納します。
全体の製造プロセスを図1に示します。我々は、カリフォルニア大学バークレー校のナノファブリケーション研究所ですべての製造プロセスを実施しています。
2。反応液の調製
ここでは、例として成長PT 3鉄ナノロッドのために反応溶液を調製する。白金(II)アセチルアセトナート(20 mg / ml)と鉄(II)アセチルアセトナート(20 mg / ml)をペンタデカンとオレイルアミン(7:3 vol / vol)のまたはペンタデカン、オレイルアミンの混合物の混合溶媒に溶解し、たオレイン酸(6時03分01秒容量/ vol / vol)をsurfactanを比較するために使用されトン効果。
3。反応溶液を読み込む
- 反応液の約50 NLはシリンジとテフロンナノチューブ(コール - パーマーから購入し、IL)を用いて、液晶セル内の貯水池の1つにロードされます。その後、他の貯水池は、同じ方法で満たされている。
- 反応液の約30 plは毛細管力によって細胞に引き込まれ、表示ウィンドウには2つのシリコン窒化膜の間に挟まれた液体層(〜100 nm)を形成している。
- 液体セルは、その後、薄い銅カバー(テッドペラ社から購入したシングルスロット0.6ミリメートル径の穴、で〜50μmのTEMグリッド)を使用して密封されている。真空グリースは、カバーの片面に塗布し、エポキシは液体セルの端をシールするために使用されていました。最終液体セルの合計の厚さは250から300程度である。
4。 TEMに液体セルを読み込む
- 300キロボルトで運転JEOL 3010 TEMとFEI単色F20ユタテックnaiがその場イメージングのために使用され、200kVで運営しています。
- 液体セルは、イメージングのための標準的なTEM試料として顕微鏡にロードされます。
5。リアルタイムTEMイメージング
- 完璧な高分解能TEM撮像状態顕微鏡を調整し、1から8×10 5 / m 2のビーム電流密度をリアルタイムイメージングの間、維持される。
- PTFEシステムでは、ナノ粒子の核生成と成長、液体層の上に電子ビームをキャストすることによって開始することができます。
- ガタンDigitalMicrographソフトウェアと組み合わせてVirtualDubのソフトウェアは、ナノ粒子のダイナミクスを記録するために利用される。
結果
液晶セルTEM法を使用することにより、我々は、ナノ粒子のビルディング·ブロックからのPt 3鉄ナノロッドの溶液成長を可視化した図2は、さまざまな溶液条件のPt 3鉄ナノロッドの成長軌道を描いた連続した画像を示しています。 Photoshopを使用して偽の着色プロセスは、ナノ粒子を強調するために採用した。
ペンタデカンとオレイルアミン(7:3 vol / vol)の混合溶媒を用いた場合、成長の3つの異なるステージが( 図2A)を同定することができる。 PtとFeの前駆体は、電子線照射によって縮小されたときにまず第一に、多くの小さなナノ粒子が形成される。それらのいくつかは、モノマーアタッチメントによって育つものもあれば、合体を受ける。第二に、短いナノ粒子鎖はnanopaticle相互作用を介して形成されている。第三に、形成されたナノ粒子のように短いチェーンが比較的長い曲がりくねったナノ粒子鎖を形成するためのビルディング·ブロックとして機能します。時ペンタデカン、OLEの混合物イルアミン、オレイン酸(6時03分01秒容量/ vol / vol)のナノ粒子の鎖を巻き、使用されていたが最初に形成した後、ナノ粒子鎖は短時間( 図2B)内で単結晶ナノロッドをまっすぐにし、形成している。
要約すると、我々は、ビルディングブロックの矯正、方位と形状修正に続く形指向性ナノ粒子の添付ファイルから巻多結晶ナノ粒子鎖の成長を介して、単結晶ナノロッドの形成を示している。リアルタイムイメージングから統計情報およびナノ粒子のダイナミクスの定量化機能素子7のための階層的なナノ材料の成長と自己組織化の理解と制御に大きな意義がある。

図1。 の概要。 (I)は、シリコンウェーハの両側に入金シリコン窒化膜、(II)フォトリソグラフィパターニングおよびエッチングにより表示ウィンドウや貯水池を作製し、底部チップの平らな側(III)の預金インジウムスペーサー、(IV)のボンドクランプと一緒に底部と頂部チップ。
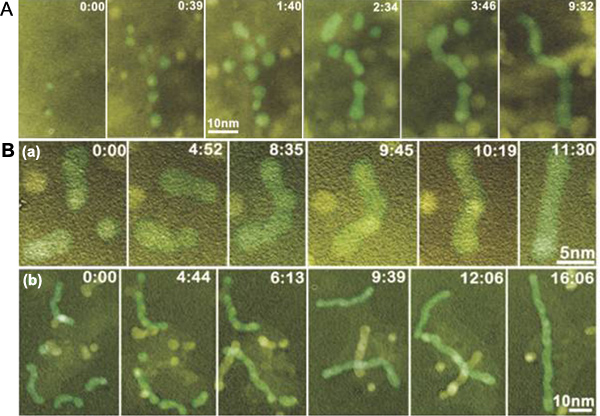
図2電子ビーム露光中に液体セル中のPt 3鉄ナノロッドの成長。 (A)の形状指向ナノ粒子付着によるナノワイヤー形成の後期に分子前駆体溶液中の初期の核生成と成長から進化を示すシーケンシャルTEM像。ペンタデカンとオレイルアミン(7:3 vol / vol)の混合溶媒を用いた。 (B)はツイストPT 3鉄ナノロッドの形成とその後の矯正プロセス。 (a)ショートPT 3鉄ナノロッドの成長の連続TEM像。 (b)は、シーケンシャルTEM像は、長いPT 3鉄ナノロッドの成長を示す。ペンタデカン、オレイルアミン、オレイン酸(午前6時03分01秒容量/ vol / vol)の混合溶媒を用いた。秒、初期時間が7任意です:両方(A)と(B)、時間は分のように表示されます
ディスカッション
すべての製造プロセスは、半導体デバイスが作られたクリーンルームで行われてきた。
インジウムの堆積前に、チップのO 2プラズマクリーニングは、表面上の有機残渣を除去することが必要である。このように、高品質のインジウムスペーサは上部と下部のチップのボンディングおよび漏洩自由液細胞の収率を向上させることができ、達成することができます。
厚さ約13nmの超薄膜でウィンドウを表示窒化ケイ素は、高空間分解能を達成するための鍵となります。そのような液体セルを扱う場合は、特別な注意が製造だけでなく、実験の間に膜を壊すことを避けるために必要です。たとえば、フラットフロントのピンセットをお勧めします。そして、膜洗浄処理中に、O 2プラズマの低消費電力と用量( すなわち 、20〜30秒のために30ウォルト)を組み込むことができる。成長速度は、電子ビームカレンに強く依存することができるのでトン密度、イメージングが重要である一方で、同じ電子ビーム電流密度を維持した。液晶セルTEM法は、リアルタイムで、溶液中のナノ結晶の成長ダイナミクスの研究を可能にするだけでなく、他のダイナミックなプロセス( すなわち 、液体、液滴のダイナミクスなどのナノ粒子の拡散を)明らかにすることができるだけでなく、。さらに、それは、ネイティブな環境では生物学的プロセスを可視化するための有望な経路を提供する。
開示事項
特別な利害関係は宣言されません。
謝辞
鄭は、EM液細胞の初期開発時に有用な議論を教授A.ポールAlivisatosとウルリッヒダーメンに感謝します。彼女は、DOE科学局早いキャリア研究プログラムのサポートに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | |||
| 白金(II)アセチルアセトナート | アルドリッチ | 523038 | |
| 鉄(II)アセチルアセトナート | アルドリッチ | 413402 | |
| ペンタデカン | アルドリッチ | P3406 | |
| オレイルアミン | アルドリッチ | O7805 | |
| オレイン酸 | シグマ | O4137 | |
| 機器 | |||
| TEM | JEOL | JEOL 3010 | |
| 単色のTEM | FEI | F20ユタTecnai |
参考文献
- de Jonge, N., Ross, F. M. Electron microscopy of specimens in liquid. Nature Nanotechnology. 6, 695-704 (2011).
- Sun, Y. G. Watching nanoparticle kinetics in liquid. Mater. Today. 15, 140-147 (2012).
- Tao, F., Salmeron, M. In Situ Studies of Chemistry and Structure of Materials in Reactive Environments. Science. 331, 171-174 (2011).
- de Jonge, N., Poirier-Demers, N., Demers, H., Peckys, D. B., Drouin, D. Nanometerresolution electron microscopy through micrometers-thick water layers. Ultramicroscopy. 110, 1114-1119 (2010).
- Zheng, H., et al. Observation of Single Colloidal Platinum Nanocrystal Growth Trajectories. Science. 324, 1309-1312 (2009).
- Williamson, M. J., Tromp, R. M., Vereecken, P. M., Hull, R., Ross, F. M. Dynamic microscopy of nanoscale cluster growth at the solid-liquid interface. Nature Materials. 2, 532-536 (2003).
- Liao, H. -. G., Cui, L., Whitelam, S. Real-Time Imaging of Pt3Fe Nanorod Growth in Solution. Science. 336, 1011-1014 (2012).
- Mirsaidov, U. M., Zheng, H., Casana, Y., Matsudaira, P. Imaging Protein Structure in Water at 2.7 nm Resolution by Transmission Electron Microscopy. Biophysical Journal. 102, L15-L17 (2012).
- Yin, Y. D., et al. Formation of hollow nanocrystals through the nanoscale Kirkendall Effect. Science. 304, 711-714 (2004).
- Kan, S., Mokari, T., Rothenberg, E., Banin, U. Synthesis and size-dependent properties of zinc-blende semiconductor quantum rods. Nature Materials. 2, 155-158 (1038).
- Peng, X. G., et al. Shape control of CdSe nanocrystals. Nature. 404, 59-61 (2000).
- Skrabalak, S. E., et al. Gold Nanocages: Synthesis, Properties, and Applications. Accounts of Chemical Research. 41, 1587-1595 (2008).
- Zhang, Q. B., Xie, J. P., Yang, J. H., Lee, J. Y. Monodisperse Icosahedral Ag, Au, and Pd Nanoparticles: Size Control Strategy and Superlattice Formation. Acs Nano. 3, 139-148 (2009).
- Xin, H. L., Zheng, H. In Situ Observation of Oscillatory Growth of Bismuth Nanoparticles. Nano Letters. 12, 1470-1474 (2012).
- Murray, C. B. Watching Nanocrystals Grow. Science. 324, 1276-1277 (2009).
- Xin, H. L., et al. Revealing Correlation of Valence State with Nanoporous Structure in Cobalt Catalyst Nanoparticles by In Situ Environmental TEM. ACS Nano. 6, 4241-4247 (2012).
- Daulton, T. L., Little, B. J., Lowe, K., Jones-Meehan, J. In situ environmental celltransmission electron microscopy study of microbial reduction of chromium(VI) using electron energy loss spectroscopy. Microscopy and Microanalysis. 7, 470-485 (2001).
- Mohanty, N., Fahrenholtz, M., Nagaraja, A., Boyle, D., Berry, V. Impermeable Graphenic Encasement of Bacteria. Nano Letters. 11, 1270-1275 (2011).
- Yuk, J. M., et al. High-Resolution EM of Colloidal Nanocrystal Growth Using Graphene Liquid Cells. Science. 336, 61-64 (2012).
- Zheng, H., Claridge, S. A., Minor, A. M., Alivisatos, A. P., Dahmen, U. Nanocrystal Diffusion in a Liquid Thin Film Observed by in Situ Transmission Electron Microscopy. Nano Letters. 9, 2460-2465 (2009).
- Park, J., et al. Direct Observation of Nanoparticle Superlattice Formation by Using Liquid Cell Transmission Electron Microscopy. Acs Nano. 6, 2078-2085 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved