Method Article
ラットの精巣挙筋の虚血再灌流障害における白血球 - 内皮相互作用のリアルタイムデジタルイメージング(IRI)
要約
精巣挙筋微小循環における毛細血管細静脈のデジタル生体蛍光顕微鏡では、白血球 - 内皮相互作用への洞察を得るために便利な方法です。横紋筋組織の虚血再灌流障害(IRI)であった。ここでは、安全技術を実行し、その応用と限界を議論するための詳細なプロトコルを提供しています。
要約
虚血再灌流障害(IRI)は、このような脳卒中、心筋梗塞、腸管虚血などの移植や心臓血管手術後などの病的状態の大きな配列に関与しています。以前は虚血組織の1再灌流、不可逆的な予防のために不可欠ながら、組織損傷は、罹患組織の過度の炎症を誘発する。活性酸素種の産生、補体系の活性化と増加した血管透過性に隣接し、白血球の活性化は、再灌流時の炎症性組織損傷の病理学的カスケードの原則俳優の一人です。2、3、白血球の活性化は成る多段階のプロセスです。ローリング、強固な接着と輪廻のような補因子、ケモカイン、または血小板活性化因子としての化学誘引物質に応答して、接着分子との間の複雑な相互作用によって媒介される。4 <Pクラスは= "jove_content">毛細血管細静脈における白血球のローリングは、主に彼らのカウンターリガンドとセレクチン5の相互作用によって媒介されていますが、内皮への白血球の強固な接着は細胞間接着分子(ICAM)、血管の細胞への結合を介してセレクチン制御です。接着分子(VCAM)。6、7
白血球-内皮相互作用の in vivo観察のためのゴールドスタンダードは、1968年に記載され生体内顕微鏡の技術である8。
IRI(虚血再灌流障害)の様々なモデルが様々な器官のために記載されているものの、9月12日わずか数は、画像品質の高いレベルでの微小血管床における白血球動員の直接可視化に適しています。8
ここでは精巣挙筋微小循環の後毛細血管細静脈のデジタル生体蛍光顕微鏡を促進するラット13の定性的かつ定量的に横紋筋組織中のIRI-研究のための白血球動員を分析し、技術を達成するための詳細なマニュアルを提供する便利な方法として。我々はさらに一般的な落とし穴を説明し、読者が本当に感謝することができ、かつ安全にする方法を実行する必要があり有用なヒントを提供しています。
ステップのプロトコル·バイ·ステップでは、より長い期間の動物はしっかりと麻酔を維持するのに十分な監視の下で呼吸制御された麻酔の使用を開始する方法を表しています。その後、卓越した光学分割のための薄い平らなシートとして挙準備を説明し、よく私たちの研究室で確立されているIRIで白血球イメージングのためのプロトコルを提供しています。
プロトコル
1。麻酔および監視
- 動物実験を行う前に、適切な国や機関の倫理が場所でなければなりません。 180グラム - 120から体重の倫理委員会麻酔雄Sprague Dawleyラットからの承認に続く。イソフルラン気化器を介してプレキシグラスボックスに3体積%イソフルランおよびラットの内側に置く - 2を提供します。
- 麻酔の適切なレベルが達成されるとすぐに(つま先またはテールピンチへの反応の欠如)ラット腹側頸部の領域に重み付けし、剃られています。
- 37℃で体温を維持するために加熱パッドの上に背横臥ラットを置き°Cとシリコーンマスクを使用して、2体積%でイソフルランが適用されます。
次の準備手順は、最善の手術用顕微鏡を用いて達成されています。
- 気管の準備のために、頸動脈と頸静脈は、エリアO 2cmの水平方向の皮膚切開を行いますF頸切痕と横方向に唾液腺を動員。
- あなたは今腹、首の筋肉に直面しています。慎重に正中線でそれらを分離し、気管を見つける。気管の2cmをし、それを引き上げるようにその下のマイクロピンセットを置く - 1を公開します。
- 今すぐ気管の腹側を介して約半分スリット。あなたは、気管の切断端が胸に戻ってスリップして作業が非常に困難になりますない場合は、を介してすべての方法を切らないように注意してください。
- 以前に動物の人工呼吸器に接続されている気管の下部に気管チューブとして使用Abbocath管(14G)を挿入します。ヒント:事務所マグネットクランプで固定と同様に管の周囲気管の縫合が所定の位置に気管チューブを保つために不可欠です。一般的に我々はTerylene 5/0縫合糸を使用、しかし類似の縫合材料を使用することができます。
- 一回換気量、4.5〜5ミリリットル; FIO 2 45回/分-呼吸がします(周波数、35のボリュームを制御することができます、0.35から0.50;イソフルラン1.5から2体積%)14無気肺は、H 2 O 15の5〜10mmの呼気終末陽圧を維持することによって防ぐことができます
- 頸動脈canulationは、右胸骨舌骨筋は、頸動脈を見つけるために鈍的切開で区切られています。
- 頸動脈から慎重に迷走神経を分離し、心臓から血流を停止するには、斜めマイクロ鉗子で血管をマウントします。
- 頸動脈の下に縫合糸の長さの等しい2個を渡します。心臓への参照では、より遠位の縫合糸は、近位縫合糸を頸動脈の周りに緩く接続されているのに対し、頭部から流れる血を閉塞するためにしっかりと接続されています。
- マイクロはさみを使用して、小さなカットが2字の間に頸動脈にされています。
- 圧力変換器に接続されている生理食塩水で満たされたポリエチレンカテーテル(0.28ミリメートル、内径)を挿入します。
- レム動脈にカテーテルをさらにマイクロ鉗子とスレッドをオベ。その後、動脈カテーテルの周囲に近字を締めます。ヒント:第二近位縫合の応用は、マイクロ鉗子を除去した後、出血を防ぐことができます。
- 頸動脈の周り遠合、追加の停泊のためにカテーテルを接続します。
- 心拍数と血圧を監視することによって継続的に麻酔を監視します。血液ガス分析装置を用いた間欠的な動脈血液ガス分析を行う16心拍数300拍または超える360 BPMよりも低いだけでなく、5分以上は80 mmHgの下にドロップし、平均動脈圧は除外基準である17、18は、血液を維持する生理的な範囲内でのpH(7.35から7.45)。実験が原因で異常な監視速度に終了する必要があります場合には、首の転位またはexanguationで動物を酷評する。
蛍光色素または他の薬物oの静脈内のアプリケーションのfの関心は、次の手順を実行します。
- 手術用顕微鏡で左頚静脈の領域をフォーカスします。
- それぞれの手で鉗子で、頸静脈を明らかにする薄い筋膜を引き裂く。角度のマイクロ鉗子で静脈をマウントします。血流は、その後停止します。
- 鉗子を使用して、縫合糸の同じ長さの2つの部分は頸動脈canulationに一致した頸静脈の下に渡されます。しっかりと遠位縫合と頸静脈の周り緩く近位縫合糸を結びます。
- 頸静脈に小さなカットを行い、生理食塩水でフラッシュされたポリエチレンカテーテル(0.28ミリメートル、内径)を挿入します。切開とcanulationは、頸動脈のそれよりも厳しいと時間がかかることをマークします。
- 心臓に向かってカテーテルを通し、静脈カテーテルの周りの心に最も近い字を締めます。
- 適合開通した後、カテーテルの周りに遠合字を結ぶ。ヒント:BOの追加固定テープで目のカテーテルは、追い出しを防ぐことができます。
- 管内凝固を防ぐために頻繁にカテーテルを洗浄します。
2。精巣挙筋の調製
- 精巣挙筋イメージングのために2 cmの厚さ - 私たちは1.5のアルミステージを使用しています。ステージでは、急速にその結果精巣挙筋組織の熱制御を緩和する加熱パッドの所望の温度を採用しています。これは、炎症研究のための非常に重要です。精巣挙筋温度の調節がより困難ですが、代わりにプレキシグラスのプラットフォームを使用することができます。ステージの中央に陰嚢を配置します。
- 最初の切開は、微細ハサミを用いて皮下空間の慎重な拡張に続いて非常に遠位端に陰嚢皮膚上と外精筋膜で作られています。楽器の基礎となる組織には手を触れないでください。
- 組織が露出しているとすぐにそれは、Wi予備加熱(37℃)リン酸緩衝食塩水で湿らせている番目のカルシウムとマグネシウム。露出した組織への定期的な解決策を適用します。
- 外精筋膜と精巣挙筋の間に結合組織は慎重に周囲の組織から精巣挙筋を解放するために削除されます。
- 精巣挙筋の外面は、その後慎重に結合組織がクリアされます。結合組織郭清水和物中の連続的な灌流、視認性と除去が容易になります。
- 押したまま、わずかに袋の端を拡張するために精巣挙袋の先端部を縫合。
- 腹側面上に袋の先端を切開とマイクロはさみを使用して、近切開を細長い。慎重に熱焼灼を利用した切開線に沿って出血血管を焼灼する。追加の炎症性刺激を制限するために不要な焼灼を避けることができます。ヒント:準備の外周近くに血流ダイナミクスは、この組織の損傷によって変更されている19ため、最小限に抑えます。SEはデータ収集に影響を与え、準備の中心付近の血管は、イメージングに使用する必要があります。
- まだ睾丸の下精巣上体に薄い膜によって接続されたものの、オープンクレマスターは、アルミの台座の上に平ら。片側に睾丸を反映して精巣上体に接続して小動脈と静脈を含め、この靭帯を公開しています。容器を密封し、睾丸と精巣挙筋組織との間の結合靭帯を切断するマイクロはさみを採用し焼灼を使用しています。
- ゆっくりと鼠径管に孤立した睾丸を押し戻す。他の著者は、関連付けられた鼠径流行のパッドと一緒に近結紮(高位精巣摘出術)後の睾丸を切除。通常ではありません我々はすべての追加手術の刺激を回避しようとIRI誘導白血球の活性化、従って我々は精巣を切除控える、などの機密性の高いモデルでは20精巣挙筋の十分な露出を得るために必要がある。
- 最初に加えて固定は縫合糸、組織の4辺(両側に2本ずつ)と慎重にアルミステージ上に放射状に精巣挙筋組織を広めるためにテープにスレッドをアタッチします。アルミステージとの間のギャップを残し、鼠径管の外部入り口は虚血のために、後続の精巣挙筋のクリッピングを簡素化します。
- 灌流セットアップの精巣挙筋組織に近いポリエチレンカテーテルの代わりに両端(0.28ミリメートル内径)。ルーメンは、最終的な流体チャンバ内の空気の泡を避けるために空気の自由であることを確認してください。
- シリンジを用いて精巣挙筋の周囲に石油ゼリー(ワセリン)の線を引く。ラインカバレッジに使用されるカバースリップのサイズを拡張する必要があります。
- 流体チャンバを作成するには、精巣挙筋組織上の正方形のカバースリップ(32×32 mm)を置き、しっかりとワセリンラインにエッジを接続します。
- 場合には精巣挙筋組織は、特定の薬と周囲のインフルエンザの継続的な交換を灌流されていませんidは必須ではないです。作成されたチャンバー内にカルシウムとマグネシウムと食塩水をリン酸緩衝単一のアプリケーションは、十分であるかもしれません。薬と局所的刺激は、しかし1時間あたり3 mlの割合でマイクロ灌流ポンプを介して連続的に実行する必要があります。
- 精巣挙筋組織は現在、顕微鏡イメージングのための準備ができています。
3。生体内のセットアップ
基本的な生体内のセットアップは変わる場合があります。落射蛍光イメージングのための実験は、暗室内で実行する必要があります。
- 動物は、落射照明用光源のLED 470nmで装備生体蛍光顕微鏡のステージに転送されます。約800×の倍率を達成するために、水浸対物レンズ(20×/ 1.0)を使用します。オフライン評価のためのパーソナルコンピュータの高解像度デジタルカメラとストアのレコードの手段による記録の観測。
- 白血球標識に、ローダミンを注入静脈内投与は0.4 mg / kg体重の濃度で頸静脈カテーテルを介して6G。
- 観察のための後毛細血管細静脈を選択してください。十分であるべきである容器のサイズは20〜60μmであり、血流の間の範囲にする必要があります。組織のプレ活性化の影響を最小限に抑えるために、白血球のローリングで唯一の血管は<20 cells/30秒と付着細胞数は、<細静脈内皮細胞の10cells/200μmは、さらなる分析のために利用することができる。
- 可能であれば、最大3つの毛細血管細静脈の観察のために使用できますが、それらは異なる時点で血管を混乱させないために精巣挙筋組織の対応するセクションに配置する必要があります。
4。虚血再灌流障害(IIR)
- 組織が30分間安定させます。
- 白血球のローリングと遵守のための基礎値を確立するために30秒の記録を実行します。理想的には、セルを確認するために合計3基底録音で生成数字と標準偏差を取得する。
- 穏やかに、アプリケーションの鉗子を使用してによって公開されている精巣挙筋組織の非常に近位端の周りにBiemer容器クリップを配置します。うっはすぐに起こるべきであり、観測された容器のセクションで落射蛍光顕微鏡で可視化することができます。
- 時間のコースの様々な必要なダメージのレベルに応じて利用することができます。他の著者によって説明されるように我々は、虚血時間の30分を適用します21から23は、その後、血管クランプを外します。血流は、別の15分間安定化することができます。
- 30秒の期間以降の録音は、再灌流期間(例えば30秒毎に15分)を通して行うことができます。オフライン分析のためのデジタル録音を保存します。
- 実験の終了については、ラットはそのような頭蓋骨の基部はさみ刃の鈍いエッジと鈍器を押すことにより、十分な麻酔下に頚椎脱臼により安楽死されています。その他の手は、尾の付け根はすぐに頭蓋骨から頸椎の分離を引き起こし、プルアップされています。
5。オフラインビデオの再生の解析
- オフラインビデオの再生分析のためにスローモーションで異なる写真やビデオシーケンスの観測の選択を可能にするソフトウェアを使用すると便利です。適切なコントラストと明るさを調整します。我々は、長さの測定とデジタル倍率を可能にする顕微鏡の製造元から提供されているソフトウェアを使用しています。
- 白血球のローリングの定量化のため、すべてのレコードの整合性のある容器を垂直に交差する仮想回線を定義します。手動で30秒以内にラインを通過ローリング白血球の数を数えます。
- 付着白血球の定量化のために、すべてのレコードに一致している200μmの血管のセクションを定義する23は 30秒の間に静的なままではっきりと見える白血球の数をカウントします- 。こうしてdefinEDとして付着し、24
6。代表的な結果
精巣挙筋のIRIは、平均動脈圧(MAP)、心拍数と血中のpHに影響を与えません
前述のセットアップ( 図1)を使用して 、我々は2時間プロトコルを介してIRIの微小循環を調査したがはるかに長い観測時間を最大6時間まで可能です。 図2に示すように、平均動脈圧および心拍数は、調査期間を通じて安定しているとして、精巣挙筋のIRIは、ラットの循環に有意なmacrohemodynamic効果を持っていません。さらに、我々は、生理的限界内にあったその血液pHの動脈の頻繁な測定によって恒常性を監視し、有意な群間差は認められなかった。
IRIは、精巣挙筋の循環に白血球のローリングを誘導する
白血球血管内皮相互作用が鍵となります急性炎症のイベント。生体顕微鏡を用いて我々は以前のデータは21日、25日に一致した精巣挙筋( 図3A)のIRIのローリング白血球数の時間依存性の増加を発見した。ローリングは、再灌流時間の120分後に±137.63の最大2時間の観測時間をかけてベースライン値の22.55パーセントをマウントして、偽手術動物(137.63±22.55対99.43±ベースライン値の14.04パーセント)に比べて統計的有意性に達した。
IRIは、精巣挙筋循環の白血球の接着を誘導する
白血球 - 内皮相互作用のさらなる評価のために我々は、200μmの血管セクションの白血球の接着を分析した。 IRIは、60分後に動物を運営して有意に偽の値を超えて付着白血球数の増加を誘発した(118.33±6.83対96.27±ベースライン値の5.78パーセント)、さらにASCE再灌流120分( 図3B)でnded。
要約の in vivoモデルで記述さ IRIながら、動物の生存における急性白血球の活性化の一貫したデータを供給し、循環の安定性が保証されています。

図1。 A.ラットの精巣挙筋の虚血再灌流障害。麻酔および監視するために必要な準備の後で生体蛍光顕微鏡の性能のためのフロー· チャート 、ラットの精巣挙筋は、イメージングのために公開されています。白血球活性化の記録は、組織の虚血前と後に撮影されています。その後のビデオ分析は最高のオフラインで実行されています。B.は提案された生体セットアップの模式図は 拡大図を表示するには、ここをクリックしてください 。

図2。精巣挙筋のIRIは、平均動脈圧(MAP)、心拍数と血中のpHに影響を与えません。動脈圧(A)と心拍数(B)を意味し 、右のcanulation後の圧力トランスデューサーを介した実験を通して、30分ごとにモニターした頸動脈。動脈血pHの(C)の測定は、0、60、および120分後に行われた。値は平均値±6つの異なるラットのSEMであり、有意な群間差なしの生理的レベルであった。 拡大図を表示するには、ここをクリックしてください 。
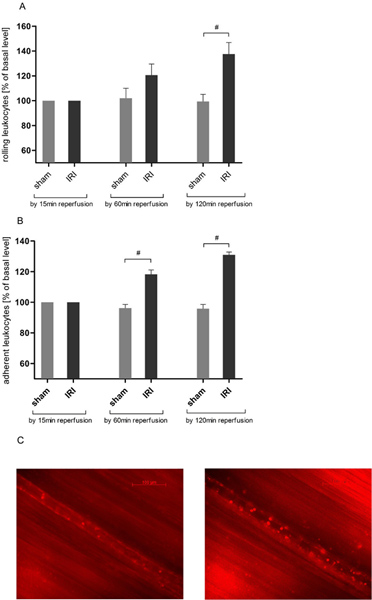
図3。 IRIは、白血球増加精巣挙筋循環の内皮相互作用。ローダミン6Gと白血球のラベリング(0.4 mg / kg体重)後、生体蛍光顕微鏡は、組織の虚血30分後にプロトコルを120分にわたって再灌流障害における白血球-内皮相互作用を決定するために使用されていました。レコードはおよその倍率×800で撮影されました。白血球のローリングは、虚血を受けていない精巣挙筋組織での実験を通して安定しているのに対し、A. IRIが大幅に再灌流120分で精巣挙筋の毛細血管細静脈におけるローリング白血球の数が増加します。値は平均値±6観測されたラットのSEMである。 #p <0.05を対応のないt検定を使用します。B.付着白血球の数が大幅に精巣挙筋の虚血30分および組織灌流のその後の60分後にランダムに選ばれた200μmの毛細血管の血管のセクションで増加します。結果は、さらにMOを得る再2時間再潅流期間の後に顕著になります。値は平均値±6観測されたラットのSEMである。 #P <0.05後毛細血管細静脈のC.代表画像前虚血(左)へ。対応のないt検定を使用して、IRI(右)後120分。 拡大図を見るにはここをクリック 。
ディスカッション
白血球-内皮相互作用、活性酸素種の産生および補体系の活性化IRI-誘発組織障害の主要な特徴である26は、罹患組織の微小循環は、炎症の発症の積分サイトと見なされます。別にそのようなフローチャンバーアッセイとしてex vivoでの実験を27日、28日からは、さらにin vivoでの関連で評価するために生体内イメージングの定評のあるモデルを提供するために必須です。 IRIは、さまざまな器官系に関与しているのに、ここではフラップ手術( 図1)したがって、特に関連し、体系的に第一バエズら13により記述されていた横紋筋組織の再灌流障害における白血球-内皮相互作用を調べるための方法を説明します。 29それは他の臓器の虚血後の組織の損傷は、同じ炎症性のメカニズムを含むことを前提としていますので、説明したモデルが街に使用することができこのような心筋梗塞、脳卒中または腸管虚血などの条件に該当するIRIの病態生理学的メカニズムにnの原理の洞察。
使用される動物
ここに提示されたモデルは、ラットやマウスを含め、ほとんどのげっ歯類に適しています。このモデルでは必要であるイメージングの長期間我々は一般的に気管切開とボリューム制御呼吸を容易に行うことができるようにラットを好む。動脈canulation経由して心臓血管のイメージングとの組み合わせで、ラットは時間( 図2)循環とhomeostatically安定して保持することができます。さらに、精巣挙筋組織は、それが毛細血管イメージングのためのより多くのオプションを残して、マウスでよりもラットでより広範である。組織の準備がラガーラットで予備成形しやすくなるかもしれませんが、additiのバックグラウンド蛍光とオーバーレイを削減するため、(100 -150グラム)は、1つは、精巣挙筋組織を考慮する必要があり、特に精巣挙筋は、若いラットで薄くなっているonal筋膜組織。しかし、生体内顕微鏡用マウスを使用することの利点は、変調微小イベントに個々の遺伝子の役割を解明する貴重なトランスジェニック動物の可用性です。
組織の種類
最初に説明するので、生体内顕微鏡は、マスター·頬の袋、ウサギの耳、齧歯類の腸間膜と、挙睾筋を含む微小製剤の様々な使用されています。これらの製剤のほとんどに関連付けられている一つの主な欠点は、よく30精巣挙筋の準備が細心の注意を払って実施するので、腸間膜のために持って記載されているローリングと接着性の白血球の一時的増加を伴う手術操作による細胞の潜在的な活性化である。我々の経験に、曝露された組織であって制限的焼灼など少なくとも30分の十分な組織の安定化期間の頻繁な湿潤は、白血球を回避または低減することができ刺激。
腸間膜イメージング上の精巣挙筋のイメージングの主な利点は、腹腔の開口部をスペア簡単にアクセスがあります。全体的な外科手術による外傷が減少し、透過照明のための段階を表示するプレキシグラスのいずれかにマウントしたり、など我々のプロトコルを利用して、エピillumintaionの熱制御されたアルミプラットフォームは、容易に実行されます。さらに、腸間膜のイメージングを制限する古い動物で毛細血管細静脈の周りを収集脂肪が精巣挙筋組織の周りは存在しない。
白血球ラベリング
このような染色核および/ または赤血球で発見されていない細胞内小器官(と血小板および内皮細胞である程度まで)白血球に選択的に蓄積するローダミン6G 31、アクリジンオレンジまたはアクリジンRedなどの試薬32は、我々は、ローダミン6Gを使用して好むprを持って0.4 mg / kg体重の濃度で白血球を検出するためのeviously好中球の活性化に有意な影響を及ぼさないことが示されて33アクリジンオレンジは、細動脈の血管収縮(未観測)により、多くの染色背景と毒性を示した。蛍光イメージングのためのLEDの使用率は、正確な励起スペクトルを提供するなど、同時に白血球の活性化と毛細血管漏出を検出するために、例えば、異なる波長の組み合わせなど、より複雑なアプリケーションを可能にし、従ってでの将来の選択の方法でなければなりませんin vivoイメージング。
精巣挙筋組織中のIRI
精巣挙筋に虚血を適用することが容易に行われ、完全にそのような自由なフラップ手術など臨床的に関連する条件を反映することができます。また、炎症に影響を与える物質とそのような寒虚血、温虚血または精巣挙筋灌流などの変更が容易に適用することができます。陰嚢内注入はチェの方法かもしれません精巣挙筋組織の治療は録音する前に、数時間または数日を必要されるce。
IRIのための時間のコースの様々な必要なダメージのレベルに応じて利用することができます。ここでは血管を介して固定点を通過する白血球細胞をカウントすることにより、再灌流2時間後、圧延、かなりのレベル( 図3)を生成するために、30分虚血のモデルを記述します。ローリングの増加が緩やかであるとして、それは興味のある他の薬剤を介してIRIの白血球を刺激するのに十分な潜在的なままになります。しかし、時間のコースの様々な必要な白血球の活性化のレベルに応じて利用できる21、25白血球接着は、ほとんどの場合、100の血管壁にはっきりと表示されているセルのカウントによって測定される- 200μmのストレッチ30秒間静止したまま、この時間は研究室によって異なる場合がありますが。我々は60分後に有意なたIRIの付着白血球数の著しい増加を観察した。
それは炎症の研究のためのin vivoで白血球活性化の再現性の高いデータを提供するので、結論として、横紋筋組織のIRIの生体蛍光顕微鏡はよくラット精巣挙筋の組織で行うことができます。
開示事項
利害の衝突が宣言されません。
謝辞
この作品は、SU Eisenhardtに "ドイツ学術振興"(EI 866/1-1)の助成金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 機器の名前: | 会社名: | カタログ番号: | コメント: |
| Forene 100%(V / V) | アボット | B506 | イソフルランAPI |
| Terylene縫合 | Serag Weissner | OC108000 | |
| Portexファインボアポリエチレンチューブ | 医療スミス | 800/100/100 | 0.28ミリメートル、内径 |
| 0.9%食塩水 | Fresinusカービ | 808771 | |
| チェンジ·先端デラックス焼灼キット | Bovie医療 | DEL1 | |
| Abbocath-T 14G | Venisystems | G713- A01 | 鏡筒として使用 |
| サーボ人工呼吸器900C | Maquet | 動物ventialtorとして使用 | |
| 論理的な圧力トランスデューサー | 医療スミス | MX1960 | |
| Sirecust 404モニタ | ジーメンス | ||
| ABL 700ベンチトップ·アナライザ | 放射計 | 血液ガス測定用 | |
| 加温パッド | Effenberger | 8319 | |
| アルミステージ | Alfun | AW7022 | |
| 手術用顕微鏡OPMI 6 SDFC | カールツァイス | ||
| 顕微楽器ラボのら | S&T | 767 | |
| Biemer血管クリップ | ディーナー | 64.562 | |
| 鉗子を適用する | ディーナー | 64.568 | Biemer容器クリップの |
| ローダミン6G | Sigma-Aldrich社 | R4127 | |
| ワセリン白DAB | ウィンスロップ | 2726853 | |
| メガネをカバー | 32×32ミリメートル | ||
| 生体内のセットアップ | |||
| ツァイスAxioはスコープ1 MAT | カールツァイス | 490036 | 落射蛍光顕微鏡 |
| 470nmのLEDが | カールツァイス | 423052 | 蛍光光源 |
| コリブリ2システム | カールツァイス | 423052 | |
| Wプラン·アポクロマート20倍/ 1,0 DIC | カールツァイス | 421452 | 水浸対物レンズ |
| AxioCam MRM牧師3つのFireWire | カールツァイス | 426509 | 高解像度デジタルカメラ |
| アクシオビジョンLEソフトウェア | カールツァイス | 410130 | オフライン解析に使用 |
参考文献
- Cetin, C. Protective effect of fucoidin (a neutrophil rolling inhibitor) on ischemia reperfusion injury: experimental study in rat epigastric island flaps. Ann. Plast. Surg. 47, 540-546 (2001).
- Granger, D. N. Role of xanthine oxidase and granulocytes in ischemia-reperfusion injury. Am. J. Physiol. 255, H1269-H1275 (1988).
- Lazarus, B. The role of mast cells in ischaemia-reperfusion injury in murine skeletal muscle. J Pathol. 191, 443-448 (2000).
- van den Heuvel, M. G. Review: Ischaemia-reperfusion injury in flap surgery. J. Plast. Reconstr. Aesthet. Surg. 62, 721-726 (2009).
- Rosen, S. D. Cell surface lectins in the immune system. Semin. Immunol. 5, 237-247 (1993).
- van der Flier, A., Sonnenberg, A. Function and interactions of integrins. Cell Tissue Res. 305, 285-298 (2001).
- Panes, J., Perry, M., Granger, D. N. Leukocyte-endothelial cell adhesion: avenues for therapeutic intervention. Br. J. Pharmacol. 126, 537-550 (1999).
- Gavins, F. N., Chatterjee, B. E. Intravital microscopy for the study of mouse microcirculation in anti-inflammatory drug research: focus on the mesentery and cremaster preparations. J. Pharmacol. Toxicol. Methods. 49, 1-14 (2004).
- Sutton, T. A. Injury of the renal microvascular endothelium alters barrier function after ischemia. Am. J. Physiol. Renal. Physiol. 285, 191-198 (2003).
- Serracino-Inglott, F. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am. J. Surg. 185, 589-595 (2003).
- Eppinger, M. J. Mediators of ischemia-reperfusion injury of rat lung. Am J Pathol. 150, 1773-1784 (1997).
- Dumont, E. A. Real-time imaging of apoptotic cell-membrane changes at the single-cell level in the beating murine heart. Nat Med. 7, 1352-1355 (2001).
- Baez, S. An open cremaster muscle preparation for the study of blood vessels by in vivo microscopy. Microvasc Res. 5, 384-394 (1973).
- Woeste, G. Octreotide attenuates impaired microcirculation in postischemic pancreatitis when administered before induction of ischemia. Transplantation. 86, 961-967 (2008).
- Schultz, J. E., Hsu, A. K., Gross, G. J. Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart. Circ. Res. 78, 1100-1104 (1996).
- Dobschuetz, E. v. o. n. Dynamic intravital fluorescence microscopy--a novel method for the assessment of microvascular permeability in acute pancreatitis. Microvasc Res. 67, 55-63 (2004).
- Vutskits, L. Adverse effects of methylene blue on the central nervous system. Anesthesiology. 108, 684-692 (2008).
- Takasu, A. Improved survival time with combined early blood transfusion and fluid administration in uncontrolled hemorrhagic shock in rats. J. Trauma. 8, 312-316 (2010).
- Proctor, K. G., Busija, D. W. Relationships among arteriolar, regional, and whole organ blood flow in cremaster muscle. Am. J. Physiol. 249, 34-41 (1985).
- Bagher, P., Segal, S. S. The Mouse Cremaster Muscle Preparation for Intravital Imaging of the Microcirculation. J. Vis. Exp. (52), e2874 (2011).
- Kanwar, S., Hickey, M. J., Kubes, P. Postischemic inflammation: a role for mast cells in intestine but not in skeletal muscle. Am. J. Physiol. 275, 212-218 (1998).
- Leoni, G. Inflamed phenotype of the mesenteric microcirculation of melanocortin type 3 receptor-null mice after ischemia-reperfusion. FASEB J. 22, 4228-4238 (2008).
- Simoncini, T. Interaction of oestrogen receptor with the regulatory subunit of phosphatidylinositol-3-OH kinase. Nature. 407, 538-541 (2000).
- Woollard, K. J. Pathophysiological levels of soluble P-selectin mediate adhesion of leukocytes to the endothelium through Mac-1 activation. Circ. Res. 103, 1128-1138 (2008).
- Mori, N. Ischemia-reperfusion induced microvascular responses in LDL-receptor -/- mice. Am. J. Physiol. 276, H1647-H1654 (1999).
- Eisenhardt, S. U. Monitoring Molecular Changes Induced by Ischemia/Reperfusion in Human Free Muscle Flap Tissue Samples. Ann. Plast. Surg. , (2011).
- Eisenhardt, S. U. Generation of activation-specific human anti-{alpha}M{beta}2 single-chain antibodies as potential diagnostic tools and therapeutic agents. Blood. 109, 3521-3528 (2007).
- Eisenhardt, S. U. Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res. 105, 128-137 (2009).
- Eisenhardt, S. U. C-reactive protein: how conformational changes influence inflammatory properties. Cell Cycle. 8, 3885-3892 (2009).
- Granger, D. N. . Physiology and pathophysiology of leukocyte adhesion. , 520 (1995).
- Baatz, H. Kinetics of white blood cell staining by intravascular administration of rhodamine 6G. Int. J. Microcirc. Clin. Exp. 15, 85-91 (1995).
- Mempel, T. R. In vivo imaging of leukocyte trafficking in blood vessels and tissues. Curr. Opin. Immunol. 16, 406-417 (2004).
- Abbitt, K. B., Rainger, G. E., Nash, G. B. Effects of fluorescent dyes on selectin and integrin-mediated stages of adhesion and migration of flowing leukocytes. J. Immunol. Methods. 239, 109-119 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved