Method Article
腫瘍の4DライブセルイメージングのためのMAMEモデル:微小環境の相互作用に影響を与える悪性進行
要約
我々は侵襲的な表現型への微小環境に影響を与える進行中の乳房の腫瘍細胞と他の細胞間の相互作用をリアルタイムでライブセルイメージングのための3D共培養モデルを開発しました。これらのモデルは、パラクリン誘起分解、ケモカイン/サイトカインと侵襲性に関与するキナーゼ経路を標的とする薬剤の臨床画面として使用できます。
要約
我々は長期的MAME(M ammary rchitecture と m icroenvironment eの ngineering)3D共培養モデルを開発し、細胞のリアルタイムで生細胞イメージングのためにそれらを使用している:細胞の相互作用。私たちの全体的な目標は、侵襲的な表現型への進行を勉強するために侵入前の乳房病変のアーキテクチャを要約するモデルを開発することでした。具体的には、浸潤性乳管癌の上皮内乳房上皮細胞の進行を増強または低減に関与している腫瘍微小環境のプレ悪性の乳房上皮細胞の変異体および他の細胞型の間の相互作用を分析するモデルを開発しました。現在までに研究された他の細胞型は、上皮細胞、線維芽細胞、マクロファージ、血液とリンパの微小血管内皮細胞である。中に乳房内の細胞の相互作用を再現するように設計されているMAMEのモデルに加えて、癌の進行は、我々は前立腺癌の進行に匹敵するモデルを開発しました。
ここでは、ライブセルイメージングやin situで乳管癌(DCIS)時間の経過とともに浸潤表現型の細胞と線維芽細胞の共培養の推移をフォローするための機能タンパク質分解アッセイを使用するとともに、3次元共培養を確立するための手順を説明する文化の中で23日間以上このような場合。 MAME共培養では、複数のレイヤーで構成されています。線維芽細胞をI型コラーゲンの一番下の層に埋め込まれています。その上DCIS細胞が播種されている再構成基底膜(RBM)の層を配置されます。 2%のRBMの最後の最上位層が含まれており、メディアの変更があるたびに補充されています。侵襲的な表現型への進行に関連付けられたイメージのタンパク質分解には、私がRBの中間層と混合し、コラーゲンIとDQ-IV型コラーゲンの層と混合染料急冷(DQ)蛍光マトリックスタンパク質(DQ-コラーゲンを使用しM)と共焦点顕微鏡を使用して、ライブの文化を守ってください。光のセクションは、キャプチャされ処理され、Volocity可視化ソフトウェアと3Dで再構築されます。 MAME共培養23日間で、DCIS細胞が増殖し、大規模な侵襲的な構造に合体する。線維芽細胞が移行し、これらの侵襲的な構造に組み込まれになります。コラーゲンの蛍光タンパク質分解断片が細胞内に、DCISの構造の表面に関連して発見され、また周囲のマトリックス全体に分散されています。ターゲットタンパク分解、ケモカイン/サイトカインとキナーゼ経路または共培養の細胞組成の変更はMAMEモデルが新たな治療アプローチの臨床画面として使用することができることを示唆し、侵襲性を減らすことができる薬。
プロトコル
1。 DQ-基板を準備します。
- 4で50μlのアリコートを、店舗に分割℃、DQ-基質は脱イオン水でDQ基板の1 mg / mlのストック溶液を調製し、バイアルを開く前に室温まで昇温を凍結乾燥することができ
それが〜50から5分と熱が°Cの分散を容易にするための超音波水浴中でDQ基板を攪拌する必要があるかもしれません 。
- 4℃一晩氷上で融解RBM°C; RBMは、すべての回で氷の上で処理する必要があります。
- 10Xリン酸塩を作るために生理食塩水(PBS)、80グラムのNaClを溶解させる(1.37 M)、2グラムのKCl(0.027 M)、14.4グラムのNa 2 HPO 4(1 M)と、2.4グラムのKH 2 PO 4(0.02 M)でバッファリング800ミリリットルの超純水。 1.0 M HClで7.4にPBS緩衝溶液のpHを調整します。体積1リットルに持って、濾過によって滅菌する。
- 冷やしたコラーゲンIチルド10X PBSの1部に8部:氷上のコラーゲンI溶液を調製します。 pHを調整する混合物を滅菌した0.1 M NaOHを用いて7.2から7.6へ。 pHのストリップでpHをチェックし、滅菌水で10重量部に最終的な音量を調整します。
- 25μg/ mlで、2.4 mg / mlの最終濃度に予冷したチューブは、それぞれのコラーゲンでDQ-I型コラーゲンI溶液を希釈することによりI型コラーゲンマトリックス:DQ-I型コラーゲンを準備します。
- それぞれ、25μg/ mlに12から15 mg / mlの最終濃度に予冷したチューブ内のRBMにおけるDQ-IV型コラーゲンを(Cultrexまたはマトリゲル)で希釈して再構成基底膜(RBM)マトリックス:DQ-IV型コラーゲンを準備します。気泡を作成するのを避けるために穏やかにピペッティングを使用して氷の上で混ぜる。
2。 MAME共培養を準備します。
共培養の模式図、図1を参照してください。
- 場所35 mmの培養皿またはIbiTreatμ-ディッシュ35 mmを使用する2つの長方形のプラスチックのカバーガラス(10分間、空気乾燥させ、70%アルコールで滅菌)。ここで方向性は、我々が学生のために使用され、カバーガラスおよびμ-料理の両方のためのものです正立顕微鏡で死ぬ。倒立顕微鏡の研究のために、私たちは唯一のμ-食器を使用しています。
- I型コラーゲンマトリックス:DQ-I型コラーゲンと線維芽細胞の希望の番号を混ぜる。 I型コラーゲンマトリックス:図2と図3に示すように、長期的な共培養のために、私たちはメディアに加え、DQ-I型コラーゲンの60μlを10μlの500線維芽細胞を使用しています。
- 慎重にピペットは、100μlのピペットを使用して、線維芽細胞70μlの広がり:DQ-コラーゲンI:I型コラーゲンマトリックスの各カバースリップの表面全体に固化するために30分間CO 2なしで加湿インキュベーター中で37℃のままにします。
- 転送35mmの平衡を10分間、5%CO 2で37℃のインキュベーターにカバースリップを含む料理をお楽しみいただけます。
- インキュベーターから取り出し、それらが室温になるまで、ボンネットの下に35-mmディッシュにしておきます。
- 固化したDQ-I型コラーゲンの上にRBMマトリックス:埋め込まれた線維芽細胞のI型コラーゲンマトリックスDQ-IV型コラーゲンの60μlを添加します。ピペットチップ、CAとDQ-I型コラーゲン:コラーゲンIマトリックス線維芽細胞を傷つけ避けて、均等にRBMマトリックス:refully DQ-IV型コラーゲンを広げた。
- 転送35ミリ固めるために10分間、5%CO 2で37℃のインキュベーターにカバースリップを含む料理をお楽しみいただけます。 DQ-IV型コラーゲン中:RBM行列が固化され、上皮細胞をトリプシン処理し、カウントされます。
- RBMマトリックス:DQ-IV型コラーゲンでコーティングされたカバースリップ上腫瘍/上皮細胞懸濁液50μlを置きます。 37℃インキュベーターにカバースリップを含む場所35-mmディッシュ。 RBM行列:セル40〜60分は、DQ-IV型コラーゲンにアタッチすることができます。図2と図3に示すように、長期的な共培養のために、私たちは2500年上皮または腫瘍細胞を使用しています。
- それぞれの35-mmディッシュに2%のRBMを含む培養液2 mlを追加します。任意の薬物療法を行う場合には、薬物は、この時点で追加する必要があります。
- イメージングする前に、所望の期間インキュベートします。長期培養のために、メディアは3〜4日ごとに変更する必要があります。細胞を維持することができる彼らの通常の培地インチ乳癌細胞株のMAME共培養のために、私たちはMEGM SingleQuotsを添加した上皮細胞基礎培地(MEBM-PRF)を使用します。
3。共焦点顕微鏡によるライブMAME共培養の4D(3D +時間)イメージングを実行します。
- 示す証明の原理研究のために、MAME共培養は、当社の公開手順1に記載の蛍光細胞追跡色素で標識した。イメージングする前に、5%CO 2インキュベーターで37°CでPBSで洗浄した後、共培養は、37℃インキュベーター内で45分間MEGM培地中の5μMのCellTrackerオレンジとインキュベートし、PBSで再度洗浄し、30分間温めMEGMmediumと共にインキュベートした。
- 画像MAME共培養では、ツァイスLSM-510 META共焦点顕微鏡で低倍率(10倍、水浸レンズ)に住んでいます。
- 光のセクションは、構造体の全体の深さを通して間隔でキャプチャされます。我々の研究のために、私たちは10時の光学切片をキャプチャするμmの間隔で。
- 3Dで画像を再構成する光学切片を使用しています。我々は、3D再構成を生成するためにVolocityソフトウェアを使用します。
- 細胞間相互作用とその周辺のマトリックスとの相互作用を可視化することができる:構造は、細胞ができるように3D再構成の映画を作る。我々はQuikTime Player 7でムービーを作りました。
4。代表的な結果
我々が開発したMAME共培養では、乳房の腫瘍とその微小環境を構成するさまざまな細胞成分間の相互作用のリアルタイムでの生細胞イメージングのための扱いやすい実験モデルである。ここでは、細胞を再現するためにMAMEモデルの能力を実証:乳がんの進行中および生細胞イメージングの細胞間相互作用は、時間の経過とともにそれらの相互作用に従うこと。我々は上の、上皮内MCF10.DCISヒト乳癌細胞株とヒト乳癌に関連した線維芽細胞ライン、WS-12Tiとの間の画像の相互作用する能力を示しています文化の中で3週間以上の期間。共培養は、3、16、23日に撮像した。共培養のボリューム全体を介して光のセクションは、図2の3つの時点の各々について示されている3Dと代表的な例に再建されました。図2の赤色蛍光はMCF10.DCISおよびWS-12Tiのセルを表します。 2つの細胞型の間で長期の共培養のために区別するためには、文化を確立する前に蛍光蛋白質と個々の細胞型をトランスフェクトまたは形質導入することができます。差動識別のための蛍光タンパク質で標識されMCF10.DCISおよびWS-12Ti細胞のMAMEの共培養は、図3に示されています。
MAME共培養に、この場合、DQ-コラーゲンで、基板を組み込むことによって、我々は侵襲的な表現型への移行に関連付けられているタンパク質分解の経時変化を評価し、定量化することができます。我々は、その結果蛍光開裂生成物を定量するための方法を確立していますDQ-コラーゲン分解2,3から。我々は、細胞核を標識し、カウントすることにより、細胞当たりベースでMAME共培養の全体の3Dボリューム全体の分解産物を正規化します。さらに、我々は細胞外および細胞内コンパートメントに劣化をローカライズし、我々は以前に2で説明したように、全体の細胞内と細胞外の分解産物を定量化することができます。図2および図3の緑色蛍光は、2つのDQ-コラーゲン基質の切断産物を表しています。この時点では、差動標識コラーゲンは、私たちはI型コラーゲンのIV型コラーゲンと分解の分解を区別できるようになることはできません。
MAME共培養における相互作用は動的であり、時間の経過とともに変更することができます。時間的および動的な情報を入手するには、ビューの同じフィールドには、週に数分から一定の期間にわたって繰り返してボリューム全体の標本を通じて取得されたイメージングと光学セクションすることができますしたがって、4-Dのデータを収集します。細胞数の変化、細胞遊走および細胞の相互作用、構造ボリューム、構造の形状、球形から構造の偏差、侵襲outgrowthsとタンパク質分解:図2に、我々は23日間で発生したという劇的な変化を示しています。さらに、我々はまた、MAME共培養は、低下させる彼らの、この期間に細胞外マトリックスを囲むためにボリュームの全体的な変化を示しています。図2Aに示すように、三日間で、ボリュームは110,000μmの3です。図2BとCに示すように対照的に、16でMAME共培養の量と23日は、唯一の46250μmの3

図1。 MAME共培養の模式図。プラスチック製カバースリップは、DQ-I型コラーゲンと線維芽細胞(マゼンタ)を含む、I型コラーゲンでコーティングされています。 DQ-colを含む再構成基底膜の2層目(RBM)ラゲンIVが追加されます。腫瘍細胞(赤)の上に播種し、培養培地に2%のRBMは、オーバーレイ(ホワイトドット)メディアのすべての変化であるされています。グリーンはDQ-コラーゲンIとIVの蛍光切断産物を表しています。
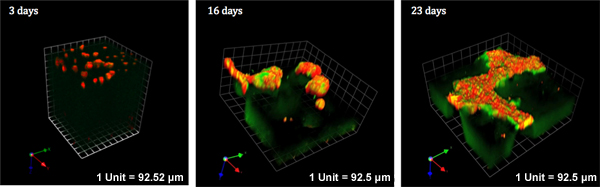
図2。 MCF10.DCISヒト乳癌細胞およびWS-12Tiヒト乳房線維芽細胞の共培養MAME。線維芽細胞がコラーゲンDQ-IV型コラーゲンを含むRBMとI / DQ-I型コラーゲンとオーバーレイに埋め込まれていた。 DCISの細胞はその後2%RBMを含むメディアとのRBMとオーバーレイに播種した。共培養の体積の減少によって示されるようにここに示す共培養23日間で、細胞増殖、DQ-IV型コラーゲンおよびI(緑)とコラーゲンマトリックスの劣化があった。細胞は、イメージング(赤)の前にin situで CellTrackerオレンジで標識することによって局在していた。同じライブ共培養は、Cで撮影した画像で23日間にわたって観察された共培養の3、16、23日でonfocal顕微鏡。得られた光学スライスはVolocityソフトウェアを使用して3Dで再構築されました。倍率10倍。

図3。 MAME 16日MCF10.DCISヒト乳癌細胞およびWS-12Tiヒト乳房線維芽細胞の共培養そのそれぞれ急行RFP(赤)とYFP(白)、。共培養が確立され、図2のように分析した。ここに示されている2つの細胞型は、しかし、差彼らは互いに区別することができるように標識されていました。この図では、高倍率の画像は、図2のものに比べ、DCIS細胞と線維芽細胞に近い地域でDQ-I型コラーゲンのびまん性タンパク質分解の表面でDQ-IV型コラーゲンの分解を示しています。倍率20倍。
ディスカッション
示したように、MAME共培養は、乳房の腫瘍とその微小環境を構成するさまざまな細胞成分間の相互作用のリアルタイムでライブセルイメージングに使用することができます。我々の研究室で進行中の研究では、我々は、タンパク質分解DCISから浸潤性乳管癌への移行に関連付けられた経路と同様に、このようなケモカイン/サイトカイン/増殖因子経路として、この移行に関与するタンパク質分解経路と他の経路間の相互作用を識別するために、MAME共培養を使用している。我々はさらにMAMEモデルは、小分子阻害剤の効果をスクリーニングするタンパク分解/ケ モカイン/サイトカイン/増殖因子経路の3-5を調節する抗体またはshRNAを阻止するためのツールとして使用することができることを示した。ここで図2と図3に示すように、我々は、以前週間に、6,7を示しているようにMAMEのモデルは、分、時間に至るまで倍以上の腫瘍の増殖、浸潤およびタンパク質分解のライブセルイメージングに使用することができます。ザ観察される相互作用は1つの種の細胞の間、すなわち、ヒト腫瘍細胞と腫瘍関連細胞ではなく、生体内イメージング8のようにヒト腫瘍細胞とマウス間質細胞の間にある。 MAMEモデルは扱いやすいシステムです。興味のある分子はDQ-コラーゲンの分解への細胞型における彼らの貢献を撮影と3Dの2に定量することができるように、前の共培養に個々の細胞型におけるshRNAのとダウンレギュレートすることができます。 MAMEモデルからの馴化培地は、得られた情報等、抗体をブロッキング、小分子阻害剤の効果をテストするための実験的な基礎を提供するプロテアーゼの分泌の変化、サイトカインなどを測定するためにサンプリングすることができます
いずれかの腫瘍微小環境(例えば、上皮細胞、単球、血液の内皮細胞で見つかった他の細胞型の寄与を評価するためにそれらを使用できるようにMAME共培養の細胞組成は、容易に操作することができます悪性進行6,7に血管とリンパ管由来)。文化の中で様々な細胞タイプのシード、別の細胞型の割合と時間の長さの数は、使用される特定の細胞型と実験問題に依存します。 MAMEのモデルは、乳房の腫瘍を取り巻く微小環境の変化、例えば、pH、酸素分圧の効果を評価するために拡張することができます。たとえば、我々はMAMEの文化が少し酸性pH、すなわち、pHを6.8に維持されている場合には、タンパク質分解と浸潤の増加があることが示されている。さらに、我々はまた、我々は前立腺癌のような他の癌をモデルに似て共培養を使用することが示されている。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、厚生R01 CA131990(BFSとRRM)の国立研究所によって、部分的には、サポートされていました。ライブセルイメージングは、コアがカルマノスがん研究所、ウェイン州立大学にNIHセンターの助成金によって、部分的には、P30 CA22453をサポートして顕微鏡、イメージングサイトメトリーリソースで実行され、母子保健と開発の国立研究所の出産期医学研究支部されました、ウェイン州立大学。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/機器 | 会社 | カタログ番号 | コメント |
| 再構成基底膜(Cultrex) | Trevigen | 3445-005-01 | マトリゲル(BD Biosciences社)に匹敵する |
| コラーゲンI | 凝集研究所 | 5005-B | |
| DQ-基質 (コラーゲンI、IV) | インビトロジェン | DQ-COL I-D12060 DQ-COL IV D12052 | |
| を22 mmプラスティックカバースリップ | フィッシャー·サイエンティフィック株式会社 | 12から547 | 半分にカットし、使用前に10分間空気乾燥のために70%エタノールにしておきます。 |
| 細胞培養培地 | ロンザ | MEBM-PRF CC-3153 MEGM CC-4136 | 赤遊離フェノール |
| μ-皿ibiTreat | Ibidi | 80136 | |
| Volocityソフトウェア | パーキンエルマー | バージョン5.5 | イメージングソフトウェアの他のブランドは、3D再構成やムービーを生成するために使用することができます。 |
参考文献
- Sameni, M., Dosescu, J., Sloane, B. F. Functional imaging of proteolysis: stromal and inflammatory cells increase tumor proteolysis. Mol. Imaging. 2, 159-175 (2003).
- Jedeszko, C., Sameni, M., Olive, M. B., Moin, K., Sloane, B. F. Visualizing protease activity in living cells: from two dimensions to four dimensions. Curr. Protoc. Cell Biol. 39, (2008).
- Jedeszko, C., Victor, B. C., Podgorski, I., Sloane, B. F. Fibroblast hepatocyte growth factor promotes invasion of human mammary ductal carcinoma in situ. Cancer Res. 69, 9148-9155 (2009).
- Sameni, M. Functional live-cell imaging demonstrates that beta1-integrin promotes type IV collagen degradation by breast and prostate cancer cells. Mol. Imaging. 7, 199-213 (2008).
- Li, Q. p21-activated kinase 1 coordinates aberrant cell survival and pericellular proteolysis in a three-dimensional culture model for premalignant progression of human breast cancer. Neoplasia. 10, 314-328 (2008).
- Sameni, M. Imaging and quantifying the dynamics of tumor associated proteolysis. Clin. Exp. Metastasis. 26, 299-309 (2009).
- Cavallo-Medved, D. Live-cell imaging demonstrates that proteases in caveolae of endothelial cells degrade extracellular matrix. Exp. Cell. Res. 315, 1234-1246 (2009).
- Fukumura, D. Tumor microvasculature and microenvironment: novel insights through intravital imaging in pre-clinical models. Microcirculation. 17, 206-225 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved