Method Article
神経向性マウス肝炎ウイルスに感染したマウスの脊髄にマウス神経幹細胞の外科的移植
要約
確立された脱髄とマウスの脊髄にマウス神経幹細胞(NSC)の移植が詳述されます。 NSCの準備、胸椎9(T9)の椎弓切除、そしてNSCの移植は、マウスの前と術後ケアと一緒に概説されています。
要約
マウス肝炎ウイルスの神経向性JHM株(MHV)に感染したマウスでは、脱髄疾患多発性硬化症(MS)の患者と同様の病理学と臨床転帰を開発する。我々は両方の再ミエリン化にと臨床転帰の有意な改善で病気のマウスの結果の脊髄にNSCのその移植を示している。慢性的な神経疾患の治療のための細胞置換療法は、今や現実のものであり、in vivoモデルで移植細胞と宿主組織の微小環境との相互作用を理解する上で不可欠です。このプレゼンテーションは、JHMV感染マウスの脊髄に細胞を移植するための適応方法を提供する。簡単に言えば、我々は、私のための手順を提供する)前に移植にNSCの準備、II)マウスの術前ケア、iii)の椎弓切除を介して脊髄の露出、ⅳ)定位NSCの注入、及びiv)術後ケア。
プロトコル
1。準備
- キシラジン - ケタミンソリューションを(ケタミンは、規制薬物である。詳細な記録が保持され、ソリューションは、安全、ロックされた場所に格納されている必要があります)を用意。
- 機械を洗浄し、滅菌する。
- 無菌剤で拭くし、滅菌紙タオルで覆うことにより、手術の領域を準備し、マイクロマニピュレーターを設定します。
2。移植用細胞の調製
- 細胞を100,000細胞の濃度/ E Lに再懸されるべきであると、のみ25万細胞をマウスごとに移植されているが、細胞の過剰は、シリンジのローディングの目的(セルを受信し、マウスあたり少なくとも30万のセルを用意)が必要です。
- 50 mlコニカルバイアルにHBSSで3回移植される細胞を洗浄する。最後のスピンの前に細胞を数える。
- ダウン最後のスピンの後、デカンテーションHBSSとペレットに達することから液滴を防ぐために下の位置に逆さまにバイアルをおきます。
- UV照射、滅菌キムワイプで内側の壁を乾かします。ペレットを乾燥させないでください。
- 直立管を保持し、ゆっくりと非常に繊細にHBSSの半分の最終的な目的のボリュームで細胞を懸濁します。
- ピペットの先端にサスペンションの大部分をピペッティングし、全体の懸濁液がピペットチップになるまで、ピペッターのダイヤルを調整することで、総容積を測定します。これにより、所望の濃度のために必要とされるどれだけ多くのHBSSを教えてくれます。
- HBSSを添加することにより、所望の量にボリュームをもたらす。
- 氷上に戻って置きます。彼らは2時間よりも長い間氷の上に存在する必要がある場合、細胞の生存を確認してください。
3。手術と移植のためのマウスの準備
- 〜100μlの用量または同等の麻酔薬のケタミン(100mg/kg)とキシラジン(10mg/kgより少ない)の腹腔内注射によってマウスを麻酔。手術の準備から縫合まですべての手続きは30〜40分かかります。
- (オプション:識別を確実にするために、各マウスの尾に番号付け、色のテープを適用)
- 腰から首までマウスの背側領域をそぎ落とし、そして電気バリカンで正中線から両側2cmの、拡張。髪はできるだけ近くに(それは地域に何度も行くことが必要な場合があります)としてカットされるべきである。
- 残りの毛を削除するには、ガーゼで脱毛クリーム(Nairさん)の薄層を適用すると、アプリケーターをひっくり返した。
- 1〜2分後に、せっけん水で軽く湿らせたガーゼでオフNairさん拭いてください。準備領域は、その後の外科手術中に傷口に得ることができる毛のある浮遊片のないクリーンな素肌にする必要があります。
ヨウ化物溶液でプリペアドエリアを滅菌する。
4。椎弓切除
- 頻繁に変更すると/または手続き中は手袋を消毒する。 (あなたは右利きの場合)、左を指している頭部とマウス背側を上に置きます。無菌性を確保するために動物を羽織るだけ坊主領域が露出されていること。胸椎約T8からT12にスパニングlaminecomyサイト上の縦切開(〜1.3センチメートル)を作る。
- 左手で開催されたグレーフェの鉗子で、しっかりとT9( 図1A)で脊柱を固定し、脊椎湾曲を誇張するために、マウスを持ち上げる。
- T10とT11の間の接合部、二つのとげの突起の間にスペースを獲得するためにメスを使用してください。さらに慎重に骨( 図1Bを参照して、C)を公開する離れて筋肉層を廃棄による接合を公開。
- 離れてラミナから、小さな切れ端で椎弓根の周り明確な筋肉を促進するためにはさみを使用してください。これは椎骨の間の小さなスペースをオープンすることになります。ゆっくりと繊細に、このギャップにはさみの一つのブレードを挿入し、茎をスニップ。はさみの曲率は常に離れて臍帯から、横方向に配置されていることを確認してください。反対側に繰り返します。 ( 図1D、Eを参照してください)
- コードを公開するラミナを持ち上げ、慎重にそれをチョキンと切る。背後にある任意のフリーまたはぎざぎざの骨片を残ししないように注意してください。 ( 図1Fを参照)
- 注射の前に、滅菌綿棒で離して血液をきれいに。
5。細胞の注入
- ハミルトンシリンジに針ナットと針を取り付け、水、次に70%エタノールで数回フラッシュすることにより、それらをきれいに、そして最終的にHBSS。水、70%エタノール、またはHBSSでそれぞれ充填した後、プランジャーを挿入します。
- プランジャーを取り外すと、針のナットを緩めて、背圧を防止するために注射器から針を引いて、セルの負荷のためにハミルトンシリンジを準備します。針とナットの慎重な取り扱いが滅菌手袋で行われていることを確認します。
- ピペットチップに細胞の15μlをロードし、シリンジに細胞をロードするために注射器のバックエンドにしっかりと先端を押してください。
- 5mm程度プランジャーを挿入し、針のナットを締めます。
- プランジャー国連を押し下げゴマ細胞懸濁液の一部が針を終了する見られている。
- シリンジ内に気泡がないことを確認して、重力によって勾配を作ることから細胞を防止するために水平位置にシリンジを下に置く。
- T8とT9( 図2B、C)のシナプス結合棘背筋の筋肉によってlaminectomizedマウスを手につかむ。
- マウスの前足が空中に存在し、その後部足が軽く図2Aと2Bのように、滅菌ペーパータオルのプラットフォームに触れるように左(垂直)マイクロマニピュレータの腕に止血クランプ。
- 右側のマイクロマニピュレータのアーム(70 °の角度で)にシリンジを接続し、クランプの前に可能な限り低い位置に注射器をスライドさせます。
- ペーパータオルに対して、その尾部を固定することによって、マウスを安定させ、ゆっくりと注射器( 図2B)を下げる。
- コードに向かって針を下ろし、背側正中線( 図2C)を介して反対側の半球に針1mmを挿入する。針の先端は中心管に近い灰白質にする必要があります。
- 徐々に細胞の2.5μlを注入する。 1μlの/ 5秒の速度で注入する。針が脊髄の外になるまで細胞を注入した後、一度に10秒ごとに回転の10分の1を10秒経ってから針を引っ込める。細胞懸濁液の可能流出に注意を払う。
- すぐに注射器を収納し、マニピュレータのアームからそれを切り離す。水平にシリンジを定める。
- マウスと縫合のテーブルへの転送を離します。
- シリンジが空になるまで繰り返して、各マウスに対して5.7から5.14までを繰り返します。ツール(滅菌)と動物の間に針を(エタノールで拭いて)滅菌する。セルを廃棄し、凝集が表示されている場合はリロード。
- 負荷との間のステップ5.1のように注射器を清掃してください。
6。縫合と術後ケア
- 切開を縫合。縫合針は、切開の両側の浅筋膜に挿入されます。スレッドは、それによって削除されたラミナのサイトで公開された脊髄を覆う、( 図3A)一緒に浅筋膜を引っ張って、によって張られている。背中の皮膚または骨格筋に接続されている皮膚の筋肉を縫合しないでください。約1 / 2"のまま、通過スレッド全体を引っ張る。ニードルホルダーを使用して、3つのノットが形成され、スレッドはできるだけ結び目の近くにトリミングされます。
- 皮膚( 図3B)、2〜3のステープルを(切開の大きさに応じて)適用することで、切開を閉じます。慎重に、基礎となる筋肉をステープル避けるため、マウスから肌を引き出します。
- 26G3 / 8針を使用すると、皮下離れて切開から背中の下部に0.5ミリリットル乳酸リンゲルを注入する。
- そのケージに戻ってマウスを置きます。それは麻酔下にある間快適に呼吸できることを確認するために、マウスは、手術部位とケージの寝具との間の接触を避け、ケージの中にその側に配置する必要があります。ケージは、加熱パッド上に配置する必要があります。
- 麻酔は、出血がおさまるを確保するために切れる後にマウスが監視されて、縫合糸は閉じたまま、そのマウスは、手術前のモビリティに戻ります。
- 鎮痛剤ブプレノルフィン(0.05〜0.1 mg / kg)を以下の手術でマウスを一度に扱う。
- 障害のあるマウスは食べ物と水への十分なアクセスがあることを確認:水のボトルは、拡張された3.5インチ噴出している手の飼育水及び/または高カロリー栄養補助食品(ニュートリカル、Tomlynを)歩くことができないマウスが取り付けられています。
7。代表的な結果:
望ましい結果は、注入時の細胞懸濁液の流出の欠如によって、プロシージャに続く脊髄の完全な外観によって識別されます。そのためには、椎弓切除中および注入中にマウスの脊椎で明るく、直接照明していることは大切です。最適な照明は光ファイバー照明( 図2A)によって促進される。

図1 - 。椎弓切除 ()椎T9後はしっかりとマイクロはさみのエントリを容易にするために、T10とT11の間にメスと脊椎スコア(B、C)、グレーフェの鉗子で開催されます。 (D)慎重にT10とT11の間にスペース(矢印とはめ込み、E)を介してマイクロハサミをスライドさせ、背板を解放するためにそれぞれの側に茎(ダッシュ、E)をカット。 (F)吻方ラミナをフリップアップし、それを切断。
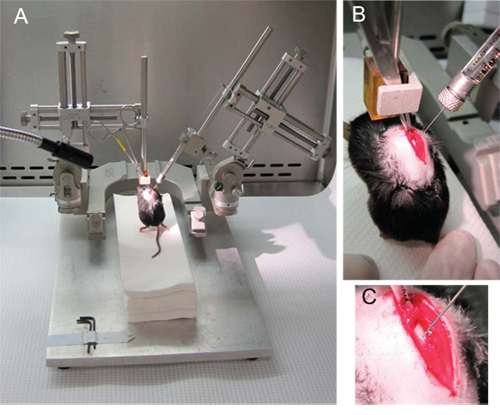
図2。 NSCの注入。(A)70の角度で、右腕に左腕とハミルトンシリンジに接続されているマウスを保持している止血剤によるマイクロマニピュレータの一般的なセットアップ。 (B)止血剤は、T8とT9の棘を結ぶ棘背筋の筋肉をホールド。 (C)針は、tによって低下する彼正中線と中心管の近位の反対側の半球上の灰白質、に。
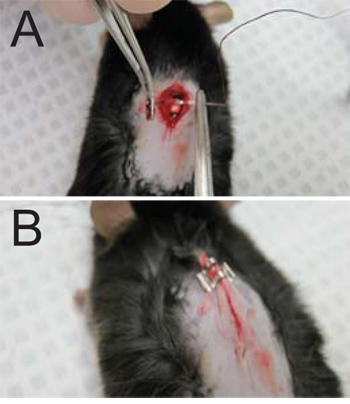
図3。縫合糸、創傷閉鎖。()縫合糸は、切開の両側の浅筋膜に適用されます。 (一ステープル3を必要とする傷に表示されている)必要に応じて(B)切開は2-3ホッチキスで閉じられます。
ディスカッション
よく実行される移植は主に細胞の慎重な椎弓切除と注入にかかっています。椎弓切除時に回避するために、主要な落とし穴は、脊髄の損傷です。これは、プロシージャ自体の間にまたは手順に従って、残された鋭い骨片による損傷によって発生する可能性があります。これらを回避するために、湾曲したマイクロはさみのポイントは常に離れてコードから直面していることを確認し、慎重にすべての骨片がクリアされていることを確認するlaminectomized背骨を検査し、残りの椎体構造は、あからさまに突出またはぎざぎざの縁がないことを。
前述のように光が射出中に露出脊髄上に明るくして、直接輝いている場合、流出の検出が可能となる。流出は、30ゲージの針(33ゲージ対)とし、注射があまりにも急速に行われている場合に発生する可能性が高いです。このプロトコルは、私達によい結果を与えているものの、他の人は注射8,9に続く後退する前に針を長く待っている期間(最大5分まで)を報告している。また、小さなゲージの針が望ましいですが、我々は33ゲージの針を通過する際、一部の細胞があまりにも容易に溶解することを観察した。
効率を最大化するために、4つの異なる局を(マウスの準備、椎弓切除、注射、および縫合糸)配乗移植チームが望ましい。また、各プロシージャのタイミングは、細胞は氷の上で待っている時間を最小限にするために最適化する必要があります。例えば、我々は4つ(シリンジの各負荷における投与量の数)のグループ私たちのマウスに移植、細胞を注入する人は、第3のマウスがlaminectomizedされた後にシリンジのロードを開始し、マウスを準備する人は、以下を麻酔してください前のグループの2番目のマウス後のグループはlaminectomizedされています。各マウスは、約30-40分かかりますにもかかわらず、このように、我々は約3時間で40マウスに細胞を(またはコントロールのメディア)移植できます。
いくつかの中枢神経系疾患の治療用細胞の補充療法は、10の臨床試験で現在です。そこNSC移植のin vivoモデルに代わるものはないとウイルス誘発脱髄を有するマウスの脊髄にNSCの移植のための我々のプロトコルは、MSの重要なモデルの使用を容易にし、また簡単に他のモデルに適合させることができます。
開示事項
資料
| Name | Company | Catalog Number | Comments |
| 試薬/装置の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| Ketaject | フェニックスParmaceuticals | NDC 57319-542-02 | |
| 塩酸キシラジン | MPのバイオメディカル | 158307 | |
| ナイル | 教会&ドワイト社 | ||
| 10μlのハミルトンシリンジのw /リムーバブルニードル | ハミルトン社 | 7635〜01 | |
| ハミルトン針、30Gまたは33 G、½インチ、30 °ベベル | ハミルトン社 | 7803-077803-05 | 使用する最適なゲージを識別するために針を通過させるに従って、細胞の生存率をテストする |
| マイクロはさみ | 世界の精密機器 | 555500S | |
| 小さなグレーフェ鉗子 | FST | 11053〜10 | |
| 定位の | Kopfは楽器 | モデル1772ユニバーサルホルダー | |
| 定位の | Kopfは楽器 | モデル1773電極ホルダー | |
| 定位の | Kopfは楽器 | モデル902小動物の定位 | |
| 定位の | Kopfは楽器 | モデル960左側の電極キャリア | |
| 縫合 | エチコン | 95057-064 | |
| 乳酸リンガー | ホスピーラ | NDC 0409-7953-03 | |
| ステープルズ | ファイン科学 | 12032〜07 | |
| 止血剤 | FST | 13010〜12 | |
| メス、サイズ10,11 | フィッシャー | 268878、268879 | |
| 縫合 | エチコン | 1676G | サイズ5-0、3 / 8"サークル、19ミリメートル針、45センチメートル編組のスレッド |
| 反射7創傷クリップアプリケーター | FST | 12031〜07 | |
| 7ミリメートル反射創傷クリップ | FST | 12032〜07 | |
| オルセン-ヘーガル針ホルダー | FST | 12502〜12 |
参考文献
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Weiner, H. L. The challenge of multiple sclerosis: how do we cure a chronic heterogeneous disease. Ann Neurol. 65, 239-248 (2009).
- Fleming, J. O., Trousdale, M. D., Bradbury, J., Stohlman, S. A., Weiner, L. P. Experimental demyelination induced by coronavirus JHM (MHV-4): molecular identification of a viral determinant of paralytic disease. Microb Pathog. 3, 9-20 (1987).
- Totoiu, M. O., Nistor, G. I., Lane, T. E., Keirstead, H. S. Remyelination, axonal sparing, and locomotor recovery following transplantation of glial-committed progenitor cells into the MHV model of multiple sclerosis. Exp Neurol. 187, 254-265 (2004).
- Carbajal, K. S., Schaumburg, C., Strieter, R., Kane, J., Lane, T. E. Migration of engrafted neural stem cells is mediated by CXCL12 signaling through CXCR4 in a viral model of multiple sclerosis. Proc Natl Acad Sci U S A. 107, 11068-11073 (2010).
- Hardison, J. L., Nistor, G., Gonzalez, R., Keirstead, H. S., Lane, T. E. Transplantation of glial-committed progenitor cells into a viral model of multiple sclerosis induces remyelination in the absence of an attenuated inflammatory response. Exp Neurol. 197, 420-429 (2006).
- Blakemore, W. F., Crang, A. J. Transplantation of glial cells into areas of demyelination in the adult rat spinal cord. , Oxford UP. Oxford. (1992).
- Liu, S. Embryonic stem cells differentiate into oligodendrocytes and myelinate in culture and after spinal cord transplantation. Proc Natl Acad Sci U S A. 97, 6126-6131 (2000).
- Keirstead, H. S. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. J Neurosci. 25, 4694-4705 (2005).
- Mayor, S. First patient enters trial to test safety of stem cells in spinal injury. BMJ. 341, c5724-c5724 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved