多価酸は複数の電離可能な水素を含み、段階的な電離過程を経ます。 イオン化可能なプロトンの酸解離定数が互いに十分に異なる場合、このような多価酸の滴定曲線には、イオン化可能な水素ごとに異なる当量点が形成されます。したがって、二価酸の滴定では2つの当量点が、三価酸の滴定では滴定曲線上に3つの当量点が形成されることになります。
炭酸(H2CO3)は、弱い二価酸の一例です。炭酸の最初のイオン化では、わずかなヒドロニウムイオンと炭酸水素イオンが生成されます。
1段階目の電離:
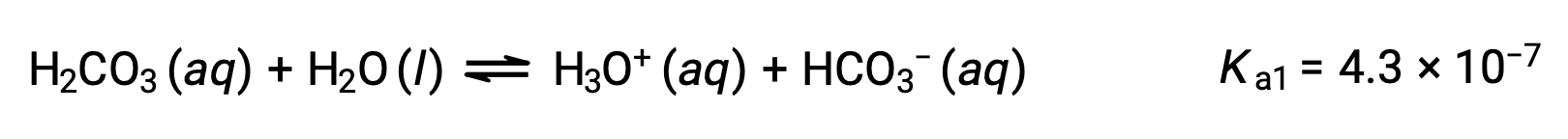
炭酸水素イオンは、酸としても作用します。電離した後、さらに少量のヒドロニウムイオンや炭酸イオンを生成します。
2段階目の電離:
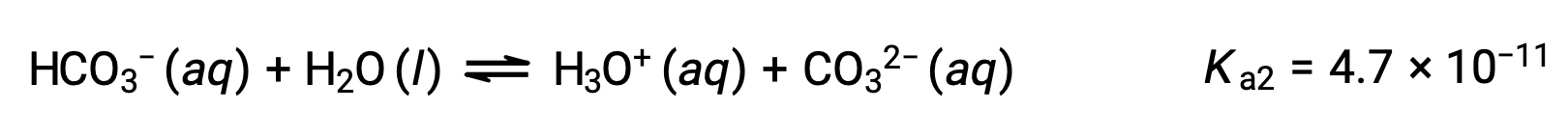
Ka1はKa2よりも104倍も大きいです。そのため、H2CO3をNaOHのような強塩基で滴定すると、電離可能な水素ごとに2つの異なる当量点が得られます。
三価酸であるリン酸は、3段階で電離します。
1段階目の電離:

2段階目の電離:

3段階目の電離:
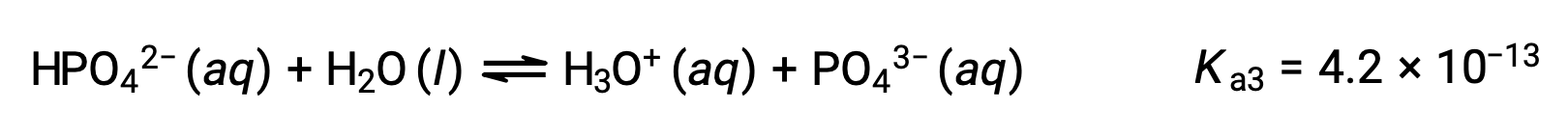
H3PO4をKOHのような強塩基で滴定すると、電離可能な各水素に対して3つの当量点が得られます。しかし、HPO42−は非常に弱い酸であるため、3つ目の当量点は滴定曲線上では容易に見分けることができません。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.
章から 16:

Now Playing
16.9 : 多価酸の滴定
酸塩基と溶解度平衡
95.4K 閲覧数

16.1 : 共通イオン効果
酸塩基と溶解度平衡
40.6K 閲覧数

16.2 : 緩衝液
酸塩基と溶解度平衡
162.9K 閲覧数

16.3 : ヘンダーソン-ハッセルバルヒ式
酸塩基と溶解度平衡
67.6K 閲覧数

16.4 : 緩衝液中のpHの変化の計算
酸塩基と溶解度平衡
52.2K 閲覧数

16.5 : 緩衝液の有効性
酸塩基と溶解度平衡
48.1K 閲覧数

16.6 : 滴定計算:強酸-強塩基
酸塩基と溶解度平衡
28.7K 閲覧数

16.7 : 滴定計算:弱酸-弱塩基
酸塩基と溶解度平衡
43.3K 閲覧数

16.8 : 指示薬
酸塩基と溶解度平衡
47.5K 閲覧数

16.10 : 溶解平衡
酸塩基と溶解度平衡
51.1K 閲覧数

16.11 : 溶解性に影響する因子
酸塩基と溶解度平衡
32.8K 閲覧数

16.12 : 錯体イオンの形成
酸塩基と溶解度平衡
22.9K 閲覧数

16.13 : イオンの沈殿
酸塩基と溶解度平衡
27.3K 閲覧数

16.14 : 定性分析
酸塩基と溶解度平衡
19.8K 閲覧数

16.15 : 酸塩基滴定曲線
酸塩基と溶解度平衡
125.4K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved