イオン性化合物の溶解度は、純水に比べて、共通のイオン(イオン性化合物の溶解により生成されるイオン)を含む水溶液では小さくなります。これは共通イオン効果と呼ばれる現象の一例で、質量作用の法則の結果をルシャトリエの原理で説明することができます。ヨウ化銀の溶解を考えてみよう。
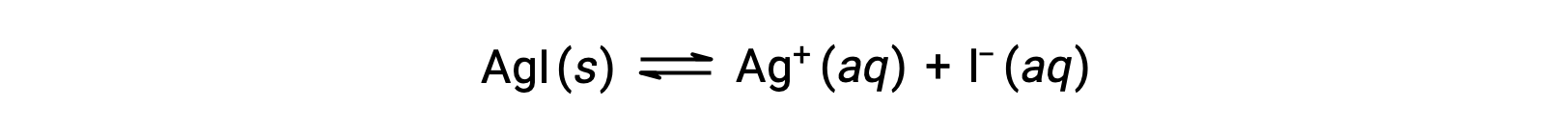
この溶解平衡は、銀(I)またはヨウ化物イオンのいずれかの添加によって左にシフトし、その結果、AgIが沈殿し、溶解したAg+とI–の濃度が低下します。これらのイオンがすでに含まれている溶液では、これらのイオンが含まれていない溶液よりもAgIの溶解量が少なくなる可能性があります。
この効果は、溶解度積の表現に代表されるように、質量作用の観点からも説明できます。
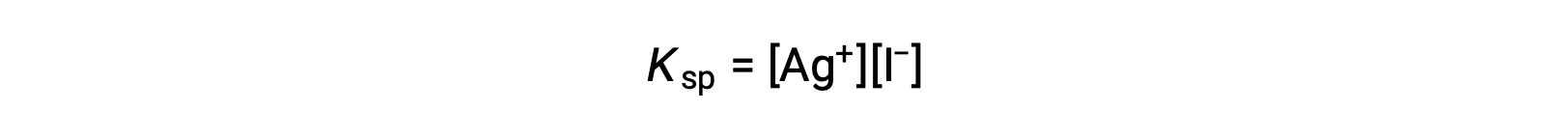
銀(I)イオンとヨウ化物イオンの物質量の積は、イオンの供給源にかかわらず平衡混合物では一定であるため、一方のイオンの濃度が増加すると、それに反比例してもう一方のイオンが減少することでバランスをとる必要があります。
溶液の共通イオン効果
共通のイオンは、溶液中での化合物の溶解度に影響を与えます。例えば、固体のMg(OH)2 は、次のようにMg2+ とOH−イオンに解離します。
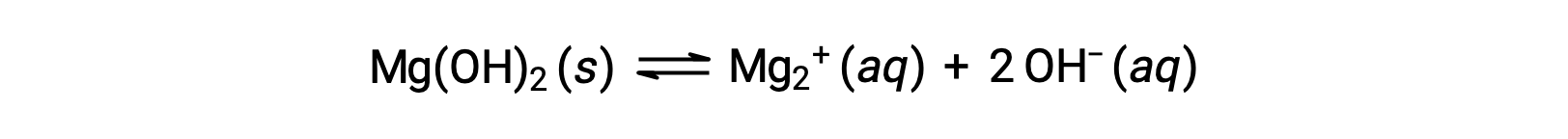
Mg(OH)2の飽和溶液にMgCl2を加えると、Le Châtelier’の原理に従って、追加のMg2+イオンによって生じる変化を相殺するために反応は左にシフトします。定量的には、添加されたMg2+によって反応商が溶解度積(Q > Ksp)よりも大きくなり、反応商が再びKspに等しくなるまでMg(OH)2が形成されます。新たな平衡では、純水にMg(OH)2を溶かした場合よりも[OH–]が少なく、[Mg2+]が多くなります。
Mg(OH)2の飽和溶液にKOHを加えると、追加のOH–イオンの増加分を相殺するために反応は左にシフトします。そして、反応商が再びKspと等しくなるまでMg(OH)2が生成します。新たな平衡状態では、純水にMg(OH)2を溶かした場合よりも[OH–]が大きく、[Mg2+]が小さくなります。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
章から 16:

Now Playing
16.1 : 共通イオン効果
酸塩基と溶解度平衡
40.5K 閲覧数

16.2 : 緩衝液
酸塩基と溶解度平衡
162.8K 閲覧数

16.3 : ヘンダーソン-ハッセルバルヒ式
酸塩基と溶解度平衡
67.5K 閲覧数

16.4 : 緩衝液中のpHの変化の計算
酸塩基と溶解度平衡
52.1K 閲覧数

16.5 : 緩衝液の有効性
酸塩基と溶解度平衡
48.1K 閲覧数

16.6 : 滴定計算:強酸-強塩基
酸塩基と溶解度平衡
28.6K 閲覧数

16.7 : 滴定計算:弱酸-弱塩基
酸塩基と溶解度平衡
43.1K 閲覧数

16.8 : 指示薬
酸塩基と溶解度平衡
47.4K 閲覧数

16.9 : 多価酸の滴定
酸塩基と溶解度平衡
95.3K 閲覧数

16.10 : 溶解平衡
酸塩基と溶解度平衡
50.9K 閲覧数

16.11 : 溶解性に影響する因子
酸塩基と溶解度平衡
32.7K 閲覧数

16.12 : 錯体イオンの形成
酸塩基と溶解度平衡
22.9K 閲覧数

16.13 : イオンの沈殿
酸塩基と溶解度平衡
27.2K 閲覧数

16.14 : 定性分析
酸塩基と溶解度平衡
19.7K 閲覧数

16.15 : 酸塩基滴定曲線
酸塩基と溶解度平衡
125.0K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved