Cella a combustibile con membrana a scambio protonico
Panoramica
Fonte: Laboratori di Margaret Workman e Kimberly Frye - Depaul University
Gli Stati Uniti consumano una grande quantità di energia – il tasso attuale è di circa 97,5 quadrilioni di BTU all'anno. La stragrande maggioranza (90%) di questa energia proviene da fonti di combustibile non rinnovabili. Questa energia viene utilizzata per l'elettricità (39%), i trasporti (28%), l'industria (22%) e l'uso residenziale / commerciale (11%). Poiché il mondo ha una fornitura limitata di queste fonti non rinnovabili, gli Stati Uniti (tra gli altri) stanno espandendo l'uso di fonti di energia rinnovabile per soddisfare le future esigenze energetiche. Una di queste fonti è l'idrogeno.
L'idrogeno è considerato una potenziale fonte di combustibile rinnovabile, perché soddisfa molti criteri importanti: è disponibile a livello nazionale, ha pochi inquinanti nocivi, è efficiente dal punto di vista energetico ed è facile da sfruttare. Mentre l'idrogeno è l'elemento più abbondante nell'universo, si trova solo in forma composta sulla Terra. Ad esempio, è combinato con l'ossigeno in acqua come H2O. Per essere utile come combustibile, deve essere sotto forma di gas H2. Pertanto, se l'idrogeno deve essere utilizzato come carburante per auto o altri dispositivi elettronici, H2 deve essere prodotto prima. Pertanto, l'idrogeno è spesso chiamato un "vettore energetico" piuttosto che un "carburante".
Attualmente, il modo più popolare per produrre gas H2 è da combustibili fossili, attraverso il reforming a vapore di idrocarburi o la gassificazione del carbone. Ciò non riduce la dipendenza dai combustibili fossili ed è ad alta intensità energetica. Un metodo meno utilizzato è l'elettrolisi dell'acqua. Ciò richiede anche una fonte di energia, ma può essere una fonte rinnovabile, come l'energia eolica o solare. Nell'elettrolisi, l'acqua (H2O) viene divisa nelle sue parti componenti, idrogeno gassoso (H2) e ossigeno gassoso (O2), attraverso una reazione elettrochimica. L'idrogeno gassoso prodotto attraverso il processo di elettrolisi può quindi essere utilizzato in una cella a combustibile a membrana a scambio protonico (PEM), generando una corrente elettrica. Questa corrente elettrica può essere utilizzata per alimentare motori, luci e altri dispositivi elettrici.
Principi
La parte I di questo esperimento prevede la generazione di idrogeno gassoso attraverso l'elettrolisi. Nell'elettrolisi, l'acqua viene divisa nelle sue parti componenti, idrogeno e ossigeno, attraverso la seguente reazione elettrochimica:
2 H2O(l) → 2 H2(g) + O2(g)
Ci sono il doppio delle molecole di idrogeno prodotte rispetto alle molecole di ossigeno. Questa reazione non avviene spontaneamente e necessita di una fonte di energia elettrica, ad esempioun pannello solare. Questa è una reazione di ossido-riduzione. Questi tipi di reazioni chimiche possono essere suddivisi in due parti: la reazione di ossidazione e la reazione di riduzione. Queste sono chiamate mezze reazioni. Nella semireazione di ossidazione, gli elettroni vengono rilasciati. Nella semireazione di riduzione, gli elettroni sono accettati.
Ossidazione: 2 H2O(l) → O2(g) + 4 H+(aq) + 4 e-
Riduzione: 4 H+(aq) + 4 e- → 2 H2(g)
L'idrogeno gassoso può essere raccolto e immagazzinato per l'uso in un secondo momento in una cella a combustibile (PEM) (Figura 1).
La parte II di questo esperimento prevede l'utilizzo dell'idrogeno gassoso immagazzinato come combustibile per produrre elettricità per alimentare un ventilatore. La cella a combustibile utilizzata in questo esperimento è una cella a combustibile PEM. La cella a combustibile PEM è come una batteria, in quanto crea elettricità attraverso una reazione chimica che comporta il trasferimento di elettroni. Nella cella a combustibile PEM, le mezze reazioni sono le seguenti:
Ossidazione: 2 H2(g) → 4 H+(aq) + 4 e-
Riduzione: 4 H+(aq) + O2(g) + 4 e- → 2 H2O(l)
La reazione complessiva è: 2 H2(g) + O2(g) → 2 H2O(l) + energia
Queste semireazioni si verificano agli elettrodi (conduttori attraverso i quali passa l'elettricità). Nella cella a combustibile PEM, ci sono due elettrodi: un anodo e un catodo. L'ossidazione si verifica all'anodo. La riduzione si verifica al catodo. Quindi, nella cella a combustibile PEM all'anodo, l'idrogeno gassoso viene ossidato e gli elettroni vengono rilasciati nel circuito. Al catodo, il gas ossigeno viene ridotto e si forma acqua. Nella cella a combustibile PEM, una membrana a scambio protonico separa i due elettrodi. Questa membrana consente ai protoni (H+) di fluire attraverso, ma impedisce agli elettroni di entrare nella membrana. Così gli elettroni sono costretti a fluire attraverso il circuito elettrico (Figura 2).

Figura 1: Diagramma di un elettrolizzatore.
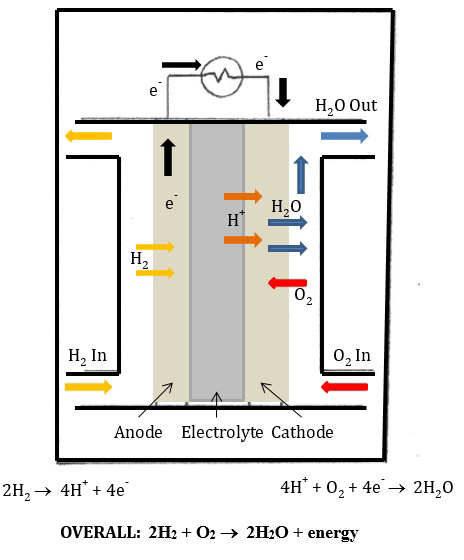
Figura 2: Cella a combustibile PEM.
Procedura
1. Utilizzo dell'elettrolizzatore per produrre idrogeno gassoso
- Impostare l'elettrolizzatore (Figura 3).
- Impostare le bombole di raccolta del gas, assicurandosi che il livello dell'acqua distillata nella bombola esterna sia al segno 0 (Figura 4).
- Collegare l'elettrolizzatore alle bombole di raccolta del gas (Figura 5).
- Collegare un pannello solare all'elettrolizzatore utilizzando fili jumper ed esporre alla luce solare diretta (Figura 6). Nota, se il tempo non sta collaborando quel giorno, usa una lampada con una lampadina per simulare il sole.
- Il gas H2 e O2 inizia ad entrare nelle bombole interne (Figura 7). Monitorare il volume di ogni gas prodotto a intervalli di 30 secondi, utilizzando la scala contrassegnata sul cilindro esterno. Ci vogliono circa 10 minuti per riempire la bombola interna con gas H2.
- Quando il cilindro interno è completamente pieno di gas H2, alcune bolle dovrebbero emergere dal cilindro interno, raggiungendo infine la superficie. A questo punto, scollegare il pannello solare dall'elettrolizzatore e chiudere il cincher sul tubo del gas H2, in modo che nessuno dei gas H2 fuoriesca. Si noti che c'è il doppio dell'idrogeno gassoso prodotto rispetto al gas ossigeno, come previsto nell'equazione chimica bilanciata.
2. Cella a combustibile
- Configurare una cella a combustibile (Figura 8).
- Scollegare il tubo del gas H2 dall'elettrolizzatore e collegarlo alla cella a combustibile.
- Collegare la cella a combustibile a una ventola (o a una luce a LED, se non è disponibile una ventola (Figura 9)) e rilasciare il cinch sul tubo del gas H2 (Figura 10). La ventola dovrebbe iniziare a girare. In caso contrario, premere la valvola di spurgo sulla cella a combustibile per far fluire il gas.
- La ventola continua a girare fino a quando tutto il gas H2 non viene consumato. Questo dovrebbe durare circa 5 minuti.

Figura 3: Un'immagine dell'elettrolizzatore.

Figura 4: Bombole di raccolta del gas con livelli di acqua distillata pari a 0.

Figura 5: Immagine dell'elettrolizzatore collegato alle bombole di raccolta del gas.

Figura 6: Il pannello solare collegato all'elettrolizzatore con fili jumper.

Figura 7: Un esempio del gas che entra nelle bombole.

Figura 8: Immagine di una cella a combustibile.

Figura 9: La cella a combustibile collegata a una luce a LED anziché a una ventola.

Figura 10: L'elettrolizzatore collegato alla cella a combustibile, che è collegata alla ventola.
Risultati
Durante la procedura di elettrolisi, l'idrogeno e l'ossigeno gassoso vengono generati una volta che il pannello solare è collegato ed esposto alla luce solare. Ci vogliono circa 10 minuti per generare abbastanza gas H2 per riempire la bombola interna (Tabella 1). Si noti che c'è il doppio di H2 generato rispetto a O2, come si vede nell'equazione bilanciata:
2 H2O(l) → 2 H2(g) + O2(g)
Una volta generato il gas H2 e collegato il tubo alla cella a combustibile, la cella a combustibile genera elettricità e fa girare la ventola. Questo dura circa 10 minuti su una bombola piena di gas H2.
| Tempo (i) | Idrogeno generato (mL) | Ossigeno generato (mL) |
| 0 | 0 | 0 |
| 30 | 4 | 2 |
| 60 | 8 | 4 |
| 90 | 10 | 6 |
| 120 | 12 | 6 |
| 150 | 14 | 6 |
| 180 | 14 | 8 |
| 210 | 16 | 8 |
| 240 | 18 | 8 |
| 270 | 20 | 10 |
| 300 | 22 | 10 |
| 330 | 22 | 10 |
| 360 | 24 | 12 |
| 390 | 24 | 12 |
| 420 | 26 | 12 |
| 450 | 26 | 14 |
| 480 | 28 | 14 |
| 510 | 28 | 14 |
| 540 | 28 | 14 |
| 570 | 30 | 16 |
| 600 | 30 | 16 |
Tabella 1: Tempo necessario per generare diverse quantità di idrogeno e ossigeno
Applicazione e Riepilogo
L'idrogeno è un combustibile flessibile. Può essere prodotto in loco in piccole quantità per uso locale o in grandi quantità in una struttura centralizzata. L'idrogeno può quindi essere utilizzato per produrre elettricità con solo acqua come sottoprodotto (a condizione che una fonte di energia rinnovabile, come una turbina eolica, sia stata utilizzata per generare l'idrogeno gassoso). Ad esempio, a Boulder, in Colorado, il progetto Wind2H2 ha turbine eoliche e pannelli solari collegati a elettrolizzatori che producono idrogeno gassoso dall'acqua e poi lo immagazzinano per essere utilizzato nella loro stazione di rifornimento di idrogeno.
Questo processo può anche essere utilizzato per far funzionare le auto con idrogeno gassoso (H2)anziché con combustibili fossili. Se una cella a combustibile PEM è installata in un'auto, l'elettricità può essere utilizzata per far funzionare il motore. L'unico scarico sarebbe l'acqua (H2O). Dal punto di vista dell'inquinamento atmosferico, questo è vantaggioso. Ci sono molti prototipi di auto a celle a combustibile sviluppati dalle principali case automobilistiche. A causa della quantità di spazio attualmente necessaria per immagazzinare i serbatoi di idrogeno compresso su un veicolo, le celle a combustibile a idrogeno sono viste principalmente sugli autobus. Gli autobus a celle a combustibile si trovano in diversi paesi in tutto il mondo. Ci sono alcune questioni tecnologiche che devono essere affrontate prima che le auto a celle a combustibile siano una valida alternativa alle auto con motore a combustione interna, tra cui la fornitura di più infrastrutture, la riduzione dei costi e un maggiore uso di fonti di energia rinnovabile quando si produce gas H2.
Inoltre, le celle a combustibile a idrogeno possono essere utilizzate al posto delle batterie per cose come videocamere e radio. Un esempio è il dispositivo UPP, che è un alimentatore portatile basato sulla tecnologia delle celle a combustibile a idrogeno che può essere utilizzato per caricare dispositivi compatibili usb.
Vai a...
Video da questa raccolta:

Now Playing
Cella a combustibile con membrana a scambio protonico
Environmental Science
22.2K Visualizzazioni

Identificazione degli alberi: come utilizzare una chiave dicotomica
Environmental Science
81.3K Visualizzazioni

Rilevamento degli alberi: metodo di campionamento a quarti centrati su un punto
Environmental Science
49.5K Visualizzazioni

Utilizzo di sistemi di geolocalizzazione (GIS) per lo studio della selvicoltura urbana
Environmental Science
12.7K Visualizzazioni

Biocarburanti: produzione di etanolo da materiali cellulosici
Environmental Science
53.3K Visualizzazioni

Test per alimenti geneticamente modificati
Environmental Science
89.9K Visualizzazioni

Torbidità e solidi totali nelle acque superficiali
Environmental Science
35.9K Visualizzazioni

Ossigeno disciolto nelle acque superficiali
Environmental Science
55.9K Visualizzazioni

Nutrienti negli ecosistemi acquatici
Environmental Science
39.0K Visualizzazioni

Misurazione dell'ozono troposferico
Environmental Science
26.5K Visualizzazioni

Determinazione degli ossidi di azoto (NO x) nei gas di scarico delle automobili tramite l'uso della spettroscopia UV-VIS
Environmental Science
30.2K Visualizzazioni

Analisi del piombo nel suolo mediante spettroscopia di assorbimento atomico
Environmental Science
125.8K Visualizzazioni

Analisi del carbonio e dell'azoto in campioni di matrici ambientali
Environmental Science
29.5K Visualizzazioni

Analisi dei nutrienti del suolo: azoto, fosforo e potassio
Environmental Science
216.1K Visualizzazioni

Analisi delle popolazioni di lombrichi nel suolo
Environmental Science
16.5K Visualizzazioni