Method Article
Valutazione dell'osso corticale mediante onde guidate da ultrasuoni: uno studio di riproducibilità in una popolazione sana
In questo articolo
Riepilogo
Qui, presentiamo in dettaglio il protocollo di misurazione del dispositivo a ultrasuoni a trasmissione assiale bidirezionale (BDAT) e lo testiamo in uno studio di riproducibilità, considerando 14 partecipanti sani e 3 operatori. L'affidabilità, misurata con i coefficienti di correlazione intraclasse (ICC), era da buona a eccellente per quattro parametri di interesse.
Abstract
Le fratture da fragilità sono ancora un onere sanitario a livello mondiale nel contesto dell'invecchiamento della popolazione. In particolare, si prevede che il numero globale di fratture dell'anca raddoppierà tra il 2020 e il 2050. Pertanto, è essenziale rilevare i pazienti a rischio di frattura da fragilità su scala di popolazione. L'attuale standard d'oro è la doppia assorbimetria a raggi X (DXA), che fornisce la densità minerale ossea areale (aBMD). I dispositivi a ultrasuoni, solitamente più portatili ed economici dei dispositivi a raggi X, rappresentano interessanti alternative DXA come strumenti di screening. Tuttavia, la dipendenza dagli operatori è solitamente riconosciuta come il loro principale svantaggio. In questo studio, viene presentato in dettaglio il protocollo di misurazione del dispositivo a ultrasuoni a trasmissione assiale bidirezionale (BDAT). La sonda ultrasonica dedicata viene posizionata a un terzo del radio distale dell'avambraccio non dominante utilizzando un gel di accoppiamento convenzionale. L'interfaccia guidata fornisce in tempo quasi reale (circa 2 Hz) quattro parametri di interesse: velocità del primo segnale in arrivo (vFAS) e della modalità A0 (vA0), spessore corticale (Ct.Th) e porosità (Ct.Po), oltre a quattro parametri di qualità. L'operatore muove lentamente la sonda sul sito di misura, osservando attentamente il feedback fornito dall'interfaccia fino a trovare una posizione stabile e iniziare una serie di 10 acquisizioni. Quando si ottengono almeno quattro serie coerenti, la misurazione termina e viene generato un report automatico. La misurazione richiede solitamente circa 5 minuti per essere completata. Per determinare la robustezza di questo protocollo, è stato condotto uno studio di riproducibilità tra 3 operatori (un esperto e due principianti) e 14 partecipanti sani (6 donne, 8 uomini, 21-53 anni). I coefficienti di correlazione intraclasse (ICC) sono risultati buoni per vA0 (0,76), Ct.Po (0,80) o eccellenti per Ct.Th (0,87) e vFAS (0,91). Le deviazioni standard sono risultate inferiori al 10% degli intervalli totali nella pratica clinica.
Introduzione
L'osteoporosi e le fratture da fragilità associate costituiscono ancora un grave problema di salute pubblica1. In particolare, si prevede che il numero mondiale di fratture dell'anca raddoppierà fino al 20502. La fragilità ossea è dovuta a un lento e silenzioso processo di demineralizzazione e perdita ossea senza importanti segnali di allerta prima dell'evento di frattura da fragilità. L'attuale gold standard per rilevare i pazienti a rischio di frattura da fragilità è la doppia assorbimetria a raggi X (DXA), che fornisce un'immagine a raggi X 2D a bassa risoluzione con un pixel grigio calibrato3. Da questa immagine è possibile estrarre la densità minerale ossea areale (aBMD in g.cm-2) in diverse regioni di interesse associate ai principali siti di frattura da fragilità: colonna vertebrale, polso e anca. Il valore aBMD diminuisce all'aumentare del tasso di frattura da fragilità3. Inoltre, la normalizzazione del T-score, rispetto ad una popolazione sana normale, consente il confronto di pazienti misurati con dispositivi proposti da diversi produttori. Il T-score DXA è stato proposto dall'Organizzazione Mondiale della Sanità per definire la diagnosi di osteoporosi in tre fasi: normale (T-score < -1), osteopenica (-1 < T-score < -2,5) e osteoporotica (T-score < -2,5)4.
La DXA presenta diverse limitazioni: le sue dimensioni, il costo relativamente elevato, la necessità di una sala dedicata e la sua capacità di discriminare tra fratturato e non fratturato, nonché la sua disponibilità in numerosi paesi, come in America Latina, sono entrambi moderati5. Pertanto, c'è bisogno di alternative DXA come strumenti di screening per la stima del rischio di frattura da fragilità6. Tuttavia, alcune alternative DXA, come la tomografia computerizzata quantitativa e i suoi derivati7, la risonanza magnetica (MRI)8, sono anche ingombranti e non ampiamente disponibili. L'ecografia quantitativa (QUS) presenta il potenziale per dispositivi di screening portatili, robusti e facili da usare. Sono stati sviluppati diversi dispositivi per la valutazione dell'osso corticale, associati a diverse frequenze che vanno da pochi kHz a pochi MHz e a diversi posizionamenti dei trasduttori in trasmissione, retrodiffusione9, eco a impulsi10 e trasmissione assiale in cui i trasduttori sono allineati con l'asse di un osso lungo come il radio e la tibia. Alcuni dispositivi forniscono surrogati aBMD11, mentre altri forniscono parametri ultrasonici "classici" come velocità12 o coefficienti di attenuazione9 e persino parametri geometrici e materiali, ad esempio lo spessore corticale, la porosità o la distribuzione delle dimensioni dei pori9. Tuttavia, fino ad oggi, la QUS non è ancora riuscita ad essere ampiamente utilizzata nella pratica clinica per la valutazione ossea, in parte a causa della mancanza di omogeneizzazione tra i dispositivi e della dipendenza dall'operatore13.
Tra le tecnologie QUS proposte come alternative DXA, la trasmissione assiale (AT) ha il vantaggio che la misura può essere eseguita all'avambraccio, un sito (i) facilmente accessibile e (ii) vicino a uno dei principali siti di fratture da fragilità, ovvero il polso. Il primo parametro AT proposto dipende dalla velocità di propagazione ultrasonica nello strato corticale, denotata velocità del suono (SOS) o velocità del segnale di primo arrivo (vFAS), a seconda dell'elaborazione del segnale e dei dispositivi, alcuni dei quali sono commerciali12,14 e altri prototipi di laboratorio15,16. Questo parametro è stato in grado di discriminare tra gruppi di pazienti con o senza fratture da fragilità con prestazioni simili alla BMD in diversi studi clinici dalla fine degli anni '9014,15. È stato anche applicato con successo per studi longitudinali multicentrici, dimostrando la sua applicazione clinica e robustezza12. La precisione del vFAS è stata migliorata combinando le due direzioni opposte di propagazione al fine di ridurre la distorsione dovuta all'angolo tra la sonda e la superficie ossea16,17. Questo punto di vista è stato indicato come AT bidirezionale (BDAT).
Anche se la vFAS ha mostrato interesse clinico, il suo principale svantaggio, simile alla BMD, è che combina diverse caratteristiche chiave dell'osso corticale come le proprietà geometriche e dei materiali, rendendo la sua interpretazione clinica non semplice. Questo è il motivo per cui è stato proposto il punto di vista dell'onda guidata, considerando il suo potenziale dovuto alla sensibilità fine delle onde guidate alle proprietà della guida d'onda. Questo approccio dovrebbe combinare l'elaborazione del segnale, la modellazione della guida d'onda e i problemi inversi ed è ampiamente utilizzato nei test non distruttivi considerando, ad esempio, le guide d'onda metalliche, come piastre o tubi18. Pertanto, dal 2010 è stato sviluppato passo dopo passo un dispositivo BDAT di seconda generazione, dai fantocci che imitano l'osso19 alla convalida ex vivo 20 e alle misurazioni in vivo 21. Il dispositivo è stato testato con successo in studi clinici in Francia22, Germania23, Regno Unito24 e Cile25 e ha mostrato risultati migliorativi in termini di tasso di successo e discriminazione dei pazienti.
Questo studio mira a esplorare la riproducibilità dell'attuale dispositivo a ultrasuoni BDAT. Innanzitutto, verranno dettagliati il dispositivo e il protocollo di misurazione. I risultati ottenuti con 14 partecipanti e 3 operatori saranno presentati e discussi in termini di screening di popolazione per l'individuazione di pazienti a rischio di fratture da fragilità.
Principio di misura: elaborazione del segnale, parametri di interesse e parametri di qualità
Il dispositivo di trasmissione assiale bidirezionale (BDAT) è composto da diverse parti, la principale delle quali è la sonda ultrasonica, il modulo elettronico e il computer. L'elenco completo è dettagliato nella Tabella dei materiali e illustrato nella Figura 1. Di seguito vengono descritti i parametri di interesse, i parametri di qualità della misura e il protocollo di misura.
vFAS
Una volta ricevuti dal computer, i segnali campionati vengono elaborati seguendo diversi passaggi. Il primo passo consiste nell'elaborazione del segnale nel dominio del tempo, rilevando il FAS utilizzando il protocollo descritto in precedenza16,17. Una volta ottenuto il tempo di arrivo per ogni ricevitore, è possibile determinare la velocità FAS, in seguito indicata con vFAS, che è la media armonica delle velocità ottenute in entrambe le direzioni di propagazione. Combinando le informazioni provenienti da entrambe le direzioni di propagazione, è possibile ottenere l'angolo di valore tra la sonda e le direzioni della superficie ossea e derivare un valore vFAS16 non distorto. Questo angolo bidirezionale viene successivamente indicato con alfa e viene utilizzato come parametro della qualità della misurazione. Questa elaborazione temporale consente anche la stima dello spessore dei tessuti molli tra la superficie ossea e la sonda, indicato ST.Th26.
Immagine dello spettro d'onda guidato
Il secondo passo consiste nell'elaborazione del segnale nel dominio di Fourier, considerando le frequenze temporali e spaziali, denotate f e k. L'approccio è un metodo basato su SVD, che consente la trasformazione dei segnali spazio-temporali nella funzione di Norm, indicata anche con un'immagine dello spettro d'onda guidata (GWSI), come illustrato nella Figura 2 per un avambraccio in vivo 19. Il metodo combina due trasformate di Fourier (tempo e spazio) e una decomposizione ai valori singolari (SVD), consentendo di visualizzare il tasso di presenza nei segnali ricevuti (in una scala 0-1) dei modi guidati dallo strato osseo corticale. La GWSI può essere interpretata come un miglioramento della trasformata spazio-temporale di Fourier, con ogni pixel associato a un piano indipendente di frequenza f e numero d'onda k. Si noti che l'approccio è stato migliorato per tenere conto dell'impatto dell'attenuazione del materiale27 e della variazione lineare dello spessore28.
Particolare attenzione sarà data alla parte superiore dello spettro, associata al modo A0, e anche alla parte più bassa, associata ai valori di velocità di fase più elevati, cioè maggiori di 4 mm·μs-1. Questa parte corrisponde alla regione di interesse 3 (ROI 3)29. Il valore medio di ROI 3, in seguito indicato come lowk, viene utilizzato anche come parametro di qualità. Un valore elevato corrisponde a una guida d'onda regolare, che consente riflessioni d'onda chiare alle interfacce ossee. Se il valore diminuisce, potrebbe essere dovuto a una guida d'onda irregolare o a una sonda mal posizionata.
Modello a guida d'onda
La dispersione dell'onda guidata, o la variazione della velocità di fase di ciascun modo guidato rispetto alla frequenza, dipende sia dal materiale che dalle proprietà geometriche della guida d'onda. Pertanto, è potenzialmente possibile recuperare queste proprietà utilizzando l'elaborazione del segnale dedicata, la modellazione della guida d'onda e gli schemi di problemi inversi. Nel caso BDAT, il modello della guida d'onda corrisponde a una piastra libera isotropa trasversale 2D, a seconda del materiale della guida d'onda e di un parametro geometrico, lo spessore30. Il materiale osseo corticale viene omogeneizzato considerando parametri fissi per la matrice ossea e porosità variabile31. Pertanto, il problema inverso dipende da due parametri, denotati spessore corticale (Ct.Th) e porosità corticale (Ct.Po). Gli effetti dell'assorbimento del materiale, della curvatura della guida d'onda e dei tessuti molli circostanti non vengono presi in considerazione nel modello, anche se influiscono sulla misurazione. Tuttavia, il loro peso sul risultato del problema inverso non è risultato determinante, il che significa che i modi nelle due principali regioni di interesse (A0 e parte più bassa) non sono significativamente modificati dalla curvatura e dai tessuti molli32.
Problema inverso
Inizialmente, il problema inverso è stato diviso in due fasi: in primo luogo, estrarre la dispersione sperimentale dell'onda guidata e, in secondo luogo, confrontarla con il modello della guida d'onda. Questo punto di vista era limitato dal rumore e dall'etichettatura dei modi30,32. Pertanto, è stato proposto un approccio dedicato per superare queste limitazioni come estensione del punto di vista della funzione di Norm. Invece di considerare ogni onda piana in modo indipendente, vengono prese in considerazione solo le possibili onde guidate fornite dal modello a guida d'onda20. Questo porta all'immagine inversa del problema, espressa nel dominio dei parametri del modello, cioè il piano Ct.th - Ct.Po (Figura 2 in basso a destra). Al modello più adatto viene data la posizione massima, mentre eventuali picchi secondari (indicati dalle immagini del problema inverso con un punto grigio) corrispondono a soluzioni ambigue, indicate nel confronto f-k con modi sperimentali con linee grigio chiaro. Come in precedenza, il valore dei pixel viene normalizzato dalla costruzione e riflette, in questo caso, la presenza di un particolare modello di guida d'onda nei segnali ricevuti. Come parametri di qualità vengono utilizzati anche il valore massimo (indicato con max) e la differenza con il secondo massimo (indicato con diff).
Il problema inverso è stato originariamente proposto per il calcolo offline, cioè una volta acquisiti i segnali, utilizzando i valori esatti dei numeri d'onda del modello. Questo approccio è stato validato sia per i siti del radio che per quelli della tibia considerando studi ex vivo20,33 e in vivo 21,34,35. Al fine di includere questi calcoli nell'interfaccia uomo-macchina (HMI), è stata proposta una versione approssimata, compatibile con l'applicazione in tempo reale, utilizzando un punto di vista a matrice sparsa36.
vA0
Dal GWSI è anche possibile estrarre la velocità del modo guidato più lento, associato al primo modo antisimmetrico A0 della piastra libera o modello Lamb33,35. La parte superiore dello spettro delle onde guidate può essere approssimata linearmente, con la pendenza che fornisce il valore della velocità vA0 (Figura 2 in basso a sinistra).
Riepilogo dei parametri:
Infine, vengono misurati quattro parametri di interesse: (i) vFAS: velocità del primo segnale in arrivo (m·s-1); ii) vA0: velocità della modalità guidata più lenta (m·s-1); (iii) Ct.Th: spessore corticale (mm); e (iv) Ct.Po: porosità corticale (%).
Vengono considerati quattro parametri di qualità: (i) alfa: angolo bidirezionale (°); (ii) lowk: valore medio della parte più bassa del GWSI (valore normalizzato compreso tra 0 e 1); (iii) max: massimo della funzione inversa del problema (valore normalizzato compreso tra 0 e 1); e (iv) diff: la differenza tra il primo e il secondo massimo della funzione inversa del problema (valore normalizzato tra 0 e 100).
Tutti questi parametri, così come le due immagini dello spettro d'onda guidata (una per direzione di propagazione) e l'immagine del problema inverso, vengono visualizzati in "tempo reale" dall'HMI, con un frame rate di circa 2 Hz. Un esempio tipico è illustrato nella Figura 3. Nella sezione seguente, il metodo di utilizzo di questi parametri è descritto in dettaglio. L'idea principale è che l'operatore muova lentamente la sonda nel sito di misura, osservando attentamente il feedback fornito dalle diverse parti dell'interfaccia fino a trovare una posizione stabile e iniziare una serie di 10 acquisizioni. Quando si ottengono almeno quattro serie coerenti, la misurazione termina e viene generato un report automatico.
Protocollo
Lo studio è stato approvato dal Comitato Etico dell'Universidad de Valparaiso, in Cile, con il numero di protocollo CEC213-20. Per i partecipanti è stato fornito il consenso informato scritto. È stata effettuata un'intervista telefonica per stabilire l'inclusione/esclusione dei partecipanti. Lo studio è stato registrato con il seguente riferimento: NCT05424536.
1. Configurazione del dispositivo
- Posiziona le parti principali del dispositivo su un grande tavolo.
- Posizionare fianco a fianco le seguenti parti: trasformatore di isolamento elettrico, modulo elettronico e computer portatile su un grande tavolo. Assicurarsi che ci sia spazio sufficiente davanti a queste parti per posizionare facilmente l'avambraccio del partecipante in un secondo momento.
- Eventualmente, posizionare il computer portatile direttamente sul modulo elettronico in caso di spazio limitato, facendo attenzione a non ostruire le finestre di ventilazione del modulo, che sono chiaramente indicate.
- Collegare il trasformatore di isolamento elettrico.
- Collegare il trasformatore di isolamento elettrico alla corrente domestica della stanza utilizzando un cavo dedicato.
- Collegare il modulo elettronico.
- Collegare il modulo elettronico al trasformatore di isolamento elettrico utilizzando un cavo di alimentazione dedicato.
- Premere il pulsante ON-OFF sul trasformatore per alimentare il modulo.
- Collegare il computer portatile.
- Collegare il computer portatile al modulo utilizzando il cavo USB (Universal Serial Bus) dedicato per inviare i segnali ricevuti digitalizzati al computer per un'ulteriore elaborazione.
- Se il laptop deve essere alimentato, collegare il cavo di alimentazione al trasformatore di isolamento elettronico.
- Collegare la sonda a ultrasuoni.
- Collegare la sonda a ultrasuoni al modulo con l'apposita fessura per cavi situata sul lato anteriore del modulo. Sono disponibili due diverse sonde per i siti di misurazione dell'avambraccio e della gamba. In questo studio, viene considerato solo il radio (sonda dell'avambraccio).
- Collegare l'interruttore a pedale.
- Posizionare l'interruttore a pedale sul pavimento vicino ai piedi, tenendo conto della posizione dell'operatore durante la misurazione di un partecipante. Collegare l'interruttore a pedale al computer utilizzando un cavo USB. Utilizzare il pedale per avviare la serie di acquisizioni.
2. Installazione dei partecipanti
- Posizionare il partecipante.
- Invitare il partecipante a sedersi di fronte all'operatore con l'avambraccio nudo appoggiato sul tavolo davanti al dispositivo precedentemente installato (vedi Figura 3).
NOTA: Viene misurato il lato controlaterale (cioè il lato sinistro per un partecipante destrorso).
- Invitare il partecipante a sedersi di fronte all'operatore con l'avambraccio nudo appoggiato sul tavolo davanti al dispositivo precedentemente installato (vedi Figura 3).
- Contrassegnare il sito di misurazione (un terzo del radio distale).
- Misura la lunghezza del raggio usando il righello dallo stiloide radiale (estremità ossea vicino al polso) al gomito.
- Dividi questa lunghezza per tre.
- Contrassegnare il sito di misurazione, cioè un terzo del radio distale, utilizzando la penna misurando un terzo della lunghezza del raggio dal polso.
- Avviare il software HMI.
- Avviare il software HMI facendo clic sull'icona corrispondente sul desktop del laptop.
- Aggiungi i dati del partecipante.
- Aggiungi i dati del partecipante (ID anonimizzato, lateralità, sito misurato, ID operatore, sesso, ecc.) utilizzando la finestra pop-up, che si apre automaticamente all'avvio del software.
- Aggiungere il gel ecografico.
- Aggiungere gel ecografico sul lato anteriore della sonda e sul sito di misurazione, contrassegnato sull'avambraccio del partecipante, per garantire la propagazione delle onde ultrasoniche.
- Mettere la sonda a contatto con l'avambraccio.
- Mettere la sonda a contatto con l'avambraccio, con il centro della sonda posizionato sul segno precedentemente fatto al punto 2.2.
3. Alla ricerca di una posizione stabile
NOTA: L'HMI visualizza quattro parametri di interesse: due velocità, vFAS e vA0, e due valori di problema inversi, spessore corticale (Ct.Th) e porosità corticale (Ct.Po). L'HMI visualizza anche quattro parametri di qualità denotati alfa, lowk, max e diff. Questi parametri sono descritti in dettaglio nell'introduzione.
- Avvia la visualizzazione in tempo reale .
- Avvia la visualizzazione in tempo reale facendo clic sul pulsante di avvio nella parte inferiore destra dell'interfaccia del software. La durata tra due visualizzazioni successive dei valori è di circa 0,5 s.
- Trova un valore vFAS stabile.
- Regolare lentamente la posizione della sonda osservando il valore del parametro vFAS visualizzato in un caso specifico dell'interfaccia. I valori normali vanno da circa 3800 m∙s-1 a circa 4200 m∙s-1.
- Se viene trovata una posizione stabile, assicurarsi che la variazione del vFAS sia inferiore a circa 40 m∙s-1 tra due calcoli successivi.
- Regolare l'angolo bidirezionale.
- Regolare lentamente la posizione della sonda rispettando il valore bidirezionale (parametro di qualità alfa) visualizzato in un caso specifico dell'interfaccia.
- Regolare la posizione della sonda aggiungendo delicatamente una pressione su un lato della sonda fino a quando il valore assoluto dell'angolo è inferiore a 2° per migliorare il parallelismo tra la sonda e la superficie ossea.
- Trovare un valore vA0 stabile.
- Regolare lentamente la posizione della sonda osservando il valore del parametro vA0 visualizzato in un caso specifico dell'interfaccia. I valori normali variano da circa 1500 m∙s-1 a circa 1900 m∙s-1.
- Se viene trovata una posizione stabile, assicurarsi che la variazione di vA0 sia inferiore a circa 40 m∙s-1 tra due calcoli successivi.
- In caso di difficoltà, osservare gli spettri dell'immagine dell'onda guidata visualizzati nella colonna di destra dell'interfaccia. Assicurarsi che la parte superiore dello spettro appaia come una linea continua, la cui pendenza fornisce il valore vA0.
- Osservare l'immagine del problema inverso.
- Osservare l'immagine del problema inverso, che appare automaticamente una volta stabilizzati i valori delle due velocità (vFAS e vA0) e dell'angolo.
- Assicurati che l'immagine mostri almeno un massimo, indicato con un pixel chiaro, ed eventualmente uno o più massimi secondari, indicati con un colore diverso. I tre parametri di qualità mancanti (max. diff, lowk) vengono calcolati automaticamente in tempo reale.
- Migliora l'immagine del problema inverso.
- Regolare lentamente la posizione della sonda osservando i massimi dell'immagine problematica inversa.
- Trova il primo massimo più alto possibile e il massimo secondario più basso possibile osservando i casi corrispondenti dell'interfaccia (valori max e diff).
- In caso di difficoltà, osservare l'immagine dello spettro d'onda guidata visualizzata nella colonna di destra dell'interfaccia. Assicurarsi che la parte inferiore dello spettro appaia con poche linee continue, il più lunghe possibile, associate a modalità di velocità di fase elevate e al parametro di qualità lowk, il più alto possibile.
- Trova una posizione stabile.
- Una volta trovata un'immagine inversa del problema accettabile, stabilizzare la posizione della sonda. Assicurarsi che non vengano rilevate modifiche significative dell'immagine del problema inverso tra due calcoli successivi.
4. Acquisizione dati
- Inizia una serie di 10 acquisizioni.
- Una volta trovata una posizione stabile, avviare una serie di 10 acquisizioni premendo l'interruttore a pedale con il piede.
- Rimanere il più stabili possibile durante le 10 acquisizioni, della durata di circa 5 s.
- Controlla la qualità della serie.
- Guarda le medie e le deviazioni standard dei parametri di interesse, che vengono calcolati automaticamente e mostrati in finestre pop-up che appaiono una volta terminata la serie.
- Se le deviazioni standard sono inferiori alle soglie fissate, tenere conto delle serie. Al contrario, rifiuta la serie.
- Risposta alla domanda posta in una seconda finestra pop-up, chiedendo se l'operatore desidera interrompere o proseguire con la serie di acquisizioni dello stesso partecipante.
- Riposizionare la sonda.
- Ricominciare i passaggi precedenti (dai passaggi 2.1 a 3.2) per trovare posizioni più stabili e acquisire più serie di 10 acquisizioni. Eventualmente, se necessario, lascia riposare il partecipante tra due riposizionamenti.
- Come in precedenza, per ogni serie vengono calcolate automaticamente le medie e le deviazioni standard dei parametri di interesse.
- Guarda la finestra pop-up dei risultati per verificare se l'ultima serie acquisita è stata conservata o rifiutata. La misurazione del partecipante termina quando vengono registrate almeno quattro serie coerenti. Le serie esterne vengono automaticamente rifiutate.
- Ottenere i valori finali.
NOTA: I valori finali dei parametri di interesse si ottengono automaticamente, considerando la media delle medie ottenute con la serie costante. - Verifica il pdf del report automatico.
- Verificare che i valori finali siano riportati nel pdf del report automaticamente e istantaneamente una volta scelta l'opzione stop nella finestra pop-up. Un esempio è mostrato nella Figura 4.
NOTA: il pdf si trova nella stessa cartella dei dati grezzi, che potrebbero essere rianalizzati in seguito offline.
- Verificare che i valori finali siano riportati nel pdf del report automaticamente e istantaneamente una volta scelta l'opzione stop nella finestra pop-up. Un esempio è mostrato nella Figura 4.
- Verificare il secondo rapporto preciso.
- Verificare il secondo report preciso generato utilizzando i valori esatti del modello di guida d'onda per il calcolo del problema inverso anziché i valori approssimati come nel caso del primo report automatico. La seconda generazione di report richiede meno di 5 minuti. Gli esempi sono mostrati nella Figura 5 e nella Figura 6.
- Verificare che il report automatico corrisponda al report esatto. Rimuovete le serie che non sono state eliminate automaticamente per mantenere la serietà coerente.
Risultati
È stato condotto uno studio di riproducibilità considerando 3 operatori (un esperto, due principianti) e 14 partecipanti sani (6 donne, 8 uomini, 21-53 anni). Gli operatori alle prime armi sono stati addestrati per circa 3 ore a comprendere e mettere in pratica il protocollo di acquisizione. Quindi, i partecipanti sono stati misurati per 2 settimane nell'agosto 2023. Ogni misurazione è stata eseguita in modo indipendente. Tutti gli operatori erano in cieco, cioè un operatore non conosceva i risultati ottenuti dagli altri due.
Ripetibilità intra-operatore
La Figura 5 illustra la ripetibilità intra-operatore per un caso coerente: 4 serie di 10 acquisizioni acquisite su un partecipante e un operatore. La prima colonna corrisponde alle funzioni inverse del problema, mentre la seconda colonna mostra la dispersione sperimentale in modalità guidata rispetto al modello più adatto. Ogni linea di figure corrisponde a una serie di successo. Il numero delle acquisizioni mantenute è riportato nel titolo: 7 su 10 per la prima serie e 10 su 10 per le successive. Per ogni serie vengono fornite le medie e le deviazioni standard e i quattro parametri (vFAS, vA0, Ct.Th e Ct.Po). Inoltre, vengono mostrati anche i parametri di qualità: angolo bidirezionale (alfa), massimo della funzione inversa del problema (max), differenza assoluta con il secondo massimo (diff) e valore medio della parte più bassa del GWSI (lowk).
Le deviazioni standard intra-serie sono basse, circa 0,02 mm per lo spessore corticale, meno dello 0,5% per la porosità corticale e meno di 20 m∙s-1 per le due velocità, indicando che le posizioni della sonda di portata erano stabili. Si può poi osservare che i valori medi ottenuti per ogni serie sono molto vicini, in particolare per i valori di spessore compresi tra 3,4 mm e 3,5 mm e per i valori di vFAS compresi tra 4040 m∙s-1 e 4070 m∙s-1. Si noti che una differenza di 40 m∙s-1 corrisponde a una differenza dell'1% per un valore medio di 4000 m∙s-1. Variazioni maggiori sono osservate per la porosità corticale, che varia dall'8% al 12%, e per la velocità vA0, che varia da 1700 m∙s-1 a 1740 m∙s-1. In questo caso coerente, quasi tutte le acquisizioni sono coerenti, cioè vicine l'una all'altra. Non c'è quasi nessuna ambiguità nel risultato finale dei quattro parametri di interesse.
Un secondo caso è illustrato nella Figura 6 per un caso meno regolare. In questo caso, tre parametri, vFAS, vA0 e Ct.Po sono molto stabili, con valori rispettivamente di circa 4120 m∙s-1, 1700 m∙s-1 e 10%. Il caso dello spessore corticale è più difficile in quanto si osservano due soluzioni ambigue, 2,6 mm e 3,5 mm, in accordo con un piccolo valore di differenza (diff inferiore allo 0,5%) tra i due primi massimi della funzione inversa del problema. Nel precedente caso regolare, questa differenza variava dall'1% al 3%. L'ambiguità viene rimossa da un'analisi esperta, in questo caso, osservando l'accordo tra modalità guidate sperimentali e teoriche (colonna di destra). Nel caso dello spessore più basso, l'accordo è migliore nella parte più bassa dello spettro (due prime serie). Per le ultime due serie, c'è un modo teorico con pochissimi punti sperimentali, intorno a 0,5 MHz, che indica una concordanza più scarsa rispetto alla serie precedente. Inoltre, il parametro diff (0,1%) è inferiore ai valori delle prime due serie (0,4% e 0,2%). In questo caso, la scelta della soluzione mantenuta (2,6 mm) non è ancora automatizzata ed è ancora necessario un esperto. Tuttavia, i tre operatori hanno affrontato problemi simili e hanno scelto soluzioni simili, vicine ai 2,6 mm.
Affidabilità extra per l'operatore
Tutti i risultati per i 4 parametri di interesse ottenuti dai 3 operatori con i 14 partecipanti sono mostrati in Figura 7. I coefficienti di correlazione intraclasse (ICC) sono stati calcolati seguendo la formula e il codice Matlab precedentemente pubblicato 37,38,39. L'ICC è comunemente utilizzato per la valutazione dell'affidabilità delle scale di misurazione, in particolare per applicazioni biomediche. I valori ICC compresi tra 0,75 e 0,9 sono generalmente associati a una buona affidabilità, mentre i valori ICC superiori a 0,9 sono considerati un'eccellente affidabilità. Il valore più basso per ICC (0,76) è stato ottenuto per il parametro vA0. La deviazione standard era pari a 17 m∙s-1, che è circa il 7% dell'intervallo di misura dell'ordine di 250 m∙s-1. Valori simili sono stati osservati per Ct.Po con ICC pari a 0,80, e una deviazione standard dell'1,1%, circa il 10% dell'intervallo. Un'ottima affidabilità (ICC circa 0,9) è stata ottenuta per gli altri due parametri, Ct.Th e Ct.Po, con una deviazione standard inferiore al 10% del range.

Figura 1: diverse parti del dispositivo a ultrasuoni a trasmissione assiale bidirezionale (BDAT). Il prototipo include l'isolamento elettronico (1), un interruttore a pedale (2), due sonde (3.1 e 3.2), un modulo elettronico (4), un computer (5) e un righello (6). Clicca qui per visualizzare una versione più grande di questa figura.
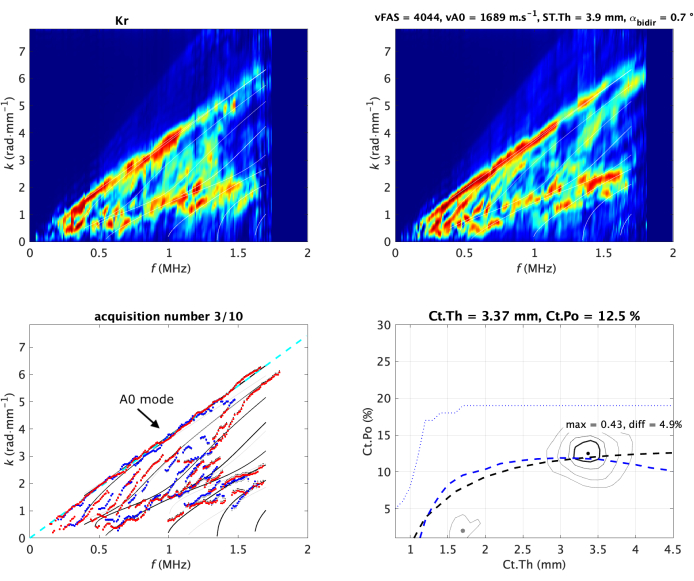
Figura 2: Acquisizione tipica su avambraccio in vivo. Le due funzioni Norm (una per direzione di propagazione) sono mostrate nella riga superiore dell'immagine. Sono anche indicati come immagini dello spettro delle onde guidate (GWSI). Dai massimi di queste immagini, è possibile estrarre le modalità guidate sperimentali (punti blu e rossi) confrontate con il modello più adatto (sotto-immagine in basso a sinistra). Il modello più adatto è parametrizzato da due valori, spessore corticale (Ct.Th) e porosità (Ct.Po), corrispondenti alla posizione massima della funzione inversa del problema (sottoimmagine in basso a destra). I loro valori sono mostrati nel titolo di ogni pannello. Il raccordo vA0 viene visualizzato come una linea tratteggiata (a sinistra). Le immagini dello spettro d'onda guidato e l'immagine del problema inverso sono normalizzate (cioè, il valore dei pixel varia da 0 a 1) dalla costruzione19,20. I valori delle due velocità misurate, vFAS e vA0, sono indicati nel titolo dell'immagine secondaria in alto a destra. Clicca qui per visualizzare una versione più grande di questa figura.
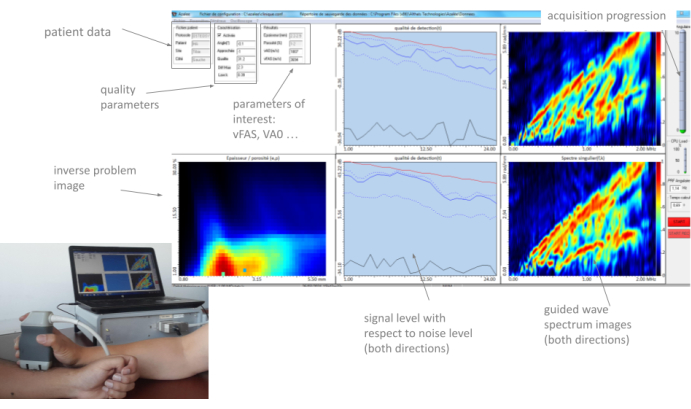
Figura 3: Interfaccia uomo-macchina (HMI). L'HMI mostra in reale i due GWSI (uno per direzione di propagazione), l'immagine inversa del problema, i parametri di interesse e i parametri di qualità. Clicca qui per visualizzare una versione più grande di questa figura.
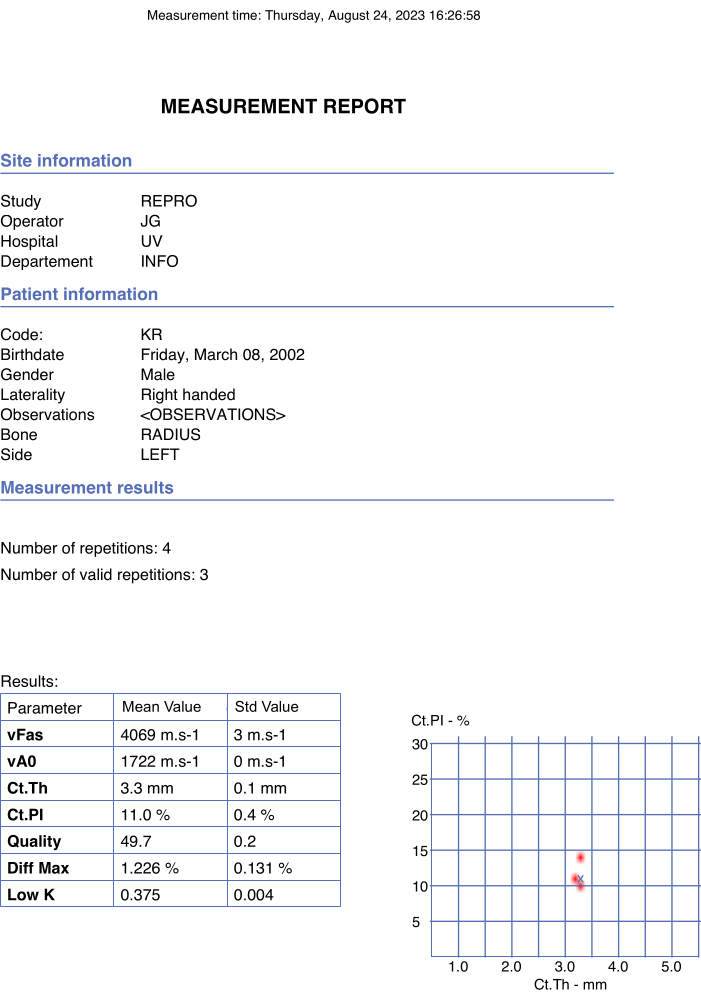
Figura 4: Esempio di report automatizzato. Il report riportava i dati del partecipante e dell'operatore nonché i valori finali dei parametri di interesse e dei parametri di qualità. Clicca qui per visualizzare una versione più grande di questa figura.
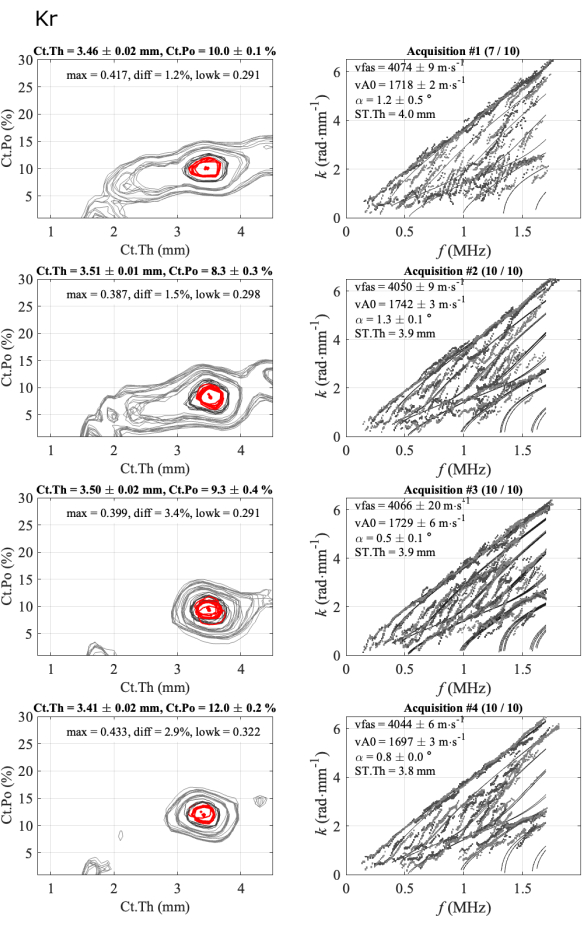
Figura 5: Esempio del secondo report per un caso coerente, uguale al report automatizzato mostrato nella Figura 4. La figura mostra 4 serie di 1 partecipante e 1 operatore: immagini di problemi inversi (colonna di sinistra) e numeri d'onda sperimentali confrontati con il modello più adatto (colonna di destra). I valori indicati corrispondono alla media e alla deviazione standard delle acquisizioni mantenute nella serie di 10 acquisizioni. Il numero di acquisizioni mantenute è indicato nel titolo della colonna di destra, ad esempio (7/10) per la prima serie. Clicca qui per visualizzare una versione più grande di questa figura.
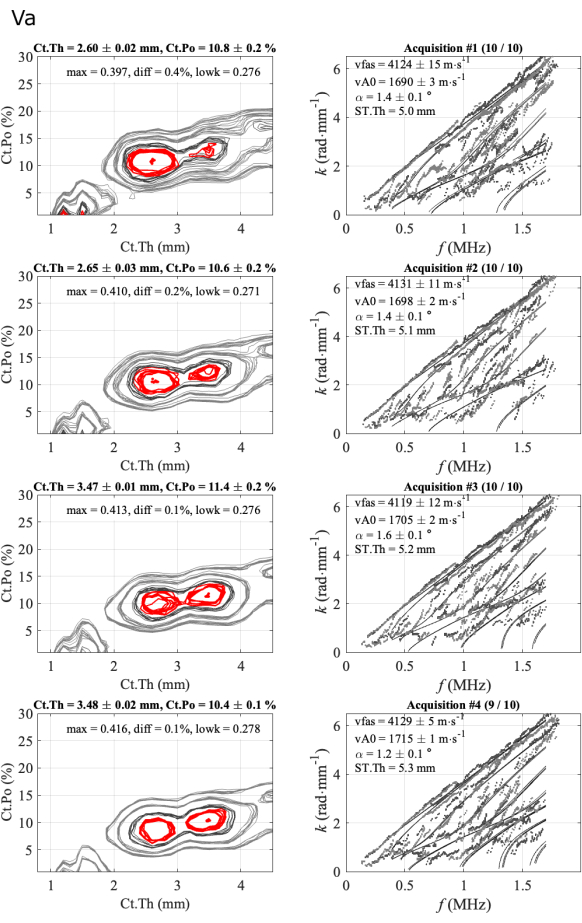
Figura 6: Esempio del secondo rapporto per un caso ambiguo per lo spessore corticale. La figura mostra 4 serie di 1 partecipante e 1 operatore: immagini di problemi inversi (colonna di sinistra) e numeri d'onda sperimentali confrontati con il modello più adatto (colonna di destra). I valori indicati corrispondono alla media e alla deviazione standard rispetto alle acquisizioni mantenute nella serie di 10 acquisizioni. Il numero di acquisizioni mantenute è indicato nel titolo della colonna di destra, ad esempio (10/10) per la prima serie. Clicca qui per visualizzare una versione più grande di questa figura.
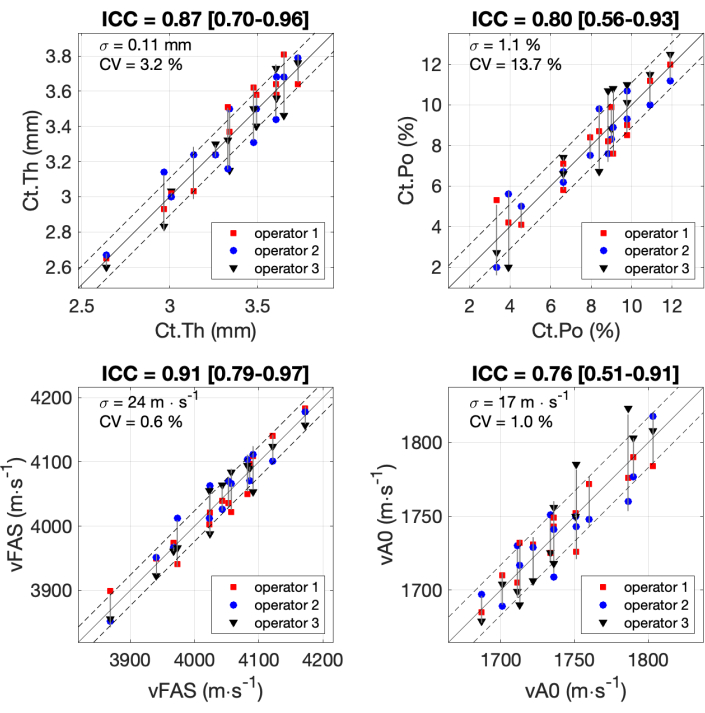
Figura 7: Affidabilità tra operatori. Vengono mostrati i risultati per i 4 parametri di interesse ottenuti dai 3 operatori con 14 partecipanti. I valori ottenuti dai 3 operatori (asse y) vengono confrontati con il valore medio dei 3 operatori (asse x). I coefficienti di correlazione intraclasse (ICC) sono indicati nei titoli. Sono indicati anche il σ di deviazione standard e il coefficiente di variazione CV. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il punto critico per il successo della misura è il corretto posizionamento della sonda rispetto all'osso. La posizione rispetto alla superficie ossea è stata risolta con successo integrando con l'interfaccia di guida la correzione bidirezionale16,17. È stato dimostrato che senza questa correzione, si può raggiungere un errore di qualche percentuale per i parametri vFAS16. Questa correzione è risultata fondamentale per discriminare accuratamente tra i pazienti poiché l'intero intervallo di misurazione (circa 3800-4200 m∙s-1) è circa il 10% del valore medio17, circa 4000 m∙s-1. La riproducibilità riscontrata in questo studio (deviazione standard di 24 m∙s-1) era simile allo studio precedente17, indicando una deviazione standard di 20 m∙s-1 e un coefficiente di variazione (CV) di circa lo 0,5%. Un coefficiente di variazione simile (0,5 %) è stato trovato a una frequenza inferiore, cioè 0,3 MHz40. Si noti che l'eccellente affidabilità del parametro vFAS (ICC = 0,91) è risultata superiore a quella recentemente ottenuta con un altro dispositivo AT in una popolazione più anziana (ICC = 0,77)41. Va notato che la popolazione in questo caso non era solo anziana ma anche tutta di sesso femminile e alcuni soggetti con altri segni clinici di aumentata porosità ossea41.
La seconda sfida è anche quella di posizionare correttamente la sonda rispetto all'asse osseo e alle due interfacce per ottenere i modi guidati, in particolare quelli ad alta velocità di fase o a basso numero d'onda. Queste modalità sono vicine alla risonanza e associate a percorsi di riflessione multipli. Se l'allineamento non è corretto, le onde verranno disperse al di fuori dell'intervallo di misurazione spaziale della sonda. Al contrario, se la sonda è posizionata correttamente, queste modalità di velocità ad alta fase appariranno come rami continui nel ROI3. Per la prima versione dell'attuale HMI, questo allineamento è stato risolto osservando il GWSI20 in tempo reale. Tuttavia, questo approccio è risultato insufficiente per raggiungere una misurazione robusta: il tasso di fallimento è risultato essere di circa il 20% nello studio clinico pilota20. L'inclusione di parametri di qualità in tempo reale consente di ridurre il fallimento a circa il 10% in un secondo studio clinico23. Quindi, l'inclusione dell'immagine del problema inverso nell'HMI "in tempo reale" consente un ulteriore miglioramento, con un tasso di guasto della corrente per la misurazione del raggio di circa il 5%25. Si noti che l'errore iniziale con il primo dispositivo che misurava solo vFAS è risultato essere di circa il 15%17.
L'affidabilità sullo spessore corticale è risultata simile a uno studio precedente22. Con una versione precedente dello stesso prototipo, anche l'ICC è risultato essere vicino a 0,9, con una deviazione standard di circa 0,1 mm e un CV di circa il 3%. Tuttavia, si osserva un netto miglioramento della porosità corticale: l'ICC è aumentato da 0,622 a 0,8 e la deviazione standard è diminuita dall'1,5% all'1%. Il parametro più difficile è vA0 a causa della vicinanza della sua velocità con la velocità dei tessuti molli, circa 1500 m∙s-1. Se la sonda è allineata correttamente, la modalità A0 appare unica e continua. Al contrario, appare discontinua e/o multipla a causa dell'accoppiamento con i tessuti molli circostanti. Questo effetto è particolarmente forte per le persone con spessore dei tessuti molli piccolo (inferiore a 4 mm) o grande (superiore a 10 mm) (indicato con ST.Th).
Come esposto in precedenza, il punto chiave è trovare la posizione corretta della sonda. Tuttavia, la posizione dovrebbe essere non solo corretta ma anche stabile per eseguire la media e la deviazione standard per una serie di 10 acquisizioni. Nella maggior parte dei casi, trovare una stalla richiede meno di 1 minuto e la misurazione completa di un paziente durerebbe circa 5 minuti. Anche se il protocollo standard descritto in questo studio è adatto per la maggior parte dei pazienti, alcune persone sono più difficili da misurare; È difficile ma possibile trovare le posizioni corrette, ma quasi impossibile trovarne una stabile. In questo caso, l'operatore può scegliere di registrare serie più lunghe, fino a 200 acquisizioni. Le migliori acquisizioni vengono successivamente determinate offline utilizzando parametri di qualità. Questo filtro dovrebbe essere applicato in tempo reale in futuro. In pratica, l'operatore registra più serie e/o acquisizioni rispetto alle 4 serie di 10 acquisizioni del protocollo di condizione ideale. Tuttavia, il tempo di misurazione abituale rimane di circa 5 minuti per un sito, avambraccio o gamba. Se, dopo alcuni minuti, l'HMI non rileva alcuna posizione corretta, la misurazione si interrompe e viene considerata un guasto. Con il dispositivo e il protocollo correnti, il tasso di errore è stato riscontrato essere inferiore al 5%25.
Il dispositivo attuale deve affrontare diverse limitazioni:
(i)Dimensioni e peso: L'attuale dispositivo BDAT è portatile: entra in un bagaglio standard e pesa circa 25 kg. Tuttavia, questo peso è elevato rispetto ai più recenti dispositivi a ultrasuoni. Si può prendere in considerazione un nuovo design elettronico, con la sonda e l'elaborazione del segnale che rimangono invariati. Tuttavia, è possibile spostare il dispositivo attuale, in particolare per i pazienti a letto o a casa con mobilità limitata.
(ii)Velocità di acquisizione: il frame rate attuale è di circa 2-4 Hz, il che significa che l'esplorazione della misura è lenta rispetto all'effettiva acquisizione in tempo reale, ovvero superiore a 25 Hz. Questo potrebbe essere migliorato in futuro, tenendo conto di computer più veloci, analisi dei dati più veloci e trasmissione tra l'elettronica e il computer. Un aumento della velocità di acquisizione migliorerebbe la facilità d'uso della misura, in particolare la ricerca del corretto posizionamento della sonda.
iii)Spessore dei tessuti molli: l'approccio attuale è limitato da un ampio strato di tessuto molle, tipicamente superiore a 10 mm. In questo caso, il primo segnale in arrivo è legato al percorso dei tessuti molli e non all'osso corticale. Pertanto, non è possibile utilizzare vFAS e l'angolo bidirezionale associato. Allo stesso modo, vA0 è molto difficile da misurare per grandi strati di tessuti molli. Senza queste due velocità, il problema inverso non può essere eseguito. In futuro, altri metodi di correzione bidirezionale potrebbero essere applicati utilizzando ad esempio tecniche di imaging. I pazienti con grandi strati di tessuti molli sono solitamente associati all'obesità e all'indice di massa corporea (BMI) superiore a 30 kg.m-2.
iv)Regolarità della guida d'onda: l'approccio del problema inverso presuppone una guida d'onda regolare con percorsi di propagazione multipli. Per i pazienti osteoporotici, l'interfaccia corticale interna può essere irregolare e, quindi, implica immagini dello spettro delle onde guidate scadenti, in particolare nella parte inferiore. Questi pazienti sono solitamente associati a un'elevata ambiguità della soluzione. Se il tessuto molle o il cattivo posizionamento non possono essere considerati l'origine di un'immagine dello spettro scadente e se il valore del parametro lowk è basso, la guida d'onda è presumibilmente irregolare e viene considerata la soluzione di spessore più basso. Possono essere utilizzati anche approcci basati sull'apprendimento automatico, che non necessitano di modellazione fisica29.
Come discusso nell'introduzione, l'attuale gold standard per l'individuazione dei pazienti a rischio di frattura da fragilità è la DXA, che deve affrontare alcune limitazioni: le sue grandi dimensioni, la scarsa disponibilità in alcune regioni, il costo relativamente elevato e l'efficacia relativamente moderata. Le prime limitazioni potrebbero essere mitigate con i dispositivi a ultrasuoni, noti per la loro attraente portabilità e i loro costi. Tuttavia, la capacità di rilevare efficacemente i pazienti a rischio dovrebbe essere almeno equivalente alla DXA. In realtà, a volte ci si aspetta che sia superiore al DXA per giustificare l'adattamento della maggior parte dei riferimenti (decisioni mediche, trattamenti, costi, stanze, ecc.) legati al gold standard. Questo è il motivo per cui alcuni dispositivi ad ultrasuoni propongono surrogati aBMD 10,11,42. Tuttavia, uno svantaggio dei parametri clinici, come l'aBMD e anche il vFAS, è l'integrazione di diverse proprietà dell'osso corticale. Ecco perché punti di vista complementari sono proposti da altri dispositivi a ultrasuoni, tra cui BDAT, che propongono parametri che possono essere più facilmente interpretati dal medico e dal paziente, come la porosità corticale, lo spessore o la distribuzione delle dimensioni dei pori9. Questi parametri riflettono le proprietà geometriche e dei materiali: l'osso corticale può essere potenzialmente valutato in termini di variazioni indipendenti di quantità o qualità. Questo punto di vista potrebbe essere molto utile per esplorare diverse possibili cause di fragilità ossea. Ad esempio, si suppone che le fratture da fragilità intra o extra-capsulare dell'anca, cioè le sedi di frattura del collo del femore o del trocantere, abbiano origini mediche diverse43. Allo stesso modo, potrebbe essere possibile seguire diversi farmaci mirati a diversi effetti sull'osso corticale, nonché in termini di quantità o qualità3.
Si noti che la precisione ottenuta con BDAT per lo spessore corticale (0,1 mm) è migliore rispetto ad altri metodi ultrasonici, solitamente superiori a 0,25 mm44. Questa differenza è in parte dovuta al fatto che il problema inverso del BDAT tiene conto delle variazioni geometriche e dei materiali combinate. Alcuni altri approcci, come l'eco a impulsi, considerano le proprietà uniche del materiale osseo per tutti i pazienti10,44. Questo valore di precisione, circa 0,1 mm (CV circa 3%), è infatti fondamentale per discriminare con precisione tra i pazienti poiché l'intervallo di spessore è inferiore a 2 mm. La precisione sulla porosità corticale (1%, CV circa il 14%) non è ancora buona come per lo spessore. Tuttavia, sono già stati osservati miglioramenti significativi rispetto al precedente studio di riproducibilità22. Ci si può aspettare che miglioramenti simili possano essere raggiunti nel prossimo futuro grazie ai futuri miglioramenti dell'HMI, in particolare in termini di frame rate più vicini al tempo reale.
Il BDAT potrebbe essere utilizzato su larga scala per lo screening della popolazione in regioni in cui la DXA non è ampiamente disponibile. Inoltre, gli ultimi risultati clinici hanno mostrato il potenziale che il BDAT potrebbe essere ancora più efficiente del DXA. Tuttavia, questi risultati dovrebbero essere confermati includendo più pazienti. La prossima sfida dovrebbe essere rappresentata dagli studi multicentrici e/o longitudinali11,12. Tuttavia, il dispositivo BDAT è ancora un prototipo disponibile per la collaborazione scientifica, poiché è già stato fatto in Germania23 e nel Regno Unito24. Sono necessari sforzi verso l'industrializzazione della prossima generazione di dispositivi BDAT, che sarebbero sicuramente più veloci e portatili.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Questo studio è stato finanziato dai progetti cileni ANID / Fondecyt / Regular 1201311 e 1241091. Gli autori desiderano ringraziare l'azienda BleuSolid per il suo supporto durante gli ultimi miglioramenti dell'HMI e Geropolis per la sala riprese.
Materiali
| Name | Company | Catalog Number | Comments |
| Computer | Notebook HP | mod Zbook (16 Go RAM, Inrel Core i7) | to receive the sampled signals and applying the signal processing steps. Results are displayed in quasi real time (up to 4 per second) through a dedicated Human Machine Interface (HMI, BleuSolid, Pomponne, France) allowing the measurement guidance; |
| Electric insulation transformer | REOMED, Solingen, Germany | IEC / EN 60601-1 | to protect the device, the patient and other devices from any electric hazard |
| Electronic module | Althaïs, Tours, France | in-house | send excitation signals (half a period of negative voltage of 170 V) and discretize received signals (1024 time points per receiver at 20 MHz sampling frequency and 12 bit dynamic) before sending them to the computer. Delays and amplification can be adapted using linear laws in order to optimize data sampling within the accessible ranges. |
| Human Machine Interface | BleuSolid, Pomponne, France | N/A | HMI |
| Pedal switch | Scythe, Germany | USB Foot Switch 2 | to start an acquisition series |
| Ruler | Westcott, USA | 10417 | to locate the measurement site |
| Ultrasonic probe radius | Vermon, Tours, France | in-house | 1 MHz central frequency, 24 receivers with 0.8 mm pitch and two blocks of 5 transmitters with 1 mm pitch. |
| Ultrasonic probe tibia | Vermon, Tours, France | in-house | 0.5 MHz central frequency, 24 receivers with 1.2 mm pitch and two block of 5 transmitters with 1.5 mm pitch |
| Ultrasonic probes | designed according to the bidirectional geometry: a single receiver array surrounded by two transmitter arrays. The three arrays are aligned, mechanically and electrically isolated in order to minimize coupling signals. The probes are adapted to two different sites, one third distal radius and mid tibia. |
Riferimenti
- Curtis, E. M., Moon, R. J., Harvey, N. C., Cooper, C. Reprint of: the impact of fragility fracture and approaches to osteoporosis risk assessment worldwide. Int J Orthop Trauma Nurs. 26, 7-17 (2017).
- Sing, C. W., et al. Global epidemiology of hip fractures: secular trends in incidence rate, post-fracture treatment, and all-cause mortality. J Bone Miner Res. 38 (8), 1064-1075 (2023).
- Choksi, P., Jepsen, K. J., Clines, G. A. The challenges of diagnosing osteoporosis and the limitations of currently available tools. Clin Diabetes Endocrinol. 4, 1-13 (2018).
- El Maghraoui, A., Roux, C. DXA scanning in clinical practice. QJM. 101 (8), 605-617 (2008).
- Maeda, S. S., et al. Challenges and opportunities for quality densitometry in Latin America. Arch Osteoporos. 16, 1-11 (2021).
- Surowiec, R. K., Does, M. D., Nyman, J. S. In vivo assessment of bone quality without x-rays. Curr Osteoporos Rep. 22 (1), 56-68 (2024).
- Whittier, D. E., et al. A fracture risk assessment tool for high resolution peripheral quantitative computed tomography. J Bone Miner Res. 38 (9), 1234-1244 (2023).
- Nyman, J. S., et al. Toward the use of MRI measurements of bound and pore water in fracture risk assessment. Bone. 176, 116863 (2023).
- Armbrecht, G., Nguyen Minh, H., Massmann, J., Raum, K. Pore size distribution and frequency-dependent attenuation in human cortical tibia bone discriminate fragility fractures in postmenopausal women with low bone mineral density. J Bone Miner Res Plus. 5 (11), e10536 (2021).
- Behrens, M., et al. The Bindex® ultrasound device: reliability of cortical bone thickness measures and their relationship to regional bone mineral density. Physiol Meas. 37 (9), 1528-1540 (2016).
- Cortet, B., et al. Radiofrequency echographic multi-spectrometry (REMS) for the diagnosis of osteoporosis in a European multicenter clinical context. Bone. 143, 115786 (2021).
- Olszynski, W. P., et al. Multisite quantitative ultrasound for the prediction of fractures over 5 years of follow-up the Canadian Multicentre Osteoporosis Study. J Bone Miner Res. 28 (9), 2027-2034 (2013).
- Hans, D., Métrailler, A., Gonzalez Rodriguez, E., Lamy, O., Shevroja, E. Quantitative ultrasound (QUS) in the management of osteoporosis and assessment of fracture risk: an update. Adv Exp Med Biol. 1364, 7-34 (2022).
- Weiss, M., Ben-Shlomo, A., Hagag, P., Ish-Shalom, S. Discrimination of proximal hip fracture by quantitative ultrasound measurement at the radius. Osteoporos Int. 11 (5), 411-416 (2000).
- Moilanen, P., et al. Discrimination of fractures by low-frequency axial transmission ultrasound in postmenopausal females. Osteoporos Int. 24, 723-730 (2013).
- Bossy, E., Talmant, M., Defontaine, M., Patat, F., Laugier, P. Bidirectional axial transmission can improve accuracy and precision of ultrasonic velocity measurement in cortical bone: a validation on test materials. IEEE Trans Ultrason Ferroelectr Freq Control. 51 (1), 71-79 (2004).
- Talmant, M., et al. In vivo performance evaluation of bi-directional ultrasonic axial transmission for cortical bone assessment. Ultrasound Med Biol. 35 (6), 912-919 (2009).
- Mitra, M., Gopalakrishnan, S. Guided wave based structural health monitoring: A review. Smart Mater Struct. 25, 053001 (2016).
- Minonzio, J. G., Talmant, M., Laugier, P. Guided wave phase velocity measurement using multi-emitter and multi-receiver arrays in the axial transmission configuration. J Acoust Soc Am. 127 (5), 2913-2919 (2010).
- Minonzio, J. G., et al. cortical thickness and porosity assessment using ultrasound guided waves: An ex vivo validation. Bone. 116, 111-119 (2018).
- Vallet, Q., Bochud, N., Chappard, C., Laugier, P., Minonzio, J. G. In vivo characterization of cortical bone using guided waves measured by axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 63 (9), 1361-1371 (2016).
- Minonzio, J. G., et al. Ultrasound-based estimates of cortical bone thickness and porosity are associated with nontraumatic fractures in postmenopausal women: a pilot study. J Bone Miner Res. 34 (9), 1585-1596 (2019).
- Minonzio, J. G., et al. Bi-directional axial transmission measurements applied in a clinical environment. PLoS One. 17 (12), e0277831 (2022).
- Behforootan, S., et al. Can guided wave ultrasound predict bone mechanical properties at the femoral neck in patients undergoing hip arthroplasty. J Mech Behav Biomed Mater. 136, 105468 (2022).
- Rojo, F., et al. . Classification of hip fragility fractures in older adults using an ultrasonic device. , (2023).
- Ishimoto, T., et al. Quantitative ultrasound (QUS) axial transmission method reflects anisotropy in micro-arrangement of apatite crystallites in human long bones: A study with 3-MHz-frequency ultrasound. Bone. 127, 82-90 (2019).
- Minonzio, J. G., Foiret, J., Talmant, M., Laugier, P. Impact of attenuation on guided mode wavenumber measurement in axial transmission on bone mimicking plates. J Acoust Soc Am. 130 (6), 3574-3582 (2011).
- Moreau, L., Minonzio, J. G., Talmant, M., Laugier, P. Measuring the wavenumber of guided modes in waveguides with linearly varying thickness. J Acoust Soc Am. 135 (5), 2614-2624 (2014).
- Miranda, D., Olivares, R., Munoz, R., Minonzio, J. G. Improvement of patient classification using feature selection applied to bidirectional axial transmission. IEEE Trans Ultrason Ferroelectr Freq Control. 69 (9), 2663-2671 (2022).
- Foiret, J., Minonzio, J. G., Chappard, C., Talmant, M., Laugier, P. Combined estimation of thickness and velocities using ultrasound guided waves: A pioneering study on in vitro cortical bone samples. IEEE Trans Ultrason Ferroelectr Freq Control. 61 (9), 1478-1488 (2014).
- Granke, M., et al. Change in porosity is the major determinant of the variation of cortical bone elasticity at the millimeter scale in aged women. Bone. 49 (5), 1020-1026 (2011).
- Bochud, N., Vallet, Q., Minonzio, J. G., Laugier, P. Predicting bone strength with ultrasonic guided waves. Sci Rep. 7 (1), 43628 (2017).
- Schneider, J., et al. Ex vivo cortical porosity and thickness predictions at the tibia using full-spectrum ultrasonic guided-wave analysis. Arch Osteoporos. 14, 1-11 (2019).
- Ramiandrisoa, D., Fernandez, S., Chappard, C., Cohen-Solal, M., Minonzio, J. G. . In vivo estimation of cortical thickness and porosity by axial transmission: Comparison with high resolution computed tomography. , (2018).
- Schneider, J., et al. In vivo measurements of cortical thickness and porosity at the proximal third of the tibia using guided waves: Comparison with site-matched peripheral quantitative computed tomography and distal high-resolution peripheral quantitative computed tomography. Ultrasound Med Biol. 45 (5), 1234-1242 (2019).
- Araya, C., et al. Real time waveguide parameter estimation using sparse multimode disperse radon transform. IEEE UFFC Latin America Ultrasonics Symposium (LAUS. , (2021).
- Bobak, C. A., Barr, P. J., O'Malley, A. J. Estimation of an inter-rater intra-class correlation coefficient that overcomes common assumption violations in the assessment of health measurement scales. BMC Med Res Methodol. 18 (1), 93 (2018).
- Shrout, P. E., Fleiss, J. L. Intraclass correlations: uses in assessing rater reliability. Psychol Bull. 86 (2), 420 (1979).
- . Intraclass correlation coefficient with confidence intervals Available from: https://www.mathworks.com/matlabcentral/fileexchange/26885-intraclass-correlation-coefficient-with-confidence-intervals (2010)
- Kilappa, V., et al. Low-frequency axial ultrasound velocity correlates with bone mineral density and cortical thickness in the radius and tibia in pre- and postmenopausal women. Osteoporos Int. 22, 1103-1113 (2011).
- Watson, C. J., de Ruig, M. J., Saunders, K. T. Intrarater and interrater reliability of quantitative ultrasound speed of sound by trained raters at the distal radius in postmenopausal women. J Geriatr Phys Ther. 47 (4), E159-E166 (2024).
- Stein, E. M., et al. Clinical assessment of the 1/3 radius using a new desktop ultrasonic bone densitometer. Ultrasound Med Biol. 39 (3), 388-395 (2013).
- Dinamarca-Montecinos, J. L., Prados-Olleta, N., Rubio-Herrera, R., Del Pino, A. C. S., Carrasco-Buvinic, A. Intra-and extracapsular hip fractures in the elderly: Two different pathologies. Rev Esp Cir Ortop Traumatol. 59 (4), 227-237 (2015).
- Karjalainen, J., Riekkinen, O., Toyras, J., Kroger, H., Jurvelin, J. Ultrasonic assessment of cortical bone thickness in vitro and in vivo. IEEE Trans Ultrason Ferroelectr Freq Control. 55 (10), 2191-2197 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon