Method Article
Un test in vitro per studiare la migrazione piastrinica utilizzando tethers avidina-biotina funzionalizzati con RGD
In questo articolo
Riepilogo
Viene fornito un protocollo dettagliato per l'imaging di singole piastrine in migrazione utilizzando cavi avidina-biotina funzionalizzati con RGD con densità regolabile, rivelando che le piastrine generano una forza sufficiente per rompere il legame avidina-biotina.
Abstract
Nonostante siano frammenti di cellule anucleate, le piastrine sono ora ampiamente riconosciute per le loro molteplici capacità. Non solo formano coaguli di sangue per prevenire il sanguinamento dopo un infortunio, ma combattono anche le infezioni e mantengono l'integrità vascolare durante le malattie infiammatorie. Mentre i tappi emostatici richiedono l'attivazione collettiva e l'aggregazione delle piastrine, il loro ruolo nella protezione dei vasi sanguigni infiammati viene svolto a livello di singola cellula. In questo contesto, dati recenti hanno dimostrato che le piastrine possono migrare autonomamente, un processo che dipende dal meccanorilevamento del loro ambiente adesivo. Qui, viene presentato un protocollo dettagliato per l'imaging della migrazione di singole piastrine, utilizzando un sistema di rivestimento a tre strati costituito da una spina dorsale di poli-L-lisina innesto di poli(glicole etilenico) (PLL-PEG)-biotina (1), un linker avidina fluorescente (2) e biotina-ciclica Arg-Gly-Asp (cRGD) (3) come motivo di legame delle integrine piastriniche. Questo approccio riduzionista consente un controllo preciso delle proprietà di adesione del substrato e funge da semplice test in vitro standardizzato per studiare i meccanismi alla base della migrazione piastrinica. I risultati indicano che le piastrine che migrano legandosi al cRGD esercitano forze in grado di interrompere il legame avidina-biotina. Inoltre, la densità della biotina-cRGD influenza significativamente sia la diffusione che la migrazione piastrinica.
Introduzione
Le piastrine sono piccoli frammenti di cellule anucleate derivate dai megacariociti nel midollo osseo. Le piastrine attivate si assemblano in aggregati che costituiscono la base di un coagulo di sangue per sigillare le lesioni vascolari nell'emostasi fisiologica o per occludere i vasi sanguigni malati nella trombosi patologica1. Negli ultimi decenni, tuttavia, è diventato chiaro che le piastrine svolgono anche un ruolo centrale nella fisiopatologia dell'infiammazione, dell'infezione e della malignità, dove le interazioni multiformi con le cellule immunitarie, le cellule tumorali e i patogeni invasori sono fondamentali per modellare la risposta immunitaria dell'ospite 2,3. Dati recenti hanno dimostrato che le piastrine hanno la capacità di migrare autonomamente4. In risposta alla batteriemia sistemica, le piastrine vengono reclutate nei sinusoidi del fegato, dove aderiscono e migrano. La migrazione consente alle piastrine di catturare e legare i batteri, che a loro volta supportano l'attivazione dei leucociti. In particolare, le piastrine rimangono intravascolari durante questo processo e non migrano verso il tessuto sub-endoteliale4. Inoltre, le piastrine sono sentinelle dell'infiammazione vascolare, scansionano i vasi sanguigni infiammati alla ricerca di microlesioni causate dalla stravasazione delle cellule immunitarie5 e impiegano la migrazione per salvaguardare i vasi sanguigni infiammati 6,7. Qui, le piastrine usano le loro integrine per legare il fibrinogeno depositato sull'endotelio infiammato. Le piastrine formano quindi sporgenze lamellipodiali che consentono loro di scansionare le proprietà adesive del loro ambiente. Le piastrine quindi si polarizzano e migrano verso densità più elevate di fibrinogeno, un processo noto come aptotassi. La migrazione diretta delle piastrine supporta infine il posizionamento in corrispondenza delle microlesioni endoteliali che prevengono il sanguinamento nei tessuti infiammati, inclusi muscoli e polmoni.
La migrazione piastrinica dipende in modo critico dalle proprietà meccaniche del substrato adesivo 4,8. Il compito di rilevare e trasdurre le proprietà meccaniche dell'ambiente è principalmente mediato dai recettori delle integrine, che sono proteine eterodimeriche transmembrana composte da una subunità α- e β con il dominio extracellulare che si lega al ligando sulla matrice extracellulare e il dominio intracellulare che si lega al citoscheletro di actina tramite proteine adattatrici 9,10. L'integrina piastrinica più abbondante è αIIbβ3 e il suo principale ligando è la fibrina(ogen)11. L'impegno integrina-ligando innesca eventi di segnalazione che culminano nella formazione di un lamellipodio guidato da Arp2/3 che forma il bordo d'attacco di unapiastrina 7 aderente. Le piastrine aderenti sondano istantaneamente le proprietà meccaniche del loro ambiente adesivo tirandole4. Quando le forze di trazione dipendenti dalla miosina IIa superano la stabilità meccanica della matrice extracellulare (ad esempio, fibrina(ogen)), le piastrine rompono meccanicamente i ligandi indeboliti e utilizzano le loro sporgenze lamellipodiali per scansionare il microambiente alla ricerca di ligandi adesivi, stabilire nuovi legami di substrato e migrare lontano dall'ambiente impoverito dal ligando6. È probabile che la migrazione cellulare guidata dalla deplezione meccanica del ligando non proteolitica svolga un ruolo che va oltre la funzione piastrinica, poiché sembra essere un fenomeno generale osservato nelle cellule in grado di rimodellare meccanicamente la loro matrice adesiva8. La velocità di deplezione del ligando determina la velocità di migrazione e dipende sia dalla stabilità del ligando che dalla densità del ligando del substrato8. Le piastrine a bassa densità di ligandi sono in grado di distruggere meccanicamente i ligandi delle integrine ingegnerizzati (ciclico Arg-Gly-Asp (cRGD))6,7 legati a vetrini coprioggetti con legami di biotina-avidina aventi una forza di delegante di circa 160 piconewton (pN)12,13,14,15.
Qui, queste osservazioni vengono sfruttate per sviluppare un semplice protocollo in vitro per la generazione di superfici adesive ligando-labili, facilitando lo studio dei meccanismi di migrazione piastrinica. Il rivestimento adesivo descritto in questo protocollo è costituito da tre elementi essenziali: (1) una spina dorsale PLL-PEG-biotina e (2) un linker neutravidina-fluoresceina isotiocianato (NA-FITC) che facilita il legame di (3) biotina-cRGD (un ligando adesivo) alla spina dorsale PLL-PEG-biotina (vedi anche Figura 1B). La stabilità di questo costrutto dipende dalla forza del legame biotina-avidina, che può rompersi all'interfaccia (A) PLL-PEG-biotina-NA-FITC o (B) FITC-NA-biotina-cRGD. Inoltre, la densità dei ligandi adesivi può essere regolata adattando il rapporto tra PLL-PEG-biotina e PLL-PEG nello strato inferiore. L'interruzione del legame (A) provoca il rilascio di FITC dal rivestimento, portando a una diminuzione del segnale di fluorescenza sotto le piastrine in migrazione. Insieme, il rivestimento descritto in questo protocollo, quindi, consente una precisa sintonizzabilità delle proprietà meccaniche e adesive del substrato e fornisce una facile lettura della migrazione piastrinica basata sulla fluorescenza.
Protocollo
Gli esperimenti sugli animali condotti in questo studio sono stati eseguiti in conformità con tutte le norme etiche pertinenti per gli studi che coinvolgono i topi e sono stati approvati dalla legislazione locale sulla protezione degli animali (Regierung von Oberbayern, Monaco, 190-15, 2015). In questo studio sono stati utilizzati topi C57BL/6 femmine e maschi, di 8-10 settimane (peso corporeo 20-25 g). I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Rivestimento cRGD di biotina-neutravidina-biotina
- Sonicare i vetrini coprioggetti in vetro (24 mm x 24 mm; # 1,5) entro il 20% di HNO3 per 1 minuto, seguito da sonicazione all'interno di isopropanolo, etanolo e H2O per 1 minuto. Dopo ogni sonicazione, sciacquare accuratamente i vetrini coprioggetti in acqua distillata (ddH2O) e infine asciugarli nell'incubatore.
- Trattare i vetrini coprioggetti prepuliti con plasma O2 in un detergente al plasma per 2 minuti, quindi assemblare con vetrini appiccicosi come descritto in precedenza16. I vetrini adesivi e i vetrini coprioggetti formeranno un canale tra di loro (come mostrato nella Figura 1A).
NOTA: Un trattamento al plasma efficiente è importante. Usa O2 come sorgente di plasma. - Riempire il canale con 2,5 μL di PLL-PEG-biotina (1 mg/mL) diluiti in 97,5 μL di PLL-PEG (1 mg/mL) e incubare per 30 minuti a temperatura ambiente (RT), quindi lavare tre volte con PBS. La PLL-PEG-biotina si lega alla neutravidina nel passaggio successivo, mentre la spina dorsale PLL-PEG forma un substrato inerte che impedisce il legame aspecifico di proteine e piastrine.
NOTA: La concentrazione di PLL-PEG-biotina nelle soluzioni di rivestimento definisce la densità finale dei ligandi cRGD. - Aggiungere 100 μL di Neutravidin-FITC (25 μg/mL) e incubare per 30 minuti al buio a RT, quindi lavare tre volte con PBS.
NOTA: Regolare la concentrazione di Neutravidina-FITC sulla concentrazione di PLL-PEG-biotina. Aumentare la concentrazione di Neutravidina-FITC se sono rivestite densità più elevate di PLL-PEG-biotina. - Aggiungere 100 μL di ciclo [Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotina) (0,1-1 μM), incubare per 30 minuti a RT e lavare tre volte con PBS. I vetrini coprioggetti sono pronti per l'uso. Uno schema del rivestimento è illustrato nella Figura 1B.
2. Isolamento delle piastrine di topo dal sangue
- Preparare il tampone di Tyrode modificato, che contiene 136,9 mM di NaCl, 12,1 mM di NaHCO3, 2,6 mM di KCl, 5,5 mM di glucosio, 10 mM di HEPES e regolare il pH a 7,4 e 6,5.
- Anestetizzare i topi (seguendo protocolli istituzionalmente approvati) mediante iniezione intraperitoneale di 0,5 mg/kg di fentanil, 5 mg/kg di midazolam e 0,05 mg/kg di medetomidina. Dopo aver confermato la profondità dell'anestesia tramite pizzicamento delle dita, rimuovere la pelle toracica con le forbici.
- Preparare una siringa da 2 ml (ago da 26 G) con 150 μL di acido-citrato-destrosio (ACD) come anticoagulante. Inserire l'ago tra la seconda e la terza costola sul lato sinistro dello sterno per prelevare il sangue dal cuore. Successivamente, sopprimere il topo mediante lussazione cervicale.
NOTA: (1) Composizione del tampone ACD: 85 mM di citrato di sodio tribasico disidratato e 65 mM di acido citrico monoidrato in 111 mM di glucosio. (2) Il prelievo di sangue deve essere eseguito senza intoppi per evitare la formazione di coaguli. Circa 1 ml di sangue può essere ottenuto da topi di 8-10 settimane. - Miscelare il sangue con 1 mL di tampone di Tyrode (pH 6,5) in una provetta FACS (polistirene a fondo tondo) da 5 mL e centrifugare a 70 x g per 20 minuti a RT con il freno disattivato.
- Dopo la centrifugazione, prelevare la parte superiore (circa 1 mL) contenente plasma ricco di piastrine (PRP). Miscelare con 3 mL di tampone di Tyrode (pH 6,5) e aggiungere 100 ng/mL di prostaciclina (PGI2) per prevenire l'attivazione piastrinica.
- Centrifugare a 1200 x g per 5 minuti a RT, scartare il surnatante, risospendere il pellet in 500 μl di tampone di Tyrode (pH 6,5) e misurare la conta piastrinica utilizzando un emocitometro.
3. Migrazione piastrinica di topo su rivestimento cRGD di biotina-neutravidina-biotina
- Integrare il tampone di Tyrode modificato (pH 7,4) con 10 x 103/μL di piastrine di topo, 1 mM di CaCl2, 2 μM di U46619 e 4 μM di Adenosina 5'-difosfato sale sodico (ADP) e pipettare un volume totale di 240 μL nei canali preparati nella fase 1.
- Registra la migrazione piastrinica in tempo reale utilizzando un microscopio invertito dotato di un incubatore a tavolino. In alternativa, incubare il canale per 1 ora a 37 °C in un incubatore.
- Fissare il campione con paraformaldeide al 4% per 10 minuti a RT e lavare cinque volte con PBS.
- Permeabilizzare le piastrine con Triton-X (0,2% in PBS) per 5 minuti e lavarle cinque volte con PBS.
- Diluire 2,5 μl di falloidina Alexa Fluor 594 (40x stock metanolico) in 100 μl di PBS. Incubare con le piastrine per 30 minuti al buio, quindi lavare cinque volte con PBS.
- Visualizzare i vetrini al microscopio a fluorescenza.
4. Quantificazione
NOTA: Le piastrine che formano filopodi (sporgenze simili a dita) o lamellipodi (sporgenze simili a fogli) sono state contate come piastrine aderenti4. Le piastrine con una distanza di migrazione superiore a uno del suo diametro sono state definite piastrine migranti.
- Frazione di piastrine in migrazione: conta i numeri di adesione o migrazione piastrinica con lo strumento Multi Point nelle Fiji. Fare clic con il pulsante destro del mouse sul menu a discesa dello strumento Punto nella barra degli strumenti per selezionare lo strumento Multipunto . Calcola la frazione di piastrine in migrazione dividendo il numero di piastrine in migrazione per il numero di piastrine adesive.
- Distanza media di migrazione: Estrarre la distanza di migrazione da campioni fissi misurando la lunghezza del percorso di migrazione "impresso" nel rivestimento neutravidina-FITC utilizzando lo strumento a riga a mano libera . Fare clic con il pulsante destro del mouse sul menu a discesa di Linea retta nella barra degli strumenti per selezionare lo strumento Linea a mano libera .
- Descrittori della forma delle piastrine: genera maschere binarie segmentando le piastrine fluorescenti (Alexa594-Falloidina) utilizzando la funzione Soglia . Seleziona Immagine > Regola > soglia nella barra degli strumenti.
- I descrittori di forma come l'area, il perimetro, la circolarità e le proporzioni possono essere ottenuti nelle particelle analizzate. Seleziona i descrittori di forma in Analizza > Imposta misure, quindi seleziona Visualizza risultati in Analizza > Analizza particelle.
Risultati
Le piastrine attivate aderiscono e si diffondono facilmente su vetrini rivestiti di PLL-PEG-biotina-neutravidina-FITC-biotina-cRGD (Figura 1C e Figura 2A; 0 min e 5 min) e successivamente si polarizzano formando un lamellipodio sul bordo d'attacco (Figura 2A; 10 min). Durante questo processo, lo pseudonucleo (area scura al centro delle piastrine) si è spostato dal centro alla parte posteriore della piastrina (Figura 2A). Le piastrine polarizzate iniziano quindi a migrare senza un'evidente direzionalità (Figura 2A; 15 min e 20 min e Figura 2B). Abbiamo osservato che le piastrine che migrano sui rivestimenti PLL-PEG-biotina-neutravidina-FITC-biotina-cRGD possono rompere il legame neutravidina-FITC-biotina-PLL-PEG, come evidenziato dalla riduzione dell'intensità della fluorescenza lungo il percorso di migrazione (Figura 1C e Figura 2A, B). Inoltre, il complesso neutravidina-FITC-biotina-cRGD si accumula sulla superficie piastrinica (Figura 2A, B). Questo fenomeno è simile a risultati precedenti in cui le piastrine in migrazione rimuovevano il fibrinogeno dal substrato e lo accumulavano all'interno del loro sistema canalicolare aperto (OCS)4.
Per studiare come la densità del ligando influenzi la migrazione piastrinica, la densità del cRGD è stata regolata variando il rapporto tra PLL-PEG-biotina e PLL-PEG nel primo strato di rivestimento. Questi dati rivelano che le piastrine di topo raggiungono una migrazione ottimale a una concentrazione del 2,5% di PLL-PEG-biotina. La migrazione è ridotta sia a concentrazioni più basse (1%) che più alte (10%) di PLL-PEG biotina (Figura 3A, B). Questi cambiamenti nel comportamento migratorio dipendenti dal substrato sono accompagnati da alterazioni della morfologia piastrinica (Figura 3C). A basse densità di ligando (1%), le piastrine non si diffondono adeguatamente, come evidenziato da una bassa proiezione dell'area piastrinica e del perimetro (Figura 3C). Ciò suggerisce un'insufficiente attivazione delle integrine e segnalazione outside-in7. Di conseguenza, le piastrine non sono in grado di esercitare forze sui leganti cRGD, non riescono a rimodellare il substrato e non migrano (Figura 3A, B).
A una densità intermedia del ligando (2,5%), c'è un aumento significativo dell'area piastrinica e del perimetro (Figura 3C). Le piastrine si diffondono efficacemente, interrompendo meccanicamente i ligandi labili del cRGD, e migrano (Figura 3A, B). Tuttavia, ad alte densità di ligando (10%), sebbene la diffusione aumenti, le piastrine non riescono a polarizzarsi, indicato da un rapporto d'aspetto ridotto (Figura 3C). In queste condizioni, le piastrine rimangono attaccate al substrato appiccicoso e non migrano perché non possono rompere i ligandi labili del cRGD (Figura 3A, B).
Questi risultati dimostrano che la migrazione piastrinica dipende in modo critico dalle proprietà adesive del substrato. Le piastrine possono migrare solo quando si impegnano sufficientemente con i leganti adesivi e contemporaneamente generano forze di trazione sufficientemente forti da superare la tolleranza alla tensione del substrato adesivo 4,6,7,8.

Figura 1: Procedura di rivestimento e imaging dal vivo dell'interazione piastrina-substrato. (A) Fotografia della camera assemblata. (B) Principio del protocollo. A sinistra: Schema del rivestimento. I vetrini coprioggetti trattati al plasma sono stati rivestiti con tre strati. Il primo strato è la miscela di PLL-PEG e PLL-PEG-biotina (la spina dorsale del PLL-PEG è inerte alle cellule e impedisce il legame non specifico). Il secondo strato è neutravidina-FITC e il terzo strato è biotina-cRGD. I ponti Neutravidin-FITC PLL-PEG-biotina e biotina-cRGD. Le piastrine si legano alla biotina-cRGD attraverso le integrine nella membrana plasmatica. A destra: Illustrazione del legame biotina-avidina da parte delle integrine piastriniche. Le piastrine esercitano forze sul substrato attraverso l'impegno integrina-cRGD e rompono il legame superiore cRGD-biotina - neutravidina-FITC - o il legame inferiore neutravidina-FITC - PLL-PEG-biotina. La rottura del legame inferiore tra neutravidina-FITC e biotina-PLL-PEG provoca una riduzione del segnale fluorescente, mentre la rottura del legame superiore tra biotina-cRGD e neutravidina-FITC non lo fa. (C) Serie temporali che mostrano la migrazione piastrinica e la deplezione dei ligandi labili del cRGD. Le aree di fluorescenza ridotta indicano le tracce di migrazione delle piastrine (vedi anche Figura 2A) e le aree di fluorescenza aumentata indicano l'accumulo di FTIC-neutravidina-biotina-cRGD sulle piastrine migranti. Barra della scala: 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
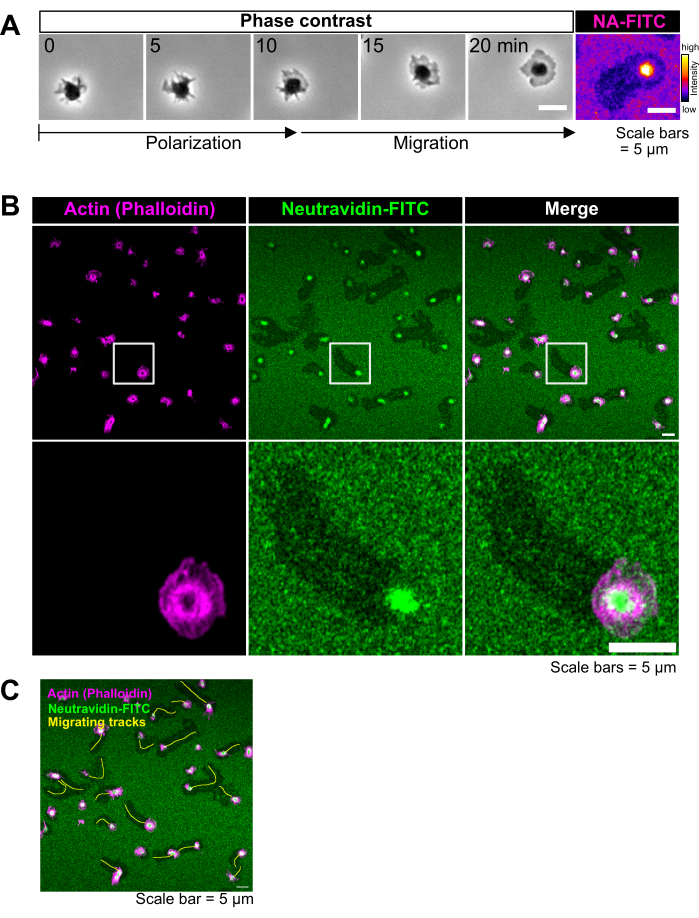
Figura 2: Imaging in immunofluorescenza della migrazione piastrinica codificata dal substrato rimodellato. (A) Sequenza filmata rappresentativa della migrazione di singole piastrine. A sinistra: immagini a contrasto di fase delle piastrine in migrazione. Le piastrine si polarizzano formando un lamellipodio sul bordo d'attacco e successivamente migrano. A destra: la Neutravidina-FITC è stata rimossa dal substrato, lasciando l'"impronta" della migrazione piastrinica. La rottura di cRGD-biotina-neutravidina-FITC si accumula al centro delle piastrine in migrazione. (B) Immagini rappresentative della migrazione piastrinica su rivestimenti ligando labile cRGD-biotina-avidina. Tomaia: le piastrine colorate con falloidina (Alexa FluorTM 594) hanno mostrato una grande formazione di lamellipodium e una forma polarizzata che ricorda le piastrine migranti. Le piastrine in migrazione rompono il legame cRGD-biotina-neutravidina-FITC, generando percorsi di migrazione sul substrato indicati da un segnale FITC ridotto. Inferiore: immagine ritagliata con ingrandimento maggiore. (C) Le tracce di migrazione sono state disegnate manualmente nelle Figi con linee gialle. Barre della scala: 5 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Il rapporto tra PLL-PEG-biotina e PLL-PEG determina la migrazione e la forma delle piastrine. (A) Immagini rappresentative delle piastrine su rivestimenti PLL-PEG-biotina all'1%, 2,5% e 10%, barra della scala: 5μm. (B) Quantificazione dell'adesione piastrinica, dell'efficienza di migrazione e della distanza di migrazione, n = 4 esperimenti indipendenti; Media/SD; Corsa unidirezionale ANOVA/Tukey; **p < 0,01; p < 0,001; p < 0,0001, ns: non significativo (C) Quantificazione dei descrittori di forma piastrinica (area, perimetro, circolarità e rapporto d'aspetto), n = 4 esperimenti indipendenti; Media/Min-Max; Corsa unidirezionale ANOVA/Tukey; **p < 0,01; p < 0,001; p < 0,0001, ns: non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo, viene presentata una procedura di rivestimento a tre strati costituita da (1) una spina dorsale PLL-PEG-biotina e (2) un linker neutravidina-FITC che facilita il legame di (3) biotina-cRGD (un ligando adesivo) alla spina dorsale PLL-PEG-biotina (vedi anche Figura 1B) che consente una precisa sintonizzabilità delle proprietà meccaniche e adesive del substrato variando il rapporto tra PLL-PEG-biotina e PLL-PEG e fornisce una facile lettura della migrazione piastrinica basata sulla fluorescenza. Mentre questo protocollo utilizza la neutravidina coniugata con FITC e la falloidina coniugata con Alexa Fluor 594 per monitorare la migrazione e la forma delle piastrine, è possibile utilizzare altre avidine e falloidina coniugate con fluorofori. Poiché tutti i reagenti di rivestimento, inclusi PLL-PEG, PLL-PEG-biotina, neutravidina-FITC e cRGD-biotina, così come gli attivatori piastrinici sono disponibili in commercio, questo esperimento può essere eseguito senza troppi sforzi aggiuntivi. La fase critica è il trattamento al plasma perché un trattamento al plasma inefficiente porta a un legame inadeguato di PLL-PEG/PLL-PEG-biotina al substrato, con conseguente fallimento dell'adesione e della migrazione piastrinica. Le prestazioni del pulitore al plasma sono importanti. In generale, i pulitori al plasma con generatori a 13,6 MHz hanno prestazioni migliori rispetto a quelli con 40 KHz o 100 KHz. Inoltre, una sorgente di plasma di ossigeno è più adatta dell'aria ambiente. Dopo il successo del trattamento al plasma, le fasi di rivestimento non sono quasi soggette a errori.
In precedenza è stato dimostrato che le piastrine utilizzano la modalità di migrazione mesenchimale, che è fortemente dipendente dalle aderenze del substrato 4,17. Analogamente ai fibroblasti, basse densità di ligandi impediscono la migrazione poiché le piastrine faticano ad aderire al substrato, mentre alte densità di ligandi ostacolano la migrazione impedendo il disimpegno delle aderenze solide18 (Figura 3). A densità intermedie, le piastrine aderiscono mentre le forze di trazione dipendenti dalla miosina IIA per legame integrinico sono ancora sufficienti per rompere le aderenze. È interessante notare che l'elevata affinità tra l'integrina αIIbβ3 e il suo ligando fibrina(ogen) provoca lo smontaggio delle aderenze non attraverso il rilascio del ligando adesivo, ma piuttosto attraverso la sua rottura o distacco dal substrato sottostante, come le cellule endoteliali in vivo o i vetrini coprioggetti in vitro 4,6. La forza di distacco necessaria per staccare il fibrinogeno dal substrato sottostante è fortemente influenzata da proprietà fisiche e (bio-)chimiche che sono spesso difficili da controllare, il che può portare a una significativa variabilità nell'efficienza della migrazione. Il test qui presentato offre un approccio riduzionista per affrontare questo problema. Tuttavia, la forza di rottura del legame avidina-biotina è fissata a circa 160 pN, quindi è necessario utilizzare sensori di tensione più sofisticati, come quelli basati su un cavo di DNA a doppio filamento, per studiare l'adesione piastrinica a regimi di forza inferiori19.
Studi precedenti hanno scoperto che la migrazione piastrinica è coinvolta nell'infezione batterica e nell'infiammazione vascolare in vivo. Di conseguenza, le piastrine con difetti di migrazione, come la contrattilità della miosina, la polimerizzazione dell'actina o la segnalazione dell'integrina outside-in, mostrano una ridotta clearance batterica e integrità vascolare 4,6,7. Il test qui presentato è semplice, stabile e, quindi, adatto per lo screening di piccoli inibitori molecolari e dei loro effetti sulla migrazione piastrinica. Fornisce un nuovo strumento in vitro per esplorare bersagli terapeutici nell'infiammazione o nella trombosi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Deutsche Forschungsgemeinschaft (DFG; Fondazione tedesca per la ricerca) numeri di progetto 514478744 e 514477451 a F.G. Il progetto è finanziato dall'Unione Europea (ERC, MEKanics, 101078110). Le opinioni e i pareri espressi sono esclusivamente quelli dell'autore o degli autori e non riflettono necessariamente quelli dell'Unione europea o dell'Agenzia esecutiva del Consiglio europeo della ricerca. Né l'Unione europea né l'autorità che concede l'aiuto possono essere ritenuti responsabili per tali questioni.
Materiali
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
Riferimenti
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon