Method Article
Un metodo di omogeneizzazione ad alta velocità assistito da separazione magnetica per la produzione su larga scala di vescicole derivate da endosomi
In questo articolo
Riepilogo
Qui, descriviamo un metodo di omogeneizzazione ad alta velocità assistita da separazione magnetica per la produzione su larga scala di nanovescicole derivate dall'endosoma come un nuovo tipo di mimici degli esosomi (EM) che condividono la stessa origine biologica e struttura, morfologia e composizione proteica simili delle vescicole extracellulari (EV) native.
Abstract
Le vescicole extracellulari (EV) hanno attirato un'attenzione significativa nella ricerca fisiologica e patologica, nella diagnosi e nel trattamento delle malattie; Tuttavia, la loro traduzione clinica è stata limitata dalla mancanza di approcci di produzione su larga scala. Pertanto, questo protocollo fornisce un metodo di omogeneizzazione ad alta velocità assistito da separazione magnetica per la produzione su larga scala di nanovescicole derivate da endosomi come un nuovo tipo di mimici degli esosomi (EM) derivati dagli endosomi, che hanno una resa circa 100 volte superiore rispetto al metodo di ultracentrifugazione convenzionale. In questo metodo, le nanoparticelle magnetiche (MNP) sono state internalizzate dalle cellule parentali tramite endocitosi e sono state successivamente accumulate all'interno dei loro endosomi. Quindi, gli endosomi caricati con MNPs sono stati raccolti e purificati mediante trattamento ipotonico e separazione magnetica. Un omogeneizzatore ad alta velocità è stato utilizzato per rompere gli endosomi caricati con MNP in nanovescicole monodisperse. Le vescicole derivate dall'endosoma risultanti presentano la stessa origine biologica e struttura, caratterizzate dall'analisi del tracciamento delle nanoparticelle, dal microscopio elettronico a trasmissione e dal western blotting. La loro morfologia e composizione proteica sono simili a quelle delle vescicole extracellulari native, il che indica che le vescicole extracellulari possono potenzialmente fungere da surrogato a basso costo e ad alto rendimento delle vescicole extracellulari native per le traduzioni cliniche.
Introduzione
Le vescicole extracellulari (EV) sono piccole vescicole secrete da quasi tutte le cellule con una gamma di dimensioni comprese tra 30 e 150 nm, contenenti abbondanti sostanze bioattive. A seconda della cellula di origine, le vescicole extracellulari mostrano un'elevata eterogeneità, possedendo più componenti specifiche per le cellule madri1. Le vescicole extracellulari vengono rilasciate nei fluidi corporei e trasportate in siti distanti dove vengono assorbite dalle cellule bersaglio per l'azione2, che può essere utilizzata per fornire un'ampia gamma di molecole bioattive e farmaci per la riparazione dei tessuti, la diagnosi e il trattamento dei tumori e la modulazione immunitaria 3,4. Tuttavia, altre nanoparticelle biologiche (ad esempio, lipoproteine) e nanovescicole (ad esempio, vescicole extracellulari derivate da percorsi non endosomiali) con proprietà biofisiche simili nei fluidi corporei influenzano inevitabilmente l'isolamento e la purificazione delle vescicole extracellulari. Ad oggi, l'ultracentrifugazione rimane il gold standard per l'isolamento delle EV e sono stati sviluppati altri metodi di isolamento, tra cui la centrifugazione a gradiente di densità del saccarosio, l'ultrafiltrazione, la precipitazione del polietilenglicole, la cromatografia e l'isolamento delle microsfere immunomagnetiche5. L'attuale collo di bottiglia che limita la traduzione clinica e la commercializzazione delle terapie con EV è la grave mancanza di tecniche di isolamento che consentano un isolamento altamente scalabile e riproducibile delle EV 6,7,8. Le tecniche tradizionali di isolamento delle vescicole extracellulari (ad esempio, l'ultracentrifugazione e la cromatografia ad esclusione dimensionale) soffrono di una bassa resa (1 x 107-1 x 108/1 x 10 6 cellule), di un lungo ciclo di produzione (24-48 ore), di una scarsa riproducibilità della qualità del prodotto e richiedono apparecchiature di produzione costose e ad alta intensità energetica che non sono in grado di soddisfare l'attuale domanda clinica di vescicole extracellulari6.
I mimici degli esosomi (EM), surrogati sintetici delle vescicole extracellulari native, hanno attirato un'attenzione importante a causa della loro struttura, funzione e scalabilità molto simili nella produzione. La principale fonte di EM proviene dall'estrusione diretta di intere cellule parentali con sezionamento continuo 9,10, dimostrando potenti funzioni biologiche come EV native11,12. Ad esempio, gli EM derivati dalle cellule staminali mesenchimali del cordone ombelicale umano (hUCMSC) esercitano effetti di guarigione delle ferite simili a quelli delle vescicole extracellulari native e sono più ricchi di composizione proteica13. Sebbene gli EM derivati da cellule intere abbiano la complessità biologica delle vescicole extracellulari, il loro principale svantaggio è l'eterogeneità dei prodotti perché sono inevitabilmente contaminati da vari organelli cellulari e detriti cellulari. L'analisi della localizzazione delle proteine ha inoltre rivelato che gli EM derivati dall'estrusione di cellule intere contengono molte proteine non specifiche per le vescicole extracellulari provenienti dai mitocondri e dal reticolo endoplasmatico13. Inoltre, la maggior parte dei metodi per la produzione di EM richiede ancora l'ultracentrifugazione, un processo che richiede molto tempo ed energia14. Considerando il fatto che gli esosomi derivano esclusivamente da endosomi cellulari, abbiamo ipotizzato che le nanovescicole derivate da endosomi bioingegnerizzati possano ricapitolare meglio l'omologia biologica tra esosomi ed EM rispetto agli EM derivati dalla membrana cellulare ben consolidati prodotti con il metodo di estrusione dell'intera cellula14. Tuttavia, la produzione di nanovescicole derivate da endosomi è difficile a causa della mancanza di approcci praticabili.
Sono stati condotti studi clinici utilizzando le vescicole extracellulari come surrogato della terapia cell-free e di un sistema di somministrazione di farmaci su scala nanometrica per il trattamento di varie malattie. Ad esempio, le vescicole extracellulari derivate da cellule staminali mesenchimali del midollo osseo sono state utilizzate per trattare la polmonite grave causata da COVID-19 e hanno ottenuto risultati promettenti. Recentemente, anche le vescicole extracellulari geneticamente modificate che trasportano le proteine CD24 hanno dimostrato potenti benefici terapeutici per il trattamento dei pazienti COVID-1915,16. Tuttavia, il requisito clinico della terapia con EV non può ancora essere soddisfatto con i metodi di isolamento tradizionali a causa della bassa resa e del basso costo. Questo studio riporta la produzione su larga scala di nanovescicole derivate dall'endosoma attraverso un approccio di omogeneizzazione ad alta velocità assistito da separazione magnetica. Sfrutta la via dell'endocitosi delle MNP per isolare gli endosomi caricati con MNP tramite separazione magnetica, seguita da omogeneizzazione ad alta velocità per formulare gli endosomi in nanovescicole monodisperse. Poiché i tipi di endosomi raccolti da questo protocollo sono diversi, sono ancora necessarie ulteriori ricerche approfondite per stabilire le buone pratiche di fabbricazione (GMP) nel settore. Questo nuovo approccio di preparazione EM è più efficiente in termini di tempo (5 minuti di omogeneizzazione ad alta velocità) per ottenere nanovescicole omologhe alle vescicole extracellulari native. Produce esponenzialmente più vescicole dalla stessa quantità di cellule rispetto all'ultracentrifugazione, che può essere generalmente applicata a vari tipi di cellule.
Protocollo
NOTA: Uno schema del metodo è mostrato nella Figura 1.
1. Preparazione e isolamento EM
- Internalizzazione cellulare delle MNP
- Colture cellulari
- Sospendere 1 ×10 6 cellule staminali mesenchimali (BMSC) del midollo osseo di ratto, cellule 293T o cellule di carcinoma epiteliale ovarico di topo (ID8) in terreno completo DMEM con il 10% di siero fetale bovino (FBS) e il 5% di soluzione di penicillina-streptomicina (P/S) in 2 mL per piastra a sei pozzetti (vedere Tabella dei materiali).
- Coltivare le cellule per una notte a 37 °C e al 5% di CO2 .
NOTA: Il numero di cellule dopo l'aderenza era di circa 1 × 106.
- Endocitosi delle MNP
- Ridurre il volume medio di ciascuna piastra a sei pozzetti a 1 ml. Co-coltura delle cellule con nanoparticelle di ossido di ferro (IONPs) modificate con polilisina da 10 nm (vedi Tabella dei materiali) a una concentrazione di 100 μg/1 × 106 cellule e incubare a 37 °C in un'atmosfera contenente il 5% di CO2 per 12 ore per consentire alle cellule di endocitosare completamente gli IONP.
- Colture cellulari
- Isolamento e omogeneizzazione degli endosomi
- Trattamento ipotonico cellulare
- Digerire le cellule che hanno IONP completamente internalizzato con 0,5 ml/pozzetto di tripsina per 3 minuti e terminare la digestione aggiungendo 1 ml/pozzetto di terreno completo.
- Centrifugare a 1000 x g per 5 minuti ed eliminare il surnatante. Risospendere le cellule in soluzione salina tampone fosfato (PBS) e centrifugare, ripetutamente due volte per lavare via il terreno residuo e gli IONP non assorbiti.
- Infine, risospendere il pellet in 8 mL in soluzione ipotonica pre-preparata (71,4 mM di cloruro di potassio, 1,3 mM di citrato di sodio, pH 7,2-7,4) per 15 minuti (vedi Tabella dei materiali).
- Rilascio di organelli mediante omogeneizzazione a bassa velocità
- Trasferire la sospensione cellulare in soluzione ipotonica in una provetta di vetro e rilasciare gli organelli utilizzando un omogeneizzatore di vetro (vedi Tabella dei materiali) con 20 urti a 1000 giri/min.
- Separazione magnetica per ottenere endosomi
- Trasferire 1 mL della soluzione cellulare omogeneizzata in una provetta per microcentrifuga da 1,5 mL e inserirla in un separatore magnetico per 1 ora per separare completamente gli endosomi caricati con IONP da altri organelli (come nucleo e mitocondri) e detriti cellulari.
- Raccogliere i pellet marroni sulla superficie di contatto delle provette per microcentrifuga accanto al telaio magnetico (vedi Tabella dei materiali), cioè gli endosomi caricati con IONP. Scartare il liquido nelle provette della microcentrifuga e aggiungere 3 mL di PBS per risospendere gli endosomi.
- Trattamento ipotonico cellulare
- Omogeneizzazione ad alta velocità
- Trasferire la soluzione contenente gli endosomi in una provetta da centrifuga da 15 mL con un volume di liquido compreso tra 3 e 10 mL.
- Estendere la sonda da 10 mm dell'omogeneizzatore ad alta velocità (vedere la tabella dei materiali) fino al fondo della provetta da centrifuga senza toccare il fondo. Regolare il pulsante Velocità sotto lo schermo, impostare la velocità su 140 x g e regolare il pulsante Ora per impostare il tempo di 5 minuti, quindi premere il pulsante OK .
- Premere il pulsante Start per eseguire l'omogeneizzazione dopo aver posizionato una ghiacciaia sotto il campione.
- Smistamento magnetico per EM
- Trasferire la soluzione contenente nanovescicole ottenute dall'omogeneizzazione ad alta velocità nella provetta per microcentrifuga da 1,5 mL e metterla in un separatore magnetico per 1 ora.
- Raccogliere il liquido che contiene gli EM richiesti. Fare attenzione a non toccare la superficie dei tubi accanto al telaio magnetico, che ha adsorbito IONP liberi e EM caricati con IONP.
2. Caratterizzazione EM (Figura 2 e Figura 3)
- Analisi dinamica della diffusione della luce (DLS)
- Iniettare 1 mL di campione EMs (20 μg/mL) lungo la parete nella cuvetta e posizionarlo nella fessura del campione dello strumento DLS (vedere la tabella dei materiali).
- Apri il software DLS, seleziona Particle Size Test e inizia il test.
- Misurare la concentrazione proteica utilizzando un kit per il dosaggio delle proteine BCA (vedere la tabella dei materiali).
- Analisi di tracciamento delle nanoparticelle (NTA)
- Diluire gli EM con PBS in una soluzione a 1 × 107-1 × 108 particelle/mL e iniettarli nella camera dello strumento NTA (vedere la tabella dei materiali) utilizzando una siringa da 1 mL a una velocità di flusso di 500-1000 μL/min.
- Aprire i 488 canali laser e assicurarsi che il numero di EM nell'interfaccia software sia compreso tra 100 e 300 e in moto browniano.
- In base al protocollo del produttore, selezionare la SOP appropriata (EV-488) per garantire che la sensibilità dello strumento sia adatta al rilevamento EM.
- Microscopia elettronica a trasmissione (TEM)
- Fissare gli EM (1 mg/mL) con un volume uguale di glutaraldeide al 5% per 30 minuti e quantificare la concentrazione di EM come 1 mg/mL mediante il kit del test delle proteine BCA.
- Posizionare una goccia di 10 μL di EM sul lato carbone della rete di rame e rimuovere il liquido in eccesso dal lato con carta da filtro dopo 10 minuti. Aggiungere 10 μL di PBS e tamponare immediatamente con carta da filtro. Ripetere due volte per rimuovere la glutaraldeide in eccesso.
- Far cadere 5 μL di mezzo di contrasto in acetato di uranile e colorare negativamente per 1 minuto, quindi rimuovere il mezzo di contrasto in eccesso. Lavare tre volte con acqua deionizzata e asciugare a temperatura ambiente (RT).
- Registrare l'immagine tramite un TEM a una tensione di accelerazione di 100 kV.
- Western blotting
- Aggiungere ai campioni 100 μL di tampone di lisi cellulare e 5 μL di un cocktail di inibitori della proteasi 50x (vedere Tabella dei materiali). Mescolare delicatamente con una pistola a pipetta e mettere in ghiaccio per 30 min.
- Centrifugare la soluzione a 1000 x g per 10 minuti a 4 °C, quantificare la concentrazione proteica del surnatante con un kit di analisi delle proteine BCA e raccoglierla.
- Miscelare il surnatante da 100 μL con 25 μL di tampone di carico proteico 5x e riscaldare a 95 °C per 10 minuti.
- Preparare i gel secondo le istruzioni dei gel preformati. Caricare 15 μg di proteine per pozzetto ed eseguire l'elettroforesi su gel a 80 V. Attendere che il campione scorra verso il gel di separazione, passare a 100 V, quindi trasferire la proteina su una membrana di nitrocellulosa a 100 V, 60 minuti sotto bagno di ghiaccio.
- Rilevare i marcatori non specifici per le vescicole extracellulari (Calnexin) e i biomarcatori delle vescicole extracellulari (annessina e CD63) mediante western blotting (vedere la tabella dei materiali).
NOTA: Gli anticorpi sono diluiti secondo le raccomandazioni del produttore.
3. Rilevamento della funzione EM in vitro
- Etichettatura EM
- Miscelare 1 μL di PKH26 con 250 μL di diluente C (1:250) per ottenere una soluzione colorante 2x (4 × 10-6 M) (vedi Tabella dei materiali).
- Miscelare 250 μL di EM (1 mg/mL) con 250 μL di soluzione colorante 2x e soffiare rapidamente con una pistola di pipettaggio.
- Incubare a RT per 2-5 minuti capovolgendo delicatamente la provetta da centrifuga.
- Aggiungere un volume uguale di siero o l'1% di proteine sieriche bovine e incubare per 1 minuto per terminare la digestione.
- Rimuovere l'eccesso di PKH26 mediante ultrafiltrazione con provette di ultrafiltrazione da 1000 KD a 3000 x g per 30 minuti e ripetere tre volte aggiungendo PBS. Risospendere il liquido rimanente a 500 μL con PBS e filtrare attraverso un filtro da 0,22 μm.
- Saggio di captazione cellulare
- Inoculo cellulare: Seme 1 × 106 cellule in piastre confocali da 35 mm con 1 mL di DMEM contenente il 10% di FBS e il 5% di P/S, e incubare a 37 °C e 5% di CO2 per una notte.
- Filtrare gli EM con filtri per siringa sterili da 0,22 μm per rimuovere potenziali contaminazioni.
- Trattare le cellule con EM marcati con PKH26 (109 particelle/mL) per 8 ore.
- Lavare tre volte con PBS, aggiungere DAPI (10 ng/mL) e incubare per 10 minuti a RT.
- Acquisire le immagini di fluorescenza nella microscopia a fluorescenza a scansione laser confocale utilizzando i canali laser da 405 nm e 561 nm (vedere la tabella dei materiali).
Risultati
Il flusso di lavoro della preparazione EM mediante omogeneizzazione ad alta velocità assistita da separazione magnetica è mostrato nella Figura 1. Le cellule internalizzano IONP modificati con polilisina da 10 nm, che sono specificamente accumulati negli endosomi tramite endocitosi (Figura 3A). Dopo essere stati trattati con tampone ipotonico e omogeneizzati, gli endosomi caricati con IONP vengono rilasciati dalle cellule e successivamente raccolti mediante separazione magnetica. Gli endosomi isolati vengono ulteriormente ricostituiti in nanovescicole monodisperse, note anche come EM, mediante omogeneizzazione ad alta velocità. Abbiamo esplorato diversi parametri chiave (ad esempio, velocità e tempo di omogeneizzazione) per identificare condizioni di preparazione EM ottimizzate (Figura 2). Infine, è stata scelta una velocità di omogeneizzazione di 140 x g per 5 minuti come condizione ottimizzata considerando la dimensione delle particelle e la resa degli EM prodotti. Gli IONP liberi e gli EM caricati con IONP vengono infine rimossi dalla soluzione del prodotto finale mediante un secondo ciclo di separazione magnetica per ottenere EM privi di IONP. Il metodo produce nanovescicole altamente uniformi e monodisperse da endosomi di cellule parentali, che condividono la stessa origine biologica delle vescicole extracellulari native.
Per confrontare le vescicole extracellulari ottenute mediante ultracentrifugazione con le EM generate con questo metodo, BMSC e 293T sono state preparate per le vescicole extracellulari e le EM. Il diametro e la morfologia degli EM sono stati analizzati mediante NTA e TEM. La morfologia delle BMSC-EM ha la caratteristica di una tipica struttura vescicolare a forma di ciotola ed è delimitata da un doppio strato lipidico (Figura 3A). Come analizzato da NTA, sia i BMSC-EM che i 293T-EM hanno un diametro idrodinamico simile a quello dei veicoli elettrici nativi (BMSC-EV e 293T-EV) (Figura 3B). Le rese di BMSC-EMs di omogeneizzazione ad alta velocità sono state di 8,16 × 10 8-1,42 × 109/1 × 10 6 cellule, e la resa delle EV native preparate mediante ultracentrifugazione è stata solo di 7,2 × 10 7-1,12 × 108/1 × 106cellule. Allo stesso modo, le rese di 293T-EMs di omogeneizzazione ad alta velocità sono state di 3,71 × 10 8-7,58 × 108/1 × 10 6 cellule, che raggiungono fino a circa 100 volte superiori a quelle delle 293T-EV native preparate con il metodo convenzionale dell'ultracentrifuga (≈5,5 × 10 6/1 × 10 6cellule) (Figura 4A).
Inoltre, i risultati del western blotting hanno mostrato che i BMSC-EM contengono gli stessi biomarcatori proteici delle vescicole extracellulari (CD63 e annessina). Sia gli EM che le EV sono negativi per l'espressione di Calnexin, suggerendo che gli EM prodotti con questo metodo non hanno quasi nessuna contaminazione della membrana plasmatica (Figura 3C). Non vi è alcuna differenza significativa nella concentrazione proteica tra EM ed EV, le BMSC-EM e le BMSC-EV hanno mostrato concentrazioni proteiche totali simili, 11,15 μg/1 × 10 9 particelle e 14,71 μg/1 ×10 9 particelle tramite il kit di analisi delle proteine BCA. Inoltre, le 293T-EM e le 293T-EV hanno mostrato concentrazioni proteiche totali rispettivamente di circa 31,8 μg/1 × 109 particelle e 9,95 μg/1 × 109 particelle (Figura 4B). Questi risultati indicano che gli EM hanno una composizione proteica simile a quella degli EV nativi. Per rilevare se gli EM possono essere endocitosi, gli EM e le EV marcati con PKH26 sono stati co-incubati con BMSC e ID8 a una concentrazione di 1 × 109 particelle/mL per 8 ore e le cellule sono state osservate al microscopio a fluorescenza confocale per confermare che gli EM potevano essere prontamente assorbiti dalle cellule per l'azione così come le EV (Figura 5).

Figura 1: Diagramma schematico del metodo di omogeneizzazione ad alta velocità assistita da magneti. Fase 1: Le cellule internalizzano gli IONP negli endosomi attraverso l'endocitosi. Fase 2: Raccogliere gli organelli, compresi gli endosomi caricati con IONP, dopo il trattamento ipotonico e l'omogeneizzazione. Fase 3: Purificare gli endosomi caricati con IONP mediante separazione magnetica. Fase 4: Gli endosomi vengono omogeneizzati e ricostituiti in nanovescicole monodisperse. Fase 5: Rimuovere gli IONP liberi e gli EM caricati con IONP mediante separazione magnetica per raccogliere gli EM privi di IONP. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: L'ottimizzazione delle condizioni di preparazione EM. (A) Il diametro e il PDI dei BMSC-EM in risposta alle variazioni di velocità di omogeneizzazione quando il tempo è impostato a 5 min sono stati analizzati da DLS. (B) Il diametro e il PDI dei BMSC-EM in risposta alle variazioni del tempo di omogeneizzazione quando la velocità di omogeneizzazione è impostata a 140 x g sono stati analizzati da DLS. (C) Il diametro e il PDI dei BMSC-EM in diversi punti temporali di archiviazione sono stati analizzati da DLS. (D) Il diametro e la concentrazione di BMSC-EMs in risposta alle variazioni di velocità di omogeneizzazione quando il tempo è impostato a 5 min sono stati analizzati mediante NTA. (E) Il diametro e la concentrazione di BMSC-EM in risposta alla variazione del tempo di omogeneizzazione quando la velocità di omogeneizzazione è impostata a 140 x g sono stati analizzati mediante NTA. (F) Il diametro e la resa delle BMSC-EM in risposta alla co-incubazione delle cellule BMSC con IONPs di diverse concentrazioni sono stati analizzati mediante NTA. p < 0,0001. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Caratterizzazione degli EM. (A) Caratterizzazione TEM della morfologia delle cellule parentali con IONP endocitosi, endosomi ed EM. Le barre della scala rappresentano 500 nm. (B) I diametri idrodinamici di BMSC-EM, BMSC-EV, 293T-EM e 293T-EV sono caratterizzati da NTA. (C) Risultati dell'analisi Western blot di BMSC-EMs, BMSC-EVs e lisati cellulari BMSC. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Il rendimento dei mercati emergenti è superiore a quello dei veicoli elettrici. (A) Il rendimento dei mercati emergenti e dei veicoli elettrici preparati da BMSC e 293T è stato analizzato mediante NTA. (B) Resa proteica di EM e EV preparati a partire da BMSC e 293T. **p < 0,01. Fare clic qui per visualizzare una versione più grande di questa figura.
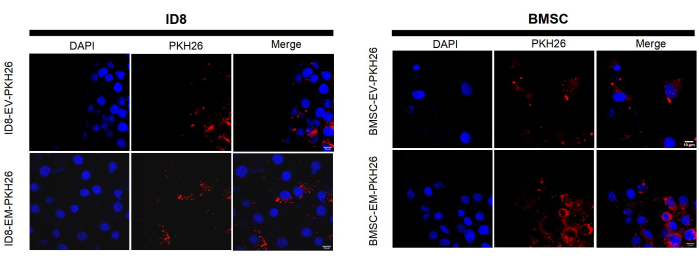
Figura 5: Immagini rappresentative al microscopio a fluorescenza di EV e EM marcati con PKH26 internalizzati da BMSC e ID8. Le barre della scala rappresentano 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Come surrogato della terapia cell-free e di un sistema di somministrazione di farmaci su scala nanometrica, le vescicole extracellulari devono ancora soddisfare le loro aspettative cliniche e un ostacolo principale è la mancanza di metodi di produzione e purificazione scalabili e riproducibili6. Pertanto, vari tipi di EM sono stati sviluppati come analoghi delle EV con complessità biologica simile14. Ad oggi, l'esempio EM più comunemente usato sono le nanovescicole derivate dalla membrana plasmatica cellulare. La preparazione di tali nanovescicole è relativamente facile e diretta estrudendo direttamente intere cellule madri17. Tuttavia, le nanovescicole derivate dalla membrana plasmatica cellulare non possono ricapitolare le vescicole extracellulari native a causa di due inconvenienti: in primo luogo, l'origine biologica di queste nanovescicole proviene dalla membrana plasmatica cellulare, che contiene diverse composizioni lipidiche e proteiche rispetto alle vescicole extracellulari native; In secondo luogo, le contaminazioni, tra cui proteine, acidi nucleici e lipidi da organelli non EV e detriti cellulari, causano l'inevitabile eterogeneità EM. In questo metodo, abbiamo incubato cellule con IONP e raccolto endosomi caricati con IONP attraverso la separazione magnetica, quindi generato nanovescicole monodisperse tramite omogeneizzazione ad alta velocità, ottenendo infine EM privi di IONP mediante un secondo ciclo di separazione magnetica. Inoltre, abbiamo ottimizzato le condizioni di preparazione dei campi elettromagnetici esplorando l'impatto di diversi parametri, come la velocità e il tempo di omogeneizzazione, sulle dimensioni e sulla resa dei mercati emergenti. Questo protocollo sfrutta un interessante fenomeno biologico: le MNP (ad esempio, IONP a 10 nm) possono essere internalizzate in modo efficiente da quasi tutte le cellule tramite endocitosi e accumulate esclusivamente negli endosomi, non in altri organelli. Questo processo biologico unico ha permesso l'isolamento di endosomi caricati con MNP senza contaminazioni non EV tramite separazione magnetica. In cambio, le nanovescicole preparate da questi endosomi cellulari purificati potrebbero ricapitolare più fedelmente la complessità biologica delle vescicole extracellulari native.
Inoltre, lo standard aureo del metodo di isolamento delle EV è l'ultracentrifugazione, che costa terreni di coltura cellulare massicci e un lungo tempo di elaborazione di oltre 5 ore e produce solo 1 × 107-1 × 108 particelle da 1 x 10 6 cellule6. I metodi tradizionali di estrusione di cellule parentali intere comprendono più fasi che coinvolgono l'estrusione di membrane ad altissima pressione e l'ultracentrifugazione, che hanno una resa relativamente più elevata ma richiedono attrezzature costose17. Tuttavia, la resa, l'efficienza, i costi e la manodopera dei mercati emergenti sono notevolmente migliorati utilizzando il nostro protocollo. L'omogeneizzatore ad alta velocità è un'apparecchiatura comune e a basso costo per un breve tempo di elaborazione di 5 minuti in questo protocollo e questo metodo può produrre fino a 100 volte più EM da 1 × 106 celle rispetto alle vescicole extracellulari native. Tuttavia, questo metodo presenta alcune limitazioni, come la perdita di proteine endosomiali durante l'omogeneizzazione ad alta velocità, ed è stato dimostrato che le MNP endocitose dalle cellule possono essere trasferite ai lisosomi, il che costituirebbe una potenziale contaminazione18.
In prospettiva, gli EM possono essere ingegnerizzati per esercitare importanti funzioni biologiche come le loro controparti native, il che può servire come un nuovo e promettente tipo di terapia biologica. Le sostanze bioattive (ad esempio, proteine e acidi nucleici) possono essere integrate negli EM attraverso la selezione di specifiche cellule parentali (ad esempio, cellule staminali19) o modificazioni genetiche (ad esempio, proteine di fusione20). Ad esempio, le nanovescicole derivate da cellule mediante l'estrusione di cellule staminali embrionali viventi hanno un effetto positivo sul processo di recupero o di guarigione delle ferite19. La modificazione genetica è un approccio alternativo per generare EM con specifiche funzioni biologiche. Ad esempio, quando le cellule sono state trasfettate con vettori di nanocorpi del recettore del fattore di crescita antiepidermico (EGFR) fusi a peptidi segnale di ancoraggio del glicosilfosfatidilinositolo (GPI), i nanocorpi di EGFR possono essere ancorati sulla superficie delle vescicole extracellulari per colpire le cellule tumorali che esprimono EGFR20. Gli EM hanno funzionato bene come surrogato della terapia cell-free e come sistema di somministrazione di farmaci su scala nanometrica in diversi studi preclinici14, ma c'è una mancanza di una comprensione meccanicistica completa dell'EM o della terapia basata su EV con preoccupazioni sull'eterogeneità e la riproducibilità di EV e EM nelle indagini cliniche. Nel loro insieme, le funzioni biologiche degli EM e le loro implicazioni cliniche giustificano ulteriori indagini.
Divulgazioni
D.W. e P.G. sono co-inventori di una domanda di brevetto depositata dall'Istituto di Medicina di Base e Cancro (IBMC), Accademia Cinese delle Scienze. L'altro autore dichiara di non avere conflitti di interesse.
Riconoscimenti
Gli autori riconoscono l'uso di strumenti presso la Shared Instrumentation Core Facility presso l'Istituto di Medicina di Base e Cancro (IBMC), Accademia Cinese delle Scienze. Questo studio è stato sostenuto dalla National Natural Science Foundation of China (NSFC; 82172598), dalla Natural Science Foundation della provincia di Zhejiang, Cina (LZ22H310001), dal 551 Health Talent Training Project della Health Commission of Zhejiang Province, Cina, dal Progetto di ricerca sullo sviluppo agricolo e sociale dell'Ufficio municipale per la scienza e la tecnologia di Hangzhou (2022ZDSJ0474) e dalla sovvenzione di ricerca interdisciplinare Qiantang.
Materiali
| Name | Company | Catalog Number | Comments |
| Annexin antibody | ABclonal | A11235 | Western blotting |
| BCA assay kit | Beyotime | P0012 | Protein concentration assay |
| Calnexin | GeneTex | HL1598 | Western blotting |
| CD63 antibody | ABclonal | A19023 | Western blotting |
| Cell lysis buffer for Western and IP | Beyotime | P0013 | Western blotting |
| Centrifuge | Beckman | Allegra X-30R | Cell centrifuge |
| CO2 incubator | Thermo | Cell culture | |
| Confocal laser scanning fluorescence microscopy | NIKON | A1 HD25 | Photo the fluorescence picture |
| DMEM basic (1x) | GIBCO | C11995500BT | Cell culture |
| Dynamic light scattering (DLS) | Malvern | Zetasizer Nano ZS ZEN3600 | Diameter analysis |
| Electric glass homogenizer | SCIENTZ(Ningbo, China) | DY89-II | Low-speed homogenization |
| Exosome-depleted FBS | system Bioscience | EXO-FBS-50A-1 | Cell culture |
| High-speed homogenizer | SCIENTZ(Ningbo, China) | XHF-DY | High-speed homogenization |
| Magnetic grate | Tuohe Electromechanical Technology (Shanghai, China) | NA | Magnetic separation |
| PKH26 Red Fluorescent Cell Linker Kit for General Cell Membrane Labeling | Sigma-Aldrich | PKH26GL-1KT | The kit contains PKH26 cell linker in ethanol and Diluent C |
| Polylysine-modified iron oxide nanoparticles (IONPs) | Zhongke Leiming Technology (Beijing, China) | Mag1100-10 | Cell culture |
| Potassium chloride | Aladdin | 7447-40-7 | Cell hypotonic treatment |
| Protease inhibitor cocktail | Beyotime | P1030 | Proteinase inhibitor |
| Sodium citrate | Aladdin | 7447-40-7 | Cell hypotonic treatment |
| Transmission electron microscopy (TEM) | JEOL | JEM-2100plus | Morphology image |
| Ultracentrifuge | Beckman | Optima XPN-100 | Exosome centrifuge |
| ZetaView nanoparticle tracking analyzers | Particle Metrix | PMX120 | Nanoparticle tracking analysis |
Riferimenti
- Kalluri, R., LeBleu, V. S. The biology, function, and biomedical applications of exosomes. Science. 367 (6478), eaau6977 (2020).
- Hyenne, V., et al. RAL-1 controls multivesicular body biogenesis and exosome secretion. J Cell Biol. 211 (1), 27-37 (2015).
- Farooqi, A. A., et al. Exosome biogenesis, bioactivities and functions as new delivery systems of natural compounds. Biotechnol Adv. 36 (1), 328-334 (2018).
- Gatti, S., et al. Microvesicles derived from human adult mesenchymal stem cells protect against ischaemia-reperfusion-induced acute and chronic kidney injury. Nephrol Dial Transplant. 26 (5), 1474-1483 (2011).
- Zhang, Y., et al. Exosome: A review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications. Int J Nanomedicine. 15, 6917-6934 (2020).
- Yang, D., et al. Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics. Theranostics. 10 (8), 3684-3707 (2020).
- Castilletti, C., et al. Coordinate induction of IFN-alpha and -gamma by SARS-CoV also in the absence of virus replication. Virology. 341 (1), 163-169 (2005).
- Guo, P., Huang, J., Moses, M. A. Cancer nanomedicines in an evolving oncology landscape. Trends Pharmacol Sci. 41 (10), 730-742 (2020).
- Jo, W., et al. Large-scale generation of cell-derived nanovesicles. Nanoscale. 6 (20), 12056-12064 (2014).
- Yoon, J., et al. Generation of nanovesicles with sliced cellular membrane fragments for exogenous material delivery. Biomaterials. 59, 12-20 (2015).
- Li, M., et al. Exosome mimetics derived from bone marrow mesenchymal stem cells ablate neuroblastoma tumor in vitro and in vivo. Biomater Adv. 142, 213161 (2022).
- Wang, J., et al. Exosome mimetics derived from bone marrow mesenchymal stem cells deliver doxorubicin to osteosarcoma in vitro and in vivo. Drug Deliv. 29 (1), 3291-3303 (2022).
- Zhang, Z., et al. Comprehensive proteomic analysis of exosome mimetic vesicles and exosomes derived from human umbilical cord mesenchymal stem cells. Stem Cell Res Ther. 13 (1), 312 (2022).
- Li, Y. J., et al. Artificial exosomes for translational nanomedicine. J Nanobiotechnology. 19 (1), 242 (2021).
- Yang, W., et al. Clinical characteristics of 310 SARS-CoV-2 Omicron variant patients and comparison with Delta and Beta variant patients in China. Virol Sin. 37 (5), 12 (2022).
- Shapira, S., et al. A novel platform for attenuating immune hyperactivity using EXO-CD24 in COVID-19 and beyond. EMBO Mol Med. 14 (9), 15997 (2022).
- Jang, S. C., et al. Bioinspired exosome-mimetic nanovesicles for targeted delivery of chemotherapeutics to malignant tumors. ACS Nano. 7 (9), 7698-7710 (2013).
- Le, T. S., et al. Quick and mild isolation of intact lysosomes using magnetic-plasmonic hybrid nanoparticles. ACS Nano. 16 (1), 885-896 (2022).
- Jeong, D., et al. Nanovesicles engineered from ES cells for enhanced cell proliferation. Biomaterials. 35 (34), 9302-9310 (2014).
- Kooijmans, S. A., et al. Display of GPI-anchored anti-EGFR nanobodies on extracellular vesicles promotes tumour cell targeting. J Extracell Vesicles. 5, 31053 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon