Method Article
Purificazione del biogas attraverso l'uso di un sistema microalga-batterico in stagni semi-industriali ad alta velocità
In questo articolo
Riepilogo
L'inquinamento atmosferico ha un impatto sulla qualità della vita di tutti gli organismi. In questo articolo descriviamo l'utilizzo della biotecnologia delle microalghe per il trattamento del biogas (rimozione simultanea di anidride carbonica e idrogeno solforato) e la produzione di biometano attraverso stagni algali aperti semi-industriali ad alto tasso e successiva analisi dell'efficienza del trattamento, del pH, dell'ossigeno disciolto e della crescita delle microalghe.
Abstract
Negli ultimi anni sono emerse diverse tecnologie per purificare il biogas in biometano. Questa depurazione comporta una riduzione della concentrazione di gas inquinanti come l'anidride carbonica e l'idrogeno solforato per aumentare il contenuto di metano. In questo studio, abbiamo utilizzato una tecnologia di coltivazione di microalghe per trattare e purificare il biogas prodotto dai rifiuti organici dell'industria suinicola per ottenere biometano pronto all'uso. Per la coltivazione e la purificazione, a San Juan de los Lagos, in Messico, sono stati installati due fotobioreattori a laghetto aperto da 22,2m3 accoppiati con un sistema di colonne di assorbimento-desorbimento. Sono stati testati diversi rapporti liquido/biogas di ricircolo (L/G) per ottenere le massime efficienze di rimozione; sono stati misurati altri parametri, come il pH, l'ossigeno disciolto (DO), la temperatura e la crescita della biomassa. Gli L/G più efficienti sono stati 1,6 e 2,5, con un effluente di biogas trattato con una composizione del 6,8%vol e del 6,6%vol in CO2, rispettivamente, ed efficienze di rimozione per H2S fino al 98,9%, oltre a mantenere valori di contaminazione da O2 inferiori al 2% vol. Abbiamo scoperto che il pH determina notevolmente la rimozione di CO2 , più di L/G, durante la coltivazione a causa della sua partecipazione al processo fotosintetico delle microalghe e della sua capacità di variare il pH quando solubilizzata a causa della sua natura acida. DO, e la temperatura hanno oscillato come previsto dai cicli naturali luce-buio della fotosintesi e dall'ora del giorno, rispettivamente. La crescita della biomassa variava con l'alimentazione di CO2 e nutrienti, nonché con la raccolta del reattore; Tuttavia, la tendenza è rimasta pronta per la crescita.
Introduzione
Negli ultimi anni sono emerse diverse tecnologie per purificare il biogas in biometano, promuovendone l'utilizzo come combustibile non fossile, mitigando così le emissioni inutilizzabilidi metano 1. L'inquinamento atmosferico è un problema che colpisce la maggior parte della popolazione mondiale, in particolare nelle aree urbanizzate; In definitiva, circa il 92% della popolazione mondiale respira aria inquinata2. In America Latina, i tassi di inquinamento atmosferico sono principalmente creati dall'uso di combustibili, per cui nel 2014 il 48% dell'inquinamento atmosferico è stato causato dal settore della produzione di elettricità e calore3.
Nell'ultimo decennio sono stati proposti sempre più studi sulla relazione tra gli inquinanti presenti nell'aria e l'aumento dei tassi di mortalità, sostenendo che esiste una forte correlazione tra i due set di dati, in particolare nelle popolazioni infantili.
Per evitare il protrarsi dell'inquinamento atmosferico, sono state proposte diverse strategie; uno di questi è l'utilizzo di fonti di energia rinnovabili, tra cui turbine eoliche e celle fotovoltaiche, che diminuiscono il rilascio di CO2 nell'atmosfera 4,5. Un'altra fonte di energia rinnovabile proviene dal biogas, un sottoprodotto della digestione anaerobica della materia organica, prodotto insieme a un digestato organico liquido6. Questo gas è composto da una miscela di gas e le loro proporzioni dipendono dalla fonte di materia organica utilizzata per la digestione anaerobica (fanghi di depurazione, letame bovino o rifiuti organici agroindustriali). Generalmente, queste proporzioni sono CH4 (53%-70%vol), CO2 (30%-47%vol), N2 (0%-3%vol), H2O (5%-10%vol), O2 (0%-1%vol), H2S (0-10.000 ppmv), NH3 (0-100 ppmv), idrocarburi (0-200 mg/m3) e silossani (0-41 mg/m3) 7,8,9, dove la comunità scientifica è interessata al gas metano in quanto questa è la componente energetica rinnovabile della miscela.
Tuttavia, il biogas non può essere semplicemente bruciato come ottenuto perché i sottoprodotti della reazione possono essere dannosi e contaminanti; Questo fa sorgere la necessità di trattare e purificare la miscela per aumentare la percentuale di metano e diminuire il resto, convertendolo essenzialmente in biometano10. Questo processo è noto anche come aggiornamento. Anche se, attualmente, esistono tecnologie commerciali per questo trattamento, queste tecnologie presentano diversi inconvenienti economici e ambientali 11,12,13. Ad esempio, i sistemi con lavaggio a carbone attivo e acqua (ACF-WS), lavaggio con acqua a pressione (PWS), permeazione di gas (GPHR) e adsorbimento a pressione oscillante (PSA) presentano alcuni inconvenienti economici o di altro tipo di impatto ambientale. Una valida alternativa (Figura 1) è l'utilizzo di sistemi biologici come quelli che combinano microalghe e batteri coltivati in fotobioreattori; Alcuni vantaggi includono la semplicità di progettazione e funzionamento, i bassi costi operativi e le sue operazioni e sottoprodotti rispettosi dell'ambiente 10,13,14. Quando il biogas viene purificato in biometano, quest'ultimo può essere utilizzato come sostituto del gas naturale e il digestato può essere implementato come fonte di nutrienti per supportare la crescita delle microalghe nel sistema10.
Un metodo ampiamente utilizzato in questa procedura di upgrading è la crescita di microalghe in fotoreattori a circuito aperto accoppiati a una colonna di assorbimento a causa dei minori costi operativi e del capitale di investimento minimo necessario6. Il tipo di reattore a pista più utilizzato per questa applicazione è lo stagno algale ad alta velocità (HRAP), che è un laghetto a canalizzazione poco profondo in cui la circolazione del brodo algale avviene tramite una ruota a pale a bassa potenza14. Questi reattori necessitano di grandi aree per la loro installazione e sono molto suscettibili alla contaminazione se utilizzati in condizioni esterne; nei processi di purificazione del biogas, si consiglia di utilizzare condizioni alcaline (pH > 9,5) e l'uso di specie algali che prosperano a livelli di pH più elevati per migliorare la rimozione di CO2 e H2S evitando la contaminazione15,16.
Questa ricerca mirava a determinare le efficienze del trattamento del biogas e la produzione finale di biometano utilizzando fotobioreattori HRAP accoppiati con un sistema di colonne di assorbimento-desorbimento e un consorzio di microalghe.
Protocollo
1. Configurazione del sistema
NOTA: Nella Figura 2 è mostrato uno schema delle tubazioni e della strumentazione (P&ID) del sistema descritto in questo protocollo.
- Allestimento del reattore
- Preparare il terreno livellandolo e compattandolo per migliorare la stabilità del reattore.
- Su un campo aperto, scavare due buche allungate e a 3 m dall'estremità, scavare ulteriormente una buca profonda 3 m2 e 1 m (nota come pozzo di aerazione).
- Posizionare due HRAP (Figura 3) all'interno dello spazio su supporti metallici ricoperti di geomembrana. Ogni reattore deve avere una capacità operativa di 22,2 m3.
- Posizionare una pompa ad aria per reattore da 1728,42 watt (2,35 hp) vicino al punto degli HRAP in cui sono stati scavati i pozzi di aerazione.
- Fissare una ruota a pale (mossa da un motore elettrico da 1103,24 watt [1,5 hp]) attraverso il reattore per favorire il contatto tra biomassa e fluidi.
- Configurazione del trattamento dei gas (Figura 4)
- Costruire la colonna di desorbimento con un tubo di cloruro di polivinile (PVC) da 6", in cui la corrente di ingresso entra a 2 m dalla parte superiore coperta e la corrente di uscita scorre dal basso (Figura 2).
- Allestire il serbatoio di assorbimento (Vt: 2,55 m3), dove la corrente di ingresso gassosa (biogas non trattato) viene fatta gorgogliare dal basso attraverso 11 tubi diffusori e proviene dal digestore anaerobico attraverso una tubazione in PVC da 4" che passa attraverso un soffiatore di biogas, un rotametro da 1" e una porta di campionamento, mentre il liquido proviene dal ricircolo del media dopo la colonna di desorbimento sul fondo del serbatoio. L'uscita del liquido si trova sul lato del serbatoio. Trasporta il fluido arricchito di CO2 alla colonna di controllo del livello e il gas esce dall'uscita nella parte superiore del serbatoio, che è collegata con una tubazione in PVC da 1" per condurre il biometano ottenuto a un bruciatore per la sua combustione continua (Figura 2).
- Collegare il serbatoio di assorbimento alla colonna di desorbimento attraverso un tubo in PVC da 4", passando attraverso una porta di campionamento tra le due operazioni (Figura 2).
- Costruire la colonna di controllo del livello con un tubo in PVC da 6" dove l'ingresso si trova nella parte inferiore. Dispone di due uscite (controllate con valvole a farfalla), a seconda delle esigenze dell'impianto; il primo si trova ad un'altezza di 2,5 m e il secondo a 3 m da terra (Figura 2).
- Collegare i fotobioreattori HRAP attraverso una tubazione in PVC da 2" alla colonna di desorbimento da 6", passando attraverso una pompa centrifuga di ricircolo (1103,24 watt [1,5 hp]) e un rotametro da 1" (Figura 2).
- Collegare la colonna di controllo del livello attraverso un tubo in PVC da 4" a un tubo in PVC schedule 40, passando attraverso una porta di campionamento. Successivamente, collegarlo a una porzione di tubo flessibile in PVC, seguito da un altro tubo in PVC schedule 40 e, infine, da un tubo in PVC da 4", che si apre ai fotobioreattori HRAP (Figura 2).
- Installare il bypass della colonna di desorbimento con una tubazione in PVC da 2" e collegarla al tubo principale prima della porta di campionamento (Figura 2).
2. Collaudo funzionale del sistema
- Pompa centrifuga di ricircolo (1103,24 watt [1,5 hp])
- Per determinare la portata massima della pompa, adescare l'interno per almeno 10 minuti per evitare l'aspirazione dell'aria e avviarla a 230 V e 1 fase.
- Testare il flusso di ricircolo lasciandolo fluire attraverso il rotametro da 1".
- Sistema di gorgogliamento del biogas
- Per determinare la forza necessaria per far gorgogliare almeno una colonna d'aria equivalente a 200 mbar, testare almeno 3 soffianti con potenze diverse (485,52 watt [0,66 CV], 1838,74 watt [2,5 CV] e 3309,74 watt [4,5 CV]) facendo gorgogliare aria nel serbatoio di assorbimento.
- Verificare visivamente le dimensioni e la distribuzione raggiunte dalle bolle d'aria all'interno del serbatoio. Nelle condizioni operative qui descritte, il diametro medio previsto delle bolle è di 3 mm.
3. Inoculazione e crescita in condizioni indoor
- Trasferire un ceppo puro di Arthrospira maxima dalle piastre di agar a 15 mL di terreno minerale acquoso17 (NaHCO3 [10 g/L], Na3PO4 ·12H2O [0,033 g/L], NaNO3 [0,185 g/L], MgSO4 ·7H2O [0,014 g/L], FeSO4 ·7H2O [0,0008 g/L], NaCl [0,4 g/L]).
- Aumentare la coltura a matracci da 500 mL con terreno acquoso Jourdan innocuo, utilizzando il 100% del volume del pallone, e lasciarla crescere in fotoperiodi di 12 ore di luce/12 ore di buio utilizzando lampade a diodi emettitori di luce (LED) con dispositivo a montaggio superficiale (SMD) 2835 che forniscono luce fredda a 2000 lm e sotto miscelazione continua mediante gorgogliamento dell'aria (0,3 L/min o 0,6 vvm). (fase della durata di circa 1 mese).
- Continuare il processo di scaling up aggiungendo il 20% del volume precedente al nuovo volume fino a raggiungere 50 L.
- Adattare la coltura alle condizioni di funzionamento della luce naturale e ai terreni di coltura Jourdan in serra in sacchi trasparenti da 50 L (fase della durata di circa 2 mesi).
- Continuare la scalatura in queste condizioni fino a 5 m3 fotobioreattori HRAP (step della durata di circa 2 mesi).
4. Avvio operativo del sistema in condizioni esterne
- Aggiungere l'intero volume di questi fotobioreattori HRAP da 5 m3 ai fotobioreattori HRAP da 13 m3 situati all'aperto e riempire il resto del volume con il terreno di coltura Jourdan. Iniziare a miscelare attraverso una ruota a pale ad una velocità di 30 cm/s, coltivando in modalità batch per 15 giorni o fino a raggiungere 0,7 g/L (passaggio della durata di circa 1 mese).
- Una volta che la crescita raggiunge 0,7 g/L, trasferire il volume al3 HRAP operativo da 22,2 m, riempire il resto con il terreno Jourdan e impostare la ruota a pale a una velocità di 30 cm/s. Lasciare crescere la biomassa fino a raggiungere 0,7 g/L e un pH di 10; Una volta soddisfatte queste condizioni, avviare il campionamento e la raccolta, se necessario.
- Avviare il ricircolo del liquido dal fotobioreattore HRAP al serbatoio di assorbimento a flusso variabile per aumentare la produttività della biomassa. Iniziare a gorgogliare il biogas a un flusso medio di 3,5 m3/h dopo 2 ore per fornire carbonio inorganico alla coltura. Prestare attenzione al pH poiché deve rimanere al di sopra di 9.
NOTA: Prima di far ricircolare il fluido attraverso il serbatoio di assorbimento, adescare la pompa centrifuga sopra descritta. - Aggiunta di nutrienti: Monitorare settimanalmente le condizioni dei nutrienti durante la raccolta e il bilancio complessivo dell'azoto assumendo lo stato stazionario calcolato come mostrato:
MNaNO3 = (MBiomassa x 0.10)/0.12 [g]
Dove:
MNaNO3 = Massa di nitrato di sodio [g]
MBiomassa = Biomassa raccolta [g]
1.10: Resa in massa di azoto/biomassa16 [g/g]
1.12: Frazione di massa dell'azoto nel nitrato di sodio [g/g] - Con i risultati del bilancio azotato, riformulare il terreno di Jourdan per aggiungere la quantità proporzionale di Na3PO4·12H2O, MgSO4·7H2O e FeSO4·7H2O. Non aggiungere altro bicarbonato di sodio o cloruro di sodio.
NOTA: Sciogliere i nutrienti in acqua pulita prima di aggiungerli ai reattori. - Monitorare l'evaporazione dell'acqua e aggiungerla settimanalmente se necessario.
5. Campionamento e analisi
- Biogas
- Prelevare il biogas dall'uscita di campionamento prima del serbatoio di assorbimento e dall'uscita di campionamento dopo il serbatoio collegando un sacchetto di fluoruro di polivinile da 10 L all'uscita con un tubo flessibile di diametro adeguato; Metti ciascuno di essi in sacchetti separati di fluoruro di polivinile.
- Calibrare l'analizzatore di gas portatile impostando il trasduttore di pressione a zero e attendendo la stabilizzazione. A tale scopo, premere Start, quindi Next (Avanti) e collegare una provetta trasparente e una provetta gialla come indicato dall'analizzatore. Premere Avanti e infine, Letture gas.
- Collegare ogni campione contenuto all'interno delle sacche di fluoruro di polivinile all'analizzatore, premere Avanti e misurare le concentrazioni di CH4, CO2, O2 e H2S come %vol da entrambi i punti del sistema.
- Determinare il rapporto volumetrico liquido/biogas di ricircolo (L/G) dividendo il flusso di ricircolo del liquido per il flusso di produzione di biogas. Calcolare il flusso di gas corrispondente (m3/h) che presenta la massima efficienza di rimozione di CO2 e H2S.
- Misurazione online delle condizioni dell'impianto (pH, ossigeno disciolto, temperatura)
- Calibrare tutti i sensori secondo le specifiche del produttore.
- Posizionare un sensore di pH, un sensore di ossigeno disciolto (DO) e un sensore di temperatura nel liquido di ciascun HRAP.
NOTA: Per la marca e le specifiche di ciascuno dei sensori, riview il file Tabella dei materiali. - Collegare i sensori di pH e DO a un dispositivo di acquisizione dati costituito da un processore quad-core a 64 bit da 1,4 GHz collegato a uno schermo portatile che memorizza un programma Python preconfezionato scritto in Integrated Development and Learning Environment (IDLE) 2.7.
- Aprire il programma attraverso lo schermo e indicare gli intervalli di tempo per memorizzare ogni punto dati (in questo caso, ogni 2 minuti).
- Crea un foglio di calcolo in cui il programma memorizzerà automaticamente i dati raccolti.
- Fare clic sul pulsante che indica ON, indicando che è pronto per iniziare a memorizzare i dati.
- Per interrompere l'acquisizione dei dati, fare clic sul pulsante che riporta la scritta OFF.
- Per scaricare le informazioni, inserire un bus seriale universale (USB) e importare il foglio di calcolo.
- Collegare il sensore di temperatura a un termoregistratore per memorizzare i dati registrati durante gli esperimenti.
- Brevi prove esplorative
- Determinare l'L/G più efficiente
- Regolare il flusso di biogas in ingresso per selezionare il valore L/G da testare (0,5, 1, 1,5, 1,6, 2, 2,5, 3,3, 3,4).
- Misurare il pH e le concentrazioni in ingresso e in uscita di ciascun gas (CH4, CO2, H2S, O2, N2) all'inizio e ogni 15 minuti per un'ora (60 minuti), utilizzando gli strumenti descritti in precedenza.
- Determinare l/G più efficiente confrontando i valori di uscita e scegliere quello più conveniente in base alle esigenze dell'esperimento.
- Relazione tra L/G, pH e CO2
- Scegli almeno due L/G da confrontare.
- Per ogni L/G, misurare il pH e le concentrazioni in ingresso e in uscita di CO2 e di H2S, O2 e N2 come controllo all'inizio, ogni 15 minuti per 60 minuti, e poi ogni ora per un totale di 5 ore, utilizzando gli strumenti descritti in precedenza.
- Calcolare le percentuali di rimozione di CO2 utilizzando l'equazione:
%Rimozione CO2 = ((CO2in ingresso - CO2in uscita)/(CO2in uscita)) x 100 - Rappresentare graficamente i risultati e confrontare il comportamento del pH e della CO2 per ciascuno degli L/G testati.
- Determinare l'L/G più efficiente
- Curva di calibrazione per correlare il peso della biomassa per litro di coltura rispetto all'assorbanza a 750 nm18
- Campiona la coltura delle alghe per cercare di ottenere un'assorbanza di 1,0. Se la coltura ha un'assorbanza inferiore a 1,0, estrarre l'acqua mediante filtrazione (filtro da 0,45 μm) da un campione di coltura. Se l'assorbanza è maggiore di 1, può essere diminuita aggiungendo un terreno di coltura fresco.
- Preparare cinque sospensioni di cellule di alghe utilizzando il campione e aggiungere terreno di coltura fresco, in percentuale volume/volume (V/V): 100%, 80%, 60%, 40% e 20%.
- Misurare e registrare l'assorbanza a 750 nm delle cinque soluzioni con uno spettrofotometro utilizzando cuvette di plastica, dove il terreno di coltura fresco è il bianco.
- Determinare il peso della biomassa per litro di coltura di ogni sospensione filtrando 10 mL attraverso un filtro da 0,45 μm precedentemente pesato ed essiccando il campione in un essiccatore di silice per 24 ore e successivamente 48 ore per garantire un peso costante. Ripeti questo passaggio per ciascuna delle cinque soluzioni.
NOTA: Si sconsiglia l'essiccazione di una temperatura più elevata (superiore a 60 °C) a causa della perdita di alcuni composti chiave che potrebbero volatilizzarsi e modificare il peso del campione. - Una volta confermato il peso, calcolare la concentrazione di biomassa all'interno del reattore con l'equazione:
Concentrazione di biomassa = (Peso della biomassa - peso del filtro) x 1000/Volume filtrato [g/L] - Effettuare una regressione lineare dei dati di peso della biomassa in grammi per litro di coltura in funzione dell'assorbanza misurata a 750 nm utilizzando un foglio di calcolo o qualsiasi altro software. Il coefficiente di regressione lineare deve essere maggiore di 0,95; In caso contrario, la curva non è utile e il protocollo deve essere ripetuto.
NOTA: È descritto come peso della biomassa e non come peso secco come la maggior parte dei metodi perché il metodo di essiccazione utilizzato non consente la rimozione completa dell'acqua nel campione, lasciando un contenuto d'acqua inferiore al 5%19.
- Crescita della biomassa
- Monitora i reattori ogni giorno. Prelevare un campione da 1 litro dal punto intermedio tra la ruota a pale e il suo ritorno da ciascuna coltura e portarlo in laboratorio.
- Controllare la crescita della colonia e la purezza della coltura al microscopio.
- Misurare e registrare l'assorbanza a 750 nm dei campioni con uno spettrofotometro, dove il terreno di coltura fresco è il bianco.
- Confrontare con la curva di calibrazione per ottenere il peso stimato della biomassa in grammi per litro.
- Registrare la crescita di ciascun reattore di canalizzazione.
- Produzione di biomassa - raccolta
- Monitora i reattori ogni giorno. Se la crescita della biomassa supera 0,7 g/L durante il campionamento, è necessaria la raccolta.
- Alternando tra i due HRAP, posizionare una rete di poliestere sopra una sezione a un'estremità del reattore e posizionare un'estremità di un tubo flessibile in PVC all'interno del flusso del liquido in modo che l'altra estremità dreni il liquido sopra la rete.
- Scaricare tra 4500 L e 7500 L (a seconda della saturazione della biomassa del reattore) sulla rete, mantenendo un flusso continuo verso il corrispondente HRAP. La biomassa sarà trattenuta sulla rete.
- Per raccogliere, rimuovere la rete dalla parte superiore del reattore e posizionarla su una superficie diversa per raschiare via la biomassa e metterla in un imbuto.
- Spingi la biomassa attraverso l'imbuto per creare forme allungate sopra una rete pulita e asciutta; posizionare la rete in un ambiente caldo e coperto (34-36 °C) per 48-72 ore.
- Una volta asciutta, rimuovere la biomassa dalla rete e pesarla. Calcolare la concentrazione di biomassa raccolta in g/L con queste equazioni:
Volume del liquido drenato = Portata pompa x Tempo di scarico [L]
Concentrazione di biomassa raccolta = Peso della biomassa raccolta/Volume del liquido drenato [g/L]
Risultati
Seguendo il protocollo, il sistema è stato costruito, testato e inoculato. Le condizioni sono state misurate e conservate, e i campioni sono stati prelevati e analizzati. Il protocollo è stato eseguito per un anno, a partire da ottobre 2019 e fino a ottobre 2020. È importante ricordare che d'ora in poi, gli HRAP saranno denominati RT3 e RT4.
Produttività del biometano
Al fine di determinare le condizioni che favoriscono la più alta rimozione di H2S e CO2 e, di conseguenza, la più alta concentrazione di metano, sono stati provati diversi rapporti di ricircolo liquido/biogas (L/G) in un range compreso tra 0,5 e 3,4. Questi risultati sono stati ottenuti per esperimenti con una durata di almeno 60 min (1 h) di gorgogliamento continuo di biogas nel periodo compreso tra il 25 settembre e il 28 settembre. Durante questi test, le microalghe hanno fissato la CO2 e i batteri hanno ossidato l'H2S, concentrando il metano (CH4 ) e, in sostanza, purificando la miscela di gas.
Considerando la capacità media di eliminazione di CO2 dell'intero sistema (volume HRAP + volume serbatoio = 24,75 m3) e una concentrazione di biomassa stabile di 0,8 g/L, è stato stimato un tasso di fissazione specifico, risultante in 65 mgCO2 / gbiomassa h, che è inferiore al massimo teorico riportato (300 mgCO2 / gbiomassa h). Ciò denota che il processo di purificazione del biogas a base di microalghe-batteri è adatto ad essere potenziato.
In generale, la purificazione del biogas ha mostrato una maggiore efficacia con valori di L/G più elevati, mantenendo efficienze di rimozione pari o superiori al 98% per H2S e valori di contenuto inferiori al 7,5% vol per CO2 (Figura 5, Figura 6 e Figura 7). Tuttavia, la contaminazione da biometano di O2 dovuta alla produzione fotosintetica di questo gas era molto più alta a valori di L/G più elevati, il che può essere un potenziale problema per l'uso commerciale poiché le concentrazioni di O2 , per legge, devono rimanere piuttosto basse per ridurre il rischio di esplosione20. Un altro motivo è legato all'evitare di diminuire il suo potere calorifico mediante la diluizione dell'O2 . Invece, si potrebbe sostenere che gli L/Gs 1.6 e 2.5 rappresentano i risultati complessivamente più efficienti, con concentrazioni di CO2 comprese tra 6,6%vol e 6,8%vol, CH4 a 87%vol e O2 a meno di 1,5%vol, oltre a presentare efficienze di rimozione di H2S superiori al 98,5% (Figura 5, Figura 6, e Figura 7). Un confronto tra le percentuali ottenute e quanto accettato dalla legge si trova nella Tabella 1.
È interessante notare che il rapporto ricircolo liquido/biogas di 2 ha una concentrazione di CO2 più elevata (7,4%vol) anche se il valore si colloca tra i L/G più efficienti; ciò potrebbe essere attribuito al fatto che è stato testato in RT3 invece che in RT4. In questo caso, le condizioni erano meno favorevoli per la rimozione di CO2 , probabilmente a causa di una minore concentrazione di biomassa. Complessivamente, il biometano medio prodotto in queste condizioni è stato pari a 20,68 m3/giorno, con una portata media di 4,14 m3/h.
I risultati possono variare a seconda delle condizioni di crescita, del tipo di biogas (sintetico o reale) e delle alghe; ad esempio, Serejo et al.21 hanno utilizzato due miscele di biogas sintetiche che simulano una miscela di gas di CO2 e N2 da confrontare con un normale biogas composto da CH4 al 70% vol, CO2 al 29,5% vol 2 e H2S allo 0,5% vol, purificandolo attraverso un sistema a colonna di assorbimento HRAP da 180 L coltivando Chlorella vulgaris. In questo articolo, Serejo testa anche diversi rapporti L/G, che vanno da 0,5 a 67, in un sistema più piccolo ma simile a valori di pH più bassi e illuminazione artificiale. È stata raggiunta la rimozione completa di H2S e una percentuale media di rimozione dell'80% nei rapporti migliori (superiore a 15). Queste efficienze di rimozione sono aumentate linearmente con il rapporto; Tuttavia, è aumentata anche la contaminazione da ossigeno, il che potrebbe porre problemi nella qualità complessiva del biometano risultante. L'aumento delle nostre efficienze di rimozione della CO2 non è stato lineare; tuttavia, una migliore eliminazione della CO2 può essere osservata con rapporti più grandi. La spiegazione è multicausale, coinvolge il pH, le condizioni dei nutrienti della coltura e la crescita della biomassa, nonché il gorgogliamento del biogas.
L'effetto del rapporto L/G sulle prestazioni del sistema di upgrading del biogas è stato valutato senza ripetizioni. Era giustificato dal fatto che i saggi venivano eseguiti in un periodo diurno dalle 10:00 alle 13:00 (indurrebbe un irraggiamento solare e una temperatura esterna stabili); pertanto, ha indotto condizioni di crescita quasi ottimali per i microrganismi fotosintetici, quindi si potrebbe assumere che il pH sia il parametro più influente sull'assorbimento di CO2 22 dove è stata riportata anche una deviazione standard molto piccola inferiore al 2% per i saggi che valutano l'effetto del rapporto L/G sull'efficienza di rimozione dell'assorbimento di CO2 .
I reattori sono coltivati all'esterno, il che significa che, anche se l'inoculo fosse una coltura pura di alghe Arthrospira maxima, la probabilità di contaminazione con altri organismi che possono sopravvivere nelle difficili condizioni di pH all'interno della coltura è alta. Questo è il caso dei batteri ossidanti dello zolfo 23,24. Tuttavia, questa contaminazione si rivela vantaggiosa per lo scopo finale dell'esperimento poiché questi batteri aiutano a rimuovere l'H2S dal biogas, essenzialmente facendosi carico di questo compito e aiutando la qualità del biometano risultante.
Nelle condizioni ambientali e di resistenza ionica prevalenti durante il funzionamento del sistema, l'H2S disciolto veniva ossidato a polisolfuri e tiosolfato mediante reazioni ossico-abiotiche, dove, dopo alcuni giorni, doveva essere completamente ossidato a solfato25. La rimozione di H2S per precipitazione con cationi nel mezzo nutritivo acquoso è insignificante a causa della quantità insufficiente di cationi immessi nel sistema rispetto alla velocità di carico di H2S (raggiungendo rapporti molari Cationi/H2S molto inferiori a 2). L'assenza di precipitati è stata confermata dalla nostra ispezione visiva durante l'esecuzione del processo di upgrading del biogas. L'ossidazione biologica del solfuro non è stata verificata in questo momento poiché il sistema è aperto all'ambiente.
Condizioni del sistema
L'ossigeno disciolto (DO) e le variazioni di pH sono state misurate sia in condizioni di luce che di buio. Durante il giorno (condizioni di luce), l'ossigeno disciolto è aumentato a causa della produzione fotosintetica di ossigeno da parte delle microalghe, mentre di notte (condizioni di oscurità), è diminuito sia a causa della mancanza di fotosintesi che a causa del metabolismo eterotrofo, che utilizza la respirazione (Figura 8).
I livelli di pH variavano anche con la presenza di CO2 all'interno del liquido (Figura 8), aumentando di valore quando veniva disciolta meno CO2 e diminuendo quando veniva rimossa meno CO2 ; in particolare, ci sono picchi più piccoli nei periodi in cui non veniva più fornita CO2 , di cui parleremo più avanti. Durante la mattinata, il pH ha raggiunto il suo picco intorno alle 11:00 e i valori più bassi intorno alle 18:00, il che è anche coerente con l'attività fotosintetica delle alghe. È importante attirare l'attenzione sul calo maggiore intorno al giorno 2; il breve test esplorativo con L/G di 1.64 è stato eseguito il 29 settembre, fornendo biogas continuo per circa 24 ore (intorno al giorno 1) e ha provocato una massiccia destabilizzazione del sistema, richiedendo l'apporto di urea per favorire ilrecupero dell'azoto. L'altro breve test esplorativo con 1,58 è stato eseguito il 5 ottobre (intorno al 7° giorno), ma in condizioni di sistema migliori (fornitura di biogas durante il periodo di luce), motivo per cui il pH si è allontanato leggermente dai picchi regolari solo per due giorniprima di tornare al comportamento normale.
I picchi di pH più piccoli nella Figura 8 possono essere attribuiti a un periodo di autoregolazione delle alghe rispetto all'ambiente durante il passaggio dalla fotosintesi alla respirazione.
Facendo riferimento ai brevi test esplorativi per mettere in relazione pH e L/G con le percentuali di rimozione della CO2 (Figura 9), abbiamo testato due rapporti, 1,64 e 1,58, come accennato in precedenza. Queste sono entrambe le medie degli L/G registrati durante gli esperimenti. Si possono notare due comportamenti distinti, in cui la percentuale di rimozione e il pH con un rapporto di 1,58 erano notevolmente meno stabili e molto più bassi di quelli registrati per il rapporto di 1,64.
Ciò è supportato dall'upgrading del biogas eseguito da Bahr et al.15, attraverso l'uso di un sistema a colonna HRAP con una specie di alga Arthrospira maxima . Bahr ha valutato le efficienze di rimozione della CO2 in diverse condizioni di pH e portate liquide, nonché la rimozione della contaminazione da H2S e O2 su diverse composizioni di gas sintetici che vanno dalla semplice CO2-N 2 alle composizioni di biogas con concentrazioni variabili di H2S (fino allo 0,5% vol). Hanno concluso che a valori di pH più elevati (compresi tra 9 e 10) e a una maggiore portata del liquido del terreno di coltura (80 ml/min), le percentuali di rimozione della CO2 erano vicine al 100% ma subivano una maggiore contaminazione da O2 , mentre a valori di pH più elevati (comprese tra 9 e 10) e una portata del liquido del terreno di coltura inferiore (20 ml/min), le percentuali di rimozione della CO2 rimanevano vicine al 100% e si osservava una contaminazione da O2 molto inferiore. Hanno anche riportato la rimozione completa di H2S in queste condizioni.
Allo stesso modo, l'oscillazione dell'ossigeno disciolto (Figura 8) può essere attribuita all'attività fotosintetica delle alghe poiché, durante il giorno, l'ossigeno disciolto aumentava a causa della produzione fotosintetica di ossigeno da parte delle microalghe, mentre di notte diminuiva sia per mancanza di fotosintesi che per il metabolismo eterotrofo, che utilizza la respirazione.
La temperatura nel fotobioreattore HRAP (RT4) è variata a causa dell'ora del giorno e del clima autunnale, raggiungendo il picco quasi tutti i giorni tra 23 °C e 28 °C intorno alle 17:00 e raggiungendo i valori più bassi tra 11 °C e 15 °C intorno alle 6:00 (Figura 10). La temperatura all'ingresso e all'uscita del serbatoio di assorbimento è stata misurata occasionalmente, ottenendo una temperatura media rispettivamente di 30,1 °C e 32,5 °C. Pertanto, il contenuto d'acqua (vapore) dopo il trattamento deve essere leggermente superiore (13,5%) rispetto a prima del trattamento con biogas, supponendo che in entrambi i casi l'umidità nel biogas abbia raggiunto la saturazione. Si consiglia vivamente di installare un essiccatore di biogas per una gestione ottimale e un ulteriore utilizzo del biogas purificato.
L/G medio inteso per il periodo compreso tra il 28 settembre e il 10 ottobre è stato di 1,6 poiché i test brevi hanno suggerito che questo rapporto avrebbe favorito risultati migliori; tuttavia, non è stato possibile mantenerlo durante le notti a causa dell'eccessiva acidificazione della coltura di microalghe causata da una scarsa capacità tampone del pH dei terreni di coltura acquosi. Pertanto, solo durante le ore diurne, il biogas veniva immesso nel serbatoio di assorbimento, regolando i valori L/G a circa 1,5.
Produttività della biomassa
L'inoculazione su RT3 è stata eseguita il 20 maggio 2020 e su RT4 il 27 maggio 2020; il tempo che intercorre tra i test (settembre) e l'inoculazione è servito a stabilizzare la cultura e a risolvere i problemi operativi che si sono presentati, come piaghe e malfunzionamenti del sistema, considerando la pandemia globale di COVID.
La crescita della biomassa è stata misurata in due modi: campionamento e raccolta. Ai fini del presente articolo, il campionamento si riferisce alla concentrazione di biomassa in un dato momento nel reattore, mentre la raccolta si riferisce all'efficienza di produzione della biomassa, ovvero la quantità di biomassa che è stata recuperata durante il processo per evitare l'inibizione della crescita. Il test è stato effettuato dal 29 settembre al 9 ottobre, con una media L/G di 1,5, anche se è stato preferito un rapporto di 1,6; Il motivo per cui è risultato più basso è dovuto al rapporto di 1,15 registrato intorno al giorno 11.
Il campionamento (Figura 11) è stato effettuato regolarmente dal giorno 1 al giorno 11 (dal 29 settembre al 9 ottobre), dove l'andamentodella crescita in entrambi i reattori è stato molto simile: si è iniziato con una concentrazione più alta, raggiungendo il valore più basso per l'esperimento nei giorni 4 e 5, recuperando costantemente in RT4 e con qualche variazione in RT3, finalmente cadendo di nuovo. Lo stesso identico comportamento si osserva in Harvesting, che suggerisce quindi che un evento (molto probabilmente un fattore esterno) ha influenzato la crescita di entrambe le culture contemporaneamente.
La raccolta (Figura 12) è stata effettuata in modo semi-regolare, alternando una vendemmia per RT3 e la vendemmia successiva per RT4. Tuttavia, la scala deve essere considerata; Sia nel campionamento che nel prelievo, la variazione tra i numeri è molto bassa, indicando che l'evento che ha interessato entrambi i reattori non era critico. La linea tratteggiata rossa nella Figura 8 indica il periodo di tempo in cui i reattori non sono stati captati; ciò è dovuto a due fattori: alcuni giorni sono stati durante il fine settimana, quando, sfortunatamente, i reattori non erano accessibili per il campionamento o la raccolta (il che può essere confermato anche nella Figura 11), e la metodologia prevede la raccolta del reattore che ha la concentrazione più alta. Nel complesso, c'erano quattro reattori, di cui solo due (RT3 e RT4) hanno partecipato a questo studio, rendendo i giorni dopo il fine settimana, giorni in cui gli altri due reattori (RT1 e RT2) sono stati raccolti dal team e con il risultato che non ci sono dati di raccolta da RT3 e RT4. I dati di raccolta sono stati inferiori di circa il 50% rispetto ai dati di campionamento; Ciò potrebbe essere dovuto al fatto che l'efficienza della metodologia è inferiore.
La variazione tra i valori ogni giorno è stata piccola (Figura 11), il che allude a una cultura resiliente che consente di cambiare le condizioni del sistema e rimane stabile. L'Arthrospira maxima cresce preferenzialmente in terreni altamente gassati ad alto pH ed è altamente sensibile all'inibizione dell'NH3 15, il che è coerente con i risultati mostrati nella Figura 8. La calibrazione eseguita nell'agosto 2020 è illustrata nella Figura 13.
Revisione post-produzione e sottoprodotti
Al fine di esaminare il potenziale di questo gas di ridurre le emissioni nocive per l'ambiente, è stato eseguito un rapporto completo da parte di una società esterna, in cui si affermava che il biometano prodotto con questa tecnologia ha ridotto le emissioni totali dirette di CO2 dell'84%, rispetto all'utilizzo del biogas non purificato direttamente dal digestore anaerobico. Inoltre, se analizzata attraverso un'analisi del ciclo di vita dell'elettricità generata sia dal biogas grezzo che dal biometano purificato, la capacità termica complessiva che il biometano era in grado di fornire era superiore di 23.000 kJ rispetto alla capacità termica del biogas grezzo.
Infine, un sottoprodotto di questo processo di purificazione è la microalga raccolta, che, una volta essiccata, ha una miriade di applicazioni in altri settori, il che potrebbe aggiungere più valore al metodo e rendere il processo economicamente vantaggioso26. Ad esempio, è stato condotto uno studio sulle colture di basilico per valutare parametri come il numero di foglie, il peso fresco e secco dei germogli e il peso fresco delle foglie quando si utilizza biomassa essiccata di Scenedesmus rispetto a un normale fertilizzante inorganico; Hanno trovato risultati comparabili in questi criteri sia nella biomassa che nei fertilizzanti27. Risultati simili sono stati riscontrati in un altro studio in cui sono state confrontate la crescita di quattro piante coltivate commerciali utilizzando diverse concentrazioni di un fertilizzante a base di biomassa algale sospesa in acqua; Anche a basse concentrazioni (20%) di fertilizzante, le colture hanno raggiunto la massima crescita, in modo paragonabile ai fertilizzanti chimici28.
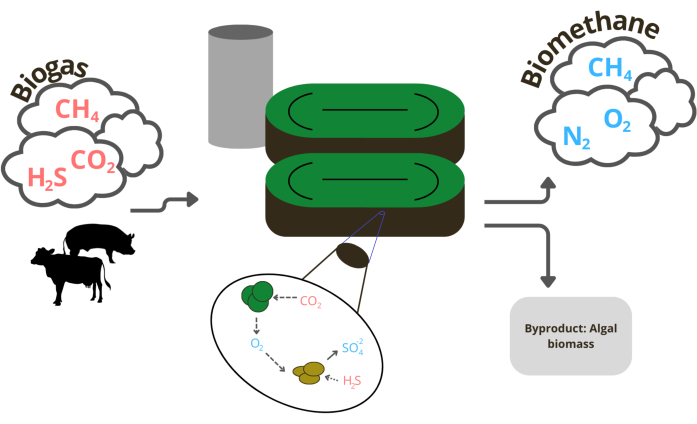
Figura 1: Rappresentazione visiva del processo biologico che avviene nella purificazione del biogas utilizzando microalghe Fare clic qui per visualizzare una versione più grande di questa figura.
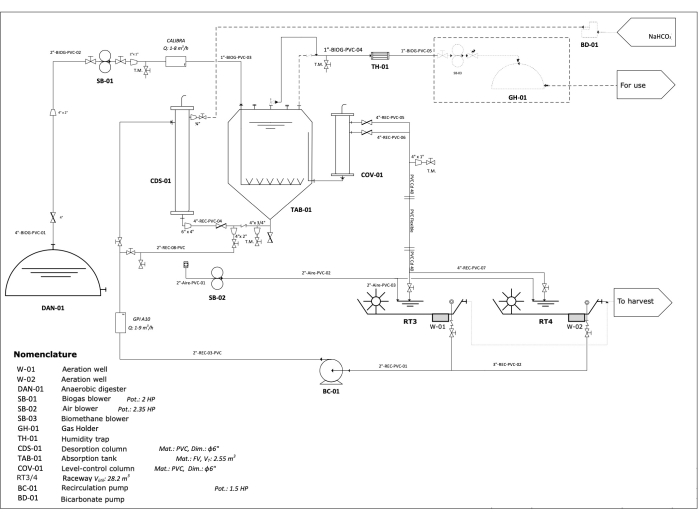
Figura 2: Diagramma P&ID per il sistema descritto nel protocollo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Fotografia degli HRAP utilizzati durante la sperimentazione. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Serbatoio di assorbimento. (A) Fotografie del terreno di coltura e degli ingressi del biogas al serbatoio di assorbimento. (B) Vista anteriore e posteriore del serbatoio di assorbimento. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Brevi test esplorativi in RT3 per determinare l'efficienza L/G. Il verde scuro corrisponde a CH4, il verde corrisponde a CO2, il rosa chiaro corrisponde a O2 e il rosa scuro corrisponde a N2. pH medio 9,2435; Ingresso liquido 60-100 L/min; Ingresso gas 50-120 L/min. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Brevi test esplorativi in RT4 per determinare l'efficienza L/G. Il rosa scuro corrisponde a N2, il rosa chiaro corrisponde a O2, il verde scuro corrisponde a CO2 e il verde chiaro corrisponde a CH4. pH medio 9,95; Ingresso liquido 116-118 L/min; Ingresso gas 35-75 L/min. Fare clic qui per visualizzare una versione più grande di questa figura.
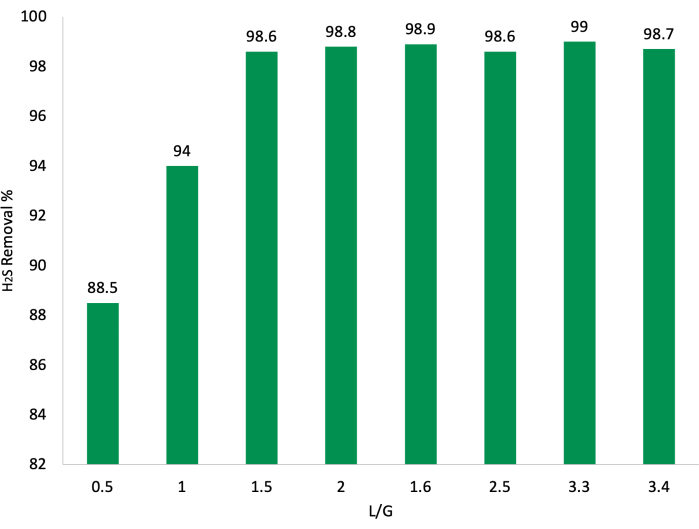
Figura 7: Confronto di tutte le percentuali di rimozione di H2S in ciascun L/G durante le brevi prove esplorative. Gli L/G di 0,5, 1, 1,5 e 2 corrispondono a RT3 e 1,6, 2,5, 3,3 e 3,4 a RT4. Fare clic qui per visualizzare una versione più grande di questa figura.
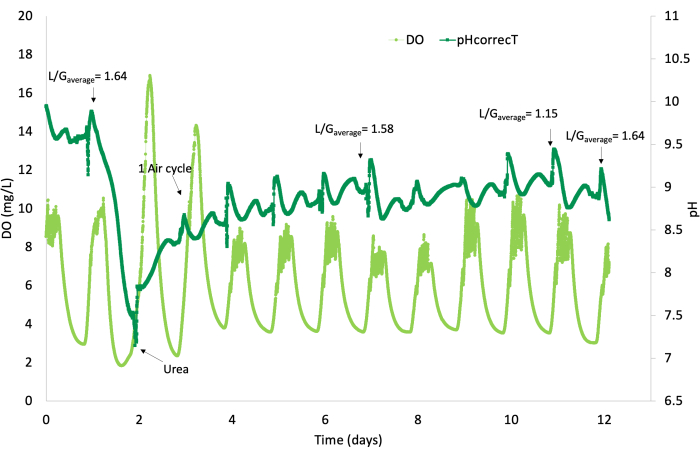
Figura 8: Profilo pH e OD. Profilo pH (verde scuro) e DO (verde chiaro) per RT4 tra il 28 settembre e il 10 ottobre 2020. Ingresso liquido 75-118 L/min; Ingresso gas 57-75 L/min. Concentrazioni medie di alimentazione per ciascun gas: CH4- 60%vol, H2S - 2400 ppmv, CO2- 34%vol, O2- 0,6%vol. Fare clic qui per visualizzare una versione più grande di questa figura.
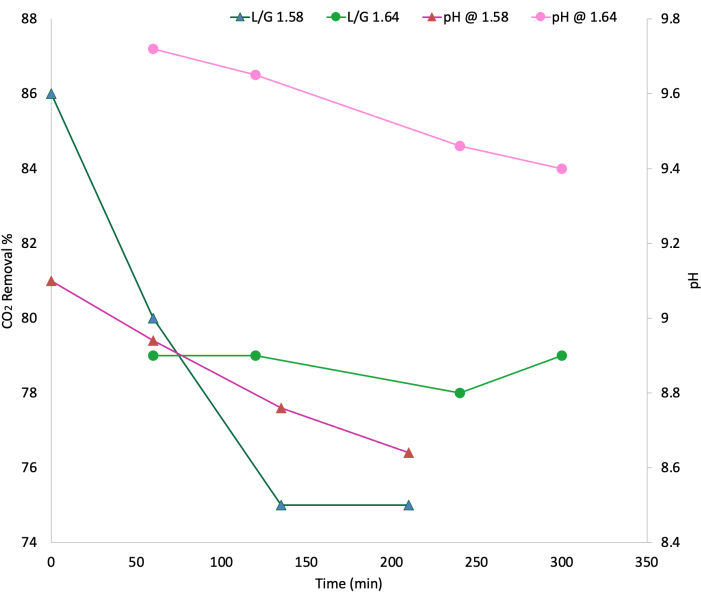
Figura 9: Profili percentuali di rimozione per CO2 in funzione dei livelli di pH e L/G. Il verde corrisponde alle percentuali di rimozione di CO2 ai rapporti L/G: 1,58 (triangoli verde scuro) e 1,64 (cerchi verde chiaro). Il rosa corrisponde ai valori di pH nei rapporti L/G: 1,58 (triangoli rosa scuro) e 1,64 (cerchi rosa chiaro). Ingresso liquido 75-118 L/min; Ingresso gas 57-75 L/min. Concentrazioni medie di alimentazione per ciascun gas: CH4- 60%vol, H2S - 2400 ppmv, CO2- 34%vol, O2- 0,6%vol. Fare clic qui per visualizzare una versione più grande di questa figura.
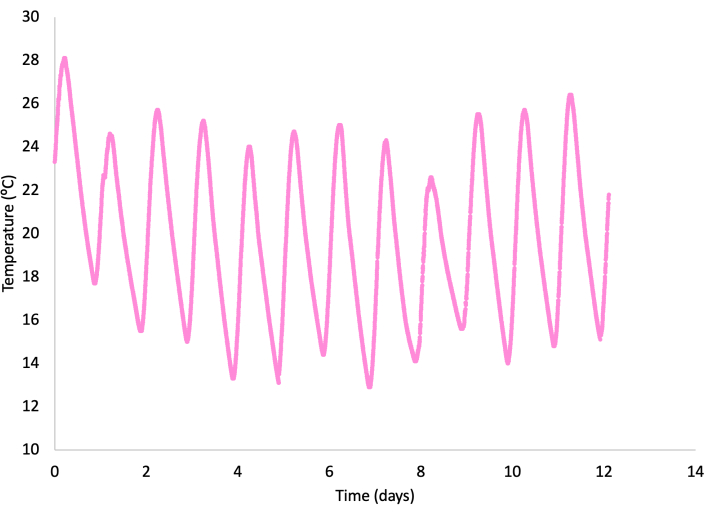
Figura 10: Profilo di temperatura per RT4 tra il 28 settembre e il 10 ottobre 2020. Fare clic qui per visualizzare una versione più grande di questa figura.
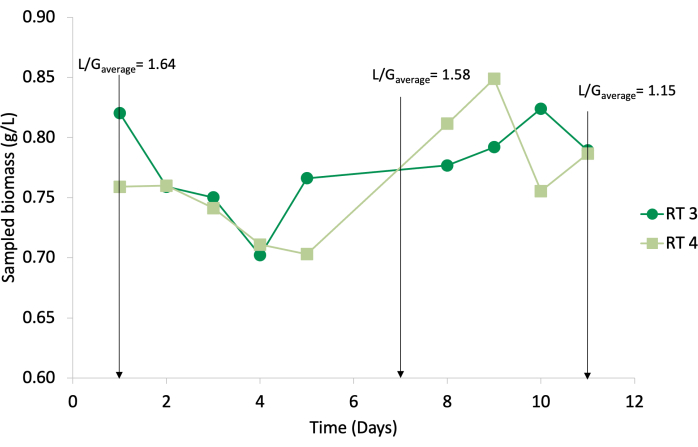
Figura 11: Risultati del campionamento per RT4 (quadrati verde chiaro) e RT3 (cerchi verde scuro) tra il 28 settembre e il 10 ottobre 2020. I rapporti L/G sono indicati con frecce. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 12: Risultati della raccolta per RT4 (quadrati verde chiaro) e RT3 (cerchi verde scuro) tra il 28 settembre e il 10 ottobre 2020. I rapporti L/G sono indicati con frecce. In linee tratteggiate rosse, viene mostrato il periodo in cui non c'è stato raccolto per nessuno dei due reattori. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 13: La curva di calibrazione eseguita nell'agosto 2020, correlando la concentrazione della coltura algale in grammi per litro all'assorbanza a 750 nm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Componente (%vol) | Composizione del biogas ottenuto | Composizione del biogas migliorata | Biometano commerciale Composizione NOM-001-SECRE-2010 |
| CH4 | 64,2 ± 0,8 | 85,1 ± 2,0 | >84 |
| Emissioni di CO2 | 33,8 ± 0,1 | 7.2 ± 1.2 | <3 |
| H2S (ppmv) | 2539 ± 32 | 30,5 ± 4,2 | <6 |
| O2 | 0,3 ± 0,1 | 1,7 ± 0,5 | <0.2 |
Tabella 1: Composizioni comparative del biogas
Discussione
Nel corso degli anni, questa tecnologia algale è stata testata e utilizzata come alternativa alle dure e costose tecniche fisico-chimiche per purificare il biogas. In particolare, il genere Arthrospira è ampiamente utilizzato per questo scopo specifico, insieme alla clorella. Ci sono poche metodologie, tuttavia, che vengono realizzate su scala semi-industriale, il che aggiunge valore a questa procedura.
È fondamentale mantenere concentrazioni di O2 più basse utilizzando il corretto rapporto L/G; Tuttavia, ciò dipende dalla regione in cui verrà applicato questo protocollo. Il contenuto di ossigeno è fortemente regolato nel biometano a causa del rischio di esplosione e corrosione nelle tubazioni. Alcuni paesi dell'Unione Europea richiedono un contenuto a partire dall'1%vol 29,30,31. Il metano, invece, deve essere ad una concentrazione superiore al 65% vol31. In Messico non esiste quasi nessuna regolamentazione per quanto riguarda il biogas e il biometano, poiché è considerato equivalente al gas naturale, dove secondo le norme messicane32, il contenuto minimo di CH4 nel biometano è dell'84% vol ed è consentito un contenuto massimo di O2 dello 0,20% vol.
Inoltre, il pH determina notevolmente la rimozione di CO2 , più di L/G, durante la coltivazione, motivo per cui è fondamentale mantenere un adeguato controllo del pH durante tutta la metodologia, in particolare durante il gorgogliamento del biogas. È importante capire che una volta che la CO2 è solubilizzata nel liquido, c'è un equilibrio chimico in gioco che influisce direttamente sui livelli di pH. Ai livelli di pH intorno ai quali queste colture oscillavano (8,5-9,5), i bicarbonati sono la forma in cui questa molecola è presente, con un leggero aumento dei carbonati all'estremità superiore dell'intervallo di pH33. In questa forma, le microalghe sono anche in grado di metabolizzare il carbonio durante le reazioni oscure della fotosintesi per produrre carboidrati34. Anche la tempistica del gorgogliamento del biogas è importante, di cui si consiglia di mantenere il gorgogliamento diurno. Tuttavia, L/G influisce anche sulla rimozione della CO2 e sul pH, come si può vedere in FIG. 5. La percentuale di rimozione e il pH con un rapporto di 1,58 erano meno coerenti e molto più bassi di quelli registrati per il rapporto di 1,64. Questo comportamento potrebbe essere attribuito a una maggiore assunzione di gas nel rapporto di ricircolo (più gas produce un rapporto più piccolo), che ha abbassato il pH a un ritmo più veloce. Tuttavia, si potrebbe anche sostenere che il pH iniziale per 1,64 era più alto, il che ha favorito il comportamento tamponato delle efficienze di eliminazione della CO2 durante questo test. L/G in questo protocollo è controllato attraverso la quantità di biogas che viene fatto bollire; Tuttavia, altri protocolli variano la velocità del liquido di ricircolo, che è anche un'opzione. Inoltre, non è possibile far bollire il biogas di notte a causa dell'acidificazione della coltura e del metabolismo delle alghe, poiché in questo momento non viene fornita luce artificiale.
Un altro fenomeno che introduce variabilità nella validità dei risultati è il gorgogliamento intermittente dell'aria utilizzato per evitare la sedimentazione della biomassa nei reattori, che impedisce l'inibizione della crescita da parte dell'accumulo di ossigeno. Questo, tuttavia, non può essere evitato se si utilizza questo metodo. Un'alternativa al gorgogliamento dell'aria è l'aggiunta di più ruote a pale per migliorare il movimento lungo la lunghezza del reattore, che potrebbe essere efficace in altri esperimenti. Dall'altro, le estese aree di terreno necessarie per l'installazione dei reattori, nonché il notevole consumo di acqua per avviare e manutenere l'impianto al fine di ottenere una discreta produttività del biometano.
È importante notare che questo processo di campionamento regolare utilizza la curva di calibrazione peso-assorbanza della biomassa (Figura 9), in cui la correlazione tra i dati è quasi 1 (0,9995); Anche se il metodo potrebbe non essere basato su un precedente articolo sulle stesse alghe, il coefficiente di determinazione mostra una forte connessione statistica che questo metodo è affidabile. Inoltre, è importante descrivere l'importanza sia del campionamento che della raccolta in una metodologia come questa. Il campionamento ha permesso un corretto mantenimento della coltura di alghe, mentre la raccolta ha avuto un triplice scopo: in primo luogo, ha evitato l'inibizione della crescita dovuta al sovraffollamento della coltura che poteva causare l'accumulo di ossigeno35; in secondo luogo, il recupero della biomassa algale può portare a ulteriori opportunità economiche; e, infine, ha concesso un'altra opportunità per misurare il trend di crescita della cultura.
Tuttavia, anche la determinazione dei momenti appropriati per la raccolta (che in questo protocollo sono definiti dai risultati del campionamento) è un passaggio critico perché riduce la biomassa nei reattori. Una minore concentrazione di biomassa influisce sulla rimozione del pH e della CO2 come ciclo: in condizioni sfavorevoli del sistema (ad esempio, a valori di pH più bassi), la crescita della biomassa rallenta, il che, a sua volta, riduce la capacità del sistema di eliminare la CO2 poiché c'è meno biomassa per metabolizzarla; una maggiore quantità di CO2 disciolta acidificherebbe i terreni di coltura e chiuderebbe il ciclo36. Molti altri fattori contribuiscono alla crescita del pH e della biomassa, che non dovrebbero essere trascurati in questa eccessiva semplificazione di causa-effetto; La disponibilità di azoto può essere estremamente importante per l'alga Arthrospira maxima, così come le condizioni climatiche come la temperatura e l'intensità luminosa 16,36, che non possono essere controllate in un sistema come questo. Ad esempio, l'aggiunta di urea, come si vede nella Figura 4, è la prova che l'azoto, insieme a valori di pH più elevati, può regolarizzare un sistema di alghe.
Altri limiti di questo metodo sono legati alla produttività della raccolta, che, rispetto al campionamento, è inferiore di circa il 50%, il che ostacola la fattibilità economica del sistema e richiederebbe il miglioramento delle tecniche di filtrazione. I risultati del peso di raccolta sono sovrastimati del 6% (come misurato in seguito seguendo i metodi standard del peso secco), dato che le condizioni di essiccazione in quella parte del protocollo non comportano la completa eliminazione dell'acqua. Per quanto riguarda la biomassa, i risultati del campionamento (compresa la curva di taratura) sono sovrastimati di almeno il 5% a causa dell'eliminazione incompleta dell'acqua nella metodologia19; Tuttavia, poiché l'errore è sistematico, si consiglia di procedere solo con un'analisi termogravimetrica per verificare il contenuto di acqua nella coltura per considerare e apportare le correzioni analitiche ai risultati e alla curva di calibrazione.
Divulgazioni
Conflitto di interessi. Gli autori dichiarano di non avere alcun conflitto di interessi.
Riconoscimenti
Si ringrazia DGAPA UNAM progetto numero IT100423 per il finanziamento parziale. Ringraziamo anche PROAN e GSI per averci permesso di condividere le loro esperienze tecniche sui loro impianti completi di upgrading del biogas fotosintetico. Il supporto tecnico di Pedro Pastor Hernández Guerrero, Carlos Martin Sigala, Juan Francisco Díaz Márquez, Margarita Elizabeth Cisneros Ortiz, Roberto Sotero Briones Méndez e Daniel de los Cobos Vasconcelos è molto apprezzato. Una parte di questa ricerca è stata condotta presso il Laboratorio di Ingegneria Ambientale dell'IIUNAM con certificazione ISO 9001:2015.
Materiali
| Name | Company | Catalog Number | Comments |
| 1" rotameter | CICLOTEC | N/A | |
| 1" rotameter | GPI | A10-LMA100IA1 | |
| Absorption tank | EFISA | Made under previous design | |
| Air blower (2.35 HP) | Elmo Rietschle | 2BH11007AH01 | |
| Biogas blower (2 HP) | Elmo Rietschle | 2BH11007AH01 | |
| Biogas composition measure | Geotech | BIOGAS 5000 | |
| Data-acquisition device | LabJack Co. | U3-LV | |
| Diffuser tubes | Aero-Tube | C3060AR | |
| DO sensor | Applisens | Z10023525 | |
| Dodecahydrated trisodium phosphate | Quimica PIMA | N/A | Fertilizer grade (greenhouse and experior use) |
| Dodecahydrated trisodium phosphate | Fermont | 35963 | Analytical grade (Used in cultures inside the laboratory) |
| Durapore membrane (45 µm) | MerckMillipore | HVLP04700 | |
| Electric motor 1.5 HP | Weg | 00158ET3ERS56C | |
| Ferrous sulfate heptahydrate | Agroquimica Samet | N/A | Fertilizer grade (greenhouse and experior use) |
| Ferrous sulfate heptahydrate | Fermont | 63593 | Analytical grade (Used in cultures inside the laboratory) |
| Geomembrane | GEOSINCERE | N/A | |
| Magnesium sulfate heptahydrate | Tepeyac | N/A | Fertilizer grade (greenhouse and experior use) |
| Magnesium sulfate heptahydrate | Fermont | 63623 | Analytical grade (Used in cultures inside the laboratory) |
| Paddle wheel | GSI | Made under previous design | |
| pH sensor | Van London pHoenix | 715-772-0041 | |
| Portable screen | Rasspberry | Pi 3 B+ | |
| Recirculation centrifugal pump (1.5 HP) | Aquapak | ALY 15 | |
| Sodium bicarbonate | Industria del alcali | N/A | Fertilizer grade (greenhouse and experior use) |
| Sodium bicarbonate | Fermont | 12903 | Analytical grade (Used in cultures inside the laboratory) |
| Sodium chloride | Sal Colima | N/A | Fertilizer grade (greenhouse and experior use) |
| Sodium chloride | Fermont | 24912 | Analytical grade (Used in cultures inside the laboratory) |
| Sodium nitrate | Vitraquim | N/A | Fertilizer grade (greenhouse and experior use) |
| Sodium nitrate | Fermont | 41903 | Analytical grade (Used in cultures inside the laboratory) |
| Storing program (pH, DO) | Python Software Foundation | Python IDLE 2.7 | |
| Tedlar bags | SKC Inc. | 232-25 | |
| Temperature recorder | T&D | TR-52i | |
| UV-Vis Spectrophotometer | ThermoFisher Scientific instrument | GENESYS 10S | |
| Vacuum pump | EVAR | EV-40 |
Riferimenti
- Muñoz, R., Meier, L., Diaz, I., Jeison, D. A review on the state-of-the-art of physical/chemical and biological technologies for biogas upgrading. Rev Environ Sci Biotechnol. 14, 727-759 (2015).
- Karimi, B., Shokrinezhad, B. Air pollution and mortality among infant and children under five years: A systematic review and meta-analysis. Atmospheric Pollut Res. 11 (6), 61-70 (2020).
- Koengkan, M., Fuinhas, J. A., Silva, N. Exploring the capacity of renewable energy consumption to reduce outdoor air pollution death rate in Latin America and the Caribbean region. Environ Sci Pollut Res. 28, 1656-1674 (2021).
- Alvarez-Herranz, A., Balsalobre-Lorente, D., Shahbaz, M., Cantos, J. M. Energy innovation and renewable energy consumption in the correction of air pollution levels. Energy Policy. 105, 386-397 (2017).
- Razmjoo, A., et al. A technical analysis investigating energy sustainability utilizing reliable renewable energy sources to reduce CO2 emissions in a high potential area. Renew Energy. 164, 46-57 (2021).
- Franco-Morgado, M., Tabaco-Angoa, T., Ramírez-García, M. A., González-Sánchez, A. Strategies for decreasing the O2 content in the upgraded biogas purified via microalgae-based technology. J Environ Manage. 279, 111813 (2021).
- Bailón, L., Hinge, J. . Report: Biogas and Bio-Syngas Upgrading. , (2012).
- Persson, M., Jonsson, O., Wellinger, A. Biogas Upgrading to Vehicle Fuel Standards and Grid Injection. Brochure of IEA Task 37. Energy from Biogas and Landfill Gas. , (2006).
- Soreanu, G., Béland, M., Falletta, P. Approaches concerning siloxane removal from biogas -- a review. Canadian Biosystems Engineering. 53, 8.1-8.18 (2011).
- Toro-Huertas, E. I., Franco-Morgado, M., de los Cobos Vasconcelos, D., González-Sánchez, A. Photorespiration in an outdoor alkaline open-photobioreactor used for biogas upgrading. Sci Total Environ. 667, 613-621 (2019).
- Cozma, P., Wukovits, W., Mămăligă, I., Friedl, A., Gavrilescu, M. Modeling and simulation of high pressure water scrubbing technology applied for biogas upgrading. Clean Technol Environ Policy. 17, 373-391 (2015).
- Sheets, J. P., Shah, A. Techno-economic comparison of biogas cleaning for grid injection, compressed natural gas, and biogas-to-methanol conversion technologies: Techno-economic analysis of existing and emerging biogas upgrading technologies. Biofuels Bioprod Biorefining. 12, 412-425 (2018).
- Toledo-Cervantes, A., Estrada, J. M., Lebrero, R., Muñoz, R. A comparative analysis of biogas upgrading technologies: Photosynthetic vs physical/chemical processes. Algal Res. 25, 237-243 (2017).
- Marín, D., et al. Anaerobic digestion of food waste coupled with biogas upgrading in an outdoors algal-bacterial photobioreactor at pilot scale. Fuel. 324, 124554 (2022).
- Bahr, M., Díaz, I., Dominguez, A., González Sánchez, A., Muñoz, R. Microalgal-biotechnology as a platform for an integral biogas upgrading and nutrient removal from anaerobic effluents. Environ Sci Technol. 48 (1), 573-581 (2014).
- Franco-Morgado, M., Alcántara, C., Noyola, A., Muñoz, R., González-Sánchez, A. A study of photosynthetic biogas upgrading based on a high rate algal pond under alkaline conditions: Influence of the illumination regime. Sci Total Environ. 592, 419-425 (2017).
- . Manuel de culture artisanale de spiruline Available from: https://www.scribd.com/document/513003475/Manuel-de-Culture-Artisanale-de-Spiruline (2006)
- Lu, L., Yang, G., Zhu, B., Pan, K. A comparative study on three quantitating methods of microalgal biomass. Indian J Geo-Mar Sci. 46, 2265-2272 (2017).
- Sukarni, S. Thermogravimetric analysis of the combustion of marine microalgae Spirulina platensis and its blend with synthetic waste. Heliyon. 6 (9), e04902 (2020).
- Kundu, S., Zanganeh, J., Moghtaderi, B. A review on understanding explosions from methane-air mixture. J Loss Prev Process Ind. 40, 507-523 (2016).
- Serejo, M. L., et al. Influence of biogas flow rate on biomass composition during the optimization of biogas upgrading in microalgal-bacterial processes. Environ Sci Technol. 49 (5), 3228-3236 (2015).
- Toledo-Cervantes, A., Madrid-Chirinos, C., Cantera, S., Lebrero, R., Muñoz, R. Influence of the gas-liquid flow configuration in the absorption column on photosynthetic biogas upgrading in algal-bacterial photobioreactors. Bioresour Technol. 225, 336-342 (2017).
- Posadas, E., et al. Minimization of biomethane oxygen concentration during biogas upgrading in algal-bacterial photobioreactors. Algal Res. 12, 221-229 (2015).
- González Sánchez, A., FloresMárquez, T. E., Revah, S., Morgan Sagastume, J. M. Enrichment and cultivation of a sulfide-oxidizing bacteria consortium for its deploying in full-scale biogas desulfurization. Biomass Bioenergy. 66, 460-464 (2014).
- González-Sánchez, A., Posten, C. Fate of H2S during the cultivation of Chlorella sp. deployed for biogas upgrading. J Environ Manage. 191, 252-257 (2017).
- Hussain, F., et al. Microalgae an ecofriendly and sustainable wastewater treatment option: Biomass application in biofuel and bio-fertilizer production. A review. Renew Sustain Energy Rev. 137, 137 (2021).
- lvarez-González, A., et al. Can microalgae grown in wastewater reduce the use of inorganic fertilizers. J Environ Manage. 323, 116224 (2022).
- Deepika, P., MubarakAli, D. Production and assessment of microalgal liquid fertilizer for the enhanced growth of four crop plants. Biocatal Agric Biotechnol. 28, 101701 (2020).
- . Perspectives for a european standard on biomethane: a Biogasmax proposal Available from: https://trimis.ec.europa.eu/sites/default/files/project/documents/20120601_135059_69928_d3_8_new_lmcu_bgx_eu_standard_14dec10_vf__077238500_0948_26012011.pdf (2010)
- . Biomethane - Oxygen Content Assessment Available from: https://www.gasnetworks.ie/docs/corporate/gas-regulation/Oxygen-concentration-report-17985-AI-RPT-001-Rev-5-Biomethane-review-Penspen.pdf (2018)
- . European biomethane standards for grid injection and vehicle fuel use Available from: https://www.biosurf.eu/wordpress/wp-content/uploads/2015/06/9.-Arthur_Wellinger.pdf (2017)
- . NORMA Oficial Mexicana NOM-001-SECRE-2010, Especificaciones del gas natural (cancela y sustituye a la NOM-001-SECRE-2003, Calidad del gas natural y la NOM-EM-002-SECRE-2009, Calidad del gas natural durante el periodo de emergencia severa) Available from: https://www.dof.gob.mx/normasOficiales/3997/sener/sener.html (2010)
- Sharifian, R., Wagterveld, R. M., Digdaya, I. A., Xiang, C., Vermaas, D. A. Electrochemical carbon dioxide capture to close the carbon cycle. Energy Environ Sci. 14, 781-814 (2021).
- Masojídek, J., Torzillo, G., Koblížek, M. Photosynthesis in Microalgae. Handbook of Microalgal Culture. , (2013).
- Rendal, C., Witt, J., Preuss, T. G., Ashauer, R. A framework for algae modeling in regulatory risk assessment. Environ Toxicol Chem. 42 (8), 1823-1838 (2023).
- Alami, A. H., Alasad, S., Ali, M., Alshamsi, M. Investigating algae for CO2 capture and accumulation and simultaneous production of biomass for biodiesel production. Sci Total Environ. 759, 143529 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon