Method Article
Misurazione della vitalità embrionale e delle dimensioni della covata in Caenorhabditis elegans
In questo articolo
Riepilogo
Qui, presentiamo un metodo generale per determinare la vitalità embrionale e il numero totale di embrioni prodotti (covata) utilizzando l'organismo modello C. elegans.
Abstract
Caenorhabditis elegans è un eccellente organismo modello per lo studio della meiosi, della fecondazione e dello sviluppo embrionale. I C. elegans esistono come ermafroditi autofecondanti, che producono grandi nidiate di progenie: quando sono presenti maschi, possono produrre nidiate ancora più grandi di progenie incrociata. Gli errori nella meiosi, nella fecondazione e nell'embriogenesi possono essere rapidamente valutati come fenotipi di sterilità, ridotta fertilità o letalità embrionale. Questo articolo descrive un metodo per determinare la vitalità embrionale e la dimensione della covata in C. elegans. Dimostriamo come impostare questo test scegliendo un verme su una singola piastra di Youngren modificata, solo bacto-peptone (MYOB), stabiliamo il lasso di tempo appropriato per contare la progenie vitale e gli embrioni non vitali e spieghiamo come contare accuratamente campioni di vermi vivi. Questa tecnica può essere utilizzata per determinare la vitalità negli ermafroditi autofecondanti e nella fecondazione incrociata mediante coppie di accoppiamento. Questi esperimenti relativamente semplici sono facilmente adottabili per i nuovi ricercatori, come studenti universitari e studenti laureati del primo anno.
Introduzione
La riproduzione sessuale negli organismi eucarioti richiede la produzione di gameti funzionali che si fondono per formare un embrione attraverso il processo di fecondazione. I gameti materni e paterni, gli ovuli (ovuli) e gli spermatozoi vengono creati attraverso la divisione cellulare specializzata e i processi di differenziazione della meiosi e della gametogenesi1. La meiosi inizia con una singola cellula diploide e termina con la formazione di cellule figlie che contengono metà del numero di cromosomi della cellula parentale originale. Dalla riduzione della ploidia al rimescolamento del materiale genetico attraverso l'assortimento indipendente e la ricombinazione crossover, la meiosi svolge molteplici funzioni importanti1. Gli errori all'interno della meiosi possono provocare aneuploidia, in cui ci sono troppi o troppo pochi cromosomi all'interno di un gamete. L'incidenza di aneuploidie ha un enorme impatto sulla salute umana, poiché gli squilibri cromosomici sono una delle principali cause di aborti spontanei e disturbi dello sviluppo come la sindrome di Down e la sindrome di Edwards2.
La fecondazione è il processo mediante il quale i gameti materni e paterni si fondono per generare un nuovo organismo3. Il riconoscimento gamete-gamete è facilitato dalle proteine sulla superficie del gamete3. Gli errori con la compatibilità dei gameti portano alla sterilità poiché la fusione di spermatozoi e ovuli non è in grado di procedere. La fusione dello sperma con un ovocita innesca una serie di eventi che portano alla corretta formazione di un embrione attivo che può iniziare il viaggio di sviluppo da un embrione unicellulare a un organismo multicellulare completamente funzionale attraverso divisioni mitotiche4. Durante l'embriogenesi, gli eventi molecolari che regolano lo sviluppo devono essere strettamente regolati e precisamente programmati per consentire una corretta crescita dell'organismo5. Una corretta differenziazione cellulare durante lo sviluppo precoce è fondamentale quando l'organismo passa da un embrione pluripotente a un organismo a tutti gli effetti. A causa della complessità di questi eventi, le interruzioni possono portare a difetti dello sviluppo che si traducono in letalità embrionale.
Caenorhabditis elegans è un eccellente organismo modello per studiare la meiosi, la fecondazione e lo sviluppo embrionale. C. elegans è un nematode trasparente che ha due sessi, maschi ed ermafroditi. C. elegans ermafroditi, che sono capaci di autofecondazione, sono il sesso predominante 6,7. La gonade ermafrodita produce prima spermatozoi durante il quarto stadio larvale (L4), che sono immagazzinati nella spermateca. Nella transizione da L4 all'età adulta, la linea germinale passa alla produzione di ovociti, che vengono poi fecondati attraverso lo sperma immagazzinato. I maschi, che nascono negli ermafroditi ad un tasso inferiore allo 0,2%, producono solo spermatozoi e possono accoppiarsi con ermafroditi. Dopo la fecondazione incrociata, gli spermatozoi maschili superano gli spermatozoi ermafroditi nella fecondazione degli ovociti8. Ciò consente il mantenimento relativamente facile dei mutanti omozigoti attraverso ceppi autofecondanti e manipolazioni genetiche attraverso incroci genetici. I due sessi consentono studi che esplorano le differenze tra meiosi nelle linee germinali maschili e femminili. Inoltre, a causa della natura trasparente di C. elegans e delle sue uova, i processi di meiosi, gametogenesi, fecondazione ed embriogenesi possono essere studiati in animali vivi e intatti utilizzando tecniche di imaging a fluorescenza.
Quando si analizzano nuove mutazioni in geni che possono svolgere un ruolo nella meiosi, nella fecondazione e / o nello sviluppo embrionale in C. elegans, un primo passo cruciale è determinare la vitalità embrionale e le dimensioni della covata poiché gli errori in questi processi spesso portano a un fallimento o a una riduzione della produzione di progenie vitale. Questo documento descrive un protocollo per valutare la fertilità, la vitalità embrionale e le dimensioni della covata da ermafroditi autofecondanti o incroci tra ermafroditi e maschi. Mentre questo test classico è stato utilizzato in molti studi su C. elegans , forniamo un protocollo standardizzato per l'impostazione e la quantificazione accurata. In questo protocollo, singoli vermi o coppie maschio/ermafrodita sono isolati per consentire l'accoppiamento e la produzione di prole. La produzione e la vitalità della progenie vengono osservate per una serie di giorni per determinare il numero di progenie vitale e di embrioni non vitali. A conclusione dell'esperimento, le singole nidiate vengono analizzate per calcolare la percentuale di vitalità embrionale e la dimensione totale della covata.
Protocollo
NOTA: vedere la tabella dei materiali per i dettagli su tutti i materiali utilizzati in questo protocollo.
1. Preparazione di lastre sperimentali
- Preparare piastre di Petri di diametro 35 mm con mezzi Youngren modificati, solo bacto-peptone (MYOB). Per preparare le piastre MIOB, aggiungere 20 g di Bacto agar, 2 g di NaCl, 0,55 g di Trizma-HCl, 0,24 g di Trizma-OH, 3,1 g di Bacto peptone e 1,6 ml di colesterolo a 1 L di ddH2O e autoclave per 40 minuti a 121 °C. Lasciare raffreddare a 55 °C e, con tecnica sterile, versare 4 ml di mezzo fuso in ciascuna capsula di Petri da 35 mm.
NOTA: Un litro di MYOB produce ~ 250 piastre, che possono essere conservate a 4 ° C per un massimo di 6 mesi. Si consiglia un minimo di 10 individui per replica con tre set di repliche per ogni ceppo. - Utilizzando la tecnica sterile, seminare le piastre con una piccola macchia (circa 50 μL) di batteri OP50 nel mezzo della piastra.
NOTA: I piccoli prati sono particolarmente importanti per valutare la fertilizzazione incrociata poiché il punto più piccolo porta a maggiori incontri tra maschi ed ermafroditi, aumentando così la possibilità di accoppiamento.
2. Saggi di vitalità embrionale (autofecondazione ermafrodita)
- Giorno 1
- Etichettare il retro di ogni piatto. Assicurati di tenere traccia di ogni piastra e dei rispettivi vermi durante l'esperimento.
NOTA: Tecnica di etichettatura preferita-Giorno 1: verme 1, Giorno 1: worm 2, ... and so on. - Trasferire un singolo ermafrodito stadio L4 su ogni piastra. Assicurarsi che nessun embrione o altro verme venga trasferito sulla piastra. Lasciare che i vermi diventino adulti e deporre l'autoprogenie per 24 ore alla temperatura di coltura standard di 20 °C. Segna questi piatti il giorno 3.
NOTA: La temperatura degli esperimenti può essere alterata in caso di mutazioni sensibili alla temperatura. Per le mutazioni sensibili alla temperatura, i saggi di vitalità embrionale devono essere eseguiti sia alla temperatura permissiva (15-16 °C) che a quella non permissiva (24-26 °C).
- Etichettare il retro di ogni piatto. Assicurati di tenere traccia di ogni piastra e dei rispettivi vermi durante l'esperimento.
- Giorno 2
- Etichetta un set di nuove piastre: Giorno 2: worm 1, Giorno 2: worm 2, ... and so on.
- Trasferire i singoli vermi del giorno 1 sulle nuove piastre.
NOTA: Questi vermi dovrebbero aver raggiunto l'età adulta e i vermi selvatici dovrebbero aver già iniziato a deporre embrioni. - Lasciare che i vermi depongano embrioni per 24 ore a 20 °C o altra temperatura appropriata. Segna questi piatti il giorno 4.
- Giorno 3
- Etichettare un set di nuovi piatti. Giorno 3: verme 1, Giorno 3: verme 2, ... and so on.
- Trasferire il giorno 2 singoli vermi su nuove piastre. Lasciare deporre la prole per 24 ore a 20 °C o altra temperatura appropriata. Segna questi piatti il giorno 5.
NOTA: In caso di temperature più basse, i tempi di schiusa saranno aumentati. Regolati di conseguenza. - Disegna un motivo a griglia su un coperchio da 35 mm usando un pennarello fine. Posizionare il coperchio a griglia sotto la piastra di prova per il conteggio per tenere traccia dei vermi precedentemente contati (Figura 1A-B).
- Utilizzando un contatore di cellule differenziali, segnare le piastre del giorno 1 per la presenza o l'assenza di progenie. Conta le larve vive e gli embrioni non schiusi.
NOTA: A questo punto, è trascorso un tempo sufficiente per cui qualsiasi embrione vitale dovrebbe essersi schiuso. Tutti gli embrioni non nati sono presunti morti. - All'interno di un singolo quadrato, contare gli embrioni non schiusi e le larve vive che si trovano interamente all'interno del quadrato (Figura 1C-F).
- Per i worm che si trovano sui bordi quadrati, contare in base alla posizione della testa del verme. Contare i vermi con teste che toccano i bordi superiore e sinistro del quadrato (non contare quelli che toccano i bordi inferiore o destro; Figura 1D). Non contare gli ovociti non fecondati per questo test (Figura 1F).
- Utilizzando un contatore di cellule differenziali, segnare le piastre del giorno 1 per la presenza o l'assenza di progenie. Conta le larve vive e gli embrioni non schiusi.
- Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio.
- Giorno 4
- Segnare le piastre del giorno 2 contando le larve vive e gli embrioni non schiusi, come descritto al punto 2.3.3.1. Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio.
- Giorno 5
- Segnare le piastre del giorno 3 contando le larve vive e gli embrioni non schiusi, come descritto al punto 2.3.3.1. Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio. Analizzare i dati ottenuti utilizzando il metodo descritto nell'analisi dei dati.
NOTA: Alcuni mutanti genetici possono avere un ciclo riproduttivo ritardato o esteso. Monitorare i singoli ceppi per la deposizione continua degli embrioni oltre le piastre del giorno 3. Se la produzione di embrioni non è cessata entro il giorno 4, continuare a trasferire gli adulti a nuove piastre.
- Segnare le piastre del giorno 3 contando le larve vive e gli embrioni non schiusi, come descritto al punto 2.3.3.1. Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio. Analizzare i dati ottenuti utilizzando il metodo descritto nell'analisi dei dati.
3. Saggi di vitalità embrionale (cross-fertilizzazione maschio/ermafrodita)
- Giorno 1
- Etichettare il retro di ogni piatto. Assicurati di tenere traccia di ogni piastra e dei rispettivi vermi durante l'esperimento.
- Trasferire un singolo verme ermafrodita L4 su ogni piastra. Assicurarsi che nessun embrione o altro verme venga trasferito sulla piastra.
NOTA: I ceppi femminizzati, come i mutanti con perdita di funzione di fog-2 , che non producono spermatozoi, possono essere utilizzati al posto degli ermafroditi. - Trasferire un singolo verme maschio L4 su ciascuna piastra marcata contenente un ermafrodita L4. Assicurarsi che nessun embrione o altro verme venga trasferito sulla piastra.
NOTA: Ceppi come i maschi della variante plg-1 possono essere utilizzati per identificare se l'accoppiamento è avvenuto, poiché questi maschi depositano un tappo copulatore sulla vulva ermafrodita dopo l'accoppiamento. - Lasciare che i vermi si accoppiano e depongono la prole per 24 ore a 20 °C, o ad altra temperatura appropriata. Segna queste piastre per le larve vive rispetto agli embrioni non schiusi il giorno 3.
- Giorno 2
- Etichettare un set di nuove piastre e trasferire i vermi, come nel giorno 2 sopra. In questo caso, assicurati di trasferire sia l'ermafrodita che il maschio su nuove piastre. Assicurarsi che l'ermafrodita abbia raggiunto l'età adulta.
- Lasciare deporre gli ermafroditi per 24 ore a 20 °C, o ad altra temperatura appropriata. Segna queste piastre per larve vive rispetto agli embrioni non nati il giorno 4.
- Giorno 3
- Etichettare una serie di nuove piastre e trasferire i vermi, come nel giorno 3 sopra. Assicurati di trasferire sia l'ermafrodita che il maschio su nuove piastre.
- Lasciare deporre la prole per 24 ore a 20 °C o ad altra temperatura appropriata. Assegna un punteggio a queste piastre per embrioni vivi rispetto a quelli non nati il giorno 5.
- Utilizzando un contatore differenziale di cellule, contare le larve vive e gli embrioni non schiusi dalle piastre del giorno 1, come descritto al punto 2.3.3.1.
NOTA: Non gettare le piastre, poiché sono necessarie per il giorno 4. - Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio.
- Giorno 4
- Contare la progenie viva e gli embrioni non nati dalle piastre del giorno 2, come descritto al punto 2.3.3.1. Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio.
- Controlla i piatti del giorno 1 per i maschi. Se l'accoppiamento è avvenuto, il rapporto genetico atteso tra ermafroditi e maschi dovrebbe essere 50:50. Se le piastre del giorno 1 non contengono maschi, l'accoppiamento tra il maschio e l'ermafrodito non si è verificato. Scartare questa coppia di accoppiamento e registrare questa osservazione nel quaderno di laboratorio.
- Giorno 5
- Contare le larve vive e gli embrioni non nati dalle piastre del giorno 3, come descritto al punto 2.3.3.1. Registrare il numero di larve vive ed embrioni non nati in un quaderno di laboratorio. Analizzare i dati ottenuti utilizzando i metodi descritti nell'analisi dei dati.
4. Analisi dei dati
- Calcolare la percentuale di vitalità embrionale di una data replica biologica di un ceppo utilizzando l'equazione (1).
NOTA: Il numero di progenie viva e di embrioni non nati è ottenuto sommando il conteggio giornaliero durante il periodo sperimentale.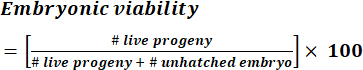 (1)
(1) - Calcola la dimensione della covata per verme di un dato ceppo sommando il numero di progenie (embrioni e larve non schiusi) prodotte dall'ermafrodita genitore. Calcolare la dimensione media della covata usando l'equazione (2).
 (2)
(2) - Riportare la percentuale di vitalità embrionale e la dimensione media della covata con la deviazione media e standard tra le repliche biologiche. Eseguire il t-test di Student confrontando i dati di controllo e sperimentali.
Risultati
Abbiamo eseguito saggi di vitalità embrionale e dimensionamento della covata su N2 (wild type) e su due ceppi che ospitano mutazioni nei geni coinvolti nella meiosi, him-5 (e1490) e spo-11 (ok79). Poiché sia him-5 che spo-11 svolgono un ruolo nella formazione del crossover meiotico, le mutazioni in questi due geni provocano la formazione di gameti aneuploidi. Questo test di vitalità embrionale per N2 ha prodotto una percentuale di vitalità del 98,9%, mentre sia him-5 (e1490) che spo-11 (ok79) hanno mostrato una riduzione della vitalità della progenie con una percentuale rispettivamente del 74,9% e dello 0,8% (Figura 2A; p < 0,0005). Questi risultati sono coerenti con i risultati precedentemente pubblicati 7,9. La dimensione media della covata di N2, him-5 (e1490) e spo-11 (ok79) è stata determinata rispettivamente in 217, 105 e 219 (Figura 2B). Coerentemente con le pubblicazioni precedenti, him-5 (e1490) ha una dimensione della covata significativamente ridotta rispetto al tipo selvatico, mentre spo-11 (ok79) non 7,9.
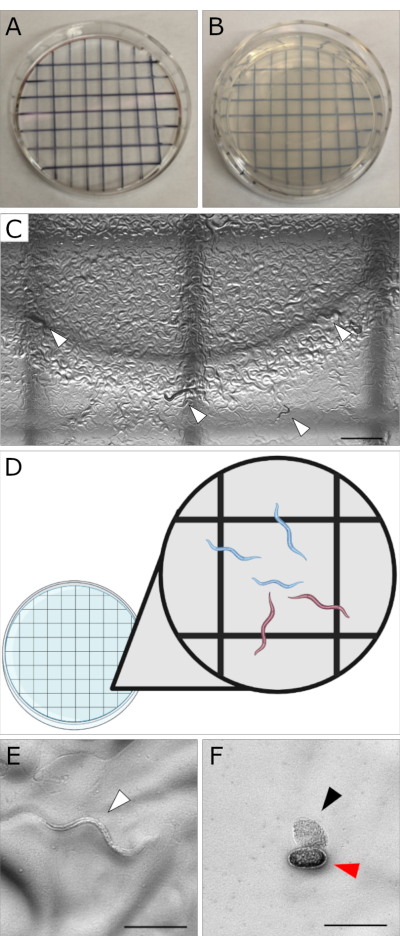
Figura 1: Dimostrazione dell'impostazione del conteggio e della morfologia dell'embrione su piastre . (A) Immagine di un coperchio con un motivo a griglia tratteggiato disegnato con un temperino fine. (B) Una piastra MYOB da 35 mm con il coperchio modellato sotto per il conteggio. (C) Immagine che mostra un campo visivo a basso ingrandimento (10x) che mostra più caselle della griglia. Le punte di freccia bianche indicano diverse larve all'interno di questo campo visivo. Il conteggio dovrebbe essere fatto ad un ingrandimento maggiore (solo un quadrato in campo) per osservare sia le larve che gli embrioni. Barra della scala = 1.000 μm. (D) Cartone animato del coperchio con il motivo a griglia posto sotto una piastra di 35 mm. L'inserto indica la tecnica corretta per determinare quali larve sono contate in un dato quadrato. Conta dall'alto verso il basso, da sinistra a destra. Conta tutti i vermi che si trovano interamente all'interno del quadrato. I vermi che toccano il confine dovrebbero essere contati in base alla posizione della testa del verme, non alla coda. Contare i worm rivolti verso la griglia corrente o le griglie che sono state precedentemente contate (ad esempio, bordi superiore e sinistro). Non contare i vermi con teste che toccano il bordo inferiore o destro. Dal riquadro, i vermi blu saranno contati mentre i vermi rossi no. (E) Immagine rappresentativa di larve tratteggiate sane di N2 L1 (punta di freccia bianca). (F) Immagine rappresentativa di un ovocita non fecondato (punta di freccia nera) e di un embrione non schiuso (punta di freccia rossa). Gli ovociti non fecondati non devono essere conteggiati per questo test. Barre della scala (E,F) = (100 μm). Nota: Le immagini in C, E e F sono state scattate con un microscopio Zeiss AxioZoom, con una fotocamera collegata allo scopo di dimostrare l'aspetto di larve, embrioni e ovociti su piastre di vermi. Per i saggi di vitalità embrionale, i conteggi vengono effettuati osservando le lastre utilizzando uno stereomicroscopio (senza telecamera). Fare clic qui per visualizzare una versione ingrandita di questa figura.
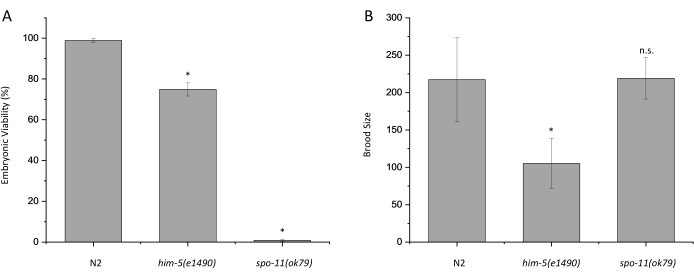
Figura 2: Grafici rappresentativi che illustrano i risultati dei saggi di vitalità embrionale e le dimensioni delle covate. (A) Percentuale di vitalità embrionale di N2, him-5 (e1490) e spo-11 (ok79) a 20 °C. (B) Dimensioni della covata di N2, him-5 (e1490) e spo-11 (ok79) a 20 °C . La progenie di almeno 28 ermafroditi è stata valutata per ogni ceppo. Il numero totale di embrioni non nati più le larve segnate erano N2 = 6302, him-5 (e1490) = 2.945 e spo-11 (ok79) = 7.230. Le barre di errore indicano la deviazione standard in tre singole repliche separate. Statistiche calcolate utilizzando il test t di Student, n.s. = non significativo, *p < 0,0005. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La propagazione delle specie che si riproducono sessualmente richiede la formazione di gameti aploidi (cioè uova e spermatozoi) attraverso la meiosi, che vengono poi unificati alla fecondazione, ripristinando il numero cromosomico diploide e avviando lo sviluppo embrionale. Gli errori in uno qualsiasi di questi processi possono portare a infertilità, letalità embrionale e / o difetti alla nascita. C. elegans è un potente sistema modello per studiare la riproduzione sessuale. Gli effetti delle mutazioni geniche o del knockdown dell'espressione genica (ad esempio, interferenza dell'RNA) possono essere valutati in tempi relativamente brevi e semplici utilizzando i saggi di vitalità embrionale e dimensionamento della covata sopra descritti. Abbiamo utilizzato questi metodi per la caratterizzazione iniziale di geni coinvolti nella segregazione cromosomica meiotica e nella fecondazione/attivazione dell'uovo10,11,12. Una riduzione osservata della vitalità embrionale o delle dimensioni della covata indica un'interruzione della meiosi, della gametogenesi, della fecondazione o dell'embriogenesi.
Poiché la vitalità embrionale e il dimensionamento della covata sono valutati relativamente facilmente attraverso il conteggio della progenie e un semplice calcolo matematico, questi sono esperimenti introduttivi ottimali per i principianti della ricerca sia in laboratorio che in classe. La facilità di allevamento di C. elegans e i vantaggi economici li rendono particolarmente adatti alle lezioni di biologia sperimentale. Gli studenti acquisiscono una preziosa esperienza di ricerca attraverso l'allevamento di C. elegans , imparano a usare microscopi da dissezione e possono porre domande biologiche in un sistema di sviluppo a cui è possibile rispondere in un lasso di tempo relativamente breve (circa 5 giorni con il protocollo descritto in questo articolo).
La tempistica della conta della progenie è molto importante per i saggi di vitalità embrionale. A 20 °C, l'embriogenesi dura circa 16 ore e gli adulti maturi dal punto di vista riproduttivo iniziano a deporre le uova circa 60 ore dopo la schiusa come larve di L1. Poiché il ciclo vitale è rapido, è importante contare la progenie entro la finestra appropriata, lasciando tempo sufficiente agli embrioni per schiudersi, ma prima che la progenie stessa inizi a deporre le uova. È anche importante notare che i periodi di crescita variano a seconda della temperatura. La crescita è circa 2,1 volte più veloce a 24-25 °C che a 15-16 °C e circa 1,3 volte più veloce a 20 °C rispetto a 15-16 °C13. In questo protocollo, raccomandiamo che i conteggi avvengano 48 ore dopo che gli adulti sono stati posti su un piatto fresco. Questo lasso di tempo assicura che tutti gli embrioni con sviluppo wild-type abbiano tempo sufficiente per schiudersi (>16 ore), ma non invecchiano fino al punto di capacità riproduttiva. Può essere necessario estendere i test eseguiti a temperature inferiori a 20 °C (trasferire gli animali per 4 giorni) affinché gli embrioni si schiudano e la progenie cotta raggiunga stadi larvali più facili da osservare tra i batteri sulle piastre MYOB (stadi L3-L4).
Una limitazione ai saggi di vitalità embrionale e al dimensionamento della covata è che il processo di sviluppo specifico che è perturbato non è immediatamente evidente. Tuttavia, questi test iniziali possono essere seguiti con tecniche citologiche per determinare quale processo è interessato. Ad esempio, la dissezione dei vermi adulti per rilasciare la gonade seguita dalla colorazione 4',6-diamidino-2-fenilindolo (DAPI) e un'attenta analisi della morfologia del DNA all'interno della linea germinale possono rivelare se i processi meiotici sono interrotti. Inoltre, la colorazione DAPI degli embrioni può rivelare in quale fase l'embriogenesi si arresta.
In conclusione, abbiamo descritto un protocollo per misurare il numero di embrioni prodotti (covata) e la percentuale di embrioni che sono vitali per vari mutanti di C. elegans. Questo test può essere utilizzato sia per ermafroditi autofecondanti che per incroci maschio/ermafrodita. Con il breve ciclo di vita di C. elegans, questo protocollo può essere completato in meno di 1 settimana. I saggi di vitalità embrionale e le dimensioni delle covate possono essere utilizzati come prime analisi dei geni coinvolti nella meiosi, nella fecondazione o nello sviluppo embrionale e sono protocolli appropriati per ricercatori più avanzati e principianti della ricerca (studenti universitari e laureati del primo anno).
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Il lavoro nel laboratorio Jaramillo-Lambert è supportato dal National Institutes of Health NIGMS R35GM142524. Tutti i ceppi di C. elegans sono stati forniti dal Caenorhabditis Genetics Center, finanziato dal National Institutes of Health, P40 OD010440. La Figura 1D è stata creata utilizzando Biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| 35 mm Petri dishes | Tritech research | T3501 | Semi-stackable, non-vented. |
| Bacto Agar | Becton, Dickinson and Company | 214010 | For MYOB |
| Bacto-Peptone | Gibco | 211677 | For MYOB |
| Cholestrol | Sigma | C8503 | For MYOB |
| Sodium Chloride | J.T. Baker | FW 58.440 | For MYOB |
| Trizma Base | Sigma | T1503 | For MYOB |
| Trizma hydrochloride | Sigma | T3253 | For MYOB |
| Strains | |||
| C. elegans wild type strain | Caenorhabditis Genetics Center | N2 | |
| Escherichia coli | Caenorhabditis Genetics Center | OP50 | |
| him-5(e1490) | Caenorhabditis Genetics Center | DR466 | |
| spo-11(ok79) | Caenorhabditis Genetics Center | AV106 | |
| Equipment/software | |||
| Differential cell counter | Fischer Scientific | 02-670-12 | |
| MicroSoft Excel or Prism | MicroSoft or GraphPad | For recording and creating graphical representations of data. | |
| platinum wire | Tritech research | PT9901 | For making worm picks. 99.5% Platinum, 0.5% Iridium. This comes as 3 ft/pack, which is sufficient for making 36 worm picks (~1 inch platinum wire per pick). |
| Stereomicroscope | Nikon | SMZ-745 | Diascopic base with focus mount, integrated LED module, power cord, 6.7x to 50x Zoom range [WD 115 mm], Widefield Eyepiece C-15x/17 (Note: equivalent stereomicroscopes are available from other manufacturers.) |
| worm pick handle | Tritech research | TWPH1 | For making worm picks. Mount ~1 in platinum wire into worm pick handle. Alternatively, worm picks can be made by mounting platinum wire in a glass Pasteur pipette. |
Riferimenti
- Hillers, K., Jantsch, V., Martinez-Perez, E., Yanowitz, J. Meiosis. WormBook: the Online Review of C. elegans Biology. , (2017).
- O'Connor, C. Chromosomal abnormalities: aneuploidies. Nature Education. 1 (1), 172 (2008).
- Marcello, M. R., Singaravelu, G., Fertilization Singson, A. Fertilization. Advances in Experimental Medicine and Biology. 757, 321-350 (2013).
- Marcello, M. R., Singson, A. Fertilization and the oocyte-to-embryo transition in C. elegans. BMB Reports. 43 (6), 389-399 (2010).
- Robertson, S., Lin, R. The oocyte-to-embryo transition. Advances in Experimental Medicine and Biology. 757, 351-372 (2013).
- Corsi, A. K., Wightman, B., Chalfie, M. A transparent window into biology: A primer on Caenorhabditis elegans. WormBook: the Online Review of C. elegans Biology. , 1-31 (2015).
- Hodgkin, J., Horvitz, H., Brenner, S. Nondisjunction mutants of the nematode CAENORHABDITIS ELEGANS. Genetics. 91 (1), 67-94 (1979).
- Chu, D. S., Shakes, D. C. Spermatogenesis. Advances in Experimental Medicine and Biology. 757, 171-203 (2013).
- Dernburg, A. F., et al. Meiotic recombination in C. elegans initiates by a conserved mechanism and is dispensable for homologous chromosome synapsis. Cell. 94 (3), 387-398 (1998).
- Bhandari, N., et al. Identification of suppressors of top-2 embryonic lethality in Caenorhabditis elegans. G3. 3 (4), 1183-1191 (2020).
- Jaramillo-Lambert, A., Fabritius, A. S., Hansen, T. J., Smith, H. E., Golden, A. The identification of a novel mutant allele of topoisomerase II in Caenorhabditis elegans reveals a unique role in chromosome segregation during spermatogenesis. Genetics. 204 (4), 1407-1422 (2016).
- Jaramillo-Lambert, A., Golden, A. The C-terminus of SPE-11 is required for proper embryonic development in C. elegans. microPublication Biology. , (2020).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-11 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon