Method Article
Un'attività di pianificazione visuospaziale abbinata a sistemi di eye-tracker ed elettroencefalogramma
In questo articolo
Riepilogo
Lo studio della pianificazione cognitiva che combina sistemi EEG e eye-tracking fornisce un approccio multimodale per indagare i meccanismi neurali che mediano il controllo cognitivo e il comportamento diretto all'obiettivo negli esseri umani. Qui, descriviamo un protocollo per studiare il ruolo delle oscillazioni cerebrali e dei movimenti oculari nella pianificazione delle prestazioni.
Abstract
Il processo di pianificazione, caratterizzato dalla capacità di formulare un piano organizzato per raggiungere un obiettivo, è essenziale per il comportamento umano orientato all'obiettivo. Poiché la pianificazione è compromessa in diversi disturbi neuropsichiatrici, l'implementazione di test clinici e sperimentali adeguati per esaminare la pianificazione è fondamentale. A causa della natura dell'implementazione della pianificazione, a cui partecipano diversi domini cognitivi, la valutazione della pianificazione e la progettazione di paradigmi comportamentali accoppiati con metodi di neuroimaging sono sfide attuali nelle neuroscienze cognitive. Un compito di pianificazione è stato valutato in combinazione con un sistema di elettroencefalogramma (EEG) e registrazioni dei movimenti oculari in 27 partecipanti adulti sani. La pianificazione può essere suddivisa in due fasi: una fase di pianificazione mentale in cui una sequenza di passaggi è rappresentata internamente e una fase di esecuzione in cui l'azione motoria viene utilizzata per raggiungere un obiettivo precedentemente pianificato. Il nostro protocollo includeva un compito di pianificazione e un compito di controllo. Il compito di pianificazione prevedeva la risoluzione di 36 prove di labirinto, ognuna delle quali rappresentava una mappa dello zoo. Il compito ha avuto quattro periodi: i) pianificazione, in cui i soggetti sono stati istruiti a pianificare un percorso per visitare le posizioni di quattro animali secondo una serie di regole; ii) manutenzione, in cui i soggetti dovevano conservare nella memoria di lavoro il percorso pianificato; iii) esecuzione, in cui i soggetti hanno utilizzato i movimenti oculari per tracciare il percorso precedentemente pianificato come indicato dal sistema eye-tracker; e iv) risposta, dove i soggetti hanno riportato l'ordine degli animali visitati. Il compito di controllo aveva una struttura simile, ma la componente di pianificazione cognitiva è stata rimossa modificando l'obiettivo del compito. I modelli spaziali e temporali dell'EEG hanno rivelato che la pianificazione induce un aumento graduale e duraturo dell'attività theta frontale-mediana (FMθ) nel tempo. La fonte di questa attività è stata identificata all'interno della corteccia prefrontale mediante analisi della fonte. I nostri risultati hanno suggerito che il paradigma sperimentale che combina sistemi EEG e eye-tracker era ottimale per valutare la pianificazione cognitiva.
Introduzione
Negli ultimi 10 anni, sono state condotte ricerche approfondite per esaminare il ruolo delle dinamiche neurali oscillatorie sia sulla cognizione che sul comportamento. Questi studi hanno stabilito che le interazioni frequenza-specifiche tra regioni corticali specializzate e diffuse svolgono un ruolo cruciale nella cognizione e nel controllo cognitivo 1,2,3. Questo approccio evidenzia la natura ritmica dell'attività cerebrale, che aiuta a coordinare le dinamiche corticali su larga scala e sostiene l'elaborazione cognitiva e il comportamento diretto all'obiettivo 4,5. Ci sono prove sostanziali che dimostrano che le oscillazioni ritmiche nel cervello sono coinvolte in vari processi cognitivi, tra cui la percezione6, l'attentio 7,8,9, il processo decisionale10, la riattivazione della memoria11, la memoria di lavoro12 e il controllo cognitivo13. Sono stati proposti diversi meccanismi oscillatori per guidare il comportamento diretto all'obiettivo, con reti transitorie su larga scala specifiche di frequenza che forniscono un quadro per l'elaborazione cognitiva 1,14,15. Ad esempio, risultati recenti suggeriscono che specifiche bande di frequenza nel cervello possono riflettere un meccanismo di feedback che regola l'attività di picco, fornendo un quadro di riferimento temporale per coordinare l'eccitabilità corticale e la tempistica del picco per produrre il comportamento 16,17,18. Una recensione è fornita da Helfrich e Knight19.
Questo insieme di prove solleva interrogativi su come la corteccia prefrontale (PFC) codifichi i contesti di pianificazione dei compiti e le relative regole comportamentali rilevanti. Da tempo si è pensato che la PFC supporti il controllo cognitivo e il comportamento diretto all'obiettivo attraverso i modelli oscillatori dell'attività neurale che genera, distorcendo selettivamente l'attività neurale in regioni cerebrali distanti e controllando il flusso di informazioni in reti neurali su larga scala20. Inoltre, è stato proposto che le regioni che mostrano sincronia locale abbiano maggiori probabilità di partecipare ad attività interregionali 21,22,23. In particolare, le oscillazioni corticali in banda theta (4-8 Hz), misurate mediante elettroencefalogramma del cuoio capelluto (EEG), sono state proposte come potenziale meccanismo per la trasmissione del controllo top-down attraverso ampie reti13. In particolare, l'attività della banda theta negli esseri umani riflette processi cognitivi di alto livello, come la codifica e il recupero della memoria, la conservazione della memoria di lavoro, il rilevamento di novità, il processo decisionale e il controllo dall'alto verso il basso 12,24,25,26.
In relazione a ciò, Cavanagh e Frank13 hanno proposto due meccanismi sequenziali dei processi di controllo: il riconoscimento della necessità del controllo e l'istanza del controllo. Il riconoscimento della necessità di controllo può essere indicato dall'attività theta della linea mediana frontale (FMθ) originata dalla corteccia prefrontale mediale (mPFC), che è stata descritta in termini di componenti del potenziale correlato all'evento (ERP) che riflettono i processi di controllo correlati alla mPFC in risposta a varie situazioni, come nuove informazioni 27,28,29, requisiti contrastanti di stimolo-risposta 30, feedback di errore31, e rilevamento degli errori32. Questi componenti ERP, che riflettono la necessità di un maggiore controllo cognitivo in presenza di novità, conflitto, punizione o errore, mostrano una firma spettrale comune nella banda theta registrata agli elettrodi della linea mediana frontale 26,27,33,34,35,36,37,38,39,40, 41,42,43,44.
Le risposte EEG dell'attività FMθ mostrano un modello di ripristino di fase e di aumento della potenza nella banda di frequenza theta26. Nonostante i limiti del metodo EEG in termini di risoluzione spaziale, sono state raccolte varie fonti di prove per dimostrare che l'attività di FMθ è generata dalla corteccia cingolata media (MCC)13. Si ritiene che queste dinamiche theta servano come strutture temporali che regolano i processi neuronali della mPFC, che vengono successivamente aumentati in risposta a eventi che richiedono un maggiore controllo26. Ciò è stato stabilito attraverso l'analisi della sorgente 31,33,45,46,47, le registrazioni EEG e la risonanza magnetica funzionale (fMRI) concomitanti48,49 e le registrazioni EEG invasive negli esseri umani50 e nelle scimmie 51,52,53.
Sulla base di queste osservazioni, si ritiene che il theta della linea mediana frontale serva come un meccanismo universale, un linguaggio comune, per l'esecuzione del controllo adattivo in diverse situazioni in cui vi è una mancanza di certezza riguardo alle azioni e ai risultati, come durante la pianificazione. Il paradigma comportamentale che proponiamo in questo protocollo è stato utilizzato per studiare la pianificazione cognitiva e le sue caratteristiche temporali e neurali. Sebbene siano stati riportati vari meccanismi per il controllo cognitivo in altri scenari, l'attuale protocollo ha permesso la recente descrizione della pianificazione e delle sue proprietà neurali e temporali associate54. Il processo cognitivo della pianificazione comprende due fasi distinte: la fase di pianificazione mentale, durante la quale si sviluppa una rappresentazione interna di una sequenza di piani55, e la fase di esecuzione della pianificazione, in cui viene eseguito un insieme di azioni motorie per raggiungere l'obiettivo precedentemente pianificato56. È noto che la pianificazione richiede l'integrazione di vari componenti delle funzioni esecutive, tra cui la memoria di lavoro, il controllo dell'attenzione e l'inibizione della risposta, rendendo difficile la manipolazione sperimentale e la misurazione isolata di questi processi57,58.
Gli studi di neuroimaging sulla pianificazione cognitiva hanno paradigmi comportamentali comunemente usati come la Torre di Londra 59,60,61; Tuttavia, al fine di controllare i fattori confondenti, i compiti utilizzati per lo studio della pianificazione cognitiva possono diventare limitati e artificiali, portando a una minore validità predittiva ed ecologica 62,63,64,65. Per superare questo problema nel campo della neuropsicologia, le situazioni di pianificazione del mondo reale sono state proposte come compiti ecologici62,63. Il sottotest Zoo Map Task nella batteria di valutazione comportamentale della sindrome disesecutiva misura le capacità di pianificazione e organizzazione in modo più naturale e pertinente64,66. Questo test è un test carta e matita che prevede la pianificazione di un percorso per visitare 6 dei 12 luoghi su una mappa dello zoo. I luoghi sono luoghi comuni che si possono trovare in un normale zoo, come una casa per elefanti, una gabbia per leoni, un'area di riposo, una caffetteria, ecc. Ci sono due condizioni che valutano diversi livelli di pianificazione: i) la condizione di formulazione, in cui i soggetti vengono istruiti a pianificare un percorso per visitare sei luoghi nell'ordine di loro scelta ma secondo un insieme di regole; e ii) la condizione di esecuzione, in cui i soggetti sono istruiti a visitare sei luoghi in un ordine specifico e seguendo anche una serie di regole. Queste due condizioni forniscono informazioni sulle capacità di pianificazione in problemi mal strutturati (formulazione) e ben strutturati (esecuzione)67. Il primo si presenta come un compito cognitivo più impegnativo in una situazione aperta perché richiede ai soggetti di sviluppare una strategia logica per raggiungere l'obiettivo. Prima di tracciare un percorso, è necessario ideare una sequenza di operatori; In caso contrario, è probabile che si verifichino errori. D'altra parte, la condizione di esecuzione richiede una minore richiesta cognitiva perché la risoluzione di un compito che implica il rispetto di una specifica strategia imposta richiede solo al soggetto di monitorare l'attuazione del piano formulato per raggiungere l'obiettivo66. D'altra parte, il labirinto di Porteus è un compito ben noto nel campo della psicologia, in particolare nelle aree della psicologia cognitiva e della neuropsicologia, ed è stato ampiamente utilizzato come strumento per valutare vari aspetti della cognizione, come la risoluzione dei problemi e la pianificazione68,69. Il compito del labirinto di Porteus è un compito con carta e matita che inizia con una semplice analisi degli stimoli visivi e diventa sempre più difficile. Il soggetto deve trovare e tracciare il percorso corretto da un punto di partenza a un'uscita (tra diverse opzioni) seguendo regole, come evitare percorsi che si intersecano e vicoli ciechi, e agire il più rapidamente possibile68. Ogni volta che appare un bivio mentre disegnano il percorso, i soggetti prendono decisioni per raggiungere l'obiettivo ed evitare di infrangere le regole date69.
Considerando i limiti e i punti di forza dei compiti comunemente usati ed ecologici, abbiamo progettato il nostro paradigma comportamentale basandoci principalmente sul Compito66 della Mappa dello Zoo e sul Compito del Labirinto di Porteus68. Il paradigma comportamentale si compone di quattro fasi distinte che comprendono il processo cognitivo della pianificazione in uno scenario di vita quotidiana. Queste fasi sono le seguenti: Fase 1, pianificazione, in cui i partecipanti hanno il compito di creare un percorso per visitare varie località su una mappa, garantendo il rispetto delle regole stabilite; Fase 2, manutenzione, in cui i partecipanti sono tenuti a conservare nella memoria di lavoro il percorso pianificato; Fase 3, esecuzione, in cui i partecipanti eseguono il percorso precedentemente pianificato disegnando e monitorando attentamente la sua precisione; e Fase 4, risposta, in cui i partecipanti riportano la sequenza degli animali visitati secondo il percorso54 pianificato. Il nostro paradigma consente di misurare diversi parametri della capacità di pianificazione utilizzando diverse fasi, che riflettono le varie componenti della pianificazione (come la memoria di lavoro, l'attenzione esecutiva e le abilità visuospaziali) in modo più realistico, poiché la mappatura dei percorsi è un evento comune nella vita quotidiana. Inoltre, per controllare i fattori confondenti, il paradigma include un compito di controllo con una struttura di compiti di pianificazione e stimoli equivalenti, che coinvolge le componenti cognitive esecutive coinvolte anche nella pianificazione, ma esclude la componente del processo di pianificazione. Ciò consente la separazione della componente del processo di pianificazione per il confronto sia dei marcatori elettrofisiologici che dei parametri comportamentali54.
Inoltre, l'eye-tracking ha dato un contributo significativo agli studi sulle neuroscienze cognitive fornendo un metodo non invasivo per misurare e analizzare i movimenti oculari, che può fornire preziose informazioni sui processi cognitivi e sui meccanismi neurali alla base della percezione, dell'attenzione e delle funzioni cognitive. La misurazione di diversi tipi di movimenti oculari con un sistema di tracciamento oculare può fornire informazioni preziose sui processi cognitivi e sui meccanismi neurali coinvolti nella pianificazione. Ad esempio, possono essere misurati i seguenti aspetti: fissazioni, che sono i periodi di sguardo stabile durante i quali vengono acquisite informazioni visive70; saccadi, che sono i rapidi movimenti oculari che vengono utilizzati per spostare lo sguardo da un luogo all'altro71; inseguimento regolare, che è un tipo di movimento degli occhi che consente agli occhi di seguire un oggetto in movimento senza intoppi72; microsaccadi, che sono piccoli movimenti oculari rapidi che si verificano anche durante le fissazioni73; e le palpebre, che sono un'azione riflessa che aiuta a mantenere gli occhi lubrificati e a proteggerli da corpi estranei74. Questi movimenti oculari possono fornire informazioni sui processi cognitivi coinvolti nella ricerca visiva, nell'allocazione dell'attenzione70, nel tracciamento visivo72, nella percezione73 e nella memoria di lavoro74, che sono componenti importanti per la pianificazione e il controllo cognitivo.
D'altra parte, recenti studi sul sistema locus coeruleus-norepinefrina (LC-NE) hanno dimostrato il suo ruolo rilevante nel controllo cognitivo75. Il locus coeruleus (LC) proietta in diverse regioni del cervello, come la corteccia cerebrale, l'ippocampo, il talamo, il mesencefalo, il tronco encefalico, il cervelletto e il midollo spinale 76,77,61. Le innervazioni LC-NE particolarmente dense ricevono aree cerebrali PFC associate al controllo cognitivo75. Inoltre, alcuni studi indicano che l'iperattività cronica del sistema LC può contribuire ai sintomi del disturbo maniaco-depressivo, come l'impulsività e l'insonnia. Al contrario, una diminuzione cronica della funzione LC è stata collegata a una ridotta espressione emotiva, una caratteristica prevalente tra i pazienti che soffrono di depressione78. Una risposta iperattiva del locus coeruleus agli stimoli può portare a una risposta eccessiva in individui con disturbi da stress o ansia79. Pertanto, alterazioni nel sistema LC-NE possono contribuire ai sintomi della disregolazione cognitiva e/o emotiva. Tecniche non invasive possono essere utilizzate per esaminare l'attività del locus coeruleus, una delle quali è rappresentata dalle variazioni del diametro della pupilla, che sono per lo più controllate dalla noradrenalina rilasciata dal locus coeruleus. La noradrenalina agisce sul muscolo dilatatore dell'iride stimolando gli alfa-adrenergici e sul nucleo di Edinger-Westphal, che invia segnali al ganglio ciliare e controlla la dilatazione dell'iride attraverso l'attivazione degli alfa-2 adrenocettori postsinaptici 66,80,81,82. Le registrazioni neuronali dirette di LC da scimmie hanno confermato la relazione tra l'attività LC-NE, il diametro della pupilla e le prestazioni cognitive83. La dilatazione della pupilla è stata ripetutamente osservata in risposta a maggiori richieste di elaborazione in diversi compiti cognitivi 71,84,85,86,87.
I marcatori elettrofisiologici del controllo cognitivo combinati con il tracciamento oculare e le registrazioni pupillari potrebbero districare domande cruciali su come il controllo cognitivo e la pianificazione sono implementati nel cervello. L'importanza di utilizzare il nostro protocollo che combina sistemi EEG e eye-tracker è duplice. Da un lato, il controllo cognitivo sembra richiedere la partecipazione dell'attività cerebrale distribuita a precise relazioni temporali, che costituiscono candidati ideali per studiare la funzione della rete cerebrale. D'altra parte, le anomalie in una qualsiasi di queste capacità hanno un grave impatto sul comportamento normale, come potrebbe essere nel caso di una varietà di disturbi cognitivi e neuropsichiatrici, come il disturbo da deficit di attenzione/iperattività88,89, il disturbo depressivo maggiore90,91, il disturbo bipolare91, la schizofrenia92, la demenza frontotemporale93, così come i disturbi dovuti a lesioni frontali94. Inoltre, l'attuale protocollo consente di utilizzare la pupillometria come parametro per confrontare l'attività e le oscillazioni LC-NE utilizzando l'eye-tracking e l'elettroencefalografia. Ciò potrebbe non solo fornire prove della relazione teorica tra LC-NE, pupillometria e marcatori neurali nell'uomo, ma potrebbe anche consentire il monitoraggio della traiettoria di sviluppo delle caratteristiche correlate al sistema LC-NE durante la pianificazione cognitiva. Tuttavia, nel nostro modello, ci siamo concentrati sul verificare se durante la pianificazione fosse presente un modello specifico di saccadi che potesse potenzialmente portare a specifici cambiamenti di oscillazione95. Inoltre, abbiamo utilizzato un sistema di eye-tracker come parte importante dell'esame dell'esecuzione comportamentale di un piano nella fase di esecuzione del nostro paradigma comportamentale.
Per riassumere, questo protocollo potrebbe produrre modelli testabili delle dinamiche della rete cerebrale che potrebbero fungere da piattaforma sia per ulteriori ricerche di base che per eventuali applicazioni cliniche e terapeutiche.
Protocollo
Tutte le procedure di questo protocollo sono state approvate dal comitato di bioetica della Facoltà di Medicina della Pontificia Universidad Católica de Chile e tutti i partecipanti hanno firmato un modulo di consenso informato prima dell'inizio dello studio (numero del progetto di ricerca: 16-251).
1. Reclutamento dei partecipanti
- Reclutare adulti sani destrimani (maschi e femmine) con visione normale o corretta e sottoporli a screening in base ai criteri di inclusione/esclusione.
NOTA: In questo studio sono stati reclutati 27 individui sani di età compresa tra i 19 e i 38 anni che parlavano fluentemente. La dimensione del campione può variare in base al livello di potenza statistica desiderato e la fascia di età può variare a seconda della specifica domanda di ricerca da affrontare. Nel nostro protocollo abbiamo calcolato la dimensione del campione prendendo in considerazione il test statistico del rango con segno di Wilcoxon, una dimensione dell'effetto di 0,7, un livello alfa di 0,05 e una potenza di 0,95, come descritto in Faul et al.96. Abbiamo utilizzato il MINI-International Neuropsychiatric Interview97, applicato da uno psicologo qualificato, per valutare i partecipanti in termini di criteri di inclusione/esclusione. Reclutare solo soggetti destrimani per ridurre la variabilità del segnale EEG perché gli individui mancini potrebbero presentare una diversa distribuzione topografica dell'attività EEG 98,99,100.
2. Preparazione degli stimoli
- Per l'attività di pianificazione, creare una serie di stimoli utilizzando un software di editor di grafica vettoriale (vedi Tabella dei materiali). Per ogni stimolo, progetta un labirinto in scala di grigi che rappresenti una mappa dello zoo. All'interno del labirinto, crea un passaggio e diversi percorsi che conducono alle posizioni degli animali (ad esempio, in questo studio, c'erano quattro posizioni degli animali, vedi Figura 1).
NOTA: In questo studio, abbiamo creato 36 labirinti in cui ogni stimolo consisteva in una mappa dello zoo con un cancello di partenza, quattro immagini di animali situati sul labirinto e diversi percorsi. I percorsi sul labirinto possono o meno portare alle posizioni degli animali. L'uso di stimoli in scala di grigi con contrasto ridotto è spesso preferito per la pupillometria perché riduce la stimolazione dei coni retinici, responsabili della visione dei colori. Questo spostamento dell'enfasi dello stimolo consente una misurazione più sensibile dei cambiamenti nelle dimensioni della pupilla, che si pensa riflettano i cambiamenti nello stato di eccitazione o attenzione. Inoltre, l'uso di stimoli in scala di grigi riduce la variabilità nella misurazione dovuta alle differenze nella visione dei colori tra gli individui101. - Al fine di ottenere diversi livelli di complessità nel compito finale, suddividere gli stimoli in base al numero di soluzioni valide in conformità con l'obiettivo e le regole stabilite (in particolare, l'obiettivo è pianificare un percorso per visitare i luoghi degli animali). Il numero di soluzioni valide si riferisce al numero di percorsi che è possibile pianificare seguendo le regole (vedere le regole nella Figura 2 e il passaggio 5.12.1.). Classificare gli stimoli con più di cinque possibili soluzioni come "facili" e quelli con cinque o meno possibili soluzioni come "difficili". Quindi, crea un numero uguale di prove per ogni categoria.
NOTA: In alternativa, richiedere agli autori gli stimoli creati per Domic-Siede et al.54 , poiché tali stimoli sono stati creati seguendo queste istruzioni. Considera che tutti i materiali sono disponibili su richiesta, ma le specifiche sono dettagliate qui. In questo studio, abbiamo creato 18 prove facili e 18 prove difficili. Valutare le differenze nei livelli di difficoltà a livello comportamentale ed elettrofisiologico è importante perché aiuterà a determinare se si sta misurando la domanda cognitiva/sforzo cognitivo/difficoltà o gli aspetti intrinseci della pianificazione cognitiva (vedi risultati rappresentativi e sezioni di discussione). - Per l'attività di controllo, utilizzare la stessa struttura dell'attività di pianificazione (periodo di valutazione, manutenzione, esecuzione, risposta, vedere la Figura 2) e utilizzare gli stessi stimoli creati per l'attività di pianificazione, ma aggiungere una linea tracciata che rappresenta un percorso segnato per visitare la sequenza di posizioni degli animali a partire dal cancello fino all'ultima posizione (vedere la Figura 1B). Rendi il percorso contrassegnato di un colore leggermente più scuro rispetto ai percorsi principali del labirinto, con un basso contrasto valutato utilizzando un luxmetro (vedi passaggio 2.4).
NOTA: L'idea alla base di questo è quella di mantenere le caratteristiche psicofisiche di entrambe le condizioni (pianificazione e compiti di controllo) il più simili possibile. I percorsi tracciati dei labirinti possono seguire o meno le regole (vedi sezione 5 del protocollo per maggiori dettagli sulle istruzioni fornite ai partecipanti). In questo studio, metà degli stimoli aveva una sequenza di visita corretta seguendo le regole, mentre l'altra metà presentava errori (come utilizzare lo stesso percorso due volte o attraversare vicoli ciechi, vedi passaggio 5.12.1 e passaggio 5.12.3 e Figura 2). - Valutare l'illuminamento degli stimoli utilizzando un luxmetro posizionato nella mentoniera che i soggetti utilizzeranno (vedi step 4.5 e step 4.6) e alla stessa distanza dallo schermo. Ogni stimolo di ogni condizione produce un valore di lux. Registra manualmente ogni valore per ulteriori analisi.
NOTA: Non sono previste differenze di illuminamento tra le condizioni (vedere il passaggio 4.6). In caso contrario, controlla il contrasto degli stimoli. Questo è rilevante se il diametro della pupilla sarà misurato102. - Crea uno stimolo che rappresenti il feedback corretto (pollice in su quando corretto) e un altro stimolo che rappresenti un feedback errato (pollice in giù quando non corretto) utilizzando anche un editor grafico vettoriale (vedi Tabella dei materiali) (Figura 2).

Figura 1: Stimoli del compito sperimentale e di controllo. Vengono mostrati esempi illustrativi degli stimoli (A) di pianificazione e (B) di controllo. Gli stimoli rappresentano una mappa dello zoo composta da un cancello, quattro posizioni di animali in luoghi diversi e diversi percorsi. Gli stimoli per entrambe le condizioni erano simili; l'unica differenza era che per il compito di controllo, (B) gli stimoli avevano una linea segnata che indicava un percorso già esistente (linea nera qui a scopo illustrativo). Questa linea negli stimoli di controllo reali era leggermente più scura, con un basso contrasto controllato dall'illuminamento (vedi passaggio 2.4). Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
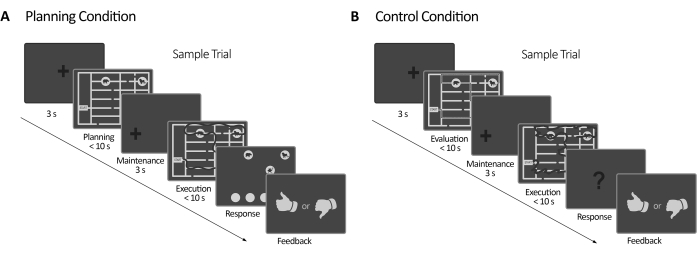
Figura 2: Disegno sperimentale. (A) Pianificazione della prova di attività. Le prove in questa condizione sono iniziate con una croce di fissazione di 3 s. Quindi, i partecipanti sono stati istruiti a pianificare un percorso per visitare tutti e quattro i luoghi degli animali seguendo una serie di regole (massimo 10 secondi). Successivamente, è apparsa una croce di fissazione spostata (3 s), seguita dalla comparsa del labirinto di nuovo. In questo periodo (esecuzione), i soggetti dovevano eseguire il tracciato pianificato nel precedente periodo di pianificazione utilizzando il loro sguardo con feedback visivo online (fornito dal sistema eye-tracker), che delineava il loro movimento dello sguardo in tempo reale (dark line) (10 s massimo). Successivamente, nel periodo di risposta, i soggetti dovevano riportare la sequenza fatta durante l'esecuzione ordinando gli animali visitati. In base alle loro risposte, è stato fornito un feedback. (B) Prova del compito di controllo. Le prove in questa condizione sono iniziate con una croce di fissazione di 3 s. Quindi, i partecipanti sono stati istruiti a valutare se un percorso tracciato (linea scura) seguiva le regole o meno. Successivamente, è apparsa una croce di fissazione spostata (3 s), seguita dalla comparsa del labirinto di nuovo. In questo periodo, i soggetti hanno dovuto ridisegnare il percorso già tracciato con feedback visivi online, come nel periodo di esecuzione della pianificazione (massimo 10 s). Successivamente, nel periodo di risposta, i soggetti dovevano rispondere (sì o no) se la sequenza tracciata seguiva le regole precedentemente indicate In base alle loro risposte, è stato fornito un feedback. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
3. Pianificazione e programmazione delle attività di controllo
- Scrivere uno script che codifica un paradigma di attività di pianificazione basato sul compito66 della mappa dello zoo e sul labirinto di Porteus68utilizzando un software di presentazione degli stimoli/esperimenti comportamentali (vedi Tabella dei materiali e file supplementare).
- Codificare l'attività considerando due condizioni (una condizione di pianificazione e una condizione di controllo) con una struttura simile a quella illustrata nella sezione 2 e nella sezione 4 (vedere la Figura 2 e il file supplementare).
NOTA: È importante utilizzare la stessa struttura in entrambe le condizioni al fine di controllare i fattori confondenti e le componenti percettive coinvolte nel processo di risoluzione delle richieste del compito (Figura 2). L'utilizzo della stessa struttura migliora la valutazione dello specifico processo cognitivo coinvolto nella pianificazione cognitiva. - Sincronizzare la comunicazione tra il computer di visualizzazione, il computer EEG e il computer host (computer eye-tracker) tramite Ethernet e comunicazione parallela tramite porta che invia impulsi logici transistor-transistor (TTL) dal computer di visualizzazione (vedere la Figura 3).
- Scrivere un codice per calibrare i movimenti oculari con il sistema eye-tracker all'inizio delle attività di pianificazione e controllo e dopo ogni cinque prove completate perché la posizione dello sguardo sullo schermo è cruciale per il periodo di esecuzione (vedere i passaggi 3.2.3 e 3.3.3 del protocollo, la sezione di discussione e il codice nel file supplementare).
NOTA: Potrebbero verificarsi ritardi nella comunicazione con il computer. Esistono diversi metodi per misurare il ritardo tra gli impulsi TTL su due computer diversi, ma un approccio comune consiste nell'utilizzare un dispositivo hardware come un oscilloscopio digitale o un analizzatore logico. Un altro approccio consiste nell'utilizzare metodi basati su software, come l'invio degli impulsi TTL su una connessione di rete e l'utilizzo di strumenti di analisi della rete per misurare il ritardo. Un altro approccio consiste nel sincronizzare gli orologi dei due computer, utilizzando un sistema di posizionamento globale (GPS) o un server NTP (Network Time Protocol) o utilizzando una soluzione di sincronizzazione basata su hardware, calcolare il ritardo tra il timestamp e l'ora di arrivo per ogni impulso e calcolare la media dei risultati per ottenere il ritardo complessivo tra i due computer.
- Codificare l'attività considerando due condizioni (una condizione di pianificazione e una condizione di controllo) con una struttura simile a quella illustrata nella sezione 2 e nella sezione 4 (vedere la Figura 2 e il file supplementare).
- Scrivere un codice per l'attività di pianificazione con la struttura seguente: il periodo di pianificazione, il periodo di manutenzione, il periodo di esecuzione della pianificazione, il periodo di risposta e il feedback (Figura 2, File supplementare).
- Il periodo di pianificazione: Avviare la condizione di pianificazione impostando una croce di fissazione presentata per 3 s come linea di base.
- Presentare casualmente l'insieme di labirinti uno per uno (36 in questo studio).
NOTA: In questo periodo di pianificazione, ai partecipanti viene chiesto di pianificare un percorso per visitare le quattro località degli animali, con un tempo massimo di 10 s, seguendo una serie di regole (le regole sono state precedentemente spiegate loro; vedere la sezione 5 del protocollo per vedere le regole fornite, così come la Figura 2). - Includere un trigger TTL nel codice che segnala l'inizio della presentazione dello stimolo utilizzando un codice tag e inviare questo trigger al computer EEG e al computer host dell'eye-tracker per ulteriori analisi più ristrette e a finestre.
- Scrivi nel codice che il periodo di pianificazione culmina una volta premuto un pulsante da un joystick/tastiera ogni volta che il soggetto termina la pianificazione o se viene superato il tempo massimo. Il tempo di reazione (RT) deve essere registrato nel file di log per ulteriori analisi.
NOTA: Per questo periodo, abbiamo utilizzato un codice trigger utilizzando il numero 1, ma si raccomanda l'uso di tag descrittori di eventi gerarchici (HED) rispetto ai codici numerici, perché i tag HED forniscono significato e struttura al contenuto, rendendo così più facile per altri ricercatori o collaboratori comprendere il contenuto dei dati. - Il periodo di manutenzione: Iniziare questo periodo utilizzando una croce di fissazione spostata presentata per 3 s. Localizzare la croce di fissazione spostata nella posizione spaziale in cui si trova il cancello del labirinto per anticipare la posizione iniziale (cancello) della mappa dello zoo (vedi Figura 2).
NOTA: Lo scopo di questo periodo è triplice. In primo luogo, la croce di fissazione spostata facilita l'esecuzione della traccia che rappresenta il percorso pianificato per il periodo successivo (vedi passaggio 3.2.8). In secondo luogo, durante questo periodo, i partecipanti conservano nella loro memoria di lavoro il piano elaborato durante il periodo di pianificazione. Infine, questo periodo funge da intervallo tra le prove per delimitare la fine del periodo di pianificazione e l'inizio del periodo successivo, il periodo di esecuzione della pianificazione. - Il periodo di esecuzione della pianificazione: Dopo che la croce di fissazione spostata viene mostrata per 3 s durante il periodo di manutenzione, presentare nuovamente il labirinto.
- Invia un trigger TTL all'EEG e al computer eye-tracker host per indicare l'inizio di questo periodo utilizzando un codice tag specifico.
- Scrivere un codice per fornire un feedback visivo in tempo reale (una linea scura, vedere il periodo di esecuzione nella Figura 2) della posizione dello sguardo del soggetto circa 992 ms dopo l'inizio di questo periodo.
NOTA: Iniziare a delineare con un ritardo (circa 1.000 ms) dà ai soggetti il tempo di orientarsi nel labirinto, consentendo loro di delineare il percorso precedentemente pianificato (durante il periodo di pianificazione) con una linea scura. - Registrare le coordinate dei percorsi per un'ulteriore ricostruzione dei percorsi effettuati dai soggetti e assegnare un punteggio alle prestazioni offline (vedere il passaggio 6.1.1, Figura 4).
- Garantire un tempo massimo di 10 s per tracciare il percorso pianificato e consentire ai soggetti di finalizzare questo periodo premendo un pulsante. In questo modo, i soggetti possono controllare quando hanno terminato il loro percorso disegnato.
- Salvare l'RT nel file di log per ulteriori analisi.
- Il periodo di risposta: Scrivere un codice per il periodo di risposta, che inizia dopo 10 secondi di esecuzione della pianificazione o dopo la pressione di un pulsante alla fine del periodo di esecuzione della pianificazione, in cui il labirinto scompare ma gli animali e le loro posizioni spaziali rimangono sullo schermo.
- Posiziona quattro cerchi vuoti orizzontalmente nella parte inferiore dello schermo durante il periodo di risposta.
NOTA: Lo scopo di questo periodo è quello di consentire ai soggetti di indicare la sequenza di animali visitati durante il periodo di esecuzione della pianificazione inserendo gli animali nei cerchi nello stesso ordine in cui li hanno visitati utilizzando un joystick o una tastiera. - Configurare il programma/codice per consentire ai soggetti di utilizzare il joystick o la tastiera per selezionare ciascuno degli animali (quattro animali in questo studio) presentati prima e inserirli in ciascuno dei quattro cerchi (vedere File supplementare e Figura 2).
- Valutazione: Scrivi un codice per fornire 3 secondi di feedback ai partecipanti. Se le regole vengono seguite, deve essere visualizzata un'immagine con il pollice in su in risposta a combinazioni valide di animali visitati, mentre un'immagine con il pollice in giù deve essere visualizzata se la combinazione riportata non è valida.
- Invia un trigger TTL, utilizzando un codice tag specifico per un feedback corretto e un altro codice tag per un feedback errato, ai computer EEG e eye-tracker.
NOTA: Il motivo per cui si dà un feedback è quello di facilitare il monitoraggio delle prestazioni e mantenere la motivazione durante l'attività. Questa fornitura di feedback in tempo reale migliora l'effetto di ricompensa e incoraggia la corretta esecuzione del compito103.
- Scrivere un codice per l'attività di controllo con la stessa struttura della condizione di pianificazione: un periodo di controllo, un periodo di manutenzione, un periodo di esecuzione del controllo, un periodo di risposta e un feedback (vedere File supplementare, Figura 2).
- Il periodo di controllo: Scrivere un codice per il periodo della condizione di controllo per mitigare i fattori confondenti. Il codice per questo periodo deve iniziare con una croce di fissazione presentata per 3 s come linea di base.
NOTA: Poiché il compito di pianificazione richiede prevalentemente l'attuazione della pianificazione, ma recluta anche altri domini cognitivi come parte della funzione esecutiva, come la funzione visuospaziale, la memoria di lavoro, il controllo attenzionale, il controllo inibitorio, ecc.66,88,104,105, un compito di controllo è cruciale per mitigare i fattori confondenti. Pertanto, l'obiettivo principale di questo compito è quello di richiedere tutte le funzioni cognitive e percettive necessarie per risolvere il compito di pianificazione, rimuovendo l'implementazione della pianificazione cognitiva54. - Presenta casualmente i labirinti della condizione di controllo uno per uno (labirinti con un percorso segnato già tracciato). Codificare un tempo massimo di 10 s.
- Includi un trigger TTL nel codice che segnala l'inizio della presentazione dello stimolo utilizzando un tag e invia questo trigger al computer EEG e al computer host dell'eye-tracker.
- Scrivi nel codice che questo periodo di controllo culmina una volta che un pulsante da un joystick/tastiera viene premuto ogni volta che il soggetto termina o se viene superato il tempo massimo.
NOTA: I soggetti sono istruiti a valutare i percorsi segnalati (indipendentemente dal fatto che stiano seguendo le regole o meno, vedere il passaggio 5.12 per i dettagli sulle istruzioni fornite ai partecipanti). - Salvare il tempo di reazione (RT) nel file di log per ulteriori analisi.
- Il periodo di manutenzione: Una volta terminato il periodo di controllo, presentare una croce di fissazione spostata per 3 s.
- Come periodo di esecuzione della pianificazione, posizionare la croce di fissaggio dove si trova l'ingresso del cancello per facilitare l'attrazione dello sguardo per il periodo successivo.
- Il periodo di esecuzione del controllo: Presenta di nuovo il labirinto e contemporaneamente invia un trigger TTL all'EEG e ai computer eye-tracker host con un tag che segnala l'inizio del periodo di esecuzione.
- Ripetere lo stesso codice del periodo di esecuzione della pianificazione per fornire un feedback online sulla posizione dello sguardo e per delineare e sovrapporre lo sguardo con il percorso tracciato.
- Assicurarsi un tempo massimo di 10 s per tracciare il percorso e consentire ai soggetti di finalizzare questo periodo premendo un pulsante.
- Salvare l'RT nel file di log per ulteriori analisi.
- Il periodo di risposta del controllo: Una volta terminato il periodo di esecuzione del controllo, presentare un punto interrogativo che indichi il periodo di risposta.
- Programmare due pulsanti, rispettivamente, per consentire ai soggetti di dare una risposta utilizzando un joystick o una tastiera.
NOTA: Qui, ai soggetti viene chiesto di rispondere se la sequenza contrassegnata dalla traccia era corretta o meno selezionando un pulsante per corretto/SÌ e un altro per errato/NO. - Salvare l'accuratezza nel file di registro.
- Valutazione: Scrivi un codice per fornire 3 secondi di feedback corretto ogni volta che i soggetti rispondono correttamente (un'immagine con il pollice in su) e fornire 3 secondi di feedback errato quando i soggetti rispondono in modo errato (un'immagine con il pollice in giù).
- Come nella condizione di pianificazione, inviare un trigger TTL all'EEG e ai computer eye-tracker host con un tag per il feedback corretto e un altro tag per il feedback errato.
- Il periodo di controllo: Scrivere un codice per il periodo della condizione di controllo per mitigare i fattori confondenti. Il codice per questo periodo deve iniziare con una croce di fissazione presentata per 3 s come linea di base.
- Compiti di formazione: Creare stimoli, scrivere un codice e presentare prima delle suddette attività di pianificazione e controllo una breve sessione di formazione di circa sei prove/labirinti per ogni condizione (pianificazione e controllo)
NOTA: L'idea è quella di garantire la familiarizzazione con l'impostazione dell'attività. Si raccomanda di stabilire i criteri per procedere. In questo studio, se le ultime tre prove erano corrette e i partecipanti hanno riferito di aver compreso l'obiettivo e la procedura alla fine della sessione di allenamento, i partecipanti hanno quindi proceduto alla sessione sperimentale.

Figura 3: Esempio di configurazione di laboratorio. Rappresentazione schematica di una configurazione di laboratorio che mostra tre computer interconnessi. Il computer host (computer eye-tracker) è responsabile del tracciamento e della memorizzazione dei dati del movimento oculare. Il computer EEG acquisisce e memorizza i segnali EEG. Il computer del display controlla l'esperimento comportamentale, presenta gli stimoli ai soggetti e invia i trigger degli eventi ai computer host ed EEG attraverso porte parallele e connessioni LAN per sincronizzare la raccolta dei dati. Clicca qui per visualizzare una versione più grande di questa figura.
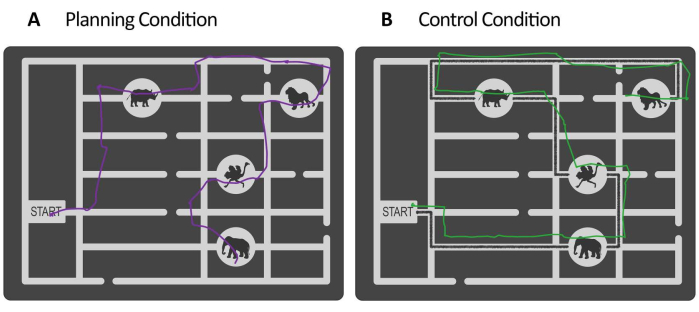
Figura 4: Ricostruzione del percorso a partire dal feedback visivo online fornito dal sistema eye-tracker. Esempi illustrativi di ricostruzione di un percorso dall'esecuzione motoria di un piano (A, in viola, periodo di esecuzione della pianificazione) e di un periodo di esecuzione del controllo (B, linea in verde) e con dati eye-tracker. Il percorso ricostruito nel periodo di esecuzione della pianificazione viene utilizzato per valutare l'accuratezza di ogni prova dell'attività di pianificazione. Clicca qui per visualizzare una versione più grande di questa figura.
4. Ambiente e attrezzature di laboratorio
- Utilizzare un sistema di acquisizione EEG per registrare l'attività EEG dal cuoio capelluto del partecipante, con gli elettrodi EEG posizionati secondo il sistema internazionale 10-20106. Posizionare due elettrodi sulle mastoidi del partecipante per il ririferimento offline. Utilizzare gli elettrodi dell'elettrooculogramma per identificare i segnali di movimento degli occhi verticali, orizzontali e ammiccanti durante l'ispezione visiva.
- Utilizzare il software di acquisizione EEG per l'acquisizione dei dati EEG con una frequenza di campionamento di 2.048 Hz o 1.024 Hz e un filtro passa-banda tra 0,1-100 Hz nel computer EEG.
NOTA: Le frequenze di campionamento di 1.024 Hz e 2.048 Hz forniscono una risoluzione sufficiente per analizzare le oscillazioni a bassa frequenza. È importante acquisire segnali EEG con un'elevata frequenza di campionamento, ad esempio superiore a 1.000 Hz, quando si analizzano le oscillazioni a bassa frequenza, al fine di garantire che i segnali a bassa frequenza non siano alias. - Utilizzare un computer con display, che è collegato al computer EEG e al computer host eye-tracker tramite porte parallele ed ethernet e dispone di una piattaforma per eseguire esperimenti comportamentali installata su di esso, per proiettare gli stimoli su un monitor esteso con una risoluzione minima di 1.920 pixel x 1.080 pixel e una frequenza di aggiornamento di 60 Hz. Posizionare questo monitor a circa 82 cm di distanza dal soggetto.
NOTA: Abbiamo utilizzato un monitor da 24 pollici con refresh rate impostato a 144 Hz situato a 82 cm di distanza dal partecipante. Si consiglia di utilizzare un monitor con una dimensione dello schermo di almeno 19 pollici per esperimenti cognitivi che prevedono la registrazione dell'EEG e dei movimenti oculari. Inoltre, una raccomandazione generale è quella di posizionare il monitor a una distanza che consenta al partecipante di eseguire comodamente l'attività e mantenere uno sguardo stabile sullo schermo, pur consentendo registrazioni accurate dell'EEG e dei movimenti oculari. Si consiglia di testare e regolare la configurazione secondo necessità per garantire i migliori risultati. - Utilizza un sistema di tracciamento oculare per fornire ai partecipanti un feedback in tempo reale sui loro movimenti oculari durante i periodi di esecuzione e registra le dimensioni della pupilla. Impostare la frequenza di campionamento a 1.000 Hz per una risoluzione temporale adeguata.
- Evitare i movimenti della testa. Sono necessarie restrizioni di movimento della testa a sinistra e a destra e su e giù per mantenere l'occhio all'interno del campo visivo della videocamera. La limitazione del movimento in avanti e indietro è necessaria per mantenere l'occhio nella gamma focale della videocamera. Usa una combinazione di poggiafronte e mento per mantenere i movimenti entro questo intervallo.
- Valutare la luminanza degli stimoli utilizzando un luxmetro digitale o simile per confrontare le differenze tra gli stimoli di pianificazione e gli stimoli di controllo.
NOTA: Un test statistico come un t-test o Wilcoxon può essere utilizzato per valutare le differenze tra gli stimoli delle due condizioni. - Utilizzare un joystick di controllo o una tastiera con almeno quattro pulsanti: due pulsanti per domande Sì/No dalla condizione di controllo; uno di questi due pulsanti per terminare le prove; e altri due pulsanti per il periodo di risposta della condizione di pianificazione per spostarsi avanti o indietro per inserire gli animali in ciascuno dei quattro cerchi nella parte inferiore dello schermo.
5. Sessioni di registrazione di elettroencefalografia e eye-tracking
- Prima di iniziare lo studio, chiedi ai partecipanti di completare il consenso informato scritto e firmato.
- Prima della sessione di registrazione, chiedere ai partecipanti di non presentarsi truccati (mascara e eyeliner possono essere rilevati come pupilla dal sistema eye-tracker), di aver assunto farmaci o caffeina107,108, o se avvertono una forte stanchezza109 (stress, privazione del sonno, ecc.).
- Chiedi ai partecipanti di completare un sondaggio demografico per fornire informazioni sul loro sesso, età, manualità, lingua madre e storia neuropsichiatrica tramite l'intervista neuropsichiatrica MINI-International97 applicata da uno psicologo qualificato.
- Pulire la fronte, il cuoio capelluto, le mastoidi e la posizione della pelle dell'elettrooculogramma (EOG) del soggetto con una salvietta imbevuta di alcol.
- Posizionare tutti gli elettrodi esterni sul partecipante. Metti l'EOG orizzontale bipolarmente sul canto esterno di entrambi gli occhi e l'EOG verticale sopra e sotto l'occhio destro del partecipante. Posizionare due elettrodi esterni sulla mastoide destra e sinistra per un successivo ririferimento.
- Misurare la testa del soggetto e posizionare la cuffia EEG della dimensione corretta secondo il sistema internazionale esteso 10-20. Per fare ciò, trova e posiziona l'elettrodo Cz seguendo questi passaggi:
- Identifica la linea mediana del cuoio capelluto ispezionando visivamente l'attaccatura dei capelli e la parte superiore del naso. Identifica una linea che collega questi due punti per definire la linea mediana.
- Individua il Cz. Il Cz è tipicamente definito come il punto medio tra i due punti preauricolari (cioè i punti situati proprio davanti a ciascun orecchio). Individua questi punti, quindi identifica una linea che li collega per identificare la posizione approssimativa del Cz.
- Misurare e segnare il Cz. Misurare la distanza tra il nasion (cioè la protuberanza ossea nella parte superiore del naso) e il Cz. La distanza tra la nasi e la Cz è in genere di circa il 53% della circonferenza totale della testa nel sistema 10-20. Segna la posizione del Cz usando una penna o un altro strumento di marcatura.
NOTA: È importante seguire una procedura coerente e standardizzata per il posizionamento degli elettrodi al fine di ridurre al minimo gli errori e garantire la validità dei dati EEG. Si consiglia di sviluppare una procedura di posizionamento standard. Crea una procedura standard per posizionare gli elettrodi sul cuoio capelluto di ogni soggetto e assicurati che la stessa procedura venga utilizzata per ogni soggetto. Nel caso in cui ci sia un team o uno staff che esegue le registrazioni, formare i tecnici o gli assistenti di ricerca sulla corretta procedura di posizionamento per assicurarsi che posizionino gli elettrodi in modo coerente e accurato. Inoltre, la digitalizzazione delle posizioni degli elettrodi per ogni soggetto sarebbe un approccio auspicabile per eseguire successivamente l'analisi della sorgente. Negli studi EEG, la precisa posizione tridimensionale (3D) di ciascun elettrodo sulla testa del soggetto è spesso un requisito per stabilire una correlazione tra i dati EEG e la corrispondente attività cerebrale110. Queste informazioni sono anche fondamentali per il corretto allineamento dei dati EEG con le immagini anatomiche derivate dalle tecniche di imaging MRI o TC111,112.
- Inserire il gel conduttivo in ogni foro del tappo utilizzando una siringa con ago smussato, allontanando i capelli del partecipante con la punta. Successivamente, metti tutti gli elettrodi del cuoio capelluto sulla cuffia EEG.
- Controllare le impedenze utilizzando il software di registrazione EEG e assicurarsi che siano al di sotto del livello di resistenza raccomandato dal sistema EEG.
- Chiedi al partecipante di rimanere il più fermo possibile durante l'esperimento. Ispeziona il segnale EEG e testalo chiedendo al partecipante di sbattere le palpebre, fare una mascella e rimanere alcuni secondi con gli occhi chiusi.
- Far accomodare il partecipante in una stanza buia e insonorizzata. Utilizzare una mentoniera per stabilizzare la testa e ridurre al minimo il movimento, e verificare che ci sia una distanza di circa 82 cm tra la mentoniera e il centro dello schermo di presentazione dello stimolo.
- Posiziona un joystick o una tastiera davanti al partecipante per le risposte.
- Disposizioni: Dare istruzioni orali utilizzando ausili visivi prima di iniziare ogni condizione (pianificazione e controllo). Nelle istruzioni, includi esempi visivi degli stimoli e spiega come risolvere i labirinti rispettivamente nelle condizioni di pianificazione e di controllo.
- Per il compito di pianificazione, istruire i soggetti a trovare un percorso per completare una sequenza di visite a determinati luoghi di animali (quattro luoghi in questo studio) in diversi luoghi del labirinto in qualsiasi ordine e seguendo una serie di regole: "(1) Pianificare il percorso il più velocemente possibile entro un massimo di 10 secondi; (2) Iniziare dal cancello e concludere il percorso al quarto animale visitato; (3) Non passare due volte per lo stesso sentiero o angolo; (4) Non attraversare un vicolo cieco; (5) Non attraversare un sentiero perpendicolarmente"54.
NOTA: Per le regole da 2 a 5, si consiglia di mostrare esempi visivi al partecipante. - Successivamente, inizia la sessione di addestramento alle attività di pianificazione di sei prove.
NOTA: Istruire i partecipanti a segnalare prima di ogni periodo di calibrazione dell'eye-tracker se si sono verificati problemi nell'esecuzione dell'attività, in particolare durante la delineazione del percorso nel periodo di esecuzione. Prendere nota se è stata eseguita una versione di prova per il controllo offline/post-elaborazione (vedere il passaggio 6.1.1). - Per la condizione di controllo, istruire i soggetti a valutare se il percorso già segnato sul labirinto è stato realizzato correttamente o in modo errato considerando le regole precedentemente apprese.
NOTA: Fornire esempi con supporto visivo di come valutare i labirinti senza utilizzare strategie di pianificazione, come non cercare di pianificare un nuovo percorso quando vengono rilevati errori (come disegni che utilizzano lo stesso percorso due volte, attraversando un vicolo cieco, ecc.). Quando viene rilevato un errore, l'attenzione deve essere rivolta esclusivamente alla segnalazione del rilevamento dell'errore piuttosto che alla correzione del percorso. Dopo ogni prova, chiedi ai partecipanti quali strategie hanno implementato. Quindi, fornisci un feedback orale sulle loro prestazioni per assicurarti che abbiano valutato i percorsi tracciati ed evitato di pianificare nuovi percorsi. Successivamente, inizia la sessione di addestramento del compito di controllo di sei prove.
- Per il compito di pianificazione, istruire i soggetti a trovare un percorso per completare una sequenza di visite a determinati luoghi di animali (quattro luoghi in questo studio) in diversi luoghi del labirinto in qualsiasi ordine e seguendo una serie di regole: "(1) Pianificare il percorso il più velocemente possibile entro un massimo di 10 secondi; (2) Iniziare dal cancello e concludere il percorso al quarto animale visitato; (3) Non passare due volte per lo stesso sentiero o angolo; (4) Non attraversare un vicolo cieco; (5) Non attraversare un sentiero perpendicolarmente"54.
- Controllare il segnale EEG per assicurarsi che tutti i canali vengano acquisiti correttamente. Avviare la registrazione EEG.
- Calibrare l'eye tracker.
NOTA: Verificare la capacità dell'eye tracker di determinare la posizione dello sguardo quando il partecipante dirige lo sguardo verso varie regioni dello schermo.- Informare il partecipante che l'eye tracker sarà calibrato e che vedrà un cerchio bianco (con un piccolo punto grigio) che si muove in modo casuale verso i quattro angoli dello schermo (procedura di calibrazione a cinque punti). Istruiscili a fissare il loro sguardo nel cerchio e informali che, quando si sposta in un'altra posizione, dovrebbero seguire la posizione del cerchio e fissare nuovamente il loro sguardo in quella nuova posizione.
- Esegui l'esperimento, inizia a salvare i movimenti oculari facendo clic su Output/Registra e chiedi al partecipante di seguire le istruzioni fornite in precedenza, informandolo che l'esperimento inizierà ora.
- Conservare la stanza del laboratorio in un ambiente buio. I maggiori cambiamenti nella dilatazione della pupilla si verificano in risposta ai cambiamenti di luminanza113. Mantenere un livello di luce costante nell'ambiente sperimentale.
6. Analisi dei dati
- Analisi comportamentali
- Analizzare i dati comportamentali utilizzando software statistici (vedi Tabella dei materiali). Misurare l'accuratezza (percentuale di risposte accurate) come parametro comportamentale quantitativo sia nelle condizioni di pianificazione che in quelle di controllo. Per la condizione di pianificazione, utilizzare i dati dell'eye-tracker (coordinate x e y della posizione dello sguardo) per ricreare i percorsi intrapresi durante il periodo di esecuzione offline e determinare l'accuratezza dei percorsi pianificati rispetto ai percorsi tracciati effettivi (Figura 4). Per fare ciò, controlla manualmente la congruenza tra le combinazioni effettuate correttamente/in modo errato nel periodo di risposta e la traccia effettuata.
- Calcola l'RT, che è il tempo medio impiegato per risolvere i labirinti per il periodo di pianificazione e il tempo medio impiegato per valutare i percorsi contrassegnati per il periodo di controllo.
- Calcolare l'RT medio dei periodi di esecuzione per le condizioni di pianificazione e controllo. In particolare, utilizzare l'RT corrispondente solo alle prove corrette.
NOTA: In modo complementare, è possibile utilizzare il punteggio lineare integrato velocità-accuratezza (LISAS)114,115 descritto in Domic-Siede et al.54, che fornisce una misura combinata che considera il tempo di reazione e l'accuratezza. Poiché il tempo di reazione durante il periodo di esecuzione della pianificazione e l'accuratezza della pianificazione sono correlati, il LISAS può essere utilizzato per calcolare un indice che tiene conto del tempo di reazione corretto per il numero di errori commessi. Inoltre, l'indice LISAS può essere utilizzato per valutare la correlazione tra segnali elettrofisiologici e prestazioni comportamentali. Viene calcolato come una combinazione lineare del tempo di reazione (RT) e della proporzione di errore (PE). - Valutare l'omoschedasticità utilizzando un test statistico come il test di Levene116,117 e testare la normalità utilizzando il test di distribuzione della normalità omnibus di D'Agostino e Pearson118 o il test di Shapiro Wilk119 per scegliere il test statistico appropriato per i confronti (parametrico o non parametrico).
- Valutare se la componente di pianificazione nella condizione di pianificazione è cognitivamente più impegnativa rispetto alla condizione di controllo utilizzando il test di rango firmato di Wilcoxon120 o il test t a coppie abbinate121 per confrontare i parametri comportamentali tra le condizioni.
NOTA: In questo modo, convalidare che il paradigma comportamentale sia ottimale per valutare la pianificazione cognitiva. - Separare le prove nella condizione di pianificazione in categorie "facile" e "difficile" (fare riferimento al passaggio 2.2), quindi utilizzare un test t a coppie abbinate per confrontare l'accuratezza e i tempi di reazione nei periodi di pianificazione ed esecuzione tra le prove "facile" e "difficile".
- Pre-elaborazione EEG e movimenti oculari
- Eseguire la pipeline di pre-elaborazione dei dati EEG spiegata nei punti seguenti utilizzando script autoprodotti e/o toolbox stabiliti, come quelli descritti in Delorme e Makeig122, in Dimigen et al.123 e in Mognon et al.124, in un software in linguaggio di programmazione (vedi Tabella dei materiali).
- Sincronizza l'attività del movimento oculare con le registrazioni EEG per importare le fissazioni, le saccadi e gli eventi di battito delle palpebre per una migliore ispezione visiva o ulteriori analisi (vedi passaggio 3.1.2 e il file supplementare).
NOTA: In questo studio, abbiamo utilizzato i timestamp sui dati di tracciamento oculare e i timestamp sui dati EEG come descritto in Domic-Siede et al.54 e in Dimigen et al.123 per importare gli eventi di movimento oculare nei dati EEG in un software di linguaggio di programmazione. - Sottocampionare i dati a 1.024 Hz nel caso in cui siano stati registrati a 2.028 Hz per ridurre le esigenze computazionali.
NOTA: Una frequenza di campionamento di 1.024 Hz è sufficiente in base alla gamma di frequenza di interesse di 4-8 Hz, alla risoluzione di frequenza prevista e ai requisiti computazionali dell'analisi. - Ri-referenziare il segnale EEG alla media degli elettrodi sulle mastoidi.
NOTA: Sono possibili altri riferimenti. La scelta del riferimento può influire sui risultati dell'analisi EEG e sull'interpretazione dei dati, quindi è importante considerare attentamente i pro e i contro delle diverse opzioni di riferimento. Il riferimento mastoideo medio è una scelta popolare per gli studi EEG perché fornisce un riferimento stabile che è facile da calcolare e ha dimostrato di essere efficace per l'analisi di molti segnali EEG diversi. Fare riferimento dei dati EEG alla media delle mastoidi (noto come riferimento mastoideo medio) è un approccio comune per analizzare l'attività theta frontale nei dati EEG del cuoio capelluto. Gli elettrodi mastoidi si trovano vicino all'orecchio e forniscono un riferimento per i segnali EEG. Fare riferimento alla media dei mastoidi può aiutare a ridurre l'influenza del rumore e degli artefatti che non sono di interesse evitando di cancellare il segnale di interesse, il che aiuta l'utente a ottenere una rappresentazione più chiara dei segnali EEG. - Applicare una risposta all'impulso finito (FIR) a fase zero con una frequenza di taglio passa-alto di 1 Hz e una frequenza di taglio passa-basso di 40 Hz sul segnale esteso (senza temporizzazione) utilizzando un software di linguaggio di programmazione.
NOTA: In questo studio, abbiamo utilizzato la cassetta degli attrezzi descritta in Delorme e Makeig122. - Per ogni condizione, considerando il numero di prove, suddividere i dati in epoche centrate rispettivamente intorno all'inizio dei periodi di pianificazione e controllo. Utilizzare 1 s prima dell'inizio della presentazione del labirinto come base e 4 s dopo il periodo di pianificazione o controllo come segmenti di interesse. Utilizzare un software di linguaggio di programmazione.
NOTA: In questo studio, abbiamo utilizzato la cassetta degli attrezzi descritta in Delorme e Makeig122e 36 epoche/prove. - Creare una seconda segmentazione centrata sulla fine dei periodi di pianificazione e controllo utilizzando 4 s prima della fine e 1 s dopo come periodo di manutenzione.
NOTA: il motivo per cui si selezionano i primi e gli ultimi 4 secondi dei periodi di pianificazione e controllo (passaggio 6.2.6 e passaggio 6.2.7) è che la durata di ciascun periodo in entrambe le condizioni può variare e l'analisi del primo e dell'ultimo secondo di pianificazione può fornire una visione più completa del processo di pianificazione. Pertanto, queste lunghezze delle finestre sono adeguate e sufficienti per analizzare le dinamiche oscillatorie alla base della pianificazione. - Sul segnale segmentato, eseguire l'algoritmo ICA (Independent Components Analysis)125di Logistic Infomax per identificare e rimuovere i componenti artefatti.
- Utilizzare il criterio del rapporto varianza saccade-fissazione raccomandato in Plöchl et al.126per rilevare automaticamente potenziali componenti rumorose e utilizzare il rilevatore automatico di artefatti EEG basato sull'uso congiunto di caratteristiche spaziali e temporali raccomandato in Mognon et al.124.
NOTA: Raccomandiamo l'uso del classificatore di componenti indipendenti proposto in Pion-Tonachini et al.127, che stima le classificazioni dei componenti indipendenti come vettori composizionali in sette categorie, aiutando a identificare gli artefatti. - Ispezionare altri potenziali componenti artefatti come EMG, movimento degli elettrodi o componenti non correlati al cervello. Convalida il rifiuto di questi componenti ispezionando visivamente le topografie, gli spettri e le attivazioni nel tempo.
- Interpolare (interpolazione sferica) i canali rumorosi mediante reiezione automatica del canale utilizzando il criterio della curtosi (con un punteggio z di 5 come soglia).
- Analisi tempo-frequenza
- Eseguire una trasformata di Fourier veloce (FFT) di breve durata (da 1 Hz a 40 Hz) utilizzando una lunghezza della finestra di 250 ms e un passo temporale di 5 ms. Utilizzare una finestra di Hanning. Utilizzare lo z-score per normalizzare i grafici tempo-frequenza alla linea di base (da -1 s a -0,1 s).
NOTA: La visualizzazione dello spettro è soggetta a un compromesso tra le dimensioni della finestra e la risoluzione temporale. Per ottenere una visione completa dell'intero spettro, compresa la gamma theta da 4 Hz a 8 Hz, si consiglia di utilizzare il limite inferiore della dimensione della finestra, che è di 250 ms, per garantire una risoluzione temporale più elevata durante ogni prova e attività. Inoltre, si consiglia di utilizzare una finestra di Hanning, poiché questa è ampiamente considerata una scelta convenzionale per questi casi. Per una migliore risoluzione in termini di tempo e frequenza, vedere i passaggi successivi. - Selezionare un grafico tempo-frequenza da un elettrodo frontocentrale, come Fz, o da un gruppo medio di elettrodi frontali.
NOTA: Considera l'ampia evidenza riguardante l'associazione tra controllo cognitivo e theta frontale della linea mediana12,128,129. - Seleziona grafici tempo-frequenza di controllo non frontale da elettrodi come gli elettrodi Pz e Oz per facilitare i confronti.
- Per gli elettrodi frontali e di controllo, eseguire un test di permutazione non parametrico basato su cluster per campioni accoppiati, con un valore p < 0,05 per i confronti a livello di gruppo dei grafici tempo-frequenza di entrambe le condizioni. Usa il metodo Monte Carlo con 1.000 estrazioni casuali. Utilizzare il valore statistico massimo del cluster per eseguire il test di permutazione130.
- Calcolare la media della banda di frequenza theta (4-8 Hz) dei primi 4 s di pianificazione e controllo, rispettivamente, e degli ultimi 4 s del segmento.
- Confronta l'attività theta media tra le condizioni utilizzando un test t a coppie abbinate o un test di rango con segno di Wilcoxon.
- Analizza il profilo temporale dell'attività theta. Per fare ciò, calcolare la media della gamma di frequenza di 4-8 Hz tra le prove per soggetto.
- Confronta le dinamiche dell'attività theta tra le condizioni utilizzando un test di Wilcoxon con rango con segno accoppiato e corretto con il tasso di falsa scoperta (FDR).
NOTA: Nel test di Wilcoxon sono stati utilizzati incrementi di 88 ms di finestre non sovrapposte.
- Eseguire una trasformata di Fourier veloce (FFT) di breve durata (da 1 Hz a 40 Hz) utilizzando una lunghezza della finestra di 250 ms e un passo temporale di 5 ms. Utilizzare una finestra di Hanning. Utilizzare lo z-score per normalizzare i grafici tempo-frequenza alla linea di base (da -1 s a -0,1 s).
- Ricostruzione della fonte
- Utilizzare un toolbox per la ricostruzione dell'analisi delle fonti, come il toolbox ad accesso aperto descritto in Tadel et al.131 o un altro simile.
- Calcola le fonti del segnale EEG pre-elaborato dai primi 4 secondi di pianificazione utilizzando un algoritmo come la tomografia elettromagnetica cerebrale standardizzata a bassa risoluzione (sLORETA)132e il metodo di imaging a norma minima, nonché il metodo degli elementi al contorno simmetrici (BEM simmetrico), con l'aiuto di una cassetta degli attrezzi come quella descritta in Gramfort et al.133per risolvere il problema inverso.
- Utilizzare l'algoritmo di origine (algoritmo sLORETA in questo studio) su un modello MNI anatomico (abbiamo utilizzato il modello MNI in Brainstorm "Colin27") con le posizioni predefinite degli elettrodi per ciascun partecipante nel caso in cui non vi sia una digitalizzazione 3D degli elettrodi (vedere il passaggio 5.6).
NOTA: Va notato che l'utilizzo delle posizioni predefinite degli elettrodi non è il metodo più efficiente per determinare le fonti di attività cerebrale. Tuttavia, può comunque fornire una comprensione generale dell'origine dell'attività. È importante tenere presente che le fonti di localizzazione ottenute con questi metodi sono approssimazioni approssimative e devono essere interpretate con cautela durante l'analisi dei risultati. - Applicare un filtro passa-banda 4-8 Hz sul segnale pre-elaborato.
- Applicare una normalizzazione z-score utilizzando come base il periodo compreso tra -1.000 ms e -10 ms prima dell'inizio dello studio.
- Fare la media dell'attività theta utilizzando una finestra temporale di interesse compresa tra 1 s e 4 s dopo l'inizio della prova.
- Confrontare le sorgenti spaziali medie tra le condizioni utilizzando un test del segno di permutazione non parametrico con il campionamento Monte Carlo (1.000 randomizzazioni)131.
- Per determinare le regioni di interesse (ROI), etichettare la corteccia utilizzando un atlante cerebrale.
NOTA: Abbiamo utilizzato il Destrieux Atlas134 implementato nella cassetta degli attrezzi descritta in Tadel et al.131. - Seleziona le regioni cerebrali di interesse (ROI).
NOTA: Abbiamo considerato le prove che riportano che le regioni della corteccia prefrontale, come il giro frontale superiore bilaterale (SF), il giro frontopolare trasverso bilaterale e i solchi (FP), l'ACC bilaterale, l'MCC bilaterale e la corteccia prefrontale dorsolaterale bilaterale137,138, sono coinvolte nelle funzioni di controllo cognitivo135,136. - Eseguire l'analisi delle componenti principali (PCA) sul precedente segnale EEG pre-elaborato (intervallo 1-40 Hz) per ciascuna ROI e adottare la prima modalità di decomposizione PCA per ciascuna ROI.
- Esegui un'analisi spettrale utilizzando una trasformata di Fourier veloce di breve durata e confronta i risultati tra le regioni di interesse sinistra e destra utilizzando un test di permutazione non parametrico basato su cluster130.
- Estrai e rappresenta i ROI sinistro e destro che non mostrano differenze come una serie temporale bilaterale: SF, ACC e MCC. Quindi, traccia grafici tempo-frequenza e confronta le condizioni.
- Confronta i grafici tempo-frequenza in base al livello di complessità dell'attività di pianificazione (prove facili o difficili) per ogni ROI.
- Specchia il bordo del segnale per ciascuno dei 512 campioni ed esegui un filtro passa-banda compreso tra 4 Hz e 8 Hz per le ROI selezionate.
- Applicare una trasformata di Hilbert per ottenere l'ampiezza istantanea139utilizzando un toolbox di elaborazione del segnale da un software di linguaggio di programmazione (vedi Tabella dei materiali).
- Correggere il segnale utilizzando la normalizzazione z-score (da -1.000 a -10 ms come basale) e fare la media delle prove per soggetto.
- Confronta ogni profilo temporale della banda theta ROI tra le condizioni utilizzando il test di rango con segno di Wilcoxon (coppie abbinate, 1 s di finestre non sovrapposte) e correggi con l'FDR.
- Correlazioni tra attività EEG e prestazioni comportamentali
- Normalizza le serie temporali di origine delle ROI alla linea di base utilizzando lo z-score. Selezionare una finestra da 1 s a 4 s dopo l'inizio della pianificazione o del controllo (dove si osserva un'attività theta prominente nei grafici tempo-frequenza).
- Per determinare l'aumento dell'attività theta nella condizione di pianificazione rispetto alla condizione di controllo, trasformare prima il segnale nel dominio della frequenza (1-40 Hz) utilizzando il metodo multitaper attraverso un toolbox come il toolboxChronux 140 per ogni condizione e sorgente nelle regioni di interesse.
- Calcola la frequenza media della banda theta (4-8 Hz) e calcola due misure della potenza theta: i) la differenza tra la potenza theta durante il periodo di pianificazione (θ pianificazione) e il periodo di controllo (θ controllo), indicata come Δ theta, e ii) l'aumento relativo dell'attività theta, espresso come rapporto tra Δ theta (Δ θ) e l'attività theta durante il periodo di controllo (controllo θ), come in Domic-Siede et al.54:
 (1)
(1)
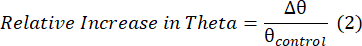
- Calcolare due parametri comportamentali: iii) Δ pianificazione LISAS, sottraendo il controllo LISAS dalla pianificazione LISAS, e iv) Δ esecuzione della pianificazione LISAS, sottraendo l'esecuzione del controllo LISAS dall'esecuzione della pianificazione LISAS, come in Domic-Siede et al.54:
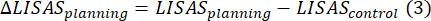

- Eseguire le correlazioni rho di Spearman utilizzando i parametri elettrofisiologici e comportamentali calcolati, e quindi corretti dal FDR.
- Analisi del movimento oculare: Per controllare le potenziali differenze nei movimenti oculari per ciascuna condizione che potrebbero causare diverse dinamiche oscillatorie, eseguire la seguente analisi:
- Determinare l'ampiezza della saccade e la velocità di picco della saccade dall'intera prova e da 0 s a 3,75 s durante le condizioni di pianificazione e controllo.
- Confronta i risultati utilizzando il test di rango con segno di Wilcoxon o il test t a coppie corrispondenti, a seconda di quale sia appropriato.
NOTA: Una cassetta degli attrezzi come quella descritta in Dimigen et al.123può essere utile. - Calcolare e valutare la coerenza tra la potenza EEG di Fourier su un elettrodo frontale (ad esempio, l'Fz o un elettrodo ROI frontale medio) e la velocità delle saccadi come descritto in Sato e Yamaguchi141.
- Utilizzare il test del rango con segno di Wilcoxon per confrontare i valori del tasso di coerenza potenza-saccadi dei primi 4 s di ogni prova tra le due condizioni.
Risultati
Nel presente protocollo, l'RT del periodo di pianificazione è stato confrontato con gli RT del periodo di controllo e del periodo di esecuzione della pianificazione. Inoltre, rispetto alla condizione di controllo, i partecipanti hanno commesso più errori e hanno avuto una precisione inferiore durante il periodo di pianificazione (Figura 5).
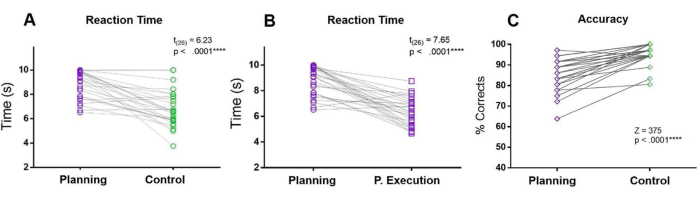
Figura 5: Tempo di reazione e precisione per l'attività di pianificazione. Confronto tra i tempi di reazione (A) nel periodo di pianificazione (cerchi viola) e nel periodo di controllo (cerchi verdi) utilizzando un test t abbinato. (B) Confronto tra i tempi di reazione nel periodo di pianificazione (cerchi viola) e il periodo di esecuzione della pianificazione (quadrati viola) utilizzando un test t accoppiato abbinato. (C) Confronto del tasso di accuratezza nella condizione di pianificazione (diamanti viola) e nella condizione di controllo (diamanti verdi) utilizzando un test di rango con segno Wilcoxon. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, l'analisi dei livelli di complessità della pianificazione ha mostrato differenze significative nell'accuratezza e nei tempi di reazione (RT) tra i livelli "difficile" e "facile" durante la pianificazione e l'esecuzione (Figura 6). Il livello "difficile" aveva RT più lunghi e una precisione inferiore. Questi risultati suggeriscono che dividere le prove in base al numero di soluzioni valide può distinguere le prove "facili" da quelle "difficili".

Figura 6: Confronto delle prestazioni comportamentali ai diversi livelli di complessità. Differenze significative nelle prestazioni comportamentali ai livelli di complessità "facile" e "difficile" sono state identificate utilizzando un test t a coppie abbinate. Durante la pianificazione e l'esecuzione sono stati osservati tempi di reazione (RT) inferiori per il livello "facile" rispetto a quello "difficile" e la precisione è stata maggiore per il livello "facile". Le barre di errore rappresentano il SEM (errore standard della media). Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Questi risultati hanno indicato che quando la componente di pianificazione è stata rimossa con successo dalla condizione di controllo (tramite la manipolazione delle istruzioni), l'attività di pianificazione era cognitivamente più complessa, impegnativa, impegnativa e dispendiosa in termini di tempo. Quindi, i correlati neurali indotti dai compiti potrebbero essere confrontati tra loro.
Per analizzare l'attività theta della linea mediana frontale durante la pianificazione, la banda di frequenza theta media durante la pianificazione per l'elettrodo Fz è stata confrontata con quella del periodo di controllo ed è stato riscontrato un aumento significativo della frequenza della banda theta durante la pianificazione (Figura 7).

Figura 7: Attività theta frontale della linea mediana durante la pianificazione cognitiva. (A) Mappe topografiche che rappresentano la potenza della banda theta in tutti i soggetti normalizzata ai punteggi z durante il compito di pianificazione (a sinistra), il compito di controllo (al centro) e l'effetto di pianificazione (a destra). Durante la pianificazione cognitiva, i soggetti hanno mostrato un aumento dell'attività theta della linea mediana frontale. La barra dei colori mostra i valori z compresi tra -0,5 e 1,5. (B) Un grafico a violino che mostri i valori minimo, quartile, mediano e massimo del punteggio z dell'attività theta nei soggetti durante la pianificazione (viola) rispetto al periodo di controllo (verde) per gli elettrodi Fz (a sinistra), Pz (al centro) e Oz (a destra) utilizzando un test t a coppie corrispondenti. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, per valutare la dinamica temporale dell'attività theta frontale osservata, sono state formulate mappe topografiche corrispondenti a specifici punti temporali della potenza della banda theta (750 ms, 1.750 ms, 2.750 ms e 3.750 ms) (Figura 8A). Inoltre, rispetto al periodo di controllo, l'analisi tempo-frequenza ha dimostrato un aumento significativo, progressivo e sostenuto dell'attività theta a partire da 1 s dopo l'inizio del periodo di pianificazione (Figura 8B).
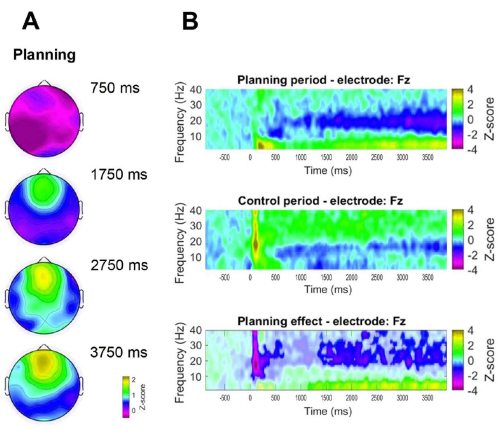
Figura 8: Dinamica temporale theta della linea mediana frontale. (A) Intervalli di tempo topografici dell'attività theta. È stato osservato un progressivo aumento dell'attività theta della linea mediana frontale nel tempo durante l'attuazione della pianificazione (periodo di pianificazione). La barra dei colori indica le unità di punteggio z (da -0,5 a 2,2). (B) Grafici tempo-frequenza per il periodo di pianificazione (in alto), il periodo di controllo (al centro) e l'effetto di pianificazione, calcolati sottraendo il periodo di controllo dal periodo di pianificazione (in basso). I pixel non significativi, determinati utilizzando un test di permutazione basato su cluster non parametrico per campioni accoppiati, vengono mostrati più chiari nel grafico dell'effetto di pianificazione. La barra colorata indica le unità di punteggio z (da -4 a 4). Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Per la ricostruzione della sorgente dell'attività theta, è stato visualizzato un modello di cervello e confrontato tra le condizioni, e questo ha indicato che l'attività theta ha avuto origine all'interno delle aree della corteccia prefrontale (corteccia frontale superiore, FS; corteccia cingolata anteriore, ACC; e corteccia cingolata media, MCC), nonché che c'erano differenze significative tra le condizioni (nella SF bilaterale, l'ACC bilaterale e l'MCC bilaterale) (Figura 9), con una maggiore attività theta osservata nel periodo di pianificazione (Figura 9).
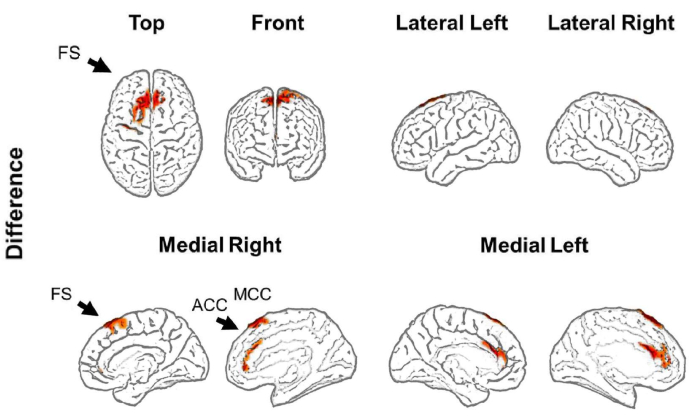
Figura 9: Ricostruzione della fonte. Un algoritmo sLORETA è stato utilizzato per stimare l'attività theta da diverse fonti cerebrali. L'attività theta è stata filtrata in banda di 4-8 Hz, normalizzata con z-score, corretta al basale, mediata tra 1 s o 4 s dopo l'insorgenza della pianificazione o del controllo, rispettivamente, e confrontata tra le condizioni. Un aumento significativo dell'attività theta è stato riscontrato nell'area frontale superiore bilaterale, nella corteccia cingolata anteriore bilaterale e nella corteccia cingolata media bilaterale. La figura mostra i valori t significativi del test di permutazione. Abbreviazioni: FS = frontale superiore; ACC = corteccia cingolata anteriore; MCC = corteccia cingolata media. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Successivamente, il profilo temporale dei cambiamenti theta nel tempo per ciascuna sorgente è stato valutato calcolando una trasformata di Hilbert, e quindi abbiamo confrontato l'ampiezza istantanea dell'attività theta tra le condizioni. Abbiamo scoperto che le sorgenti di MCC frontopolare sinistro, ACC bilaterale e MCC bilaterale presentavano un'attività theta più elevata dopo l'inizio del periodo di pianificazione (Figura 10). Questi risultati hanno suggerito che il nostro paradigma sperimentale, che richiede una pianificazione cognitiva, induce l'attività theta che ha origine all'interno delle regioni PFC.

Figura 10: Profilo temporale dell'attività theta delle sorgenti PFC. L'ampiezza istantanea calcolata con la trasformata di Hilbert è stata applicata al primo componente della decomposizione PCA per ciascuna sorgente frontale e sia le condizioni che la linea di base sono state normalizzate allo z-score per mostrare l'attività theta frontale nel tempo. Le aree ombreggiate in grigio mostrano differenze significative determinate utilizzando una finestra mobile non sovrapposta con passi di 1 s (test di rango con segno di Wilcoxon) corretti dal FDR. Le regioni ombreggiate rappresentano intervalli di confidenza del 95%. La regione FP sinistra, l'ACC bilaterale e l'MCC bilaterale hanno mostrato aumenti dell'attività theta dopo l'inizio della pianificazione. Abbreviazioni: ACC = corteccia cingolata anteriore; MCC = corteccia cingolata media. La condizione di pianificazione è mostrata in viola. La condizione di controllo viene visualizzata in rosso. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, ci siamo proposti di esaminare la variazione delle caratteristiche spettrali durante la pianificazione per quanto riguarda il livello di complessità, come indicato dai risultati comportamentali. Da notare che una discrepanza significativa è stata riscontrata solo nell'ACC sinistro all'interno della banda alfa. Ciò supporta l'idea che il nostro compito di pianificazione valuti gli aspetti intrinseci della pianificazione attraverso cambiamenti nelle oscillazioni theta in misura maggiore rispetto alle richieste cognitive generali (sforzo) tipicamente incontrate nei compiti di controllo cognitivo (Figura 11).

Figura 11: EEG attraverso i livelli di complessità della pianificazione. I grafici tempo-frequenza ROI hanno mostrato un significativo cluster positivo nella banda alfa esclusivamente nella corteccia cingolata anteriore sinistra (ACC) per il livello "difficile". I pixel non significativi, determinati utilizzando un test di permutazione basato su cluster non parametrico per campioni accoppiati, sono mostrati in una tonalità più chiara sul grafico, con la barra del colore che indica le unità di punteggio z da -3 a 3. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Quando sono state eseguite correlazioni tra l'attività theta e le prestazioni comportamentali, è stata osservata una correlazione negativa; in particolare, all'aumentare dell'attività theta nella regione frontopolare sinistra durante il periodo di pianificazione, il punteggio di esecuzione della pianificazione LISAS è diminuito (Figura 12). Questo modello può riflettere che la regione FP sinistra può essere necessaria durante l'elaborazione della pianificazione per eseguire con successo un piano in seguito e suggerisce un ruolo per l'attività theta.
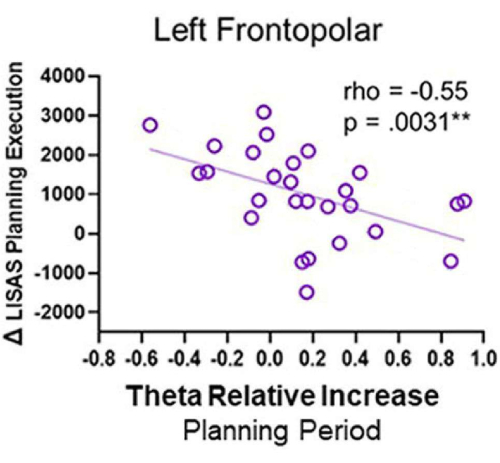
Figura 12: Attività theta e prestazioni comportamentali. La correlazione rho di Spearman tra l'attività theta della corteccia frontopolare sinistra e l'esecuzione della pianificazione Δ LISAS ha mostrato una significativa correlazione negativa. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, le diverse richieste cognitive e gli obiettivi indotti da ciascuna condizione possono aver causato movimenti oculari contrastanti tra le condizioni di pianificazione e di controllo, portando a diversi modelli di attività oscillatoria95. Per affrontare il problema di cui sopra, abbiamo analizzato i dati di un singolo soggetto e di un singolo studio a vari livelli. In particolare, le serie temporali del canale Fz e le dinamiche temporali dell'attività theta sembravano non avere alcuna connessione con il tasso di saccadi nel tempo (Figura 13A).
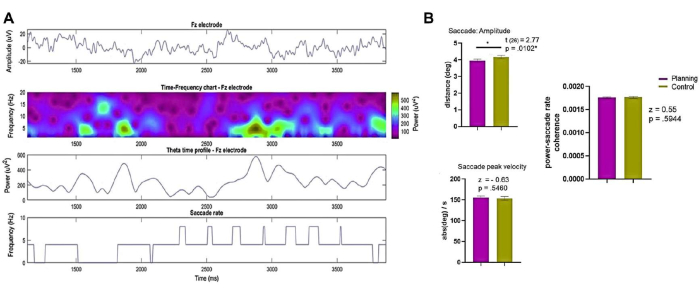
Figura 13: Risultati delle registrazioni EEG e dei movimenti oculari. (A) Le righe presentano l'EEG (in alto), il grafico tempo-frequenza (in alto al centro), il profilo tempo theta dall'elettrodo Fz (in basso al centro) e il tasso di saccadi del soggetto 8 e della prova 9 (in basso) nella condizione di pianificazione. (B) Viene mostrato un confronto del test di rango con segno di Wilcoxon dell'ampiezza della saccade, della velocità di picco della saccadica e della coerenza del tasso di potenza-saccadica tra le condizioni, rivelando differenze statistiche significative nell'ampiezza della saccade tra le condizioni di pianificazione e di controllo. Il SEM è rappresentato dalle barre di errore. Questa cifra è stata modificata da Domic-Siede et al.54. Clicca qui per visualizzare una versione più grande di questa figura.
Successivamente, abbiamo ottenuto l'ampiezza della saccade e la velocità di picco dall'intero studio e da 0 s a 3,75 s per il confronto (Figura 13B). Abbiamo scoperto che l'ampiezza della saccade era maggiore nella condizione di controllo. Tuttavia, non sono state riscontrate differenze statisticamente significative tra le condizioni dell'indice di coerenza tra la potenza theta di Fourier all'elettrodo Fz e la velocità delle saccadi (Figura 10B), indicando che qualsiasi potenziale relazione tra le saccadi e l'attività theta era coerente tra le condizioni.
Nel loro insieme, questi risultati supportano che il protocollo sperimentale descritto è adatto per studiare la pianificazione cognitiva come funzione di controllo cognitivo.
Discussione
Il protocollo qui descritto offre un approccio innovativo per valutare la pianificazione cognitiva e il controllo cognitivo durante un compito di pianificazione nuova ed ecologica in associazione con misurazioni comportamentali e fisiologiche pertinenti e complementari, come le dinamiche oscillatorie e pupillari. Durante i nostri esperimenti, l'attività EEG è stata registrata mentre i partecipanti eseguivano il compito di pianificazione, in cui i partecipanti sono stati istruiti a elaborare e poi eseguire un piano. La condizione di controllo, che prevedeva la valutazione di un percorso pre-disegnato sulla mappa dello zoo, è stata stabilita per eliminare l'aspetto della pianificazione cognitiva mantenendo un ambiente e una struttura simili. Questo approccio consente di valutare se la pianificazione cognitiva, come funzione di controllo cognitivo, porta alla generazione di attività theta frontale dalle regioni PFC e se diverse fonti di oscillazione theta PFC sono collegate a diversi aspetti delle prestazioni di pianificazione. Un altro aspetto che potrebbe essere valutato utilizzando questo protocollo è la differenziazione dei vari processi cognitivi coinvolti durante le fasi di pianificazione, come l'elaborazione del piano, l'esecuzione del piano, il raggiungimento del piano e l'elaborazione del feedback. Abbiamo scoperto che la pianificazione induceva un'attività theta frontale canonica associata al controllo cognitivo, che contribuiva a raggiungere in modo efficiente un obiettivo. Questi risultati sono alla base dell'interesse di questo protocollo.
Nonostante i vasti sviluppi nelle neuroscienze cognitive, la maggior parte degli esperimenti di neuroimaging esamina le funzioni cognitive isolate utilizzando compiti artificiali in ambienti con deprivazione sensomotoria e stimoli eccessivamente semplificati per controllare i fattori confondenti. Problematicamente, questi esperimenti potrebbero non essere in grado di identificare i veri meccanismi cerebrali coinvolti quando una funzione cognitiva viene implementata in una situazione quotidiana (durante situazioni ecologiche)138,140. In particolare, le capacità di formulare obiettivi, pianificare ed eseguire piani in modo efficace sono difficili da valutare poiché richiedono varie funzioni cognitive (memoria di lavoro, controllo inibitorio, flessibilità cognitiva, ecc.)104,144. Pertanto, la progettazione di un compito comportamentale ecologico è incoraggiata e suggerita sulla base delle attuali tendenze nelle neuroscienze cognitive 142,143,145,146.
Il nostro compito di pianificazione, nonostante si svolga in un ambiente di laboratorio (all'interno di una stanza con gli stimoli visualizzati su uno schermo), è stato reso coinvolgente e interattivo per i partecipanti attraverso l'uso di stimoli e obiettivi significativi con cui potevano interagire sullo schermo. Inoltre, il compito richiede ai partecipanti di impegnarsi in una situazione di vita reale, pianificando un percorso per visitare vari luoghi. Per avere un compito ecologico, il paradigma deve sfidare i soggetti a svolgere un comportamento specifico o una funzione cognitiva in modo simile a quello che dovrebbero fare nella vita di tutti i giorni 62,63,147. Per sviluppare un progetto ecologico, il compito di pianificazione utilizzato qui consiste nel pianificare un percorso per visitare luoghi diversi in più fasi56. La prima fase prevede che i partecipanti creino un piano assicurandosi che segua una serie di regole. La seconda fase prevede il mantenimento del piano nella memoria di lavoro, mentre la terza fase prevede l'esecuzione del piano e il monitoraggio della sua aderenza alle regole. Queste fasi rappresentano diverse fasi della pianificazione e dell'orchestrazione di altre funzioni esecutive, come la flessibilità cognitiva, il controllo inibitorio e la memoria di lavoro. Al fine di avere un valido disegno del compito cognitivo ecologico, il compito dovrebbe essere in grado di rilevare specifici disturbi cognitivi in pazienti con disturbi psichiatrici o cognitivi che hanno difficoltà a svolgere quella specifica funzione cognitiva nella loro vita quotidiana105. Ciò può essere ottenuto attraverso la ricerca futura che utilizza questo protocollo.
I risultati comportamentali ottenuti attraverso l'uso di questo protocollo sono stati allineati con le previsioni sperimentali. Una differenza significativa nel comportamento è stata osservata quando la componente di pianificazione è stata rimossa dal compito di controllo per formare una condizione di controllo, facilitando così ulteriori confronti. La condizione di pianificazione è risultata essere cognitivamente più impegnativa della condizione di controllo, come evidenziato da parametri come il tempo di reazione e l'accuratezza. Ciò può riflettere l'aumento del coinvolgimento delle funzioni cognitive elevate nell'attuazione della pianificazione 23,55,56,57,148,149,150.
Considerando che la condizione di controllo coinvolge una cognizione meno complessa, come evidenziato dai tempi di reazione più rapidi, dalle migliori prestazioni e dai diversi processi cognitivi richiesti (la valutazione delle regole), una possibile modifica alternativa consiste nello sfruttare i livelli di complessità presenti nel compito di pianificazione, manipolarli e analizzare parametricamente la funzione di pianificazione in base ai diversi livelli di complessità (ad esempio, aumentando il numero di prove e creando condizioni di prova difficili, medie e facili). Tuttavia, i risultati del nostro protocollo hanno mostrato che, mentre era possibile distinguere tra prove "facili" e "difficili" sulla base di misure comportamentali, non sono state rilevate differenze nelle misure elettrofisiologiche. Ciò suggerisce che i risultati del nostro protocollo riflettono più accuratamente le caratteristiche intrinseche della funzione di pianificazione piuttosto che aspetti più ampi del controllo cognitivo, come l'attenzione, lo sforzo mentale, il livello di difficoltà o un alto livello di richiesta cognitiva54. Tuttavia, ulteriori ricerche potrebbero prendere in considerazione altri tipi di condizioni di controllo, come seguire un percorso segnalato che visita le quattro posizioni degli animali, ma anche ricordare l'ordine di sequenza. In questo modo, il livello di difficoltà potrebbe essere controllato meglio e la pianificazione potrebbe essere distinta dalla memoria di lavoro, ma un possibile svantaggio di questo è la fatica, perché i soggetti dovrebbero svolgere due compiti molto impegnativi.
Diversi studi hanno collegato diversi parametri del movimento oculare a specifici eventi cognitivi. Da un lato, alcuni studi hanno trovato correlazioni tra le oscillazioni theta e il diametro della pupilla durante i compiti cognitivi, suggerendo una relazione tra queste due misure della funzione cognitiva. Ad esempio, Lin et al.152 hanno trovato una correlazione tra l'attività theta mediofrontale e i cambiamenti nelle dimensioni della pupilla, riflettendo vari gradi di conflitto soggettivo. I loro risultati suggeriscono che questi segnali rappresentano l'elaborazione dei conflitti, l'aumento dell'attenzione e le risposte comportamentali flessibili. Quindi, la relazione tra l'attività theta mediofrontale e le risposte della pupilla sembra giocare un ruolo nella ponderazione dei costi e dei benefici durante i processi decisionali. In un altro studio, Yu et al.153 hanno esaminato come l'impegno del tempo sul compito influenzi neurofisiologicamente il controllo cognitivo attraverso un compito di memoria di lavoro che modula le risposte inibitorie del controllo. Hanno studiato la relazione tra i dati del diametro della pupilla e l'attività theta frontale e hanno dimostrato che all'aumentare della durata del compito, le prestazioni diminuivano, e questo era accompagnato da una diminuzione della modulazione della dilatazione della pupilla e dell'attività theta frontale. All'inizio del compito, hanno trovato una forte correlazione tra l'impegno nel compito, l'attività theta e il controllo cognitivo, come indicato dalla modulazione della dilatazione della pupilla, principalmente per compiti impegnativi che richiedevano un'elevata memoria di lavoro e controllo inibitorio. Tuttavia, questa relazione si è dissipata verso la fine, segnalando una disconnessione tra lo sforzo investito e il controllo cognitivo utilizzato per eseguire il compito, che è un segno distintivo degli effetti prefrontali del tempo sul compito153. D'altra parte, altri studi hanno indagato saccadi e oscillazioni. Ad esempio, Nakatani et al.154 hanno rivelato che, in un compito percettivo, l'ampiezza della banda alfa dalle regioni occipitali predice gli effetti delle palpebre e delle saccadi. Inoltre, Velasques et al.155 hanno dimostrato che, durante un compito di attenzione prosaccadica, l'ampiezza della saccade era associata a cambiamenti gamma frontali. Inoltre, Bodala et al.156 hanno scoperto che le diminuzioni del theta della linea mediana frontale erano accompagnate da diminuzioni dell'attenzione sostenuta, così come l'ampiezza e la velocità delle saccadi. Questi risultati suggeriscono che i movimenti oculari, in particolare le saccadi, possono riflettere i processi cognitivi piuttosto che contribuire solo al rumore di fondo nei segnali EEG. Nel presente studio, abbiamo migliorato l'eliminazione degli artefatti legati al movimento oculare utilizzando l'algoritmo ICA con il criterio del rapporto varianza saccade-fissazione126. Questo criterio migliora la rimozione degli artefatti per le attività di visualizzazione libera157. Nel nostro studio, non sono state osservate differenze nella velocità di picco della saccadica e nella coerenza tra la potenza theta e la velocità della saccade in tutte le condizioni. Tuttavia, sono necessari ulteriori studi per rispondere a queste domande.
Un passaggio fondamentale nell'utilizzo di questo protocollo è la calibrazione costante dell'eye tracker durante l'esperimento, poiché la perdita dei dati dello sguardo dalla fotocamera potrebbe causare errori che contaminerebbero l'attività e renderebbero difficile ottenere risposte accurate. Pertanto, è fondamentale calibrare il più spesso possibile. Tuttavia, esiste un compromesso tra il numero di prove con un eye tracker calibrato e la durata dell'esperimento. Nel nostro studio, abbiamo deciso di calibrare ogni cinque prove.
Dovrebbero essere condotte ricerche future che esplorino la relazione tra le oscillazioni theta e il diametro della pupilla durante questo compito di pianificazione. La pianificazione è un aspetto critico del controllo esecutivo che richiede l'allocazione di risorse attentive e il coordinamento di molteplici processi cognitivi. Comprendere la relazione tra le oscillazioni theta e il diametro della pupilla durante le attività di pianificazione potrebbe fornire preziose informazioni sui meccanismi neurali sottostanti al controllo esecutivo e su come cambiano nel tempo. Inoltre, tali studi potrebbero portare a una comprensione più profonda di come i cambiamenti nella funzione cognitiva, come l'affaticamento o i cali di attenzione, influenzino le prestazioni nella pianificazione delle attività e la capacità di allocare le risorse in modo efficace. Queste informazioni potrebbero avere importanti implicazioni per lo sviluppo di interventi volti a migliorare le prestazioni di pianificazione, come programmi di allenamento cognitivo o trattamenti per condizioni come il disturbo da deficit di attenzione/iperattività (ADHD), tra gli altri.
Ricerche precedenti hanno indicato che la PFC svolge un ruolo cruciale nella pianificazione cognitiva, come confermato dai nostri risultati. Questi risultati dimostrano che la pianificazione cognitiva induce l'attività di FMθ nella PFC, in particolare nella corteccia cingolata anteriore, nella corteccia cingolata media e nelle regioni frontali superiori54. Questi risultati sono in linea con le ricerche precedenti sulle funzioni esecutive. Ci sono prove sostanziali a sostegno dell'idea che l'attività di FMθ agisca come un processo dall'alto verso il basso per avviare il controllo e facilitare la comunicazione tra le regioni del cervello durante compiti impegnativi13. Mentre solo pochi studi hanno esaminato le dinamiche temporali dell'attività di FMθ associate al controllo cognitivo, c'è un ampio consenso sul fatto che il profilo temporale di FMθ può fornire informazioni su vari aspetti del controllo cognitivo e sul coinvolgimento di regioni PFC distinte. L'utilizzo del nostro protocollo per la valutazione della pianificazione cognitiva ci ha permesso di caratterizzare il profilo temporale dell'attività FMθ durante la pianificazione. In particolare, l'attività di FMθ durante la condizione di pianificazione ha mostrato un aumento progressivo. Implementando questo protocollo, per la prima volta, è stato dimostrato che FMθ, è presente anche durante l'implementazione della pianificazione, come in altre funzioni cognitive di ordine superiore, e la sua dinamica temporale può fungere da indicatore di controllo cognitivo.
I nostri risultati e il nostro protocollo hanno potenziali applicazioni nel campo delle neuroscienze, anche per migliorare le valutazioni neuropsicologiche virtuali e il trattamento dei disturbi neuropsichiatrici con problemi di pianificazione cognitiva associati, come la depressione e il disturbo da deficit di attenzione/iperattività. Ad esempio, le valutazioni potrebbero comportare l'esame di diversi modelli di errori a livello di prestazioni comportamentali, diversi modelli oscillatori a livello elettrofisiologico e diversi movimenti oculari. Inoltre, i risultati di questo lavoro possono informare lo sviluppo di interfacce cervello-computer e programmi di allenamento cognitivo che mirano a migliorare le capacità di pianificazione cognitiva.
Il presente protocollo può contribuire con nuove prove alla comprensione dei meccanismi neurali che sono alla base dell'elusiva funzione di controllo cognitivo della pianificazione cognitiva nelle popolazioni neurotipiche e neuropsichiatriche. Inoltre, il nostro paradigma comportamentale potrebbe offrire intuizioni sulla neurobiologia del controllo cognitivo e della pianificazione attraverso l'esame delle misurazioni elettrofisiologiche, pupillometriche e comportamentali con un compito di pianificazione pratica che esamina gli aspetti intrinseci della pianificazione piuttosto che le richieste cognitive generali tipicamente presenti nei compiti di controllo cognitivo, come riflesso nei cambiamenti nelle oscillazioni theta.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dal programma di borse di dottorato Becas de Doctorado Nacional año 2015 di ANID 21150295, FONDECYT regular grant 1180932, FONDECYT regular grant 1230383, FONDECYT de Iniciación grant 11220009, Postdoc grant Universidad de O'Higgins e dall'Institut Universitaire de France (IUF). Vogliamo ringraziare il professor Pablo Billeke per il suo feedback sulla progettazione del paradigma. Ringraziamo il professor Eugenio Rodríguez per aver gentilmente condiviso i suoi codici di analisi tempo-frequenza. Infine, ringraziamo Milan Domic, Vicente Medel, Josefina Ihnen, Andrea Sánchez, Gonzalo Boncompte, Catalina Fabar e Daniela Santander per il loro feedback.
Materiali
| Name | Company | Catalog Number | Comments |
| EEG System | Biosemi | ActiveTwo Base system, 64 channels | |
| Eye-tracker System | Eyelink SR Research | EyeLink 1000 Plus Core Unit, High-speed camera, Host PC/Monitor, | |
| CPU display | Intel | Hard drive 221 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| CPU EEG | Intel | Hard drive 223 GB, Processor Intel Core i7-4790 3.60 Hz, OS Windows 7, 4GB RAM | |
| Monitor | ASUS | ASUS VG248QE 24" LCD monitor | |
| Joytsick | Logitech | Model F310 | |
| Luxmeter | Focket | LCD screen (0-200.000 lux) model Liebe WH LX1330B | |
| Statistics software | GraphPad Prism | GraphPad Prism version 8 for Windows | |
| MATLAB Programming Software | The MathWorks | MATLAB R2014a and R2018b | |
| SVG tool Inkscape | Inkscape Project | vector graphic editor software | |
| Presentation Software | Neurobehavioral Systems | stimulus delivery and experiment control program for neuroscience |
Riferimenti
- Siegel, M., Donner, T. H., Engel, A. K. Spectral fingerprints of large-scale neuronal interactions. Nature Reviews Neuroscience. 13 (2), 121-134 (2012).
- Fries, P. A mechanism for cognitive dynamics: Neuronal communication through neuronal coherence. Trends in Cognitive Sciences. 9 (10), 474-480 (2005).
- Fries, P. Rhythms for cognition: Communication through coherence. Neuron. 88 (1), 220-235 (2015).
- Thut, G., Miniussi, C., Gross, J. The functional importance of rhythmic activity in the brain. Current Biology. 22 (16), 658-663 (2012).
- Fröhlich, F., McCormick, D. A. Endogenous electric fields may guide neocortical network activity. Neuron. 67 (1), 129-143 (2010).
- Spaak, E., de Lange, F. P., Jensen, O. Local entrainment of alpha oscillations by visual stimuli causes cyclic modulation of perception. Journal of Neuroscience. 34 (10), 3536-3544 (2014).
- Fiebelkorn, I. C., Saalmann, Y. B., Kastner, S. Rhythmic sampling within and between objects despite sustained attention at a cued location. Current Biology. 23 (24), 2553-2558 (2013).
- Landau, A. N., Fries, P. Attention samples stimuli rhythmically. Current Biology. 22 (11), 1000-1004 (2012).
- Song, K., Meng, M., Lin, C., Zhou, K., Luo, H. Behavioral oscillations in attention: Rhythmic α pulses mediated through θ band. Journal of Neuroscience. 34 (14), 4837-4844 (2014).
- Wyart, V., Nobre, A. C., Summerfield, C. Dissociable prior influences of signal probability and relevance on visual contrast sensitivity. Proceedings of the National Academy of Sciences of the United States of America. 109 (9), 3593-3598 (2012).
- Leszczyński, M., Fell, J., Axmacher, N. Rhythmic working memory activation in the human hippocampus. Cell Reports. 13 (6), 1272-1282 (2015).
- Onton, J., Delorme, A., Makeig, S. Frontal midline EEG dynamics during working memory. NeuroImage. 27 (2), 341-356 (2005).
- Cavanagh, J. F., Frank, M. J. Frontal theta as a mechanism for cognitive control. Trends in Cognitive Sciences. 18 (8), 414-421 (2014).
- Siegel, M., Buschman, T. J., Miller, E. K. Cortical information flow during flexible sensorimotor decisions. Science. 348 (6241), 1352-1355 (2015).
- Weisz, N., et al. Prestimulus oscillatory power and connectivity patterns predispose conscious somatosensory perception. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 417-425 (2014).
- Buzsáki, G., Draguhn, A. Neuronal oscillations in cortical networks. Science. 304 (5679), 1926-1929 (2004).
- Cohen, M. X. A neural microcircuit for cognitive conflict detection and signaling. Trends in Neurosciences. 37 (9), 480-490 (2014).
- Yuste, R. From the neuron doctrine to neural networks. Nature Reviews Neuroscience. 16 (8), 487-497 (2015).
- Helfrich, R. F., Knight, R. T. Oscillatory dynamics of prefrontal cognitive control. Trends in Cognitive Sciences. 20 (12), 916-930 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annual Review of Neurosciences. 24 (1), 167-202 (2001).
- von Nicolai, C., et al. Corticostriatal coordination through coherent phase-amplitude coupling. Journal of Neuroscience. 34 (17), 5938-5948 (2014).
- Sweeney-Reed, C. M., et al. Thalamic theta phase alignment predicts human memory formation and anterior thalamic cross-frequency coupling. ELife. 4, 07578(2015).
- Voytek, B., et al. Oscillatory dynamics coordinating human frontal networks in support of goal maintenance. Nature Neuroscience. 18 (9), 1318-1324 (2015).
- Raghavachari, S., et al. Theta oscillations in human cortex during a working-memory task: Evidence for local generators. Journal of Neurophysiology. 95 (3), 1630-1638 (2006).
- Jacobs, J., Hwang, G., Curran, T., Kahana, M. J. EEG oscillations and recognition memory: Theta correlates of memory retrieval and decision making. NeuroImage. 32 (2), 978-987 (2006).
- Itthipuripat, S., Wessel, J. R., Aron, A. R. Frontal theta is a signature of successful working memory manipulation. Experimental Brain Research. 224 (2), 255-262 (2013).
- Cavanagh, J. F., Zambrano-Vazquez, L., Allen, J. J. B. Theta lingua franca: A common mid-frontal substrate for action monitoring processes. Psychophysiology. 49 (2), 220-238 (2012).
- Mas-Herrero, E., Marco-Pallarés, J. Frontal theta oscillatory activity is a common mechanism for the computation of unexpected outcomes and learning rate. Journal of Cognitive Neuroscience. 26 (3), 447-458 (2014).
- Folstein, J. R., Van Petten, C. Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology. 45 (1), 152-170 (2008).
- Cohen, M. X., Donner, T. H. Midfrontal conflict-related theta-band power reflects neural oscillations that predict behavior. Journal of Neurophysiology. 110 (12), 2752-2263 (2013).
- Walsh, M. M., Anderson, J. R. Modulation of the feedback-related negativity by instruction and experience. Proceedings of the National Academy of Sciences of the United States of America. 108 (47), 19048-19053 (2011).
- Luu, P., Tucker, D. M., Makeig, S. Frontal midline theta and the error-related negativity: Neurophysiological mechanisms of action regulation. Clinical Neurophysiology. 115 (8), 1821-1835 (2004).
- Hanslmayr, S., et al. The electrophysiological dynamics of interference during the Stroop task. Journal of Cognitive Neuroscience. 20 (2), 215-225 (2008).
- Cavanagh, J. F., Cohen, M. X., Allen, J. J. B. Prelude to and resolution of an error: EEG phase synchrony reveals cognitive control dynamics during action monitoring. Journal of Neuroscience. 29 (1), 98-105 (2009).
- Cohen, M. X., van Gaal, S., Ridderinkhof, K. R., Lamme, V. A. F. Unconscious errors enhance prefrontal-occipital oscillatory synchrony. Frontiers in Human Neuroscience. 3, 54(2009).
- Cavanagh, J. F., Frank, M. J., Klein, T. J., Allen, J. J. B. Frontal theta links prediction errors to behavioral adaptation in reinforcement learning. NeuroImage. 49 (4), 3198-3209 (2010).
- Cohen, M. X., Cavanagh, J. F. Single-trial regression elucidates the role of prefrontal theta oscillations in response conflict. Frontiers in Psychology. 2, 30(2011).
- Cohen, M. X., Van Gaal, S. Dynamic interactions between large-scale brain networks predict behavioral adaptation after perceptual errors. Cerebral Cortex. 23 (5), 1061-1072 (2013).
- Nigbur, R., Cohen, M. X., Ridderinkhof, K. R., Stürmer, B. Theta dynamics reveal domain-specific control over stimulus and response conflict. Journal of Cognitive Neuroscience. 24 (5), 1264-1274 (2012).
- van Driel, J., Swart, J. C., Egner, T., Ridderinkhof, K. R., Cohen, M. X. No) time for control: Frontal theta dynamics reveal the cost of temporally guided conflict anticipation. Cognitive, Affective, and Behavioral Neuroscience. 15 (4), 787-807 (2015).
- van de Vijver, I., Ridderinkhof, K. R., Cohen, M. X. Frontal oscillatory dynamics predict feedback learning and action adjustment. Journal of Cognitive Neuroscience. 23 (12), 4106-4121 (2011).
- Narayanan, N. S., Cavanagh, J. F., Frank, M. J., Laubach, M. Common medial frontal mechanisms of adaptive control in humans and rodents. Nature Neuroscience. 16 (12), 1888-1895 (2013).
- Anguera, J. A., et al. Video game training enhances cognitive control in older adults. Nature. 501 (7465), 97-101 (2013).
- Smit, A. S., Eling, P. A. T. M., Hopman, M. T., Coenen, A. M. L. Mental and physical effort affect vigilance differently. International Journal of Psychophysiology. 57 (3), 211-217 (2005).
- Cohen, M. X., Ranganath, C. Reinforcement learning signals predict future decisions. Journal of Neuroscience. 27 (2), 371-378 (2007).
- Gehring, W. J., Goss, B., Coles, M. G. H., Meyer, D. E., Donchin, E. A neural system for error detection and compensation. Psychological Science. 4 (6), 385-390 (1993).
- Yeung, N., Botvinick, M. M., Cohen, J. D. The neural basis of error detection: Conflict monitoring and the error-related negativity. Psychological Review. 111 (4), 931-959 (2004).
- Debener, S., et al. Trial-by-trial coupling of concurrent electroencephalogram and functional magnetic resonance imaging identifies the dynamics of performance monitoring. Journal of Neuroscience. 25 (50), 11730-11737 (2005).
- Hauser, T. U., et al. The feedback-related negativity (FRN) revisited: New insights into the localization, meaning, and network organization. NeuroImage. 84, 159-168 (2014).
- Wang, C., Ulbert, I., Schomer, D. L., Marinkovic, K., Halgren, E. Responses of human anterior cingulate cortex microdomains to error detection, conflict monitoring, stimulus-response mapping, familiarity, and orienting. Journal of Neuroscience. 25 (3), 604-613 (2005).
- Tsujimoto, S., Genovesio, A. Firing variability of frontal pole neurons during a cued strategy task. Journal of Cognitive Neuroscience. 29 (1), 25-36 (2017).
- Womelsdorf, T., Johnston, K., Vinck, M., Everling, S. Theta-activity in anterior cingulate cortex predicts task rules and their adjustments following errors. Proceedings of the National Academy of Sciences of the United States of America. 107 (11), 5248-5253 (2010).
- Womelsdorf, T., Vinck, M., Stan Leung, L., Everling, S. Selective theta synchronization of choice-relevant information subserves goal-directed behavior. Frontiers in Human Neuroscience. 4, 2010(2010).
- Domic-Siede, M., Irani, M., Valdés, J., Perrone-Bertolotti, M., Ossandón, T. Theta activity from frontopolar cortex, mid-cingulate cortex and anterior cingulate cortex shows different roles in cognitive planning performance. NeuroImage. 226, 117557(2021).
- Wilensky, R. Planning and Understanding: A Computational Approach to Human Reasoning. , Addison-Wesley. Reading, MA. (1983).
- Grafman, J., Hendler, J. Planning and the brain. Behavioral and Brain Sciences. 14, 563-564 (1991).
- Hayes-Roth, B., Hayes-Roth, F. A cognitive model of planning. Cognitive Science. 3 (4), 275-310 (1979).
- Tremblay, M., et al. Brain activation with a maze test: An EEG coherence analysis study in healthy subjects. Neuroreport. 5 (18), 2449-2453 (1994).
- Shallice, T. Specific impairments of planning. Philosophical Transactions of the Royal Society B: Biological Sciences. 298 (1089), 199-209 (1982).
- Unterrainer, J. M., Owen, A. M. Planning and problem solving: From neuropsychology to functional neuroimaging. Journal of Physiology. 99 (4-6), 308-317 (2006).
- Domic-Siede, M., et al. La planificación cognitiva en el contexto de la evaluación neuropsicológica e investigación en neurociencia cognitiva: Una revisión sistemática. Terapia Psicológica. 40 (3), 367-395 (2022).
- Miotto, E. C., Morris, R. G. Virtual planning in patients with frontal lobe lesions. Cortex. 34 (5), 639-657 (1998).
- Burgess, P. W., Simons, J. S., Coates, L. M. A., Channon, S. The search for specific planning processes. The Cognitive Psychology of Planning. Morris, R., Ward, G. , Psychology Press. Hove, UK. 199-227 (2005).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Campbell, Z., et al. Utilizing virtual reality to improve the ecological validity of clinical neuropsychology: An fMRI case study elucidating the neural basis of planning by comparing the Tower of London with a three-dimensional navigation task. Applied Neuropsychology. 16 (4), 295-306 (2009).
- Wilson, B. A., Alderman, N., Burgess, P. W., Emslie, H., Evans, J. J. Behavioural Assessment of the Dysexecutive Syndrome. , Thames Valley Test Company. St Edmunds, UK. (1996).
- Spector, L., Grafman, J. Planning, neuropsychology, and artificial intelligence: Cross fertilization. Handbook of Neuropsychology. Boller, F., Grafman, J. 9, Elsevier Science Publishers. Amsterdam, the Netherlands. 377-392 (1994).
- Porteus, S. D. The Maze Test and Clinical Psychology. , Pacific Books. Palo Alto, California. (1959).
- Lis, S., Krieger, S., Wilhelm, J., Gallhofer, B. Feedback about previous action improves executive functioning in schizophrenia: An analysis of maze solving behaviour. Schizophrenia Research. 78 (2-3), 243-250 (2005).
- Zelinsky, G. J. A theory of eye movements during target acquisition. Psychological Review. 115 (4), 787-835 (2008).
- Wurtz, R. H., Goldberg, M. E., Robinson, D. L. Brain mechanisms of visual attention. Scientific American. 246 (6), 124-135 (1982).
- Burr, D., Morrone, M. C. Eye movements: Building a stable world from glance to glance. Current Biology. 15 (20), 839-840 (2005).
- Rolfs, M. Microsaccades: Small steps on a long way. Vision Research. 49 (20), 2415-2441 (2009).
- Ortega, J., Plaska, C. R., Gomes, B. A., Ellmore, T. M. Spontaneous eye blink rate during the working memory delay period predicts task accuracy. Frontiers in Psychology. 13, 788231(2022).
- Grueschow, M., Kleim, B., Ruff, C. C. Role of the locus coeruleus arousal system in cognitive control. Journal of Neuroendocrinology. 32 (12), 12890(2020).
- Aston-Jones, G., Shaver, R., Dinan, T. Cortically projecting nucleus basalis neurons in rat are physiologically heterogeneous. Neuroscience Letters. 46 (1), 19-24 (1984).
- Foote, S. L., Bloom, F. E., Aston-Jones, G. Nucleus locus coeruleus: New evidence of anatomical and physiological specificity. Physiological Reviews. 63 (3), 844-914 (1983).
- Siever, L. J., Davis, K. L. Overview: Toward a dysregulation hypothesis of depression. The American Journal of Psychiatry. 142 (9), 1017-1031 (1985).
- Aston-Jones, G., Gold, J. I. How we say no: Norepinephrine, inferior frontal gyrus, and response inhibition. Biological Psychiatry. 65 (7), 548-549 (2009).
- Aston-Jones, G., Cohen, J. D. An integrative theory of locus coeruleus norepinephrine function: adaptive gain and optimal performance. Annual Review of Neurosciences. 28, 403-450 (2005).
- Einhauser, W., Stout, J., Koch, C., Carter, O. Pupil dilation reflects perceptual selection and predicts subsequent stability in perceptual rivalry. Proceedings of the National Academy of Sciences of the United States of America. 105 (5), 1704-1709 (2008).
- Yoshitomi, T., Ito, Y., Inomata, H. Adrenergic excitatory and cholinergic inhibitory innervations in the human iris dilator. Experimental Eye Research. 40 (3), 453-459 (1985).
- Rajkowski, J., Kubiak, P., Aston-Jones, G. Locus coeruleus activity in monkey: Phasic and tonic changes are associated with altered vigilance. Brain Research Bulletin. 35 (5-6), 607-616 (1994).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Beatty, J., Kahneman, D. Pupillary changes in two memory tasks. Psychonomic Science. 5, 371-372 (1966).
- Hess, E. H., Polt, J. M. Pupil size in relation to mental activity during simple problem-solving. Science. 143 (3611), 1190-1192 (1964).
- Kuchinke, L., Vo, M. L., Hofmann, M., Jacobs, A. M. Pupillary responses during lexical decisions vary with word frequency but not emotional valence. International Journal of Psychophysiology. 65 (2), 132-140 (2007).
- Barkley, R. A. Adolescents with attention-deficit/hyperactivity disorder: An overview of empirically based treatments. Journal of Psychiatric Practice. 10 (1), 39-56 (2004).
- Gau, S. S. F. em89, Shang, C. Y. Executive functions as endophenotypes in ADHD: Evidence from the Cambridge Neuropsychological Test Battery (CANTAB). Journal of Child Psychology and Psychiatry and Allied Disciplines. 51 (7), 838-849 (2010).
- Bora, E., Harrison, B. J., Yücel, M., Pantelis, C. Cognitive impairment in euthymic major depressive disorder: A meta-analysis. Psychological Medicine. 43 (10), 2017-2026 (2013).
- Rive, M. M., Koeter, M. W. J., Veltman, D. J., Schene, A. H., Ruhé, H. G. Visuospatial planning in unmedicated major depressive disorder and bipolar disorder: Distinct and common neural correlates. Psychological Medicine. 46 (11), 2313-2328 (2016).
- Holt, D. V., Wolf, J., Funke, J., Weisbrod, M., Kaiser, S. Planning impairments in schizophrenia: Specificity, task independence and functional relevance. Schizophrenia Research. 149 (1-13), 174-179 (2013).
- Lima-Silva, T. B., et al. Functional profile of patients with behavioral variant frontotemporal dementia (bvFTD) compared to patients with Alzheimer's disease and normal controls. Dementia and Neuropsychologia. 7 (1), 96-103 (2013).
- Karnath, H. O., Wallesch, C. W., Zimmermann, P. Mental planning and anticipatory processes with acute and chronic frontal lobe lesions: A comparison of maze performance in routine and non-routine situations. Neuropsychologia. 29 (4), 271-290 (1991).
- Staudigl, T., Hartl, E., Noachtar, S., Doeller, C. F., Jensen, O. Saccades are phase-locked to alpha oscillations in the occipital and medial temporal lobe during successful memory encoding. PLoS Biology. 15 (12), 2003404(2017).
- Faul, F., Erdfelder, E., Lang, A. G., Buchner, A. G*Power 3: A flexible statistical power analysis program for the social, behavioral, and biomedical sciences. Behavior Research Methods. 39 (2), 175-191 (2007).
- Ferrando, L., Bobes, J., Gibert, J., Soto, M. MINI Entrevista Neuropsiquiátrica Internacional (MINI International Neuropsychiatric Interview, MINI). Instrumentos de Detección y Orientación Diagnóstica. , Retrieved from www.novartis.es (2000).
- McAssey, M., Dowsett, J., Kirsch, V., Brandt, T., Dieterich, M. Different EEG brain activity in right and left-handers during visually induced self-motion perception. Journal of Neurology. 267 (1), 79-90 (2020).
- Kelly, R., Mizelle, J. C., Wheaton, L. A. Distinctive laterality of neural networks supporting action understanding in left- and right-handed individuals: An EEG coherence study. Neuropsychologia. 75, 20-29 (2015).
- O'Hare, A. J., Atchley, R. A., Young, K. M. Central and divided visual field presentation of emotional images to measure hemispheric differences in motivated attention. Journal of Visualized Experiments. (129), 56257(2017).
- Beatty, J. Task-evoked pupillary responses, processing load, and the structure of processing resources. Psychological Bulletin. 91 (2), 276-292 (1982).
- Wainstein, G., et al. Pupil size tracks attentional performance in attention-deficit/hyperactivity disorder. Scientific Reports. 7 (1), 8228(2017).
- Drueke, B., et al. Neural correlates of positive and negative performance feedback in younger and older adults. Behavioral and Brain Functions. 11, 17(2015).
- Lezak, M. D. The problem of assessing executive functions. International Journal of Psychology. 17 (1-4), 281-297 (1982).
- Oosterman, J. M., Wijers, M., Kessels, R. P. C. Planning or something else? Examining neuropsychological predictors of zoo map performance. Applied Neuropsychology. 20 (2), 103-109 (2013).
- Keil, A., et al. Committee report: Publication guidelines and recommendations for studies using electroencephalography and magnetoencephalography. Psychophysiology. 51 (1), 1-21 (2014).
- Abokyi, S., Owusu-Mensah, J., Osei, K. A. Caffeine intake is associated with pupil dilation and enhanced accommodation. Eye. 31 (4), 615-619 (2017).
- Wilhelm, B., Stuiber, G., Lüdtke, H., Wilhelm, H. The effect of caffeine on spontaneous pupillary oscillations. Ophthalmic & Physiological Optics. 34 (1), 73-81 (2014).
- McGinley, M. J., David, S. V., McCormick, D. A. Cortical membrane potential signature of optimal states for sensory signal detection. Neuron. 87 (1), 179-192 (2015).
- Slotnick, S. D. High density event-related potential data acquisition in cognitive neuroscience. Journal of Visualized Experiments. (38), 1945(2010).
- Lamm, C., Windischberger, C., Leodolter, U., Moser, E., Bauer, H. Co-registration of EEG and MRI data using matching of spline interpolated and MRI-segmented reconstructions of the scalp surface. Brain Topography. 14 (2), 93-100 (2001).
- Schwartz, D., et al. Registration of MEG/EEG data with 3D MRI: Methodology and precision issues. Brain Topography. 9, 101-116 (1996).
- Laeng, B., Sirois, S., Gredebäck, G. Pupillometry: A window to the preconscious? Perspectives on psychological science. Journal of the Association for Psychological Science. 7 (1), 18-27 (2012).
- Vandierendonck, A. A comparison of methods to combine speed and accuracy measures of performance: A rejoinder on the binning procedure. Behavior Research Methods. 49 (2), 653-673 (2017).
- Vandierendonck, A. Further tests of the utility of integrated speed-accuracy measures in task switching. Journal of Cognition. 1 (1), 8(2018).
- Levene, H. Robust tests for equality of variances. In Contributions to Probability and Statistics: Essays in Honor of Harold Hotelling. Olkin, I. , Stanford University Press. Redwood City, CA. 278-292 (1960).
- Zimmerman, D. W. A note on preliminary tests of equality of variances. The British Journal of Mathematical and Statistical Psychology. 57, 173-181 (2004).
- D'Agostino, R. B., Belanger, A., D'Agostino, R. B. A suggestion for using powerful and informative tests of normality). The American Statistician. 44 (4), 316(1990).
- Shapiro, S. S., Wilk, M. B. An analysis of variance test for normality (complete samples). Biometrika. 52 (3-4), 591-611 (1965).
- Wilcoxon, F. Individual comparisons by ranking methods. Biometrics Bulletin. 1 (6), 80(1945).
- Fay, M. P., Proschan, M. A. Wilcoxon-Mann-Whitney or t-test? On assumptions for hypothesis tests and multiple interpretations of decision rules. Statistics Surveys. 4, 1-39 (2010).
- Delorme, A., Makeig, S. EEGLAB: An open-source toolbox for analysis of single-trial EEG dynamics including independent component analysis. Journal of Neuroscience Methods. 134 (1), 9-21 (2004).
- Dimigen, O., Sommer, W., Hohlfeld, A., Jacobs, A. M., Kliegl, R. Coregistration of eye movements and EEG in natural reading: Analyses and review. Journal of Experimental Psychology. 140 (4), 552-572 (2011).
- Mognon, A., Jovicich, J., Bruzzone, L., Buiatti, M. ADJUST: An automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 48 (2), 229-240 (2011).
- Bell, A. J., Sejnowski, T. J. A non-linear information maximization algorithm that performs blind separation. Advances in Neural Information Processing Systems 7. Leen, T. K., Tesauro, G., Touretsky, D. S. , MIT Press. Cambridge, MA. edited by (1995).
- Plöchl, M., Ossandón, J. P., König, P. Combining EEG and eye tracking: Identification, characterization, and correction of eye movement artifacts in electroencephalographic data. Frontiers in Human Neuroscience. 6, 278(2012).
- Pion-Tonachini, L., Kreutz-Delgado, K., Makeig, S. ICLabel: An automated electroencephalographic independent component classifier, dataset, and website. NeuroImage. 198, 181-197 (2019).
- Gartner, M., Grimm, S., Bajbouj, M. Frontal midline theta oscillations during mental arithmetic: Effects of stress. Frontiers in Behavioral Neuroscience. 9, 96(2015).
- Wang, W., Viswanathan, S., Lee, T., Grafton, S. T. Coupling between theta oscillations and cognitive control network during cross-modal visual and auditory attention: Supramodal vs modality-specific mechanisms. PLoS One. 11 (7), 0158465(2016).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG- and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Tadel, F., Baillet, S., Mosher, J. C., Pantazis, D., Leahy, R. M. Brainstorm: A user-friendly application for MEG/EEG analysis. Computational Intelligence and Neuroscience. 2011, 879716(2011).
- Pascual-Marqui, R. D. Standardized low-resolution brain electromagnetic tomography (sLORETA): Technical details. Methods and Findings in Experimental and Clinical Pharmacology. 24, 5-12 (2002).
- Gramfort, A., Papadopoulo, T., Olivi, E., Clerc, M. OpenMEEG: Opensource software for quasistatic bioelectromagnetics). Biomedical Engineering Online. 9, 45(2010).
- Destrieux, C., Fischl, B., Dale, A., Halgren, E. Automatic parcellation of human cortical gyri and sulci using standard anatomical nomenclature. Neuroimage. 53 (1), 1-15 (2010).
- Orr, J. M., Weissman, D. H. Anterior cingulate cortex makes 2 contributions to minimizing distraction. Cerebral Cortex. 9 (3), 703-711 (2009).
- Christoff, K., Gabrieli, J. D. E. The frontopolar cortex and human cognition: Evidence for a rostrocaudal hierarchical organization within the human prefrontal cortex. Psychobiology. 28 (2), 168-186 (2000).
- Nitschke, K., Köstering, L., Finkel, L., Weiller, C., Kaller, C. P. A meta-analysis on the neural basis of planning: Activation likelihood estimation of functional brain imaging results in the Tower of London task. Human Brain Mapping. 38 (1), 396-413 (2017).
- Barbey, A. K., Koenigs, M., Grafman, J. Dorsolateral prefrontal contributions to human working memory. Cortex. 49 (5), 1195-1205 (2013).
- Le Van Quyen, M., et al. Comparison of Hilbert transform and wavelet methods for the analysis of neuronal synchrony. Journal of Neuroscience Methods. 111 (2), 83-98 (2001).
- Bokil, H., Andrews, P., Kulkarni, J. E., Mehta, S., Mitra, P. P. Chronux: A platform for analyzing neural signals. Journal of Neuroscience Methods. 192 (1), 146-151 (2010).
- Sato, N., Yamaguchi, Y. EEG theta regulates eye saccade generation during human object-place memory encoding. Advances in Cognitive Neurodynamics ICCN 2007. , Springer. Dordrecht, the Netherlands. 429-434 (2008).
- Zaki, J., Ochsner, K. The need for a cognitive neuroscience of naturalistic social cognition. Annals of the New York Academy of Sciences. 1167, 16-30 (2009).
- Shamay-Tsoory, S. G., Mendelsohn, A. Real-life neuroscience: An ecological approach to brain and behavior research. Perspectives on Psychological Science. 14 (5), 841-859 (2019).
- Diamond, A. Executive functions. Annual Review of Psychology. 64, 135-168 (2013).
- Dudai, Y. Memory from A to Z: Keywords, Concepts and Beyond. , Oxford University Press. New York, NY. (2002).
- Kingstone, A., Smilek, D., Ristic, J., Friesen, C. K., Eastwood, J. D. Attention, researchers! It is time to take a look at the real world. Current Directions in Psychological Science. 12 (5), 176-180 (2003).
- Morris, R. G., Ward, G. Introduction to the psychology of planning. The Cognitive Psychology of Planning. Morris, R., Ward, G. , Psychology Press. Hove, UK. (2005).
- Zwosta, K., Ruge, H., Wolfensteller, U. Neural mechanisms of goal-directed behavior: Outcome-based response selection is associated with increased functional coupling of the angular gyrus. Frontiers in Human Neuroscience. 9, 180(2015).
- Owen, A. M., Doyon, J., Petrides, M., Evans, A. C. Planning and spatial working memory: A positron emission tomography study in humans. European Journal of Neuroscience. 8 (2), 353-364 (1996).
- Ossandon, T., et al. Efficient "pop-out" visual search elicits sustained broadband gamma activity in the dorsal attention network. Journal of Neuroscience. 32 (10), 3414-3421 (2012).
- Lezak, M. D. Neuropsychological Assessment., 3rd edition. , Oxford University Press. New York, NY. (1995).
- Lin, H., Saunders, B., Hutcherson, C. A., Inzlicht, M. Midfrontal theta and pupil dilation parametrically track subjective conflict (but also surprise) during intertemporal choice. NeuroImage. 172, 838-852 (2018).
- Yu, S., Mückschel, M., Beste, C. Superior frontal regions reflect the dynamics of task engagement and theta band-related control processes in time-on task effects. Scientific Reports. 12 (1), 846(2022).
- Nakatani, H., van Leeuwen, C. Antecedent occipital alpha band activity predicts the impact of oculomotor events in perceptual switching. Frontiers in Systems Neuroscience. 7, 19(2013).
- Velasques, B., et al. Changes in saccadic eye movement (SEM) and quantitative EEG parameter in bipolar patients. Journal of Affective Disorders. 145 (3), 378-385 (2013).
- Bodala, I. P., Li, J., Thakor, N. V., Al-Nashash, H. EEG and eye tracking demonstrate vigilance enhancement with challenge integration. Frontiers in Human Neuroscience. 10, 273(2016).
- Dimigen, O. Optimizing the ICA-based removal of ocular EEG artifacts from free viewing experiments. NeuroImage. 207, 116117(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon