Method Article
Misurazione in tempo reale e ripetuta della crescita muscolare scheletrica in singoli pesci zebra vivi sottoposti ad alterata attività elettrica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La chiarezza ottica è un grande vantaggio per il lavoro biologico e fisiologico delle cellule nel pesce zebra. Vengono descritti metodi robusti per la misurazione della crescita cellulare nei singoli animali che consentono nuove intuizioni su come la crescita del muscolo scheletrico e dei tessuti vicini sono integrati con la crescita di tutto il corpo.
Abstract
Un certo numero di metodi può essere utilizzato per visualizzare singole cellule in tutto il corpo di zebrafish embrionale, larvale o giovanile vivo. Mostriamo che i pesci vivi con membrane plasmatiche marcate in modo fluorescente possono essere scansionati in un microscopio a scansione laser confocale per determinare il volume del tessuto muscolare e il numero di fibre muscolari presenti. Approcci efficienti per la misurazione del numero e delle dimensioni delle cellule negli animali vivi nel tempo sono descritti e convalidati rispetto a metodi di segmentazione più difficili. Vengono descritti metodi che consentono il controllo dell'attività elettrica muscolare, e quindi contrattile. La perdita dell'attività contrattile del muscolo scheletrico ha ridotto notevolmente la crescita muscolare. Nelle larve viene descritto un protocollo che consente la reintroduzione dell'attività contrattile evocata elettricamente. I metodi descritti minimizzano l'effetto della variabilità interindividuale e permetteranno di analizzare l'effetto di stimoli elettrici, genetici, farmacologici o ambientali su una varietà di parametri di crescita cellulare e fisiologica nel contesto dell'organismo vivente. Il follow-up a lungo termine degli effetti misurati di un intervento definito all'inizio della vita sugli individui può essere successivamente eseguito.
Introduzione
La crescita tissutale regolata, che comprende l'aumento del numero cellulare (iperplasia) e / o delle dimensioni delle cellule (ipertrofia), è un fattore cruciale nello sviluppo, nella rigenerazione e nell'adattamento ecologico ed evolutivo. Nonostante gli enormi progressi nella comprensione genetica molecolare della biologia cellulare e dello sviluppo negli ultimi decenni, la comprensione meccanicistica della regolazione delle dimensioni dei tessuti e degli organi è ancora agli inizi. Una delle ragioni di questa lacuna nella conoscenza è la difficoltà di quantificare la crescita dei tessuti negli organismi viventi con la necessaria precisione spaziale e temporale.
Vari aspetti della crescita di organismi interi possono essere misurati ripetutamente nel tempo, rivelando curve di crescita per ogni individuo 1,2,3,4,5. Metodi di scansione sempre più sofisticati, come la doppia assorbimetria a raggi X (DXA), la tomografia computerizzata (TC) e la risonanza magnetica (MRI), consentono di tracciare la crescita di interi organi e altre regioni del corpo (ad esempio, singoli muscoli scheletrici identificati) in singoli individui, sia umani che in organismi modello 6,7,8,9,10 . Tuttavia, questi metodi non hanno ancora la risoluzione di rivelare le singole cellule e quindi i legami tra i comportamenti cellulari e la crescita a livello tissutale sono stati difficili da discernere. Per stabilire tali collegamenti, gli studi tradizionali si sono spesso basati su coorti di singoli animali simili, alcuni dei quali vengono sacrificati in punti temporali successivi e quindi analizzati in dettaglio citologico. Tali approcci richiedono la media dei cambiamenti osservati tra gruppi di individui (preferibilmente simili, ma comunque variabili) e quindi soffrono di una mancanza di risoluzione temporale e spaziale, rendendo difficile trovare eventi correlati a livello cellulare indicativi di causa ed effetto.
Studi su organismi modello invertebrati, inizialmente in C. elegans e D. melanogaster, hanno aggirato questi problemi sviluppando la microscopia ottica per ottenere la risoluzione cellulare e misurare con precisione la crescita nel tempo in singoli individui. Tali studi hanno rivelato comportamenti di lignaggio cellulare sorprendentemente invarianti nella crescita di questi piccoli organismi modello 11,12,13,14,15,16,17. Tuttavia, molti animali, compresi tutti i vertebrati, hanno linee cellulari indeterminate e controllano la crescita dei tessuti attraverso misteriosi processi di feedback che servono a trasformare il programma di crescita geneticamente codificato in un organismo tridimensionale funzionale con tutti i suoi tessuti e organi costitutivi adeguatamente abbinati in termini di dimensioni. Per comprendere questi complessi processi di crescita, è auspicabile immaginare interi tessuti o organi nel tempo in singoli individui che possono essere manipolati sperimentalmente da interventi genetici, farmacologici o di altro tipo in un momento di scelta e l'effetto successivamente analizzato.
Ogni muscolo scheletrico vertebrato ha una dimensione, una forma e una funzione definite e interazioni ben caratterizzate con i tessuti adiacenti, come ossa, tendini e nervi. Alcuni muscoli sono piccoli, si trovano appena sotto la pelle e sono quindi buoni candidati per studi di imaging ad alta risoluzione. Simile alla maggior parte degli organi, ogni muscolo cresce durante la vita embrionale, postnatale e giovanile, prima di raggiungere una dimensione adulta stabile. Il muscolo, tuttavia, ha anche una capacità unica di cambiare dimensione durante la vita adulta, a seconda dell'uso e della nutrizione18, e questa proprietà ha un impatto importante sulla forma fisica dell'organismo, sulle prestazioni sportive e sulla vita indipendente. La perdita di massa muscolare e di funzione in età avanzata, la sarcopenia, è un problema di crescente preoccupazione per le società che affrontano l'invecchiamento della popolazione 19,20,21.
Noi e altri ci siamo concentrati sulla crescita di blocchi definiti di tessuto muscolare scheletrico nel corpo segmentalmente ripetuto delle larve di zebrafish, come un sistema apparentemente chiuso contenente diverse centinaia di cellule in cui la crescita, il mantenimento e la riparazione dei tessuti possono essere osservati e manipolati 22,23,24,25,26. Mentre alcuni lavori quantitativi sono stati precedentemente riportati 25,26,27,28,29,30,31,32,33,34,35, non è disponibile alcun metodo dettagliato e convalidato per misurare la crescita muscolare in dettaglio cellulare nei singoli organismi vertebrati nel tempo. Qui viene descritto un protocollo efficiente su come eseguire tali misurazioni ripetute, insieme alla convalida, e viene fornito un esempio del suo uso per analizzare i cambiamenti nella crescita ipertrofica e iperplastica in risposta all'attività elettrica alterata.
Protocollo
Tutte le ricerche descritte sono state eseguite in conformità con le linee guida istituzionali e sotto adeguate licenze del Ministero degli Interni del Regno Unito in conformità con l'Animal (Scientific Procedures) Act 1986 e successive modifiche. Gli embrioni/larve devono essere allevati a 28,5 °C fino al completamento della gastrulazione, ma possono poi essere mantenuti a 22-31 °C per controllare il tasso di sviluppo. I pesci possono essere scansionati o stimolati a temperatura ambiente.
1. Anestetizzare le larve di zebrafish
- Incrociare pesci adulti reporter fluorescenti adatti come Tg(Ola.Actb:Hsa.HRAS-EGFP)vu119Tg riferimento 36 o Tg(α-actina:mCherry-CAAX)pc22Tg riferimento37 e raccogliere embrioni come descritto38.
- Al momento della scelta, ad esempio 2 giorni dopo la fecondazione (dpf), anestetizzare brevemente gli embrioni utilizzando terreno di pesce contenente tricaina (acqua di pesce o mezzo E3) e schermare EGFP o mCherry al microscopio a fluorescenza, come un Leica MZ16F. Se uno ha molti embrioni, seleziona quelli con il segnale più luminoso. Riportare gli embrioni al normale terreno di coltura immediatamente dopo lo screening.
2. Montaggio del pesce per la scansione confocale
- Accendere il sistema di scansione laser confocale e i laser, per consentire al sistema di stabilizzarsi per 30-60 minuti.
NOTA: Qui, abbiamo utilizzato un microscopio Zeiss LSM 5 Exciter con supporto verticale (che migliora la distanza di lavoro) dotato di un obiettivo di immersione in acqua 20x/1,0 W. - Preparare l'agarosio a basso punto di fusione (LMA) all'1% e conservare in un blocco termico a 37 °C per un uso ripetuto in una provetta da 1,5 ml. Per evitare lo shock termico, rimuovere l'aliquota LMA dal blocco termico e lasciarla raffreddare appena sopra l'impostazione prima di applicare sulla larva, testando contro la propria pelle per giudicare la temperatura appropriata, come quando si valuta la temperatura del latte artificiale.
- Selezionare il pesce da montare e anestetizzare transitoriamente ogni pesce a turno con Tricaina (0,6 mM in mezzo di pesce).
- Prendi una capsula di Petri di 60 mm di diametro che è stata rivestita con uno strato di agarosio all'1% e mettila sul palco di un microscopio da dissezione.
- Trasferire la larva con una pipetta Pasteur di plastica da 1 mL sulla piastra di Petri rivestita da 60 mm e rimuovere il più possibile il mezzo trasferito. Quindi, sempre utilizzando la pipetta Pasteur, posizionare da 5 a 10 gocce di LMA sul pesce e posizionare rapidamente orizzontalmente in vista laterale con una pinza (o un ago di vetro fine lucidato a fuoco) prima che l'LMA si stabilizzi. Per un'imaging ottimale, è preferibile posizionare la larva vicino alla superficie superiore dell'LMA.
- In alternativa, utilizzando una pipetta Pasteur in plastica da 1 ml, raccogliere la larva con il minor mezzo di pesce possibile e trasferire la larva nell'aliquota di LMA raffreddato. Lasciare che la larva affondi per 5 secondi per diventare completamente circondata da LMA. Quindi, recuperare la larva e trasferirla in una goccia di LMA sulla capsula di Petri ricoperta di agarosio. Orientare e posizionare rapidamente la larva come descritto sopra.
- Orientare la larva con entrambi gli assi anteroposteriore e dorsoventrale entro 10° dall'orizzontale (cfr. la nota «Sull'errore e la sua correzione», al punto 4.6).
- Se la larva non è montata correttamente orizzontalmente vicino alla superficie della goccia di agarosio, rimuovere e reincorporare. Le larve possono essere facilmente recuperate mediante aspirazione delicata utilizzando una pipetta Pasteur in plastica microfine da 1 mL e LMA può essere rimosso delicatamente utilizzando Kimwipes. La pratica rende davvero perfetti nella procedura di montaggio; Trascorri un pomeriggio incorporando alcune larve poco importanti prima di provare questo in un vero esperimento.
NOTA: Sulla progettazione del microscopio: molti laboratori utilizzano microscopi confocali invertiti per l'imaging attraverso un vetrino. Abbiamo scoperto che l'incorporazione ripetuta e la rimozione di pesci tenuti in agarosio sotto un coprislip per l'osservazione in un microscopio invertito porta a una maggiore perdita di campioni durante la scansione ripetuta rispetto alla procedura descritta con un microscopio verticale. Per questo motivo, si consiglia l'uso di un sistema verticale, se disponibile. Tuttavia, una chiave per dati di alta qualità è la corretta selezione e l'uso di parametri oggettivi e di scansione, un argomento troppo grande per essere discusso qui.
- Se la larva non è montata correttamente orizzontalmente vicino alla superficie della goccia di agarosio, rimuovere e reincorporare. Le larve possono essere facilmente recuperate mediante aspirazione delicata utilizzando una pipetta Pasteur in plastica microfine da 1 mL e LMA può essere rimosso delicatamente utilizzando Kimwipes. La pratica rende davvero perfetti nella procedura di montaggio; Trascorri un pomeriggio incorporando alcune larve poco importanti prima di provare questo in un vero esperimento.
3. Scansione confocale
- Quando LMA ha impostato, inondare il piatto con circa 10 ml di terreno di pesce contenente tricaina. Se si prevede di catturare pile confocali, lasciare riposare il pesce montato per almeno 10 minuti prima di procedere alla scansione, poiché si verifica un certo gonfiore dell'agarosio.
- Caricare il piatto campione sullo stadio del sistema confocale, individuare la larva e concentrarsi sulla somite desiderata. Somite 17 può essere scelto per la sua facilità di localizzazione vicino allo sfiato anale e la facilità di imaging. Controllare contando i somiti anteriorri.
NOTA: Il primo somite è fuso dietro l'orecchio e non ha bordo anteriore, ma può essere facilmente osservato per avere fibre muscolari striate. - Impostare come per catturare una Z-stack definendo la parte superiore (cioè appena sopra la pelle) e quella inferiore (cioè appena sotto la notocorda, in modo da includere l'intero somite, anche se il pesce è montato leggermente inclinato). Entrambi i lati sinistro e destro possono essere catturati come desiderato. Ciò garantirà che tutte le scansioni YZ rapide catturino le regioni desiderate.
- Acquisire un'immagine XY come segue. Orientare l'area di scansione rispetto al pesce, come consente il software confocale. Posizionare il pesce con l'asse anteroposteriore parallelo all'asse X dell'immagine e l'asse dorsoventrale parallelo all'asse Y con somite 17 al centro del campo come mostrato nel file supplementare 1. Mettere a fuoco un piano di medio livello nel miotomo superiore in cui sono visibili tutte le metà della somite epaxiale e ipassiale insieme ai miosepti verticali e orizzontali e catturare un'immagine XY ad alta risoluzione. Ricordati di assegnare un nome e salvare l'immagine.
- Acquisire una o più immagini YZ come segue. Nei risultati rappresentativi (sotto) viene confrontata l'accuratezza dei metodi a 2 e 4 sezioni. Nell'approccio a 2 sezioni, vengono impiegate singole scansioni XY e YZ . Nell'approccio a 4 fette, vengono mediate tre scansioni YZ per fornire una stima più accurata del volume del miotomo. Se richiesto dal software confocale, riorientare il campo di scansione.
- Disegna una linea da dorsale a ventrale precisa attraverso la somite scelta perpendicolarmente all'asse anteroposteriore del pesce in una posizione anteroposteriore selezionata. Eseguire una scansione della linea Z-stack.
- Ripetere la scansione della linea YZ tre volte in posizioni anteroposteriori definite lungo il miotomo selezionato per catturare YZa, YZm e YZp. I risultati rappresentativi sono mostrati nella Figura 2A. Assegna un nome e salva queste immagini insieme all'immagine XY correlata.
NOTA: Sulla selezione dei piani YZ: il miotomo è a forma di V e la sua forma cambia durante la crescita. Per ottenere la valutazione più accurata del volume del miotomo 17 con il metodo a 4 fette, posizionare YZa sulla punta anteriore del miotomo, YZp sulle punte posteriori del miotomo agli estremi dorsali e ventrali e YZm a metà strada tra YZa e YZp. Supponendo che il somite si assottigli uniformemente, la media delle misurazioni di ciascuna sezione YZ rappresenterà il miotomo nel suo insieme. Per il metodo a 2 fette, la singola scansione YZ deve essere posizionata all'estremità posteriore del miosetto orizzontale, che corrisponde approssimativamente al centro anteroposteriore del miotomo di interesse (come YZm). In alternativa, una serie di tre sezioni YZ può essere presa anteriormente, al centro e nella parte posteriore del miosetto orizzontale ma, come mostrato di seguito, tale misurazione sovrastima o sottostima leggermente il volume del miotomo (per i somiti rostrali e caudali, rispettivamente, a causa della riduzione del miotomo). Fondamentalmente, la coerenza nel posizionamento dei piani di fette YZ tra pesci ed esperimenti è la chiave per la riproducibilità.
4. Analisi
- Poiché il miotomo cambia dimensione lungo il pesce in modo graduale, lavora sempre con lo stesso somite negli studi comparativi.
- Per misurare e calcolare il volume del miotomo, utilizzare il software confocale (come i file .lsm creati utilizzando il software per microscopi Zeiss ZEN) o il software di analisi universale delle immagini open source, come Fiji/ImageJ.
NOTA: se si modificano i formati di file, assicurarsi che la dimensione Z-step sia trasferita correttamente, poiché non tutti i software sono in grado di leggere correttamente i formati di file confocali proprietari. Ad esempio, per importare un'immagine di scansione lineare ZEN nelle Figi, utilizzare innanzitutto il comando File/Esporta per esportare .tif nella finestra Immagine ad alta risoluzione - formato piano singolo, quindi importarla nelle Figi. Sebbene YZ scan.lsm possa essere aperto direttamente nelle Figi, le immagini YZ risultanti sono generalmente compresse nella dimensione Z a causa di una valutazione errata della dimensione del passo Z. - Analisi con ZEN
- Innanzitutto, apri i file XY scan.lsm in ZEN. Vai alla scheda Grafica e seleziona lo strumento Linea. Tracciare una linea tra i due miosetti verticali di somite 17 che copre l'intera lunghezza del miotomo (parallela all'asse anteroposteriore del pesce). Selezionare la casella M per visualizzare i valori della misurazione (Lunghezza = 89,71 μm, vedere File supplementare 2).
- Aprire i file YZ scan.lsm. Nella scheda Grafica , selezionate lo strumento Bezier chiuso . Disegna attorno al perimetro del miotomo. Una volta completato, selezionare la casella M, questo rivelerà il valore della misurazione (Area = 11980.01 μm2, vedi File supplementare 3).
- Registrare manualmente i valori di ogni misurazione in un foglio di calcolo. Calcolare la media delle misurazioni CSA come richiesto. Il volume del miotomo può essere calcolato come Volume = Lunghezza del miotomo x CSA, cioè 89,71 μm x 11980,01 μm2 = 1,075 x 106 μm3.
- Analisi con Fiji/ImageJ
- Aprire i file XY scan.lsm in Fiji/ImageJ. Controlla se le immagini XY aperte direttamente nelle Figi sono calibrate correttamente in scala, come dovrebbero essere.
- Selezionate lo strumento linea retta dalle icone. Tracciare una linea lungo la lunghezza della somite 17 come descritto al punto 4.3.1. Impostare i parametri di misurazione andando su Analizza, quindi selezionare Imposta misure..., e selezionare le seguenti caselle Area e Visualizza etichetta. Per misurare, è sufficiente premere il tasto di scelta rapida M, oppure andare al menu Analizza e selezionare Misura. Una finestra pop-up risultante elenca tutti i valori di misurazione (ad esempio, Lunghezza = 90,023 μm; vedere File supplementare 4). I risultati possono essere salvati sotto forma di .csv e aperti in Microsoft Excel o simili per analisi successive.
- Per misurare CSA sulle immagini YZ, aprire le immagini YZ in .tif formato come descritto nel passaggio 4.2.
- Calibrare le immagini .tif YZ poiché non sono calibrate quando vengono esportate. I parametri per la calibrazione possono essere ottenuti in ZEN andando alle Info delle immagini selezionate: registrare i valori di Scaling X (0.489 μm) e Scaling Z (0.890 μm; vedi Supplemental File 5). Successivamente, mentre le immagini sono aperte nelle Fiji, vai su Immagine e seleziona Proprietà .... Immettere 0,489 μm per la larghezza e l'altezza dei pixel e 0,890 μm per la profondità del voxel. Selezionare la casella Globale per applicare la calibrazione universalmente se è prevista una misurazione ripetuta delle immagini YZ (vedere File supplementare 6).
NOTA: assicurarsi che tutte le immagini YZ vengano acquisite utilizzando gli stessi parametri di scansione; riavviare Fiji/ImageJ o modificare i valori di calibrazione se è necessario un nuovo set di calibrazione. - Per misurare il CSA delle immagini YZ calibrate, selezionate lo strumento Selezioni poligonali dalle icone. Disegnare attorno al perimetro del somite, e premere M per rivelare i valori della misurazione (Area = 11980,395 μm2; vedere File supplementare 7). Il volume del miotomo può essere calcolato come Volume = Lunghezza del miotomo x CSA, cioè 90,023 μm x 11980,395 μm2 = 1,079 x 106 μm3.
- Ripetere le misurazioni sulle altre immagini XY e YZ. Si consiglia di utilizzare lo stesso software per tutte le misurazioni all'interno di una serie sperimentale per coerenza. La stima del volume di ciascun software è simile ma non identica a causa degli strumenti di disegno distinti, cioè ZEN = 1,074 × 10 6 μm 3 e Fiji / ImageJ = 1,079 × 106 μm3. La crescita del miotomo tra due punti temporali (cioè da 3 a 4 dpf) può essere calcolata come: (Volume 4 dpf - Volume 3 dpf)/ Volume 3 dpf × 100%.
NOTA: Sull'errore e la sua correzione. Durante il montaggio, il pesce deve essere orientato con il suo piano sagittale (cioè gli assi anteroposteriore e dorsoventrale) il più vicino possibile all'orizzontale, per evitare rispettivamente l'imbardata e il rotolamento. Questo perché sia la lunghezza del miotomo L misurata dalla scansione XY che il CSA misurato da una scansione YZ saranno sovrastimati se il pesce mostra imbardata (rotazione attorno all'asse dorsoventrale) a causa del montaggio anteroposteriore obliquo. Né il beccheggio né il rollio durante il montaggio devono influire sulle misurazioni dopo la scansione, come descritto nella sezione 3. Tuttavia, la rotazione dorsoventrale (rollio) degrada la qualità dell'immagine. La trigonometria semplice mostra che fino a 10° di imbardata daranno un errore del 3% nella misurazione del volume, poiché misurati L e CSA aumentano ciascuno in proporzione a (cosq)-1, dove q è l'angolo di distanza dall'orizzontale anteroposteriore (imbardata). 15° e 20° di sconto daranno rispettivamente il 7% e il 13% di sovrastima del volume.
Poiché la notocorda è cilindrica, l'inclusione dell'intera notocorda nella scansione YZ può essere utilizzata per calcolare l'angolo e l'estensione dell'obliquità dall'orientamento e dalla grandezza degli assi maggiore e minore e quindi correggere L e CSA misurati per massimizzare la precisione. CSA corretto = CSA misurato x asse minore Notocorda/asse maggiore Notocorda. L corretto = Misurato L x asse minore della notocorda/asse della notocorda nella direzione Z del microscopio.
Un'ulteriore considerazione consente un'ulteriore correzione di L. Man mano che il miotomo cresce, si inclina nel piano coronale (normale all'asse dorsoventrale) in modo tale che il miotomo mediale sia leggermente anteriore al miotomo laterale. Visti dalla dorsale, i miosepti verticali sui lati sinistro e destro formano un ampio chevron rivolto anteriormente. Se l'imbardata è bassa, questa morfologia non influisce sulla misurazione di L. Ma se l'imbardata è significativa, la correzione trigonometrica diventa difficile e un approccio migliore è misurare direttamente True L stimando le coordinate XYZ dei due punti in cui il miosepta verticale anteriore e posteriore incontrano la notocorda al miosetto orizzontale. La trigonometria semplice permette di calcolare True L da queste coordinate come L = SQRT[(X 2 - X 1)2 + (Y 2 - Y 1)2 + (Z 2 - Z 1)2]. I punti deboli di quest'ultimo approccio sono che a) la selezione dei punti può variare con l'operatore e b) non viene conservata alcuna registrazione visiva dei punti scelti. Questa considerazione non influisce sulla correzione CSA.
5. Metodo opzionale: rimuovere e reintrodurre l'attività elettrica muscolare
- Creare una camera di stimolazione.
- Prendi una piastra del pozzo di 6 x 35 mm, crea due piccole aperture (<5 mm di diametro, distanti 1 cm) su ciascun lato di ciascun pozzetto (vedi Figura 1) usando un saldatore stretto.
NOTA: Maneggiare il saldatore caldo con cura e lavorare in una cappa aspirante se lo si desidera per evitare l'inalazione di vapore. - Infilare una coppia di fili d'argento o di platino (lunghi ~ 20 cm) attraverso le aperture di ciascun pozzetto (vedi Figura 1). Il materiale adesivo riutilizzabile (ad esempio, BluTack) può essere applicato vicino alle aperture per mantenere i fili in posizione e garantire una separazione di 1 cm tra i fili (vedere Figura 1).
- Prendi una piastra del pozzo di 6 x 35 mm, crea due piccole aperture (<5 mm di diametro, distanti 1 cm) su ciascun lato di ciascun pozzetto (vedi Figura 1) usando un saldatore stretto.
- A 3 dpf, dividere il pesce in tre condizioni: pesce medio Controllo, Inattivo e Inattivo + Stim.
- Per i gruppi Inattivi e Inattivi+Stim, anestetizzare le larve a 72 ore dopo la fecondazione (hpf) con Tricaina (0,6 mM).
NOTA: Seguendo il riferimento38, aliquote congelate di brodo di tricaina vengono scongelate e diluite (40 μL/mL di terreno di pesce, fino ad una concentrazione finale di 0,6 mM) prima di essere aggiunte al pesce. Non aggiungere tricaina direttamente nell'acqua contenente pesce, poiché alcuni pesci potrebbero ricevere dosi elevate. Le scorte di tricaina devono essere utilizzate entro un mese e non essere mai ricongelate. - Per il pesce medio Controllo pesce, lasciarli non anestetizzati.
- Per i gruppi Inattivi e Inattivi+Stim, anestetizzare le larve a 72 ore dopo la fecondazione (hpf) con Tricaina (0,6 mM).
- In determinati momenti dopo l'inizio dell'esposizione alla tricaina (cioè a 80 hpf), preparare il gruppo Inactive+Stim per la stimolazione.
- Preparare 60 ml di agarosio al 2% (1,2 g di polvere di agarosio in 60 ml di terreno di pesce) e sciogliere completamente con il microonde, raffreddare, aggiungere tricaina e versare 4 ml in ciascun pozzetto della camera di stimolazione (Figura 1).
- Aggiungere immediatamente pettini a 4 pozzetti su misura tra gli elettrodi (creati tagliando la plastica (ad esempio, polipropilene) delle dimensioni desiderate e incollandoli insieme usando Superglue; vedere Figura 1). Lasciare 10 minuti per impostare il gel. Rimuovere accuratamente i pettini per creare quattro pozzetti rettangolari.
- Riempire ogni pozzetto con acqua tricaina e posizionare una singola larva Inactive+Stim anestetizzata in ciascun pozzetto usando una micropipetta, con il loro asse anteroposteriore perpendicolare agli elettrodi (vedi Figura 1).
- Controllare sotto il microscopio fluorescente da dissezione se ogni pesce è completamente anestetizzato all'interno di ciascun pozzetto della camera.
- Collegare uno stimolatore elettrofisiologico regolabile alla camera tramite un controller di polarità, utilizzando clip a coccodrillo collegate a ciascuno degli elettrodi su un lato della camera (vedere Figura 1).
NOTA: Il regolatore di polarità viene utilizzato per invertire la polarità ogni 5 s, in modo da prevenire l'elettrolisi e la corrosione degli elettrodi. - Stimolare il pesce. Ad esempio, 1s con un treno di impulsi di 200, 20 V, con durata dell'impulso di 0,5 ms e separazione dell'impulso di 4,5 ms, una volta ogni 5 s fornisce un efficace regime di resistenza alla contrazione tetanica ripetuta.
- Controllare regolarmente al microscopio per confermare che i pesci vengono stimolati; Lo stimolo elettrico di esempio dovrebbe indurre una contrazione bilaterale visibile e un leggero movimento, una volta ogni 5 s.
- Per un regime di resistenza/forza elevata, stimolare il pesce ad alta frequenza per un attacco di 5 minuti, tre volte, con ogni incontro separato da 5 minuti di riposo.
NOTA: Mentre i pesci su un lato della camera sono a riposo, le clip di coccodrillo possono essere collegate alla coppia di elettrodi sull'altro lato della camera e quei pesci aggiuntivi stimolati. - Dopo la stimolazione, rimuovere con cura i pesci da ciascun pozzetto sciacquandoli delicatamente con una pipetta di plastica e restituirli all'incubatrice in mezzo di pesce fresco contenente tricaina.
- Versare via l'acqua tricaina dall'interno della camera e usare una pinza per tagliare e rimuovere l'agarosio da ciascun pozzetto. Risciacquare i pozzetti con acqua di rubinetto e lasciare asciugare.
NOTA: Se si utilizzano elettrodi a filo d'argento, occasionalmente l'ossido d'argento può accumularsi sulla superficie del filo dopo un esperimento di stimolazione. Poiché l'ossido d'argento è meno conduttivo dell'argento, per mantenere la riproducibilità, strofinare accuratamente l'ossido d'argento dal filo usando Kimwipes prima di riutilizzare la configurazione.
Risultati
Una misura rapida e precisa del volume di somite
Viene descritto un metodo di preparazione del campione, acquisizione dei dati e analisi volumetrica che consente la rapida misurazione della crescita muscolare nelle larve di zebrafish. La dimensione muscolare può essere misurata negli animali vivi utilizzando pesci marcati sulle loro membrane plasmatiche con una GFP mirata alla membrana (β-actina: HRAS-EGFP) o mCherry (α-actina: mCherry-CAAX). Le larve sono state anestetizzate transitoriamente usando tricaina, montate in agarosio a basso punto di fusione e ripresi utilizzando la microscopia a fluorescenza confocale. Somite 17 è stato scelto per l'analisi delle dimensioni muscolari data la sua accessibilità all'interfaccia tronco-coda31. In pratica, come in teoria, il volume del miotomo può essere calcolato come il prodotto della lunghezza del miotomo (L) e della media di tre misure dell'area della sezione trasversale (CSA) (Figura 2A, che viene indicato come metodo a 4 fette).
Per convalidare questo metodo, sono stati ottenuti interi stack Z confocali di miotomo di larve di pesce zebra vivo (Figura 2B) e il volume di somite è stato calcolato moltiplicando la somma delle 17 aree del profilo somite in ciascuna fetta (80-100 fette) per la distanza tra le fette (1-1,2 μm). È stata osservata una forte correlazione tra i metodi di calcolo a 4 sezioni e full stack (Figura 2C). Tuttavia, il metodo a 4 fette ha generalmente fornito una stima del volume leggermente più grande (~ 2% più grande in media) (Figura 2D). Questa differenza potrebbe essere dovuta a) all'obliquità dei campioni che danno una misura di volume erroneamente grande o b) all'osservazione che i miotomi del pesce zebra si assottigliano lungo l'asse anteroposteriore, essendo più piccoli verso la coda dell'animale. Poiché le misurazioni YZa, YZm e YZp CSA sono verso la porzione anteriore del somite 17 myotome chevron (Figura 2A), quest'ultima interpretazione è stata testata mediante analisi volumetrica dei miotomi dei somiti 16 e 18. Ogni somite era circa il 7% più grande di quello dietro (Figura 2E). Ulteriori analisi hanno rivelato che un metodo a 2 fette che richiede solo una singola misurazione YZ , situata nel mezzo della somite dove le metà epaxiale e ipaxiali si incontrano nel miosetto orizzontale (YZm) e la fetta XY , fornisce una stima ragionevolmente accurata del volume del miotomo (Figura 2F,G). L'approccio a 2 fette consente un'acquisizione più rapida dei dati quando i limiti di tempo limitano il numero di pesci che possono essere scansionati. In sintesi, questi dati mostrano che il volume del miotomo può essere misurato rapidamente e con precisione nelle larve vive di zebrafish. Le singole larve sono state misurate con successo, ripetutamente, per un periodo di 6 giorni con questo metodo.
Per lo studio comparativo della crescita di un'unità tissutale identificata, il metodo descritto fornisce stime di volume affidabili e precise. Per ottenere volumi assoluti accurati, tuttavia, è possibile applicare una serie di modifiche. In primo luogo, è possibile correggere gli errori causati dal montaggio obliquo inclinando il piatto o lo stadio del microscopio per ottenere migliori fette trasversali YZ e XY parasagittali durante l'imaging o attraverso l'uso del profilo notocorda nelle fette YZ ; l'asse minore della sezione trasversale rivela il vero diametro della notocorda cilindrica, mentre il suo asse maggiore rivela l'angolo e la grandezza dell'obliquità (cfr. nota al punto 4.6). In secondo luogo, la posizione del sezionamento XY e YZ durante la scansione deve essere selezionata per riflettere, accuratamente, il miotomo o i miotomi desiderati. (Cfr. nota al precedente punto 4.6). Si noti, tuttavia, che la forma degli chevron miotomo cambia a seconda dello stadio di sviluppo e questo deve essere preso in considerazione quando si selezionano le scansioni YZ . Infine, per determinare se i cambiamenti nel miotomo 17 riflettono la crescita muscolare in tutto l'asse, i miotomi più avanti nelle regioni del tronco o della coda possono essere misurati con il metodo descritto.
Misurazioni ripetute rivelano la crescita di somite
Un vantaggio del metodo descritto è la facilità di analisi ripetute su singoli pesci. I singoli embrioni e larve possono essere ripetutamente incorporati, misurati e rilasciati senza subire evidenti effetti a lungo termine (Figura 2H). Il miotomo cresce in modo rilevabile sia in L che in CSA tra 2 e 5 dpf, portando ad un costante aumento di volume (Figura 2H). La crescita è stata ripresa in questo modo tra 1 e 8 dpf e anche le larve sono state rilasciate dopo l'imaging e cresciute fino all'età adulta. Ci si aspetta che siano possibili analisi più avanti nel tardo periodo larvale, anche se gli effetti dell'imaging ripetuto sul comportamento alimentare dovrebbero essere monitorati attentamente rispetto ai fratelli che non sono stati ripresi. È importante sottolineare che lo sviluppo della pigmentazione può oscurare l'imaging. Mentre la pigmentazione non è un problema nei pesci correttamente orientati, poiché le strisce melanofore non impediscono le misurazioni richieste, il pigmento può essere più problematico nei campioni montati obliquamente. Si prevede l'uso di linee mutanti di pigmentazione, come roy;mitfa39, che estenderebbe la finestra temporale delle misurazioni della crescita fino al raggiungimento dei limiti della profondità di scansione confocale praticabile.
Un ulteriore vantaggio della procedura descritta è la facilità di analisi dettagliata della crescita delle singole fibre rispetto al loro intero miotomo in brevi periodi. Mediante marcatura a mosaico delle fibre attraverso l'iniezione di DNA, è stato sviluppato un metodo per rilevare l'acquisizione nucleare e la crescita nelle singole fibre identificate nell'arco di 4 ore, e quindi consentire una nuova analisi in tempi successivi (Figura 2I). Inoltre, la crescita dell'intero miotomo può essere misurata in 12 ore o meno26 (e i dati non mostrati). Misurando ripetutamente lo stesso pesce, la variabilità interindividuale viene eliminata e un piccolo numero di animali può produrre risultati statisticamente robusti26.
Le manipolazioni che modificano il volume somite possono essere facilmente rilevate
L'attuale protocollo consente di interrogare i cambiamenti nella crescita muscolare in varie condizioni biologiche e fisiologiche, come l'alterata inattività fisica. La tricaina anestetica, che blocca i potenziali d'azione nervosi inibendo i canali Na+ voltaggio-dipendenti40, è stata utilizzata per indurre l'inattività muscolare nelle larve di β-actina: HRAS-EGFP . Come mostrato in precedenza 26, l'inattività per24 ore tra il terzo e il quarto dpf ha ridotto notevolmente il volume del miotomo, indicando che la crescita muscolare larvale dipende dall'attività (Figura 3A). L'effetto dell'inattività può anche essere studiato utilizzando altri metodi di rilevazione che rivelano la struttura del somite, come mCherry-CAAX (in una linea transgenica o mediante iniezione di mRNA) o mediante immersione notturna delle larve nel colorante BODIPY (Figura 3A). Quest'ultimo approccio, pur eliminando la necessità di incrociare i pesci su fondi transgenici o iniettare embrioni, non può essere utilizzato per misurazioni ripetute a causa della tossicità di BODIPY. Pertanto, il metodo attuale consente di misurare in modo riproducibile i cambiamenti nel volume del tessuto muscolare.
Come descritto sopra, i metodi di marcatura genetica possono essere utilizzati per effettuare misurazioni ripetute del volume del miotomo, consentendo il monitoraggio della variazione delle dimensioni muscolari nei giorni successivi nei singoli pesci. Poiché i singoli pesci e le uova intere allo stesso stadio di sviluppo differiscono nel volume assoluto del miotomo (Figura 3A; forse a causa delle dimensioni o della salute delle uova), la capacità di misurare la crescita di ciascun individuo riduce gli effetti della variazione individuale consentendo analisi statistiche campionarie accoppiate. Misurare ripetutamente lo stesso pesce riduce il numero di pesci necessari per rilevare gli effetti in modo robusto. Per illustrare questo effetto, i risultati dell'analisi della crescita di ciascun individuo da 3 a 4 dpf in popolazioni di larve attive e inattive sono stati confrontati con l'analisi delle stesse due popolazioni utilizzando solo la singola misura della dimensione del miotomo effettuata a 4 dpf. Da lay a lay, è stata osservata una maggiore variazione nella riduzione apparente delle dimensioni del miotomo quando si misurava il volume del miotomo a 4 dpf solo rispetto alla misurazione del volume di 4/3 dpf per ciascun individuo (Figura 3B). Si noti la maggiore gamma di riduzione (68% -91%) nelle misurazioni di soli 4 dpf, rispetto al metodo 4/3 dpf (78% -89%) e la debole correlazione tra le due misure. Sebbene, come previsto, la riduzione media in tutte le 13 repliche biologiche fosse simile in ciascuna valutazione (Figura 3C) essendo 82,62 ± 1,01% (media ± SEM, n = 13) per il metodo 4/3 dpf e 82,31 ± 1,92% per il metodo solo 4 dpf, l'errore stimato con il metodo solo 4 dpf era quasi il doppio rispetto al metodo 4/3 dpf. Pertanto, quantificare la crescita individuale attraverso misurazioni ripetute è il metodo più accurato, eliminando la variabilità delle dimensioni tra i pesci all'interno della stessa deposizione, come dimostrato in precedenza26. Tuttavia, poiché non è stata osservata alcuna differenza significativa nella riduzione del volume del miotomo causata dall'inattività quando si misura il volume del miotomo a soli 4 dpf (Figura 3C), i dati suggeriscono che ~ 6-8 pesci sono sufficienti per calcolare la differenza di dimensioni interindividuali all'interno di una posa. Chiaramente, quando le modifiche dimensionali sono piccole, è preferibile il metodo 4/3 dpf.
Analisi delle basi cellulari della crescita
Il miotomo CSA è determinato dal numero di fibre muscolari e dalla dimensione della fibra. Il numero di fibre può essere stimato contando il numero di fibre veloci e lente su tre sezioni YZ (YZ a, YZ m, YZ p). Sebbene le regioni di due miotomi adiacenti siano contenute in tali sezioni YZ, come dimostrato dalla presenza di miosepta verticale (VM) nella maggior parte delle sezioni (Figura 2A), questi conteggi riflettono accuratamente il numero di fibre. Il conteggio eccessivo si verifica nelle macchine virtuali a causa della riduzione graduale delle coppie di fibre da ogni segmento adiacente nella macchina virtuale (Figura 4A). Tale sovraconteggio può essere spiegato utilizzando la seguente equazione: Numero di fibre = Numero totale di fibre - (fibre a contatto con VM) / 2 riferimento33. Inoltre, il volume medio delle fibre può essere determinato dividendo il volume del miotomo per il numero di fibre. Abbiamo usato queste analisi per rivelare che l'attività controlla entrambi gli aspetti cellulari della crescita (Figura 4B,C).
È evidente dalla Figura 2A che le fibre variano di dimensioni attraverso il miotomo, una realtà che non si riflette nelle misurazioni calcolate del volume medio delle fibre. Disegnando attorno a ciascuna fibra di somite 17 da due pesci, è stato dimostrato che l'area della sezione trasversale delle fibre misurata varia da 28 μm 2 a 217 μm2 (Figura 4D). In realtà, tuttavia, molte fibre sono angolate obliquamente all'interno del miotomo, quindi tali misure CSA non riflettono il vero CSA di una fibra perpendicolare al suo asse lungo. Al contrario, a causa dei diversi angoli delle fibre all'interno del miotomo, tutte le fibre che corrono con orientamenti che non sono allineati anteroposteriormente hanno lunghezze che differiscono dalla lunghezza del miotomo. Nonostante questi avvertimenti, che possono essere aggirati solo mediante la completa segmentazione del miotomo in volumi di fibre singole o mediante calcolo dopo aver misurato l'angolo di obliquità di ciascuna fibra, i CSA misurati forniscono una stima della diversità delle dimensioni delle fibre in ciascun pesce. Ad esempio, le singole fibre sono diminuite in CSA con l'inattività, con conseguente spostamento a sinistra nella curva di frequenza cumulativa rispetto alle larve di controllo attive (non anestetizzate (Figura 4E). Poiché i pesci inattivi hanno ~ 10 fibre in meno rispetto ai pesci attivi (Figura 4B), le 10 fibre più piccole di pesci attivi non anestetizzati (supponendo che siano quelle nuove) o le 10 più grandi (come estremo alternativo) sono state omesse dal confronto, il che ha mostrato che la maggior parte della perdita del volume del miotomo è dovuta alla mancanza di crescita delle fibre, piuttosto che il fallimento della formazione di nuove fibre (Figura 4F). Nel loro insieme, questi dati mostrano che il metodo descritto consente un'indagine dettagliata del ruolo dell'attività fisica sulla formazione e sulla crescita del tessuto muscolare.
Reimposizione dell'attività mediante stimolazione elettrica
L'attività fisica è necessaria per la crescita muscolare (Figura 3A). Viene descritto un metodo per imporre nuovamente le contrazioni muscolari mediante stimolazione elettrica in larve altrimenti inattive, evocando una forte risposta contrattile (Figura 5A, File supplementare 8). Sebbene qui siano descritti precisi parametri di stimolazione (Figura 5B) per attivare al massimo la muscolatura, il protocollo può essere modificato (modificando l'ampiezza della corrente, la frequenza, la durata dell'impulso, ecc.) per controllare l'attivazione muscolare e il dosaggio dell'esercizio. Pertanto, il metodo attuale fornisce uno stimolo di attività controllato con un comportamento standardizzato tra gli attacchi di attività, superando un'importante limitazione degli attuali modelli animali di esercizio18.
I metodi descritti dimostrano il potenziale dell'utilizzo di larve di zebrafish per studiare vari aspetti della crescita muscolare (ad esempio, iperplasia e ipertrofia). In particolare, la miogenesi nelle larve di zebrafish si è dimostrata suscettibile di analisi attraverso l'inattività farmacologicamente indotta e la contrattilità indotta elettricamente. L'approccio consente lo studio dei meccanismi molecolari attraverso i quali l'attività fisica porta alla crescita muscolare in vivo.

Figura 1: Progettazione di una camera di stimolazione per la reintroduzione dell'attività elettrica muscolare nelle larve di zebrafish. Una piastra di coltura cellulare a 6 pozzetti dotata di elettrodi consente il mantenimento delle larve in pozzetti realizzati con gel di agarosio al 2%. I pettini a 4 pozzetti personalizzati sono realizzati per creare pozzetti rettangolari (dimensioni come indicato) in agarosio per mantenere la posizione e l'orientamento delle singole larve di pesce e per impedire loro di entrare in contatto con i fili d'argento durante le contrazioni vigorose dopo la stimolazione elettrica. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Misurazione del volume muscolare nelle larve transgeniche vive di zebrafish α-actina:mCherry-CAAX (A,B,E) o β-actina:HRAS-EGFP (H,I). Larve riprese dalla vista laterale e mostrate dorsale verso l'alto, anteriormente a sinistra nei pannelli superiori (A, B, E). (A) Nel metodo a 4 fette, il volume del miotomo è stato calcolato moltiplicando la lunghezza del somite 17 (L) misurata tra i miosepti verticali (VM) su un piano XY (freccia blu) per la media di tre aree della sezione trasversale (CSA) misurate sui piani YZ (YZm, YZa e YZp; linee gialle tratteggiate). (B) Nel metodo Full Stack, l'area del miotomo somite 17 è stata misurata (esempi delineati in giallo) in ciascuna fetta di un'intera pila Z di una larva di zebrafish viva e la somma delle aree miotomali è stata moltiplicata per la distanza tra le fette. (C) Elevata concordanza tra i metodi 4-slice e Full Stack. I colori indicano singoli pesci β-actina:HRAS-EGFP (quadrati) o α-actina:mCherry-CAAX (cerchi). (D) Il volume del miotomo è leggermente, ma significativamente, maggiore se calcolato utilizzando il metodo a 4 fette. (E) Nelle larve affusolate di zebrafish, più somiti anteriori sono più grandi dei somiti posteriori, come misurato con il metodo a 4 fette. (F,G) Forte correlazione tra le misurazioni del volume effettuate utilizzando la media di tre sezioni CSA (metodo a 4 sezioni) o un singolo CSA YZm (metodo a 2 sezioni). I valori p mostrano i risultati di due test t a coda con varianza uguale (D,G) o ANOVA unidirezionale con test post hoc Bonferroni (E). ns, non significativo. (H) Misurazione del volume del miotomo 16, della lunghezza (L) e dell'area della sezione trasversale (CSA) da 2 a 5 dpf in tre singoli pesci (colori) che esprimono β-actina:HRAS-EGFP e myog:H2B-mRFP. Le immagini YZm dell'individuo verde in ogni punto temporale sono mostrate sopra. (I) Crescita di singole fibre misurata mediante segmentazione automatizzata a soglia costante. Un pesce β-actina:HRAS-EGFP;myog:H2B-mRFP marcato mosaicalmente mediante iniezione di un plasmide CMV:Ceruleo allo stadio di 1-2 cellule. Una singola fibra marcata Cerulean in somite 10 è stata scansionata ripetutamente con stack XYZ completi ad alta risoluzione su uno Zeiss LSM880. Le immagini mostrate sono singole sezioni rappresentative (a sinistra) e la proiezione del volume segmentato tridimensionale (a destra). Ogni punto dati sul grafico rappresenta una singola scansione della stessa fibra, a 3 dpf (0 h), dopo 4 h, e a 5 dpf (54 h). Le scansioni triplicate sono state effettuate e segmentate per punto temporale per mostrare la riproducibilità. Le punte di freccia bianche indicano nuclei di fibre; Si noti che vengono aggiunti due nuclei tra 3 e 5 dpf. Fare clic qui per visualizzare una versione ingrandita di questa figura.
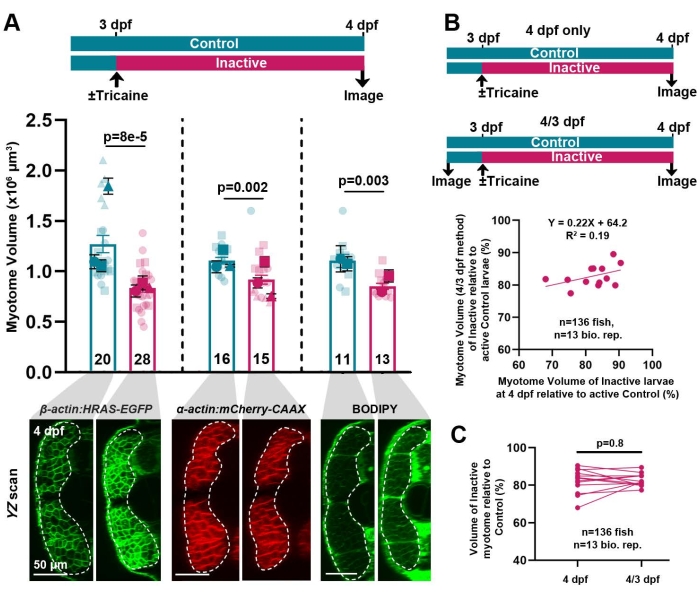
Figura 3: Crescita muscolare dipendente dall'attività in somite 17. (A) L'inibizione dell'attività per 24 ore mediante l'applicazione di tricaina (rosa) tra 3 e 4 dpf riduce il volume del miotomo sia nelle linee transgeniche che nei pesci non transgenici colorati con BODIPY rispetto ai controlli del veicolo sui fratelli (blu). Volume quantificato con il metodo a 4 sezioni. La forma del simbolo indica esperimenti replicati da deposizioni distinte (repliche biologiche). I simboli grandi indicano valori medi ± SEM. Piccoli simboli deboli mostrano il volume delle singole larve replicate. (B) Confronto della riduzione del volume del miotomo nei pesci inattivi rispetto ai fratelli di controllo determinata dalla misurazione singola del volume del miotomo a 4 dpf (solo 4 dpf, schema superiore) o variazione del volume del miotomo tra 3 e 4 dpf (4/3 dpf, schema inferiore). Ogni simbolo rappresenta il volume medio di myotome 17 in ~5 pesci inattivi da una singola deposizione diviso per il volume medio di myotome 17 di ~5 fratelli di controllo attivo. (C) Non è stata osservata alcuna differenza nella riduzione media della crescita muscolare nei pesci inattivi, quando si misurava con i metodi solo 4 dpf o 4/3 dpf. I numeri all'interno delle barre rappresentano il numero totale di pesci analizzati. I valori p mostrano i risultati di ANOVA a due vie con test post hoc di Bonferroni (A) o test t a due code con varianza disuguale (C). Fare clic qui per visualizzare una versione ingrandita di questa figura.
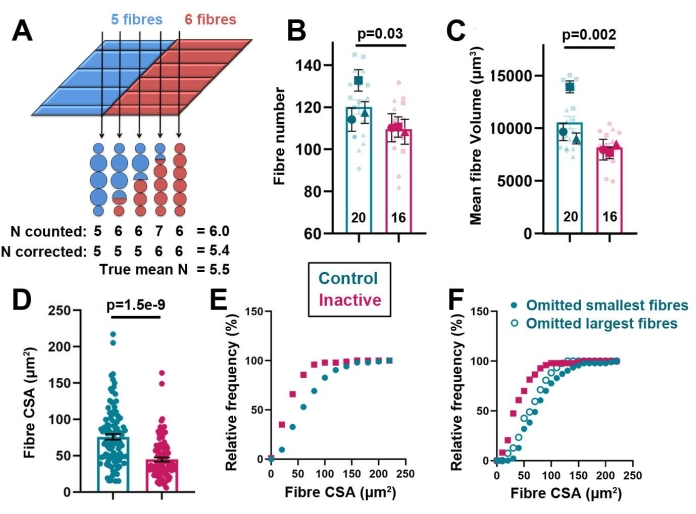
Figura 4: Cambiamenti a livello cellulare nella crescita muscolare causati dall'inattività. (A) Schema che mostra come si verifica l'overcounting nelle VM a causa del doppio conteggio delle fibre affusolate dove i miotomi blu e rosso si incontrano. Si noti che il conteggio medio delle fibre è 6 ma il vero valore medio è 5,5. Il conteggio corretto fornisce una migliore approssimazione. (B,C) Il numero di fibre (B) e il volume medio delle fibre (C) sono ridotti in inattivi (rosa) rispetto alle larve attive (bue). La forma del simbolo indica esperimenti replicati da deposizioni distinte (repliche biologiche). I simboli grandi indicano valori medi ± SEM. Simboli deboli più piccoli mostrano il valore delle singole larve replicate. I numeri all'interno delle barre rappresentano il numero totale di pesci analizzati. (D) Nelle singole larve, ogni profilo di fibra nel miotomo 17 è stato delineato e determinato il CSA. I valori p mostrano i risultati di ANOVA bidirezionale ±con test post hoc di Bonferroni (B,C) o test t a due code con uguale varianza (D). (E,F) Curve di frequenza cumulative che mostrano la distribuzione delle dimensioni delle fibre nelle larve di controllo attivo (blu) e inattive (rosa). Il confronto di tutte le fibre (E), o dopo l'omissione di fibre presunte-nascenti piccole o, all'estremo alternativo, grandi (F) mostra che l'aumento delle dimensioni delle fibre, non l'aumento del numero di fibre, rappresenta principalmente la crescita guidata dall'attività del miotomo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
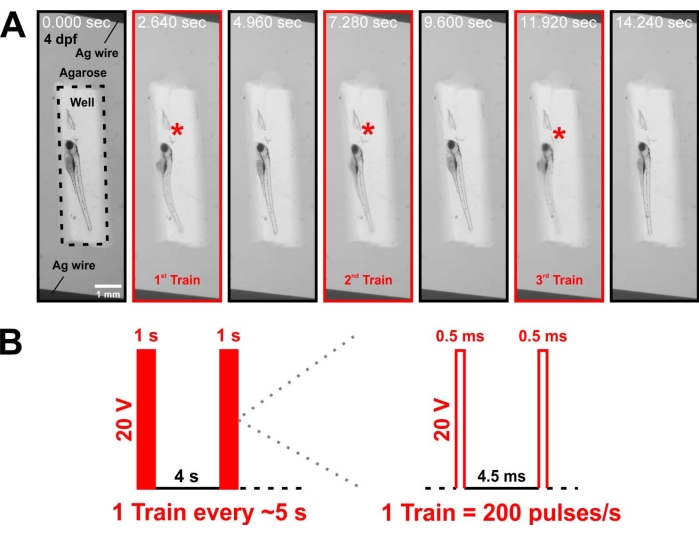
Figura 5: Una breve stimolazione elettrica evoca contrazioni muscolari tetaniche nelle larve di zebrafish anestetizzati . (A) Immagini sequenziali (catturate dal video nel file supplementare 8) che mostrano come la stimolazione elettrica innesca le contrazioni massime di una larva anestetizzata a 3 dpf. Scala temporale in secondi. Le caselle rosse indicano i movimenti all'inizio di tre treni di stimolazione 1 s successivi. Ogni immagine ha un'esposizione di 40 ms. (B) Schema che mostra il regime di stimolazione elettrica, in cui un treno di 1 s di 200 impulsi elettrici ad alta frequenza e 20 V viene dato ogni 5 s. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Schemi di immagini catturate di larve perfettamente (in alto a sinistra) e montate in modo imperfetto rispetto al quadro di riferimento XYZ del microscopio (assi neri). Miotomo (verde), notocorda (giallo), tubo neurale (abbronzatura), parametri miotomali misurati (rosso), parametri della notocorda misurati (frecce nere) e rotazioni possibili o effettive dei pesci (blu). Clicca qui per scaricare questo file.
File supplementare 2: Screenshot che mostra la misurazione della lunghezza somite dalle immagini XY in ZEN. Clicca qui per scaricare questo file.
File supplementare 3: Screenshot che mostra la misurazione CSA da immagini YZ in ZEN. Clicca qui per scaricare questo file.
File supplementare 4: Screenshot che mostra la misurazione della lunghezza somite dalle immagini XY in Fiji/ImageJ. Clicca qui per scaricare questo file.
File supplementare: Screenshot che mostra l'estrazione dei parametri di calibrazione per le immagini YZ da ZEN. Clicca qui per scaricare questo file.
File supplementare 6: Screenshot che mostra la calibrazione delle immagini YZ in Fiji/ImageJ. Clicca qui per scaricare questo file.
File supplementare 7: Screenshot che mostra la misurazione CSA dalle immagini YZ in Fiji/ImageJ. Clicca qui per scaricare questo file.
File supplementare 8: Video rappresentativo che mostra la contrazione muscolare evocata dalla stimolazione elettrica diretta (lunghezza 1 s) di una larva di tricaina-anestetizzata 3 dpf. Clicca qui per scaricare questo file.
Discussione
Qui riportiamo un metodo per la stima accurata ed efficiente del volume muscolare delle larve vive di zebrafish in stadi o in varianti genetiche in cui la pigmentazione non è un grosso ostacolo all'imaging e quando l'anestesia transitoria e / o l'immobilizzazione sono ben tollerate. Mentre abbiamo impiegato la microscopia confocale a scansione laser, gli approcci descritti sono applicabili alla microscopia confocale a disco rotante o a foglio luminoso e a qualsiasi altro metodo che crea pile di immagini su piani focali distinti. Viene descritta una serie di approcci sempre più sofisticati alla dimensione dei tessuti e alla stima del contenuto cellulare. Ogni metodo ha vantaggi e limiti, che mostriamo possono essere quantificati. Una delle principali limitazioni nello studio della crescita tissutale è la difficoltà di analizzare i cambiamenti di crescita in tempo reale poiché i tassi di crescita si alterano in risposta a una serie di eventi molecolari o subcellulari catalizzati da stimoli somministrati acutamente. Inoltre, la variazione individuale può creare problemi quando vengono confrontati individui separati. L'approccio attuale consente la misurazione della crescita tissutale in periodi inferiori a un giorno in singoli individui vivi. L'applicazione dell'approccio può essere prevista su scala temporale minuziosa.
I metodi descritti consentono analisi finora impraticabili. Utilizzando il metodo a 4 fette, la porzione di imaging del test di crescita muscolare può essere completata su un campione di circa 20 pesci entro un'ora da un operatore addestrato. Questo è in netto contrasto con il metodo convenzionale Full Stack, che richiede almeno 3 ore per lo stesso numero di pesci (cioè tre volte di più). Se sono necessarie immagini ad alta risoluzione per le successive analisi subcellulari, il metodo Full Stack può facilmente richiedere 30 minuti per pesce, rendendo impossibili i saggi di crescita di coorti di animali in uno stadio di sviluppo simile. Al contrario, i metodi a 2 o 4 sezioni consentono una rapida acquisizione di immagini di alta qualità. Passando alla considerazione dell'analisi delle immagini, i vantaggi del metodo a 2 o 4 sezioni nel risparmio di tempo dell'operatore (in assenza di segmentazione automatica delle immagini) rispetto al metodo Full Stack sono enormi. Ogni pesce richiede circa 20 minuti per l'analisi Full Stack, ma solo 3-4 minuti per l'analisi a 4 fette. Il tempo dell'operatore può essere ulteriormente conservato utilizzando il metodo a 2 sezioni quasi altrettanto preciso. Pertanto, il metodo descritto è efficiente e quindi aumenta la flessibilità nella progettazione sperimentale.
La principale limitazione dei metodi a 4 o 2 fette è che entrambi i metodi sono stime, a causa della forma a chevron sovrapposta dei somiti (ad esempio, il volume delle regioni di due somiti vicini (ad esempio, miotomo 16 e 17). È dimostrato che questo può sovrastimare il volume effettivo del miotomo 17 di circa il 2%, a seconda di dove sono state selezionate esattamente le fette YZ . Inoltre, il tracciamento manuale dei bordi somiti durante le misurazioni potrebbe contribuire a variazioni nelle stime, sebbene siano state riscontrate poche differenze tra gli sperimentatori (dati non mostrati). Gli errori di misurazione potrebbero essere risolti utilizzando algoritmi di soglia, filtraggio e segmentazione per acquisire la superficie in modo più obiettivo e riproducibile. Tuttavia, saranno ancora necessarie personalizzazioni per tenere conto delle variazioni nella fluorescenza di fondo (ad esempio a causa dell'incorporamento e / o dello spessore dell'LMA) e del livello di espressione delle proteine di fluorescenza delle singole larve nel tempo. Si noti che tali misurazioni automatizzate saranno ancora più impegnative se viene utilizzato un reporter non specifico per i muscoli, come la linea β-actina: HRAS-EGFP . Tuttavia, in molte circostanze, ad esempio, quando si confrontano gli effetti delle manipolazioni tra pesci sottoposti a trattamenti diversi che si prevede influenzino tutto il tessuto muscolare, l'imprecisione può essere irrilevante. Tuttavia, se è richiesta la massima precisione per il confronto con i numeri di fibre o nucleari contati esclusivamente dal miotomo 17, ad esempio, i metodi di "fetta" possono essere migliorati. Ciò può essere ottenuto utilizzando l'arduo metodo Full Stack, mediante correzione matematica moltiplicando i volumi misurati a 4 sezioni per 0,98, o spostando posteriormente la posizione delle scansioni YZ CSA per riflettere più accuratamente il vero CSA del miotomo 17.
Una seconda limitazione del metodo è la sua sensibilità all'orientamento di montaggio del pesce. In pratica, gli operatori esperti possono orientare i pesci entro limiti ragionevoli per la maggior parte del tempo, anche quando lavorano rapidamente per incorporare molti campioni. Possono essere previste modifiche alle apparecchiature sullo stadio del microscopio che consentirebbero la correzione dell'imbardata e del rollio prima della scansione. Senza tale apparato, viene descritto un metodo per quantificare il disorientamento che può quindi essere utilizzato per correggere i volumi misurati. Inoltre, anche se il disorientamento aumenta la variabilità del volume misurato, e quindi riduce la possibilità di osservare piccole dimensioni dell'effetto, in molte situazioni tale variazione influenzerà i campioni di controllo e sperimentali in modo simile. Quindi i risultati falsi positivi sono improbabili, se gli operatori sono a conoscenza del problema.
I metodi descritti sono stati inizialmente applicati per analizzare il ruolo dell'attività elettrica nella crescita muscolare, un argomento con una lunga storia di analisi in una vasta gamma di specie (rivisto in18). A tal fine, semplici metodi per bloccare l'attività innescata endogenamente sono descritti in dettaglio e sostituiti con una stimolazione elettrica controllata nella larva del pesce zebra. I vantaggi di questo approccio sono la rimozione dei controlli di feedback neurale40, l'eliminazione degli effetti della nutrizione alterata e la capacità di analizzare gli effetti circadiani sulla crescita stessa, piuttosto che sui proxy di crescita, come il turnover proteico26. Poiché diversi modelli di attività elettrica innescano risposte muscolari distinte, regolando il tipo, le dimensioni e il metabolismo delle fibre 41,42,43,44,45,46,47,48, i metodi attuali aprono il pesce zebra a tali analisi.
I metodi descritti offrono una serie di tecniche con cui molti aspetti della fisiologia muscolare, della biologia cellulare e della patologia possono essere analizzati in una risoluzione temporale e spaziale senza precedenti sfruttando il pesce zebra relativamente inesplorato. Gli approcci attuali potrebbero chiaramente essere applicati ad altre specie, regioni del corpo e fasi di sviluppo. La rapida crescita precoce delle larve di zebrafish rende l'individuazione degli effetti acuti delle manipolazioni sulla crescita dei tessuti e sulla morfogenesi particolarmente interessanti nelle aree di studio. Inoltre, il muscolo zebrafish ha dimostrato di condividere vari meccanismi di crescita e controlli con i mammiferi. Mentre i pesci zebra sono vertebrati che conservano molti aspetti della genetica molecolare muscolare, delle cellule e della biologia dello sviluppo con gli esseri umani, ci sono anche differenze significative nel controllo della crescita muscolare. Ad esempio, i tipi di fibre lenti e veloci sono più chiaramente segregati spazialmente nei pesci e l'innervazione del muscolo mostra differenze. Inoltre, va tenuto presente che, finora, siamo stati in grado di analizzare solo le prime fasi dello sviluppo. Analisi analoghe sono previste in fasi successive.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Gli autori sono profondamente in debito con gli sforzi dei membri del laboratorio Hughes Drs Seetharamaiah Attili, Jana Koth, Fernanda Bajanca, Victoria C. Williams, Yaniv Hinits, Giorgia Bergamin e Vladimir Snetkov per lo sviluppo dei protocolli descritti, e a Henry Roehl, Christina Hammond, David Langenau e Peter Currie per aver condiviso plasmidi o linee di zebrafish. SMH è uno scienziato del Medical Research Council (MRC) con sovvenzione del programma G1001029, MR / N021231 / 1 e MR / W001381 / 1. MA ha conseguito una borsa di studio di dottorato del programma di formazione di dottorato MRC presso il King's College di Londra. Questo lavoro ha beneficiato dell'input trigonometrico di David M. Robinson, studioso, mentore e amico.
Materiali
| Name | Company | Catalog Number | Comments |
| Adhesive, Blu Tack | Bostik | - | - |
| Aerosol vacuum | - | - | - |
| Agarose | Sigma-Aldrich | A9539 | - |
| Agarose, low gelling temperature | Sigma-Aldrich | A9414 | Once melted, keep at 37oC in a block heater to remain in liquid form for repeated use. |
| Block heater | Cole-Parmer | SBH130 | - |
| BODIPY FL C5-ceramide | Thermo Scientific | D3521 | To be diluted in fish water and used at 5 µM for overnight incubation. |
| Crocodile clips and wires | - | - | - |
| Fiji/imageJ | National Institutes of Health, NIH | - | - |
| Fish medium, Fish water | - | - | Circulating system water collected from the fish facility. |
| Fish medium, E3 medium | - | - | E3 is described in The Zebrafish Book. http://zfin.org (5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, and 0.33 mM MgSO4 in distilled water). |
| Fluorescence microscope | Leica | Leica MZ16F | Fluorescence microscope of other kind are also expected to be suitable. |
| Glass needle | World Precision Instruments, Inc. | 1B100-6 | To be fire-polished to prevent damage of the embryos during manipulation. |
| Grass stimulator | Grass Instruments | S88 | Stimulators of other kind are also expected to be suitable. |
| Kimwipes, Delicate Task Wipers | Kimberly-Clark Professional | 13258179 | - |
| Laser scanning microscope (LSM) | Zeiss | Zeiss LSM 5 Exciter Zeiss LSM 880 | LSM of other kind are also expected to be suitable. |
| Nunc Cell-Culture Treated, 6-well plate | Thermo Scientific | 140675 | - |
| Objective, 20×/1.0W water immersion | Zeiss | - | - |
| Pasteur Pipette, Graduated 1 mL | Starlab Group | E1414-0100 | - |
| Pasteur Pipette, Micro Fine Tip 1 mL | Starlab Group | E1414-1100 | - |
| Petri dish, 60 mm | Sigma-Aldrich | P5481 | - |
| Plasmid, CMV-Cerulean | Christina L. Hammond (University of Bristol) | pCS2+_cerulean_kanR plasmid injected at 25-75 pg at one-cell stage. Citation: Bussman J, and Schulte-Merker S. (2011) Development 138:4327-4332. doi: 10.1242/dev.068080. | |
| Plasmid, pCS-mCherry-CAAX | Henry Roehl (University of Sheffield) | - | For in vitro transcription using the SP6 promoter (plasmids containing other membrane labelling markers can be used); synthesised capped mRNA to be injected at 100-200 pg at one-cell stage. |
| Pulse Controller | Hoefer Scientific Instruments | PC750 | - |
| Soldering iron | - | - | - |
| Tricaine | Sigma-Aldrich | E10521 | Ethyl 3-aminobenzoate methanesulfonate/ MS-222; to be dissolved in fish water and used at 0.6 mM. |
| Volocity | Perkin Elmer/Quorum Technologies Inc | - | - |
| Watchmaker forceps, No. 5 | - | - | - |
| Wire, Platinum | Goodfellow | PT005142/12 | 0.40 mm in diameter; an expensive alternative of silver. |
| Wire, Silver | Acros Organics | 317730010 | 0.25 mm in diameter (a range of diameter i.e. 0.25-0.5 mm had been tested, which produced similar results). |
| Zebrafish, myog:H2B-mRFP | David M. Langenau (Massachusetts General Hospital; Harvard Stem Cell Institute) | - | ZFIN official name: Tg(myog:Hsa.HIST1H2BJ-mRFP), fb121Tg. http://zfin.org/ZDB-ALT-160803-2 Citation: Tang Q, Moore JC, Ignatius MS, Tenente IM, Hayes MN, Garcia EG, Torres Yordán N, Bourque C, He S, Blackburn JS, Look AT, Houvras Y, Langenau DM. Imaging tumour cell heterogeneity following cell transplantation into optically clear immune-deficient zebrafish. Nat Commun. 2016 Jan 21;7:10358. doi: 10.1038/ncomms10358. |
| Zebrafish, α-actin:mCherry-CAAX | Peter D. Currrie (ARMI, Monash University) | - | ZFIN official name: Tg(actc1b:mCherry-CAAX), pc22Tg. http://zfin.org/ZDB-ALT-150224-2 Citation: Berger J, Tarakci H, Berger S, Li M, Hall TE, Arner A, and Currie PD. Loss of Tropomodulin4 in the zebrafish mutant träge causes cytoplasmic rod formation and muscle weakness reminiscent of nemaline myopathy. Dis Model Mech. 2014 Dec;7(12):1407-15. doi: 10.1242/dmm.017376. |
| Zebrafish, β-actin:HRAS-EGFP | - | - | ZFIN official name: Tg(Ola.Actb:Hsa.HRAS-EGFP), vu119Tg. http://zfin.org/ZDB-ALT-061107-2 Citation: Cooper MS, Szeto DP, Sommers-Herivel G, Topczewski J, Solnica-Krezel L, Kang HC, Johnson I, and Kimelman D. Visualizing morphogenesis in transgenic zebrafish embryos using BODIPY TR methyl ester dye as a vital counterstain for GFP. Dev Dyn. 2005 Feb;232(2):359-68. doi: 10.1002/dvdy.20252. |
| ZEN software | Zeiss | - | - |
Riferimenti
- Hammond, J. A discussion on the measurement of growth and form; measuring growth in farm animals. Proceedings of the Royal Society of London. Series B: Biological Sciences. 137 (889), 452-461 (1950).
- Hubal, M. J., et al. Variability in muscle size and strength gain after unilateral resistance training. Medicine and Science in Sports and Exercise. 37 (6), 964-972 (2005).
- Stillwell, R. C., Dworkin, I., Shingleton, A. W., Frankino, W. A. Experimental manipulation of body size to estimate morphological scaling relationships in Drosophila. Journal of Visualized Experiments. (56), e3162 (2011).
- Gupta, B. P., Rezai, P. Microfluidic approaches for manipulating, imaging, and screening C. elegans. Micromachines (Basel). 7 (7), 123 (2016).
- Duckworth, J., Jager, T., Ashauer, R. Automated, high-throughput measurement of size and growth curves of small organisms in well plates. Scientific Reports. 9 (1), 10 (2019).
- Erlandson, M. C., Lorbergs, A. L., Mathur, S., Cheung, A. M. Muscle analysis using pQCT, DXA and MRI. European Journal of Radiology. 85 (8), 1505-1511 (2016).
- Buckinx, F., et al. Pitfalls in the measurement of muscle mass: a need for a reference standard. Journal of Cachexia, Sarcopenia and Muscle. 9 (2), 269-278 (2018).
- Haun, C. T., et al. A critical evaluation of the biological construct skeletal muscle hypertrophy: Size matters but so does the measurement. Frontiers in Physiology. 10, 247 (2019).
- Tavoian, D., Ampomah, K., Amano, S., Law, T. D., Clark, B. C. Changes in DXA-derived lean mass and MRI-derived cross-sectional area of the thigh are modestly associated. Scientific Reports. 9 (1), 10028 (2019).
- Foessl, I., et al. phenotyping approaches in human, mice and zebrafish - Expert overview of the EU cost action GEMSTONE ("GEnomics of MusculoSkeletal traits TranslatiOnal NEtwork"). Frontiers in Endocrinology. 12, 720728 (2021).
- Epstein, H. F., Casey, D. L., Ortiz, I. Myosin and paramyosin of Caenorhabditis-Elegans embryos assemble into nascent structures distinct from thick filaments and multi-filament assemblages. Journal of Cell Biology. 122 (4), 845-858 (1993).
- Hresko, M. C., Williams, B. D., Waterston, R. H. Assembly of body wall muscle and muscle cell attachment structures in Caenorhabditis elegans. Journal of Cell Biology. 124 (4), 491-506 (1994).
- Bao, Z., Murray, J. I. Mounting Caenorhabditis elegans embryos for live imaging of embryogenesis. Cold Spring Harbor Protocols. 2011 (9), (2011).
- Schnorrenberg, S., et al. In vivo super-resolution RESOLFT microscopy of Drosophila melanogaster. eLife. 5, 15567 (2016).
- Coquoz, S., et al. Label-free three-dimensional imaging of Caenorhabditis elegans with visible optical coherence microscopy. PloS One. 12 (7), 0181676 (2017).
- Laband, K., Lacroix, B., Edwards, F., Canman, J. C., Dumont, J. Live imaging of C. elegans oocytes and early embryos. Methods in Cell Biology. 145, 217-236 (2018).
- Pende, M., et al. High-resolution ultramicroscopy of the developing and adult nervous system in optically cleared Drosophila melanogaster. Nature Communications. 9 (1), 4731 (2018).
- Attwaters, M., Hughes, S. M. Cellular and molecular pathways controlling muscle size in response to exercise. FEBS Journal. 289 (6), 1428-1456 (2021).
- Morley, J. E., et al. Sarcopenia with limited mobility: an international consensus. Journal of the American Medical Directors Association. 12 (6), 403-409 (2011).
- Bauer, J., et al. Sarcopenia: A time for action. An SCWD position paper. Journal of Cachexia, Sarcopenia and Muscle. 10 (5), 956-961 (2019).
- Cruz-Jentoft, A. J., Sayer, A. A. Sarcopenia. Lancet. 393 (10191), 2636-2646 (2019).
- Knappe, S., Zammit, P. S., Knight, R. D. A population of Pax7-expressing muscle progenitor cells show differential responses to muscle injury dependent on developmental stage and injury extent. Frontiers in Aging Neuroscience. 7, 161 (2015).
- Gurevich, D. B., et al. Asymmetric division of clonal muscle stem cells coordinates muscle regeneration in vivo. Science. 353 (6295), (2016).
- Berberoglu, M. A., et al. Satellite-like cells contribute to pax7-dependent skeletal muscle repair in adult zebrafish. Developmental Biology. 424 (2), 162-180 (2017).
- Ganassi, M., et al. Myogenin promotes myocyte fusion to balance fiber number and size. Nature Communications. 9 (1), 4232 (2018).
- Kelu, J. J., Pipalia, T. G., Hughes, S. M. Circadian regulation of muscle growth independent of locomotor activity. Proceedings of the National Academy of Sciences of the United States of America. 117 (49), 31208-31218 (2020).
- Currie, P. D., Ingham, P. W. Induction of a specific muscle cell type by a hedgehog-like protein in zebrafish. Nature. 382, 452-455 (1996).
- Devoto, S. H., Melancon, E., Eisen, J. S., Westerfield, M. Identification of separate slow and fast muscle precursor cells in vivo, prior to somite formation. Development. 122 (11), 3371-3380 (1996).
- Blagden, C. S., Currie, P. D., Ingham, P. W., Hughes, S. M. Notochord induction of zebrafish slow muscle mediated by Sonic Hedgehog. Genes & Development. 11 (17), 2163-2175 (1997).
- Du, S. J., Devoto, S. H., Westerfield, M., Moon, R. T. Positive and negative regulation of muscle cell identity by members of the hedgehog and TGF-b gene families. Journal of Cell Biology. 139 (1), 145-156 (1997).
- Hinits, Y., et al. Defective cranial skeletal development, larval lethality and haploinsufficiency in Myod mutant zebrafish. Developmental Biology. 358 (1), 102-112 (2011).
- Pipalia, T. G., et al. Cellular dynamics of regeneration reveals role of two distinct Pax7 stem cell populations in larval zebrafish muscle repair. Disease Models & Mechanisms. 9 (6), 671-684 (2016).
- Roy, S. D., et al. Myotome adaptability confers developmental robustness to somitic myogenesis in response to fiber number alteration. Developmental Biology. 431 (2), 321-335 (2017).
- Zhang, W., Roy, S. Myomaker is required for the fusion of fast-twitch myocytes in the zebrafish embryo. Developmental Biology. 423 (1), 24-33 (2017).
- Osborn, D. P. S., et al. Fgf-driven Tbx protein activities directly induce myf5 and myod to initiate zebrafish myogenesis. Development. 147 (8), (2020).
- Cooper, M. S., et al. Visualizing morphogenesis in transgenic zebrafish embryos using BODIPY TR methyl ester dye as a vital counterstain for GFP. Developmental Dynamics. 232 (2), 359-368 (2005).
- Berger, J., Hall, T. E., Currie, P. D. Novel transgenic lines to label sarcolemma and myofibrils of the musculature. Zebrafish. 12 (1), 124-125 (2015).
- Westerfield, M. . The Zebrafish Book - A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Attili, S., Hughes, S. M. Anaesthetic tricaine acts preferentially on neural voltage-gated sodium channels and fails to block directly evoked muscle contraction. PloS One. 9 (8), 103751 (2014).
- Theriault, R., Boulay, M. R., Theriault, G., Simoneau, J. A. Electrical stimulation-induced changes in performance and fiber type proportion of human knee extensor muscles. European Journal of Applied Physiology. 74 (4), 311-317 (1996).
- Roy, D., Johannsson, E., Bonen, A., Marette, A. Electrical stimulation induces fiber type-specific translocation of GLUT-4 to T tubules in skeletal muscle. American Journal of Physiology-Endocrinology and Metabolism. 273 (4), 688-694 (1997).
- Perez, M., et al. Effects of transcutaneous short-term electrical stimulation on M. vastus lateralis characteristics of healthy young men. Pflugers Archiv-European Journal of Physiology. 443 (5-6), 866-874 (2002).
- Boncompagni, S., et al. Structural differentiation of skeletal muscle fibers in the absence of innervation in humans. Proceedings of the National Academy of Sciences of the United States of America. 104 (49), 19339-19344 (2007).
- Gundersen, K. Excitation-transcription coupling in skeletal muscle: the molecular pathways of exercise. Biological Reviews of the Cambridge Philosophical Society. 86 (3), 564-600 (2011).
- Egan, B., Zierath, J. R. Exercise metabolism and the molecular regulation of skeletal muscle adaptation. Cell Metabolism. 17 (2), 162-184 (2013).
- Sillen, M. J. H., Franssen, F. M. E., Gosker, H. R., Wouters, E. F. M., Spruit, M. A. Metabolic and structural changes in lower-limb skeletal muscle following neuromuscular electrical stimulation: A systematic review. PloS One. 8 (9), 69391 (2013).
- Khodabukus, A., et al. Electrical stimulation increases hypertrophy and metabolic flux in tissue-engineered human skeletal muscle. Biomaterials. 198, 259-269 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon