Method Article
Protocollo per lo sviluppo e l'impianto di blastocisti umani per la modellazione di blastocisti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Un protocollo che delinea la formazione di blastoidi umani che generano in modo efficiente, tempestivo e sequenziale cellule simili a blastocisti.
Abstract
Un modello della blastocisti umana formata da cellule staminali (blastoidi) sosterrebbe i progressi scientifici e medici. Tuttavia, il suo potere predittivo dipenderà dalla sua capacità di ricapitolare in modo efficiente, tempestivo e fedele le sequenze di sviluppo della blastocisti (morfogenesi, specificazione, patterning) e di formare cellule che riflettono lo stadio della blastocisti. Qui mostriamo che le cellule staminali pluripotenti umane ingenue coltivate in condizioni PXGL e poi triplicate inibite per l'Ippopotamo, trasformando il fattore di crescita β e le vie chinasi regolate dal segnale extracellulare subiscono efficacemente la morfogenesi per formare blastoidi (>70%). In corrispondenza con i tempi di sviluppo (~ 4 giorni), i blastoidi srotolano la sequenza di specifiche della blastocisti producendo analoghi del trofoblasto e dell'epiblasto, seguiti dalla formazione di analoghi dell'endoderma primitivo e dei trofoblasti polari. Ciò si traduce nella formazione di cellule trascrizionalmente simili alla blastocisti (>96%) e una minoranza di analoghi post-impianto. I blastoidi modellano in modo efficiente formando l'asse embrionale-abembrionale segnato dalla maturazione della regione polare (NR2F2+), che acquisisce il potenziale specifico di attaccarsi direzionalmente alle cellule endometriali stimolate ormonalmente, come in utero. Un tale blastoide umano è un modello scalabile, versatile ed etico per studiare lo sviluppo umano e l'impianto in vitro.
Introduzione
La mancanza di modelli sperimentali ha limitato la comprensione dell'embriogenesi umana precoce. L'attuale conoscenza degli aspetti specifici dell'uomo dello sviluppo embrionale deriva da eccedenze di embrioni di fecondazione in vitro (FIV) donati per la ricerca. Tuttavia, la disponibilità limitata, le difficoltà di manipolazioni sperimentali e la qualità variabile degli embrioni ostacolano le indagini scientifiche. Al contrario, un modello fedele in vitro di embrioni umani consentirebbe complesse manipolazioni sperimentali, offrendo così un'opportunità etica per integrare la ricerca sugli embrioni umani 1,2,3,4. Un modello precedentemente sviluppato di blastocisti di topo combina cellule staminali embrionali di topo e cellule staminali di trofoblasto5. In questo protocollo dettagliato, viene descritto un metodo per generare un modello della blastocisti umana da cellule staminali pluripotenti ingenue che è fedele ai criteri elementari della blastocisti6.
Quattro criteri per i blastoidi umani. Qui, nel tentativo di stabilire una definizione standardizzata di blastoidi umani, proponiamo quattro criteri minimi. Sebbene non esaustivi, questi criteri potrebbero servire come base per valutare i parametri che consentono la formazione di blastoidi umani (Figura 1A). (1) I blastoidi dovrebbero formarsi in modo efficiente in termini di morfologia e di generazione degli analoghi dei tre lignaggi, vale a dire, epiblasto (Epi), trofoectoderma (TE) ed endoderma primitivo (PrE). È probabile che l'inefficienza indichi uno stato cellulare iniziale inadeguato o/o una condizione di coltura (ad esempio, mezzo blastoide). (2) I blastoidi dovrebbero generare analoghi dei tre lignaggi secondo la sequenza di sviluppo (Epi/TE prima, PrE/polarTE ultima)7,8 e la tempistica (induzione ~ 3 giorni; giorni embrionali 5-7)7,9. (3) I blastoidi dovrebbero formare analoghi dello stadio di blastocisti, ma non degli stadi post-impianto (ad esempio, epiblasto post-impianto, trofoblasto o cellule di amnione). (4) Infine, i blastoidi dovrebbero essere in grado di ricapitolare le caratteristiche funzionali dell'impianto e dello sviluppo della blastocisti. Utilizzando questo protocollo, i blastoidi umani si formano in modo efficiente utilizzando più linee cellulari (>70%), sono in grado di generare gli analoghi cellulari della blastocisti in sequenza ed entro 4 giorni, e gli analoghi sono trascrizionalmente simili allo stadio di blastocisti (>96% sulla base di diverse analisi)6,10,11. Infine, i blastoidi generano in modo robusto l'asse embrionale-abembrionale, che consente loro di interagire con le cellule endometriali stimolate ormonalmente attraverso la regione polare ed espandere robustamente i lignaggi su coltura estesa (equivalente nel tempo: giorno embrionale 13).
Importanza dello stato iniziale della cella. Le cellule staminali pluripotenti umane (hPSC) possono essere stabilizzate in diversi stati che tentano di catturare precise fasi di sviluppo. Questi stati sono sostenuti da condizioni di coltura che, sebbene ancora non ottimali, vincolano le cellule inuno stadio epiblastico pre-impianto (~ giorni embrionali 5-7) o post-impianto (~ giorni embrionali 8-14). L'analisi trascrittomica ha mostrato che le hPSC coltivate in PD0325901, XAV939, Gö6983 e il fattore inibitorio della leucemia (LIF; denominate hPSC naïve PXGL)13,14 sono più simili all'epiblasto di blastocisti rispetto alle hPSC coltivate nel fattore di crescita dei fibroblasti (FGF) 2 e nell'activina15 (denominate hPSC innescate12) e alle cellule staminali pluripotenti estese umane (hEPSCs)16 (cfr. analisi nei riferimenti17, 18,19). Di conseguenza, il trascrittoma delle hPSC innescate corrisponde meglio con un epiblasto di scimmia cynomolgus post-impianto / pre-gastrulazione20. Ulteriori criteri molecolari, come l'espressione del trasposone, la metilazione del DNA e lo stato del cromosoma X, hanno confermato che le variazioni dello stato naïve assomigliano più da vicino all'epiblasto di blastocisti rispetto allo stato innescato17,21. Infine, linee di hPSC ingenue sono state derivate con successo direttamente dalle blastocisti utilizzando le condizioni di coltura PXGL22.
Le prime cellule di blastocisti umana non sono ancora impegnate. La specifica del lignaggio murino si verifica dallo stadio di morula che precede lo stadio di blastocisti23. Al contrario, esperimenti di dissociazione e riaggregazione hanno dimostrato che le cellule trofoectodermiche umane delle blastocisti precoci non sono ancora impegnate24. Di conseguenza, l'analisi delle cellule delle blastocisti umane mediante sequenziamento dell'RNA a singola cellula (scRNAseq) ha dimostrato che la prima specifica di lignaggio (trofoblasto/epiblasto) si verifica dopo la formazione della cavità della blastocisti7. Questa specifica umana differita è correlata alle osservazioni che le hPSC sono potenti per formare trofoblasti 25,26,27 quando le PSC di topo sono in gran parte impegnate nel lignaggio degli epiblasti. Queste osservazioni combinate hanno portato alla possibilità che le hPSC ingenue riflettano uno stadio di blastocisti e mantengano il potenziale per formare i tre lignaggi di blastocisti. Ultimamente, la potenza delle hPSC per specificare analoghi extraembrionali è stata proposta per passare dal trofoectoderma all'amnione durante la progressione dallo stato naïve a quello innescato27. Pertanto, le hPSC naïve sono più simili allo stadio preimpianto 17,18,21 e hanno una maggiore capacità di formare trofoblasti rispetto alle hPSC innescate27, hEPSCs 16 o stati riprogrammati intermedi28, che sono inclini a formare analoghi post-impianto10 (Figura 1B ). Lo stato cellulare iniziale è quindi cruciale per formare gli analoghi extraembrionali appropriati. Sebbene rimanga da fare un'analisi approfondita affiancata degli analoghi del trofoectoderma convertiti, uno stato naïve PXGL che riflette la blastocisti precoce sembra importante per formare blastoidi ad alta fedeltà.
Sollecitazione della specificazione e della morfogenesi mediante segnalazione dell'inibizione delle vie. L'inibizione della via di segnalazione hippo è un meccanismo conservato che guida la specifica del trofoblasto in topi, mucche eumani 9,29,30. Inoltre, dal 2013, è noto che l'inibizione del NODAL (A83-01) e della chinasi extracellulare regolata dal segnale (ERK; PD0325901 o equivalente) e l'attivazione delle vie di segnalazione della proteina morfogenetica ossea (BMP) innesca hPSC innescate per attivare la rete trascrizionale associata al lignaggio del trofoblasto 25,31,32,33,34. Inoltre, recentemente diversi rapporti hanno anche confermato che l'inibizione della via NODAL ed ERK e l'attivazione del BMP facilitano la differenziazione del trofoblasto dalle hPSC naïve 25,31,32,33,34. Infine, se la specificazione del trofoblasto viene attivata da uno stato naïve, le cellule ricapitolano aspetti della progressione evolutiva del trofoectoderma26. Tuttavia, le linee auto-rinnovanti che riflettono il trofoectoderma della blastocisti non sono state stabilizzate in vitro. Seguendo la specifica del trofoblasto, l'induzione del fattore di crescita epidermico (EGF) e delle vie di segnalazione Wnt insieme all'inibizione dell'HDAC potrebbe facilitare la progressione dello sviluppo del trofoblasto 34,35 e stabilizzare le cellule in linee di cellule staminali del trofoblasto umano (hSTC) che riflettono i citotrofoblasti post-impianto 18,35. Tali linee possono essere derivate sia da blastocisti che da tessuti placentari35.
Il secondo lignaggio extraembrionale, chiamato PrE, è specificato dopo i trofoblasti e ha origine dall'epiblasto 7,9. Contrariamente al murino PrE36, si pensa che la controparte umana sia indipendente dalla segnalazione FGF37,38. Le linee che riflettono l'endoderma extraembrionale (chiamato nEnd) sono state stabilite da hPSC ingenue mediante induzione di vie di segnalazione utilizzando l'activina A, Wnt e LIF39. Incoerente con gli esperimenti di inibizione embrionale, l'inibizione ERK ha dimostrato di prevenire la formazione di tali cellule nEND in vitro39. Fino ad ora, tali linee non sono state derivate direttamente dalle blastocisti.
Ultimamente, i modelli dell'embrione precoce sono stati formati combinando variazioni dei mezzi precedentemente sviluppati per hTSCs35 e cellule nEND39 utilizzando così attivatori del fattore di crescita trasformante - β (TGF-β), EGF e Wnt vie di segnalazione28,40. Questi modelli embrionali si formano a bassa efficienza (10%-20%) e formano cellule simili allo stadio post- piuttosto che pre-impianto10, compresi analoghi dell'epiblasto post-impianto, trofoblasto, amnione, gastrula, tessuti mesodermici (~ giorno embrionale 14) e citotrofoblasti10. Al contrario, una tripla inibizione delle vie hippo, ERK e TGF-β guida in modo efficiente la formazione di blastoidi comprendenti cellule simili a blastocisti41. Insieme allo stato cellulare iniziale, proponiamo che l'inibizione delle triple vie (Hippo, ERK, TGF-β) sia il secondo parametro essenziale per formare blastoidi ad alta fedeltà (Figura 1B).
Valutazione dello stato cellulare e dello stadio riflesso utilizzando scRNAseq. Gli stati delle cellule che compongono blastoidi possono essere valutati attraverso l'analisi scRNAseq. La loro somiglianza trascrizionale con specifici stadi embrionali può essere misurata utilizzando solo cellule blastoidi e confrontandole con hPSC innescate o hSTC che riflettono gli stadi post-impianto20,35. L'esecuzione di analisi dei cluster utilizzando diversi livelli di definizione rivela come le sottopopolazioni si fondono progressivamente quando la definizione diminuisce, rivelando così le somiglianze dei cluster. Sebbene l'ottimalità nel numero di cluster possa essere misurata42, il clustering ad alta risoluzione informa anche sull'eventuale presenza di piccole sottopopolazioni anormali, ad esempio riflettendo le fasi post-impianto10. I geni differenzialmente espressi tra i cluster possono fornire informazioni sui loro analoghi nel processo di sviluppo valutando i livelli di espressione dei set di geni di riferimento che definiscono i lignaggi specifici dello stadio. Ciò consente di misurare l'arricchimento delle sottopopolazioni di blastoidi attraverso mappe di distanza non supervisionate (ad esempio, utilizzando geni arricchiti dall'alto) o mediante analisi di arricchimento del set genico (GSEA)43. Usando questo protocollo blastoide, si formano solo tre cluster principali che riflettono trascrizionalmente i tre lignaggi di blastocisti. Un cluster comprende sia le hPSC naïve iniziali che l'analogo epiblastico dei blastoidi. L'analisi delle cellule in diversi punti temporali ha mostrato la natura sequenziale delle specifiche dei lignaggi (i trofoblasti iniziano a specificare entro 24 ore e le cellule endodermiche primitive entro 60 ore). Un clustering ad alta risoluzione ha catturato una sottopopolazione di cellule (3,2%) che esprimono geni specifici per gli embrioni dello stadio di gastrulazione (possibilmente mesoderma o amnione). Da notare, le hPSC naïve iniziali comprendevano anche il 5% di cellule simili al post-impianto, come descritto in precedenza44. In una seconda analisi, le cellule blastoidi possono essere fuse in silico con cellule di riferimento isolate da concepti in diversi stadi 45,46,47 al fine di dedurre l'equivalenza di stadio. Qui sono state utilizzate come punti di riferimento cellule isolate dal concetto preimpianto 45,46, blastocisti in vitro coltivate 45 ed embrioni in stadio di gastrulazione47. Usando questo protocollo, è stato quantificato che le cellule blastoidi non corrispondenti rivelate dal clustering ad alta risoluzione si raggruppano effettivamente con mesoderma e amnione post-impianto. Nelle fasi future, il benchmarking del trascrittoma dovrebbe essere integrato con l'analisi dell'espressione del trasposone, della metilazione del DNA e dello stato del cromosoma X che forniscano anche punti di riferimento delle fasi di sviluppo21.
Valutazione della formazione degli assi e di altre funzionalità dei blastoidi umani. Una blastocisti matura è caratterizzata dalla formazione dell'asse embrionale-abembrionale che modella i trofoblasti per l'impianto. Utilizzando questo protocollo blastoide, un asse si forma robustamente esemplificato da una maturazione dei trofoblasti prossimali (ad esempio, NR2F2 + / CDX2-) che acquisiscono la capacità di attaccarsi alle cellule organoidi endometriali solo quando sono stimolate ormonalmente48,49. Il confronto con trofosfere che non formano l'epiblasto mostra che queste cellule interne inducono trofoblasti adiacenti a maturare in modo da mediare l'attaccamento iniziale all'endometrio. Quando coltivati in un terreno di coltura esteso progettato per le blastocisti di scimmia cynomolgus50, tutti e tre i lignaggi del blastoide si espandono costantemente per sei giorni aggiuntivi (equivalente al giorno 13) sebbene la loro organizzazione non rifletta quella fase di sviluppo.
L'implicazione di blastoidi umani ad alta efficienza e alta fedeltà. La conservazione dei principi di sviluppo che sono stati scoperti negli organismi modello è intrinsecamente difficile da testare nel conceptus umano a causa dell'accesso limitato e delle difficoltà tecniche nel manipolarlo geneticamente e fisicamente. Un modello blastoide ad alta efficienza e ad alta fedeltà consentirebbe screening genetici e farmacologici ad alto rendimento, che sono alla base delle scoperte scientifiche e biomediche. Inoltre, l'incorporazione di complesse modificazioni genetiche per alterare e registrare i processi biologici integrerebbe tali studi. Nel complesso, proponiamo che la tripla inibizione (Hippo, TGF-β, ERK) delle hPSC PXGL naïve sia conduttiva per la formazione efficiente di blastoidi umani ad alta fedeltà conformi ai quattro criteri minimi. La natura scalabile e versatile di questo protocollo lo rende adatto a generare ipotesi mirate che possono poi essere convalidate utilizzando blastocisti umane. In quanto tali, i blastoidi umani non sostituiranno l'uso del conceptus umano per la ricerca in vitro , ma potrebbero agire come un modo potente per incanalare la ricerca attraverso approcci sperimentali precedentemente inaccessibili al centro del processo di scoperta scientifica e biomedica. Il protocollo mostra come formare blastoidi umani e anche come analizzare le cellule contenute all'interno del blastoide.
Protocollo
Le Linee guida per la ricerca sulle cellule staminali e la traduzione clinica della Società internazionale per la ricerca sulle cellule staminali (ISSCR) raccomandano che la ricerca sui blastoidi umani sia consentita solo dopo la revisione e l'approvazione attraverso un processo di revisione scientifica ed etica specializzato 3,4. Tutte le procedure sperimentali sono state condotte seguendo le linee guida del comitato etico della ricerca umana dell'Istituto di Biotecnologie Molecolari dell'Accademia Austriaca delle Scienze (IMBA) sotto l'approvazione Rivron_Stellungnahme_2020-04-22. Il rispetto di queste linee guida è necessario per pubblicare i risultati della ricerca su riviste scientifiche.
1. Coltura di cellule staminali embrionali naïve umane in condizioni PXGL
NOTA: Le hPSC naive possono essere ottenute presso i laboratori competenti. Le linee qui utilizzate sono state ottenute dai laboratori di Yasuhiro Takashima (attualmente al CiRA, Kyoto, Giappone) e di Austin Smith (attualmente al Living Systems Institute, Exeter, Regno Unito). In alternativa, le hPSC ingenue possono essere ripristinate internamente da linee di hPSC innescate come descritto in precedenza13,14. Le hPSC ingenue appaiono stabili per più passaggi (> 15) ma la qualità della cultura può variare nel tempo. Se la qualità dell'hPSC naïve diminuisce, scongelare una nuova fiala di cellule o generare hPSC naïve de novo da PSSC innescati. Per tutte le composizioni dei media si veda la tabella supplementare 1.
- Preparazione dello strato irradiato di alimentatore embrionale di topo (MEF)
- Il giorno prima del passaggio di hPSC naïve, preparare una piastra di coltura cellulare a 6 pozzetti con strati di MEF irradiati seguendo i passaggi descritti di seguito.
- Rivestire una piastra di coltura cellulare a 6 pozzetti con 1 mL di gelatina allo 0,1% in PBS per pozzetto. Incubare la piastra a 37 °C per 30 min. Rimuovere la soluzione di gelatina.
- Preparare il mezzo MEF a 37 °C.
- Scongelare i MEF a bagnomaria a 37 °C fino a quando non rimane solo un piccolo grumo di ghiaccio. Sciogliere il volume del flaconcino con 1 mL di mezzo MEF preparato utilizzando una pipetta P1000.
- Trasferire la sospensione cellulare in un tubo da 15 ml. Abbassare la sospensione a 200 x g per 4 min. Aspirare il surnatante e risospese il pellet MEF aggiungendo mezzo MEF fresco (sufficiente per 1,5 ml per pozzetto).
- Contare le celle usando i vetrini di conteggio delle cellule e aggiungere 300.000 celle per pozzetto e trasferire la piastra in un incubatore normossidico a 37 °C.
NOTA: se i MEF si staccano nel tempo, è possibile aggiungere nuovi MEF al supporto PXGL durante la modifica di routine dei supporti.
- Passaggio di cellule staminali pluripotenti naïve umane
- Prima di passare le hPSC, controllare la loro morfologia al microscopio. Le colonie hanno tipicamente una morfologia a forma di cupola con bordi luminosi e definiti. Se le singole colonie mostrano una morfologia più piatta o se iniziano ad emergere colonie differenziate, seguire le istruzioni del punto 1.2.8.
- Aspirare il mezzo e lavare le celle con PBS una volta. Aggiungere 500 μL di soluzione di distacco cellulare per pozzetto di una piastra a 6 pozzetti.
- Incubare le cellule per 5 minuti a 37 °C. Utilizzare una pipetta P1000 e pipettare le cellule più volte per dissociare le colonie in singole cellule.
- Raccogliere le cellule e trasferirle in un tubo da 15 ml contenente tampone di lavaggio (1 mL per pozzetto di una piastra a 6 pozzetti). Abbassare le celle a 200 x g per 4 minuti.
- Aspirare il surnatante e risospesciare il pellet in mezzo PXGL fresco (sufficiente per 1,5 ml per pozzetto). Considera un rapporto di divisione di 1: 3-1: 6 per il passaggio di routine.
NOTA: Dopo ogni 3-4 passaggi o se la qualità della coltura cellulare diminuisce in base alla morfologia cellulare (ad esempio, l'emergere di colonie piatte nella popolazione), aggiungere 10 μM Y-27632 e l'estratto di membrana basale del fattore di crescita (5 μL / pozzetto) al mezzo durante le prime 24 ore dopo il passaggio. - Prima di ripavimentare le hPSC, preparare le piastre con MEF freschi aspirando il mezzo MEF e lavando le cellule una volta con PBS. Quindi, utilizzare una pipetta P1000 per trasferire 1,5 mL di sospensione cellulare hPSC per pozzetto di una piastra a 6 pozzetti contenente i MEF.
NOTA: Assicurarsi che il pipettaggio porti a una semina omogenea delle cellule attraverso l'area del pozzo. Ciò garantirà la crescita di colonie con dimensioni omogenee e relativa sincronia delle cellule. - Coltura di hPSC in condizioni ipossiche a 37 °C in ambiente umidificato. Dopo 24 ore, le hPSC devono essere attaccate. Un numero elevato di cellule non aderenti (o fluttuanti) riflette un problema di vitalità o di attaccamento al passaggio.
- Cambia mezzo con 1,5 ml di PXGL medio per pozzo al giorno. Passa hPSC ogni 3-4 giorni o usali per esperimenti di formazione di blastoidi.
NOTA: Dopo lo scongelamento delle hPSC, passarle per un minimo di tre passaggi prima di iniziare un esperimento di blastoide.
2. Formazione di blastoidi
- Formazione di aggregati PSC ingenui
- Preparare e preriscaldare il supporto PXGL, il supporto basale N2B27, il tampone di lavaggio, il PBS e i supporti di aggregazione prima di iniziare l'esperimento. Escludere i MEF dalla sospensione delle hPSC per la formazione di blastoidi seguendo i passaggi descritti di seguito.
- Per l'esclusione del MEF, preparare una piastra rivestita di gelatina aggiungendo 1 mL di gelatina allo 0,1% nel pozzetto di una piastra a 6 pozzetti e incubando a 37 °C per 30-90 minuti.
- Per raccogliere le cellule, aspirare il mezzo e lavare le cellule con 1 mL di PBS.
- Aggiungere 500 μL di soluzione di distacco cellulare (per pozzetto di una piastra a 6 pozzetti) e incubare a 37 °C per 5 min.
- Controllare le cellule al microscopio per seguire la dissociazione delle colonie in singole cellule (alcuni grumi multicellulari possono essere dissociati in seguito con un delicato pipettaggio).
- Diluire la soluzione di distacco cellulare con 1 mL di tampone di lavaggio. Raccogliere le cellule dalla piastra pipettando delicatamente da 5 a 10 volte. Trasferire la sospensione cellulare in un tubo da 15 ml. Abbassare le celle a 200 x g per 4 minuti.
- Aspirare il surnatante, risospese le cellule in 1,5 mL di mezzo PXGL (per pozzetto di una piastra a 6 pozzetti) e seminare le cellule sulle piastre rivestite di gelatina per l'esclusione del MEF e incubare a 37 °C per 60-90 min.
- Una volta che le cellule naïve sono seminate per l'esclusione MEF, rimuovere il PBS dai microwell ed equilibrare i pozzetti con 200 μL di mezzo N2B27 basale (per 1 chip microwell) e incubare per 60 min a 37 °C.
- Raccogliere il surnatante contenente le cellule naïve non attaccate, trasferirlo in un tubo da 15 ml e ruotare le cellule a 200 x g per 4 minuti.
- Aspirare il mezzo e risospescere le cellule in 1 mL di terreno basale N2B27. Contare le celle utilizzando le diapositive di conteggio delle celle. Abbassare le celle a 200 x g per 4 minuti.
- Aspirare il mezzo e aggiungere una quantità appropriata di 10 μM Y-27632 contenuta nel mezzo N2B27 per ottenere una densità cellulare di 30.000 celle per 50 μL.
NOTA: il numero di celle di seeding iniziale ottimale può variare tra le diverse linee di cella. Ad esempio, per seminare 50-60 cellule / microwell, 30.000 cellule (incluso il surplus considerando che alcune cellule cadono al di fuori del microwell) vengono seminate in 1 pozzo di 96 piastre di pozzo che contiene 430 microwell. Un numero di cellule di partenza inappropriato può provocare la piccola formazione di aggregati senza cavità o la formazione di una struttura cavitata che raggiunge più di 250 μm. - Aspirare il mezzo da array di microwell bilanciati e aggiungere 25 μL di supporti N2B27 con 10 μM Y-27632. Aggiungere 50 μL di sospensione cellulare e incubare a 37 °C per 15 minuti (fino a quando le cellule cadono sul fondo del microwell). Quindi, aggiungere 125 μL di N2B27 medio integrato con 10 μM Y-27632.
- Sviluppo di blastoidi
- Entro 24 ore, aggregati di hPSC ingenui possono essere osservati (giorno 0) sul chip microwell. Per iniziare la formazione di blastoidi, preparare il mezzo PALLY e seguire i passaggi descritti di seguito.
- Media PALLY preriscaldante a 37 °C per 30 min.
NOTA: 1-Oleoyl Lysophosphatidic acid (LPA) e 10 μM Y-27632 devono essere aggiunti appena prima dell'uso. La concentrazione ottimale di LPA varia tra 0,5-5 μM. Questo deve essere titolato per le singole linee hPSC utilizzate per i blastoidi. - Aspirare il mezzo di aggregazione. Aggiungere 200 μL di mezzo PALLY preriscaldato ai microventi. Riposizionare la piastra di coltura cellulare in un incubatore ipossico a 37 °C. Ripeti la modifica dei media il giorno 1.
- Il giorno 2, rimuovere PALLY medium e aggiungere 200 μL di N2B27 medium integrato con LPA e 10 μM Y-27632.
NOTA: Il giorno 2 la maggior parte degli aggregati continua a crescere. Tuttavia, alcuni aggregati formano piccole cavità. Coltura continua di blastoidi in PALLY fino al giorno 4 o in terreno di coltura in vitro (IVC1) dal giorno 2 in poi. Tuttavia, a seguito di questo cambiamento dei media aumenta la formazione di PrE nei blastoidi maturi. - Ripeti la modifica dei media il giorno 3. La formazione completa di blastoidi avviene entro il giorno 4.
NOTA: Si ritiene che i blastoidi si siano pienamente sviluppati quando hanno subito una morfogenesi completa basata sulla morfometria delle blastocisti umane del giorno 7 (ad esempio, un intervallo di diametro da 150 -250 μm; un cluster interno circondato da un epitelio di cellule simili a trofoectodermi) e hanno formato cellule polari simili a trofoectodermi (NR2F2 + / CDX2-) e cellule simili a PrE (GATA4 +). Questo può essere valutato utilizzando la colorazione a immunofluorescenza o lo smistamento cellulare attivato dalla fluorescenza (FACS).
3. Formazione di blastoidi in micropiastre a 96 pozzetti ad attacco ultra basso
- Preparare la sospensione cellulare naïve hPSCs per la formazione di blastoidi seguendo i passaggi sopra descritti da 2.1.1 a 2.1.11.
- Aspirare il mezzo e aggiungere una quantità appropriata di mezzo N2B27 contenente 10 μM Y-27632 per ottenere la densità cellulare di 70 celle per 100 μL del mezzo.
NOTA: il numero ottimale di celle di seeding iniziale può variare tra le diverse linee cellulari. Ad esempio, 70 celle / pozzo può essere il numero di cella ottimale per la maggior parte delle linee cellulari. - Centrifugare la piastra a 200 x g per 2 minuti a temperatura ambiente per raggruppare le celle sul fondo dei pozzetti.
- Incubare la piastra in un incubatore a 37 °C in condizioni di coltura ipossica. Entro 24 ore si possono osservare aggregati di hPSC ingenue (giorno 0) sui pozzi.
- Preparare 2x PALLY medio. Aggiungere 100 μL di mezzo PALLY 2x preribalizzato ai pozzetti.
- Riposizionare la piastra di coltura cellulare in un incubatore ipossico a 37 °C. Dopo 24 ore, aspirare metà del fluido (100 μL) e sostituirlo con 100 μL di mezzo PALLY preriscaldato. Ripeti il passaggio fino al giorno 4. Assicurarsi di non aspirare gli aggregati.
NOTA: il giorno 2, la maggior parte degli aggregati continua a crescere. Tuttavia, alcuni aggregati hanno piccole cavità piene di liquido. Il giorno 4, la maggior parte delle strutture cavitate subisce una completa morfogenesi per formare strutture simili a blastocisti.
4. Formazione di trofosfere
- Per la formazione della trofosfera, seguire il protocollo di formazione dei blastoidi dal passo 2.1.1 (esclusione MEF) fino al passo 2.1.12 (ultimo passaggio del protocollo di semina).
- Una volta che gli aggregati di hPSC naïve si sono formati dopo 24 h, scambiare il mezzo di aggregazione con PALY (senza LIF) integrato con 3 μM SC-144 per la formazione di trofosfere che rappresentano il trofoectoderma precoce e PALLY integrato con 2 μM XMU-MP-1 per la formazione di trofosfere che rappresentano il trofoectoderma maturo.
- Aggiorna il mezzo ogni giorno. La formazione completa della trofosfera avviene entro il giorno 4.
5. Analisi dello stato delle cellule blastoidi e del suo stadio riflesso utilizzando scRNAseq
- Per raccogliere i blastoidi ed eseguire la dissociazione, riscaldare l'incubatore vibrante a 37 °C e impostarlo a 100 giri/min.
- Raccogliere i blastoidi dalla piastra iniziale a 96 pozzetti e trasferirli in più pozzetti di una piastra a 96 pozzetti con fondo a U utilizzando una pipetta boccale dotata di un capillare di vetro.
NOTA: I blastoidi (> 70%) devono essere selezionati in base ai criteri morfometrici (dimensione = 150-250 μm con un unico cluster interno) al fine di evitare la contaminazione con strutture non blastoidi (< 30%). - Lavare una volta con 200 μL di PBS usando un P200 visualizzando sotto uno stereomicroscopio. Trasferire in un pozzo contenente 50 μL di collagenasi e incubare per 30 minuti nell'incubatrice vibrante.
- Trasferire i blastoidi in un pozzetto con 100 μL di 10x tripsina-EDTA e mescolare bene. Incubare per 20 minuti nell'incubatrice vibrante.
- Dissociare i blastoidi in una singola cellula utilizzando la pipetta P200. Trasferire le celle in un tubo da 15 ml con tampone FACS (1% FBS in PBS).
- Per catturare rapporti specifici degli analoghi dei tre lignaggi, colorare gli analoghi TE e PrE con anticorpi TROP2 e PDGFRa rispettivamente.
NOTA: Il numero di cellule PrE nelle blastocisti umane è inferiore rispetto alle blastocisti di topo, che potrebbero riflettere i difetti dello sviluppo delle blastocisti formate attraverso la fecondazione in vitro (FIV) o una differenza di specie. Nei blastoidi, gli analoghi PrE sono meno abbondanti degli analoghi TE ed EPI e rappresentano il 7,4% delle cellule dopo aver contato le cellule GATA4+ mediante imaging a immunofluorescenza. Inoltre, il processo di dissociazione potrebbe indurre distorsioni nelle proporzioni dei diversi tipi di cellule come analoghi PrE per rappresentare l'1% -2% delle cellule dopo la dissociazione dei blastoidi, il tagging PDGFRa e l'analisi FACS. - FACS ordina le cellule da tutti e tre gli analoghi del lignaggio in 384 piastre contenenti un buffer di lisi per l'analisi smart-seq2. Escludere le cellule morte contrassegnate da colorazione DAPI (eseguita secondo le istruzioni del produttore).
- Per valutare gli stati cellulari (tipo di cellula e stadio di sviluppo), confrontare i dati trascrittomici del blastoide con i controlli appropriati.
6. Coltura estesa per valutare la progressione dello sviluppo dei blastoidi
- Coltura di blastoidi umani su lastre rivestite di matrice a membrana basale (fondo di vetro).
- Rivestire la piastra con matrice a membrana basale.
- Ispezionare visivamente i blastoidi per valutare e registrare la morfologia.
NOTA: Solo i blastoidi che mostrano la classica morfologia di blastocisti a sfera cava con ICM compatto hanno il potenziale di crescere e svilupparsi ulteriormente. - Aggiungere 100 μL di CMRL medium-1 per un pozzetto della piastra a 96 pozzetti e posizionare la piastra nell'incubatore almeno 2 ore prima del trasferimento dei blastoidi per l'equilibrio.
- Utilizzando uno stereomicroscopio, identificare visivamente i blastoidi con una buona morfologia, trasferire i blastoidi selezionati in un pozzo di piastra a 96 pozzetti contenente 100 μl di CMRL medium-1 per rimuovere le tracce di mezzi blastoidi.
- Trasferire i blastoidi nel pozzo contenente il media CMRL-1 preequilibrato. Posizionare la piastra nell'incubatrice e incubare a 37°C durante la notte.
NOTA: Fino a 5 blastoidi possono essere coltivati in un pozzo di 96 piastre di pozzo. Avere troppi blastoidi in un singolo pozzo può portare alla formazione di aggregati di blastoidi multipli. - Il giorno dopo, ispeziona visivamente i blastoidi al microscopio. Se i blastoidi sono attaccati, aggiungere 100 μL di MEDIA-1 CMRL preequilibrato integrato con una matrice di membrana basale al 5%. Posizionare la piastra nell'incubatrice e incubare a 37 °C durante la notte.
- Il giorno dopo, monitora i blastoidi al microscopio. Rimuovere metà del supporto (100 μL) e sostituirlo con 100 μL di media-2 CMRL preequilibrato integrato con matrice di membrana basale al 5%.
- Nei giorni successivi, sostituire metà del supporto (100 μL) con media CMRL-3 preequilibrato integrato con matrice di membrana basale al 5%. Posizionare la piastra nell'incubatrice e incubare a 37 °C durante la notte. Ripetere ogni giorno per un massimo di 4-6 giorni di coltura in vitro .
NOTA: Abbiamo coltivato blastoidi per un massimo di 6 giorni in condizioni di coltura estesa che corrisponde all'equivalente temporale del giorno 13 di embrioni umani coltivati in vitro .
7. Blastoidi immunocoloranti
- Aspirare il mezzo. Lavare i campioni 3 volte con PBS per 5 minuti.
- Aggiungere 200 μL di paraformaldeide fredda al 4% (PFA) in PBS e fissare i campioni per 30 minuti a temperatura ambiente. Rimuovere la soluzione di PFA e lavare i campioni 3 volte con PBS per 10 minuti.
NOTA: se i blastoidi sono stati coltivati su chip microwell, trasferire i blastoidi dal chip in piastre a U a 96 pozzetti per i seguenti passaggi. - Permeabilizzare e bloccare i blastoidi in 100 μL di soluzione bloccante per pozzetto (PBS contenente 0,3% Triton-X 100 e 10% di siero d'asino normale) per 60 min.
NOTA: A seconda della specie ospite degli anticorpi, adattare il siero di conseguenza. - Rimuovere la soluzione di blocco. Aggiungere 100 μL di anticorpi primari diluiti in una soluzione bloccante fresca e incubare i campioni durante la notte a 4°C.
NOTA: le concentrazioni di anticorpi primari devono essere determinate in base alle istruzioni del produttore. - Lavare i campioni 3 volte con 0,1% di Triton-X 100 in PBS (soluzione di lavaggio) per 10 minuti. Aggiungere 100 μL di anticorpi secondari in soluzione bloccante insieme a 20 μg/mL di colorazione nucleare di Hoechst e incubare i campioni per 1 ora a temperatura ambiente. Proteggere i campioni dalla luce.
NOTA: Le concentrazioni di anticorpi secondari devono essere determinate in base alle istruzioni del fabbricante. - Lavare i campioni 3 volte con soluzione di lavaggio per 10 minuti. Per l'imaging, trasferire i campioni sul fondo di vetro μ-slide in PBS.
NOTA: il supporto di montaggio deve essere selezionato in base all'obiettivo utilizzato per l'imaging. Ad esempio, l'80% di glicerolo in PBS è possibile utilizzare per il montaggio dei campioni durante l'utilizzo di obiettivi di olio.
Risultati
Tipicamente, le hPSC naïve coltivate in PXGL (Figura 2A) sono strutture aggregate e cavitate che emergono tra 48 e 72 ore dopo l'induzione PALLY e raggiungono un diametro di 150-250 μm entro 96 h (Figura 2B). Utilizzando (1) numeri ottimali di cellule di semina, (2) durata dell'aggregazione pre-coltura con N2B27 (da 0 a 24 h), (3) concentrazione di singoli componenti chimici (in particolare LPA) e (4) durata del trattamento PALLY, l'efficienza di induzione raggiunge il 70%-80% come definito in base a parametri morfometrici (dimensione complessiva di 150-250 μm, singola cavità regolare, singolo cluster cellulare interno; Figura 2C,D) e la presenza dei tre lignaggi. Uno stato cellulare iniziale non ottimale e/o condizioni di induzione si tradurranno in una formazione di blastoidi meno efficiente o assente. Per garantire la massima efficienza e formare solo analoghi preimpianto, è fondamentale utilizzare una cultura di alta qualità di hPSC PXGL ingenue. Questo può essere valutato misurando con FACS la percentuale di cellule positive per i marcatori di superficie SUSD2 (stato naïve) e CD24 (stato innescato). Anche ulteriori marcatori di superficie specifici per i lignaggi extraembrionali fuori bersaglio (ad esempio, amnion, mesoderma extraembrionale) sarebbero utili ma, per quanto ne sappiamo, non sono attualmente disponibili. Se l'efficienza di formazione ottenuta è inferiore ai risultati riportati, è importante controllare attentamente tutti i componenti del mezzo blastoide, in particolare l'LPA che viene ricostituito in PBS e che, come ligando GPCR, può essere più instabile rispetto alle molecole sintetiche ricostituite in DMSO. Nella maggior parte dei casi, anche se la resa non è massimale, le strutture cavitate sono ancora composte dai tre lignaggi di blastocisti. L'emergere di tre lignaggi di blastocisti e la formazione dell'asse embrionale-abembrionale possono essere confermati dalla colorazione immunofluorescenza dei marcatori (EPI: NANOG, OCT4, TE: GATA3, Polar-TE NR2F2, Mural-TE: CDX2, PrE: GATA4; Figura 2E,G). Le trofosfere, che sono composte solo da TE, aiutano a sezionare ulteriormente il ruolo della comunicazione intercellulare. Le trofosfere possono formarsi con un'efficienza del 50%-60% entro 96 h dall'induzione (Figura 2H,I). La formazione di blastoidi può essere eseguita non solo in array di microwell fatti in casa, ma anche in 96 piastre di pozzo ultra-basse disponibili in commercio con ottimizzazione delle condizioni di induzione (vedere Protocollo e Figura 2J). I blastoidi hanno anche la capacità di svilupparsi ulteriormente per ulteriori 6 giorni, che è equivalente nel tempo dell'embrione del giorno 13, con protocollo di differenziazione in vitro (Figura 2K).
Al fine di caratterizzare ulteriormente lo stato cellulare delle cellule blastoidi, è necessario utilizzare la tecnologia di sequenziamento dell'RNA a singola cellula. UMAP viene comunemente applicato per visualizzare una distribuzione degli stati delle cellule e su di esso viene eseguita un'analisi di clustering non supervisionata per valutare la vicinanza dei singoli stati cellulari. Diversi parametri nell'analisi dei dati a cella singola possono influenzare il modo in cui le cellule vengono visualizzate negli UMP, portando così a cluster con diverse posizioni e forme spaziali e relative (Figura 3A). Tuttavia, in questa analisi, le cellule mostrano profili di clustering marcatamente riproducibili indipendentemente dai parametri utilizzati per eseguire il clustering e la visualizzazione dei dati, il che consente di distinguere con elevata sicurezza le tre linee di blastocisti. Abbiamo usato cellule di embrioni raccolti in diverse fasi dello sviluppo come riferimento. La fusione di questi set di dati mostra che la maggior parte dell'analogo del trofoectoderma da blastoide si è raggruppato con trofoectoderma preimpianto ma non con trofoblasti post-impianto (Figura 3B). Questi risultati sono stati confermati anche da un consorzio indipendente10.
Quando gli embrioni gastrulanti allo stadio Carnegie 7 (CS7) vengono introdotti nella mappa di riferimento, una piccola popolazione di cellule blastoidi (3%) si raggruppa con i lignaggi mesodermici e amnioni di questi embrioni (Figura 3C). Quando le cellule simili agli annioni vengono introdotte nella mappa di riferimento, una piccola popolazione di cellule blastoidi (< il 2%) si raggruppa con tali cellule simili agli anoni.
Nel complesso, solo le strutture che comprendono una singola cavità regolare, un singolo cluster cellulare interno, una dimensione complessiva che va da 150-250 μm, comprendente analoghi trascrittomici delle tre linee di blastocisti e in gran parte prive di altri lignaggi (ad esempio, amnione, mesoderma, mesoderma extraembrionale) sono considerate blastoidi umani.
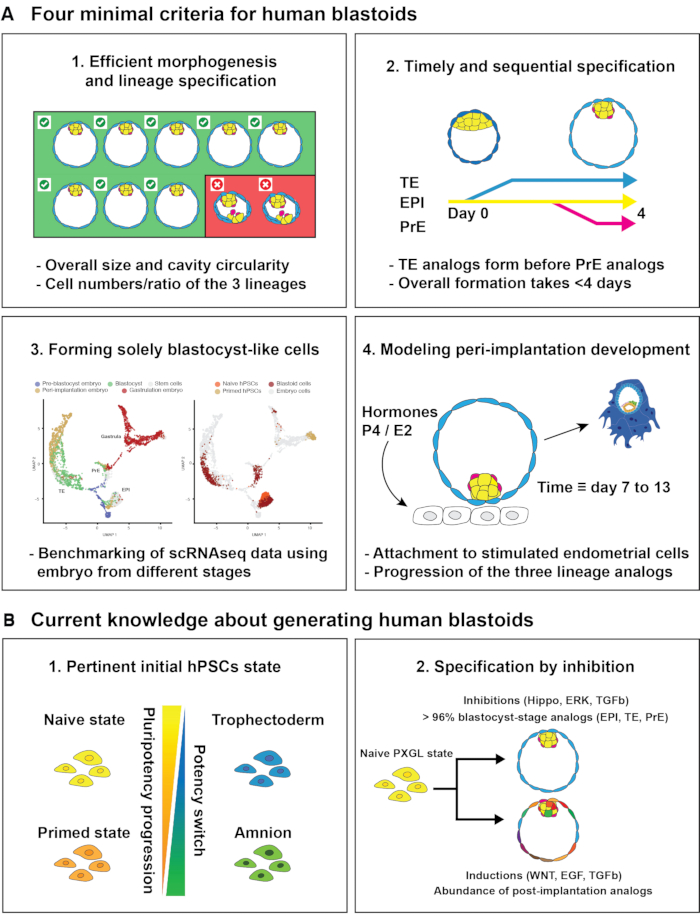
Figura 1: Quattro caratteristiche e due approcci per la generazione di blastoidi ad alta fedeltà. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Blastoidi e trofosfere derivate da aggregati di hPSC naïve. (A) Immagini a contrasto di fase che mostrano hPSC naïve coltivate in mezzo PXGL co-coltivate con MEF irradiato. Barra di scala: 50 μm. (B) Immagini a contrasto di fase che mostrano il cambiamento morfologico di aggregati hPSC naïve coltivati su un array di microwell idrogel non aderente con 500 nM LPA (pally medium). Barra di scala: 200 μm. (C) Blastoidi umani formati su un array di microwell dopo 96 h. Barre di scala: 400 μm. (D) Quantificazione della percentuale di micro pozzetti contenenti un blastoide umano indotto dalla condizione di coltura PALLY con concentrazione di LPA ottimizzata da diverse linee hPSC naïve (n = 3 array di microwell). (E) Colorazione immunofluorescenza di blastoidi umani con marcatori epiblasti (EPI) (giallo) NANOG e OCT4; i marcatori TE (ciano) CDX2 e GATA3; e il marcatore endoderma primitivo (magenta) SOX17 e GATA4. Barra di scala: 100 μm. (H-I) Quantificazione del numero di cellule (a sinistra) e della percentuale di cellule (a destra) appartenenti a ciascun lignaggio in blastoide (96 h) in base alla colorazione di immunofluorescenza di OCT4, GATA3 e GATA4. (G) Colorazione immunofluorescenza di blastoidi umani per CDX2 (ciano) e NR2F2 (magenta). (F) Immagini a contrasto di fase di trofosfere in fase iniziale e avanzata su array di microwell indotte dall'aggiunta di 3 μM SC144 (H) o 2 μM XMU-MP-1 (I), rispettivamente. (J) Immagini a contrasto di fase che mostrano il cambiamento morfologico di aggregati di hPSC naïve coltivati in una piastra a 96 pozzetti di attacco ultra-basso con LPA (pally medium) da 500 nM. (K) Immagine a contrasto di fase (a sinistra) e colorazione immunofluorescenza (a destra) per OCT4 (giallo), GATA3 (ciano) e GATA4 (magenta) in blastoidi coltivati in condizioni di coltura post-impianto per 6 giorni. Barra di scala: 100 μm. Questa cifra è adattata da 6,10. Fare clic qui per visualizzare una versione più grande di questa figura.
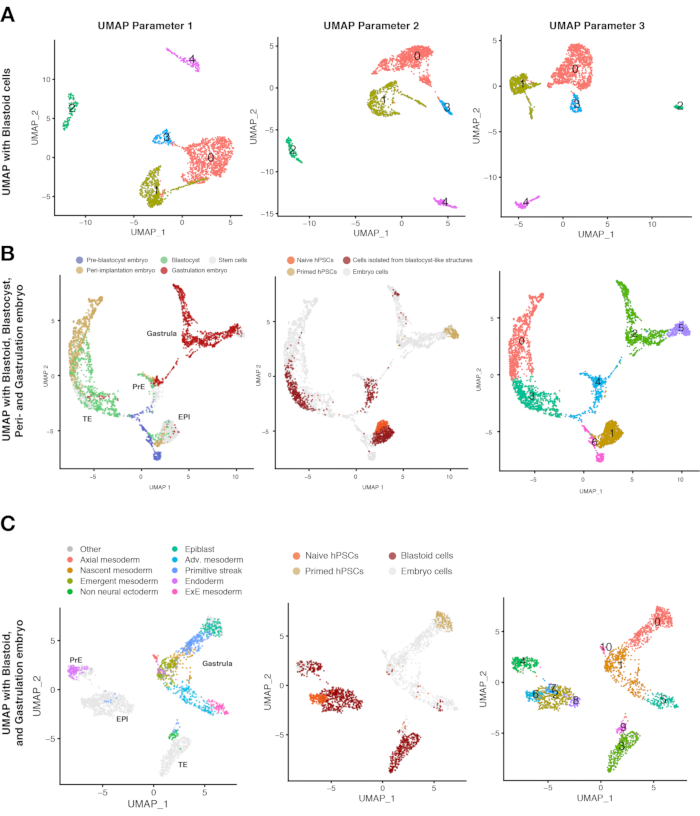
Figura 3: Caratterizzazione della composizione dei blastoidi mediante sequenziamento a singola cellula. (A) Analisi di clustering non supervisionata con parametri diversi su UMAP del trascrittoma di singole cellule derivate dai diversi punti temporali di blastoide (24 h, 60 h, 96 h), hPSC naïve, hPSC innescate e hTSC (rappresentano il citotrofoblasto post-impianto). (B) UMAP del trascrittoma di cellule derivate da blastoidi (96 h), hPSC naïve e hPSC innescate integrate con set di dati pubblicati da embrioni umani di stadi preimpianto, perimpianto (blastocisti in coltura in vitro ) e gastrulazione (stadio Carnegie 7, cioè tra E16-19). Le singole cellule sono colorate in base alla loro origine in embrioni umani (a sinistra), cellule derivate da blastoidi o cellule staminali (al centro) e al risultato di un'analisi di clustering non supervisionata (a destra). (C) UMP del trascrittoma di cellule derivate da blastoidi, hPSC naïve, hPSC innescate e integrate con set di dati pubblicati dall'embrione di stadio di gastrulazione (stadio Carnegie 7, cioè tra E16-19). Le singole cellule sono colorate in base alla loro origine in embrioni umani (a sinistra), cellule derivate da blastoidi o cellule staminali (al centro) e al risultato di un'analisi di clustering non supervisionata (a destra). Questa cifra è adattata da6. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella supplementare 1: Tutta la composizione dei media utilizzata in questo studio. Fare clic qui per scaricare questa tabella.
Discussione
Nel presente studio, mostriamo, passo dopo passo, come stabilire blastoidi umani ad alta efficienza utilizzando un protocollo semplice e robusto. Dopo l'aggregazione di hPSC PXGL naïve e la loro tripla inibizione, i blastoidi si formano in modo efficiente (> 70%) e generano sequenzialmente i 3 analoghi della blastocisti entro 4 giorni. Limitazioni nell'efficienza e nella qualità dei blastoidi (ad esempio, presenza di cellule fuori bersaglio) possono verificarsi se lo stato iniziale è sub-ottimale. Da notare, abbiamo misurato che le hPSC PXGL contengono circa il 5% delle cellule che riflettono le fasi post-impianto. Queste cellule potrebbero limitare la formazione di blastoidi di alta qualità. Oltre allo stato iniziale ingenuo di PXGL che riflette l'epiblasto di blastocisti, un altro fattore cardine è il mezzo utilizzato per la formazione di blastoidi. Al fine di formare rapidamente cellule simili alla blastocisti e prevenire la formazione di cellule fuori bersaglio, simili al post-impianto, proponiamo che l'inibizione delle triple vie (Hippo, ERK, TGF-β) sia essenziale. Mentre diverse linee cellulari danno diverse rese di blastoide su ERK / TGF-β inibizione (generalmente intorno al 10% -20%), l'esposizione a LPA provoca la formazione di una resa blastoide altrettanto elevata su tutte le linee cellulari, utilizzando rigorosi criteri di specifica morfometrica e di lignaggio. LPA agisce probabilmente sull'inibizione della via hippo, che svolge un ruolo critico nella prima segregazione del lignaggio tra i lignaggi epiblasto e trofoectoderma nel topo e nell'uomo 8,51. Il significativo miglioramento dell'efficienza del blastoide da parte dell'LPA suggerisce che i meccanismi di specificazione delle cellule interne-esterne mediate dalla via hippo in gioco nella blastocisti sono cooptati durante la formazione dei blastoidi. Un limite attuale risiede nel fatto che, a causa di una sub-ottimalità dei protocolli utilizzati per la coltura di blastocisti o blastoidi umani al giorno 7-13 equivalente al tempo (dopo la formazione di blastocisti/blastoidi), non siamo in grado di valutare in che misura possiamo modellare correttamente lo sviluppo post-impianto.
L'analisi dello stato trascrittomico delle cellule blastoidi può essere facilmente ottenuta utilizzando scRNAseq, mappe di riferimento adeguate e metodi bioinformatici. In precedenza, l'analisi trascrittomica ha mostrato che le hPSC coltivate in PXGL sono più simili all'epiblasto di blastocisti rispetto allo stato innescato. Limitazioni nell'analisi dei dati possono verificarsi se la mappa di riferimento comprende solo cellule allo stadio di blastocisti. La mappa di riferimento dovrebbe includere cellule provenienti da embrioni post-impianto al fine di valutare la presenza di potenziali cellule fuori bersaglio. In futuro, al fine di confrontare le cellule blastoidi, una mappa di riferimento che includa tutti i tessuti del conceptus umano pre e post-impianto sarebbe estremamente preziosa. Inoltre, le mappe di riferimento multi-omiche a singola cellula, ad esempio includendo il trascrittoma, l'accessibilità alla cromatina e la metilazione del DNA, aiuterebbero ulteriormente. Infine, i metodi bioinformatici standardizzati per valutare quantitativamente le somiglianze tra le cellule dei modelli embrionali e i concetti di riferimento e per identificare positivamente le cellule fuori bersaglio aiuterebbero ulteriormente ad analizzare e confrontare in modo imparziale i risultati.
Complessivamente, i blastoidi formati dalla tripla inibizione delle vie Hippo, TGF-β ed ERK possiedono le quattro caratteristiche di 1) morfogenesi altamente efficiente, 2) sequenza corretta di specifiche di lignaggio, 3) elevata purezza di cellule simili a blastocisti a livello di trascrittoma, 4) capacità di modellare lo sviluppo del perimpianto. Queste caratteristiche dei blastoidi faciliteranno la costruzione di ipotesi sullo sviluppo e l'impianto di blastocisti, tuttavia, non ricapitolano le fasi precedenti dello sviluppo embrionale. In contrasto con la limitata accessibilità e versatilità della blastocisti umana, i blastoidi sono suscettibili di screening genetici e farmacologici per le indagini funzionali dello sviluppo e dell'impianto di blastocisti. In futuro, tali conoscenze di base potrebbero contribuire a migliorare la formulazione dei mezzi di fecondazione in vitro, lo sviluppo di contraccettivi post-fecondazione e una migliore gestione della gravidanza precoce.
Divulgazioni
L'Istituto per le biotecnologie molecolari, Accademia austriaca delle scienze ha depositato una domanda di brevetto EP21151455.9 che descrive i protocolli per la formazione di blastoidi umani e il test di interazione blastoide-endometrio. HK, AJ, HHK e NR sono gli inventori di questo brevetto. Tutti gli altri autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo progetto ha ricevuto finanziamenti dal Consiglio europeo della ricerca (CER) nell'ambito del programma di ricerca e innovazione Horizon 2020 dell'Unione europea (accordo di sovvenzione ERC-Co n. 101002317 "BLASTOID: una piattaforma di scoperta per l'embriogenesi umana precoce"). H.H.K. è sostenuto dall'Austrian Science Fund (FWF), Lise Meitner Programme M3131-B. Ringraziamo Yasuhiro Takashima per aver condiviso le linee cellulari H9 e H9-GFP e Austin Smith, Peter Andrews e Ge Guo per aver condiviso le linee cellulari HNES1, Shef6, niPSC 16.2b e cR-NCRM2. Ringraziamo Hossein Baharvand per aver condiviso gli organoidi endometriali. Ringraziamo Joshua M. Brickman per aver condiviso l'RNA isolato dalle cellule differenziate PrE e dalle cellule nEND. Ringraziamo Shankar Srinivas per aver condiviso i dati di sequenziamento dell'RNA unicellulare dell'embrione di peri-gastrulazione. Ringraziamo Aleksand Bykov e Luisa Cochella per l'assistenza tecnica per la preparazione della biblioteca SMARTSeq2. Ringraziamo la struttura NGS, Biooptic e Stem Cell dell'IMBA per l'assistenza critica.
Materiali
| Name | Company | Catalog Number | Comments |
| Neurobasal media | in house | ||
| DMEM/F12 | in house | ||
| 100X N2 supplemen | Gibco | 17502048 | |
| 50X B27 supplement | Gibco | 17504044 | |
| 100X Glutamax | Gibco | 35050038 | |
| 100 mM Sodium Pyruvate | Gibco | 11360039 | |
| MEM-Non-essential amino acids | Gibco | 11140050 | |
| 1 M Hepes | in house | ||
| 50 mM 2-Mercaptoethanol | Thermofisher | 31350010 | |
| 100X Penicillin-Streptomycin | Sigma-Aldrich | P0781 | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A7979 | |
| PD0325901 | Medchem express | HY-10254 | |
| XAV-939 | Medchem express | HY-15147 | |
| Gö 6983 | Medchem express | HY-13689 | |
| Human recombinant Leukemia Inhibitory Factor | in house | ||
| A83-01 | Medchem express | HY-10432 | |
| 1-Oleoyl Lysophosphatidic acid (LPA) | Peprotech | 2256236 | |
| Y-27632 | Medchem express | HY-10583 | |
| CMRL medium | Gibco | 21530027 | |
| Fetal Bovine Serum (FBS) | Sigma-Aldrich | F7524 | |
| KnockOut Serum Replacement (KSR) | Thermofisher | 10-828-028 | |
| Accutase | Biozym | B423201 | cell detachment solution |
| Geltrex | Thermofisher | A1413302 | growth factor basement membrane extract |
| TROP2 antibody | R&D systems | MAB650 | |
| PDGFRα antibody | R&D systems | AF307 | |
| SC-144 | Axon | 2324 | |
| XMU-MP-1 | Med Chem Express | HY-100526 | |
| Matrigel | basement membrane matrix | ||
| Countess cell counting chamber slides | Thermo fisher | cell counting slides | |
| DAPI Staining Solution | Miltenyi Biotec | 130-111-570 |
Riferimenti
- Rivron, N., et al. Debate ethics of embryo models from stem cells. Nature. 564 (7735), 183-185 (2018).
- Hyun, I., Munsie, M., Pera, M. F., Rivron, N. C., Rossant, J. Toward Guidelines for Research on Human Embryo Models Formed from Stem Cells. Stem Cell Reports. 14 (2), 169-174 (2020).
- Clark, A. T., et al. Human embryo research, stem cell-derived embryo models and in vitro gametogenesis: Considerations leading to the revised ISSCR guidelines. Stem Cell Reports. 16 (6), 1416-1424 (2021).
- Lovell-Badge, R., et al. ISSCR Guidelines for Stem Cell Research and Clinical Translation: The 2021 update. Stem Cell Reports. 16 (6), 1398-1408 (2021).
- Rivron, N. C., et al. Blastocyst-like structures generated solely from stem cells. Nature. 557 (7703), 106-111 (2018).
- Kagawa, H., et al. Human blastoids model blastocyst development and implantation. Nature. , 04267-04268 (2021).
- Meistermann, D., et al. Integrated pseudotime analysis of human pre-implantation embryo single-cell transcriptomes reveals the dynamics of lineage specification. Cell Stem Cell. 28 (9), 1625-1640 (2021).
- Gerri, C., et al. Initiation of a conserved trophectoderm program in human, cow and mouse embryos. Nature. 587 (7834), 443-447 (2020).
- Gerri, C., Menchero, S., Mahadevaiah, S. K., Turner, J. M. A., Niakan, K. K. Human Embryogenesis: A Comparative Perspective. Annual Review of Cell and Developmental Biology. 36, 411-440 (2020).
- Zhao, C., et al. Reprogrammed iBlastoids contain amnion-like cells but not trophectoderm. bioRxiv. , 2021.05.07.442980 (2021).
- Zijlmans, D. W. Integrated multi-omics reveal polycomb repressive complex 2 restricts human trophoblast induction. Nat. Cell Biol. 24, 858-871 (2022).
- Nichols, J., Smith, A. Naive and primed pluripotent states. Cell Stem Cell. 4 (6), 487-492 (2009).
- Guo, G., et al. Epigenetic resetting of human pluripotency. Development. 144 (15), 2748-2763 (2017).
- Takashima, Y., et al. Resetting transcription factor control circuitry toward ground-state pluripotency in human. Cell. 158 (6), 1254-1269 (2014).
- Thomson, J. A. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Yang, Y., et al. Derivation of Pluripotent Stem Cells with In Vivo Embryonic and Extraembryonic Potency. Cell. 169 (2), 243-257 (2017).
- Stirparo, G. G., et al. Integrated analysis of single-cell embryo data yields a unified transcriptome signature for the human pre-implantation epiblast. Development. 145 (3), 158501 (2018).
- Castel, G., et al. Induction of Human Trophoblast Stem Cells from Somatic Cells and Pluripotent Stem Cells. Cell Reports. 33 (8), 108419 (2020).
- Posfai, E., et al. Evaluating totipotency using criteria of increasing stringency. Nature Cell Biology. 23 (1), 49-60 (2021).
- Nakamura, T., et al. A developmental coordinate of pluripotency among mice, monkeys and humans. Nature. 537 (7618), 57-62 (2016).
- Theunissen, T. W., et al. Molecular Criteria for Defining the Naive Human Pluripotent State. Cell Stem Cell. 19 (4), 502-515 (2016).
- Guo, G., et al. Naive Pluripotent Stem Cells Derived Directly from Isolated Cells of the Human Inner Cell Mass. Stem Cell Reports. 6 (4), 437-446 (2016).
- Rossant, J. Genetic Control of Early Cell Lineages in the Mammalian Embryo. Annual Review of Genetics. 52, 185-201 (2018).
- De Paepe, C., et al. Human trophectoderm cells are not yet committed. Human reproduction. 28 (3), 740-749 (2013).
- Amita, M., et al. Complete and unidirectional conversion of human embryonic stem cells to trophoblast by BMP4. Proceedings of the National Academy of Sciences of the United States of America. 110 (13), 1212-1221 (2013).
- Io, S., et al. Capturing human trophoblast development with naive pluripotent stem cells in vitro. Cell Stem Cell. 28 (6), 1023-1039 (2021).
- Guo, G., et al. Human naive epiblast cells possess unrestricted lineage potential. Cell Stem Cell. 28 (6), 1040-1056 (2021).
- Liu, X., et al. Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature. 591 (7851), 627-632 (2021).
- Hirate, Y., et al. Polarity-dependent distribution of angiomotin localizes Hippo signaling in preimplantation embryos. Current biology: CB. 23 (13), 1181-1194 (2013).
- Cockburn, K., Biechele, S., Garner, J., Rossant, J. The Hippo pathway member Nf2 is required for inner cell mass specification. Current Biology: CB. 23 (13), 1195-1201 (2013).
- Xu, R. H., et al. BMP4 initiates human embryonic stem cell differentiation to trophoblast. Nature Biotechnology. 20 (12), 1261-1264 (2002).
- Krendl, C., et al. GATA2/3-TFAP2A/C transcription factor network couples human pluripotent stem cell differentiation to trophectoderm with repression of pluripotency. Proceedings of the National Academy of Sciences of the United States of America. 114 (45), 9579-9588 (2017).
- Xu, R. H., et al. Basic FGF and suppression of BMP signaling sustain undifferentiated proliferation of human ES cells. Nature Methods. 2 (3), 185-190 (2005).
- Horii, M., Bui, T., Touma, O., Cho, H. Y., Parast, M. M. An Improved Two-Step Protocol for Trophoblast Differentiation of Human Pluripotent Stem Cells. Current Protocols in Stem Cell Biology. 50 (1), 96 (2019).
- Okae, H., et al. Derivation of Human Trophoblast Stem Cells. Cell Stem Cell. 22 (1), 50-63 (2018).
- Yamanaka, Y., Lanner, F., Rossant, J. FGF signal-dependent segregation of primitive endoderm and epiblast in the mouse blastocyst. Development. 137 (5), 715-724 (2010).
- Kuijk, E. W., et al. The roles of FGF and MAP kinase signaling in the segregation of the epiblast and hypoblast cell lineages in bovine and human embryos. Development. 139 (5), 871-882 (2012).
- Roode, M., et al. Human hypoblast formation is not dependent on FGF signalling. Developmental Biology. 361 (2), 358-363 (2012).
- Linneberg-Agerholm, M., et al. Naïve human pluripotent stem cells respond to Wnt, Nodal and LIF signalling to produce expandable naïve extra-embryonic endoderm. Development. 146 (24), (2019).
- Yu, L., et al. Blastocyst-like structures generated from human pluripotent stem cells. Nature. 591 (7851), 620-626 (2021).
- Yanagida, A., et al. Naive stem cell blastocyst model captures human embryo lineage segregation. Cell Stem Cell. 28 (6), 1016-1022 (2021).
- Zappia, L., Oshlack, A. Clustering trees: a visualization for evaluating clusterings at multiple resolutions. GigaScience. 7 (7), (2018).
- Subramanian, A., et al. Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide expression profiles. Proceedings of the National Academy of Sciences of the United States of America. 102 (43), 15545-15550 (2005).
- Messmer, T., et al. Transcriptional Heterogeneity in Naive and Primed Human Pluripotent Stem Cells at Single-Cell Resolution. Cell Reports. 26 (4), 815-824 (2019).
- Zhou, F., et al. Reconstituting the transcriptome and DNA methylome landscapes of human implantation. Nature. 572 (7771), 660-664 (2019).
- Petropoulos, S., et al. Single-Cell RNA-Seq Reveals Lineage and X Chromosome Dynamics in Human Preimplantation Embryos. Cell. 167 (1), 285 (2016).
- Tyser, R. C. V., et al. A spatially resolved single cell atlas of human gastrulation. bioRxiv. , (2020).
- Turco, M. Y., et al. hormone-responsive organoid cultures of human endometrium in a chemically defined medium. Nature Cell Biology. 19 (5), 568-577 (2017).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development. 144 (10), 1775-1786 (2017).
- Ma, H., et al. In vitro culture of cynomolgus monkey embryos beyond early gastrulation. Science. 366 (6467), (2019).
- Nishioka, N., et al. The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass. Developmental Cell. 16 (3), 398-410 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon