Method Article
In vivo Funzione di sottogruppi differenziali di cellule dendritiche cutanee nell'induzione dell'immunità Th17 nell'infezione intradermica da Candida albicans
In questo articolo
Riepilogo
Qui, dimostriamo la funzione in vivo di sottogruppi di cellule dendritiche cutanee nell'immunità Th17 dell'infezione dermica profonda da Candida albicans .
Abstract
La pelle è l'organo barriera più esterno del corpo, che contiene diversi tipi di cellule dendritiche (DC), un gruppo di cellule professionali che presentano l'antigene. Quando la pelle incontra agenti patogeni invasori, diverse DC cutanee avviano una risposta immunitaria distinta delle cellule T per proteggere il corpo. Tra i patogeni invasori, l'infezione fungina guida specificamente una risposta immunitaria protettiva Th17 che produce interleuchina-17. È stato sviluppato un protocollo per differenziare in modo efficiente le cellule Th17 mediante infezione intradermica da Candida albicans per studiare un sottogruppo di DC cutanee responsabili dell'induzione dell'immunità Th17. La citometria a flusso e le analisi di espressione genica hanno rivelato un'importante induzione della risposta immunitaria Th17 nei linfonodi drenanti e nella pelle infetta. Utilizzando ceppi murini depletivi del sottoinsieme DC indotti dalla tossina difterica, le DC dermiche CD301b+ sono risultate responsabili del montaggio della differenziazione ottimale di Th17 in questo modello. Pertanto, questo protocollo fornisce un metodo prezioso per studiare la funzione in vivo di sottogruppi differenziali di DC cutanee per determinare l'immunità Th17 contro l'infezione fungina cutanea profonda.
Introduzione
La pelle è l'organo barriera più esterno, che protegge il corpo dall'invasione di agenti patogeni e stimoli esterni1. La pelle è composta da due strati distinti, tra cui l'epidermide, un epitelio stratificato di cheratinociti, e il derma sottostante, una fitta rete di collagene e altri componenti strutturali. Come tessuto di barriera epiteliale primario, la pelle fornisce principalmente barriere fisiche e contribuisce a ulteriori barriere immunologiche in quanto contiene numerose cellule immunitarie residenti 2,3. Tra le cellule immunitarie cutanee, le cellule dendritiche (DC) sono un tipo di cellule professionali presentanti l'antigene, che assorbono attivamente antigeni self e non-self e migrano verso i linfonodi regionali (LN) per avviare le risposte e la tolleranza delle cellule T antigene-specifiche in base alla natura degli antigeni4.
La pelle ospita cellule presentanti l'antigene epidermico, vale a dire le cellule di Langerhans (LC) e almeno due tipi di DC, tra cui le DC convenzionali dermiche di tipo 1 (cDC1) e le DC convenzionali dermiche di tipo 2 (cDC2)5. Le LC epidermiche sono di origine monocitica embrionale e mantengono il loro numero di cellule autoperpetuandosi in condizioni omeostatiche6. Al contrario, le cellule staminali dermiche cDC1 e cDC2 sono di origine ematopoietica e vengono continuamente rifornite dai progenitori DC5. Le DC cutanee sono caratterizzate dai loro marcatori di superficie, approssimativamente divisi in popolazioni di Langerin+ (inclusi LC e cDC1) e CD11b+Langerin- (principalmente cDC2). Inoltre, questo gruppo ha rivelato che la popolazione CD11b+Langerin-DC è ulteriormente classificata in due sottogruppi in base all'espressione7 di CD301b.
Le importanti caratteristiche funzionali delle DC cutanee sono incentrate su una divisione del lavoro, determinata principalmente dalla natura intrinseca di ciascun sottogruppo di DC, dalle posizioni in situ delle DC, dal microambiente tissutale e dai segnali infiammatori locali8. Queste caratteristiche funzionali delle DC cutanee richiedono lo studio del ruolo di specifici sottogruppi di DC durante alcuni tipi di risposta immunitaria della pelle. Dopo stimolazione antigenica da parte di DC cutanee nei LN drenanti, le cellule T CD4+ naive si differenziano in sottogruppi specifici di cellule T helper, che producono un insieme di citochine definite per esercitare la loro funzione effettrice9. Tra i sottogruppi di cellule T helper CD4+, le cellule Th17 produttrici di interleuchina-17 (IL-17) svolgono un ruolo cruciale nelle malattie autoimmuni e nell'immunità antifungina10. A questo proposito, l'infezione fungina cutanea è stata un modello robusto per studiare l'immunità Th17 in vivo 11,12,13. Quando le pelli strippate con nastro adesivo sono esposte per via epicutanea al lievito Candida albicans (C. albicans), le LC epidermiche svolgono un ruolo fondamentale nel guidare la differenziazione Th17 antigene-specifica14.
L'immunità protettiva contro l'infezione intradermica da C. albicans richiede un'immunità innata come l'attività fibrinolitica dei fibroblasti e dei fagociti15. Tuttavia, poco si sa sul ruolo dei sottogruppi cutanei di DC nello stabilire l'immunità Th17 nell'infezione cutanea profonda da C. albicans. Questo articolo descrive un metodo di infezione cutanea intradermica di C. albicans, che produce risposte immunitarie Th17 locali e regionali. L'applicazione di ceppi murini di deplezione del sottogruppo di DC indotta dalla tossina difterica (DT) ha rivelato che le DC dermiche CD301b+ sono cruciali per l'immunità Th17 in questo modello. L'approccio qui descritto consente lo studio della risposta Th17 all'infezione fungina invasiva profonda del derma.
Protocollo
NOTA: Tutti gli esperimenti sugli animali sono stati approvati dall'Institution Animal Care and Use Committee (IACUC, Approval ID: 2019-0056, 2019-0055). Per questo studio sono stati utilizzati topi femmina C57BL/6 wild-type (WT) di età compresa tra 7 e 9 settimane del peso di 18-24 g. Alcuni studi sono stati condotti utilizzando topi femmina del recettore della tossina Langerin-difterite (DTR) e CD301b-DTR della stessa età e peso. In ogni gruppo sono stati utilizzati da quattro a sei topi per un esperimento e i dati sono rappresentativi di tre esperimenti indipendenti. Questo lavoro è stato condotto in condizioni di Biosicurezza di Livello 3, che potrebbero essere eseguite anche in condizioni di Biosicurezza di Livello 2 secondo le linee guida istituzionali (temperatura ambiente 23 °C ± 3 °C, umidità 50% ± 10%).
1. Preparazione della Candida albicans
NOTA: Gli esperimenti in questa sezione sono stati eseguiti in una cabina di sicurezza biologica.
- Streak C. albicans ceppare SC5314 su una piastra di agar di lievito-peptone-destrosio-adenina (YPDA) utilizzando un anello di inoculazione e un ago.
- Incubare la piastra capovolta per 2 giorni a 30 °C.
NOTA: La piastra di agar YPDA con C. albicans può essere conservata a 4 °C per un massimo di 1 mese. - Isolare una singola colonia dalla piastra per l'inoculazione in 10 mL di terreno YPDA in una provetta da 50 mL utilizzando un puntale per pipetta sterile.
- Incubare a 30 °C agitando a 230-250 giri/min per ~17 ore.
- Mettere la sospensione di lievito in una cuvetta e misurare la densità ottica (OD) a 600 nm ogni 30 minuti utilizzando uno spettrofotometro UV-VIS fino a quando l'OD600 raggiunge 1,5-2,0.
NOTA: Questo passaggio può richiedere 16-18 ore. - Centrifugare la sospensione di lievito a 1000 × g per 5 min.
- Scartare il surnatante e risospendere le cellule di lievito in una quantità appropriata di soluzione salina sterile tamponata con fosfato (PBS).
- Contare le cellule di C. albicans utilizzando un emocitometro e centrifugare la sospensione a 1000 × g per 5 minuti.
- Scartare il surnatante e risospendere le cellule di C. albicans in PBS a una concentrazione di 1 × 107 cellule in 40 μl di PBS per piede.
- Per la preparazione di C. albicans (HK) ucciso termicamente, uccidere le cellule di lievito riscaldandole a 65 °C per 60 minuti utilizzando un miscelatore riscaldante dopo aver determinato il numero di cellule.
2. Infezione del piede del mouse con C. albicans
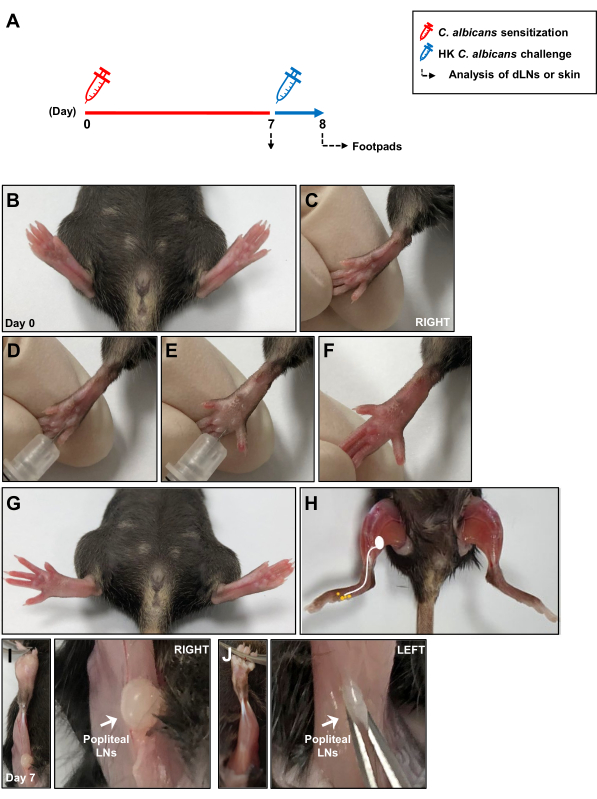
Figura 1: Diagramma schematico del modello di infezione intradermica da Candida albicans . (A) I cuscinetti posteriori dei topi sono stati iniettati per via intradermica con 1 × 107 C. albicans. Dopo 7 giorni, i cuscinetti plantari dei topi sono stati riesposti a 1 × 107 HK C. albicans mediante iniezione intradermica e la risposta di ipersensibilità di tipo ritardato è stata misurata 24 ore dopo la provocazione dell'antigene. La risposta immunitaria locale durante la sensibilizzazione di C. albicans è stata analizzata dopo 7 giorni in LN drenanti per la pelle. (B, C) Immagini dei cuscinetti dei piedi prima dell'iniezione intradermica del cuscinetto del piede con C. albicans. (D, E) Iniezione di C. albicans nel derma profondo del cuscinetto del piede destro. (F, G) Segni clinici di arrossamento e gonfiore in seguito all'iniezione del cuscinetto del piede destro. (H) Uno schizzo che mostri le vie linfatiche dal cuscinetto plantare ai LN poplitei dopo l'iniezione di C. albicans . (I) LN poplitei esposti situati dietro il ginocchio 7 giorni dopo l'iniezione di C. albicans e (J) senza iniezione. Abbreviazioni: HK = ucciso a caldo; LN = linfonodi. Clicca qui per visualizzare una versione più grande di questa figura.
- Anestetizzare i topi con isoflurano in una camera di induzione fino a quando i topi non hanno una frequenza respiratoria lenta e non mostrano risposte di ritiro ai pizzicamenti delle dita dei piedi o della coda.
NOTA: Durante l'anestesia, si consiglia un unguento per gli occhi per prevenire la secchezza oculare, soprattutto per un'anestesia che dura più di 5 minuti. - Rimuovere il tappo da un ago da 31 G e caricare la siringa da insulina da 0,3 mL con il C. albicans preparato dal passaggio 1.9 dopo aver mescolato le cellule.
- Rimuovere il topo anestetizzato dalla camera di induzione e iniettare delicatamente 40 μl di cellule di lievito (1 × 107 cellule) nel derma profondo del cuscinetto destro per la sensibilizzazione di C. albicans .
NOTA: Il volume massimo che può essere iniettato in un footpad è di 50 μl. - Estrarre lentamente l'ago della siringa dal sito di iniezione.
- Metti ogni topo da solo in una gabbia fino a quando non si è completamente ripreso dall'anestesia e poi rimettilo in sicurezza nella gabbia di casa.
- Per sviluppare una risposta antigene-specifica a C. albicans , sfidare il piede destro dei topi con l'HK C. albicans preparato tramite iniezione intradermica 7 giorni dopo la sensibilizzazione, come descritto in precedenza (1 × 107 cellule; 40 μL per piede; ripetere i passaggi 2.1-2.5).
- Raccogliere LN drenanti per la pelle 7 giorni dopo la sensibilizzazione di C. albicans o tessuti del piede lesionato 24 ore dopo la provocazione dell'antigene dopo eutanasia in una camera di CO2 .
3. Deplezione delle cellule dendritiche indotta dalla tossina difterica in vivo
NOTA: In questo studio, sia i topi Langerin-DTR che CD301b-DTR sono stati trattati con DT 1 giorno prima e dopo la sensibilizzazione intradermica a C. albicans.
- Preparare una soluzione da 10 μg/mL di DT in PBS.
- Rimuovere il tappo dall'ago di una siringa da insulina da 1 mL, miscelare il DT e riempire la siringa con il DT.
- Trattenere correttamente i topi in posizione a testa in giù.
- Disinfettare il lato ventrale dei topi con etanolo al 70%.
- Iniettare lentamente ogni topo con 100 μL di 1 μg di DT per via intraperitoneale nel quadrante inferiore sinistro dell'addome per esaurire specifici sottogruppi di cellule dendritiche.
NOTA: Fare attenzione a non danneggiare gli organi durante l'iniezione. - Attendere 5 s; Quindi, rimuovere lentamente l'ago.
4. Reazione quantitativa a catena della polimerasi in tempo reale
- Posizionare il mouse in una camera di CO2 fino a quando non si osserva alcun movimento respiratorio.
- Disinfettare il topo con etanolo al 70% e tagliare la lesione dalla pelle del piede posteriore in piccoli pezzi usando una pinza e delle forbici.
- Immergere completamente i tessuti affettati nel reagente di isolamento dell'RNA.
- Omogeneizzare i campioni utilizzando un omogeneizzatore tissutale secondo le istruzioni del produttore (2 cicli di 3 minuti a 30 Hz).
NOTA: In questo studio sono state utilizzate perle di acciaio inossidabile per la lisi dei tessuti. - Centrifugare a 10.000 × g per 5 min, 4 °C.
- Trasferire con cura il surnatante in un tubo nuovo.
- Isolare l'RNA totale dalla cute lesionata utilizzando un kit di isolamento dell'RNA totale.
- Determinare la concentrazione di RNA utilizzando uno spettrofotometro UV-Vis.
- Sintetizzare il cDNA utilizzando un kit di trascrizione inversa per la reazione a catena della polimerasi quantitativa in tempo reale (qPCR).
- Esegui la qPCR in tempo reale con il sistema PCR in tempo reale monitorando la sintesi del DNA a doppio filamento durante i cicli di PCR utilizzando un colorante fluorescente verde.
NOTA: In questo studio, i risultati sono stati normalizzati al livello di ipoxantina-guanina fosforibosiltransferasi (Hprt). Le sequenze di primer sono elencate nella Tabella 1 e il protocollo PCR è il seguente: denaturazione iniziale a 95 °C per 30 s, amplificazione per 42 cicli (95 °C per 5 s, 60 °C per 30 s).
5. Isolamento cellulare e analisi citofluorimetrica
- Dopo l'eutanasia con CO2 , sezionare i topi usando pinze e forbici, esponendo e raccogliendo con cura i LN drenanti per i piedi chiamati LN poplitei, situati dietro il ginocchio.
- Preparare sospensioni unicellulari dai LN drenanti per le zampe di ciascun topo filtrando i tessuti attraverso un colino da 70 μm dopo l'omogeneizzazione utilizzando lo stantuffo di una siringa da 3 mL.
- Lavare le celle con PBS e centrifugare a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e lavare nuovamente le cellule con PBS.
- Centrifugare a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e risospendere le cellule in un terreno RPMI-10 completo contenente 55 μM di β-mercaptoetanolo, 50 ng/mL di forbolo 12-miristato 13-acetato (PMA) e 500 ng/mL di ionomicina in una piastra a 24 pozzetti per la stimolazione delle cellule T.
- Dopo 1 ora, aggiungere 10 μg/mL di brefeldina A e 1000x monensin alla sospensione cellulare e alla coltura per altre 5 ore.
- Raccogliere le cellule e lavarle con un tampone di selezione cellulare attivato dalla fluorescenza (FACS).
- Centrifugare a 500 × g per 5 minuti a 4 °C ed eliminare il surnatante.
- Colorare le cellule morte con un colorante fissabile per la colorazione delle cellule morte e incubare per 30 minuti a 4 °C.
- Lavare i campioni con tampone FACS e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e colorare le cellule con anticorpi marcatori di superficie coniugati con fluorocromo e bloccante del recettore Fc per 30 minuti a 4 °C.
- Lavare i campioni con tampone FACS e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e risospendere le cellule pellettate in soluzione di fissazione e permeabilizzazione per 15-20 minuti a 4 °C per la colorazione intracellulare.
- Lavare i campioni con 1 tampone di lavaggio e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Eliminare il surnatante ed eseguire la colorazione intracellulare con citochine per 30 minuti a 4 °C.
- Lavare i campioni con 1 tampone di lavaggio e centrifugare a 500 x g per 5 minuti a 4 °C.
- Risospendere le cellule nel volume appropriato (200-300 μL) di tampone FACS.
- Analizza l'espressione proteica utilizzando la citometria a flusso.
Risultati
Qui, abbiamo dimostrato un modello di infezione intradermica di C. albicans per studiare il ruolo della risposta immunitaria cutanea Th17 mediata da DC in vivo. Dopo un'iniezione intradermica iniziale di C. albicans nel cuscinetto plantare, i LN drenanti per la pelle sono stati ingranditi (Figura 2A). Durante il periodo di sensibilizzazione, il rapporto tra le cellule T effettrici CD4+ e CD8+ è stato notevolmente aumentato (Figura 2B, C). Inoltre, le cellule T effettrici CD4+ producevano abbondantemente IL-17A rispetto alle cellule T effettrici CD8+ (Figura 2D, E). Questi risultati hanno indicato che l'infezione intradermica da C. albicans guida potentemente l'immunità delle cellule T CD4+ produttrici di IL-17A.
L'espressione dell'interferone gamma (Ifnγ), Il4 e Il17a è stata osservata nella pelle del cuscinetto del piede con C. albicans (Figura 3). Sebbene la sensibilizzazione iniziale con C. albicans abbia portato ad un aumento dei livelli di Ifnγ e Il4 mRNA al giorno 7, non c'è stato alcun aumento di Il17a in questo momento. È importante sottolineare che i topi hanno mostrato un profondo aumento dell'espressione locale di Il17a 24 ore dopo la riesposizione a C. albicans . Tuttavia, la sfida con C. albicans non ha aumentato ulteriormente i livelli di mRNA di Ifnγ e Il4. Questi risultati hanno indicato che la riesposizione a C. albicans per via intradermica, descritta in questo protocollo, induce efficacemente una risposta antigene-specifica all'IL-17 nella pelle.
Le DC cutanee migrano e presentano antigeni nei LN drenanti dopo l'esposizione agli antigeni, avviando risposte immunitarie antigene-specifiche. Un sistema murino indotto da DT, depleto di sottoinsieme di DC, è stato utilizzato per determinare quali sottogruppi di DC sono responsabili dell'immunità Th17 a C. albicans. La deplezione delle DC di Langerin+ (LC e cDC1) ha portato a rapporti comparabili tra le cellule T CD4+ e CD8+ (Figura 4A-C) e la produzione di IL-17A dalle cellule T CD44+ effettrici CD4+ nei LN drenanti della pelle (Figura 4D, E). Nel frattempo, la deplezione di CD301b+ cDC2 ha attenuato significativamente l'espressione di IL-17A insieme a un relativo declino delle cellule T CD4+ (Figura 4A-E). Questi risultati dimostrano che le DC dermiche CD301b+ invocano una risposta immunitaria protettiva Th17 contro l'infezione cutanea profonda da C. albicans in vivo.

Figura 2: L'infezione intradermica da Candida albicans induce la differenziazione delle cellule Th17 nei LN drenanti della pelle. (A) Immagini rappresentative di LN drenanti la pelle in topi naïve (superiore) o sensibilizzati a C. albicans (inferiore) 7 giorni dopo l'iniezione intradermica nel cuscinetto plantare. (B) Strategie di gating per le cellule T effettrici dei LN drenanti della pelle al giorno 7 dopo l'infezione. (C) La proporzione tra la popolazione di cellule T effettrici CD4+ e CD8+ nei LN drenanti 7 giorni dopo la sensibilizzazione intradermica. (D) Grafici citofluorimetrici rappresentativi dell'espressione intracellulare di IL-17A da cellule T effettrici CD4+ o cellule T CD8+ in LN drenanti cutanei 7 giorni dopo l'infezione intradermica. (E) Il numero assoluto di cellule produttrici di IL-17A da cellule T effettrici CD4+ o CD8+ . I dati provengono da almeno due esperimenti indipendenti con quattro o sette topi per gruppo. Le barre di errore indicano la media ± l'errore standard della media. , p<0.001. Abbreviazioni: LNs= linfonodi; CD = cluster di differenziazione; IL = interleuchina; FSC = dispersione in avanti; SSC = dispersione laterale; A = zona di picco; H = altezza del picco; TCR = recettore delle cellule T; ns = non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
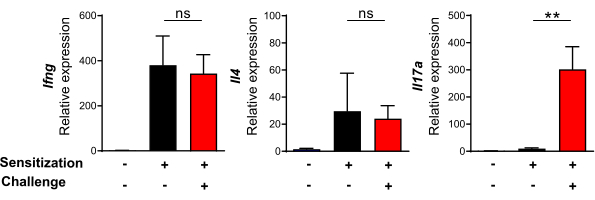
Figura 3: La pelle lesionata riesposta alla Candida albicans mostra tipicamente una risposta antigene-specifica all'IL-17. Analisi dell'espressione genica di Ifng, Il4 e Il17a nella pelle del cuscinetto plantare prima (7 giorni dopo la sensibilizzazione) e 24 ore dopo la provocazione di HK C. albicans tramite iniezione intradermica rispetto alla pelle naïve. I dati provengono da almeno due esperimenti indipendenti con quattro o cinque topi per gruppo. Le barre di errore indicano la media ± l'errore standard della media. **, pag<0,005. Abbreviazioni: HK = ucciso a caldo; IL = interleuchina; Ifng = gene dell'interferone gamma; ns = non significativo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Le DC dermiche CD301b+ guidano l'immunità Th17 contro l'infezione dermica profonda da Candida albicans. I LN drenanti cutanei di topi naive, WT, Langerin-DTR e CD301b-DTR con trattamento DT sono stati analizzati mediante citometria a flusso 7 giorni dopo l'infezione intradermica da C. albicans. (A) Convalida per la deplezione di specifici sottogruppi di DC nell'epidermide e nel derma di topi WT, Langerin-DTR e CD301b-DTR dopo il trattamento DT. (B) Strategie di gating per le cellule T CD4+ e CD8+ dei LN drenanti della pelle al giorno 7 dopo l'infezione. (C) I rapporti tra le cellule T CD4+ e CD8+ in ciascun gruppo sperimentale. (D) Grafici citometrici a flusso rappresentativi della produzione intracellulare di IL-17A da cellule T effettrici CD44+CD4+ in ciascun gruppo sperimentale. (E) Il numero assoluto di cellule Th17 produttrici di IL-17A in ciascun gruppo sperimentale. I dati provengono da almeno due esperimenti indipendenti con cinque o sei topi per gruppo. Le barre di errore indicano la media ± l'errore standard della media. **, pag<0,005; , p<0.001. Abbreviazioni: DC = cellule dendritiche; WT = wild-type; DTR = recettore della tossina difterica; DT = tossina difterica; CD = cluster di differenziazione; LN = linfonodi; IL = interleuchina; Th17 = T helper 17 cellule; ns = non significativo. Clicca qui per visualizzare una versione più grande di questa figura.
| Geni | Inoltrare | Inverso |
| Hprt | TCAGTCAACGGGGGACATAAA | GGGGCTGTACTGCTTAACCAG |
| Il4 | AGATCATCGGCATTTTGAACG | TTTGGCACATCCATCTCCG |
| IL17A | CAGCAGCGATCATCCCTCAAAG | CAGGACCAGGATCTCTTGCTG |
| Ifng | GATGCATTCATGAGTATTGCCAAGT | GTGGACCACTCGGATGAGCTC |
Tabella 1: Sequenze di primer.
Discussione
Questo articolo descrive un metodo di infezione intradermica da C. albicans che consente lo studio del ruolo delle DC cutanee nella risposta immunitaria Th17 in vivo. Applicando l'analisi citofluorimetrica multiparametrica con ceppi di topo indotti da DT, abbiamo scoperto che le DC dermiche CD301b+ sono un sottogruppo cruciale di DC cutanee per l'avvio dell'immunità Th17 contro l'infezione dermica profonda da C. albicans . Inoltre, i risultati hanno mostrato che la risposta delle cellule T produttrici di IL-17 è stata prodotta principalmente dalle cellule T CD4+ ma non dalle cellule T CD8+ , indicando che questo modello è un modello fedele dell'immunità Th17 in vivo.
Precedenti studi hanno dimostrato che l'infezione epicutanea da C. albicans ha portato all'immunità Th17 attraverso LC epidermici produttori di IL-614,16. Inoltre, una risposta Th17 all'infezione epicutanea da C. albicans è stata specificamente indotta dalla forma di lievito ma non dalla forma ifale di C. albicans, suggerendo che la morfologia di C. albicans è cruciale per l'immunità antifungina Th1716. Pertanto, questo protocollo utilizza anche la forma di lievito di C. albicans, che si trasformerebbe nella forma ifale in condizioni di nutrizione arricchita e a temperature più elevate17. Non è chiaro se un'iniezione intradermica di ife di C. albicans induca l'immunità Th17. Sebbene studi precedenti abbiano dimostrato il ruolo dell'immunità innata contro l'infezione intradermica da C. albicans che ha provocato un'elevata risposta immunitaria dell'interferone-γ, non hanno valutato la risposta IL-1715,18. Sarebbero necessari studi futuri per dimostrare le differenze nell'immunità Th17 tra le forme di infezione intradermica del lievito e ifali.
Il derma contiene tutti i sottogruppi di DC cutanee. A differenza dell'infezione epicutanea, questo protocollo mostra che le DC dermiche CD301b+ sono cruciali per indurre l'immunità Th17 contro l'infezione intradermica da C. albicans nei LN regionali. Rispetto all'infezione epicutanea di C. albicans, una via di somministrazione intradermica potrebbe bypassare l'esposizione persistente di C. albicans sulla superficie epidermica e il conseguente danno epidermico mediato dall'invasione di pseudoife di C. albicans 14. Ciò potrebbe indurre un minor grado di attivazione epidermica della LC, che richiede la produzione di IL-1β e il successivo fattore di necrosi tumorale-alfa derivato dai cheratinociti (TNF-α) per la loro migrazione verso i LN regionali19.
Inoltre, una localizzazione intradermica iniziale di C. albicans porterebbe a una forte attivazione e a un maggiore assorbimento da parte delle DC dermiche. Tra le DC dermiche, studi precedenti hanno dimostrato che CD11b+ cDC2 e CD301b+ cDC2 mediano una risposta immunitaria Th17 sia nell'intestino che nella pelle 7,20. I risultati qui riportati dimostrano il ruolo cruciale delle DC dermiche CD301b+ per il priming delle cellule Th17 nel modello di infezione intradermica da C. albicans. Pertanto, questo modello fornisce un importante protocollo sperimentale per studiare le caratteristiche immunologiche centrate su Th17 dell'infezione fungina cutanea profonda, che è più prevalente negli individui immunocompromessi21. L'uso di ceppi di topo immunodeficienti in questo protocollo farà luce sulla nuova immunopatogenesi dell'infezione fungina cutanea profonda.
Per un esperimento di successo per analizzare la risposta immunitaria Th17 all'infezione dermica profonda da C. albicans , gli utenti devono avere familiarità con la dissezione anatomica dei LN poplitei drenanti della pelle (Figura 1). Inoltre, gli utenti devono essere addestrati all'analisi citofluorimetrica multicolore delle cellule T nei LN. Per seguire questo protocollo è necessaria anche una conoscenza avanzata dell'immunologia cutanea. L'uso di questo metodo è quindi ideale per comprendere meglio i ruoli di ciascun sottogruppo di DC cutanee durante le infezioni cutanee fungine profonde.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questa ricerca è stata supportata dalla borsa di ricerca della Facoltà Samjung-Dalim del Yonsei University College of Medicine (6-2019-0125), da un programma di ricerca scientifica di base attraverso la National Research Foundation of Korea finanziato dal Ministero dell'Istruzione (2019R1A6A1A03032869) e dal Ministero della Scienza e delle Tecnologie dell'Informazione e della Comunicazione (2018R1A5A2025079, 2019M3A9E8022135 e 2020R1C1C1014513) e dai Centri coreani per il controllo e la prevenzione delle malattie (KCDC, 2020-ER6714-00).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
Riferimenti
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574(2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon