Method Article
Frazionamento cellulare di cellule U937 mediante purificazione del gradiente di densità isopicnica
In questo articolo
Riepilogo
Questo protocollo di frazionamento consentirà ai ricercatori di isolare proteine citoplasmatiche, nucleari, mitocondriali e di membrana da cellule di mammifero. Le ultime due frazioni subcellulari vengono ulteriormente purificate tramite gradiente di densità isopicnica.
Abstract
Questo protocollo descrive un metodo per ottenere frazioni proteiche subcellulari da cellule di mammifero utilizzando una combinazione di detergenti, lisi meccanica e centrifugazione a gradiente di densità isopicnica. Il vantaggio principale di questa procedura è che non si basa sul solo uso di detergenti solubilizzanti per ottenere frazioni subcellulari. Ciò consente di separare la membrana plasmatica da altri organelli legati alla membrana della cellula. Questa procedura faciliterà la determinazione della localizzazione delle proteine nelle cellule con un metodo riproducibile, scalabile e selettivo. Questo metodo è stato utilizzato con successo per isolare proteine citosoliche, nucleari, mitocondriali e di membrana plasmatica dalla linea cellulare monocitaria umana, U937. Sebbene ottimizzata per questa linea cellulare, questa procedura può servire come punto di partenza adatto per il frazionamento subcellulare di altre linee cellulari. Le potenziali insidie della procedura e come evitarle sono discusse così come le alterazioni che potrebbero dover essere considerate per altre linee cellulari.
Introduzione
Il frazionamento subcellulare è una procedura in cui le cellule vengono lisate e separate nei loro componenti costitutivi attraverso diversi metodi. Questa tecnica può essere utilizzata dai ricercatori per determinare la localizzazione delle proteine nelle cellule di mammifero o per l'arricchimento di proteine a bassa abbondanza che altrimenti non sarebbero rilevabili. Mentre attualmente esistono metodi per il frazionamento subcellulare, così come i kit commerciali che possono essere acquistati, soffrono di diverse limitazioni che questa procedura tenta di superare. La maggior parte dei metodi di frazionamento cellulare sono esclusivamente a base di detergente1,2, basandosi sull'uso di tamponi contenenti quantità crescenti di detergente per solubilizzare diversi componenti cellulari. Mentre questo metodo è rapido e conveniente, si traduce in frazioni impure. Questi sono progettati per consentire ai ricercatori di isolare facilmente uno o due componenti della cellula, ma non sono abbastanza complessi da isolare più frazioni subcellulari da un campione allo stesso tempo. Affidarsi esclusivamente ai detergenti di solito si traduce in organelli chiusi in membrana e la membrana plasmatica solubilizzata indiscriminatamente, rendendo difficile la separazione di questi componenti. Un'ulteriore complicazione derivante dall'uso di questi kit è l'incapacità dei ricercatori di modificarli / ottimizzarli per applicazioni specifiche, poiché la maggior parte dei componenti sono formulazioni proprietarie. Infine, questi kit possono essere proibitivamente costosi, con limitazioni nel numero di usi che li rendono meno ideali per campioni più grandi.
Nonostante la disponibilità di kit per l'isolamento dei mitocondri che non si basano su detergenti, non sono progettati per isolare la membrana plasmatica e produrre quantità significativamente inferiori di campione rispetto ai protocolli di isolamento standard 3,4. Mentre i metodi di centrifugazione differenziale richiedono più tempo, spesso si traducono in frazioni distinte che non possono essere ottenute con kit esclusivamente a base di detergenti1. La separazione senza il solo uso di detergenti solubilizzanti consente anche un'ulteriore purificazione utilizzando ultracentrifugazione e gradienti di densità isopicnica, con conseguente minore contaminazione incrociata. Questo protocollo di frazionamento dimostra l'isolamento delle frazioni subcellulari dai monociti U937 utilizzando una combinazione di approcci basati su detergenti e centrifugazione ad alta velocità. Questo metodo faciliterà l'isolamento dei componenti nucleari, citoplasmatici, mitocondriali e della membrana plasmatica di una cellula di mammifero con una contaminazione minima tra le frazioni.
Protocollo
1. Preparare tamponi e reagenti
- Preparare soluzioni fresche di fosfatasi e inibitori della proteasi.
- Aggiungere 17,4 mg di fenilmetansulfonil fluoruro (PMSF) a 1 mL di etanolo al 100% per preparare una scorta di 100 mM.
NOTA: Indossare dispositivi di protezione quando si maneggia PMSF in quanto è pericoloso se ingerito o inalato e a contatto con la pelle o gli occhi. È corrosivo per gli occhi e la pelle. - Secondo le istruzioni del produttore, preparare un cocktail inibitore della proteasi disponibile in commercio (100x).
- Aggiungere 91,9 mg di ortovanadato di sodio (SOV) a 1 mL di acqua deionizzata per preparare una scorta di 500 mM.
NOTA: Indossare dispositivi di protezione quando si maneggia SOV in quanto è pericoloso se ingerito, inalato o a contatto con gli occhi. Una grave sovraesposizione può provocare la morte.
- Aggiungere 17,4 mg di fenilmetansulfonil fluoruro (PMSF) a 1 mL di etanolo al 100% per preparare una scorta di 100 mM.
- Preparare il tampone di lisi A, il tampone di isolamento citoplasmatico (CI), il tampone di solubilizzazione cellulare (CS), il tampone di lisi nucleare (NL), il tampone di lisi B, il tampone di omogeneizzazione cellulare (CH), il diluente di iodixanolo e i detergenti.
- Aggiungere 8,7 g di cloruro di sodio (NaCl) e 50 ml di acido 4-(2-idrossietil)-1-piperazineetanosolfonico (HEPES, 1 M, pH 7,4) a 950 ml di acqua deionizzata per preparare il tampone di lisi A (concentrazioni finali di 150 mM NaCl e 50 mM HEPES).
- Preparare soluzioni madre di detergenti come segue: aggiungere 0,1 g di sodio dodecilsolfato (SDS) a 10 ml di tampone di lisi A (concentrazione finale dell'1% SDS), aggiungere 0,1 g di desossicolato di sodio a 10 ml di tampone di lisi A (concentrazione finale dell'1%), aggiungere 2,5 mg di digitonina a 10 ml di tampone di lisi A (concentrazione finale di 250 μg/ml), e aggiungere 1 mL di detergente non ionico e non denaturante (vedere la tabella dei materiali) a 9 ml di tampone di lisi A (concentrazione finale del 10% (v/v)).
- Preparare il tampone CI aggiungendo 10 μL di stock PMSF (100 mM), 10 μL di inibitore della proteasi (100x), 2 μL di stock SOV (500 mM) e 100 μL di digitonina madre (250 μg/mL) a 878 μL di tampone di lisi A (concentrazioni finali di 1 mM PMSF, 1x inibitore della proteasi, 1 mM SOV e 25 μg/mL di digitonina). Mantenere la soluzione su ghiaccio fino all'aggiunta al pellet cellulare.
- Preparare il tampone CS aggiungendo 10 μL di stock di PMSF (100 mM), 10 μL di inibitore della proteasi (100x), 2 μL di stock di SOV (500 mM), 100 μL di materiale detergente non ionico e non denaturante (vedere la tabella dei materiali) (10%) e 118 μL di stock di glicole esilenico (8,44 M) a 760 μL di tampone di lisi A (concentrazioni finali di 1 mM PMSF, 1x inibitore della proteasi, 1 mM SOV, 1% detergente non ionico, non denaturante e 1 M glicole esilene). Mantenere la soluzione su ghiaccio fino all'aggiunta al pellet cellulare.
- Preparare il tampone NL aggiungendo 10 μL di stock di PMSF (100 mM), 10 μL di inibitore della proteasi (100x), 2 μL di stock di SOV (500 mM), 50 μL di stock di desossicolato di sodio (10%), 100 μL di stock di SDS (1%) e 118 μL di stock di glicole esilenico (8,44 M) a 710 μL di tampone di lisi A (concentrazioni finali di 1 mM PMSF, 1x inibitore della proteasi, 1 mM SOV, 0,5% desossicolato di sodio (v/v), 0,1% SDS (p/v) e 1 M glicole esilenico). Mantenere la soluzione su ghiaccio fino all'aggiunta al pellet nucleare.
- Aggiungere 20 ml di HEPES (1 M, pH 7,4), 0,74 g di cloruro di potassio (KCl), 0,19 g di cloruro di magnesio (MgCl 2), 2 mL di acido etilendiamminotetraacetico (0,5 M EDTA),2 mL di glicole etilenico bis(β-amminoetil etere)-N,N,N',N'-tetraacetico (0,5 M EGTA), 38,3 g di mannitolo e 23,9 g di saccarosio a 980 ml di acqua deionizzata per preparare il tampone di lisi B (concentrazioni finali di 20 mM HEPES, 10 mM KCl, 2 mM MgCl2, 1 mM EDTA, 1 mM EGTA, 210 mM mannitolo e 70 mM saccarosio).
- Preparare il tampone CH aggiungendo 10 μL di stock di PMSF (100 mM) e 2 μL di stock di SOV (500 mM) a 988 μL di tampone di lisi B (concentrazioni finali di 1 mM PMSF e 1 mM SOV; regolare il volume finale per adattarsi al numero di cellule da lisare). Mantenere la soluzione su ghiaccio fino all'aggiunta al pellet cellulare.
- Preparare il diluente di iodixanolo aggiungendo 12 mL di HEPES (1 M, pH 7,4), 447 mg di KCl, 114 g di MgCl 2, 1,2 mL di 0,5 M EDTA,1,2 mL di 0,5 M EGTA, 21,3 g di mannitolo e 14,4 g di saccarosio a 88 mL di acqua deionizzata (concentrazioni finali di 120 mM HEPES, 60 mM KCl, 12 mM MgCl2, 6 mM EDTA, 6 mM EGTA, 1200 mM mannitolo e 420 mM saccarosio).
- Conservare i tamponi a 4 °C e la digitonina a -20 °C.
2. Isolamento proteico citosolico
NOTA: I seguenti passaggi consentiranno la crescita e l'espansione delle cellule U937 seguita dall'estrazione di proteine citosoliche. Alla concentrazione utilizzata, la digitonina permeabilizza la membrana plasmatica senza interromperla, consentendo il rilascio di proteine citosoliche e la ritenzione di altre proteine cellulari.
- Coltura delle cellule in RPMI 1640 con siero bovino fetale al 10% a 37 °C e al 5% di CO2. Assicurarsi che le cellule siano cresciute fino a un totale finale di 6 x 108 celle.
NOTA: In questo protocollo, le cellule sono state contate utilizzando un emocitometro e un microscopio standard. - Centrifugare le cellule coltivate a 400 × g per 10 minuti. Dopo aver eliminato il surnatante, risospendere il pellet cellulare in soluzione salina tamponata fosfato (PBS) a temperatura ambiente ad una concentrazione finale di 4 × 106 cellule/ml e pipettare delicatamente per rompere i grumi.
- Centrifugare la sospensione cellulare a 400 × g per 10 minuti per pellettare le cellule. Eliminare il surnatante e risospendere il pellet cellulare nel tampone di lisi ghiacciato A (preparato al punto 1.2.1) ad una concentrazione finale di 2 × 107 cellule/ml.
- Rimuovere 7,5 mL delle cellule sospese nel tampone di lisi A (3 × 107 cellule) e tenerle in ghiaccio per l'estrazione delle proteine nucleari (sezione 6). Centrifugare la sospensione cellulare a 4 °C, 400 × g per 10 minuti per pellettare le celle.
NOTA: eseguire tutti i passaggi successivi a 4 °C o su ghiaccio e preraffreddare tutti i buffer. - Eliminare il surnatante, risospendere il pellet cellulare nel tampone CI ad una concentrazione finale di 2 × 107 cellule/ml e pipettare delicatamente per rompere i grumi. Ruotare la sospensione della cella a 4 °C per 20 minuti.
- Centrifugare la sospensione cellulare a 4 °C, 400 × g per 10 minuti e trasferire il surnatante in una provetta pulita. Conservare il pellet cellulare e conservare sul ghiaccio. Centrifugare il surnatante raccolto a 4 °C, 18.000 × g per 20 minuti a pellettare i detriti cellulari.
NOTA: Questa fase di centrifugazione ad alta velocità è fondamentale per prevenire la contaminazione della frazione citosolica con organelli e proteine legate alla membrana. - Scartare il pellet dopo aver trasferito il surnatante in una provetta da centrifuga pulita. Ripetere entrambe le fasi di centrifugazione nella fase 2.6 fino a quando non si ottiene pellet dopo la centrifugazione.
- Raccogli il surnatante, che è la frazione citosolica. Per la conservazione a breve termine (1 mese), assicurarsi che il surnatante sia conservato a 4 °C. Per la conservazione a lungo termine (>1 mese), combinare il surnatante con 1x tampone Laemmli contenente 1x agente riducente, riscaldare a 95 °C per 7 minuti e conservare a -20 o -80 °C.
- Risospendere il pellet cellulare (dal punto 2.6) nel tampone di lisi A ad una concentrazione finale di 4 × 106 cellule/ml; Pipettare delicatamente per rompere i grumi.
3. Omogeneizzazione cellulare
NOTA: I seguenti passaggi consentiranno l'omogeneizzazione meccanica delle cellule trattate con digitonina (dal punto 2.9), necessaria per l'isolamento delle frazioni proteiche mitocondriali e di membrana.
- Centrifugare la sospensione cellulare nel tampone di lisi A (preparato al punto 2.9), conservare il pellet e scartare il surnatante per rimuovere la digitonina in eccesso e i contaminanti citosolici dal pellet cellulare.
NOTA: Lavaggi ripetuti nel tampone di lisi A possono essere eseguiti per rimuovere i contaminanti citosolici in eccesso. - Risospendere il pellet cellulare in tampone CH ghiacciato (preparato al punto 1.2.7) ad una concentrazione finale di 4 × 106 cellule/ml. Incubare la sospensione cellulare sul ghiaccio per 30 minuti.
- Se si utilizza un metodo basato su perline per la lisi meccanica, posizionare 30 g di perline di acciaio inossidabile prelavato da 3,2 mm in un tubo a scopa da 50 ml, riempire con 15 ml di tampone di lisi B e mettere su ghiaccio per raffreddare. Se si utilizza un omogeneizzatore Dounce (con un pestello B aderente), riempire con un volume appropriato di tampone di lisi B, inserire il pestello e metterlo sul ghiaccio per raffreddare.
- Dopo l'incubazione (fase 3.2), eliminare il tampone B di lisi dai tubi a perline (o omogeneizzatore Dounce) e trasferire 15 mL della sospensione cellulare al tubo del tallone (o un volume appropriato all'omogeneizzatore).
- Se si utilizza il metodo basato su perline, posizionare i tubi a scopa contenenti la sospensione cellulare nel dispositivo del frullatore e configurare per funzionare per 5 minuti alla velocità 8. Se usi un omogeneizzatore Dounce, tienilo sul ghiaccio ed esegui 40 passaggi con il pestello usando colpi lenti e uniformi (o utilizza un metodo alternativo di lisi cellulare meccanica come dettagliato nella sezione di discussione).
NOTA: se si utilizza un dispositivo di miscelazione diverso da quello utilizzato qui, potrebbe essere necessario determinare empiricamente velocità e tempo. - Trasferire l'omogenato in una provetta da centrifuga pulita e centrifugarlo a 400 × g per 10 minuti a 4 °C. Trasferire il surnatante in un tubo di centrifuga pulito e risparmiare; Scartare il pellet.
NOTA: Il protocollo può essere messo in pausa qui e l'omogenato conservato a 4 °C per il breve periodo (24 ore).
4. Rimozione dei detriti e isolamento delle frazioni mitocondriali e di membrana grezze
NOTA: I seguenti passaggi consentiranno la rimozione dei detriti cellulari centrifugando l'omogenato a velocità crescenti. Segue la centrifugazione differenziale per l'isolamento delle frazioni mitocondriali e di membrana grezze.
- Centrifugare l'omogenato (dal punto 3.6) a 500 × g per 10 minuti a 4 °C. Trasferire il surnatante in una provetta da centrifuga pulita ed eliminare il pellet.
- Centrifugare il surnatante (dal punto 4.1) a 1.000 × g per 10 minuti a 4 °C. Trasferire il surnatante in una provetta da centrifuga pulita ed eliminare il pellet.
- Centrifugare il surnatante (dal punto 4.2) a 2.000 × g per 10 minuti a 4 °C. Trasferire il surnatante in una provetta da centrifuga pulita ed eliminare il pellet.
- Centrifugare il surnatante (dal punto 4.3) a 4.000 × g per 20 minuti a 4 °C. Trasferire il surnatante in una provetta da centrifuga pulita e conservare il pellet, che è la frazione mitocondriale grezza.
- Centrifugare il surnatante (dal punto 4.4) a 18.000 × g per 1 h a 4 °C. Scartare il surnatante e salvare il pellet, che è la frazione grezza della membrana.
NOTA: Il protocollo può essere messo in pausa qui e i campioni pellettati conservati a 4 °C per il breve termine (24 ore).
5. Purificazione del gradiente di densità isopicnica
NOTA: I seguenti passaggi utilizzano la centrifugazione a gradiente di densità isopicnica per purificare le frazioni mitocondriali e di membrana grezze.
- Preparare una soluzione di lavoro al 50% (v/v) di iodixanolo mescolando 1 parte di diluente (preparato al punto 1.1.3) con 5 parti di iodixanolo [ soluzione madre al 60% (p/v)]. Preparare soluzioni di iodixanolo al 10%, 15%, 20%, 25%, 30% e 35% (v/v) mescolando la soluzione di lavoro al 50% (v/v) con il tampone di lisi B in quantità appropriate.
- Risospendere i pellet mitocondriali grezzi e di membrana (dalle fasi 4.4 e 4.5) ciascuno in 200 μL di tampone di lisi B. Regolare al 45% di iodixanolo (v/v) aggiungendo 1800 μL di soluzione di iodixanolo di lavoro (50% (v/v)) a 200 μL del pellet risospeso.
- Creare un gradiente discontinuo di iodixanolo come segue (regolare i volumi in base alla capacità del tubo per ultracentrifuga): Aggiungere 1 mL di iodixanolo al 15% (v/v) sul fondo di un tubo di ultracentrifuga a parete sottile da 8 mL, aperto, posizionare 1 mL di iodixanolo al 20% (v/v) sotto il primo strato (con la tecnica di sottoposa), seguito dal sottostrato di 1 mL del 25%, 1 mL del 30% e 1 mL del 35% di iodixanolo (v/v).
NOTA: In questo passaggio dovrebbero essere creati 2 gradienti, 1 per la frazione mitocondriale e 1 per la frazione di membrana. - In 1 gradiente, aggiungere i 2 ml del pellet mitocondriale grezzo (sospeso in iodixanolo al 45% (v / v)) usando la tecnica del sottofondo del tubo al di sotto dello iodixanolo al 35% (v / v). Nell'altro gradiente, aggiungere i 2 ml del pellet di membrana grezzo (sospeso in iodixanolo al 45% (v / v)) utilizzando la tecnica del sottofondo del tubo al di sotto dello iodixanolo al 35% (v / v).
- Aggiungere 1 mL di iodixanolo al 10% (v/v) alla parte superiore di ciascun tubo sfumato sovrapponendolo sopra lo strato del 15%. Bilanciare i tubi entro 0,1 g l'uno dall'altro con l'aggiunta di 10% di iodixanolo (v / v).
- Far ruotare i tubi del gradiente di densità a 4 °C per 18 ore a 100.000 × g. Assicurarsi di impostare l'accelerazione e la decelerazione sui valori minimi per l'ultracentrifuga utilizzata.
NOTA: Nel gradiente mitocondriale, ci sarà una banda visibile all'interfaccia tra il 25% e il 30% di iodixanolo (v / v). Questa è la frazione mitocondriale pura. Nel gradiente di membrana, ci sarà una banda visibile nella frazione di iodixanolo (v / v) del 15%. Questa è la frazione pura della membrana. Ci possono essere bande aggiuntive nelle frazioni di iodixanolo (v / v) del 25% e del 30% nel gradiente della membrana. Questa è contaminazione mitocondriale. - Raccogliere le frazioni dalla parte superiore del tubo in aliquote da 1 ml, facendo attenzione a ridurre al minimo il volume della frazione contenente le bande visibili e cambiando la punta della pipetta dopo che ogni strato è stato raccolto. In alternativa, forare il lato del tubo a pareti sottili con un ago e raccogliere le bande visibili.
- Conservare i campioni come descritto al punto 2.8 fino alla verifica mediante saggio proteico e western blot.
6. Isolamento delle proteine nucleari
NOTA: Utilizzando detergenti ionici e non ionici e tecniche come la sonicazione e la centrifugazione, i seguenti passaggi solubilizzeranno tutte le membrane cellulari e consentiranno l'isolamento delle proteine nucleari.
- Centrifugare l'aliquota di 7,5 mL di cellule sospese nel tampone di lisi A (dal punto 2.4) ed eliminare il surnatante. Aggiungere 800 μL di tampone CS ghiacciato (preparato al punto 1.2.4) e risospendere il pellet mediante pipettaggio e vortexing. Incubare i campioni su ghiaccio (o a 4 °C) per 30 minuti per distruggere le membrane del plasma e degli organelli proteggendo le proteine nucleari.
- Centrifugare la sospensione cellulare a 7.000 × g per 10 minuti a 4 °C ed eliminare il surnatante. Aggiungere 800 μL di tampone NL ghiacciato (preparato nella fase 1.2.5) al pellet nucleare dopo l'inclusione di 1U/μL benzonasi. Risospendere il pellet mediante pipettaggio delicato. Incubare su un rotatore end-over-end per 30 minuti a 4 °C per distruggere la membrana nucleare.
- Sonicare per 5 s al 20% di potenza con provette di campionamento raffreddate in un bagno di ghiaccio (3x, con pause di 5 s tra gli impulsi), che insieme alla benzonasi (aggiunta al punto 6.2), taglierà gli acidi nucleici.
- Centrifugare il sonicato a 7.800 × g per 10 minuti a 4 °C. Raccogli e salva il surnatante, che è la frazione nucleare. Assicurati di non disturbare il pellet insolubile durante la raccolta del surnatante. Per la conservazione, i campioni possono essere preparati come descritto al punto 2.8.
7. Quantificazione delle proteine e analisi western blot
NOTA: I seguenti passaggi quantificheranno le proteine totali in ciascuna frazione e confermeranno la purezza delle frazioni subcellulari.
- Eseguire un test Bradford standard per quantificare la proteina totale in ogni frazione. Fare riferimento alla Tabella 1 per le rese proteiche attese.
NOTA: Altri saggi proteici come il test dell'acido bicinconinico (BCA) o l'assorbanza a 280 nm possono essere utilizzati per misurare le proteine totali al posto di un test di Bradford. - Unire le frazioni con 1x tampone Laemmli contenente 1x agente riducente e riscaldare a 95 °C per 7 minuti. Caricare 10 μg di ciascuna frazione in un gel standard SDS-poliacrilammide gel di elettroforesi (PAGE) e far funzionare il gel a 20 mA per 1 ora.
- Trasferire le proteine risolte su una membrana di polivinildifluoruro (PVDF) eseguendo un trasferimento immunoblot standard a 100 V per 30 minuti. Bloccare la membrana PVDF con latte al 5% in 1x soluzione salina tamponata Tris (TBS) contenente lo 0,1% di un detergente non ionico (v/v) per 30 minuti a temperatura ambiente.
- Aggiungere gli anticorpi primari appropriati per rilevare le proteine di mantenimento specifiche per ciascuna frazione subcellulare e incubare per una notte a 4 °C. Lavare la membrana con latte al 5% in 1x TBS contenente lo 0,1% del detergente non ionico (v/v) per 10 minuti a temperatura ambiente.
NOTA: Per questo protocollo, gli anticorpi contro la gliceraldeide-3-fosfato deidrogenasi (GAPDH, 1:10000), l'istone H3 (1:2000), il canale anionico voltaggio-dipendente (VDAC, 1:1000) e la Na,K+-ATPasi sono stati utilizzati rispettivamente per frazioni citosoliche, nucleari, mitocondriali e di membrana. - Aggiungere gli anticorpi secondari coniugati con perossidasi di rafano (HRP) appropriati alla membrana (diluire secondo le istruzioni del produttore) e incubare a temperatura ambiente per 1 ora. Lavare la membrana con latte al 5% in 1x TBS contenente lo 0,1% del detergente non ionico (v/v) per 10 minuti a temperatura ambiente. Sviluppare la macchia utilizzando la chemiluminescenza standard.
Risultati
Un diagramma di flusso schematico di questa procedura (Figura 1) riassume visivamente i passi che sono stati intrapresi per frazionare con successo U9375 cellule cresciute in sospensione. Le frazioni raccolte dalla parte superiore del gradiente di densità isopicnica in volumi uguali (1 ml) mostrano la purificazione delle frazioni mitocondriali e di membrana (Figura 2). L'utilizzo di un anticorpo contro VDAC, una proteina localizzata nella membrana mitocondriale esterna6, mostra che la frazione mitocondriale è migrata verso le frazioni di iodixanolo (v / v) del 25% e del 30% (Figura 2A). L'uso di un anticorpo contro la subunità Na,K+-ATPasi α1, parte di un eterodimero integrale di membrana trovato principalmente nella membrana plasmatica7, mostra la separazione della contaminazione della membrana dalla frazione mitocondriale pura (Figura 2A). La frazione pura di membrana è migrata verso le frazioni meno dense, 10% e 15% di iodixanolo (v / v) (Figura 2B). La contaminazione mitocondriale della frazione di membrana è stata separata dal gradiente.
Un western blot8 eseguito con i marcatori di localizzazione aggiuntivi (a cui si fa riferimento nella fase 7.4) mostra la purezza delle frazioni citosolica e nucleare, verificando inoltre che i campioni mitocondriali e di membrana siano esenti da contaminazione da proteine provenienti da altre parti della cellula (Figura 3). L'uso di un anticorpo contro GAPDH, normalmente localizzato nel citoplasma della cellula9, mostra che questa proteina si trova solo nella frazione citosolica (Figura 3A, corsia 1, primo pannello) e che non si osserva alcuna contaminazione nelle proteine nucleari estratte, nei mitocondri purificati per densità o nelle frazioni di membrana (Figura 3A; corsie 2, 3 e 4; primo pannello). Il sondaggio per l'istone H3, una proteina presente nel nucleo e coinvolta nella struttura della cromatina10, mostra un'estrazione nucleare riuscita (Figura 3A, corsia 2, secondo pannello), con una rilevazione minima nella frazione citoplasmatica e nessuna contaminazione incrociata nelle frazioni mitocondriali o di membrana.
Il sondaggio per VDAC in tutte le frazioni mostra la presenza di questa proteina nella frazione mitocondriale pura (Figura 3A, corsia 3, terzo pannello) e che non esiste alcuna contaminazione incrociata nelle altre frazioni (Figura 3A; corsie 1, 2 e 4; terzo pannello). Il sondaggio per la subunità Na/K-ATPasi α1 mostra similmente che questa proteina si trova solo nella frazione di membrana pura (Figura 3A, Lane 4, quarto pannello). Queste frazioni sono state analizzate mediante densitometria per confermare la riproducibilità e la significatività statistica (Figura 3B-E). In contrasto con i risultati del frazionamento riuscito (Figura 3), l'esecuzione impropria di questo metodo (o il mancato rispetto di tutti i passaggi raccomandati) può causare contaminazione incrociata dei componenti cellulari (Figura 4). Un'alta concentrazione di istone H3 nella frazione citosolica (Figura 4, corsia 1, secondo pannello) può derivare da una mancata corretta chiarificazione della frazione citosolica (a cui si fa riferimento al punto 2.6). Ciò può verificarsi se non vengono eseguiti abbastanza centrifughi di chiarificazione o se la frazione citosolica non viene chiarita rapidamente. Se la frazione citosolica non viene chiarita abbastanza rapidamente, può provocare la lisi dei frammenti cellulari, portando alla contaminazione della frazione citosolica.
La mancata esecuzione della fase di purificazione della densità isopicnica comporterà la contaminazione della frazione di membrana (Figura 4, Corsia 4, tutti i pannelli), a seconda di quanto sia eterogeneo il campione prima della purificazione della densità. La corretta aderenza a tutte le fasi del protocollo è fondamentale per ottenere la separazione desiderata delle frazioni subcellulari. Quando quantificato utilizzando un test di Bradford, è possibile determinare la resa proteica per ogni frazione. La resa proteica attesa per frazione è riportata nella Tabella 1. È utile eseguire un test di quantificazione delle proteine prima di eseguire western blot per diversi motivi. In primo luogo, conferma che le frazioni contengono effettivamente proteine; in secondo luogo, consente il caricamento di gel SDS-PAGE in base alla quantità proteica; infine, supponendo che le rese proteiche siano simili a quelle attese (Tabella 1), conferma la corretta esecuzione della procedura.
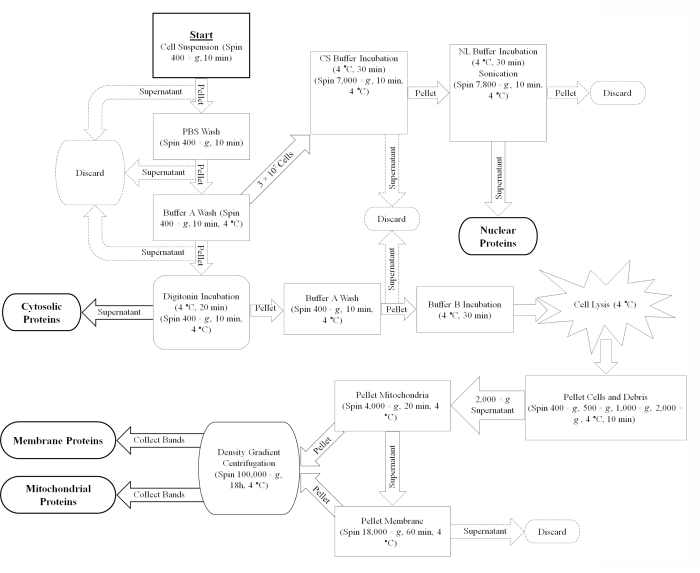
Figura 1: Diagramma della procedura di frazionamento cellulare. Una panoramica del protocollo di frazionamento cellulare rappresentato come diagramma di flusso. Abbreviazioni: PBS = soluzione salina tamponata con fosfato; CS = solubilizzazione cellulare; NL = lisi nucleare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
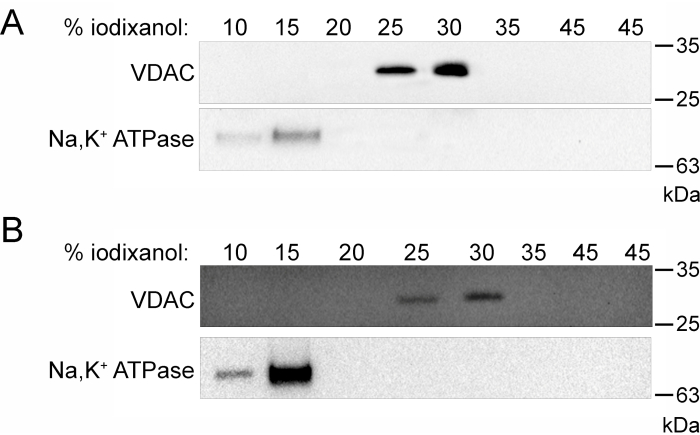
Figura 2: Purificazione della densità isopicnica delle frazioni mitocondriali grezze e di membrana . (A) Macchia occidentale rappresentativa di tutte le frazioni raccolte dopo la purificazione del gradiente di densità della frazione mitocondriale grezza. (B) Macchia occidentale rappresentativa di tutte le frazioni raccolte dopo la purificazione del gradiente di densità della frazione grezza della membrana. Entrambe le purificazioni del gradiente di densità mostrano la migrazione del marcatore mitocondriale, VDAC, per le frazioni di iodixanolo (v/v) del 25% e 30% e la migrazione del marcatore di membrana, Na,K+ ATPasi, per le frazioni di iodixanolo (v/v) del 10% e del 15%. Abbreviazione: VDAC = canale anionico dipendente dalla tensione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Isolamento riuscito delle frazioni citosoliche, nucleari, mitocondriali e di membrana U937. (A) Macchie occidentali rappresentative di frazioni cellulari isolate da una coltura cellulare di U937 con questa tecnica e sondate per marcatori di citoplasma (GAPDH, primo pannello), nucleo (istone H3, secondo pannello), mitocondri (VDAC, terzo pannello) e membrana (Na,K+ ATPasi α1, quarto pannello). (B-E) Densitometria di macchie occidentali di frazioni cellulari isolate da colture cellulari U937 con questa tecnica. I risultati provengono da 3 esperimenti indipendenti. Le barre di errore rappresentano la deviazione standard. Anova a senso unico. p<0.001. Abbreviazioni: GAPDH = gliceraldeide-3-fosfato deidrogenasi; VDAC = canale anionico voltaggio-dipendente; cyto = citosolico; nuc = nucleare; mito = mitocondriale; mem = membrana. Fare clic qui per visualizzare una versione ingrandita di questa figura.
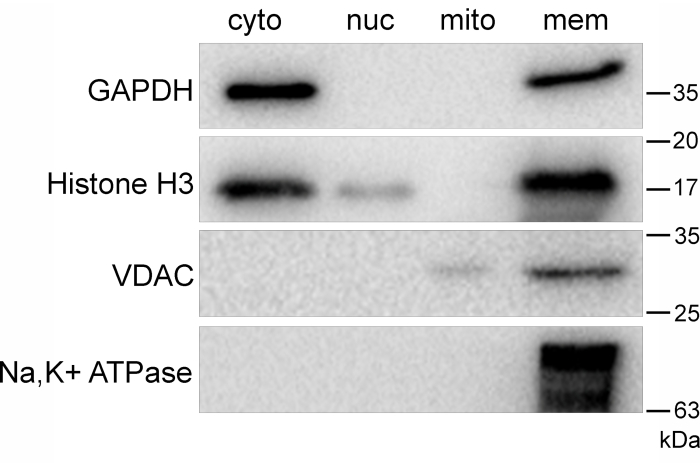
Figura 4: Frazionamento incompleto dei componenti della cella U937. Macchie occidentali rappresentative di frazioni cellulari isolate da una coltura cellulare U937 che mostrano contaminazione della frazione citosolica con istone H3 (corsia 1, secondo pannello) a causa di una chiarificazione impropria di questa frazione e una frazione grezza di membrana che non è stata sottoposta a purificazione del gradiente di densità isopicnica (corsia 4, tutti i pannelli). Abbreviazioni: cyto = citosolico; nuc = nucleare; mito = mitocondriale; mem = membrana. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Frazione | Resa (μg/ml) | Deviazione standard | Volume approssimativo |
| Citoplasma | 1500 | 146 | 5 ml |
| Nucleo | 1200 | 172 | 500 μL |
| Mitocondri | 400 | 66 | 500 μL |
| Membrana | 200 | 23 | 500 μL |
Tabella 1: Resa proteica per ogni frazione subcellulare.
Discussione
Questo metodo è una versione modificata di un approccio precedentemente pubblicato al frazionamento subcellulare senza l'uso della centrifugazione ad alta velocità11. Questo metodo modificato richiede attrezzature più specializzate per ottenere i migliori risultati, ma è più completo e costantemente riproducibile.
Lo sviluppo del protocollo iniziale è stato necessario a causa dell'incapacità di separare campioni mitocondriali e di membrana per l'analisi della localizzazione proteica durante la necroptosi12. I tentativi di utilizzare esclusivamente i metodi a base di detergenti presenti nella maggior parte dei kit disponibili in commercio hanno portato a una miscela omogenea contenente la membrana plasmatica e tutti gli organelli racchiusi nella cellula. Altre limitazioni di questi kit includono l'impossibilità di apportare modifiche alla procedura, il costo per campione, le restrizioni di volume e il numero di campioni che possono essere elaborati. La procedura qui presentata può essere modificata su qualsiasi scala, modificata per isolare meno frazioni e può essere eseguita senza l'uso di costosi reagenti. Le rese frazionarie possono essere aumentate utilizzando più celle; i passaggi possono essere adattati alla ricerca eseguita; e l'esecuzione del metodo è flessibile. Ad esempio, se i ricercatori non stanno esaminando una particolare frazione subcellulare, non hanno bisogno di isolare quel campione nel corso della procedura. Allo stesso modo, l'aggiunta di particolari inibitori o reagenti può essere omessa se il ricercatore non prevede di studiare lo stato di fosforilazione delle proteine (ortovanadato di sodio) o non si preoccupa di denaturare le proteine (glicole esilene).
L'uso dello iodixanolo come soluzione del gradiente di densità è facoltativo; Tuttavia, questo reagente non interferisce con il successivo esame dei campioni tramite Western Blotting. È anche possibile rimuovere lo iodaxanolo dai campioni mediante diluizione e centrifugazione per recuperare i mitocondri o la membrana, sebbene ciò influisca sulla resa finale. Possono essere utilizzate altre soluzioni alternative di gradiente di densità, incluso il saccarosio. Per ottenere risultati ottimali e frazioni pure, ci sono diversi fattori da considerare e particolari passaggi critici nel protocollo che richiedono un'attenta attenzione. Questo protocollo è ottimizzato per il frazionamento delle cellule U937 e la concentrazione di cellule raccomandata in particolari punti del protocollo è specifica per questa linea cellulare. Questi valori sono stati determinati empiricamente e molto probabilmente dovranno essere regolati per diversi tipi di cellule, in particolare, se si ottengono risultati non ottimali durante l'esecuzione del protocollo.
La chiarificazione del campione citoplasmatico dovrebbe avvenire il prima possibile per rimuovere le cellule ininterrotte e i detriti che potrebbero causare contaminazione incrociata da proteine provenienti da altre frazioni subcellulari (Figura 4, corsia 1, secondo pannello). L'omogeneizzazione può essere realizzata con qualsiasi forma di lisi meccanica, sebbene i risultati qui presentati siano stati ottenuti utilizzando un metodo basato su perline e un dispositivo di miscelazione. Possono essere utilizzate anche forme manuali alternative di omogeneizzazione (un omogeneizzatore Dounce o il passaggio attraverso un ago di piccolo calibro), ma possono causare problemi di riproducibilità a causa della variabilità della tecnica da parte dell'individuo che esegue la procedura. L'interesse di questo gruppo è principalmente nei leucociti circolanti, motivo per cui le cellule U937 vengono utilizzate in questa procedura. Tuttavia, questa procedura può essere applicata ad altre linee cellulari di sospensione con probabilmente poca necessità di alterazione. Le porzioni che potrebbero dover essere regolate per adattarsi a un'altra linea cellulare di sospensione includono le concentrazioni cellulari utilizzate durante la procedura e la concentrazione di digitonina utilizzata per estrarre la frazione citosolica.
Sebbene non sia ottimizzata per le linee cellulari aderenti, questa procedura può servire come punto di partenza per apportare modifiche per adattarsi alle celle aderenti. Questi aggiustamenti includono la concentrazione cellulare, la concentrazione di digitonina e il tempo di omogeneizzazione. Inoltre, le cellule aderenti sono limitate dalla superficie mentre le celle di sospensione sono limitate dal volume; Ciò semplifica il ridimensionamento delle celle di sospensione. Per scalare le cellule aderenti, devono essere utilizzate piastre di coltura tissutale con un'ampia superficie (>500 cm2). Questa procedura è un frazionamento subcellulare economico e riproducibile con la capacità di separare frazioni citosoliche, nucleari, mitocondriali e di membrana con grande purezza. Uno dei maggiori vantaggi di questa procedura è la separazione della frazione mitocondriale dalla frazione di membrana. Questo non è possibile nelle procedure esclusivamente a base di detergenti. Sebbene i detergenti siano utilizzati in questa procedura, vengono utilizzati per permeabilizzare, ma non interrompere la membrana plasmatica (digitonina) e per ottenere la frazione nucleare dopo l'isolamento delle frazioni mitocondriale e di membrana.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato da NIH R15-HL135675-01 e NIH 2 R15-HL135675-02 a T.J.L.
Materiali
| Name | Company | Catalog Number | Comments |
| Benzonase Nuclease | Sigma-Aldrich | E1014 | |
| Bullet Blender Tissue Homogenizer | Next Advance | 61-BB50-DX | |
| digitonin | Sigma | D141 | |
| end-over-end rotator | ThermoFisher | ||
| Ethylenediaminetetraacetic acid (EDTA) | Sigma | E9884 | |
| ethylene glycol-bis(β-aminoethyl ether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma | E3889 | |
| GAPDH (14C10) | Cell Signalling Technologies | 2118 | |
| HEPES | VWR | 97064-360 | |
| Hexylene glycol | Sigma | 68340 | |
| Igepal | Sigma | I7771 | Non-ionic, non-denaturing detergent |
| KCl | Sigma | P9333 | |
| Mannitol | Sigma | M9647 | |
| MgCl2 | Sigma | M8266 | |
| NaCl | Sigma | S9888 | |
| Na, K-ATPase a1 (D4Y7E) | Cell Signalling Technologies | 23565 | |
| Open-Top Polyclear Tubes, 16 x 52 mm | Seton Scientific | 7048 | |
| OptiPrep (Iodixanol) Density Gradient Medium | Sigma | D1556-250ML | |
| phenylmethanesulfonyl fluoride (PMSF) | Sigma | P7626 | |
| Protease Inhibitor Cocktail, General Use | VWR | M221-1ML | |
| refrigerated centrifuge | ThermoFisher | ||
| S50-ST Swinging Bucket Rotor | Eppendorf | ||
| Sodium dodecyl sulfate (SDS) | Sigma | 436143 | |
| Sodium deoxycholate | Sigma | D6750 | |
| sodium orthovanadate (SOV) | Sigma | 567540 | |
| sonicator | ThermoFisher | ||
| Sorvall MX120 Plus Micro-Ultracentrifuge | ThermoFisher | ||
| Stainless Steel Beads 3.2 mm | Next Advance | SSB32 | |
| Sucrose | Sigma | S0389 | |
| Tris-buffered Saline (TBS) | VWR | 97062-370 | |
| Tween 20 | non-ionic detergent in western blotting buffers | ||
| VDAC (D73D12) | Cell Signalling Technologies | 4661 |
Riferimenti
- Baghirova, S., Hughes, B. G., Hendzel, M. J., Schulz, R. Sequential fractionation and isolation of subcellular proteins from tissue or cultured cells. MethodsX. 2, 440-445 (2015).
- Il Hwang, S., Han, D. K. Subcellular fractionation for identification of biomarkers: Serial detergent extraction by subcellular accessibility and solubility. Methods in Molecular Biology. 1002, 25-35 (2013).
- Clayton, D. A., Shadel, G. S. Isolation of mitochondria from cells and tissues. Cold Spring Harbor Protocols. 2014 (10), 1040-1041 (2014).
- Stimpson, S. E., Coorssen, J. R., Myers, S. J. Optimal isolation of mitochondria for proteomic analyses. Analytical Biochemistry. 475, 1-3 (2015).
- Sundström, C., Nilsson, K. Establishment and characterization of a human histiocytic lymphoma cell line (U-937). International Journal of Cancer. 17 (5), 565-577 (1976).
- Hodge, T., Colombini, M. Regulation of metabolite flux through voltage-gating of VDAC channels. Journal of Membrane Biology. 157 (3), 271-279 (1997).
- Therien, A. G., Blostein, R. Mechanisms of sodium pump regulation. American journal of physiology. Cell physiology. 279 (3), 541-566 (2000).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proceedings of the National Academy of Sciences of the United States of the America. 76 (9), 4350-4354 (1979).
- Barber, R. D., Harmer, D. W., Coleman, R. A., Clark, B. J. GAPDH as a housekeeping gene: analysis of GAPDH mRNA expression in a panel of 72 human tissues. Physiological Genomics. 21 (3), 389-395 (2005).
- Bradbury, E. M., Cary, P. D., Crane-Robinson, C., Rattle, H. W. E. Conformations and interactions of histones and their role in chromosome structure. Annals of the New York Academy of Sciences. 222, 266-289 (1973).
- McCaig, W. D., Deragon, M. A., Haluska, R. J., Hodges, A. L., Patel, P. S., LaRocca, T. J. Cell fractionation of U937 cells in the absence of high-speed centrifugation. Journal of Visualized Experiments. (143), e59022 (2019).
- McCaig, W. D., et al. Hyperglycemia potentiates a shift from apoptosis to RIP1-dependent necroptosis. Cell Death Discovery. 4, 55 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon