Method Article
Isolamento, cultura e induzione adipogenica di cellule staminali adipose originali adipose-derivate da cellule staminali periaortiche
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo un protocollo per l'isolamento, la coltura e l'induzione adipogenica delle cellule staminali derivate dalla cresta neurale derivate da cellule staminali derivate da adiposo (NCADSC) dal tessuto adiposo periaortico del Wnt-1Cre Topi Rosa26RFP/z. Le NCADSC possono essere una fonte facilmente accessibile di ADSC per la modellazione dell'adipogenesi o della lipogenesi in vitro.
Abstract
Una quantità eccessiva di tessuto adiposo che circonda i vasi sanguigni (tessuto adiposo perivascolare, noto anche come PVAT) è associato ad un alto rischio di malattie cardiovascolari. Gli ADSC derivati da diversi tessuti adiposi mostrano caratteristiche distinte, e quelli del PVAT non sono stati ben caratterizzati. In un recente studio, abbiamo riferito che alcuni ADSC nel tessuto adiposo arco periaortico (PAAT) discendono dalle cellule della cresta neurale (NCC), una popolazione transitoria di cellule migratorie provenienti dall'ectoderma.
In questo articolo, descriviamo un protocollo per l'isolamento delle cCI con etichettatura RFP (proteina fluorescente rossa) dal PAAT del Wnt-1Cre MiriRosa26 RFP/z e inducendo ne la differenziazione adipogenica in vitro. In breve, la frazione vascolare stromale (SVF) è enzimaticamente dissociata dal PAAT, e la RFP- ADSC derivato dalla cresta neurale (NCADSC) sono isolati dalla fluorescenza activated cell sorting (FACS). Le NCADSC si differenziano in adipociti sia marroni che bianchi, possono essere crioconservate e mantenere il loro potenziale adipogenico per passaggi da 3 a 5 dollari. Il nostro protocollo può generare ABbondanti ADSC dal PVAT per la modellazione dell'adipogenesi PVAT o della lipogenesi in vitro. Pertanto, queste NCADSC possono fornire un valido sistema per studiare gli interruttori molecolari coinvolti nella differenziazione PVAT.
Introduzione
La prevalenza dell'obesità è in aumento in tutto il mondo, il che aumenta il rischio di malattie croniche correlate, tra cui malattie cardiovascolari e diabete1. IL PVAT circonda i vasi sanguigni ed è una delle principali fonti di fattori endocrini e paracrini coinvolti nella funzione di vascolatura. Studi clinici dimostrano che l'elevato contenuto di PVAT è un fattore di rischio indipendente della malattia cardiovascolare2,3, e la sua funzione patologica dipende dal fenotipo delle cellule staminali derivate da adiposa costitutive (ADSC)4.
Anche se le linee cellulari ADSC come il murino 3T3-L1, 3T3-F442A e OP9 sono utili modelli cellulari per studiare l'adipogenesi o la lipogenesi5, i meccanismi regolatori per l'adipogenesi differiscono tra le linee cellulari e le cellule primarie. Gli ADSC nella frazione di cellula vascolare stromale (SVF) isolati direttamente dai tessuti adiposi e indotti a differenziarsi in adipociti molto probabilmente ricapitolano in vivo adipogenesi e lipogenesi6. Tuttavia, la fragilità, la galleggiabilità e le variazioni di dimensioni e immunofenotipi degli ADSC rendono difficile il loro isolamento diretto. Inoltre, le diverse procedure di isolamento possono anche influenzare in modo significativo il fenotipo e la capacità potenziale adipogenica di queste cellule7, sottolineando così la necessità di un protocollo che mantenga l'integrità dell'ADSC.
Il tessuto adiposo è tipicamente classificato come il tessuto adiposo bianco (WAT) morfologicamente e funzionalmente distinto, o il tessuto adiposo marrone (BAT)8, che ospita ADSC distinti9. Mentre gli ADSC isolati dai WAT sottocutanei perigonadali e inguinali sono stati caratterizzati negli studi precedenti9,10,11,12, meno è noto per quanto riguarda gli ADSC da PVAT che è composto principalmente da BAT13.
In uno studio recente, abbiamo scoperto che una parte degli ADSC residenti nel tessuto adiposo dell'arco periaortico (PAAT) è derivata da cellule della cresta neurale (NCC), una popolazione transitoria di cellule progenitrici migratorie che provengono dall'ectoderma14,15. I topi transgenici Wnt1-Cre sono stati utilizzati per tracciare lo sviluppo delle cellule della cresta neurale16,17. Abbiamo attraversatoi topi Wnt1-Cre con i topi Rosa26RFP/ s per generare Wnt-1Cre. I topi Rosa26RFP/z, in cui gli NCC e i loro discendenti sono etichettati con proteine fluorescenti rosse (RFP) e sono facilmente rintracciabili in vivo e in vitro15. In questo articolo viene descritto un metodo per isolare gli ADSC derivati dalla cresta neurale (ADSC derivati da NC o NCADSC) dal PAAT del topo e induriamo gli NCADSC a differenziarsi in adipociti bianchi o adipociti bruni.
Protocollo
Il protocollo sugli animali è stato rivisto e approvato dal Comitato per la cura degli animali della Shanghai Jiao Tong University.
1. Generazione di Wnt-1Cre Rosa26RfP/ Topi
- Cross Wnt-1 Cre1 - Topi16 con rosa26RFP / mouse18 per generare Wnt-1 Cre. Topi Rosa26RFP/z. I topi della casa in un ciclo di luce/buio di 12 h in una struttura priva di agenti patogeni a 25 gradi centigradi e il 45% di umidità fino a 4-8 settimane.
2. Dissezione del PAAT
NOTA: vedere la figura 1.
- Sterilizzare tutti gli strumenti chirurgici (ad es. forbici chirurgiche, pinze standard e forbici microchirurgiche e pinze) autoclando a 121 gradi centigradi per 30 min.
- Preparare il mezzo di digestione (High glucose Dulbecco's Modified Eagle Medium [HDMEM] contenente 2 mg/mL di tipo I). Preparare il mezzo di coltura (HDMEM contenente 10% siero bovino fetale [FBS] e 1% v/v penicillina-streptomycin [PS]). Sterilizzare utilizzando un filtro di siringa da 0,22 m prima dell'uso.
- Sterilizzare i reagenti di coltura cellulare utilizzando UV, etanolo, filtrazione o vapore, a seconda dei casi.
- Preparare un piatto Petri con Hanks' Balanced Saline Solution (HBSS) e un tubo conico da 15 mL con 10 mL di HBSS integrato con 1% v/v di soluzione PS. Tienili entrambi sul ghiaccio.
- Anestesizzare i topi15 con isoflurane e sacrificio per lussazione cervicale. Immergere i corpi in un bicchiere riempito con 75% alcol (200 mL) per 5 min per sterilizzare la superficie della pelle.
- Tagliare e separare la pelle sull'addome e tagliare lungo la linea mediana ventrale dal bacino al collo. Aprire l'addome e spostare il fegato per esporre il diaframma19.
- Tagliare il diaframma e le costole su entrambi i lati della linea mediana ed esporre il cuore e i polmoni sbucciando le costole.
- Rimuovere il polmone e il timo ed estrarre il PAAT insieme all'aorta e al cuore.
- Tagliare l'aorta alla radice aortica per rimuovere il cuore. Fai un taglio tra l'arco aortico e l'aorta discendente e separa con cura il tessuto adiposo che circonda entrambe le strutture e le arterie carotidecomuni sinistra e destra dalla parete toracica posteriore. Trasferire il tessuto nel tampone HBSS ghiacciato nella parabola Petri.
- Utilizzando pinze sterili, rimuovere la maggior parte della vascolatura (ad esempio, aorta, arterie carotide comuni e altre piccole vascolarizzazioni) e fasciatura possibile, e trasferire il tessuto adiposo nei tubi Eppendorf 2 mL contengono 0,5 mL di ghiaccio-freddo GNS buffer sul ghiaccio.
3. Isolamento dell'SVF
Raccogliere il PAAT di 5-6 topi in un tubo di microcentrifuga da 2 mL contenente 1 mL di digestione appena preparato medio e tritare il tessuto utilizzando forbici chirurgiche in un tubo Eppendorf a temperatura ambiente (RT).
- Trasferire la miscela in tubi da 50 mL contenenti 9 mL del mezzo di digestione. Omogeneizzare i tessuti pipetting su e giù con una pipetta da 1 mL 10x.
- Incubare i tubi a 37 gradi centigradi con agitazione costante a 100 giri/mm per 30-45 min e controllare ogni 5-10 min per evitare disgestione eccessiva. Questo è fondamentale per migliorare la vitalità e la resa delle cellule.
NOTA: Una buona digestione dei tessuti si tradurrà in un tessuto omologioso, giallo chiaro, visibile ad occhio nudo dopo aver vorticoso delicatamente il tubo. - Interrompere la digestione aggiungendo 5 mL di HDMEM contenente 10% FBS e 1% v/v PS a RT e mescolare bene con il pipettaggio.
- Centrifugare la sospensione cellulare a 500 x g per 5 min a RT. L'SVF sarà visibile come pellet bruna. Aspirare con attenzione gli adipociti galleggianti e decantare il rimanente super-natante senza disturbare la SVF. Sciogliere il pellet SVF in 10 mL di mezzo di coltura e filtrare attraverso un colino cellulare di 70 m.
- Centrifugare la sospensione cellulare a 500 x g per 5 min, rimuovere il supernatante e risospendere delicatamente il pellet in 5 mL di tampone di lisi eritrocite in un tubo conico da 15 mL per 10 min a RT.
- Interrompere la reazione aggiungendo 10 mL di 1x PBS contenente 1% FBS. Centrifugare la sospensione cellulare a 500 x g per 5 min a 4 gradi centigradi, rimuovere il supernatante e sospendere nuovamente il pellet in 10 mL di 1x PBS contenente 1% FBS.
- Centrifugare nuovamente le cellule a 500 x g per 5 min a 4 gradi centigradi. Rimuovere il supernatante e risospendere il pellet in 5 mL di mezzo di coltura in un tubo conico da 15 mL a 4 gradi centigradi.
- Dopo un ultimo round di centrifugazione (500 x g per 5 min a 4 gradi centigradi), risospendere le cellule sventate in 5 mL di buffer FACS (PBS contenente 10% FBS, 100 unità/mL DNA I e 1% v/v PS) sul ghiaccio e contare le cellule con un emocitometro.
4. Isolamento degli NCADSC da parte di FACS
- Impostare e ottimizzare la selezione delle celle seguendo il manuale di istruzioni. Selezionare l'ugello di 100 m, sterilizzare i tubi di raccolta, installare il dispositivo di raccolta richiesto e impostare i flussi laterali20.
- Per l'ordinamento dellecelle RFP sono consigliati un filtro laser e ottico 579/verde 561 nm 579/16. Eseguire la compensazione utilizzando il controllo negativo e i controlli positivi a macchia singola. Vedere Figura 2A per lo schema di gating.
- Filtrare le cellule attraverso un colino da 40 m, centrifugare a 500 x g per 5 min e sospendere nuovamente le cellule in 2 mL di buffer FACS ad una densità di 0,5–1 x 107/mL. Trasferire le celle in tubi di polistirolo inferiore rotondi da 5 mL e caricare nella selezionatrice.
- Eseguire il tubo campione sperimentale a 4 gradi centigradi, accendere le piastre di deflessione e ordinare in un tubo conico da 15 mL prestrato con RPMI contenente 1% FBS e 1% v/v PS.
NOTA: Proteggere i campioni dalla luce forte per ridurre al minimo lo spegnimento RFP.
5. Cultura degli NCADSC
- Placcare le cellule smistati ad una densità di 5.000 cellule/cm2 in una piastra di coltura di 12 pozzi in mezzo di coltura completa e incubare a 37 gradi centigradi in un'atmosfera umida con 5% di CO2 per 20-24 h.
- Rimuovere il mezzo di coltura, lavare le cellule con PBS preriscaldato (37 gradi centigradi) per rimuovere i detriti delle cellule e aggiungere un nuovo mezzo di coltura.
- Una volta che le cellule sono confluenti dell'80-90%, digerire il monostrato utilizzando una soluzione EDTA di prova dello 0,25% a 37 gradi centigradi in un'incubatrice per 3-5 min e neutralizzare con 2 mL di mezzo di coltura.
- Centrifugare le cellule raccolte per 15 min a 250 x g a RT, rimuovere il supernatante, e rimettere in sospensione le cellule in 1 mL di mezzo di coltura. Conta le celle con un emocitometro.
- Semina le cellule in una piastra di 12 pozzi alla densità di 5.000 cellule/cm2.
- Risospendere le cellule rimanenti nel mezzo di coltura contenente 10% DMSO, congelare e conservare in azoto liquido.
6. Induzione adipogenica delle NCADSC
- Indurre la differenziazione adipogenica delle NCADSC all'80-90% di confluenza e condizioni di coltura standard21.
- Per l'induzione adipogenetica marrone, prima di tutto trattare le cellule coltivate con un mezzo di induzione adipogenico marrone (HDMEM, 10% FBS, 1% v/v PS, 0,5 m/L IBMX, 0,1 M/L dexamethasone, 1M /L rosiglitazone, 10 nmol/L triiodothyronine e 1 insulina di g/mL per 2 giorni. Lavare le cellule con PBS 2x e sostituirle con un nuovo mezzo (HDMEM, 10% FBS, 1% v/v PS, 1 rosiglitazone M/L, 10 nmol/L triiodothyronine e 1 insulina g/mL). Modificare questo supporto ogni 2 giorni per un totale di 3-5x.
- Per l'induzione adipogenetica bianca, prima trattare le cellule con un mezzo di induzione adipogenico bianco (HDMEM, 10% FBS, 1% v/v PS, 0,5 mM/L IBMX, 0,1 M/L dexamethasone e 1 g/mL di insulina) per 2 giorni. Lavare le cellule con PBS 2x e sostituirle con un nuovo mezzo (HDMEM, 10% FBS, 1% v/v PS e 1 omb/mL di insulina). Cambia questo mezzo ogni 2 giorni per un totale di 3-5x.
- Analizzare le cellule adipogeniche in base alle esigenze.
NOTA: Essere gentile quando si pulsano le cellule con PBS. Gli adipociti differenziati possono facilmente lavarsi via.
Risultati
Utilizzando il protocollo descritto in precedenza, abbiamo ottenuto 0,5–1,0 x 106 ADSC da 5-6 Wnt-1Cre Rosa26topi RFP/z (48 settimane, maschi o femmine).
Il diagramma di flusso della raccolta di PAAT da topi è presentato nella Figura 1. La morfologia delle NCADSC era simile all'ADSC da altri tessuti adiposi dei topi. I NCADSC coltivati hanno raggiunto l'80-90% di confluenza dopo 7-8 giorni di cultura, e gli NCADSC hanno avuto una morfologia simile a un fibroblasto espansa (Figura 2B,C).
Per confermare ulteriormente che gli NCADSC avevano un potenziale adipogenico, è stata indotta la differenziazione degli NCADSC in adipociti bianchi o marroni. La colorazione rosso olio è stata utilizzata per rilevare gli adipociti maturi (Figura 2). Le NCADSC hanno mostrato un forte potenziale adipogenico sia per gli adipociti bianchi che per quelli bruni dopo l'induzione. Gli adipociti maturi sono stati osservati dopo 8 giorni di induzione adipogenica bianca o marrone, con oltre il 60% degli NCADSC che mostrano una differenziazione adipogenica (Figura 2D,F,H). Il prolungamento del tempo di induzione adipogenica ha migliorato il tasso di raccolta degli adipociti maturi (dati non mostrati). Gli NCADSC avevano notevolmente ridotto il potenziale adipogenico dopo il passaggio (Figura 2E,G,H).
Immunoblotting e pcR quantitativo in tempo reale (qRT-PCR) (vedi File supplementare 1 per i primer utilizzati) hanno dimostrato che i livelli di espressione delle proteine e dei geni relativi adipociti specifici (Perilipin, PPAR, Cebp/z) nelle NCADSC adipogenicamente differenziate sono notevolmente aumentati dopo 8 giorni di induzione adipogenica bianca (Figura 3A, B). I risultati di qRT-PCR hanno mostrato che l'induzione di geni specifici di adipocite (Perilipin, PPAR, Cebp ) e di geni bruni specifici dell'adipocito (Pgc1, UCP-1, PPAR, PRDM16) è aumentata significativamente in 8 giorni di induzione adipogenica bruna delle NCADSC(Figura 3B,C,D).
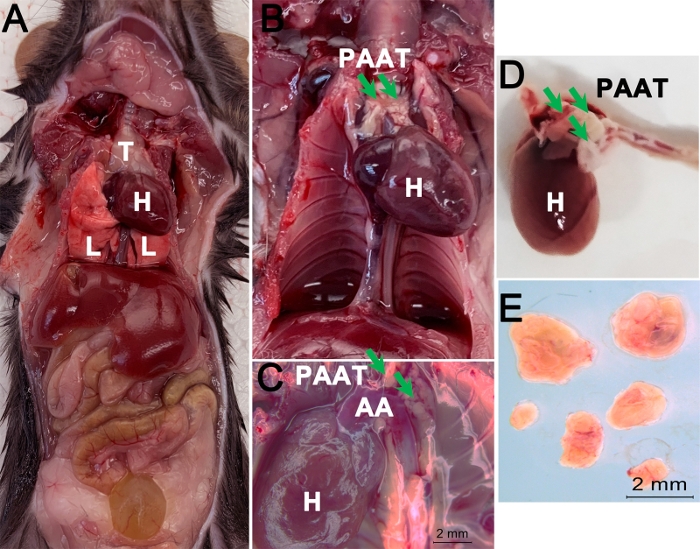
Figura 1: Diagramma di flusso della raccolta di PAAT dai topi. (A) Anestesizzare e sacrificare il Wnt-1Cre Rosa26topo RFP / z ed eseguire la dissezione longitudinale del mouse per esporre cuore e polmoni; (B) Rimuovere i polmoni e il timo; (C) Esporre PAAT, arco aorta, e il cuore; (D) Rimuovere PVAT, aorta e cuore nel buffer HBSS preraffreddato; (E) Raccogliere PAAT e trasferire nel buffer HBSS preraffreddato. H - Cuore; AA - Arco Aorta; T - Timo; L - Polmone. Fare clic qui per visualizzare una versione più grande di questa figura.
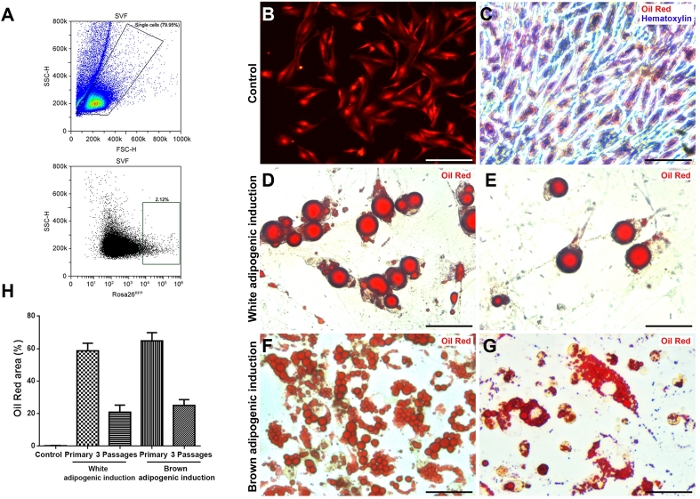
Figura 2: differenziazione adipogenica degli NCADSC isolati dal PAAT. (A) Schema generale di gating per la caratterizzazione e l'ordinamento delle popolazioni di NCADSC (RFP). (B) Le immagini al microscopio a fluorescenza mostrano che gli NCADSC hanno aderito ed espanso dopo la semina di 96 h su una piastra di coltura di 12 pozzi. (C–G) Immagini rappresentative che mostrano che l'olio rosso O macchiato NCADSC da PAAT dopo induzione adipogenica. (C) Controllo (nessuna induzione). (D) NCADSC primarie e(E)NCADSC con 3 passaggi ovito dopo 10 giorni di induzione adipogenetica bianca. (F) NCADSC primarie e(G) NCADSC con 3 passaggi dopo 10 giorni di induzione adipogenetica bruna. (H) Risultati statistici dell'area di colorazione rossa del petrolio delle NCADSC primarie e 3 x di passaggio dal PAAT dopo 8 giorni di induzione adipogenetica. n n - 6. I valori sono espressi come media : deviazione standard (SD). Barra di scala : 50 m. Fare clic qui per visualizzare una versione più grande di questa figura.
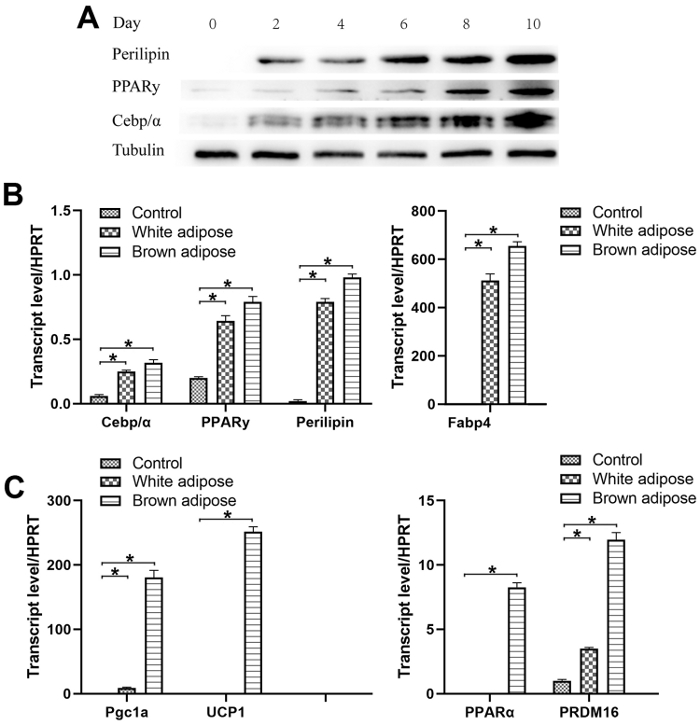
Figura 3: caratterizzazione dell'induzione adipogenica bianca e marrone degli NCADSC. (A)Immunoblot che mostra i livelli di espressione delle proteine specifiche degli adipociti (Perilipin, PPAR, Cebp/z) nelle NCADSC bianche differenziate adipogenicamente. (B) risultati qRT-PCR che mostrano l'induzione di geni specifici di adipociti, Cebp/z, PPAR, Perilipin, Fabp4 nelle NCADSC bianche e marroni differenziate adigenicamente. (C) risultati qRT-PCR che mostrano l'induzione di geni bruni specifici dell'adipocito, Pgc1, UCP-1, PPAR, PRDM16 nelle NCADSC bianche e marroni differenziate adipogenicamente. I livelli di espressione sono stati normalizzati rispetto a HPRT e misurati dal metodo Ct (Sezione Ct). Risultato rappresentativo di n - 3 esperimenti indipendenti. I valori sono espressi come media: è stato utilizzato il test t Student a due code non accoppiato per i confronti tra i due gruppi. < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1. Fare clic qui per visualizzare questo file (fare clic con il pulsante destro del mouse per scaricare).
Discussione
In questo studio, presentiamo un metodo affidabile per l'isolamento, la cultura e l'induzione adipogenica degli NCADSC estratti dal PVAT di Wnt-1 Cre. Topi transgenici Rosa26RFP/z progettati per la produzione di RFPe ADSC. Le relazioni precedenti mostrano che non vi è alcuna differenza significativa nell'espressione dei marcatori di cellule staminali mesenchymale (MSC) multipotenti in NCADSC e non NCADSC22e che gli NCADSC hanno un forte potenziale per differenziarsi in adipociti in vitro15,22,23. Pertanto, le NCADSC isolate con questo protocollo dovrebbero essere adatte per la maggior parte degli studi ADSC.
Il vantaggio dell'attuale metodo è che il reporter fluorescente intrinseco nelle NCADSC transgeniche rende il processo di isolamento semplice ed economico senza la necessità di anticorpi o FACS basati su sonda, o lo smistamento di cellule magnetiche attivate24. Inoltre, l'intensità di fluorescenza di RFP è più forte di FITC, che migliora ulteriormente l'efficienza del FACS.
La chiave di questo protocollo è l'utilizzo di giovani topi. Anche se i topi più grandi e più anziani possono produrre una maggiore quantità di tessuto adiposo, la proporzione di adipociti derivati da NC nel PAAT diminuisce con l'età perché gli NCC contribuiscono principalmente allo sviluppo precoce del PAAT15. Così, il potenziale adipogenico di queste cellule diminuisce con l'età. Sulla base dei nostri esperimenti, l'intervallo di tempo ottimale per l'isolamento NCADSC nei topi è di 4-8 settimane.
Il nostro metodo è semplice, pratico e può generare ABbondanti ADSC per lo studio dell'adipogenesi o lipogenesi PVAT in vitro e per testare nuovi farmaci contro l'obesità e le malattie cardiovascolari. Inoltre, le NCADSC del Wnt-1Cre I topi Rosa26RFP/z possono anche essere un efficace sistema in vitro per altri campi di ricerca. Tuttavia, rimangono diversi avvertimenti: In primo luogo, queste cellule sono più sensibili e fragili di linee adipociti immortalati. In secondo luogo, il loro alto tasso di proliferazione e la differenziazione adipogenica è controbilanciato dal fatto che tendono a perdere il loro potenziale adipogenico dopo un massimo di cinque passaggi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
National Key R&D Program of China (2018YFC1312504), National Natural Science Foundation of China (81970378, 81670360, 81870293), e la Commissione scienza e tecnologia del comune di Shanghai (174111971000, 17140902402) ha fornito i fondi per questo studio .
Materiali
| Name | Company | Catalog Number | Comments |
| 4% PFA | BBI life sciences | E672002-0500 | Lot #: EC11FA0001 |
| Agarose | ABCONE (China) | A47902 | 1% working concentration |
| Anti-cebp/α | ABclonal | A0904 | 1:1000 working concentration |
| Anti-mouse IgG, HRP-linked | CST | 7076 | 1:5000 working concentration |
| Anti-perilipin | Abcam | AB61682 | 1 μg/mL working concentration; lot #: GR66486-54 |
| Anti-PPARy | SANTA CRUZ | sc-7273 | 0.2 μg/mL working concentration |
| Anti-rabbit IgG, HRP-linked | CST | 7074 | 1:5000 working concentration |
| Anti-β-Tubulin | CST | 2146 | 1:1000 working concentration |
| BSA | VWR life sciences | 0332-100G | 50 mg/mL working concentration; lot #: 0536C008 |
| Collagenase, Type I | Gibco | 17018029 | |
| Dexamethasone | Sigma-Aldrich | D4902 | 0.1 µM working concentration |
| Erythrocyte Lysis Buffer | Invitrogen | 00-4333 | |
| FBS | Corning | R35-076-CV | 50 mg/mL working concentration; lot #: R2040212FBS |
| HBSS | Gibco | 14025092 | |
| HDMEM | Gelifesciences | SH30243.01 | Lot #: AD20813268 |
| IBMX | Sigma-Aldrich | I7018 | 0.5 mM working concentration |
| Insulin | Sigma-Aldrich | I3536 | 1 μg/mL working concentration |
| Microsurgical forceps | Suzhou Mingren Medical Equipment Co.,Ltd. (China) | MR-F201A-1 | |
| Microsurgical scissor | Suzhou Mingren Medical Equipment Co.,Ltd. (China) | MR-H121A | |
| Oil Red O solution | Sigma-Aldrich | O1516 | 0.3% working concentration |
| PBS (Phosphate buffered saline) | ABCONE (China) | P41970 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PrimeScript RT reagent Kit | TAKARA | RR047A | Lot #: AK4802 |
| RNeasy kit | TAKARA | 9767 | Lot #: AHF1991D |
| Rosa26RFP/+ mice | JAX | No.007909 | C57BL/6 backgroud; male and female |
| Rosiglitazone | Sigma-Aldrich | R2408 | 1 μM working concentration |
| Standard forceps | Suzhou Mingren Medical Equipment Co.,Ltd. (China) | MR-F424 | |
| Surgical scissor | Suzhou Mingren Medical Equipment Co.,Ltd. (China) | MR-S231 | |
| SYBR Premix Ex Taq | TAKARA | RR420A | Lot #: AK9003 |
| Triiodothyronine | Sigma-Aldrich | T2877 | 10 nM working concentration |
| Wnt1-Cre+;PPARγflox/flox mice | JAX | No.009107 | C57BL/6 backgroud; male and female |
Riferimenti
- Afshin, A., et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. New England Journal of Medicine. 377 (1), 13-27 (2017).
- Brown, N. K., et al. Perivascular adipose tissue in vascular function and disease: a review of current research and animal models. Arteriosclerosis, Thrombosis, and Vascular Biology. 34 (8), 1621-1630 (2014).
- Britton, K. A., et al. Prevalence, distribution, and risk factor correlates of high thoracic periaortic fat in the Framingham Heart Study. Journal of the American Heart Association. 1 (6), 004200 (2012).
- Police, S. B., Thatcher, S. E., Charnigo, R., Daugherty, A., Cassis, L. A. Obesity promotes inflammation in periaortic adipose tissue and angiotensin II-induced abdominal aortic aneurysm formation. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (10), 1458-1464 (2009).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metabolism. 4 (4), 263-273 (2006).
- Aune, U. L., Ruiz, L., Kajimura, S. Isolation and differentiation of stromal vascular cells to beige/brite cells. Journal of Visualized Experiments. (73), e50191 (2013).
- Ruan, H., Zarnowski, M. J., Cushman, S. W., Lodish, H. F. Standard isolation of primary adipose cells from mouse epididymal fat pads induces inflammatory mediators and down-regulates adipocyte genes. Journal of Biological Chemistry. 278 (48), 47585-47593 (2003).
- Cinti, S. Between brown and white: novel aspects of adipocyte differentiation. Annals of Medicine. 43 (2), 104-115 (2011).
- Van Harmelen, V., Rohrig, K., Hauner, H. Comparison of proliferation and differentiation capacity of human adipocyte precursor cells from the omental and subcutaneous adipose tissue depot of obese subjects. Metabolism. 53 (5), 632-637 (2004).
- Rodeheffer, M. S., Birsoy, K., Friedman, J. M. Identification of white adipocyte progenitor cells in vivo. Cell. 135 (2), 240-249 (2008).
- Church, C. D., Berry, R., Rodeheffer, M. S. Isolation and study of adipocyte precursors. Methods in Enzymology. 537, 31-46 (2014).
- Chen, Y., et al. Isolation and Differentiation of Adipose-Derived Stem Cells from Porcine Subcutaneous Adipose Tissues. Journal of Visualized Experiments. (109), e53886 (2016).
- Ye, M., et al. Developmental and functional characteristics of the thoracic aorta perivascular adipocyte. Cellular and Molecular Life Sciences. 76 (4), 777-789 (2019).
- Medeiros, D. M. The evolution of the neural crest: new perspectives from lamprey and invertebrate neural crest-like cells. Wiley Interdisciplinary Reviews. Developmental Biology. 2 (1), 1-15 (2013).
- Fu, M., et al. Neural Crest Cells Differentiate Into Brown Adipocytes and Contribute to Periaortic Arch Adipose Tissue Formation. Arteriosclerosis, Thrombosis, and Vascular Biology. , (2019).
- Danielian, P. S., Muccino, D., Rowitch, D. H., Michael, S. K., McMahon, A. P. Modification of gene activity in mouse embryos in utero by a tamoxifen-inducible form of Cre recombinase. Current Biology. 8 (24), 1323-1326 (1998).
- Tamura, Y., et al. Neural crest-derived stem cells migrate and differentiate into cardiomyocytes after myocardial infarction. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 582-589 (2011).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Tan, P., Pepin, &. #. 2. 0. 1. ;., Lavoie, J. L. Mouse Adipose Tissue Collection and Processing for RNA Analysis. Journal of Visualized Experiments. (131), e57026 (2018).
- Basu, S., Campbell, H. M., Dittel, B. N., Ray, A. Purification of specific cell population by fluorescence activated cell sorting (FACS). Journal of Visualized Experiments. (41), e1546 (2010).
- Gupta, R. K., et al. Zfp423 expression identifies committed preadipocytes and localizes to adipose endothelial and perivascular cells. Cell Metabolism. 15 (2), 230-239 (2012).
- Sowa, Y., et al. Adipose stromal cells contain phenotypically distinct adipogenic progenitors derived from neural crest. PLoS One. 8 (12), 84206 (2013).
- Billo, N., et al. The generation of adipocytes by the neural crest. Development. 134 (12), 2283-2292 (2007).
- Thelen, K., Ayala-Lopez, N., Watts, S. W., Contreras, G. A. Expansion and Adipogenesis Induction of Adipocyte Progenitors from Perivascular Adipose Tissue Isolated by Magnetic Activated Cell Sorting. Journal of Visualized Experiments. (124), e55818 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon