Method Article
Visualizzazione della morfologia degli astrociti utilizzando Lucifero Giallo Iontoresis
In questo articolo
Riepilogo
Gli astrociti sono cellule morfologicamente complesse, esemplificate dai loro molteplici processi e territori cespugliosi. Per analizzare la loro morfologia elaborata, presentiamo un protocollo affidabile per eseguire iontoforesi gialla di Lucifero intracellulare in tessuto leggermente fissato.
Abstract
Gli astrociti sono componenti essenziali dei circuiti neurali. Tile tutto il sistema nervoso centrale (CNS) e sono coinvolti in una varietà di funzioni, che includono l'autorizzazione del neurotrasmettitore, regolazione iosse, modulazione sinaptica, supporto metabolico ai neuroni, e regolazione del flusso sanguigno. Gli astrociti sono cellule complesse che hanno un soma, diversi rami principali e numerosi processi fini che contattano diversi elementi cellulari all'interno del neuropil. Per valutare la morfologia degli astrociti, è necessario disporre di un metodo affidabile e riproducibile per visualizzare la loro struttura. Riportiamo un protocollo affidabile per eseguire iontoresi intracellulare di astrociti utilizzando colorante giallo Lucifero fluorescente (LY) nel tessuto cerebrale leggermente fissato da topi adulti. Questo metodo ha diverse caratteristiche che sono utili per caratterizzare la morfologia degli astrociti. Permette la ricostruzione tridimensionale dei singoli astrociti, utile per eseguire analisi morfologiche su diversi aspetti della loro struttura. L'immunohistochimica insieme alla iontoforesi LY può anche essere utilizzata per comprendere l'interazione degli astrociti con diversi componenti del sistema nervoso e per valutare l'espressione delle proteine all'interno degli astrociti etichettati. Questo protocollo può essere implementato in una varietà di modelli murini di disturbi del SNC per esaminare rigorosamente la morfologia degli astrociti con microscopia leggera. LY iontohoresis fornisce un approccio sperimentale per valutare la struttura degli astrociti, soprattutto nel contesto di lesioni o malattie in cui queste cellule sono proposte per subire cambiamenti morfologici significativi.
Introduzione
Gli astrociti sono le cellule gliali più abbondanti nel sistema nervoso centrale (SNC). Essi svolgono ruoli in omeostasi iogeno, regolazione del flusso sanguigno, formazione di sinapsi così come l'eliminazione, e l'assorbimento del neurotrasmettitore1. L'ampia gamma di funzioni astrocite si riflette nella loro complessa struttura morfologica2,3. Gli astrociti contengono diversi rami primari e secondari che si dividono in migliaia di ramifici e volantini più sottili che interagiscono direttamente con sinapsi, dendriti, assoni, vasi sanguigni e altre cellule gliali. La morfologia degli astrociti varia tra diverse regioni del cervello, che possono suggerire la loro capacità di svolgere le loro funzioni in modo differenziale nei circuiti neuronali4. Inoltre, gli astrociti sono noti per alterare la loro morfologia durante lo sviluppo, durante le condizioni fisiologiche, e in più stati di malattia3,5,6.
È necessario un metodo coerente e riproducibile per risolvere con precisione la complessità della morfologia degli astrociti. Tradizionalmente, l'immunohistochimica è stata utilizzata per visualizzare gli astrociti con l'uso di marcatori proteici specifici o arricchiti di astrociti. Tuttavia, questi metodi rivelano il modello di espressione proteica piuttosto che la struttura dell'astrocito. I marcatori comunemente usati, come la proteina acida fibrillare gliale (GFAP) e la proteina legante del calcio S100 , non esprimono nell'intero volume cellulare e quindi non risolvono la morfologia completa7. Gli approcci genetici per esprimere onnipresenti proteine fluorescenti negli astrociti (iniezioni virali o linee di segnalazione di topi transgenici) possono identificare i rami più fini e il territorio generale. Tuttavia, è difficile distinguere gli astrociti individuali e le analisi possono essere di parte dalla popolazione di astrociti presa di mira dal promotore specifico8. La microscopia elettronica della sezione seriale è stata utilizzata per rivelare un quadro dettagliato delle interazioni dei processi astrociti con le sinapsi. A causa delle migliaia di processi astrociti che contattano le sinapsi, attualmente non è possibile ricostruire un'intera cella con questa tecnica9, anche se questo dovrebbe cambiare con l'uso di approcci di apprendimento automatico per l'analisi dei dati.
In questo rapporto, ci concentriamo su una procedura per caratterizzare gli astrociti del topo utilizzando la iontoresi intracellulare con colorante giallo Lucifero (LY), usando il radiato strato CA1 come esempio. Il metodo si basa sul lavoro passato pionieristico di Eric Bushong e Mark Ellisman10,11. Gli astrociti da fette di cervello leggermente fissate sono identificati dalla loro caratteristica forma di soma e riempiti con LY. Le cellule vengono poi immagini con microscopia confocale. Dimostriamo come la iontoresi LY possa essere usata per ricostruire singoli astrociti ed eseguire analisi morfologiche dettagliate dei loro processi e territori. Inoltre, questo metodo può essere applicato in combinazione con l'immunostochimica per identificare le relazioni spaziali e le interazioni tra astrociti e neuroni, altre cellule gliali e vascolatura cerebrale. Consideriamo LY iontoresis uno strumento molto adatto per analizzare la morfologia in diverse regioni del cervello e modelli murini di condizioni sane o malattie7,12,13.
Protocollo
Gli esperimenti sugli animali in questo studio sono stati eseguiti in conformità con il National Institute of Health Guide for the Care and Use of Laboratory Animals e sono stati approvati dal Chancellor's Animal Research Committee presso l'Università della California, Los Angeles. In tutti gli esperimenti sono stati usati topi adulti (6-8 settimane) di genere misto.
1. Preparazione della soluzione
-
Soluzione di liquido cerebrospinale artificiale (ACSF)
- Preparare una nuova soluzione ACSF (135 mM NaCl, 5 mM KCl, 1 mM MgCl2, 14,7 mM NaHCO3, 11 mM D-glucose, 1,25 mM Na2HPO4e 2 mM CaCl2) prima di ogni esperimento. Aggiungere MgCl2 e CaCl2 nel passaggio finale. Sciogliere i componenti in acqua deionizzata di alta qualità.
- Incubare la soluzione ACSF a 35 gradi centigradi in un bagno d'acqua e bolla con 95% O2/ 5% CO2 per almeno 30 min prima dell'esperimento.
- Aggiungere il 2% di cloruro di lidocaina per raggiungere una concentrazione finale dello 0,02% in ACSF (in 100 mL).
-
Soluzione fixative
- Utilizzare il 10% di formalina tamponata per fosfato.
-
LY soluzione di tinri
- Preparare la soluzione di tintura LY all'1,5% sciogliendo accuratamente il sale di lithioum LY CH o il sale dipotassio LY CH in 5 mM di KCl. Un volume di 1 mL è sufficiente per diversi esperimenti.
- Centrifuga per 10 min a 16.800 x g. Quindi, filtrare il supernatante con un filtro di siringa di 0,2 m in un nuovo tubo. Gli aliquote possono essere mantenuti a 4 gradi centigradi per un massimo di 3 mesi.
NOT: È fondamentale centrifugare e filtrare la soluzione di tintura per impedire l'aggregazione delle particelle di tintura, che possono intasare l'elettrodo.
2. Perfusione transcardiale del topo e dissezione cerebrale
-
Preparazione di attrezzature e mouse per la perfusione transcardiale
NOTA: possono essere utilizzati topi C57/BL6 di entrambi i sessi. È stato osservato empiricamente che per il metodo per funzionare in modo affidabile, è importante che i topi non sono più vecchi di 3 mesi (6-8 settimane è l'ideale). Il protocollo di perfusione è descritto di seguito. Un riferimento aggiuntivo è fornito per maggiori dettagli14.- Pulire i tubi perfusione con soluzione ACSF per rimuovere eventuali bolle d'aria nella linea. Impostare strumenti di chirurgia in ordine di utilizzo (pinzette, forbici curve e smussate, forbici iride).
- Anazita profondamente il topo mettendolo in una camera di induzione dell'isoflurano, dopo aver aggiunto alla camera 2-3 mL di isoflurane. Lasciare agire con un'anestesia di 1/2 min. Assicurarsi che la respirazione non si fermi.
- Test per il riflesso del pizzico delle dita dei pizzicai. Procedere quando il mouse non risponde allo stimolo del dolore e il riflesso è assente. Fissare l'animale in posizione supina con la testa posta nel cono respiratorio con una fornitura di 5% di isoflurane in ossigeno e gli arti e la coda attaccati all'interno di un cappuccio di fumi chimici.
-
Perfusione transcardiale
- Utilizzando una pinzetta, sollevare la pelle sotto gabbia toracica. Fai un'incisione di 5-6 cm con le forbici curve e smussate attraverso la pelle per esporre la cavità addominale. Tagliare verso l'alto attraverso la parete addominale fino a quando il fegato e il diaframma sono visibili.
- Allontanare delicatamente il fegato dal diagramma. Con le forbici da bagno, fai un'incisione laterale di 3,4 cm nel diaframma.
- Tagliare la gabbia toracica lungo entrambi i lati del corpo per esporre la cavità toracica. Fare attenzione a non danneggiare il cuore ed evitare i polmoni. Sollevare lo sterno per esporre il cuore.
- Una volta che il cuore è visibile, iniettare 0,05 mL di soluzione di sodio di eparina (1.000 USP per mL) nel ventricolo sinistro come anticoagulante. Quindi, inserire l'ago perfusione con attenzione nel ventricolo sinistro. Assicurarsi che l'ago rimanga nel ventricolo e non perforare attraverso altre camere cardiache. Fare una piccola incisione nell'atrio destro con le forbici dell'iride.
- Perfuso con soluzione ACSF ad una velocità di circa 10 mL/min fino a quando il fluido esistente il corpo viene eliminato dal sangue (1/2 min).
- Passa dalla soluzione ACSF alla soluzione fixative senza introdurre bolle d'aria. Perfuse con soluzione fissativa per 10 min a 10,20 mL/min.
ATTENZIONE: Fare attenzione che nessuna soluzione fissativa sta drenando dal naso. Ciò indica che l'ago ha raggiunto il ventricolo destro e il fissativo sta viaggiando verso i polmoni piuttosto che attraverso il circuito sistemico al resto del corpo.
-
Dissezione del cervello
- Rimuovere la testa del mouse con le forbici e sezionare con attenzione il cervello del topo dal cranio. Mettere in soluzione fissativa per 1,5 h a temperatura ambiente per un breve periodo di post-fissazione.
NOT: Una buona perfusione è necessaria per il successo della iontoforesi LY. Il cervello dovrebbe essere di colore bianco e assente di sangue nella vascolatura cerebrale. Il corpo e gli arti dovrebbero apparire rigidi.
- Rimuovere la testa del mouse con le forbici e sezionare con attenzione il cervello del topo dal cranio. Mettere in soluzione fissativa per 1,5 h a temperatura ambiente per un breve periodo di post-fissazione.
3. Preparazione delle fette
-
Preparazione di fette di ippocampali
- Lavare il cervello con una salina tampone di fosfato da 0,1 M (PBS) a temperatura ambiente per 5 min. Quindi, asciugare il cervello con carta da filtro e rimuovere il bulbo olfattivo e il cervelletto con una lama affilata.
- Montare il cervello sul vassoio vibratome utilizzando colla cianoacrile e riempire il vassoio con PBS a temperatura ambiente. Tagliare le sezioni coronali dell'ippocampo di 110 m di spessore.
NOT: Regolare l'impostazione del vibratoma per assicurarsi che le sezioni abbiano lo stesso spessore e la stessa superficie uniforme. Per questo esperimento, sono state utilizzate un'impostazione di velocità di 4.5 e un'impostazione di frequenza di 8, che sono impostazioni arbitrarie sullo strumento (Tabella dei materiali). Gli utenti potrebbero dover sperimentare le impostazioni su altri dispositivi. - Raccogliere le sezioni dal vassoio e metterle in un piatto di PBS sul ghiaccio.
4. Preparazione dell'elettrodo
-
Preparare un elettrodo affilato con la resistenza appropriata.
- Utilizzare un elettrodo a canna singola di vetro borosilicate con filamento (O.D. 1.0 mm, I.D. 0.58 mm). Tirare un elettrodo su un tiratore di micropipette (Tabella dei materiali). Gli elettrodi ideali riempiti con 1,5% LY in 5 mM KCl dovrebbero avere una resistenza di 200 M, quando vengono messi in un bagno di PBS.
NOT: L'impostazione dell'azionamento varia a seconda dell'apparato (tipo di macchina utilizzata e filamento per l'estraimento). Un'impostazione di calore più alta di solito dà punte più lunghe e più fini. Per l'eseguitore micropipette utilizzato in questo esperimento, le impostazioni erano: calore: 317, trazione: 90, velocità: 70 e ritardo: 70. È stato utilizzato un filamento di tipo trogolo. - Conservare gli elettrodi in un contenitore chiuso per evitare che la polvere entri nella punta. Mantenere gli elettrodi elevati dal fondo della scatola per evitare che la punta si rompa.
- Utilizzare un elettrodo a canna singola di vetro borosilicate con filamento (O.D. 1.0 mm, I.D. 0.58 mm). Tirare un elettrodo su un tiratore di micropipette (Tabella dei materiali). Gli elettrodi ideali riempiti con 1,5% LY in 5 mM KCl dovrebbero avere una resistenza di 200 M, quando vengono messi in un bagno di PBS.
-
Riempire l'elettrodo con la soluzione di tinri LY.
- Posizionare un elettrodo in posizione verticale con la punta rivolta verso il basso. La pipetta si trasforma nella parte posteriore dell'elettrodo e attendere 5-10 minuti perché la soluzione si sposti verso la punta tramite un'azione capillare.
- Fissare delicatamente l'elettrodo riempito nel supporto dell'elettrodo collegato a un manipolatore.
NOT: Il filo d'argento del supporto dell'elettrodo deve essere a contatto con la LY all'interno dell'elettrodo. Regolare il volume della soluzione LY, se necessario, a seconda della lunghezza del filo.
5. Riempimento astrociti con iontoforesi
- Testare l'elettrodo.
- Mettere una fetta di cervello delicatamente in un piatto di fondo di vetro riempito con 0,1 M PBS a temperatura ambiente. Tenere la fetta in posizione con un'arpa di platino con corde di nylon.
- Assicurarsi che l'elettrodo sia collegato a una fonte di tensione e posizionare l'elettrodo di terra nella vasca contenente la fetta del cervello.
- Spostare l'obiettivo nella regione del cervello di interesse.
- Abbassare l'elettrodo nella soluzione. Sotto il campo luminoso, spostarlo al centro del campo visivo ed esaminarlo attentamente con la lente di immersione dell'acqua 40x per assicurarsi che sembri chiara e senza detriti o bolle. Se c'è qualcosa che intasa la punta dell'elettrodo, sostituirla con una nuova.
NOT: Il clogging è una preoccupazione per l'elettrodo da 200 M. Con la centrifugazione e la filtrazione della soluzione di tinri prima di ogni esperimento, questo non dovrebbe essere un problema frequente. Tuttavia, poiché la punta dell'elettrodo è piccola, il tessuto a volte può rimanere bloccato nell'apertura. Gli autori non hanno trovato un modo per prevenire questo, ma può essere facilmente affrontato semplicemente utilizzando un nuovo elettrodo. - Osservare la punta dell'elettrodo al microscopio confocale a scansione laser con il laser da 488 nm. Quindi, prova l'espulsione del die accendendo lo stimolatore a 12 V. Notare una grande nuvola di tintura fluorescente intorno alla punta dell'elettrodo mentre lo stimolatore è acceso. Se il tintura non viene espulso dopo la stimolazione della tensione, sostituire l'elettrodo.
- Sotto il campo luminoso, abbassare lentamente l'elettrodo verso la fetta fermandosi appena sopra la superficie.
- Riempire l'astrocito con iontoforesi.
- Identificare gli astrociti 40-50 m sotto la superficie della fetta con il contrasto di interferenza differenziale infrarosso (IR-DIC). Cercare le cellule con somata allungata a forma ovale di circa 10 m di diametro. Una volta scelto un astrocito, spostarlo al centro del campo visivo.
NOT: Una buona cellula per la iontoforesi ha bordi chiari e definiti intorno ad esso. Non scegliere le celle troppo vicine alla superficie della sezione perché non possono essere completamente riempite. Ci vuole un po 'di pratica nel corso di un paio di giorni per essere in grado di identificare regolarmente gli astrociti per il riempimento di tinture. A seconda dell'area del cervello utilizzata per l'esperimento, il numero di astrociti può variare. Questo può influenzare il tempo necessario per identificare un astrocito prima del riempimento. - Abbassare lentamente la punta dell'elettrodo nella fetta, navigando attraverso il tessuto, fino a quando non è sullo stesso piano del corpo cellulare.
NOT: Spostare l'elettrodo lentamente per evitare di danneggiare il tessuto. - Una volta che il corpo cellulare dell'astrocite è chiaramente visibile e delineato, lentamente e delicatamente far avanzare l'elettrodo in avanti. Spostare l'elettrodo fino a quando la punta impala il soma della cellula. Spostare lentamente la messa a fuoco dell'obiettivo su e giù per notare se l'elettrodo è all'interno del soma.
NOT: La punta dell'elettrodo deve essere all'interno del corpo cellulare e deve essere osservata una piccola rientranza sul soma. Non spostare ulteriormente l'elettrodo per evitare che la punta attraversi la cellula. - Una volta che la punta dell'elettrodo è all'interno della cellula, accendere lo stimolatore a 0,5-1 V ed espellere continuamente la corrente nella cellula. Usando il microscopio confocale, osserva il riempimento della cellula. Aumentare lo zoom digitale per vedere i dettagli della cella e assicurarsi che la punta dell'elettrodo sia visibile all'interno della cella.
NOT: Abbassare la tensione se sembra che il colore fuoriesca dalla cella o riempialtre celle nelle vicinanze. Se sembra che il colorante stia ancora fuoriuscita dalla cellula, estrarre l'elettrodo lentamente e trovare un'altra cellula. È importante che il colore non perda per avere un alto rapporto segnale/ sfondo nell'immagine finale. - Attendere circa 15 minuti fino a quando i rami e i processi più fini appaiono definiti, spegnere la tensione e ritirare delicatamente la punta dell'elettrodo dalla cella.
- Identificare gli astrociti 40-50 m sotto la superficie della fetta con il contrasto di interferenza differenziale infrarosso (IR-DIC). Cercare le cellule con somata allungata a forma ovale di circa 10 m di diametro. Una volta scelto un astrocito, spostarlo al centro del campo visivo.
- Immagine della cella riempita.
NOTA: L'imaging può essere eseguito immediatamente dopo il riempimento o la colorazione con immunohistochimica. Un obiettivo con un'apertura numerica più alta (NA) si traduce in una migliore risoluzione.- Attendere fino a quando la cella ritorna alla forma originale prima di imaging (15-20 min) con obiettivo 40x. Per creare un'immagine della cella, regolare l'impostazione sul confocale per assicurarsi che i rami e i processi più fini appaiano definiti.
- Impostare uno z-stack con una dimensione di passo di 0,3 m. Durante l'imaging, spostare l'obiettivo fino a quando non c'è alcun segnale dalla cella e impostarlo come la parte superiore. Quindi, spostare l'obiettivo verso il basso (concentrandosi attraverso la cella) fino a quando non c'è segnale, impostare che come il fondo.
- Una volta completata l'imaging, controllare l'elettrodo per l'espulsione del tinri. Se viene visualizzata una nuvola di tinri di grandi dimensioni, può essere utilizzata per la sezione successiva. In caso contrario, sostituirlo con un nuovo elettrodo.
NOT: Il riempimento della tinga di un singolo astrocite e l'imaging richiede circa 45 min a 1 h. Per questo esperimento specifico, è stato possibile ottenere circa 3/6 celle per mouse. Se necessario, più celle possono essere etichettate sulla stessa sezione. Tuttavia, per distinguere i singoli astrociti, assicurarsi di mantenere una distanza di circa 200 m tra le cellule.
6. Colorazione con Immunoistochimica (Facoltativo)
- Una volta terminata l'imaging, posizionare immediatamente la fetta in formalina del 10% sul ghiaccio da conservare per l'immunohistochimica. Conservare le fette di cervello al buio e conservarle durante la notte a 4 gradi centigradi.
- Lavare le sezioni cerebrali 3x in 0,1 M PBS con 0,5% di surfactant nonionico (cioè Triton X 100) per 5 min ciascuno. Quindi incubare in una soluzione di blocco di 0,1 M PBS con 0.5% surfactant nonionico e 10% siero di capra normale (NGS) per 1 h a temperatura ambiente con agitazione delicata.
- Incubare le sezioni con agitazione negli anticorpi primari diluiti in 0,1 M PBS con 0,5% di surfactant nonionico e 5% NGS per 2 giorni a 4 gradi centigradi.
NOT: A causa dello spessore delle fette cerebrali, il periodo di incubazione degli anticorpi primari deve essere esteso per una migliore penetrazione e la concentrazione di anticorpi può essere aumentata. In questo esperimento, è stata utilizzata una diluizione 1:500 per gli anticorpi anti-GFAP e una diluizione 1:500 è stata utilizzata per anticorpi antiacquaporina-4. - Lavare le sezioni 3x in 0,1 M PBS con 0,5% di surfactant nonionico per 10 min ciascuna e poi incubare con anticorpi secondari diluiti in 0,1 M PBS con surfactant nonionico dello 0,5% e 10% NGS per 6 h a temperatura ambiente.
NOT: Non scegliere un anticorpo secondario eccitato da 488 nm, che è la lunghezza d'onda utilizzata per visualizzare il tincolo LY. In questo esperimento, una diluizione 1:1,000 è stata usata per Alexa Fluor 546 capra anti-pollo IgG (H-L) e Alexa Fluor 647 capra anti-coniglio IgG (H-L). - Risciacquare le sezioni 3x in 0,1 M PBS per 10 min ciascuna. Quindi montare le sezioni su vetrini al microscopio in vetro in supporti di montaggio adatti per la fluorescenza. Sigillare le diapositive. Celle dell'immagine con una dimensione di 0,3 m.
Risultati
I dati riportati in questo studio provengono da cellule 7/12 da 4 topi in ogni esperimento. I dati medi sono riportati nei pannelli figura, se del caso.
Per valutare la morfologia degli astrociti, abbiamo eseguito la iontoresi intracellulare usando il tinrito LY per riempire gli astrociti nel radiato dello strato CA1, che è riassunto nella Figura 1. Figura 2 raffigura un astrocito rappresentativo e la sua struttura morfologica elaborata. La cella è stata fotoggiata post-fissaggio con l'obiettivo di immersione ad olio 60x su un microscopio a scansione laser confocale utilizzando la linea laser da 488 nm (dimensione del passo di 0,3 m e zoom digitale 3,0 x 3,5 volte). Le funzioni del tubo fotomoltiplicatore (PMT), dell'offset e del guadagno del microscopio confocale sono state regolate per creare un rapporto segnale/sfondo elevato nell'immagine finale. Nella Figura 2A, le immagini di un singolo piano ottico da diversi passaggi z (mostrate ogni 10 m, etichettate in ordine da 1/6) rivelano il soma centrale e diversi rami principali che si dividono in una fitta rete di processi. Generando una proiezione di intensità massima (dimensione dello stack di 85 m) abbiamo osservato una visione dettagliata della struttura dell'astrocito e del suo dominio (Figura 2B). Sono stati notati anche i componenti principali della struttura dell'astrocito. Figura 2 C mostra una proiezione di intensità massima di zoom (x4) di un ramo principale, diversi rami secondari e la distribuzione dei rami e dei volantini circostanti.
Le analisi morfologiche e le ricostruzioni degli astrociti sono state eseguite con il software di analisi Imaris (Table of Materials) utilizzando le immagini di post-fissazione di astrociti riempiti con LY (potrebbero essere utilizzati anche altri software come ImageJ). Dopo che la ricostruzione di ogni astrocito fu completata, furono quantificati i volumi del soma, dei rami principali, dei processi e del territorio. Il soma è stato creato per primo con un arrotondamento della superficie impostato sul limite di risoluzione del piano x-y (0,25 m). Il diametro minimo dell'oggetto è stato impostato su 3,0 m per rimuovere altri oggetti non associati al corpo della cella. Per creare i rami principali, l'intensità del soma è stata mascherata, a causa della sua luminosità rispetto al resto della cellula. L'arrotondamento della superficie e il diametro minimo dell'oggetto dei rami principali sono stati impostati su 0,3 m (dimensione del piano z). Per creare i processi, è stata anche mascherata l'intensità dei rami principali. L'arrotondamento della superficie è stato impostato su 0,18 m e il diametro minimo dell'oggetto è stato impostato su 0,3 m. Il territorio dell'astrocito è stato creato utilizzando una soglia di intensità inferiore e l'arrotondamento della superficie impostato su 0,75 m. La figura 3A mostra l'immagine originale di un astrocito CA1. Il corpo cellulare, i rami principali, i processi e il volume del territorio racchiuso dall'astrocito sono ricostruiti nella Figura 3B-E. Dopo la creazione delle ricostruzioni delle cellule, i volumi del soma, dell'intera cellula e del territorio sono stati quantificati e il numero dei rami principali è stato contato(tabella 1). Gli astrociti CA1 dello strato radiato avevano un volume medio di soma di 488,91s3, medio di 7 rami primari, volume medio delle cellule di 5,58 x 103 m3e un volume medio del territorio di 2,94 x 104 m3.
Il marcatore di astrocito ben caratterizzato, GFAP, è una proteina citoscheletrica che etichetta i filamenti intermedi di un astrocito8. Dopo che gli astrociti sono stati riempiti di colore, abbiamo eseguito l'immunostaining per GFAP per visualizzare l'espressione in singoli astrociti (Figura 4). Abbiamo scoperto che GFAP è stato espresso nel soma cellulare, nei rami principali e in alcuni rami secondari degli astrociti, ma non nei rami e nei processi più fini (Figura 4A). Non è stata riscontrata alcuna differenza significativa nel numero di rami primari etichettati da GFAP e in quelli visualizzati da LY (p - 0,1573; Figura 4 B). L'area cellulare e il volume dell'astrocito etichettato da GFAP erano significativamente più piccoli dell'area e del volume visualizzati con LY (p < 0.0001; Figura 4 C,D). Ciò dimostra che GFAP è un marcatore affidabile per l'etichettatura dei rami principali, ma non è utile per determinare l'area o il volume complessivo della cella.
Una caratteristica importante degli astrociti è il loro piedi finali, che contattano i vasi sanguigni e sono proposti per aiutare a regolare il flusso sanguigno nel SNC. Per comprendere meglio la relazione spaziale tra astrociti e vascolarizzazione cerebrale, abbiamo macchiato con anticorpi contro l'acquaporina-4 dopo il riempimento della tintura. L'acquaporina-4 è una proteina del canale d'acqua che si trova su cellule astrociti e ependymal, ed è altamente espressa in aree vicine a ventricoli e vasi sanguigni15. Abbiamo scoperto che l'acquaporina-4 è espressa su piedi finali astrociti in prossimità della vascolatura cerebrale (Figura 5A). L'immagine raffigura tre piedi finali astrociti che contattano un vaso sanguigno in luoghi diversi (indicati dalle frecce bianche). Nel CA1 strato radiatum, il numero medio di piedi d'estremità per astrocito era di 2(Figura 5B). È interessante notare che i rami che contengono i piedi d'estremità erano significativamente più spessi rispetto agli altri rami primari dell'astrocito, utilizzando le ricostruzioni principali del ramo (p - 0,0038; Figura 5 C). Abbiamo anche misurato la lunghezza dei rami contenenti piedi d'estremità dal centro del soma al vaso sanguigno e confrontato che al più breve, percorso diretto al vaso sanguigno. La lunghezza effettiva dei rami al vaso sanguigno era significativamente maggiore rispetto al percorso più breve (p - 0,0333; Figura 5 D), il che suggerisce che questi rami tendono a prendere un percorso più lungo e tortuoso verso il vaso sanguigno. Il film 1 raffigura un filmato di una ricostruzione di una colorazione di un astrocite pieno di LY e di una colorazione aquaporina-4. Le diverse componenti strutturali dell'astrocito (soma, rami principali, processi e territorio) sono rappresentate in tre dimensioni. L'astrocite con pieno di LY insieme alla colorazione dell'acquaporina-4 raffigurano gli estremi dell'astrocita che circondano il vaso sanguigno. Dalla ricostruzione dei rami principali e del vaso sanguigno, i rami che contengono i piedi d'estremità possono essere visualizzati estendendosi dal soma al vaso.
Nelle sezioni precedenti, dove vengono riportati i valori di p abbiamo usato un test t di Student non accoppiato, con significato a p < 0.05.
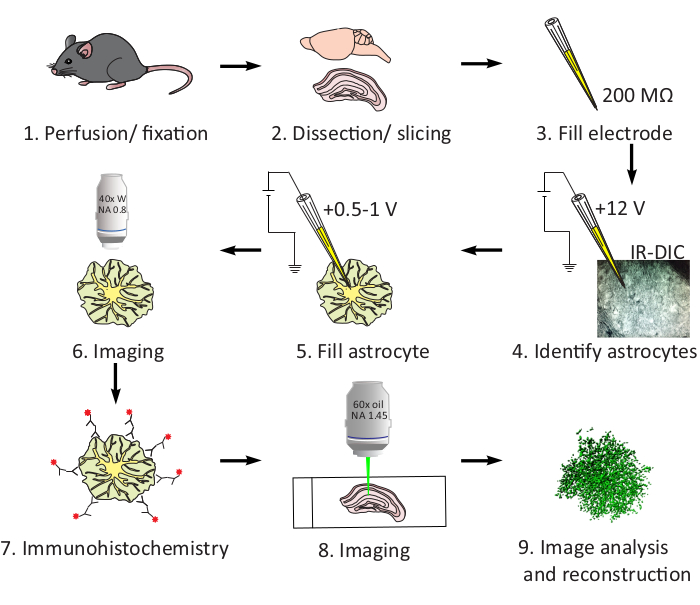
Figura 1: Diagramma del flusso di lavoro in LY iontoresis. Rappresentazione schematica del protocollo che evidenzia i passaggi critici. Dopo che il topo è stato perfuso con fissativo, il cervello è stato sezionato. Dopo un breve periodo di post-fissazione, le sezioni coronali furono tagliate con un vibratome. L'elettrodo è stato riempito con 1.5% LY dye. Gli astrociti sono stati identificati nel radiato a strati CA1 utilizzando IR-DIC su un microscopio luminoso. Il soma della cellula è stato impalato dall'elettrodo, e il tinriè è stato iniettato nella cellula applicando 0,5-1 V fino a quando i processi più fini non sono stati completamente riempiti. La fetta è stata immaginata con microscopia confocale utilizzando una lente ad immersione dell'acqua 40x e quindi elaborata per l'immunohistochimica. Ulteriore imaging è stato completato con una lente di immersione dell'olio 60x per eseguire la ricostruzione cellulare e l'analisi morfologica. Mostrato è un esempio di ricostruzione dei processi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: astrocito pieno di LY di radiatum allo strato CA1. (A) Immagini di un singolo piano ottico da un astrocita mostrato ogni 10 m (etichettato 1/6). (B) Proiezione massima dell'astrocito, raffigurante il soma cellulare, diversi rami principali, e numerosi processi che compongono il suo territorio cespuglioso. (C) Proiezione massima (zoom x4) di un ramo principale (dalla sezione delineata in giallo), due rami secondari, diverse ramieti e l'organizzazione dei processi circostanti. Barra di scala : 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Ricostruzione di un astrocito pieno di LY e dei suoi componenti. (A) Astrocito CA1 riempito con LY. (B-E) Ricostruzione tridimensionale del soma (B), soma e rami principali (C), processi (D) e territorio (E) con orientamento a 0 e 45 gradi. Barra di scala : 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: immunostaining GFAP in astrociti riempiti con LY. (A) Proiezione z rappresentativa delle colorazione LY (verde) e GFAP (magenta). Il GFAP è espresso principalmente nei rami primari e alcuni rami secondari dell'astrocito, ma non è stato trovato all'interno dell'intero territorio astrocite. Barra di scala - Grafico di 10 m. (B) del numero di rami primari etichettati da LY e GFAP. (C) Area cellulare indicata da colorazione LY e GFAP. (D) Volume cellulare indicato dalla colorazione LY e GFAP. I cerchi aperti sono dati grezzi con quadrati chiusi che indicano la media : SEM. I dati sono stati raccolti da 12 cellule da 4 mouse. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Immunostaining dell'acquaporina-4 negli astrociti riempiti di LY. (A) Rappresentativo z-proiezione di LY (verde) e acquaporina-4 colorazione (magenta). L'acquaporina-4 si esprime principalmente nei piedi finali dell'astrocite. Le frecce bianche indicano i tre piedi finali che contattano un vaso sanguigno nelle vicinanze. Barra della scala - 10 m. (B) Numero di rami con piedi d'estremità per astrocite. (C) Spessore dei rami con piedi d'estremità rispetto agli altri rami primari degli astrociti. (D) Lunghezza dei rami con piedi d'estremità rispetto al percorso più breve del vaso sanguigno. I cerchi aperti sono dati grezzi con quadrati chiusi che indicano la media : SEM. I dati sono stati raccolti da 7 cellule da 4 mouse. Fare clic qui per visualizzare una versione più grande di questa figura.

Film 1: Ricostruzione di una colorazione di un astrocite pieno di LY e acquaporina-4. Film rappresentativo di un astrocito CA1 in prossimità di un vaso sanguigno. Il soma, i rami principali, i processi e il territorio sono stati ricostruiti per analizzare la morfologia della cellula. La ricostruzione dei rami principali insieme all'acquaporina-4 raffigura due piedi finali astrociti che contattano direttamente il vaso sanguigno. Clicca qui per vedere questo video. (Fare clic con il pulsante destro del mouse per scaricare.)
| Caratteristiche morfologiche | Media : SEM |
| Volume del Soma (m3) | 489 X 30 |
| Numero di rami primari | 7,0 - 0,5 |
| Volume delle cellule (m3) | 5580 X 425 |
| Volume del territorio (m3) | 29391 - 8150 |
| Numero di celle | 14 |
Tabella 1: Analisi morfologica della struttura degli astrociti. Vengono visualizzati il volume di soma astrocito, il numero di rami primari per astrocite, il volume delle cellule astrocite e il volume racchiuso dal territorio astrocito. Sono stati raccolti dati da 14 cellule da 7 topi.
Discussione
Il metodo descritto in questo documento descrive un modo per visualizzare la morfologia degli astrociti utilizzando l'iontoresi intracellulare di LY dye in fette cerebrali leggermente fissate. Ci sono diversi fattori critici evidenziati in questo protocollo che contribuiscono al successo della iontoforesi LY e alla ricostruzione morfologica delle cellule. Un fattore è la qualità e la riproducibilità delle immagini, che è determinata in gran parte dall'età del topo e dal risultato della perfusione. In questo studio, abbiamo usato topi C57/BL6N di 6-8 settimane. Una perfusione di successo (altamente dipendente dalla corretta collocazione dell'ago perfuso e notato da un cervello di colore bianco e l'assenza di sangue nella vascolatura del cervello) è necessario per le cellule più dettagliate e chiaramente riempite. Dopo l'impalamento da parte di un elettrodo, la membrana cellulare deve mantenere una tenuta stretta intorno alla punta dell'elettrodo e impedire la fuoriuscita di tintura. Nonostante i migliori sforzi, occasionalmente altre strutture al di fuori della cellula saranno riempite come la pipetta viene avanzata attraverso il tessuto cerebrale: abbiamo escluso queste cellule dall'analisi. La resistenza degli elettrodi è un ulteriore fattore chiave. L'alta resistenza consente solo un'espulsione costante del tintura dalla punta dell'elettrodo dopo la stimolazione della tensione. Più tecnicamente, è importante mantenere movimenti delicati e lenti quando si impala il soma della cellula con l'elettrodo. La penetrazione degli elettrodi attraverso la cellula può portare a perdite di tintura dal soma. Un impalamento riuscito seguito dall'applicazione della tensione dovrebbe comportare il riempimento di tintura quasi immediato del corpo cellulare e dei processi (cioè entro pochi secondi). Il tempo necessario per riempire completamente un astrocito è legato al territorio che racchiude; tuttavia, attendere per assicurarsi che i processi più fini siano completamente riempiti (almeno 15 min).
Abbiamo trovato questo protocollo per essere un modo più fedele per studiare la morfologia degli astrociti in dettaglio, tuttavia, il metodo ha i suoi limiti. L'identificazione di una cella può richiedere molto tempo ed errori. Sotto IR-DIC, si dovrebbe identificare le caratteristiche distintive che contrassegnano il tipo di cella specifico (forma e dimensione soma). In alternativa, l'espressione di reporter fluorescenti rossi specificamente in astrociti, per iniezione virale o una linea di segnalazione di topi transgenici, consente una più facile identificazione di queste cellule prima del riempimento. Inoltre, LY è limitato come colorante citosolico perché non può essere utilizzato per etichettare la membrana astrocitica, in confronto all'etichettatura con una GFP legata alla membrana, come Lck-GFP16. Lck-GFP darebbe una rappresentazione più accurata dell'intera area territoriale, poiché LY iontomiresis rivela il volume interno di un astrocito. Tuttavia, a seconda del progetto sperimentale, LY iontomiresis è più adatto per risolvere l'intero volume interno degli astrociti, sviluppare ricostruzioni tridimensionali e quantificare i componenti anatomici che costituiscono la struttura di un astrocite6 . Infine, come per tutte le forme di microscopia confocale, la risoluzione spaziale è limitata dalla diffrazione, notata come funzione di diffusione dei punti dell'ottica al microscopio17. L'alterazione dei componenti del sistema di imaging, come la diminuzione del diametro del foro stenopeico, contribuirà a migliorare le immagini, ma la vera risoluzione è determinata dalla lunghezza d'onda della luce e dall'apertura numerica dell'obiettivo. Nel nostro caso, stimiamo che la migliore risoluzione possibile sia probabilmente di circa 300 nm, che probabilmente sarà peggiore nell'asse z.
LY iontohoresis offre diversi vantaggi rispetto ad altri metodi comunemente usati per etichettare gli astrociti. Il protocollo può essere applicato in qualsiasi modello di topo stabilito, popolazione cellulare o regione del cervello18,19,20 in quanto non è limitato da un promotore specifico astrocito o una linea di mouse transgenico. Gli approcci genetici per esprimere onnipresenti proteine fluorescenti negli astrociti mediante iniezioni virali o linee di topi reporter transgenici (ad esempio, td-Tomato) richiedono l'uso di un promotore di astrociti, che, in alcune regioni, possono essere espressi in altri tipi di cellule o meno includere tutti gli astrociti21. La iontoforesi LY è anche efficiente in termini di tempo, poiché le iniezioni virali di proteine fluorescenti richiedono un intervento chirurgico e tempo per esprimere il virus specifico, e le linee di topo transgenica richiedono l'allevamento. Infine, LY iontohoresis è un metodo utile per distinguere le singole cellule, mentre altre strategie dovrebbero anche essere combinate con un metodo per l'etichettatura sparse per visualizzare i territori dei singoli astrociti22,23, 24. Tuttavia, nessun metodo è una panacea e la cui scelta deve essere adattata alla questione specifica affrontata.
Studi futuri possono impiegare specifiche manipolazioni sperimentali ed esaminare diverse componenti della struttura degli astrociti (soma, rami, processi, territorio, ecc.) per rispondere a domande morfologiche. Questo potrebbe fornire approfondimenti e direzione nella morfologia degli astrociti e nelle sue implicazioni funzionali, che potrebbero essere analizzate ulteriormente mediante microscopia luminosa super-risoluzione o microscopia elettronica4. Ad esempio, LY iontohoresis fornisce un mezzo per visualizzare processi astrociti fini, che contattano migliaia di sinapsi e sono coinvolti in funzioni sinaptiche. Lo studio di come la struttura di questi processi cambia in diverse condizioni patologiche potrebbe aiutare a chiarire i ruoli degli astrociti nella salute e nella malattia. LY iontohoresis è una tecnica importante per visualizzare la morfologia cellulare dettagliata e caratterizzare le proprietà degli astrociti per comprendere meglio le loro funzioni nel sistema nervoso centrale.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano la signora Soto, il dottor Yu e il dottor Octeau per la guida e i commenti sul testo. Questo lavoro è supportato da NS060677.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% Buffered Formalin Phosphate | Fisher | SF 100-20 | An identical alternative can be used |
| Acrodisc Syringe Filters with Supor Membrane | Pall | 4692 | An identical alternative can be used |
| Ag/AgCl ground pellet | WPI | EP2 | A similar alternative can be used |
| Alexa Fluor 546 goat anti-chicken IgG (H+L) | Thermo Scientific | A-11040 | A similar alternative can be used |
| Alexa Fluor 647 goat anti-rabbit IgG (H+L) | Thermo Scientific | A27040 | A similar alternative can be used |
| Anti Aquaporin-4 antibody | Novus Biologicals | NBP1-87679 | A similar alternative can be used |
| Anti GFAP antibody | Abcam | ab4674 | A similar alternative can be used |
| Borosilicate glass pipettes with filament | World precision instruments | 1B150F-4 | |
| C57BL/6NTac mice | Taconic Stock | B6 | A similar alternative can be used |
| Calcium Chloride | Sigma | 21108 | An identical alternative can be used |
| Confocal laser-scanning microscope | Olympus | FV1000MPE | A similar alternative can be used |
| D-glucose | Sigma | G7528 | An identical alternative can be used |
| Disodium Phosphate | Sigma | 255793 | An identical alternative can be used |
| Electrode puller- Model P-97 | Sutter | P-97 | A similar alternative can be used |
| Fluoromount-G | Southern Biotech | 0100-01 | An identical alternative can be used |
| Heparin sodium injection (1,000 USP per mL) | Sagent Pharmaceuticals | 400-10 | An identical alternative can be used |
| Imaris software (Version 7.6.5) | Bitplane Inc. | A similar alternative can be used | |
| Isofluorane | Henry Schein Animal Health | 29404 | An identical alternative can be used |
| Lidocaine Hydrochloride Injectable (2%) | Clipper | 1050035 | An identical alternative can be used |
| Lucifer Yellow CH dilithium salt | Sigma | L0259 | |
| Lucifer Yellow CH dipotassium salt | Sigma | L0144 | |
| Magnesium Chloride | Sigma | M8266 | An identical alternative can be used |
| Microscope Cover Glass | Thermo Scientific | 24X60-1 | An identical alternative can be used |
| Microscope Slides | Fisher | 12-544-2 | An identical alternative can be used |
| Normal Goat Serum | Vector Laboratories | S-1000 | An identical alternative can be used |
| Objective lens (40x) | Olympus | LUMPLFLN 40XW | A similar alternative can be used |
| Objective lens (60x) | Olympus | PlanAPO 60X | A similar alternative can be used |
| PBS tablets, 100 mL | VWR | VWRVE404 | An identical alternative can be used |
| Pipette micromanipulator- Model ROE-200 | Sutter | MP-285 / ROE-200 / MPC-200 | A similar alternative can be used |
| Potassium Chloride | Sigma | P3911 | An identical alternative can be used |
| Sodium Bicarbonate | Sigma | S5761 | An identical alternative can be used |
| Sodium Chloride | Sigma | S5886 | An identical alternative can be used |
| Stimulator- Model Omnical 2010 | World precision instruments | Omnical 2010 | A similar alternative can be used |
| Triton X 100 | Sigma | T8787 | An identical alternative can be used |
| Vibratome- Model #3000 | Pelco | 100-S | A similar alternative can be used |
Riferimenti
- Khakh, B. S., Sofroniew, M. V. Diversity of astrocyte functions and phenotypes in neural circuits. Nature Neuroscience. 18 (7), 942-952 (2015).
- Ben Haim, L., Rowitch, D. H. Functional diversity of astrocytes in neural circuit regulation. Nature Reviews Neuroscience. 18 (1), 31-41 (2017).
- Schiweck, J., Eickholt, B. J., Murk, K. Important Shapeshifter: Mechanisms Allowing Astrocytes to Respond to the Changing Nervous System During Development, Injury and Disease. Frontiers in Cellular Neuroscience. 12, 261 (2018).
- Chai, H., et al. Neural Circuit-Specialized Astrocytes: Transcriptomic, Proteomic, Morphological, and Functional Evidence. Neuron. 95 (3), 531-549 (2017).
- Sun, D., Jakobs, T. C. Structural remodeling of astrocytes in the injured CNS. Neuroscientist. 18 (6), 567-588 (2012).
- Naskar, S., Chattarji, S. Stress Elicits Contrasting Effects on the Structure and Number of Astrocytes in the Amygdala versus Hippocampus. eNeuro. 6 (1), (2019).
- Sun, D., Lye-Barthel, M., Masland, R. H., Jakobs, T. C. The morphology and spatial arrangement of astrocytes in the optic nerve head of the mouse. Journal of Comparative Neurology. 516 (1), 1-19 (2009).
- Grosche, A., et al. Versatile and simple approach to determine astrocyte territories in mouse neocortex and hippocampus. PLoS ONE. 8 (7), 69143 (2013).
- Kaynig, V., et al. Large-scale automatic reconstruction of neuronal processes from electron microscopy images. Medical Image Analysis. 22 (1), 77-88 (2015).
- Bushong, E. A., Martone, M. E., Jones, Y. Z., Ellisman, M. H. Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. Journal of Neuroscience. 22 (1), 183-192 (2002).
- Wilhelmsson, U., et al. Redefining the concept of reactive astrocytes as cells that remain within their unique domains upon reaction to injury. Proceedings of the National Academy of Sciences of the United States of America. 103 (46), 17513-17518 (2006).
- Williams, M. E., et al. Cadherin-9 regulates synapse-specific differentiation in the developing hippocampus. Neuron. 71 (4), 640-655 (2011).
- Ogata, K., Kosaka, T. Structural and quantitative analysis of astrocytes in the mouse hippocampus. Neuroscience. 113 (1), 221-233 (2002).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Hubbard, J. A., Hsu, M. S., Seldin, M. M., Binder, D. K. Expression of the Astrocyte Water Channel Aquaporin-4 in the Mouse Brain. ASN Neuro. 7 (5), (2015).
- Benediktsson, A. M., et al. Ballistic labeling and dynamic imaging of astrocytes in organotypic hippocampal slice cultures. Journal of Neuroscience Methods. 141 (1), 41-53 (2005).
- Fouquet, C., et al. Improving axial resolution in confocal microscopy with new high refractive index mounting media. PLoS ONE. 10 (3), 0121096 (2015).
- Luna, G., et al. Astrocyte structural reactivity and plasticity in models of retinal detachment. Experimental Eye Research. 150, 4-21 (2016).
- Octeau, J. C., et al. An Optical Neuron-Astrocyte Proximity Assay at Synaptic Distance Scales. Neuron. 98 (1), 49-66 (2018).
- Sosunov, A. A., et al. Phenotypic heterogeneity and plasticity of isocortical and hippocampal astrocytes in the human brain. Journal of Neuroscience. 34 (6), 2285-2298 (2014).
- Park, Y. M., et al. Astrocyte Specificity and Coverage of hGFAP-CreERT2 [Tg(GFAP-Cre/ERT2)13Kdmc] Mouse Line in Various Brain Regions. Experimental Neurobiology. 27 (6), 508-525 (2018).
- Koeppen, J., et al. Functional Consequences of Synapse Remodeling Following Astrocyte-Specific Regulation of Ephrin-B1 in the Adult Hippocampus. Journal of Neuroscience. 38 (25), 5710-5726 (2018).
- Jefferis, G. S., Livet, J. Sparse and combinatorial neuron labelling. Current Opinion in Neurobiology. 22 (1), 101-110 (2012).
- Lanjakornsiripan, D., et al. Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications. 9 (1), 1623 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon