Method Article
Analisi della localizzazione snRNA Spliceosomic nelle cellule umane di Hela utilizzando la microiniezione
In questo articolo
Riepilogo
La biogenesi degli snRNA sillitipici è un processo complesso che coinvolge vari compartimenti cellulari. Qui, abbiamo impiegato la microiniezione di snRNA fluorescenti per monitorare il loro trasporto all'interno della cellula.
Abstract
La biogenesi degli snRNA sillitipici è un processo complesso che coinvolge fasi nucleari e citoplasmatiche e l'ultimo passo si verifica in un compartimento nucleare chiamato corpo di Cajal. Tuttavia, le sequenze che indirizzano la localizzazione dello snRNA in questa struttura subnucleare non sono note fino a poco tempo fa. Per determinare sequenze importanti per l'accumulo di snRNA nei corpi di Cajal, abbiamo impiegato microiniezione di snRNA fluorescenti etichettati in modo fluorescente seguito dalla loro localizzazione all'interno delle cellule. In primo luogo, abbiamo preparato mutanti di delezione snRNA, sintetizzato modelli di DNA per la trascrizione in vitro e snRNA trascritti in presenza di UTP accoppiati con Alexa488. Gli snRNA etichettati sono stati miscelati con 70 kDa-Dextran coniugati con TRITC, e microiniettati al nucleo o al citoplasma delle cellule umane di HeLa. Le cellule sono state incubate per 1 h e fissa e la bobina del marcatore del corpo di Cajal è stata visualizzata mediante immunoororescenza indiretta, mentre snRNA e dextran, che funge da marcatore di iniezione nucleare o citoplasmica, sono stati osservati direttamente utilizzando un microscopio a fluorescenza. Questo metodo consente di testare in modo efficiente e rapido il modo in cui le varie sequenze influenzano la localizzazione dell'RNA all'interno delle cellule. Qui, mostriamo l'importanza della sequenza di legame Sm per una localizzazione efficiente degli snRNA nel corpo di Cajal.
Introduzione
Lo splicing dell'RNA è uno dei passi cruciali nell'espressione genica, catalizzata da un grande complesso di ribonucleoproteina chiamato slicsome. In totale, più di 150 proteine e 5 piccoli RNA nucleari (snRNA) sono integrati nello spliceosome nelle diverse fasi del percorso di giunzione. U1, U2, U4, U5 e U6 snRNA stanno partecipando alla giunzione dei principali introni GU-AG. Questi snRNA si uniscono allo spliceo come piccole particelle di ribonucleoproteina nucleare preformate (snRNP) che contengono snRNA, sette proteine Sm associate allo snRNA (o alle proteine Like-Sm, che si associano allo snRNA U6) e 1-12 proteine specifiche per ogni snRNP.
L'assemblaggio di snRNP comporta stadi citoplasmatici e nucleari. Lo snRNA appena trascritto viene esportato nel citoplasma dove acquisisce un anello assemblato da sette proteine Sm. L'anello Sm successivamente funge da segnale per la reimportazione dello snRNA nel nucleo. Gli snRNA difettosi che non riescono ad associarsi alle proteine Sm vengono conservati nel citoplasma1. Gli snRNP appena importati appaiono per la prima volta nel corpo di Cajal dove incontrano proteine specifiche snRNP e terminano la loro maturazione (rivisto nel riferimento2,3). Recentemente abbiamo dimostrato che l'inibizione delle fasi di maturazione finale si traduce nel sequestro di snRNP immaturi nei corpi di Cajal4,5. Abbiamo proposto un modello in cui la maturazione finale dello snRNP è sotto controllo di qualità che monitora l'aggiunta di proteine specifiche snRNP e la formazione di snRNP attivi. Tuttavia, i dettagli molecolari di come le cellule distinguono tra particelle immature mature e aberranti correttamente assemblate rimangono sfuggenti.
Per determinare le sequenze di snRNA che sono essenziali per il targeting e l'accumulo di snRNA nei corpi nucleari di Cajal, abbiamo deciso di impiegare la microiniezione di snRNA fluorescentmente etichettati. La microiniezione è stato un metodo di scelta perché: 1) non richiede un tag di sequenza aggiuntivo per distinguere gli snRNA sintetici che formano le loro controparti endogene, il che è particolarmente importante per gli RNA brevi con poco spazio per l'inserimento di sequenze di tag extra; 2) permette l'analisi di sequenze che sono importanti per la biogenesi. Ad esempio, la sequenza Sm è essenziale per l'assemblaggio dell'anello Sm e reimportata nel nucleo6. Quando i snRNA sono espressi nella cellula, i snRNA privi della sequenza Sm sono degradati nel citoplasma e non raggiungono il nucleo e i corpi Cajal7. Tuttavia, gli snRNA senza la sequenza Sm possono essere microiniettati direttamente nel nucleo e quindi un potenziale ruolo della sequenza Sm nella localizzazione del corpo di Cajal analizzato.
Qui, descriviamo in dettaglio un metodo di microiniezione che abbiamo applicato per determinare le sequenze snRNA necessarie per indirizzare gli snRNA nel corpo di Cajal5. Abbiamo dimostrato che i siti di legame Sm e SMN sono insieme necessari e sufficienti per localizzare non solo snRNA ma vari RNA brevi non codificanti nel corpo di Cajal. Sulla base di microiniezione e di altre prove, abbiamo proposto che l'anello Sm assemblato sul sito di rilegatura Sm è il segnale di localizzazione del corpo Cajal.
Protocollo
1. Preparazione di snRNA per microiniezione
- Preparare un modello di DNA contenente la versione a lunghezza intera o troncata/mutata di snRNA da PCR utilizzando una seguente configurazione PCR: 98 C per 60 s, 98 s per 15 s, 68 gradi C per 30 s, 72 s per 1 min, 98 S per 15 s per 35x e 72 gradi centigradi per 5 min.
- Il primer in avanti deve contenere una sequenza promotore per la trascrizione in vitro appena a monte del primo nucleotide trascritto. Amplifica la sequenza di snRNA U2 usando il primer in avanti contenente il promotore T7 e il primer inverso, che termina con l'ultimo nucleotide trascritto (vedi Tabella dei materiali per i dettagli).
- Sintetizzare snRNA utilizzando un kit per breve sintesi dell'RNA (vedere Tabella dei materiali per i dettagli) contenente la polimerasi dell'RNA T7. Aggiungere 1 mM ATP, 1 mM CTP, 1 mM GTP, 0,8 mM UTP, 0,2 mM UTP-Alexa488, 1,8 mM trimethylguanosine cap analogico (m32,2,7G(5')ppp(5')G), 1 mL di un inibitore dell'RNA e 500-700 ng del modello di DNA per la miscela di reazione e incubazione a 37 C.
- Aggiungere 1 L (2U) di DNase nella reazione e incubare per ulteriori 15 min a 37 gradi centigradi.
- Isolare lo snRNA mediante estrazione di fenolo acido/cloroformio. Rimuovere la fase superiore dell'acqua e aggiungere 1/10 del volume originale di acetato di sodio da 3 M (pH - 5,2), 3 litri di glicogeno per una migliore visualizzazione del pellet e 2,5 volumi di 100% di etanolo. Incubare per 1 h a -80 gradi centigradi, centrifugare per 10 min a 14.000 x g e 4 gradi centigradi.
- Lavare il pellet con il 70% di etanolo e sciogliere in 12 gradi di acqua priva di nuclea. La solita resa dell'RNA era di circa 600 ng/mL. Conservare a -80 gradi centigradi.
- Monitorare l'integrità delle snRNA trascritte in vitro da elettrofori gel agarose.
- Prima della microiniezione, diluire l'RNA alla concentrazione finale 200 ng/mL in acqua contenente 10 g/L dextran-TRITC 70 kDa.
2. Celle
- Prima dell'uso, trattare i copricopro con 1 M HCl per 1 h, lavare accuratamente in acqua distillata e conservare in 100% etanolo. Il trattamento acido promuove l'adesione delle cellule per prevenire il peeling cellulare durante o dopo l'iniezione. Per facilitare l'identificazione delle cellule iniettate, utilizzare un coverslip con una griglia.
- Seme HeLa o altre cellule aderenti 1 giorno prima della microiniezione su copricapelli 12 mm (n. 1 o 1,5) per raggiungere il 50% di confluenza al momento della microiniezione.
3. Iniezione
NOT: Le cellule di HeLa sono state microiniettate nel Dulbecco's Modified Eagle Medium (D-MEM, 4,5 g/L D-glucosio contenente fenolo rosso e antibiotici). L'iniezione è stata effettuata utilizzando un iniettore e un micromanipolatore dotato dell'ago sterile (vedi Tabella dei materiali per i dettagli). L'intero sistema microscopico/micromanipolatore è stato preriscaldato a 37 gradi per almeno 4 h per prevenire la fluttuazione di singole parti del microscopio e del microiniettore.
- Mettere il piatto Petri (30 mm) contenente 2 mL di supporti di coltura con la coverslip al centro nel supporto del microscopio. Caricare 3 -L l di miscela di snRNA nell'ago utilizzando un microloader. Installare l'ago nel supporto del microiniettore in 45 gradi rispetto alla superficie della parabola Petri.
- Per trovare l'ago, utilizzare un obiettivo a lunga distanza 10x. In primo luogo, impostare la velocità COARSE sull'iniettore e abbassare l'ago fino a toccare il mezzo di coltura. Utilizzando il binocolo al microscopio, trovare il punto luminoso, che è il luogo in cui l'ago tocca il mezzo di coltura.
- Modificare la velocità in FINE e abbassare ulteriormente l'ago mentre si guarda al microscopio fino a quando non viene osservata la punta dell'ago. Spostare l'ago nel mezzo del campo visivo e passare a un obiettivo di 40 volte a lunga distanza.
- Dopo aver modificato l'obiettivo, selezionare la cella e spostare l'ago sopra questa cella. Impostare le pressioni e il tempo per il contatto cellulare (vedere Suggerimenti e risoluzione dei problemi nella discussione).
- Spostare l'ago verso il basso nella cella e quindi impostare il limite inferiore sul micromanipolatore. Fare attenzione a non spostare l'ago sotto la cella.
- Dopo aver impostato il limite inferiore, spostare l'ago indietro sopra la cella e premere il pulsante di iniezione sul joystick dell'iniettore. L'ago si muove automaticamente all'interno della cellula nel punto in cui è impostato il limite e inietta la miscela di RNA.
- Per finire, premere il pulsante MENU sull'iniettore e rimuovere l'ago dal supporto. Quindi scollegare il tubo dall'iniettore prima di spegnere l'iniettore e il micromanipolatore.
4. Fissazione e colorazione delle cellule
- Dopo la microiniezione, riportare le cellule in un'incubatrice di CO2 e incubare a 37 gradi centigradi per 1 h.
- Dopo l'incubazione, sciacquare le cellule tre volte con soluzione salina tampolata di fosfato (PBS) a temperatura ambiente, fissare per 20 min con 4% paraformaldeide in 0,1 M PIPES pH 6,9, e lavare tre volte con temperatura ambiente PBS. Se viene analizzata solo la localizzazione dello snRNA, sciacquare brevemente le cellule in acqua e montare in un supporto di montaggio con DAPI.
- In caso di ulteriore localizzazione delle proteine, permeabilizzare le cellule con 0,5% Triton-X100 in PBS per 5 min a temperatura ambiente. Dopo tre risciacqui con PBS, incubare le cellule con anticorpi primari e secondari e dopo i lavamenti finali in PBS e un breve risciacquo in acqua, montare in un supporto di montaggio con DAPI.
5. Microscopia
- Se non viene immagine subito dopo il montaggio, conservare i vetrini a 4 gradi centigradi fino all'imaging.
- Acquisire immagini utilizzando un sistema microscopico a fluorescenza di fascia alta dotato di un obiettivo di immersione (60X o 100x/1.4NA).
- Una volta identificate le cellule microiniettate, raccogliere una pila di 20 z-sezioni con passaggi da 200 nm z per campione e soggetti a deconvoluzione matematica. Sono state poi presentate proiezioni massime o singole pile di z.
- Per quantificare il segnale fluorescente, disegnare Regione di Interesse (ROI) intorno a un corpo cajal identificato dall'immunostaining a bobina. Misurare l'intensità del segnale snRNA nel ROI definito dalla bobina. Successivamente determinare l'intensità della fluorescenza snRNA nel ROI collocato in modo casuale nel nucleoclasmo e calcolare il rapporto del segnale di RNA nel corpo di Cajal e nucleoclasmo.
Risultati
Per monitorare la localizzazione dello snRNA e il ruolo del sito di legame Sm nel targeting del corpo di Cajal, abbiamo preparato un modello di DNA contenente il promotore T7 e il snRNA U2 o U2 a piena lunghezza che mancano i sette nucleotidi (AUUUUUGUG) che formano il sito di legame Sm. gli snRNA sono stati trascritti in vitro, isolati e mescolati con dextran-70kDa accoppiato a TRITC. Abbiamo microiniettato la miscela contenente snRNA trascritto in vitro nel nucleo o il citoplasma delle cellule HeLa.
È stato dimostrato in precedenza che il sito di rilegatura Sm è necessario per l'importazione nucleare6. Per verificare se il sito Sm è importante anche per l'accumulo del corpo di Cajal, abbiamo microiniettato snRNA manca il sito Sm direttamente nel nucleo (Figura 1A). L'iniezione nel citoplasma serviva come controllo (Figura 1B). Come controllo positivo, abbiamo microiniettato full-length snRNA (Figura 1C,D). Dopo 60 min di incubazione in un'incubatrice di CO2, le cellule microiniettate sono state fissate e la bobina del marcatore del corpo Cajal è stata visualizzata dall'immunofluorescenza indiretta. Lo snRNA a tutta lunghezza è stato accumulato nei corpi di Cajal dopo iniezioni nucleari e citoplasmiche. Al contrario, snRNA privo del sito Sm è rimasto nel citoplasma dopo microiniezione in questo compartimento, che è coerente con i risultati precedenti6. La microiniezione nucleare di snRNA senza il sito Sm ha rivelato che la sequenza di legame Sm è importante per la localizzazione del corpo di Cajal. U2 snRNA privo del sito Sm è rimasto nel nucleo, ma non si è accumulato nei corpi di Cajal (Figura 1A).
A volte, la microiniezione in un solo compartimento cellulare non è riuscita e TRICT-dextran-70kDa è stato trovato sia nel nucleo che nel citoplasma (Figura 2A). Queste cellule sono state scartate da ulteriori analisi. Nonostante il fatto che i snRNA fluorescenti etichettati con etichettatura siano immagazzinati a -80 gradi centigradi prima dell'iniezione, può verificarsi una degradazione dell'RNA. Lo snRNA degradato iniettato nel citoplasma non viene trasportato nel nucleo e rimane localizzato nel citoplasma (Figura 2B). Tale snRNA dovrebbe essere scartato e il nuovo snRNA dovrebbe essere sintetizzato.

Figura 1: localizzazione di snRNA microiniettati. Alexa488-etichettato U2 snRNA mancante del sito Sm (A,B) o full-length (C,D) sono stati microiniettati nel citoplasma o nel nucleo delle cellule di HeLa. I corpi di Cajal (frecce) sono contrassegnati da immunolabeling della bobina (rosso); snRNA sono raffigurati in verde. Dextran-TRITC-70kDa (giallo) è stato utilizzato per monitorare l'iniezione nucleare o citoplasmatica; Il DNA è stato macchiato da DAPI (blu). Le punte di freccia indicano la localizzazione citoplasmica di snRNA. Barra della scala: 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
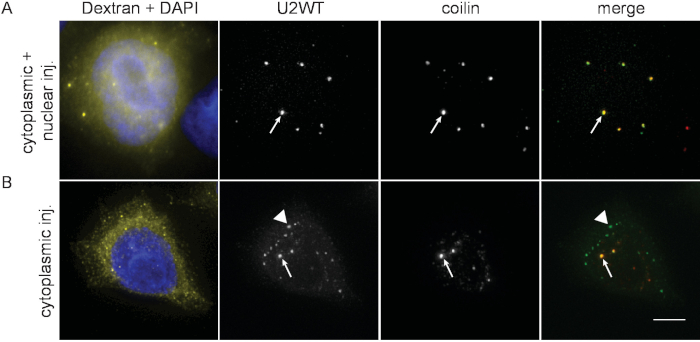
Figura 2: Una potenziale insidia dell'approccio di microiniezione. (A) La microiniezione in un compartimento si è guastata e il snRNA WT U2 è stato microiniettato sia nel citoplasma che nel nucleo. Si noti che Dextran-TRITC-70kDa (giallo) è presente in entrambi i compartimenti cellulari. (B) WT U2 snRNA è stato microiniettato nel citoplasma delle cellule HeLa (verde) ma una quantità significativa di snRNA è rimasta nel citoplasma (arrowheads), che indica una degradazione parziale dello snRNA iniettato e una perdita del sito di legame Sm. I corpi cajal (frecce) sono contrassegnati da immunolabeling a bobina (rosso). Il DNA è stato macchiato da DAPI (blu). Barra della scala: 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo impiegato la microiniezione di snRNA fluorescenti per determinare sequenze importanti per la localizzazione del snRNA nei corpi nucleari di Cajal. Grazie alla rapida e piuttosto semplice preparazione degli RNA etichettati (preparazione del modello di DNA da PCR seguita dalla trascrizione in vitro) il metodo offre un'analisi efficace di come le varie sequenze contribuiscono alla localizzazione dell'RNA. In tempi relativamente brevi, siamo stati in grado di analizzare dieci diverse eliminazioni o sostituzioni dello snRNA U2 (riferimento5 e dati non mostrati). Per gli RNA con un percorso di biogenesi complesso, questo approccio consente anche di testare sequenze essenziali per la maturazione. Nel caso dei snRNA, la cancellazione delle sequenze di legame Sm, necessarie per l'assemblaggio dell'anello Sm, comporta il sequestro e la degradazione delle snRNA mutate nel citoplasma7. Altri vantaggiosi includono che due RNA etichettati in modo diverso possono essere iniettati simultaneamente e la loro localizzazione direttamente confrontata all'interno di una cella. Tuttavia, poiché vari fluorocromi potrebbero modificare il comportamento dell'RNA, ogni fluorocro deve essere testato singolarmente prima di esperimenti di doppia etichettatura. Gli RNA di diverse centinaia di nucleotidi di lunghezza sono stati iniettati con successo e la loro localizzazione è stata saggiata in vari sistemi modello (rivisti nel riferimento8). Il passo limitante in caso di RNA più lunghi è di solito in sintesi in vitro dell'RNA a lunghezza intera. Inoltre, l'iniezione di RNA con proteine preassemblate può essere applicata per testare l'effetto delle singole proteine sulla localizzazione degli RNP. Nei nostri progetti, abbiamo iniettato snRNA associato alle proteine Sm per confermare il ruolo dell'anello Sm nella localizzazione del corpo di Cajal5. Infine, la microiniezione di RNA fluorescenti etichettati consente la quantificazione diretta senza ulteriori passaggi, come è stato precedentemente applicato per i snRNA9.
Ci sono anche diversi svantaggi dei metodi che dovrebbero essere considerati prima di lanciare un progetto di microiniezione. In primo luogo, nonostante alcune automazioni del processo di microiniezione, il metodo richiede ancora abilità ed esperienza manuali e i ricercatori dovrebbero considerare il tempo necessario per la formazione. Le parti critiche del protocollo sono la preparazione di RNA intatti, microiniezione e quindi trovare cellule iniettate nel microscopio (vedere Suggerimenti e risoluzione dei problemi di seguito). In secondo luogo, la microiniezione rappresenta uno stress significativo e molte cellule non sopravvivono per un periodo di tempo più lungo. Mentre ci sono alcuni tentativi riusciti di seguire gli RNA microiniettati all'interno delle cellule mediante l'imaging a cellule vive10, abbiamo osservato un aumento significativo della morte cellulare quando abbiamo combinato la microiniezione con l'imaging a cellule vive utilizzando la microscopia a fluorescenza. In terzo luogo, la quantità di RNA iniettato nelle cellule umane è molto bassa, il che impedisce l'analisi biochimica degli RNA iniettati. Questo significa anche che è difficile monitorare come l'incorporazione di nucleotidi fluorescenti etichettati influisce sulle funzioni dell'RNA. Pertanto, vari rapporti di etichettatura-NTP:NTP dovrebbero essere incorporati nell'RNA wild-type e la sua localizzazione analizzata per ottenere il rapporto ideale tra il segnale di fluorescenza e la funzionalità dell'RNA etichettato. Inoltre, la natura del fluorocro potrebbe influenzare la localizzazione dell'RNA. Nelle nostre mani, Alexa488-UTP ha funzionato molto meglio di Alexa546-UTP. Non abbiamo esplorato ulteriormente queste differenze, ma una ragione potrebbe essere una dimensione più grande e una forma diversa di Alexa546 rispetto ad Alexa488.
Prendendo insieme, la microiniezione di RNA è un metodo potente per la localizzazione dell'RNA, ma dovrebbe essere sempre combinata con approcci alternativi. Nel nostro caso, abbiamo introdotto con successo il sito di legame MS2 nello snRNA U2, abbiamo monitorato la sua localizzazione utilizzando MS2-YFP e confermato alcuni risultati chiave ottenuti dalla microiniezione di snRNA con il sistema MS25 .
Suggerimenti e risoluzione dei problemi
La pressione di iniezione, la pressione di compensazione e il tempo di iniezione devono essere determinati sperimentalmente per ogni linea cellulare. Abbiamo applicato la pressione di iniezione (Pi) 170 hPa e la pressione di compensazione (Pc) 50 hPa nel caso di microiniezione citoplasmatica e Pi200 hPa e Pc-80 hPa nel caso della microiniezione nucleare. Il tempo di iniezione è stato in entrambi i casi impostato su 0,2 s. A volte è possibile osservare un leggero movimento di materiale all'interno della cellula, che è un'indicazione di un'iniezione di successo. Se la cellula scoppia, è necessario diminuire la pressione di iniezione. Si consiglia inoltre di controllare la pressione di compensazione tramite il canale di fluorescenza TRITC. Quando vedi il flusso forte che esce dalla punta dell'ago, quindi diminuisci la pressione di compensazione.
Tra le iniezioni, controllare sempre se le cellule sono iniettate con successo. Identificare le cellule microiniettate tramite Dextran-TRITC iniettato utilizzando il canale di fluorescenza TRITC. Se non si vede alcuna cellula microiniettata, in primo luogo aumentare la pressione di iniezione e il tempo di iniezione. In secondo luogo, verificare se l'ago non è collegato tramite canale a fluorescenza (TRITC). Se vedete Dextran-TRITC debolmente in streaming dalla punta dell'ago, quindi l'ago è funzionale, e il problema è probabilmente nell'impostazione del limite inferiore per l'iniezione. L'impostazione del limite è un passo molto difficile e importante. Ogni cellula ha una forma diversa e si vuole cambiare il limite molto spesso per garantire una corretta microiniezione.
Nel caso ideale, si dovrebbe essere in grado di microiniettare le cellule da 50 dollari prima che la punta dell'ago sia collegata con detriti cellulari. Controllare se la fluorescenza esce regolarmente dalla punta, e se non si vede alcun Dextran-TRITC in streaming dalla punta, quindi l'ago è bloccato. Per pulirlo, tenere premuto il pulsante CLEAN sull'iniettore per 3 s, che aumenta la pressione e dovrebbe rimuovere il blocco. Se non aiuta, allora si potrebbe provare a rompere la punta dell'ago colpendo il fondo del piatto Petri. Tuttavia, questa è una procedura molto difficile, che richiede una notevole quantità di esperienza e non vi è alcuna garanzia di successo. Pertanto, per i principianti, lo scambio di aghi è consigliabile.
Prima di scambiare l'ago, premere il tasto MENU sull'iniettore. Prendere l'ago un po 'su e premere HOME sul micromanipolatore. L'ago andrà tutta la strada dal mezzo, ma il micromanipolatore ricorda la posizione originale dell'ago e non è necessario trovare di nuovo l'ago. Quando l'ago viene sostituito, premere il pulsante HOME e l'ago andrà nella posizione originale e si dovrebbe essere in grado di vedere la punta dell'ago al microscopio. Dopo aver cambiato l'ago, è necessario regolare il limite. Quindi, premere nuovamente il pulsante MENU sull'iniettore e l'ago viene preparato per la microiniezione.
Durante l'imaging, la parte più difficile è trovare le cellule microiniettate. Per localizzarli, utilizzare il canale TRITC, dove il TriTC-coniugato Dextran-70kDa è molto meglio visibile di un debole segnale Alexa488 di snRNA microiniettati. I copricopertine con una griglia sono utili qui.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Czech Science Foundation (18-10035S), dal National Sustainability Program I (LO1419), dal sostegno istituzionale (RVO68378050), dal Fondo europeo di sviluppo regionale (C..02.1.01/0.0/0.0/16_013/0001775) e dall'Agenzia Università Charles (GAUK 134516). Riconosciamo inoltre lo strumento Light Microscopy Core Facility, IMG CAS, Praga, Repubblica Ceca (supportato da sovvenzioni (Czech-Bioimaging - LM2015062).
Materiali
| Name | Company | Catalog Number | Comments |
| ChromaTide Alexa fluor 488-5-UTP | ThermoFisher | C11403 | Stock concentration 1 mM |
| Dulbecco's Modified Eagle Medium - high glucose | Sigma-Aldrich | D5796 | Containing 4.5 g⁄L D-glucose, Phenol red and antibiotics |
| FemtoJet express Injector | Eppendorf | 5247000013 | |
| Femtotips II | Eppendorf | 930000043 | Microinjection needle of 0.5 µm inner and 0.7 µm outer diameter |
| Fluoromont G with DAPI | SouthernBiotech | 0100-20 | |
| Glycogen | ThermoFisher | AM9510 | Stock concentration 5 mg/mL |
| Gridded Glass Coverslips | Ibidi | 10817 | Coverslips with a grid, no direct experience with them |
| InjectMan NI 2 Micromanipulator | Eppendorf | 5181000017 | |
| m3-2,2,7G(5')ppp(5')G trimethyled cap analogue | Jena Bioscience | NU-853-1 | Stock concentration 40 mM |
| MEGAshortscript T7 Transcription Kit | ThermoFisher | AM1354 | |
| Microscope Cover Glasses 12 mm, No. 1 | Paul Marienfeld GmbH | 111520 | For routine work |
| Microscope Cover Glasses 12 mm, No. 1.5 | Paul Marienfeld GmbH | 117520 | For high resolution images |
| Microscope DeltaVision | GE Healthcare | For image acquisition | |
| Microscope DMI6000 | Leica | For microinjection | |
| Paraformaldehyde 32% solution EM grade | EMS | 15714 | Dissolved in PIPES to the final concentration 4% |
| Phenol:Chloroform 5:1 | Sigma-Aldrich | P1944 | |
| Primers for U2 amplification: Forward: 5’-TAATACGACT CACTATAGGGATCGCTTCT CGGCCTTTTGG, Reverse: 5´ TGGTG CACCGTTCCTGGAGGT | Sigma-Aldrich | T7 rpromoter sequence in italics | |
| Phusion High Fidelity DNA polymerase | BioLab | M0530L | |
| RNasin Plus | Promega | N2615 | Stock concentration 40 mM |
| Tetramethylrhodamine isothiocyanate Dextran 65-85 kDa | Sigma-Aldrich | T1162 | Dissolved in water, stock concentration 1 mg/mL |
| Triton-X100 | Serva | 37240 | Dissolved in water, stock concentration 10% |
Riferimenti
- Ishikawa, H., et al. Identification of truncated forms of U1 snRNA reveals a novel RNA degradation pathway during snRNP biogenesis. Nucleic Acids Research. 42 (4), 2708-2724 (2014).
- Stanek, D. Cajal bodies and snRNPs - friends with benefits. RNA Biology. 14 (6), 671-679 (2017).
- Stanek, D., Fox, A. H. Nuclear bodies: news insights into structure and function. Curentr Opinion in Cell Biology. 46, 94-101 (2017).
- Novotny, I., et al. SART3-Dependent Accumulation of Incomplete Spliceosomal snRNPs in Cajal Bodies. Cell Reports. 10, 429-440 (2015).
- Roithova, A., et al. The Sm-core mediates the retention of partially-assembled spliceosomal snRNPs in Cajal bodies until their full maturation. Nucleic Acids Research. 46 (7), 3774-3790 (2018).
- Fischer, U., Sumpter, V., Sekine, M., Satoh, T., Luhrmann, R. Nucleo-cytoplasmic transport of U snRNPs: definition of a nuclear location signal in the Sm core domain that binds a transport receptor independently of the m3G cap. EMBO Journal. 12 (2), 573-583 (1993).
- Shukla, S., Parker, R. Quality control of assembly-defective U1 snRNAs by decapping and 5'-to-3' exonucleolytic digestion. Proceeding of the National Academy of U S A. 111 (32), E3277-E3286 (2014).
- Weil, T. T., Parton, R. M., Davis, I. Making the message clear: visualizing mRNA localization. Trends in Cell Biology. 20 (7), 380-390 (2010).
- Klingauf, M., Stanek, D., Neugebauer, K. M. Enhancement of U4/U6 small nuclear ribonucleoprotein particle association in Cajal bodies predicted by mathematical modeling. Molecular Biology of the Cell. 17 (12), 4972-4981 (2006).
- Mhlanga, M. M., Vargas, D. Y., Fung, C. W., Kramer, F. R., Tyagi, S. tRNA-linked molecular beacons for imaging mRNAs in the cytoplasm of living cells. Nucleic Acids Research. 33 (6), 1902-1912 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon