Method Article
Pretargeted Radioimmunotherapy basato sulla reazione di Diels-Alder domanda inversa Electron
In questo articolo
Riepilogo
Questo protocollo descrive la sintesi e la caratterizzazione di un trans- ciclottene (TCO)-anticorpo e un radioligand tetrazine Lu-etichettati (Tz) 177per pretargeted radioimmunotherapy (PRIT) modifica. Inoltre, vi si descrive l'uso di questi due costrutti di biodistribuzione in vivo e studi longitudinali terapia in un modello murino di cancro colorettale.
Abstract
Mentre radioimmunoterapia (RIT) è un approccio promettente per il trattamento del cancro, l'emivita lunga farmacocinetica degli anticorpi radiomarcati può provocare dosi di alta radiazione ai tessuti sani. Forse non a caso, diverse strategie differenti sono state sviluppate per aggirare questa limitazione preoccupante. Uno dei più promettenti di questi approcci è pretargeted radioimmunotherapy (PRIT). PRIT si basa sul disaccoppiamento radionuclide dall'immunoglobulina, iniettando loro separatamente e quindi consentendo loro di combinare in vivo presso il tessuto bersaglio. Questo approccio sfrutta le eccezionali proprietà di targeting tumorale di anticorpi costeggiando i loro svantaggi farmacocinetiche, quindi riducendo le dosi di radiazione ai tessuti non bersaglio e facilitare l'uso di radionuclidi con emivite che sono considerato troppo breve per uso in radioimmunoconjugates tradizionale. Negli ultimi cinque anni, il nostro laboratorio ed altri hanno sviluppato un approccio in vivo pretargeting basato sulla reazione di Diels-Alder (IEDDA) dell'elettrone-domanda inversa tra trans- ciclottene (TCO) e tetrazine (Tz). Questa strategia è stata applicata con successo a pretargeted tomografia a emissione di positroni (PET) ed emissione del singolo-fotone tomografia (SPECT) imaging con una varietà di sistemi antigene-anticorpo. In un paio di pubblicazioni recenti, abbiamo dimostrato l'efficacia di PRIT basati su IEDDA in modelli murini di adenocarcinoma duttale pancreatico e carcinoma colorettale. In questo protocollo, descriviamo protocolli per PRIT utilizzando un 177Lu-DOTA-etichettati tetrazine radioligand ([177Lu] Lu-DOTA-PEG7- Tz) e una variante di TCO-modificato del cancro colorettale targeting huA33 anticorpo (huA33-TCO). Più specificamente, descriveremo la costruzione di huA33-TCO, la sintesi e radiolabeling [177Lu] Lu-DOTA-PEG7- Tz e le prestazioni di biodistribuzione in vivo e studi longitudinali terapia in modelli murini di carcinoma colorettale.
Introduzione
Radioimmunoterapia (RIT) — l'uso degli anticorpi per la consegna dei radionuclidi terapeutici ai tumori — è stata a lungo un seducente approccio per il trattamento di cancro1,2. Infatti, questa promessa è stata sottolineata dalla United States Food and Drug Administration l'approvazione di due radioimmunoconjugates per il trattamento del linfoma Non-Hodgkin: 90Y-ibritumomab tiuxetano e 131-tositumomab3 , 4. ma anche dai suoi primi giorni, le prospettive cliniche di RIT sono state ostacolate da una complicazione critica: intensità di dose elevata radiazione ai tessuti sani5,6. In generale, radioimmunoconjugates per RIT sono etichettati con radionuclidi piu ' longevi (ad es., 131io [t½ = 8,0 giorni] e 90Y [t½ = 2,7 giorni]) con emivite fisiche che si incastrano bene con il emivita lunga farmacocinetica delle immunoglobuline. Questo è essenziale, in quanto garantisce che la radioattività sufficiente rimane una volta che l'anticorpo ha raggiunto la biodistribuzione ottimale dopo diversi giorni di circolazione. Tuttavia, questa combinazione di tempi di permanenza lunga nel sangue ed emivita lunga fisica comporta inevitabilmente l'irradiazione dei tessuti sani, riducendo i rapporti terapeutici e limitare l'efficacia della terapia7. Diverse strategie sono state esplorate per aggirare questo problema, compreso l'uso di frammenti anticorpali troncato come Fab, Fab', punto2, minibodies e nanobodies8,9,10. Uno dei più promettenti e affascinante, ma innegabilmente complessi approcci alternativi è in vivo pretargeting11.
In vivo pretargeting è un approccio alla terapia che cerca di sfruttare la squisita affinità e selettività degli anticorpi bordando loro farmacocinetica inconvenienti11,12,13e imaging nucleare. A tal fine, l'anticorpo radioattivo utilizzato nel tradizionale radioimmunotherapy viene decostruito in due componenti: una piccola molecola radioligand e un immunoconjugate che può legarsi sia un antigene tumorale e il suddetto radioligand. Il immunoconjugate è iniettato prima e dato un 'vantaggio', spesso parecchi giorni, durante i quali si accumula nel tessuto bersaglio e Cancella dal sangue. Successivamente, la piccola molecola radioligand è amministrato e combina con il immunoconjugate al tumore o cancella rapidamente dal corpo. In sostanza, in vivo pretargeting si basa sulla esecuzione di radiochimica all'interno del corpo stesso. Riducendo la circolazione della radioattività, questo approccio riduce le dosi di radiazione ai tessuti sani e facilita l'uso di radionuclidi contemporaneamente (ad es., 68Ga, t½ = 68 min211; Come, t½ = 7,2 h) con emivite che in genere sono considerate incompatibili con i vettori di base di anticorpi.
A partire nel tardo 1980, sono stati sviluppati una manciata di diversi approcci per in vivo pretargeting, comprese strategie basate sugli anticorpi anticorpo, l'interazione tra streptavidina e biotina e l'ibridazione di complementari oligonucleotidi14,15,16,17,18. Eppure ognuno è stata frenata a vari gradi di complicazioni, più notoriamente l'immunogenicità potente di anticorpi streptavidina-modificato19,20. Negli ultimi cinque anni, il nostro gruppo e altri hanno sviluppato un approccio in vivo pretargeting basato sulla rapida e bioorthogonal inversa electron demand Diels-Alder legatura tra trans- ciclottene (TCO) e tetrazine (Tz) 21,22,23,24. Il maggior successo di queste strategie hanno impiegato un anticorpo TCO-modificato e un radioligand Tz-cuscinetto, come TCO è in genere più stabile in vivo oltre la Tz partner (Figura 1)25,26. Come in altre metodologie pretargeting, il immunoconjugate mAb-TCO è amministrato in primo luogo e dato il tempo di cancellare dalla circolazione e si accumulano nel tessuto del tumore. Successivamente, la piccola molecola Tz radioligand viene iniettato, dopo di che fa clic con il immunoconjugate all'interno del tessuto bersaglio o cancella rapidamente dal corpo. Questo in vivo pretargeting strategia si è dimostrato altamente efficace per PET e SPECT imaging con diversi sistemi di diversi anticorpi e antigeni, costantemente producendo immagini con contrasto elevato e consentendo l'uso di radionuclidi di breve durata come 18 F (t½ = 109 min) e 64Cu (t1/2 = 12.7 ore)21,22,24. Più recentemente, l'efficacia di basati su clic pretargeted radioimmunotherapy (PRIT) è stata dimostrata in modelli murini di adenocarcinoma duttale pancreatico (PDAC) e carcinoma colorettale27,28. A tal fine, i radionuclidi terapeutici 177Lu (βmax = 498 keV, t1/2 = 6,7 giorni) è stato impiegato in combinazione con due differenti anticorpi: 5B1, che si rivolge l'antigene carboidratico 19.9 (CA 19.9) espressa ubiquitariamente in PDAC , e huA33, che si rivolge A33, una glicoproteina transmembrana espressa in > 95% dei cancri colorettali. In entrambi i casi, questo approccio a 177Lu-PRIT ha reso le concentrazioni di alta attività nel tessuto del tumore, ha creato un effetto terapeutico dose-dipendente e contemporaneamente ridotte concentrazioni di attività in tessuti sani rispetto ai tradizionali direttamente-con l'etichetta radioimmunoconjugates.
In questo articolo, descriviamo i protocolli per PRIT utilizzando un 177Lu-DOTA-etichettati tetrazine radioligand ([177Lu] Lu-DOTA-PEG7- Tz) e una variante di TCO-modificato dell'anticorpo huA33 (huA33-TCO). Più specificamente, descriviamo la costruzione di huA33-TCO (Figura 2), la sintesi e radiolabeling [177Lu] Lu-DOTA-PEG7- Tz (Figura 3 e Figura 4) e le prestazioni di in vivo biodistribuzione e terapia longitudinale studi in modelli murini di carcinoma colorettale. Inoltre, nei risultati rappresentativi e discussione, presentiamo un set di dati campione, possibili strategie di indirizzo per l'ottimizzazione di questo approccio e considerare questa strategia nel contesto più ampio di in vivo pretargeting e PRIT. Infine, è importante notare che mentre abbiamo scelto di concentrarsi su pretargeting utilizzando huA33-TCO e [177Lu] Lu-DOTA-PEG7- Tz in questo protocollo, questa strategia è altamente modulare e può essere adattato per soddisfare una vasta gamma di anticorpi e radionuclidi.
Protocollo
Tutti in vivo animale esperimenti descritti in questo lavoro sono sono eseguiti secondo protocolli approvati ed eseguiti sotto la Guida di riferimento etica del Memorial Sloan Kettering Cancer Center, Weill Cornell Medical Center e Hunter College Istituzionale cura degli animali e uso comitati (IACUC).
1. la preparazione del huA33-TCO
Nota: La sintesi di huA33-TCO è stato precedentemente segnalati29. Tuttavia, per facilitare il lettore, viene replicata qui con regolazioni per condizioni ottimali.
- In un tubo del microcentrifuge 1,7 mL, preparare una soluzione di 125 μL di (E) - cyclooct - 4-enile 2,5-diosso-1-pyrrolidinyl carbonato (TCO-NHS) a secco di dimetilformammide (DMF) ad una concentrazione di 40 mg/mL (0,15 M). Questa soluzione può essere aliquotati e congelati a-80 ° C per uso negli esperimenti futuri.
- In un tubo del microcentrifuge separata 1,7 mL, preparare una soluzione di 5 mg/mL di huA33 in 1 mL di tampone fosfato salino (PBS; 2,7 mM 11,9 millimetri di fosfato di potassio, cloruro di potassio e cloruro di sodio 137 mM a pH 7,4).
- Utilizzando piccole aliquote (< 5 μL) di 0,1 M Na2CO3, regolare il pH della soluzione dell'anticorpo da passo 1.2 a 8,8-9.0. Utilizzare carta pH o un pH-metro con un microelettrodo per monitorare il pH e prestare attenzione che il pH non superi 9.0.
- Per la soluzione di anticorpo descritta al passaggio 1.3, aggiungere lentamente un volume corrispondente a 40 equivalenti molari di TCO-NHS rispetto alla quantità di anticorpo. Ad esempio, se 5 mg (30 nmol) di huA33 è la soluzione, aggiungere 9.0 μL (1.20 μmol) della soluzione di 40 mg/mL (0,15 M) di TCO-NHS.
Nota: TCO-NHS è idrofobo. Quando si aggiunge alla soluzione dell'anticorpo, aggiungere lentamente e con agitazione per impedire la precipitazione. Non superare il 10% DMF in volume della soluzione di reazione finale. - Consentire la reazione Incubare a 25 ° C su un thermomixer per 1 h con lieve agitazione (500 giri/min).
- Dopo 1 h, purificare il immunoconjugate huA33-TCO utilizzando una colonna di dissalazione esclusione dimensioni monouso pre-confezionati.
- Equilibrare la colonna di esclusione di dimensione come descritto dal fornitore per rimuovere eventuali conservanti presenti nella colonna durante la conservazione. Una procedura tipica prevede il lavaggio della colonna 5 x con un volume di PBS che corrisponde al volume della colonna: 5 x 2,5 mL di PBS.
- Aggiungere la miscela di reazione nella colonna di esclusione di dimensione notando il volume della miscela di reazione.
- Dopo la miscela di reazione è entrato la colonna, aggiungere una quantità appropriata di PBS per portare il volume totale della soluzione aggiunto alla colonna fino a 2,5 mL. Ad esempio, se la reazione di coniugazione è provocato da un volume totale di 1,3 mL, aggiungere 1,2 mL di PBS aggiuntive alla colonna.
- Raccogliere il prodotto utilizzando 2 mL di PBS come eluente.
Nota: Questo passaggio produrrà il costrutto finale huA33-TCO in 2 mL di PBS, pH 7,4.
- Misurare la concentrazione del huA33-TCO utilizzando uno spettrofotometro UV-Vis monitoraggio lunghezza d'onda di 280 nm. Il coefficiente di estinzione molare per la maggior parte delle IgG (ε280) è 210.000 M-1cm-1.
- Se si desidera una soluzione con una maggiore concentrazione di immunoconjugate, concentrare la soluzione di huA33-TCO utilizzando un'unità filtro centrifugo con un cut-off di 50.000 peso molecolare seguendo le istruzioni del produttore.
Nota: Molti anticorpi sono stati conosciuti per aggregare o precipitare durante la concentrazione. Quando si tenta di questa procedura con un nuovo anticorpo, i ricercatori dovrebbero rinviare alla letteratura o la propria esperienza nella gestione dell'anticorpo in questione. - Conservare il immunoconjugate completato huA33-TCO a 4 ° C al buio se è necessario immediatamente. Se si vuole essere utilizzato più di 4 giorni in futuro, conservarlo a-80 ° C al buio.
Nota: Questo è un punto di sosta accettabile nella procedura. Il immunoconjugate huA33-TCO completato dovrebbe essere stabile per almeno 6 mesi di immagazzinaggio a-80 ° C al buio.
2. la sintesi di Tz-PEG7- NHBoc
- In un tubo del microcentrifuge 1,7 mL, sciogliere 5 mg di tetrazine N- hydroxysuccinimidyl ester (Tz-NHS; 12,6 μmol) a 0,15 mL di anidro dimetilsolfossido (DMSO).
- In un tubo del microcentrifuge separata 1,7 mL, sciogliere 8 mg di Boc-protetti aminoacidi PEG polimero, glicole O-(2-Aminoethyl)-O′-[2-(Boc-amino)ethyl]hexaethylene (NHBoc-PEG7-NH2; 17,1 μmol) a 0,15 mL di DMSO anidro.
- Per la soluzione di Tz-NHS, aggiungere 3 μL (21,3 μmol, 1,7 molari equivalenti) di trietilammina (tè) e mescolare accuratamente.
- Aggiungere la soluzione di rosa tetrazine alla NHBoc-PEG7-NH2 soluzione da Step 2.2 e incubare per 30 min a temperatura ambiente (TA) con lieve agitazione, la miscela di reazione.
- Dopo 30 minuti, diluire la reazione 1:1 in H2O e purificare la reazione mediante cromatografia liquida a fase inversa C18 ad alte prestazioni (HPLC) per separare qualsiasi Tz-NHS non reagito da Tz-PEG7- NHBoc. Utilizzare solventi senza acido per impedire la rimozione precoce di Boc proteggere il gruppo. Monitorare entrambi Tz-PEG7- NHBoc e Tz-NHS alla lunghezza d'onda di 525 nm.
Nota: Tempi di ritenzione sono ovviamente fortemente dipendente dalle apparecchiatura HPLC di ogni laboratorio (pompe, colonne, tubi, ecc.), e controlli appropriati devono essere eseguiti prima della purificazione. Tuttavia, per presentare un esempio, se una pendenza di 5: 95 MeCN/H2O (entrambi senza alcun additivo) a 95: 5 MeCN/H2O oltre 30 min, vengono utilizzati una portata di 1 mL/min e una colonna di18analitiche 4,6 mm x 250 mm C , i tempi di ritenzione di Tz-NHS e Tz-PEG7- NHBoc sono circa 16 min e 18 min, rispettivamente. - Congelare l'eluente HPLC raccolto usando azoto liquido e avvolgere il tubo di raccolta ora-congelato nella carta stagnola. Posto il tubo di raccolta congelato su un liofilizzatori pernottamento per rimuovere la fase mobile HPLC. Il prodotto sarà un solido rosa brillante caratteristico.
Nota: Se l'azoto liquido non è disponibile, congelare l'eluente HPLC raccolto in ghiaccio secco o durante la notte in un congelatore a-80 ° C.
3. la sintesi di Tz-PEG7-NH2
- Al prodotto da passo 2.6, Tz-PEG7- NHBoc, aggiungere 1,5 mL di diclorometano (DCM) e trasferire questa soluzione in un pallone da piccolo.
- Aggiungere 0,25 mL di acido trifluoroacetico (TFA) goccia a goccia la soluzione rosa da passo 3.1.
- Consentire la reazione Incubare 30 min a RT con lieve agitazione.
- Dopo 30 min, far evaporare il solvente tramite evaporazione rotante. Non superare una temperatura del bagno di acqua di 37 ° C.
- Ricostituire il prodotto viscoso rosa in 0,5 mL di acqua.
- Purificare il prodotto utilizzando controfase C18 HPLC per separare Tz-PEG7-NH2 dal precursore Boc-protetto. Monitorare entrambi Tz-PEG7- NHBoc e Tz-PEG7-NH2 ad una lunghezza d'onda di 525 nm.
Nota: Tempi di ritenzione sono ovviamente fortemente dipendente dalle apparecchiatura HPLC di ogni laboratorio (pompe, colonne, tubi, ecc.), e controlli appropriati devono essere eseguiti prima della purificazione. Tuttavia, per presentare un esempio, se una pendenza di 5: 95 MeCN/H2O (entrambi con 0,1% TFA) a 95: 5 MeCN/H2O oltre 30 min, vengono utilizzati una portata di 1 mL/min e una colonna di18analitiche 4,6 mm x 250 mm C , i tempi di ritenzione di Tz-PEG7- NHBoc e Tz-PEG7-NH2 sono circa 18 min e 13 min, rispettivamente. - Congelare l'eluente HPLC raccolto usando azoto liquido e avvolgere il tubo di raccolta ora-congelato nella carta stagnola. Posto il tubo di raccolta congelato su un liofilizzatori pernottamento per rimuovere la fase mobile HPLC. Il prodotto sarà un solido rosa brillante.
- Ricostituire il prodotto dal passo 3.7, Tz-PEG7-NH2, con 150 μL di DMSO e trasferirlo in una provetta da microcentrifuga 1,7 mL.
- Misurare la concentrazione di Tz-PEG7-NH2 utilizzando uno spettrofotometro UV-Vis monitoraggio lunghezza d'onda di 525 nm. Il coefficiente di estinzione molare per Tz-PEG7-NH2 (ε525) è 535 M-1cm-1.
4. la sintesi di Tz-PEG7- DOTA
- Sciogliere Tz-PEG7-NH2 (4,5 mg, 6,9 μmol) in 0,15 mL di DMSO (o semplicemente procedere con la soluzione creata nel passaggio 3.8).
- Aggiungere 22 equivalenti molari di tè (21 μL, 0,15 mmol) alla soluzione contenente tetrazine dal punto 4.1.
- Aggiungere 10 mg (14,2 μmol) di p- SCN-Bn-DOTA come un solido e vortice la soluzione per circa 2 min o fino a quando il materiale sia completamente dissolto.
- Consentire la reazione Incubare 30 min a RT con lieve agitazione.
- Dopo 30 min, diluire la reazione 1:1 in H2O e purificare il prodotto utilizzando controfase C18 HPLC per rimuovere non reagito p- SCN-Bn-DOTA. Il p- SCN-Bn-DOTA possa essere controllato a una lunghezza d'onda di 254 nm, mentre la Tz-PEG7- DOTA è meglio monitorato ad una lunghezza d'onda di 525 nm.
Nota: Tempi di ritenzione sono ovviamente fortemente dipendente dalle apparecchiatura HPLC di ogni laboratorio (pompe, colonne, tubi, ecc.), e controlli appropriati devono essere eseguiti prima della purificazione. Tuttavia, per presentare un esempio, se una pendenza di 5: 95 MeCN/H2O (entrambi con 0,1% TFA) a 95: 5 MeCN/H2O oltre 30 min e una colonna di18analitica 4.6 x 250 mm C sono usati, Tz-PEG7- DOTA e p-SCN-Bn-DOTA hanno tempi di ritenzione dei circa 15,6 min e 16,1 min, rispettivamente. - Congelare l'eluente HPLC raccolto usando azoto liquido e avvolgere il tubo di raccolta ora-congelato nella carta stagnola. Posto il tubo di raccolta congelato su un liofilizzatori pernottamento per rimuovere la fase mobile HPLC. Il prodotto sarà un brillante rosa cipria.
- Ricostituire il prodotto a 0,15 mL di DMSO e misurare la concentrazione utilizzando uno spettrofotometro UV-Vis monitoraggio lunghezza d'onda di 525 nm. Il coefficiente di estinzione molare per Tz-PEG7- DOTA (ε525) è 535 M-1cm-1.
- Analizzare il composto finale di risonanza magnetica nucleare (NMR) e spettrometria di massa ad alta risoluzione (HRMS) per verificare che la sintesi è stata eseguita correttamente. Vedere la tabella 1 per il determinato sperimentalmente gli spostamenti chimici e pesi molecolari di tutti i composti discussi in questo lavoro.
- Conservare la soluzione di - DOTA di7Tz-PEG purificata al buio a-80 ° C.
Nota: Questo è un punto di sosta accettabile nella procedura. Il precursore DOTA -7Tz-PEG completato è stabile per almeno 1 anno in queste condizioni.
5. 177Lu radiomarcatura di Tz-PEG7- DOTA
Attenzione: Questo passaggio del protocollo prevede l'utilizzo e manipolazione di radioattività. Prima di eseguire queste operazioni — o l'esecuzione di qualsiasi altro lavoro con radioattività — i ricercatori dovrebbero consultare il radiazione Safety Department di loro Istituto di provenienza. Prendere tutte le misure possibili per ridurre al minimo l'esposizione alle radiazioni ionizzanti.
Nota: Quando si lavora con piccole quantità di radiometalli è consigliabile che tutti i buffer è esente da metalli in traccia per evitare interferenze in associazione del sito di coordinamento.
- In una provetta da centrifuga 1,7 mL, aggiungere 200 μL di tampone di acetato di ammonio 0,25 M regolato con aliquote di 1 M HCl a pH 5.5.
Nota: Se si utilizza meno di 370 MBq di attività per l'etichettatura, il volume del buffer utilizzato dovrebbe essere ridotto a 100 µ l. - Aggiungere la quantità desiderata di [177Lu] LuCl3 per la soluzione tampone. L'importo aggiunto sarà dipenda dal numero dei soggetti dell'esperimento e le dosi radioattive viene somministrate. È consigliabile che 1-2 dosi extra vale la pena di radioattività aggiungersi come misura precauzionale per compensare la perdita potenziale di radioattività durante fasi di purificazione.
- Aggiungere Tz-PEG7- DOTA in DMSO al composto radioattivo al punto 5.2. La quantità di Tz-PEG7- DOTA è dipenda dal numero di soggetti in fase di test. Maggiori dettagli su questo argomento possono essere trovato nel passaggio 6.2.2.2.
- Lasciare la soluzione a incubare a 37 ° C per 20 min.
- Verificare che la radiomarcatura è completata mediante cromatografia di strato sottile istantanea di radio (radio-iTLC) con 50 mM EDTA, pH 5.5 come fase mobile. L'etichetta [177Lu] Lu-DOTA-PEG7- Tz rimarrà alla linea di base — Rf = 0 — mentre gratis [177Lu] Lu3 + sarà coordinato con l'EDTA e viaggerà con il fronte del solvente, Rf = 1.0 (Figura 3B).
- Se etichettatura quantitativa non viene raggiunta, aggiungere ulteriore ligando per coordinare il radiometal gratuito. In alternativa, purificare l'etichetta [177Lu] Lu-DOTA-PEG7- Tz utilizzando una cartuccia di18 C. Seguire le istruzioni del produttore per l'uso. Seguito è riportato un esempio di routine.
- Adescare la cartuccia passando lentamente attraverso 5 mL di etanolo attraverso la cartuccia con una grossa siringa. Quindi, passare attraverso 5 mL di acetonitrile e poi 5 mL di deionizzata (DI) H2O.
- Aspirare la soluzione di radioligand da 5.3 passo in una più piccola siringa e iniettare lentamente sulla cartuccia C18 . Quindi, lavare la cartuccia con 10 mL DI H2O di rimuovere qualsiasi unbound [177Lu] LuCl3.
- Eluire con 500 µ l di etanolo. Rimuovere qualsiasi etanolo dal prodotto finale passando sopra la nave con un tasso di flusso debole di azoto secco o argon per 10-15 min. Successivamente, risospendere il radioligando in soluzione salina in un volume determinato nel passaggio 6.2.2.2.
6. gli studi in vivo
Attenzione: Come nella sezione 5, questo passaggio del protocollo prevede l'utilizzo e manipolazione di radioattività. Prima di eseguire questi passaggi, i ricercatori dovrebbero consultarsi con reparto di sicurezza di radiazione del loro Istituto di appartenenza. Prendere tutte le misure possibili per ridurre al minimo l'esposizione alle radiazioni ionizzanti.
- Preparazione degli animali
- In athymic femminili, per via sottocutanea dell'impianto di cellule di cancro colorettale di 5 x 106 SW1222 sospese in 150 µ l di una miscela 1:1 di media delle cellule e matrice (ad es., Matrigel) e permettere a questi di crescere in un xenograft3 di 100-150 mm (14-18 giorni dopo l'inoculazione).
- L'ordinamento degli animali per un esperimento di biodistribuzione
- Una volta che i tumori sono di dimensioni sufficienti come determinato da misurazione di pinza, ordinare gli animali affinché ogni coorte ha circa lo stesso volume medio del tumore. Gli animali possono essere distinti in ogni gabbia dalle marcature sulla coda con inchiostro indelebile (una banda, due bande, ecc.).
- L'ordinamento degli animali per uno studio di terapia longitudinale
- Una volta che i tumori sono di dimensioni sufficienti, come determinato dalla misura della pinza, è possibile collegare auricolari a ciascuno degli animali per garantire un monitoraggio corretto in tutto l'esperimento.
Nota: Etichette numeriche orecchio possono staccarsi durante tutto il corso dell'esperimento. Di conseguenza, si consiglia di accompagnare queste etichette fisiche con tacche di orecchio in modo sistematico (cioè., destra, sinistra, bilaterale, diritto x 2, x 2 a sinistra). - Ordinare gli animali in modo che il volume medio del tumore in ogni gruppo è approssimativamente uguale. Il seguente metodo per l'ordinamento degli animali può essere eseguito utilizzando un programma di foglio di calcolo.
- Elencare i numeri di identificazione degli animali, modello tacca dell'orecchio e volume del tumore in tre colonne separate.
- Ordinare i dati dal più piccolo al più grande volume del tumore.
- In una quarta colonna, è necessario assegnare ogni animale un ciclo attraverso le gabbie a forma di serpente e il numero di gabbia. Ad esempio, se ci sono 5 gabbie, questa colonna sarebbe riempito "5, 4, 3, 2, 1, 1, 2, 3, 4, 5..." fino a quando tutti gli animali sono assegnati una gabbia.
- Una volta che le gabbie sono assegnate, ordinare i dati di numero di gabbia. Se vengono utilizzate le tacche dell'orecchio, garantire che ogni animale in una gabbia data ha un modello di tacca unico orecchio. Se esistono duplicati (due o più dello stesso modello) in una gabbia data, il uno mouse scambio con uno da un'altra gabbia con il motivo manca fino a quando ogni gabbia ha animali con modelli di tacca unico orecchio.
- Una volta che i tumori sono di dimensioni sufficienti, come determinato dalla misura della pinza, è possibile collegare auricolari a ciascuno degli animali per garantire un monitoraggio corretto in tutto l'esperimento.
- Formulazioni e iniezioni
Nota: La sequenza di iniezione per studi di biodistribuzione e la terapia procede come segue: huA33-TCO viene iniettato in primo luogo, seguito da [177Lu] Lu-DOTA-PEG7- Tz dopo un intervallo predeterminato.- Immunoconjugate
- Diluire una parte aliquota della soluzione huA33-TCO da 1,9 passo a una concentrazione di 0,8 mg/mL in soluzione sterile salina 0,9%.
- Disegnare le dosi di 150 µ l (100 µ g) di soluzione di huA33-TCO in siringhe pretrattati con 1% albumina di siero bovino (BSA) in PBS e memorizzare queste siringhe sul ghiaccio.
Nota: BSA trattamento riduce il legame non specifico dell'anticorpo per le pareti della siringa. - Caldo gli animali sotto una lampada di calore per 3 minuti per dilatare la vena della coda.
- Iniettare la soluzione di huA33-TCO nella vena caudale del mouse dello xenotrapianto-cuscinetto. Consentire 24h (o un intervallo di tempo pre-determinato diversi) per il huA33-TCO ad accumulare nel tumore del mouse.
-
Radioligand
- Si Tz-PEG7- DOTA come descritto nella sezione 5.
- Disegnare le dosi in 150 μL dello 0,9% sterile salina contenente 1,1 equivalenti molari di Tz-PEG7- DOTA riguardante la quantità di huA33-TCO amministrato. Ad esempio, se 100 μg (0.67 nmol) di huA33-TCO è stato iniettato nell'animale e la miscela di reazione [177Lu] - Tz7Lu-DOTA-PEG è stata effettuata con una specifica attività di 12,4 GBq/μmol, quindi le dosi creeranno contenente 9.14 MBq di ogni attività. Ciò corrisponde a 0.74 nmol di Tz (1,1 EQ. molare relativa a huA33-TCO).
- Caldo gli animali sotto una lampada di calore per 3 min a dilatare la vena della coda.
- Iniettare la dose di radioligand nella vena caudale del mouse dello xenotrapianto-cuscinetto. La quantità di attività deve essere iniettato è determinata dal ricercatore. I dati pubblicati hanno dimostrato gli effetti terapeutici di dose-dipendente sulle dimensioni del tumore all'interno di una gamma di 7,4-55,5 MBq.
- Immunoconjugate
- Biodistribuzione
- Presso il punto di tempo desiderato dopo la somministrazione del radioligand, eutanasia ogni coorte dei topi utilizzando un 2% O2 / 6% CO2 miscela di gas.
Nota: Seguire qualsiasi requisiti istituzionali per quanto riguarda i metodi per l'eutanasia fisica secondaria (ad es., la dislocazione cervicale). - Per ogni animale, rimuovere tutti gli organi di interesse, lavarli in un bagno d'acqua per rimuovere il sangue in eccesso e asciugarle su un tovagliolo di carta aperto per 5 min. elenco di organo di esempio nell'ordine suggerito: sangue, tumore, cuore, polmoni, fegato, milza, stomaco, intestino tenue , grande intestino, reni, muscolo, osso, pelle, coda.
- Una volta sufficientemente essiccati, posizionare gli organi in provette di coltura monouso pre-pesati. Pesare i tubi ora-riempito ancora una volta per ottenere la massa di ogni organo o tessuto.
- Misurare l'attività in ciascuna delle provette in un contatore gamma. Calibrare l'attività misurata con il contatore gamma al rivelatore utilizzato per misurare la dose disegnata. Conteggio radioattivo standard di 177Lu su ciascuno strumento e determinare un fattore di calibrazione per l'interconversione tra attività e conteggi al minuto (cpm).
- Tracciare i dati di biodistribuzione come un grafico a barre (Vedi Figura 5) con il valore medio normalizzato l'assorbimento per ogni organo visualizzato insieme con un bar che denota una deviazione standard. Le differenze statistiche nell'assorbimento fra gruppi di campioni possono essere valutate da un test t spaiato, in cui il significato è raggiunto quando p < 0.05.
- Presso il punto di tempo desiderato dopo la somministrazione del radioligand, eutanasia ogni coorte dei topi utilizzando un 2% O2 / 6% CO2 miscela di gas.
- Monitoraggio della terapia
- Misurare il lato più lungo del tumore oblungo (lunghezza) così come la larghezza, che è perpendicolare alla lunghezza con pinze. Calcolare il volume utilizzando la formula per il volume di un ellissoide: πL· (4/3) W· H, che si semplifica in ½L· W2, supponendo che l'altezza è circa uguale alla larghezza.
Nota: È anche possibile utilizzare un tumore palmare dispositivo di misurazione, se uno è disponibili (Vedi Tabella materiali). - Pesare ogni topo su un equilibrio per tenere traccia di aumento di peso o perdita di peso nel tempo.
- D'importanza, monitorare l'aspetto fisico di ogni animale per segni di agitazione, come curvato indietro o rotti vasi sanguigni cutanei (che possono indicare ematotossicità).
Nota: Misure del tumore dovrebbero essere raccolti ogni 1-2 giorni durante il corso dello studio longitudinale di terapia. - Traccia dati dalla terapia longitudinale studiano volumi del tumore come media nel tempo e normalizzano il volume del tumore di iniziale, se lo si desidera. Le differenze statistiche nell'assorbimento nello stesso giorno tra gruppi di campioni possono essere valutate da un test t spaiato, in cui il significato è raggiunto quando P < 0.05. Analisi statistiche più estese possono e devono essere eseguite come consigliato da un biostatistico addestrato.
- Misurare il lato più lungo del tumore oblungo (lunghezza) così come la larghezza, che è perpendicolare alla lunghezza con pinze. Calcolare il volume utilizzando la formula per il volume di un ellissoide: πL· (4/3) W· H, che si semplifica in ½L· W2, supponendo che l'altezza è circa uguale alla larghezza.
Risultati
La coniugazione del TCO per huA33 si basa sull'accoppiamento tra il TCO-NHS ammina-reattivo e i residui di lisina sulla superficie dell'immunoglobulina. Questo metodo è altamente affidabile e riproducibile e affidabile produce una grado-di-etichettatura di TCO/mAb 2-4. In questo caso, spettrometria di massa MALDI-ToF è stata impiegata per confermare un certo grado di etichettatura di circa 4,0 TCO/mAb; un valore simile è stato ottenuto utilizzando un tetrazine fluorophore-modificato come un reporter24. La sintesi del ligando tetrazine viene eseguita in tre fasi: (1) l'accoppiamento di Tz-NHS un linker di PEG mono-Boc-protetto (2) la deprotezione di questo intermedio a resa Tz-PEG7-NH2e (3) la formazione di un sollevatore di tiourea tra p- SCN-Bn-DOTA e Tz-PEG7-NH2. Questa procedura è relativamente facile e offre Tz-PEG7- DOTA in un rendimento globale di ~ 75%. Ciascuno degli intermedi è stata caratterizzata da HRMS e 1H-NMR; questi dati vengono presentati in tabella 1.
Passando per la radiomarcatura, 177Lu3 + è in genere ottenute da fornitori commerciali come un cloruro di sale [177Lu] LuCl3 in acido cloridrico 0,5 M. La radiomarcatura di Tz-PEG7- DOTA con 177Lu a cedere il radioligando [177Lu] Lu-DOTA-PEG7- Tz è molto semplice: in soli 20 minuti, la reazione è completa, producendo il prodotto desiderato in > 99% radiochimico purezza come determinato da radio-iTLC. In genere, ulteriore purificazione non è necessaria prima della formulazione. Un'indagine della letteratura su basate su Tz/TCO pretargeting suggerisce che un rapporto molare di Tz:mAb di ~ 1:1 produce i migliori in vivo dati10. Di conseguenza, non è indispensabile per ottenere il radioligando nel più alto possibile attività molare. Ad esempio, la biodistribuzione esperimenti discusso qui impiegano [177Lu] Lu-DOTA-PEG7- Tz con un'attività molare di ~ 12 GBq/µmol. Per gli studi longitudinali terapia, al contrario, [177Lu] Lu-DOTA-PEG7- Tz con attività molare superiore è stato usato per facilitare la somministrazione di dosi più elevate di radioattività senza modificare il numero di moli iniettati di tetrazine.
Come saranno affrontate ulteriormente nella discussione, biodistribuzione esperimenti sono di fondamentale importanza per la comprensione e l'ottimizzazione di qualsiasi approccio a PRIT. In questo caso, la biodistribuzione esperimenti sono stati condotti per determinare il tempo di intervallo ottimale tra l'amministrazione del immunoconjugate e l'iniezione del radioligand. A tal fine, abbiamo impiegato nudi athymic cuscinetto sottocutaneo A33 che esprimono l'antigene SW1222 xenotrapianti sulla loro spalla destra. Questi animali hanno ricevuto 100 µ g (0,67 nmol) di huA33-TCO 24, 48, 72 o 120 h prima dell'iniezione di [177Lu] Lu-DOTA-PEG7- Tz (9,14 MBq, 0.74 nmol). Figura 5 Mostra che tutti gli intervalli di iniezione producono concentrazioni di alta attività nel tessuto del tumore come pure le concentrazioni di attività bassa in organi sani. L'intervallo di iniezione 24h offre il più alto assorbimento tumoral alle 120 h post-iniezione: 21,2 ± 2.9%ID/g. Ogni insieme di condizioni produce anche rapporti di concentrazione eccezionale attività di tumore per organo. Pretargeting con un intervallo di 24 ore, ad esempio, produce rapporti tumore-sangue, tumore al fegato e tumore-a-muscolare di 20 ± 5, ± 37 7 e 184 ± 30, rispettivamente, di 120 ore dopo la somministrazione del radioligand. Basato su questi risultati, un intervallo di 24 ore è stato scelto per lo studio di terapia successiva longitudinale (Vedi sotto).
Per lo Studio in vivo longitudinale terapia, coorti (n = 10) di topi nudi athymic cuscinetto sottocutaneo SW1222 xenotrapianti il loro fianco destro erano amministrato huA33-TCO (100 ug, 0.67 nmol) 24 ore prima dell'iniezione di [177Lu] Lu-DOTA-PEG 7- Tz. Tre gruppi sperimentali differenti sono stati impiegati, ricevendo 18,7, 37 o 55,5 MBq di [177Lu] Lu-DOTA-PEG7- Tz (corrispondenti alle attività molare di 24, 45 e 70 GBq/µmol). Inoltre, due coorti di controllo ha ricevuto uno metà del regime di PRIT: entrambi huA33-TCO (100 ug, 0.67 nmol) senza [177Lu] Lu-DOTA-PEG7- Tz o [177Lu] Lu-DOTA-PEG7- Tz (55,5 MBq, 0.74 nmol) senza huA33-TCO. Si tratta di controlli essenziali per garantire che la risposta terapeutica non è suscitata dal immunoconjugate o radioligand da solo. I volumi dei tumori sono stati misurati ogni 3 giorni per le prime tre settimane dello studio e poi una volta alla settimana fino alla conclusione dell'esperimento (70 giorni, 10 emivite di 177Lu). Come si vede nella Figura 6, c'è una netta differenza nella risposta delle coorti sperimentale rispetto ai gruppi di controllo. Mentre i tumori in topi che ricevono solo una componente della strategia PRIT continuano a crescere incontrollata, i tumori dei topi che ricevono il pieno regime PRIT smettono di crescere e, in definitiva, ridurre a volumi ben di sotto di quelli misurati all'inizio dello studio. Cosa importante, senza effetti collaterali tossici sono stati osservati, e tutti gli animali ha mantenuto un peso entro il 20% della loro massa iniziale (figura 7A). Un tracciato di Kaplan-Meier dei dati fornisce una visualizzazione ancora più sorprendente dello studio: mentre tutti i topi nelle coorti controllo dovevano essere eutanasia entro poche settimane, i topi delle coorti sperimentale ha avuto un record perfetto di sopravvivenza alla fine dell'indagine ( Figura 7B).
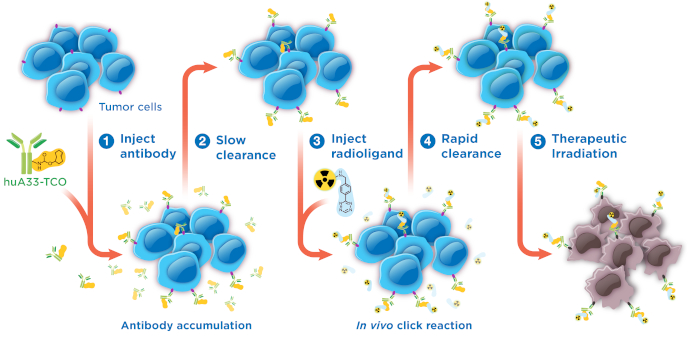
Figura 1: schema del fumetto di pretargeted radioimmunotherapy basato sulla reazione inversa dell'elettrone demand Diels-Alder. Questa figura è stata modificata da riferimento #28. Ristampato (adattato) con il permesso da Membreno, R., Cook, B. E., Fung, K., Lewis, J. S. & Zeglis, b. M. Click-Mediated Pretargeted Radioimmunotherapy di Carcinoma colorettale. Molecular Pharmaceutics. 15 (4), 1729-1734 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
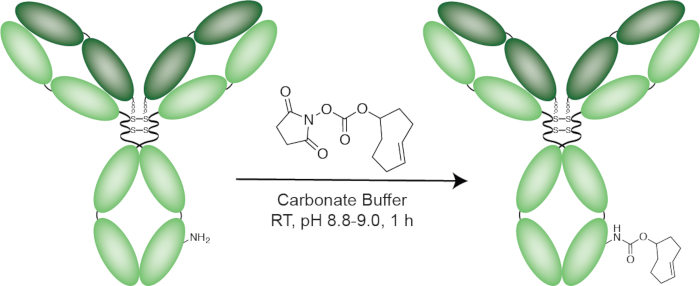
Figura 2: schema della costruzione del huA33-TCO. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: schema della sintesi di Tz-PEG7- DOTA. Clicca qui per visualizzare una versione più grande di questa figura.
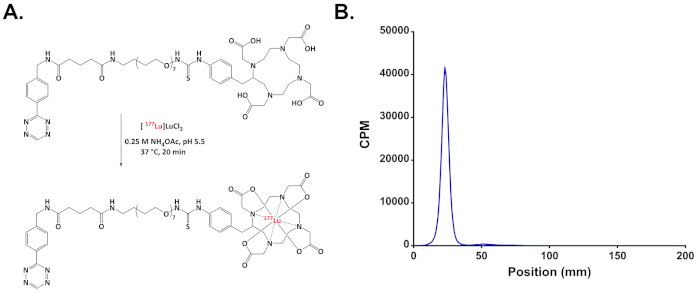
Figura 4: (A) schema della radiomarcatura di [ 177Lu] Lu-DOTA-PEG7- Tz; (B) rappresentante radio-iTLC cromatogramma dimostrando la > 98% di purezza radiochimica di [177Lu] Lu-DOTA-PEG7- Tz. Clicca qui per visualizzare una versione più grande di questa figura.
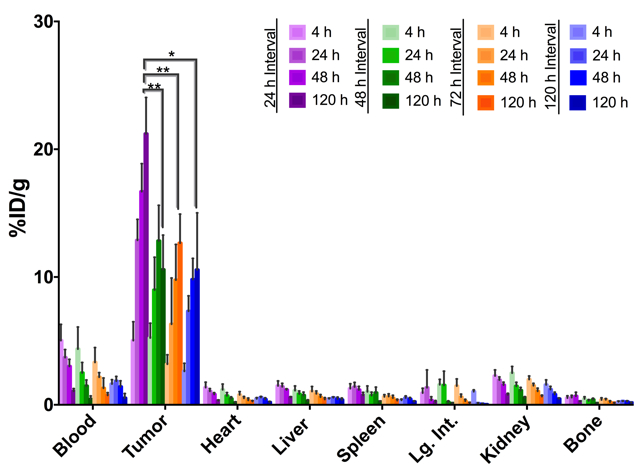
Figura 5: Biodistribuzione in di in vivo pretargeting con huA33-TCO e [177Lu] - DOTA - PEG7- Tz in topi nudi athymic cuscinetto sottocutanei tumori di cancro colorettale umano SW1222 utilizzando pretargeting intervalli di 48 (viola), 24 (verde) , 72 (arancione), o 120 ore (blu). Dati con errori standard dalle coorti di n = 4; L'analisi statistica è stata eseguita da t-test di uno studente spaiato, * *p < 0.01. Questa figura è stata modificata da riferimento #28. Ristampato (adattato) con il permesso da Membreno, R., Cook, B. E., Fung, K., Lewis, J. S. & Zeglis, b. M. Click-Mediated Pretargeted Radioimmunotherapy di Carcinoma colorettale. Molecular Pharmaceutics. 15 (4), 1729-1734 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: studio longitudinale terapia di 5 gruppi di topi (n = 10 ciascuno) cuscinetto di tumori sottocutanei SW1222 raffigurati nel volume medio del tumore in funzione del tempo (A); e volume del tumore normalizzati al volume iniziale in funzione del tempo (B). I gruppi di controllo hanno ricevuto il immunoconjugate senza il radioligand (blu) o il radioligando senza il immunoconjugate (rosso). Il tre trattamento gruppi hanno ricevuto huA33-TCO (100 µ g, 0,6 nmol) seguita 24 ore più tardi da 18,5 (verde), 37.0 (viola) o MBq (arancione) 55,5 (nmol di ~0.8 in ogni caso) [177Lu] - DOTA - PEG7- Tz. Da (Mantel-Cox) log-rank test, sopravvivenza era significativa (p < 0.0001) per tutti i gruppi di trattamento. Questa figura è stata modificata da riferimento #28. Ristampato (adattato) con il permesso da Membreno, R., Cook, B. E., Fung, K., Lewis, J. S. & Zeglis, b. M. Click-Mediated Pretargeted Radioimmunotherapy di Carcinoma colorettale. Molecular Pharmaceutics. 15 (4), 1729-1734 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: curve per animali di peso durante lo studio longitudinale di terapia di 5 gruppi di topi (n = 10 ciascuno) cuscinetto sottocutaneo SW1222 tumori (A); la sopravvivenza di Kaplan-Meier corrispondente curva (B). I gruppi di controllo hanno ricevuto il immunoconjugate senza il radioligand (blu) o il radioligando senza il immunoconjugate (rosso). Il tre trattamento gruppi hanno ricevuto huA33-TCO (100 µ g, 0,6 nmol) seguita 24 ore più tardi da 18,5 (verde), 37.0 (viola) o MBq (arancione) 55,5 (nmol di ~0.8 in ogni caso) [177Lu] - DOTA - PEG7- Tz. Questa figura è stata modificata da riferimento #28. Ristampato (adattato) con il permesso da Membreno, R., Cook, B. E., Fung, K., Lewis, J. S. & Zeglis, b. M. Click-Mediated Pretargeted Radioimmunotherapy di Carcinoma colorettale. Molecular Pharmaceutics. 15 (4), 1729-1734 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
| Composto | 1 H-NMR turni | HRMS (ESI) |
| 500 MHz, DMSO | ||
| TZ-PEG7- NHBoc | 10,52 (s, 1H) 8.50 (m, 3H), 7,82 (t, 1H), 7,46 (d, 2H), 6,69 (t, H 1), 4,33 (d, 2H), 3.42 (m, H 22), 3.33 (t, H 2), 3,31 (t, H 2), 3.12 (q, H 2), 2,99 (q, H 2), 2.12 (t, H 2), 2.03 (t, H 2), 2.12 (t, H 2), 1.70 (q, H 2), 1,29 (s 9 H) | m/z calcolato. per C35H57N7O11Na: 774.4005; trovato: 774.4014. |
| TZ-PEG7-NH2 | 10,58 (s, 1H), 8,46 (m, H 2), 7.87 (t, 1H), 7.75 (d, 2H), 7,52 (d, 1H), 4,40 (d, 2H), 3,60-3.50 (m, H 26), 3,40 (t, H 2), 3,32 (bs, 2h), 3.20 (q, H 2), 2,99 (bs, 2H), 2.19 (t, H 2), 2.12 (t, H 2), 1.79 (q, 2H). | m/z calcolato. per C30H50N7O9: 652.3670; trovato: 652.3676. |
| TZ-PEG7- DOTA | 10,57 (s, 1h), 9,63 (bs, 1H), 8.45 (m, 3H), 7,86 (m, 1H), 7,73 (bs, 1H), 7,54 (d, 2H), 7,41 (m, H 2), 7.19 (m, H 2), 6,54 (bs, 1H), 4,40 (d, 2H), 4.00-3.20 (m, H 55), 3.20 (q, 4H), 2,54 (s, 1h), 2.18 (t, 3H), 2.10 (t, 3H), 1.76 (q 2 H). | m/z calcolato. per C50H76N11O15s.: 1202.56; trovato: 1203.5741. |
Tabella 1. Dati di caratterizzazione per i composti organici descritti nel presente protocollo.
Discussione
Uno dei punti di forza di questo approccio per in vivo pretargeting — soprattutto in relazione alle strategie fondate sugli anticorpi anticorpo e radioattivi apteni — è la sua modularità: trans- ciclottene moiety possono essere aggiunti a qualsiasi anticorpo, e tetrazine radioligands possono essere radioattivi con una straordinaria varietà di radionuclidi senza alterare la loro capacità di reagire con i loro partner di clic. Ancora l'adattamento di questo approccio per altri sistemi antigene/anticorpo non è semplice come duplicare il protocollo descritto qui. Naturalmente, qualsiasi tentativo di creare un nuovo immunoconjugate mAb-TCO o un romanzo radioligand tetrazine-cuscinetto deve essere corredato di analisi della appropriata caratterizzazione chimica e biologica, compresi i test per la stabilità e reattività. Ma di là di questo, ci sono due variabili che sono particolarmente importanti per esplorare e ottimizzare: (1) la massa di mAb-TCO immunoconjugate amministrato e (2) l'intervallo di tempo tra l'iniezione del mAb-TCO e l'amministrazione del radioligand. Entrambi i fattori possono influire notevolmente il comportamento in vivo del sistema pretargeting. Ad esempio, l'uso di dosi troppo elevate di immunoconjugate o intervallo di periodi troppo brevi possa provocare concentrazioni di attività indesiderabilmente elevato nel sangue a causa di reazioni di clic tra la radioligand e immunoconjugate restanti in circolazione. Al contrario, impiegando masse di immunoconjugate che sono troppo bassi o periodi di intervallo troppo lungo inutilmente può ridurre le concentrazioni di attività nel tumore a causa di un errore per saturare l'antigene o l'inesorabile (anche se lento) isomerizzazione del trans - ciclottene a inattivo cis- ciclottene. Lungo queste linee, effettuando esperimenti di biodistribuzione utilizzando una gamma di masse di immunoconjugate e pretargeting intervalli può essere straordinariamente utile. Naturalmente, è anche consigliabile che eseguire opportuni controlli in tandem con eventuali esperimenti in vivo . Questi includono, ma non sono limitati a — esperimenti con linee cellulari di antigene-negativi, il blocco di coorti che ricevono un vasto eccesso di anticorpo non coniugata, la somministrazione del radioligando da solo, l'iniezione di radioligand seguendo un TCO- manca immunoconjugate e in vivo pretargeting utilizzando un non-specifici, isotype controllo TCO-cuscinetto immunoconjugate.
In alternativa, esperimenti di imaging possono essere utilizzati per l'ottimizzazione se il radionuclide terapeutico emette positroni o 'stampabile' fotoni o se un 'stampabile' isotopologue del radionuclide terapeutico è disponibile. In definitiva, i set di variabili che forniscono il miglior equilibrio tra concentrazioni di alta attività tumoral e rapporti di concentrazione alta tumore--fondo attività dovrebbero essere selezionati per gli studi successivi terapia longitudinale. Nel caso presentato qui, 100 µ g di huA33-TCO è stato iniettato con un intervallo di calcoli di dosimetria di 24 h. — in particolare quelli che consentono per il calcolo delle dosi di tumore e rapporti terapeutici — può essere utile anche durante il processo di ottimizzazione.
È importante notare che anche il promettente [177Lu] Lu-DOTA-PEG - Tz/huA33-TCO sistema7che è stato sviluppato poteva beneficiare di ulteriore ottimizzazione. Un confronto tra i dati di dosimetria da questo approccio a PRIT e RIT tradizionale con una variante di Lu-etichettati di 177del huA33 rivela che la dose del tumore di PRIT si trova di sotto di quella del tradizionale RIT. Inoltre, la dose efficace del sistema PRIT (0.054 mSv/MBq) è solo leggermente inferiore a quello del tradizionale RIT (0.068 mSv/MBq).
Due rimedi a questi problemi sono attualmente in fase di studio. In primo luogo, un'impalcatura dendritica è stata sviluppata in grado di aumentare il numero di TCOs accodato per ogni anticorpo30. Nel contesto del pretargeted imaging PET, questo approccio incrementa drasticamente le concentrazioni di attività tumorale, e analoghi esperimenti con [177Lu] Lu-DOTA-PEG7- Tz sono in corso. In secondo luogo, l'uso di agenti schiarimento tetrazine-cuscinetto può essere utile nel contesto di PRIT. La somministrazione di agenti prima dell'iniezione del radioligando di compensazione è stata sfruttata in una varietà di metodologie di pretargeting come un modo per diminuire la concentrazione di residui immunoconjugate nel sangue e quindi ridurre le concentrazioni di attività in organi sani23,31. L'uso di agenti di compensazione è non privo di inconvenienti, però; il più notevole dei quali è aumentare la complessità di una modalità terapeutica già certamente complicata. Tuttavia, i ricercatori al Memorial Sloan Kettering Cancer Center recentemente pubblicato una relazione convincente sulla creazione un destrano Tz-identificato agente di compensazione per pretargeted PET imaging e dati sull'uso di questo costrutto in combinazione con [177Lu] Lu-DOTA-PEG7- Tz e huA33-TCO sono prossimi32. Un altro approccio per ottimizzare i vantaggi dosimetrici di PRIT è l'uso di radionuclidi con più breve emivita fisica. Questo si è dimostrato altamente efficace per l'imaging; Tuttavia, i radionuclidi terapeutici con breve emivita fisica sono pochi e lontani tra.
Infine, saremmo negligenti se non siamo riusciti ad attuare correttamente alcune delle limitazioni intrinseche di pretargeting basato sulla reazione inversa electron demand Diels-Alder. Il primo di questi problemi è inerente a tutti gli approcci in vivo pretargeting: l'anticorpo impiegato non può essere interiorizzato legandosi al tessuto dell'obiettivo. Questo, naturalmente, è essenziale, come l'anticorpo deve rimanere accessibile per il radioligando anziché sequestrato in un compartimento intracellulare. Questa limitazione è certamente difficile da aggirare, se è stato dimostrato recentemente che gli anticorpi con tassi lenta-moderata di interiorizzare può essere utilizzato per in vivo pretargeting33,34. In secondo luogo, l'isomerizzazione lento in vivo del reattivo trans -ciclottene a inattivo cis -ciclottene ha il potenziale per limitare la lunghezza dell'intervallo tra la somministrazione del immunoconjugate TCO-cuscinetto e la iniezione del radioligand. Criticamente, intervalli fino a 120 h ancora hanno fornito i risultati eccellenti nel contesto di entrambi pretargeted PET imaging e PRIT. Tuttavia, l'uso di questi intervalli più lunghi è quasi sempre accompagnato da lievi riduzioni nelle concentrazioni di attività tumorale, un risultato che può derivare da questa isomerizzazione. Al fine di risolvere questo problema, diversi laboratori hanno tentato di creare più stabile trans- cyclooctenes senza compromettere la reattività, mentre altri hanno cercato di sviluppare dienofili completamente nuovo in grado di reagire con tetrazine35 . Nei prossimi anni, è nostra speranza che questi sviluppi chimici saranno sfruttati per PRIT.
Alla fine, PRIT basato sulla legatura demand Diels-Alder inversa dell'elettrone è innegabilmente una tecnologia emergente e un po' immatura. Tuttavia, siamo comunque incoraggiati dai risultati preclinici abbiamo ottenuto ed eccitato per la promessa clinica di questa strategia. Speriamo sinceramente che questo protocollo incoraggia gli altri ad esplorare e ottimizzare questo approccio e quindi di carburante relativo viaggio dal laboratorio alla clinica.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano il Dr. Jacob Houghton per conversazioni utili. Gli autori inoltre ringraziare il NIH per loro generosi finanziamenti (R00CA178205 e U01CA221046).
Materiali
| Name | Company | Catalog Number | Comments |
| (E)-Cyclooct-4-enyl 2,5-dioxo-1-pyrrolidinyl carbonate (TCO-NHS) | Sigma-Aldrich | 764523 | Store at -80 °C |
| 2,5-Dioxo-1-pyrrolidinyl 5-[4-(1,2,4,5-tetrazin-3-yl)benzylamino]-5-oxopentanoate (Tz-NHS) | Sigma-Aldrich | 764701 | Store at -80 °C |
| Acetonitrile (MeCN) | Fisher Scientific | A998-4 | |
| Ammonium Acetate (NH4OAc) | Fisher Scientific | A639-500 | |
| Boc-PEG7-amine (O-(2-Aminoethyl)-O′-[2-(Boc-amino)ethyl]hexaethylene glycol) | Sigma-Aldrich | 70023 | Store at -20 °C |
| Dichloromethane (DCM) | Fisher Scientific | D143-1 | |
| Dimethyl sulfoxide (DMSO), anhydrous | Fisher Scientific | D12345 | |
| EMD Millipore Amicon Ultra-2 Centrifugal Filter Unit | Fisher Scientific | UFC205024 | |
| GE Healthcare Disposable PD-10 Desalting Columns | Fisher Scientific | 45-000-148 | |
| N,N-Dimethylformamide (DMF), anhydrous | Fisher Scientific | AC610941000 | |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | 70-011-044 | 10x Concentrated |
| p-SCN-Bn-DOTA | Macrocyclics | B-205 | Store at -20 °C |
| Triethylamine (TEA) | Fisher Scientific | AC157911000 | |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | A116-50 | |
| Tumor measuring device | Peira TM900 | Peira TM900 |
Riferimenti
- Goldenberg, D. M. Targeted Therapy of Cancer with Radiolabeled Antibodies. Journal of Nuclear Medicine. 43 (5), 693-713 (2002).
- Goldenberg, D. M., et al. Radioimmunotherapy of B-cell Lymphomas with Iodine-131-labeled LL2 Monoclonal Antibody. Journal of Clinical Oncology. 9 (4), 548-564 (1991).
- Kaminski, M. S., et al. Radioimmunotherapy with 131I-Tositumomab for Relapsed or Refractory B-cell non-Hodgkin Lymphoma: Updated Results and Long-Term Follow-Up of the University of Michigan Experience. Blood. 96 (4), 1259-1266 (2000).
- Davies, A. J. Radioimmunotherapy for B-cell Lymphoma: Y90 Ibritumomab Tiuxetan and I131 Tositumomab. Oncogene. 26, 3614 (2007).
- Rajendran, J., et al. Comparison of Radiation Dose Estimation for Myeloablative Radioimmunotherapy for Relapsed or Recurrent Mantle Cell Lymphoma Using 131I Tositumomab to That of Other Types of Non-Hodgkin's Lymphoma. Cancer Biotherapy and Radiopharmaceuticals. 19 (6), 738-745 (2004).
- Rajendran, J. G., et al. High-Dose 131I-Tositumomab (Anti-CD20) Radioimmunotherapy for Non-Hodgkin's Lymphoma: Adjusting Radiation Absorbed Dose to Actual Organ Volumes. Journal of Nuclear Medicine. 45 (6), 1059-1064 (2004).
- Larson, S. M., Carrasquillo, J. A., Cheung, N. -. K. V., Press, O. Radioimmunotherapy of Human tumours. Nature Reviews Cancer. 15 (6), 347-360 (2015).
- Kelly, M. P., et al. Tumor Targeting by a Multivalent Single-Chain Fv (scFv) Anti-Lewis Y Antibody Construct. Cancer Biotherapy & Radiopharmaceuticals. 23 (4), 411-423 (2008).
- Yazaki, P. J., et al. Tumor Targeting of Radiometal Labeled Anti-CEA Recombinant T84.66 Diabody and T84.66 Minibody: Comparison to Radioiodinated Fragments. Bioconjugate Chemistry. 12 (2), 220-228 (2001).
- van Duijnhoven, S. M. J., et al. Diabody Pretargeting with Click Chemistry In Vivo. Journal of Nuclear Medicine. 56 (9), 1422-1428 (2015).
- Altai, M., Membreno, R., Cook, B., Tolmachev, V., Zeglis, B. M. Pretargeted Imaging and Therapy. Journal of Nuclear Medicine. 58 (10), 1553-1559 (2017).
- Goldenberg, D. M., Chatal, J. -. F., Barbet, J., Boerman, O., Sharkey, R. M. Cancer Imaging and Therapy with Bispecific Antibody Pretargeting. Update on cancer therapeutics. 2 (1), 19-31 (2007).
- Rossin, R., et al. In-Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angewandte Chemie International Edition. 49 (19), 3375-3378 (2010).
- Gestin, J. F., et al. Two-Step Targeting of Xenografted Colon Carcinoma Using a Bispecific Antibody and 188Re-Labeled Bivalent Hapten: Biodistribution and Dosimetry Studies. Journal of Nuclear Medicine. 42 (1), 146-153 (2001).
- Green, D. J., et al. Comparative Analysis of Bispecific Antibody and Streptavidin-Targeted Radioimmunotherapy for B-cell Cancers. Cancer Research. 76 (22), 6669 (2016).
- Sharkey, R. M., et al. Development of a Streptavidin−Anti-Carcinoembryonic Antigen Antibody, Radiolabeled Biotin Pretargeting Method for Radioimmunotherapy of Colorectal Cancer. Studies in a Human Colon Cancer Xenograft Model. Bioconjugate Chemistry. 8 (4), 595-604 (1997).
- Knox, S. J., et al. Phase II Trial of Yttrium-90-DOTA-Biotin Pretargeted by NR-LU-10 Antibody/Streptavidin in Patients with Metastatic Colon Cancer. Clinical Cancer Research. 6 (2), 406 (2000).
- Schubert, M., et al. Novel Tumor Pretargeting System Based on Complementary L-Configured Oligonucleotides. Bioconjugate Chemistry. 28 (4), 1176-1188 (2017).
- Forero, A., et al. Phase 1 Trial of a Novel Anti-CD20 Fusion Protein in Pretargeted Radioimmunotherapy for B-cell Non-Hodgkin Lymphoma. Blood. 104 (1), 227 (2004).
- Kalofonos, H. P., et al. Imaging of Tumor in Patients with Indium-111-Labeled Biotin and Streptavidin-Conjugated Antibodies: Preliminary Communication. Journal of Nuclear Medicine. 31 (11), 1791-1796 (1990).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. Journal of Nuclear Medicine. 54 (8), 1389-1396 (2013).
- Meyer, J. -. P., et al. 18F-Based Pretargeted PET Imaging Based on Bioorthogonal Diels-Alder Click Chemistry. Bioconjugate Chemistry. 27 (2), 298-301 (2016).
- Rossin, R., Läppchen, T., vanden Bosch, S. M., Laforest, R., Robillard, M. S. Diels-Alder Reaction for Tumor Pretargeting: In Vivo Chemistry Can Boost Tumor Radiation Dose Compared with Directly Labeled Antibody. Journal of Nuclear Medicine. 54 (11), 1989-1995 (2013).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Molecular Pharmaceutics. 12 (10), 3575-3587 (2015).
- Agard, N. J., Prescher, J. A., Bertozzi, C. R. A Strain-Promoted [3 + 2] Azide−Alkyne Cycloaddition for Covalent Modification of Biomolecules in Living Systems. Journal of the American Chemical Society. 126 (46), 15046-15047 (2004).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels−Alder Reactivity. Journal of the American Chemical Society. 130 (41), 13518-13519 (2008).
- Houghton, J. L., et al. Establishment of the In Vivo Efficacy of Pretargeted Radioimmunotherapy Utilizing Inverse Electron Demand Diels-Alder Click Chemistry. Molecular Cancer Therapeutics. 16 (1), 124-133 (2017).
- Membreno, R., Cook, B. E., Fung, K., Lewis, J. S., Zeglis, B. M. Click-Mediated Pretargeted Radioimmunotherapy of Colorectal Carcinoma. Molecular Pharmaceutics. 15 (4), 1729-1734 (2018).
- Reiner, T., Lewis, J. S., Zeglis, B. M. Harnessing the Bioorthogonal Inverse Electron Demand Diels-Alder Cycloaddition for Pretargeted PET Imaging. Journal of Visualized Experiments. (96), e52335 (2015).
- Cook, B. E., Membreno, R., Zeglis, B. M. Dendrimer Scaffold for the Amplification of In Vivo Pretargeting Ligations. Bioconjugate Chemistry. 29 (8), 2734-2740 (2018).
- Cheal, S. M., et al. Theranostic Pretargeted Radioimmunotherapy of Colorectal Cancer Xenografts in Mice Using Picomolar Affinity Y-86- or Lu-177-DOTA-Bn Binding scFv C825/GPA33 IgG Bispecific Immunoconjugates. European journal of nuclear medicine and molecular imaging. 43 (5), 925-937 (2016).
- Meyer, J. -. P., et al. Bioorthogonal Masking of Circulating Antibody-TCO Groups Using Tetrazine-Functionalized Dextran Polymers. Bioconjugate Chemistry. 29 (2), 538-545 (2018).
- Houghton, J. L., et al. Pretargeted Immuno-PET of Pancreatic Cancer: Overcoming Circulating Antigen and Internalized Antibody to Reduce Radiation Doses. Journal of Nuclear Medicine. 57 (3), 453-459 (2016).
- Keinänen, O., et al. Pretargeting of Internalizing Trastuzumab and Cetuximab with a (18)F-Tetrazine Tracer in Xenograft Models. European Journal of Nuclear Medicine and Molecular Imaging Research. 7, 95 (2017).
- Billaud, E. M. F., et al. Micro-flow Photosynthesis of New Dienophiles for Inverse-Electron-Demand Diels-Alder Reactions. Potential Applications for Pretargeted In Vivo PET Imaging. Chemical Science. 8 (2), 1251-1258 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon