Method Article
Isolamento dei tilacoidi fisiologicamente attivo e il loro uso nelle analisi di trasporto energia-dipendente della proteina
In questo articolo
Riepilogo
Vi presentiamo protocolli qui per isolamento ad alto rendimento di tilacoidi fisiologicamente attivo e analisi di trasporto di proteina per la traslocazione di cloroplasto doppia arginina (cpTat), secretiva (cpSec1) e vie di segnale riconoscimento delle particelle (cpSRP).
Abstract
Cloroplasti sono gli organelli in piante verdi responsabile per lo svolgimento di numerose vie metaboliche essenziali, in particolare la fotosintesi. Entro i cloroplasti, il sistema a membrana tilacoide ospita tutti i pigmenti fotosintetici, complessi del centro di reazione e la maggior parte degli elementi portanti dell'elettrone ed è responsabile della sintesi di ATP di luce-dipendente. Oltre il 90% delle proteine del cloroplasto sono codificate nel nucleo, tradotta nel citosol e successivamente importati nel cloroplasto. Ulteriore trasporto di proteine in o attraverso la membrana tilacoide utilizza uno dei quattro percorsi di spostamento. Qui, descriviamo un metodo ad alto rendimento per l'isolamento di trasporto-competente tilacoidi dai piselli (Pisum sativum), insieme a saggi di trasporto attraverso le tre energia-dipendente cpTat, cpSec1 e cpSRP-ha mediato le vie. Questi metodi consentono sperimentazioni relative alla localizzazione della proteina tilacoide, trasporto energetica e i meccanismi di traslocazione di proteine attraverso le membrane biologiche.
Introduzione
Quasi tutti i macchinari PROTEINICO responsabili cloroplasto corretta funzione deve essere spostati dal cytosol1. Presso le buste del cloroplasto, substrati della proteina sono importati attraverso il Traslocone della membrana esterna (TOC) e il Traslocone della membrana interna (TIC)2. Ulteriormente il targeting per il thylakoid membrana e lume si verifica attraverso la doppia arginina traslocazione (cpTat)3, il secretiva (cpSec1)4, il segnale riconoscimento delle particelle (cpSRP)5e i percorsi di inserimento spontaneo6 . Un metodo per l'isolamento ad alto rendimento dei cloroplasti fisiologicamente attivi e membrane tilacoidali è necessario misurare l'energetica e la cinetica di un evento di spostamento, per comprendere i meccanismi di trasporto diversi in ciascun percorso e per localizzare un substrato particolare proteina di interesse per uno qualsiasi dei sei comparti distinti del cloroplasto.
L'isolamento delle membrane da cloroplasto offre meglio sperimentale controllo sui fattori ambientali (quali le concentrazioni di sale e substrato, la presenza di ATP/GTP e condizioni di pH) che influenzano la misurazione dell'energetica di trasporto e cinetica. Questo ambiente in vitro si presta all'esplorazione dei dettagli meccanicistici di spostamento per gli stessi motivi. Inoltre, mentre software predittivo per la localizzazione delle proteine cloroplasto è migliorata7,8, in vitro trasporto saggi forniscono un metodo più veloce per la conferma nel corso di base di microscopia fluorescente saggi che richiedono un tag fluorescente geneticamente codificato, impianto di trasformazione e/o gli anticorpi specifici. Qui, presentiamo protocolli per isolamenti cloroplasto e tilacoidale da piselli (Pisum sativum), così come per le analisi di trasporto ottimizzate per ciascuna delle vie traslocazione thylakoid energia-dipendente.
Protocollo
1. materiali iniziale
- Ammollo circa 55 g di piselli per 3 ore in 400 mL di acqua distillata e quindi seminare in un vassoio di plastica (35 x 20 cm x 6 cm) in terreno coperto con sottile strato di vermiculite.
- Crescere il vassoio di piselli a 20 ° C sotto ciclo luce/buio (50 µE/m2s) 12/12 h per 9-15 giorni.
- Preparare il substrato proteico secondo un metodo preferito.
Nota: Abbiamo preparato substrati della proteina usando una varietà di metodi, tra cui 1) trascrizione in vitro da plasmidi purificati seguita da traduzione utilizzando estratti di germe di grano o di lisati di reticolociti di coniglio in presenza [3H]-leucina o [35S]-metionina, 2) traduzione in vitro utilizzando un kit di trascrizione/traduzione accoppiato come il TnT Kit Promega, con radiolabeling come sopra, e 3) la purificazione della proteina overexpressed in Escherichia coli. Prodotti radioattivi in vitro traduzione generalmente vengono temprati con 50mm aminoacido freddo prima dell'uso in reazioni di trasporto. Ciascuno di questi metodi in genere richiede qualche ottimizzazione per ogni nuova proteina substrato. Per un esempio di un sistema accoppiato in vitro , vedere Ling e Jarvis (2016)9.
2. quantificazione e isolamento cloroplasto
Nota: Il primo passo nella preparazione dei tilacoidi è l'isolamento dei cloroplasti intatti10. Tutti i materiali dovrebbero essere tenuti a freddi durante la preparazione. Risospensione dei cloroplasti deve essere maneggiati con delicatezza, come rottura in questa fase può limitare severamente thylakoid successiva resa.
- Preparare in seguito soluzioni in anticipo.
- 2 x rettifica Buffer (2xGB): 100 millimetri K-HEPES pH 7.3, sorbitolo di 660 mM, 2 mM MgCl2, 2mm MnCl2, 4mm EDTA, 0,2% di BSA.
- 2 x importazione Buffer (2xIB): 100 mM K-Tricine o K-HEPES pH 8.0, sorbitolo di 660 mM, 8 mM MgCl2.
Nota: Le concentrazioni di MgCl2 che vanno da 3 mM a 10 mM sono state utilizzate senza differenze osservabili.
- Preparare un gradiente di densità continuo mediante centrifugazione di una miscela di 15 mL di Percoll e 15 mL di 2xGB a 30.900 g in un rotore ad angolo fisso per 30 min a 4 ° C con il freno fuori.
- Raccogliere circa 25 g di piselli 9-15 giorno vecchio e omogeneizzare in 95 mL di 1xGB. O un frullatore con lame affilate o un Polytron sono stati utilizzati con successo. Filtrare la miscela attraverso almeno 2 strati di Miracloth in un imbuto.
Nota: Limitare la quantità di staminali tessuto non è necessario ma semplificano il processo di omogeneizzazione, riducendo così la rottura del cloroplasto che possa verificarsi con miscelazione prolungata. - Pellet a 3.000 g in un rotore oscillante per 5 min a 4 ° C e Risospendere delicatamente in 1 mL di 1xGB. Un pennello può essere la più delicata tecnica di risospensione.
- Strato con attenzione la sospensione verde in cima al gradiente di Percoll e centrifugare a 8.000 g in un rotore oscillante per 10 min a 4 ° C con il freno fuori.
- Accuratamente raccolto la banda inferiore verde contenente cloroplasti intatti in una nuova provetta. Spin recuperati intatti cloroplasti a 1.800 g in un rotore oscillante per 5 min a 4 ° C, scartare il surnatante e Risospendere delicatamente in 1xIB. Ripetere questo passaggio di lavaggio una volta di più, risospendere in 30 mL di 1xIB ogni volta, con il finale risospensione in 1 mL di 1xIB.
- Per quantificare il contenuto di clorofilla (Chl), mescolare 10 µ l di sedimento completamente cloroplasti con 5 mL di 80% di acetone e filtrare attraverso carta da filtro Whatman 1 (spessore nominale 180 µm). Annotare l'assorbanza a 720 nm, 663 nm e 645 nm in uno spettrofotometro e calcolare la concentrazione di Chl utilizzando la seguente formula11:
[Chl] mg/mL = [40.2* (un663 – un720) + 101.4* (un645 – un720)] * 0,1 - Regolare i cloroplasti a 1mg/mL Chl equivalenti con 1xIB.
3. isolamento dei tilacoidi
Nota: Tilacoidi sono preparati da Lisi ipotonica dei cloroplasti intatti. Ciò si ottiene esponendo i cloroplasti in un buffer ipotonico carente sorbitolo. Tilacoidi isolato possono essere utilizzato per qualsiasi delle vie di traslocazione analizzante, ma stromal Estratto (SE) inoltre deve essere isolato durante questa preparazione se vie o cpSec1 o cpSRP sono di essere studiato.
- Preparare in anticipo le seguenti soluzioni.
- Buffer di lisi ipotonico: 50mm K-Tricine o K-HEPES pH 8.0, 8 mM MgCl2.
- 2 x grezzo Stroma Buffer (per la concentrazione del SE): 100 millimetri K-HEPES pH 8.0, sorbitolo di 660 mM, 8 mM MgCl2.
- Tampone di Laemmli (per SDS-PAGE, completati con EDTA): 125 mM Tris-HCl pH 6.8, SDS 10%, 20% glicerolo, blu di bromofenolo 0,05 mg/mL, 10% β-mercaptoetanolo, 10mm EDTA.
- Se non è necessario SE recuperare, centrifugare i cloroplasti intatti a 1.000 g in un rotore oscillante per 6 min a 4 ° C.
- Scartare il surnatante e risospendere a 1 mg/mL in tampone di Lisi ipotonica. Incubare in ghiaccio al buio per 10 min, con occasionali di miscelazione.
- Recuperare i tilacoidi mediante centrifugazione a 3.200 g nel rotore per 8 min oscillante a 4 ° C. Lavare i tilacoidi due volte, risospendere con 1-2 mL di tampone di lisi ogni volta. Risospendere con 1 mL di 1xIB e requantify Chl come sopra dal protocollo di isolamento del cloroplasto.
4. concentrazione e recupero stromal Estratto
- Se ripristino SE è necessario, dividere i cloroplasti intatti in 600 aliquote µ l in provette per microcentrifuga da 1,5 mL e centrifugare ogni provetta a 1.000 g nel rotore per 6 min oscillante a 4 ° C.
Nota: Questo volume è conveniente quando si utilizzano provette microcentrifuga da 1,5 mL, che aiuta a prevenire la dispersione del pellet eventuali per membrane residue.- Risospendere a 1mg/mL Chl in tampone di Lisi ipotonica e incubare in ghiaccio al buio per 10 minuti, come descritto al punto 3.2.1.
- Centrifugare le provette a 3.200 x g a rotore per 8 min oscillante a 4 ° C e la luce verde o giallo surnatante seguente cloroplasto lisi di trasferimento ad un nuovo tubo del microcentrifuge con un volume uguale di 2 x grezzo Stroma Buffer.
- Lavare tilacoidi con 2 volumi di tampone di lisi (approssimazione di 0,5 mg/mL) e raccogliere mediante centrifugazione a 3.200 g nel rotore per 8 min oscillante a 4 ° C. Risospendere a 1mg/mL Chl in 1xIB su ghiaccio.
- Centrifugare il greggio stroma a 42.000 g in un rotore ad angolo fisso per 30 min a 4 ° C per rimuovere membrane residue. Immunoblotting per proteine dell'involucro esterno e quello interno può essere utilizzato per verificare la purezza del surnatante.
- Raccogliere il 95% del volume da ciascuna provetta senza disturbare la piccola pallina di colore giallo-verde. Nota il volume prelevato da ciascuna provetta.
- Per preparare l'estratto concentrato di stromal (SE), raccogliere i raccolti supernatanti e concentrarsi quintuplo utilizzando un concentratore a 4 mL 30 kDa MWCO.
Nota: SE preparato in questo modo equivale allo stroma derivato da cloroplasti a 2,5 mg/mL CHL. Se necessario, SE possono essere dieci volte concentrati a 5 mg/mL Chl equivalenti. SE sarà di colore dorato e viscoso. Nella centrifuga di leggenda RT del laboratorio con rotore oscillante, questo richiede circa 10 min per mL concentrato.
5. trasporto attraverso la cpTat via
Nota: A differenza del cpSec1 o cpSRP, la via di cpTat non richiede componenti solubili o esogenicamente aggiunto fonti energetiche; solo la forza motrice protonica luce-driven è necessario3. Pertanto, solo isolato proteico tilacoidi e substrato sono necessari per il dosaggio. Substrati tipici sono forme intermedie del 17 kDa (come si vede nella Figura 1) e 23 kDa subunità dell'ossigeno in evoluzione complessa, iOE17 e iOE23, rispettivamente, ma forme precursore, prOE17 e prOE23, inoltre può essere trasportato con successo. Forme di precursore hanno l'intera bipartita sequenza N-terminale targeting, mentre forme intermedie hanno solo il thylakoid sequenza di targeting.
- Preparare la miscela di trasporto di cpTat con 0,33 mg/mL Chl tilacoidi, 5mm ATP da un brodo preparato in 1xIB e 8mm ditiotreitolo (DTT) da un brodo preparato in 1xIB, sul ghiaccio. ATP non è strettamente necessario per questa reazione se condotti nell'ambito dell'illuminazione.
- Avvia trasporto introducendo 01:30 volume per volume della proteina substrato nel trasporto mescolare. Se proteina substrato non è preparata a 1xIB, preparare una diluizione con 2xIB in primo luogo, quindi utilizzare 01:30 volume per volume del substrato diluito nel mix trasporto 1:1.
Nota: Le concentrazioni di substrato varierà in base al metodo di preparazione. In genere, preparazioni in vitro permetterà nanomolari micromolar importi, mentre sovraespressione permetterà per micromolar agli importi millimolar. Metodi di rilevamento devono anche essere considerati, come autoradiografia e fluorography sono più sensibili di immunoblotting. - Illuminare la sospensione a 80-100 µE/m2s di radiazione fotosinteticamente attiva (PAR) per 10 min a temperatura ambiente. Se la cinetica del trasporto è richiesto, la pre-equilibrare mix tilacoidi e la reazione a temperatura ambiente e illuminare per fino a 30 min.
- Arrestare la reazione di trasporto con una diluizione 8 volte di 1xIB ghiacciata e recuperare tilacoidi mediante centrifugazione a 3.200 g in microcentrifuga per 5 min a 4 ° C.
- Rimuovere residuo substrato che non è stato trasportato, risospendere il pellet thylakoid in 120 µ l di 1xIB e digerire le proteine esterne tramite l'aggiunta di 6 µ l di 2 mg/mL termolisina e 10 mM CaCl2 in 1xIB.
- Incubare la reazione di proteasi in ghiaccio per 40 min e poi placare la proteasi raddoppiando il volume con 25 mM EDTA preparato in 1xIB.
- Recuperare i tilacoidi mediante centrifugazione a 3.200 g in una microcentrifuga per 5 min a 4 ° C. Lavare tilacoidi recuperati in 120 μL di 5mm EDTA in 1xIB e trasferirlo in una nuova provetta.
- Centrifugare a 3.200 g in una microcentrifuga per 5 min a 4 ° C. Risospendere in un appropriato volume di tampone di Laemmli completati con 10 mM EDTA. Un volume di 40 µ l di solito è sufficiente a rilevare substrato su un gel di SDS-PAGE e conserva il campione per ripetere i gel quando necessario.
- I campioni in un bagno di acqua bollente per 10 min e analizzare da SDS-PAGE. Autoradiografia, fluorography o macchiarsi occidentale delle proteine non-nativi o epitopo-tag sono stati utilizzati con successo per il rilevamento delle proteine trasportati.
6. trasporto attraverso la via di cpSec1
Nota: Il trasporto attraverso il Traslocone cpSec1 richiede la proteina stromal cpSecA112,13, che possono essere acquistati tramite sovraespressione in e. coli14,15 o recuperati dalla concentrazione dello stroma durante l'isolamento thylakoid. Un substrato tipico è la subunità 33 kDa dell'ossigeno in evoluzione complessa (prOE33), come si vede nella Figura 2.
- Preparare la miscela di trasporto cpSec1 con 0,33 mg/mL Chl tilacoidi, 0,83 mg/mL Chl equivalente SE o 1,5 μg di cpSecA1 ricombinante e 5mm ATP sul ghiaccio e incubare per 10 min. Una miscela di reazione di trasporto tipico qui è 72 μL, fino da 60 μL a causa dell'aggiunta di SE.
- Se invece SE verrà utilizzato cpSecA1 ricombinante, regolare cpSecA1 purificata con un volume uguale di 2xIB, quindi diluire ad una concentrazione conveniente per aggiungere delle reazioni di trasporto (ad esempio, 0,75 µ g / µ l).
Nota: Per l'archiviazione a lungo termine, cpSecA1 viene memorizzato sul ghiaccio in una stanza controllata, refrigerata dopo purificazione come congelamento abolisce l'attività.
- Se invece SE verrà utilizzato cpSecA1 ricombinante, regolare cpSecA1 purificata con un volume uguale di 2xIB, quindi diluire ad una concentrazione conveniente per aggiungere delle reazioni di trasporto (ad esempio, 0,75 µ g / µ l).
- Avvia trasporto introducendo 01:10 volume per volume della proteina substrato al trasporto mescolare. Se la proteina substrato non è preparata a 1xIB, preparare una diluizione di 1:1 con 2xIB e aggiungere 01:10 volume per volume della proteina diluita per il mix di trasporto.
- Incubare la reazione a temperatura ambiente per 10 min, con 80 – 100 µE/m2s PAR. Ancora una volta, tempi più lunghi possono essere necessari per alcuni substrati o cinetica.
- Dopo trattamento con luce, diluire 8 volte con gelide reazioni 1xIB e centrifugare a 3200 g in microcentrifuga per 5 min a 4 ° C.
- Trattare con termolisina e dissetare con EDTA come sopra in passaggi 5.5 attraverso 5.7.
- Centrifugare a 3.200 g in microcentrifuga per 5 min a 4 ° C e risospendere il pellet in un appropriato volume di tampone di Laemmli completati con 10 mM EDTA. Posto a bagnomaria per 10 min prima del caricamento su gel di SDS-PAGE bollente.
7. inserimento attraverso il Pathway di cpSRP
Nota: L'integrazione di cpSRP-mediata di luce complesse proteine (LHCP) visto nella Figura 3 la raccolta richiede cpSRP54, cpSRP43 e cpFtsY16. Questi componenti vengono forniti per la reazione di trasporto attraverso Estratto concentrato di stromal, come descritto per il protocollo di trasporto cpSec1.
- Preparare il cpSRP trasporto mix con 0,33 mg/mL Chl tilacoidi, 0,83 mg/mL SE equivalente Chl e 5mm ATP sul ghiaccio e incubare per 10 min.
- Avvia trasporto introducendo 01:10 volume per volume della proteina substrato al trasporto mescolare. Se la proteina substrato non è preparata a 1xIB, preparare una diluizione di 1:1 con 2xIB e aggiungere 01:10 volume per volume della proteina diluita per il mix di trasporto.
- Incubare la reazione a temperatura ambiente per 10 min a 80 – 100 µE/m2s PAR.
- Dopo trattamento con luce, diluire 8 volte con gelide reazioni 1xIB e centrifugare a 3.200 g in microcentrifuga per 5 min a 4 ° C. Eliminare il surnatante e risospendere il pellet in 120 µ l di 1xIB.
- Trattare con termolisina come sopra nelle sezioni 5.5 tramite 5.7. Termolisina digestione è necessaria qui per valutare integrazione riuscita membrana. Lavare tilacoidi recuperati in 120 μL di 5mm EDTA in 1xIB e trasferirlo in una nuova provetta.
- Centrifugare a 3.200 g in microcentrifuga per 5 min a 4 ° C e risospendere il pellet nuovamente in un appropriato volume di tampone di x Laemmli 2 completati con 10 mM EDTA. Posto a bagnomaria per 10 min prima dell'analisi di SDS-PAGE bollente.
Nota: Integrazione di maturo LHCP (mLHCP) è valutato dalla comparsa di un prodotto di degradazione della proteasi-protetto (mLHCP-D) circa 1.5-2 kDa minore l' ApoAlert mLHCP17.
Risultati
Per misurare la quantità di substrato correttamente trasportato, è utile includere una o più corsie di "ingresso per cento". Per i dati presentati di seguito, è stato utilizzato il 10% della reazione trasporto finale senza tilacoidi. Questo ingresso"percentuale" aiuta anche a visualizzare le dimensioni del substrato precursore. La percentuale rappresenta una quantità del substrato con cui al substrato confronta trasportato contro nota, definita e possa essere regolata su o giù come necessario usando inizialmente preparato proteina. Inoltre, è consigliabile caricare meno di 4 µ g di equivalenti di Chl in una sola corsia su gel di poliacrilammide di 0,75 mm per evitare banda orditura e sbavature. Tutti i substrati qui sotto sono stati preparati e radioattivi utilizzando kit di traduzione in vitro .
Trasporto di iOE17 con cpTat via
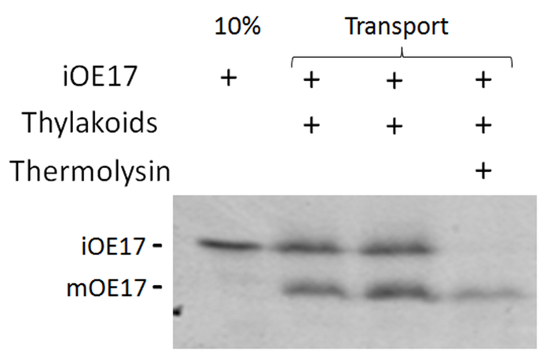
Figura 1 . Servizi di trasporto della iOE17through la via cpTat. Fluorograph di [3H]-iOE17 trasporto dosaggio e termolisina trattamento del substrato non trasportati. Clicca qui per visualizzare una versione più grande di questa figura.
Trasporto di cpTat successo della maggior parte dei substrati Tat può essere rilevato da un cambiamento di dimensione su fenditura del peptide segnale N-terminale3. In substrati dove nessun peptide segnale spaccabili esiste18,19, trattamento con proteasi è richiesto di rivelare il substrato che ha attraversato la membrana, diventando così inaccessibile alla digestione dalla proteasi. In Figura 1, trasporto di iOE17 risultati in un cambiamento di dimensione di circa 2-3 kDa fra il substrato introdotto e il maturo elaborati modulo. Substrato trasportato non è degradata attraverso trattamento con proteasi (vicolo 4).
Trasporto di prOE33 con cpSec1 via
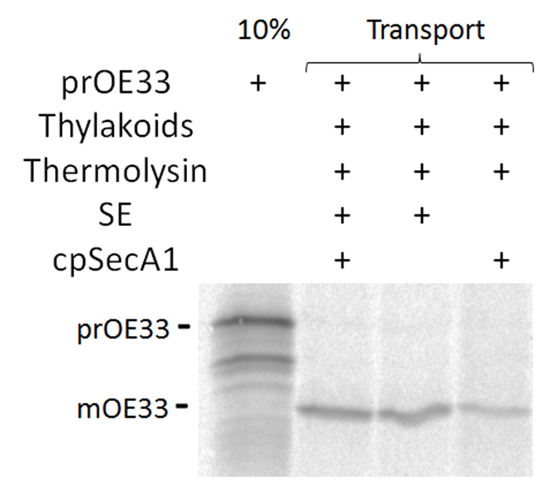
Figura 2 . Trasporto di prOE33 con cpSec1 via. Autoradiograph [35S]-prOE33 analisi di trasporto usando SE, cpSecA1 purificata o entrambi contemporaneamente. Clicca qui per visualizzare una versione più grande di questa figura.
Trasporto attraverso la via di cpSec1 (Figura 2) può essere valutata attraverso un cambiamento di dimensione nel substrato maturo se il substrato contiene un thylakoid spaccabili targeting segnale, come pure la protezione di proteasi di substrato trasportato20.
Integrazione di prLHCP con cpSRP via
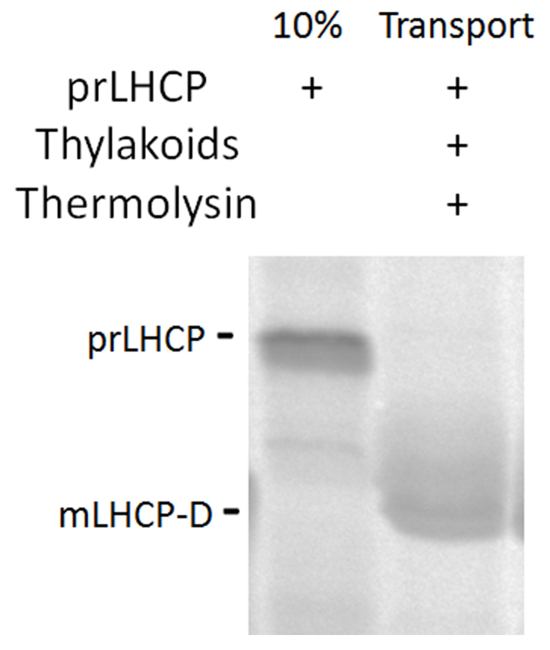
Figura 3 . Integrazione di prLHCP con cpSRP via. Autoradiograph [35S]-prLHCP e digestione per il prodotto mLHCP-D dopo l'inserimento nella membrana tilacoide. Clicca qui per visualizzare una versione più grande di questa figura.
Inserimento di prLHCP nella membrana tilacoide via la via di cpSRP può essere valutata attraverso la digestione termolisina. Un cambiamento di dimensione di circa 1.5-2 kDa è indicativo dell'inserzione della membrana di successo come la membrana protegge la proteina matura ApoAlert da proteolisi completa15. Nella Figura 3, il prodotto protetto da proteasi mLHCP-D è chiaramente visibile.
Discussione
Cloroplasto e tilacoidale isolamento
La rottura eccessiva può causare nel cloroplasto povero isolamento e così povero thylakoid resa dopo la separazione della sfumatura. È meglio omogeneizzare il tessuto raccolto delicatamente facendo in modo che tutto il materiale è sommerso prima di miscelazione e pulsare in 15 cicli di s fino a quando completamente omogeneizzato. Se necessario, utilizzare più cicli più brevi di miscelazione con meno tessuto in ogni round.
Tutti i materiali che entrano in contatto con tessuto raccolto di refrigerazione aiuta isolati cloroplasti per conservare attività fino a 2 ore. È importante mantenere i cloroplasti su ghiaccio al buio dopo isolamento pure.
È fondamentale includere magnesio nei buffer contattando tilacoidi isolato. Così facendo non si traduce in granal disimpilamento e criticamente colpisce la generazione della forza motrice protonica su illuminazione21. Tilacoidi sono stati utilizzati nelle reazioni di trasporto a 2 ore dopo l'isolamento quando tenuti sul ghiaccio e al buio.
Ottimizzazione delle reazioni di trasporto
Tilacoidi isolati possono provocare disparità Chl equivalenti tra le reazioni e trasferirsi rapidamente. Come tale, è importante mescolare i tilacoidi accuratamente prima dell'uso, soprattutto durante l'impostazione di un gran numero di campioni.
Il Pathway di Tat
L'efficienza dei trasporti attraverso il pathway di Tat può essere ridotto su lavaggio eccessivo dei tilacoidi dal Tha4 (TatA) possa essere parzialmente estratti da membrana22. In tali casi, è utile per ridurre le fasi di lavaggio thylakoid prima della reazione di trasporto. Inoltre, tempi più lunghi di illuminazione possono migliorare rilevamento dove substrati scarsamente sono trasportati in condizioni tipiche.
La via di cpSec1
Quando analizzando la via di cpSec1, la quantità di cpSecA1 in SE concentrato deve supportare trasporti, ma che il trasporto può essere debole. Trasporti efficienti in tilacoidi isolato possono beneficiare l'aggiunta di cpSecA1 purificato per determinate proteine, anche se stromali chaperoni in SE anche possono contribuire ad aumentare l'efficienza di trasporto15. Inoltre, preparazioni a base di proteine di cpSecA1 non deve essere congelati prima dell'utilizzo nel settore dei trasporti, come questo riduce l'attività di trasporto. Allo stesso modo, SE congelato è meno efficace estratto preparata al momento. Come trasporto di Tat, periodi di incubazione più lungo del mix di trasporto possono aiutare con substrati difficili.
CpSRP via
Mentre la ricostituzione di trasporto cpSRP uso dei singoli componenti è stato eseguito23, è conveniente per la fornitura di cpSRP43, cpSRP54, e cpFtsY con resistenza SE. Thermolysin è i criteri più stringenti per LHCP integrazione16, 17, ma estrazione alcalina può essere eseguita come ben17. Mentre precursori spesso possono essere congelati e conservati a-80 ° C per molte reazioni di trasporto, preparato dalla sintesi in vitro di prLHCP deve essere utilizzato per il trasporto immediatamente dopo sintesi senza congelamento.
Caratterizzazione di un substrato romanzo alle Targeting del Pathway
In casi in cui la via di traslocazione presa da un substrato romanzo è sconosciuta, si consiglia di indagare prima possibile segnale peptidi in silico usando la sequenza aminoacidica del precursore o forma intermedia. La via di cpTat in genere richiede un motivo di consenso specifico doppia arginina nel peptide di segnale e non ATP per il trasporto di successo sotto PAR3. A differenza di pathway Tat, la via di cpSec1 richiede ATP e la proteina di cpSecA1. Trasporto non riuscita in condizioni carenti questi componenti suggerisce la via cpSec120. La via di cpSRP richiede che la particella di riconoscimento del segnale trovato in SE. non riuscito il trasporto utilizzando cpSecA1 purificata e ATP, ma una mancanza di motivi di consenso di arginina doppia nel peptide segnale, suggerisce la via cpSRP23.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo manoscritto è stato preparato con finanziamento da parte della divisione di scienze chimiche, Geoscienze e Biosciences, 408 ufficio energia delle scienze di base del dipartimento di energia attraverso Grant DE-SC0017035
Materiali
| Name | Company | Catalog Number | Comments |
| Pisum sativum seeds | Seedway LLC, Hall, NY | 8686 - Little Marvel | |
| Miracloth | Calbiochem, Gibbstown, NJ | 475855-1 | |
| 80% Acetone | Sigma, Saint Louis, MO | 67-64-1 | |
| Blender with sharpened blades | Waring Commercial | BB155S | |
| Polytron 10-35 | Fischer Sci | 13-874-617 | |
| Percoll | Sigma, Saint Louis, MO | GE17-0891-01 | |
| Beckman J2-MC with JA 20 rotor | Beckman-Coulter | 8043-30-1180 | |
| Sorvall RC-5B with HB-4 rotor | Sorvall | 8327-30-1016 | |
| 100 mM dithiothreitol (DTT) in 1xIB | Sigma, Saint Louis, MO | 12/3/83 | Can be frozen in aliquots for future use |
| 200 mM MgATP in 1xIB | Sigma, Saint Louis, MO | 74804-12-9 | Can be frozen in aliquots for future use |
| Thermolysin in 1xIB (2mg/mL) | Sigma, Saint Louis, MO | 9073-78-3 | Can be frozen in aliquots for future use |
| HEPES | Sigma, Saint Louis, MO | H3375 | |
| K-Tricine | Sigma, Saint Louis, MO | T0377 | |
| Sorbitol | Sigma, Saint Louis, MO | 50-70-4 | |
| Magnesium Chloride | Sigma, Saint Louis, MO | 7791-18-6 | |
| Manganese Chloride | Sigma, Saint Louis, MO | 13446-34-9 | |
| EDTA | Sigma, Saint Louis, MO | 60-00-4 | |
| BSA | Sigma, Saint Louis, MO | 9048-46-8 | |
| Tris | Sigma, Saint Louis, MO | 77-86-1 | |
| SDS | Sigma, Saint Louis, MO | 151-21-3 | |
| Glycerol | Sigma, Saint Louis, MO | 56-81-5 | |
| Bromophenol Blue | Sigma, Saint Louis, MO | 115-39-9 | |
| B-Mercaptoethanol | Sigma, Saint Louis, MO | 60-24-2 |
Riferimenti
- Ellis, R. Chloroplast protein synthesis: principles and problems. Sub-cellular biochemistry. 9, 237 (1983).
- Li, H. -. m., Chiu, C. -. C. Protein transport into chloroplasts. Annual review of plant biology. 61, (2010).
- Cline, K., Ettinger, W., Theg, S. M. Protein-specific energy requirements for protein transport across or into thylakoid membranes. Two lumenal proteins are transported in the absence of ATP. Journal of Biological Chemistry. 267 (4), 2688-2696 (1992).
- Skalitzky, C. A., et al. Plastids contain a second sec translocase system with essential functions. Plant physiology. 155 (1), 354-369 (2011).
- Dabney-Smith, C., Storm, A. . Plastid Biology. , 271-289 (2014).
- Kim, S. J., Jansson, S., Hoffman, N. E., Robinson, C., Mant, A. Distinct "assisted" and "spontaneous" mechanisms for the insertion of polytopic chlorophyll-binding proteins into the thylakoid membrane. Journal of Biological Chemistry. 274 (8), 4715-4721 (1999).
- Emanuelsson, O., Nielsen, H., Von Heijne, G. C. h. l. o. r. o. P. ChloroP, a neural network-based method for predicting chloroplast transit peptides and their cleavage sites. Protein Science. 8 (5), 978-984 (1999).
- Emanuelsson, O., Brunak, S., Von Heijne, G., Nielsen, H. Locating proteins in the cell using TargetP, SignalP and related tools. Nature protocols. 2 (4), 953 (2007).
- Ling, Q., Jarvis, R. Analysis of protein import into chloroplasts isolated from stressed plants. Journal of Visualized Experiments. (117), e54717 (2016).
- Lo, S. M., Theg, S. M. . Photosynthesis Research Protocols. , 139-157 (2011).
- Vernon, L. P. Spectrophotometric determination of chlorophylls and pheophytins in plant extracts. Analytical Chemistry. 32 (9), 1144-1150 (1960).
- Knott, T. G., Robinson, C. The secA inhibitor, azide, reversibly blocks the translocation of a subset of proteins across the chloroplast thylakoid membrane. Journal of Biological Chemistry. 269 (11), 7843-7846 (1994).
- Yuan, J., Henry, R., McCaffery, M., Cline, K. SecA homolog in protein transport within chloroplasts: evidence for endosymbiont-derived sorting. Science. 266 (5186), 796-798 (1994).
- Nohara, T., Nakai, M., Goto, A., Endo, T. Isolation and characterization of the cDNA for pea chloroplast SecA Evolutionary conservation of the bacterial-type SecA-dependent protein transport within chloroplasts. FEBS letters. 364 (3), 305-308 (1995).
- Endow, J. K., Singhal, R., Fernandez, D. E., Inoue, K. Chaperone-assisted post-translational transport of plastidic type I signal peptidase 1. Journal of Biological Chemistry. 290 (48), 28778-28791 (2015).
- Luirink, J., Sinning, I. SRP-mediated protein targeting: structure and function revisited. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research. 1694 (1-3), 17-35 (2004).
- Yuan, J., Henry, R., Cline, K. Stromal factor plays an essential role in protein integration into thylakoids that cannot be replaced by unfolding or by heat shock protein. Hsp70. Proceedings of the National Academy of Sciences. 90 (18), 8552-8556 (1993).
- Tjalsma, H., van Dijl, J. M. Proteomics-based consensus prediction of protein retention in a bacterial membrane. Proteomics. 5 (17), 4472-4482 (2005).
- Widdick, D. A., Eijlander, R. T., van Dijl, J. M., Kuipers, O. P., Palmer, T. A Facile Reporter System for the Experimental Identification of Twin-Arginine Translocation (Tat) Signal Peptides from All Kingdoms of Life. Journal of Molecular Biology. 375 (3), 595-603 (2008).
- Yuan, J., Cline, K. Plastocyanin and the 33-kDa subunit of the oxygen-evolving complex are transported into thylakoids with similar requirements as predicted from pathway specificity. Journal of Biological Chemistry. 269 (28), 18463-18467 (1994).
- Kirchhoff, H., Borinski, M., Lenhert, S., Chi, L., Büchel, C. Transversal and lateral exciton energy transfer in grana thylakoids of spinach. Biochemistry. 43 (45), 14508-14516 (2004).
- Frielingsdorf, S., Jakob, M., Klösgen, R. B. A stromal pool of TatA promotes Tat-dependent protein transport across the thylakoid membrane. Journal of Biological Chemistry. 283 (49), 33838-33845 (2008).
- Tu, C. -. J., Schuenemann, D., Hoffman, N. E. Chloroplast FtsY, chloroplast signal recognition particle, and GTP are required to reconstitute the soluble phase of light-harvesting chlorophyll protein transport into thylakoid membranes. Journal of Biological Chemistry. 274 (38), 27219-27224 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon