Method Article
Correzione di bozze e saggio di riparazione del DNA usando l'analisi di spettrometria di massa di singolo Nucleotide estensione e MALDI-TOF
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Un metodo non-radio-isotopica non etichettata per correzione di bozze della polimerasi del DNA e un saggio di riparazione del DNA è stato sviluppato utilizzando la spettrometria di massa MALDI-TOF ad alta risoluzione e una strategia di estensione di singolo nucleotide. Il test ha dimostrato di essere molto specifico, semplice, rapida e facile da eseguire per la correzione di bozze e riparare le patch inferiore 9-nucleotidi.
Abstract
Il mantenimento del genoma e suo fedele replica è di primaria importanza per la conservazione di informazioni genetiche. Per valutare la replica ad alta fedeltà, abbiamo sviluppato un semplice non marcato e analisi di spettrometria (MS) per uno studio di correzione di bozze di massa non-radio-isotopica metodo utilizzando un'ionizzazione di matrix-assisted laser desorption con tempo di volo (MALDI-TOF). Qui, una polimerasi del DNA [per esempio, il frammento di Klenow della polimerasi di DNA di Escherichia coli (KF) ho (pol io) in questo studio] in presenza di tutti e quattro i trifosfati dideoxyribonucleotide viene utilizzato per elaborare un duplex non corrispondenti primer-modello. Il primer non corrispondente è quindi esteso Rileggi e sottoposti a MALDI-TOF MS. I prodotti si distinguono per la variazione della massa del primer fino a variazioni di singolo nucleotide. Importante, una correzione di bozze può anche essere determinato per interno singolo disadattamento, seppur alle efficienze diverse. Mancate corrispondenze in posizione 2-4-nucleotidi (nt) dall'estremità 3' sono stati efficacemente corretto da pol io, e una mancata corrispondenza alle 5 nt dal capolinea primer ha mostrato solo una parziale correzione. Nessuna correzione di bozze si è verificato per le mancate corrispondenze interne, situate al 6-9 nt da estremità 3' primer. Questo metodo può essere applicato anche ai test di riparazione del DNA (per esempio, valutare una riparazione di base-lesione dei substrati per la via di riparazione endo V). Primer contenenti 3' penultimo deoxyinosine (dI) lesioni potrebbe essere corretto da pol io. Infatti, penultimo T-I, G-I e A-ho substrati ha avuto loro ultimo 2 nucleotidi contenenti dI asportato da pol io prima di aggiungere un corretta ddN 5'-monofosfato (ddNMP) mentre la penultima C-mi mancate corrispondenze sono state tollerate da pol I, permettendo il primer per essere esteso senza riparazione, che dimostrano che la sensibilità e la risoluzione del MS test per misurare la riparazione del DNA.
Introduzione
Le funzioni di correzione di bozze di polimerasi del DNA durante la replicazione del DNA sono essenziali per garantire l'alta fedeltà dell'informazione genetica che deve essere trasferito alla progenie1,2,3,4, 5,6,7. Essendo in grado di valutare il contributo della polimerasi esonucleasi correzione di bozze sarebbe chiarire i meccanismi di salvaguardia della stabilità genetica.
Etichettatura del radioisotopo e gel a base di saggi in combinazione con analisi densitometriche del autoradiogrammi o fosforo imaging8,9,10 sono stati usati tradizionalmente per rilevare attività di correzione delle bozze del DNA polimerasi. Mentre funzionale, queste analisi sono laborioso, costoso e non suscettibili di formati ad alta velocità. In più, radioisotopi soffrono di problemi di sicurezza, compreso lo smaltimento dei rifiuti. In alternativa, correzione di bozze di attività sono stati analizzati mediante tecniche fluorometriche. Ad esempio, 2-aminopurine (2-AP) possa essere incorporati nei prodotti di estensione durante in vitro della polimerasi Revisione saggi per produrre un segnale fluorescente11,12. Purtroppo, questi approcci soffrono di una bassa specificità, poiché 2-AP può abbinare con timina e citosina. Approcci più recenti includono una sensibile basati su G-quadruplex luminescente accensione sonda per una polimerasi 3' - 5' esonucleasi dosaggio13 come pure una sonda fluorescente etichettati singolarmente per una polimerasi correzione bozze di dosaggio che supera alcuni del suddetti inconvenienti14. Entusiasmo per questi metodi fluorimetrici è diminuita a causa della necessità per l'etichettatura specifica dei substrati di DNA.
Al contrario, un MALDI-TOF MS per l'analisi del DNA è stata impiegata nell'analisi della PinPoint, dove le reazioni di estensione del primer con adenoide 4 ddNTP possono essere utilizzate per identificare i polimorfismi a un dato locus15,16,17 e è stato ampiamente adottato in applicazioni cliniche per i rilevamenti di mutazione e di diagnosi di cancro18. Utilizzando questi principi di base, abbiamo creato un'analisi senza etichetta per la determinazione in vitro del DNA polimerasi bozze attività sfruttando l'alta risoluzione, alta specificità e alto-rendimento potenziale di utilizzo di MALDI-TOF MS. E. coli DNA polimerasi ho Klenow frammento come un enzima di modello, dideoxyribonucleotide trifosfati (ddNTP) come substrati possono prendere un "snapshot" di correzione di bozze prodotti dopo un singolo nucleotide estensione tramite MALDI-TOF MS (Figura 1).
Allo stesso modo, questo metodo è stato sviluppato anche per un dosaggio di riparazione del DNA dove primer contenenti 3' penultima dI lesioni sono sottoposti a una pol che riparare dosaggio che imita endo V scalfito riparazione intermedi. Mentre non pienamente compreso, la via di riparazione endo V è l'unico sistema di riparazione conosciuto ad impiegare il pol ho correzione bozze attività esonucleasi per lesione asportazione19,20. Mediante MALDI-TOF MS, vi mostriamo una patch di riparazione chiaramente definiti dove dI possono essere asportate da pol io quando che si verificano sulle ultime 2 nt del primer prima di aggiungere il nucleotide accompagnato corretto.
Per lo studio della revisione e riparazione del DNA, questo metodo è più veloce e meno laborioso rispetto ai metodi precedenti e fornisce informazioni aggiuntive verso meccanismo e funzione.
Protocollo
1. primer/template preparazione
- Disegno primer/template con un equilibrato contenuto di G + C tra 40% e 60% come in un sequenziamento o disegno dell'iniettore di PCR. Utilizzare il primer di 18 a 21 nt per un appropriato ricottura e meglio MS segnali.
- Progettazione del modello impostando 50 ° C come il minimo di temperatura per la regione duplex con almeno 7 di fusione nt di 5'-sporgenza per separare i segnali tra il primer e il modello.
Nota: ad esempio, per il substrato P21/T28 nella tabella 1, il primer 21-nt è accoppiato con un modello 28-nt. Opzione: l'uso di acidi nucleici alternativi quali obbligazioni fosforotioato nucleasi-resistente per sostituire le ultime 4 fosfodiesterico all'estremità 3' del modello può prevenire possibili interferenze da una degradazione di fine aspecifici 3' dei modelli ( ad esempio, T28S4 in tabella 1), anche se questo aggiungerà alcuni costi per la preparazione del modello. - Utilizzo di oligonucleotidi standard dissalate senza ulteriore purificazione è soddisfacente per questo studio. Uso del oligonucleotide primer/modelli ad una concentrazione di 100 pmol / µ l in H2O come uno stock e conservare a-20 ° C. Controllare la qualità e la purezza del primer e modelli eseguendo i oligonucleotides su MALDI-TOF MS (passaggi da 4 a 7) per garantire l'unico picco segnali e un buon rapporto segnale-rumore.
- Determinare le intensità relative di segnale MALDI-TOF MS (passaggio 7) dei primer molare uguale delle sequenze rilevanti nella reazione per la calibrazione e la concentrazione normalizzazione (Figura 2).
2. reazioni di correzione di bozze
Nota: La stessa condizione di reazione correzione di bozze e il protocollo si applica a una riparazione del DNA della A-I, G-I, C-I e T-ho.
- Utilizzando una mancata corrispondenza di T-G del substrato P21/T28 per la correzione di bozze in tabella 1 come esempio, diluire primer P21 e modello T28 a 12,5 pmol / µ l con H2O; poi trasferimento 12 µ l di primer diluito e 12 µ l del modello diluito in una provetta da 1,5 mL sterilizzato microcentrifuga.
Nota: La quantità di miscela modello/primer è sufficiente per 2 reazioni; proporzionalmente aumentare di conseguenza il volume dei reagenti per le reazioni multiple. - Chiudere saldamente la provetta. Incubare per 30 min in un bagno coperto 65-° C acqua, seguito da 30 min in un bagno di acqua di 37 ° C e, infine, sul ghiaccio per garantire una corretta ricottura.
- In una provetta sterilizzata microcentrifuga da 1,5 mL, aggiungere 8 µ l di primer e mix di modello (50 pmol), 2 µ l di 10 x correzione bozze tampone di reazione, 4 µ l di miscela di 4 ddNTP (2 mM di ogni 4 dNTP) e H2O fino a 18 µ l. Flick il tubo per mescolare.
Nota: 1 x correzione di bozze reazione buffer contiene 50 mM NaCl, 10 mM MgCl2, 1 mM dithiothreitol e 10 mM Tris-HCl (pH 7.9 a 25 ° C). Vedi la Tabella materiali per la fonte commerciale di 10X tampone di reazione di correzione di bozze. La concentrazione finale di ogni ddNTP nella reazione è di 0,1 mM. - Diluire la DNA polimerasi nella gelida 1x tampone di reazione fino alla concentrazione desiderata di correzione di bozze [ad es., un tubo per microcentrifuga da 1,5 mL, aggiungere 4 µ l di 1 x correzione di bozze tampone di reazione e 1 µ l della polimerasi di Klenow 5-U da una fonte commerciale (tabella di Materials)]. Conservare l'enzima diluito su ghiaccio a tutti i tempi.
Nota: La quantità di polimerasi del DNA diluita è sufficiente per 2 reazioni; proporzionalmente aumentare di conseguenza il volume degli enzimi per reazioni multiple. Un volume di 2.0 µ l, contenente 2,0 unità della polimerasi di Klenow, può correggere le bozze di più della metà dei 50 pmoli di T-G terminal non corrispondenti P21/T28 in 5 min. - Preriscaldare il tubo del microcentrifuge con il mix di substrato dal passaggio 2.3 per la temperatura di reazione desiderata (ad esempio, in genere 37 ° C per Klenow della polimerasi e 25 ° C per T4 DNA polimerasi). Quindi trasferire la miscela di substrato preriscaldati 2.0 µ l della polimerasi del DNA diluita dal passaggio 2.4 e flick il tubo per mescolare il contenuto.
- Centrifugare le provette con enzima e substrato per pochi secondi a 3.200 x g a temperatura ambiente a rotazione verso il basso i componenti delle reazioni. Trasferire immediatamente la reazione a un blocco riscaldante o un bagno di acqua alla temperatura di incubazione desiderato come descritto al punto 2.5.
-
Terminare la reazione
- Aggiungere un volume equivalente di fenolo tamponato e mescolare nel Vortex per pochi secondi e centrifugare in una microcentrifuga a 3.200 x g a temperatura ambiente per 5 min.
- Trasferire la fase acquosa ad un tubo del microcentrifuge pulito e aggiungere un volume equivalente di cloroformio, mescolare nel Vortex per pochi secondi e centrifugare in un microfuge a 3.200 x g a temperatura ambiente per 3 min. trasferire la fase acquosa in una provetta pulita microfuge e in cubate esso a 95 ° C per 5 min; poi metterlo sul ghiaccio.
Attenzione: Fenolo e cloroformio sono sostanze chimiche pericolose. Manipolazione e smaltimento dovrebbe seguire regolamenti istituzionali.
- Trasferire la fase acquosa ad un tubo del microcentrifuge pulito e aggiungere un volume equivalente di cloroformio, mescolare nel Vortex per pochi secondi e centrifugare in un microfuge a 3.200 x g a temperatura ambiente per 3 min. trasferire la fase acquosa in una provetta pulita microfuge e in cubate esso a 95 ° C per 5 min; poi metterlo sul ghiaccio.
- In alternativa, utilizzare un acido tempra protocollo. Per questo, aggiungere 2 µ l di 1 M HCl per fermare la reazione in ghiaccio per 6 minuti, quindi aggiungere 0,64 µ l di 1 M dietanolamina (DEA) per neutralizzare il pH della miscela di reazione e incubare a 95 ° C per 5 min; poi metterlo sul ghiaccio.
- Aggiungere un volume equivalente di fenolo tamponato e mescolare nel Vortex per pochi secondi e centrifugare in una microcentrifuga a 3.200 x g a temperatura ambiente per 5 min.
3. resina aggiunta per eliminare la contaminazione salina
- Utilizzando la paletta a resina dalla desalificazione commerciale kit (vedere la Tabella materiali), prendere la resina sufficiente a coprire le fossette di piastra di resina 384-fossetta, 6 mg.
- Distribuire uniformemente la resina in tutti le fossette (6 mg/fossetta) da raschiare la parte superiore della piastra. Recuperare eventuali eccessi di resina e sostituirlo nella bottiglia.
- Trasferire i prodotti di reazione finale dal passo 2.7 dai tubi microfuge ad una piastra 384 pozzetti. Dispensare 16 µ l di H2O per diluire i prodotti di reazione finale in ciascun pozzetto e poi sigillare la piastra e centrifugare per rimuovere eventuali bolle.
- Rimuovere il sigillo, ruotare la piastra 384 pozzetti con i prodotti di reazione sottosopra per coprire la piastra piena di resina.
- Capovolgere il panino di piastre bene-a e lasciar attentamente la resina cadere nella piastra 384 pozzetti (assicurarsi che la piastra 384 pozzetti è a filo contro un perno di metallo piastra di resina-riempito).
- Rimuovere la piastra sulla parte superiore, sigillare la piastra 384 pozzetti contenenti miscele dei prodotti di reazione e resina, centrifugare brevemente esso a 3.200 x g per rimuovere tutte le bolle e inserirlo in un rotatore per almeno 15 min a temperatura ambiente per il contenuto di desalificazione.
- Dopo la pulitura di resina, centrifugare la piastra 384 pozzetti a 3.200 x g per 5 min compattare la resina sul fondo dei pozzetti.
4. trasferire i prodotti di reazione a un Chip Matrix
- Impostare le piastre campione del distributore nanolitro (nanodispenser, vedere la Tabella materiali).
- Mettere la matrice di chip (Vedi la Tabella materiali) e la piastra 384 pozzetti da sezione 3.7 nel vassoio corrispondente.
- Operare il nanodispenser per individuare i prodotti di reazione al chip; spingere il pulsante Esegui sul touch screen di nanodispenser per iniziare.
- Controllo l'immagine catturata automatizzato dei punti campione contenente informazioni sullo schermo per garantire il volume complessivo maculato sul chip di saturazione è di circa 5-10 nL. Ripetere l'esempio spotting se il volume è insufficiente.
5. impostare le informazioni di analisi sulla spettrometria di massa
- Preparare un file in formato. xls contenente le informazioni di segnale atteso per l'importazione. Ad esempio, è possibile utilizzare l'impostazione di "P21_T28.xls" (tabella 2) per la correzione di bozze reazione di P21/T28 nei passaggi 2, 3 e 4.
- Creare e definire un nuovo dosaggio nel programma applicativo (Vedi la Tabella materiali) da clic destro Gruppo dosaggio importa in formato di progettazione e selezionare il file. xls (ad es., "P21_T28.xls" dal passaggio 5.1).
- Stabilire la destinazione saggio piastra tramite l'albero di opzione del Cliente: progetto: piastra sul lato sinistro dello schermo facendo clic destro la cima dell'albero e dandogli un nome di file (ad esempio, "CTT20171201" rappresenta il codice di analisi e data).
- Selezionare il tipo di piastra 384 pozzetti e premere OK; un piatto vuoto verrà visualizzato.
- Selezionare il dosaggio appropriato (ad esempio, P21_T28) sul lato sinistro dello schermo.
- Assegnare il test selezionato (ad esempio, P21_T28) per ogni campione ha notato la posizione del campione sul chip evidenziando il pozzo e cliccando col tasto destro per selezionare Aggiungi Plex.
- Preparare una lista di lavoro di tutti i test sul chip in formato xlsx senza l'intestazione (ad es., 1201.xlsx della tabella 3). Importare il lavoro elenco tramite l'opzione Aggiungi nuovo progetto di esempio .
- Assegnare il test nell'elenco di lavoro (ad es., da 1201.xlsx) a ciascuna posizione del dosaggio P21_T28 e scegliere cliccando col tasto destro.
6. MALDI-TOF MS funzionamento
- Collegare lo spettrometro di massa per il chip utilizzando il programma di applicazione (vedere la Tabella materiali).
- Selezionare l'impostazione predefinita sul lato destro dello schermo.
- Inserire il nome di analisi dal punto 5.3 (ad esempio, CTT20171201), chip ID all'angolo del chip e salvare le impostazioni.
- Avviare il programma di controllo di MS (Vedi la Tabella materiali).
- Premere il tasto In/Out e togliere la piastra di scout. Posizionare il chip macchiato dal punto 4.4 sulla piastra di scout e premere il tasto In/Out per il chip macchiato di entrare lo spettrometro di massa.
- Fare clic sul pulsante Acquisisci del programma applicativo (Vedi la Tabella materiali) per avviare la spettrometria di massa e acquisire dati.
7. analisi dei dati
- Aprire il programma per l'analisi dei dati (Vedi Tabella materiali).
- Esplorare la struttura del database all'angolo superiore sinistro e selezionare l'ID chip dal punto 6.3. Aprire il file di dati sul lato destro dello schermo.
- Fare clic sull'icona di spettro per visualizzare lo spettro di massa. Per ritagliare un intervallo specifico di m/z, fare clic destro per selezionare la Finestra di dialogo personalizzazione e nella nuova finestra fare clic su asse x e impostare il limite superiore e inferiore desiderato e premere OK per mostrare l'intervallo specificato dello spettro.
- Esportare lo spettro per mantenere facendo clic su Esportarecord.
Nota: Utilizzando una scala di 1.600 larghezza/1.200 unità è di dimensioni ragionevoli per l'ispezione di dati sullo schermo del computer.- Selezionare il tipo di file JPEG, clicca sulla destinazione, selezionare Sfoglia disco (ad esempio, disco flash e:), digitare il nome del file (ad es., 1201-1. jpg) e quindi fare clic su Esporta.
- Per la quantificazione dei dati, utilizzare il cursore e clicca sulla cima per mostrare l'altezza di picco nell'angolo di sinistra superiore.
- In alternativa, stampare un file JPEG esportato e misurare l'altezza di picco con un righello manualmente.
Risultati
Modelli e primer:
Utilizzando la procedura presentata qui, uguale modelli molare oligonucleotide sintetico e primer di rilevanti sequenze ottenute da fonti commerciali sono stati controllati per la loro purezza e qualità (Figura 3A; notare che i segnali abbinato la massa designata e il basso fondo) così come per il rapporto tra l'intensità di picco e la massa di analita (Figura 2A). Le altezze dei picchi sono state misurate e calcolati (Figura 2B) per la normalizzazione dei dati di MS.
Spettri di massa e condizione di reazione:
L'uso di primer base singola estensione reazioni accoppiato con MALDI-TOF MS per la genotipizzazione ha precedentemente dimostrato di essere fattibile utilizzando standard ddNTP terminatori17. La correzione di bozze analisi usando ddNTP standard è simile ad una reazione di singleplex di genotipizzazione ma è molto più semplice e molto facile da eseguire per ottenere risultati di pulito e affidabili.
Gli spettri MS coperto tutti i segnali generati da modelli (Figura 3) e gli iniettori. La corretta progettazione degli iniettori e template generato un profilo di segnale ben separati per entrambi i modelli e i primer (Figura 3). In base al valore di m/z, segnali da modelli ed i loro prodotti di degradazione parziale non-specifiche (m/z > 7.000) erano ben separati dai primer non corrispondenti e revisionare i prodotti (m/z < 7.000 nella Figura 3). Se necessario, l'introduzione di nucleasi resistente fosforotioato obbligazioni per sostituire le ultime 4 fosfodiesterico all'estremità 3' del modello (tabella 1; T28S4/p21) può ridurre l'idrolisi non specifico modello (Figura 3; d27).
In assenza di dNTPs, KF ha un robusto exonuclease a 3' ed è in grado di degradare il primer e il modello in vitro21. Come il nativo 4 dNTP, l'aggiunta del 4 ddNTP impedisce una degradazione di estremità 3' di KF (Figura 3 e 3E). Allo stesso modo, un'estensione del nucleotide uno di 3'-estremità aggiunge maggiore stabilità al primer. Utilizzando pol ho revisione condizioni come precedentemente descritto20 con 10 U (46 pmol) KF, più di 80% dei 50-pmol malassortiti substrati sono stati corretti in 5 min (Figura 3, 3Ee 3G).
Intermedi e analisi meccanismo:
MALDI-TOF MS ad alta risoluzione può essere benissimo come 1 dalton; Infatti, tutti i substrati, prodotti e intermedi con variazioni di massa nella reazione possono essere risolti nello stesso spettro MS dell'intervallo selezionato. Ad esempio, in una mancata corrispondenza di terminale T-G, il G non corrispondente al capolinea primer è stato corretto con l'incorporazione di ddA con un dislivello di m/z di soltanto 32. Una tale differenza di m/z può essere facilmente identificata sullo spettro MS in un range di m/z da 5.000 a 7.000 (Figura 4A). La modifica di ogni singolo segnale può essere calcolata sommando tutti i segnali dal primer non corrispondenti, l'asportazione intermedi e revisionare i prodotti come 100%. Ad esempio, nella reazione di correzione di bozze di T-G, il prodotto corretto rispetto al prodotto l'asportazione era 23% contro 17% a 5 min, 31% contro 18% a 10 min e 69% contro il 14% a 20 min (Figura 4A).
Quando una mancata corrispondenza di T-G penultima è presente nell'iniettore, gli ultimi 2 nt dovrebbero essere asportate seguita da un'aggiunta di ddA per completare la correzione. Infatti, i prodotti corretti è aumentato con il tempo da 12% a 5 min, a 10 min, il 28% al 45% a 20 min della reazione. Inoltre, due forme di prodotti di asportazione per un penultimo T-G correzione di bozze, i prodotti intermedi e 2-nt asportazione asportazione 1-nt, erano facilmente risolvibile (Figura 4B).
Correzione di bozze cinetica con singolo dNTP:
Per pol di DNA di Escherichia coli , ddNTP non sono substrati adatti e da considerarsi come inibitori22. In alternativa, utilizzando un singolo dNTP 'corretto' nella correzione di bozze reazione invece anche sopprimere aspecifici 3' - 5' esonucleasi attività e la generazione di singolo nucleotide estensione prodotti adatti per analisi di MS (figura 5B). Il tasso di correzione di bozze ottenuto da reazioni contenente un singolo dCTP è circa due volte superiore a reazioni contenente il 4 ddNTP (Figura 5A, 5Be 5C). Pertanto, l'uso di un singolo dNTP 'corretto' nell'analisi della correzione delle bozze produce un risultato migliore senza gli effetti inibitori di ddNTP. Questo approccio dovrebbe fornire una maggiore sensibilità per la correzione analisi cinetiche.
Correzione di bozze di mancate corrispondenze interne:
MS correzione dosaggi utilizzando KF per mancate corrispondenze interne e l'identificazione dei prodotti corretto sono semplici (cioè, la correzione di bozze esonucleasi accise nucleotidi dall'estremità 3' per la mancata corrispondenza interna degli iniettori), seguita dalla Aggiunta di ddNMP abbinati all'asportazione prodotti tramite la generazione di funzione della polimerasi Rileggi prodotti inferiori i substrati di primer (Figura 6). È stata osservata una chiara tendenza di correzione di bozze efficienza, dove KF revisionare efficientemente disadattamento, durante l'ultimo e penultimo, 3rd 4th nucleotidi dall'estremità 3' dei primer (Figura 6; MM1, 2, 3 e 4). Disadattamento alle 5 nt dall'estremità 3' del primer sono stati parzialmente corretti con < 15% di correzione mancata corrispondenza e > 15% del primer ha mostrato un'estensione senza correzione di bozze (Figura6; MM5). KF non è riuscito a correggere disallineamenti posizionati a 6, 7, 8 e 9 nt dall'estremità 3' del primer (Figura 6; MM6, 7, 8 e 9) ma ancora esteso una percentuale significativa di substrati (Figura 6; PE di MM6, 7, 8 e 9).
Riparazione della lesione di deoxyinosine:
In e. coli, deoxyinosine nel DNA è principalmente trattati da endo V riparazione via20,23. Un'incisione presso il secondo legame fosfodiesterico 3' della lesione dI Endo V avvia la reazione. La rottura del filo generata è creduta per essere utilizzato da pol I per una lesione successiva asportazione e DNA resintesi24. Questa procedura è stata applicata per testare pol riparare substrati contenenti dI presso il sito penultimo 3' (tabella 1; Un-I, C-I, G-ho e T-ho) per convalidare questa ipotesi. La riparazione del 3' dI penultimo è analoga per la correzione di bozze della penultima mancata corrispondenza T-G (Figura 4B e 6; Voce di mm2), in cui gli ultimi 2 nt dovrebbe essere rimosso seguita da un'aggiunta di un ddNMP corretto per completare il ripristino. Modelli di MS ha mostrato chiaramente il pol ho corretto eteroduplici della A-I, G-ho e T-ho, seppur con diversa efficienza (Figura 7; Segnali di RP). Tuttavia, il C-ho substrato era refrattario il POL a riparare (tabella 1 e Figura 7 e 7E; RP molto basso) e ha dimostrato l'estensione dell'iniettore in misura grande (Figura 7; Segnale di PE).
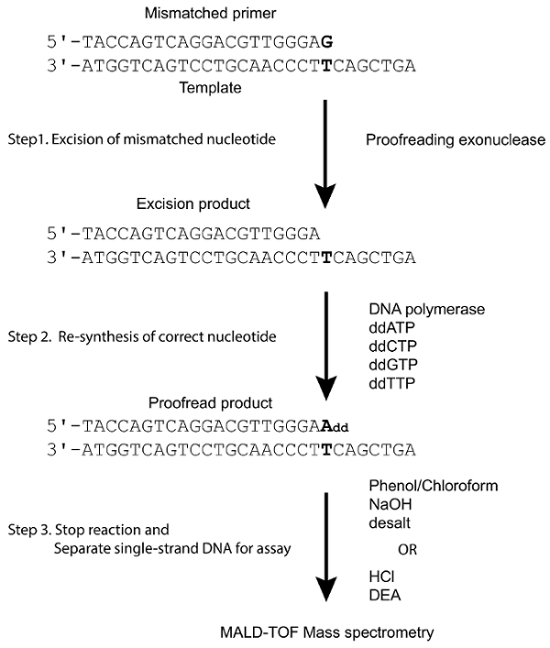
Figura 1 . Modello sistema di correzione del dosaggio per. Un primer non corrispondente è stato ricotto, come indicato a un modello che formano una mancata corrispondenza del terminale (in grassetto). Correzione di bozze exonuclease di polimerasi del DNA sarebbe rilevare e rimuovere il nucleotide non corrispondente formando un prodotto l'asportazione. In presenza di una DNA polimerasi e quattro ddNTP, il prodotto di asportazione è esteso da una singola base complementare al precedente sito non corrispondente. Quando sottoposto a MALDI-TOF, la differenza di massa tra il primer non corrispondente, i prodotti di asportazione e i prodotti corretto può essere risolta. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 . Intensità di picco e oligonucleotidi mass. Otto oligonucleotidi da 17 a 24 nt con sequenze complementari all'estremità 3' del T28 (tabella 1) sono stati testati. (A), A miscela di 50 pmoli di ogni oligonucleotide in soluzioni 40-µ l è stato sottoposto ad un'analisi di MS. (B) l'altezza di picco di 17 nt è stato usato come 100% per il calcolo. L'intensità di segnale relativo per ogni oligonucleotide era la media delle sei determinazioni e le barre di errore rappresentano 1 deviazione standard. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 . Effetto di vari template design. Correzione di bozze reazioni sono state valutate con il primer di P21 formando una mancata corrispondenza di T-G terminale con diversi modelli. La correzione di bozze analisi è stata eseguita con 10 polimerasi di Klenow (43 pmol) U, 50 pmol substrato e 4 ddNTP a 37 ° C per 5 min (A), questo pannello mostra un substrato di P21/T32 T-G senza enzima. (B), questo pannello mostra un'estensione dell'iniettore di un substrato di T-A P21/T32 da 3' exonuclease carenti Klenow. PE = prodotto di estensione del primer. (C) questo pannello mostra le bozze del substrato P21/T32 T-G. PP = prodotto correzione di bozze; D26, d27, d28 = 3' fine degradati template. (D), questo pannello mostra un substrato di P21/T28 T-G senza enzima. (E) questo pannello mostra le bozze del substrato P21/T28 T-G. PP = prodotto correzione di bozze; D26, d27 = 3' fine degradati template. (F), questo pannello mostra un substrato di P21/T28S4 T-G senza enzima. (G) questo pannello mostra le bozze del substrato P21/T28S4 T-G. PP = prodotto correzione di bozze; EP = asportazione prodotti; D27 = sottoprodotto di degradazione del modello. (Questa figura è adattata da Su et al. 25 con il permesso). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 . Tempo di analisi del percorso per l'asportazione e correzione di bozze prodotti. Correzione di bozze di analisi sono state eseguite con 2 U (8,6 pmol) KF e 50 pmol substrati come descritto nel protocollo. Le reazioni sono state temprate al indicato volte. (A) questo pannello mostra le bozze di una 3' mancata corrispondenza terminale T-G; EP = correzione di bozze asportazione prodotto; D18 & d19 = sottoprodotti di asportazione in eccesso; PP = prodotti di correzione di bozze; P21 = primer non corrispondenti. (B) questo pannello mostra le bozze di una mancata corrispondenza di T-G di 3'-penultima; EI-1 = asportazione intermedio; EP-2 = correzione di bozze asportazione prodotti; D18 = sottoprodotto di asportazione in eccesso; PP = prodotti di correzione di bozze; P21 = primer non corrispondenti; Na = nucleotidi legati agli ioni sodio. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5 . Correzione bozze di reazione con 4 ddNTP contro un singolo dNTP. Correzione di bozze di analisi sono state eseguite con 0.1 U (0,43 pmol) KF e 50 pmol substrati come descritto nel protocollo. Le reazioni sono state temprate al indicato volte. (A) questo pannello mostra le bozze di una 3' terminale G-G mancata corrispondenza con 4 ddNTP; EP = correzione di bozze asportazione prodotto; PP = correzione di bozze resintesi prodotti; P21G = fondo non corrispondente. (B) questo pannello mostra le bozze di una 3' terminale G-G mancata corrispondenza con dCTP; PP = correzione di bozze resintesi prodotti; P21G = fondo non corrispondente. (C) la correzione livelli sono la media delle tre determinazioni e le barre di errore rappresentano 1 deviazione standard. Na+ = nucleotidi legati agli ioni sodio. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 . Correzione di bozze di mancate corrispondenze interne. Correzione di bozze analisi sono state eseguite con 2 della polimerasi di Klenow (8,6 pmol) U e 50 pmol substrati a 37 ° C per 20 min, come descritto nel protocollo. Vuoto = enzima vuota di un substrato MM1. MM1 = un substrato di P21/T28 T-G; Mm2 a MM9 = substrati con incongruenze interne, i numeri indicano la posizione di mancata corrispondenza relativa estremità 3'. P21 = primer non corrispondenti; PR = prodotti corretto; PE = primer esteso; D19 e d20 = sottoprodotti di asportazione in eccesso, i numeri rappresentano la dimensione di nucleotidi. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7 . Riparazione di 3' lesioni penultimo deoxyinosine. Analisi di riparazione sono state eseguite con 2 U Klenow polimerasi e 50 pmol substrati a 37 ° C come descritto nel protocollo passaggio 2.3. Le reazioni sono state temprate al indicato volte. Questi pannelli mostrano reazioni con (A) T-ho substrato; (B), G-io substrato; (C) A-ho substrato; e (D) C-ho substrato. RP = prodotti per la riparazione; EP = asportazione prodotti; PE = primer extension prodotti, Na+ = sodio ione addotti. (E), la correzione livelli per T-I, G-I e A-fossi la media delle tre determinazioni e le barre di errore rappresentano 1 deviazione standard. I livelli di correzione per C-fossi la media delle due determinazioni. (Questa figura è adattata da Su et al. 25 con permesso.) Clicca qui per visualizzare una versione più grande di questa figura.
| Substrati | Sequenze | Efficienza di correzione (pmol) | |
| P21/T32 | 3'-TAATATGGTCAGTCCTGCAACCCTTCAGCTGA | 17,3 | |
| 5'-TACCAGTCAGGACGTTGGGAG | |||
| P21/T28 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 18,4 | |
| 5'-TACCAGTCAGGACGTTGGGAG | |||
| P21/T28S4 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 22,9 | |
| HMT | 5'-TACCAGTCAGGACGTTGGGAG | ||
| MM2 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 13,5 | |
| 5'-TACCAGTCAGGACGTTGGGGA | |||
| MM3 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 16,9 | |
| 5'-TACCAGTCAGGACGTTGGAAA | |||
| MM4 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 15.1 | |
| 5'-TACCAGTCAGGACGTTGAGAA | |||
| MM5 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | 4.2 | |
| 5'-TACCAGTCAGGACGTTAGGAA | |||
| MM6 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | < 0.5* | |
| 5'-TACCAGTCAGGACGTCGGGAA | |||
| MM7 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | < 0,5 | |
| 5'-TACCAGTCAGGACGCTGGGAA | |||
| MM8 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | < 0,5 | |
| 5'-TACCAGTCAGGACATTGGGAA | |||
| MM9 | 3'-ATGGTCAGTCCTGCAACCCTTCAGCTGA | < 0,5 | |
| 5'-TACCAGTCAGGATGTTGGGAA | |||
| A-HO | 3'-ACCAGCGACCCCTTATACAGTCAT | 8.2 | |
| 5'-TGGTCGCTGGGGAATAIG | |||
| C-IO | 3'-ACCAGCGACCCCTTATCCAGTCAT | 1.0 | |
| 5'-TGGTCGCTGGGGAATAIG | |||
| G-HO | 3'-ACCAGCGACCCCTTATGCAGTCAT | 15.4 | |
| 5'-TGGTCGCTGGGGAATAIG | |||
| T-HO | 3'-ACCAGCGACCCCTTATTCAGTCAT | 16,6 | |
| 5'-TGGTCGCTGGGGAATAIG | |||
Tabella 1. Correzione di bozze substrati ed efficienza di correzione di frammento di Klenow. Questa tavola mostra i grassetto 4-nucleotidi all'estremità 3' del modello contenente fosforotioato modifiche. Le coppie di basi non corrispondenti sono in grassetto. La correzione di bozze analisi sono state eseguite con 2 della polimerasi di Klenow (8,6 pmol) U, 50 pmol substrato e 4 ddNTP a 37 ° C per 10 min. * questi valori sono i limiti inferiori per il livello di correzione di bozze, perché il rumore di fondo impedisce una stima accurata di < 1% dei totali Massa segnali osservati. (Questa figura è adattata da Su et al. 25 con permesso.)
| BENE | TERMINE | SNP_ID | 2 °-PCRP | 1 °-PCRP | AMP_LEN | UP_CONF | MP_CONF | TM | PcGC | PWARN | UEP_DIR | UEP_MASS | UEP_SEQ | EXT1_CALL | EXT1_MASS |
| W1 | iPLEX | T28 | NA | NA | NA | NA | NA | NA | NA | F | 8524.54 | ATGGTCAGTCCTGCAACCCTTCAGCTGA | |||
| W1 | iPLEX | P21 | NA | NA | NA | NA | NA | NA | NA | F | 6495.24 | TACCAGTCAGGACGTTGGGAA | |||
Tabella 2. File T28_P21.xlsx. è stata utilizzata l'impostazione per Figura 3D, 3E, 4Ae 5A.
| 1201-1 |
| 1201-2 |
| 1201-3 |
| 1201-4 |
| 1201-5 |
| 1201-6 |
| 1201-7 |
Tabella 3. file 1201.xlsx. è stata utilizzata l'impostazione per 7 reazioni in Figura 4A.
Discussione
Questo studio ha descritto una dettagliate analisi di attività correzione di bozze analizzata mediante lo strumento commerciale prescelto (Vedi la Tabella materiali) mediante MALDI-TOF MS. I vantaggi principali sono che il primer e il modello sono etichetta gratuito e facile da eseguire, permettendo una maggiore flessibilità nella progettazione di esperimenti. Un flusso-calce completa elaborazione di 30 correzione test avrebbe preso 4 h, tra cui 3 h per eseguire manualmente la correzione di bozze reazioni e loro pulizia, mentre le analisi MALDI-TOF MS utilizzando il protocollo di cui sopra prende 1 h per completare. Lo svantaggio principale di questo metodo è la quantità di substrato necessaria per il dosaggio. Per ottenere risultati coerenti e segnali forti, abbiamo usato 50 pmoli di substrato di DNA in una reazione di 20-µ l; così, la quantità di DNA è molto superiore con radiomarcato DNA esperimenti8,9,10. Ridurre i volumi e le dimensioni del campione e messa a punto l'operazione di MS può abbassare la quantità di substrato necessaria.
Oligonucleotidi sintetici ottenuti da fonti commerciali possono essere utilizzati per il correzione di bozze studio direttamente senza ulteriore purificazione o trattamento. Tuttavia, è opportuno controllare la purezza e la qualità del DNA mediante MALDI-TOF MS. Le obbligazioni fosforotioato sono state introdotte per sostituire l'ultimo 4 fosfodiesterico all'estremità 3' del modello (tabella 1) per ridurre la degradazione aspecifica del filo del modello (Figura 3), anche se ad un costo più elevato per campione. Interessante, i segnali dal modello e primer del DNA possono essere ben separati da MS in virtù della loro differenze nel formato; così, questa modifica fosforotioato non è necessaria. In Figura 3E, per esempio, tutti i possibili prodotti dell'estensione del primer P21 e la correzione di bozze asportazione e risintesi erano meno di 22 nt (m/z < 7.000), mentre tutti i frammenti di degradazione da modello T28 erano superiori a 24 nt (m/z > 7.000 ). I risultati in Figura 4A erano dalla stessa P21/T28 duplex impostato come quelli in Figura 3E. Una finestra ingrandita di 6.000-7.000 m/z indica solo segnali dal DNA primer senza qualsiasi confusione segnali dal modello.
La strategia di utilizzo di primer con un'estensione di ddNMP ha dimostrato di essere molto stabile, e, quindi, ddNMP contenenti prodotti sono buoni indicatori per il dosaggio di correzione di bozze. L'aggiunta di ddNMP ai prodotti l'asportazione potrebbe 'congelare' il correzione di bozze prodotti nello stato per analisi immediatamente post-escissione. In alternativa, utilizzando un singolo dNTP corretto (figura 5B) invece di 4 ddNTP per sopprimere l'attività idrolitica aspecifici della correzione di bozze esonucleasi è anche fattibile.
Fermare le reazioni con una procedura di estrazione standard fenolo/cloroformio ha dimostrato di essere il mezzo migliore per la terminazione di reazione dato che, in un unico passaggio, consente le reazioni di essere fermato mentre anche la rimozione di qualsiasi interferenza di proteina. In alternativa, l'acido che è favorevole all'automazione, poi neutralizzato da non-metallo alcalino senza una separazione di fase, tempra, inoltre ha dimostrato risultati affidabili. Ione sodio addotti (Na+ in Figura 4, 5e 7) sono di preoccupazione poiché possono aumentare sfondo e complicare la discriminazione del segnale. Un corretto utilizzo della resina pulita può ridurre tali interferenze; Eppure, anche quando tali addotti sono presenti, hanno normalmente picchi molto più piccoli rispetto al loro genitore-segnale e questa proprietà può essere utilizzata per distinguere tra loro (Figura 4, 5e 7). In genere, l'altezza di picco di sodio addotti era proporzionale alle vette principali; l'inclusione o l'esclusione di sodio addotti nel calcolo non ha colpito significativamente i risultati di quantificazione. Pertanto, per la quantificazione, abbiamo usato l'altezza del picco principale solo per il calcolo.
Il correzione di bozze esperimenti descritti qui hanno approfittato di mancate corrispondenze interne per dimostrare l'importanza dell'esonucleasi partizione di dominio dosaggio dei KF26 e la polimerasi del DNA dettagliata ho capacità di rileggere in modo efficiente la mancata corrispondenza alle fino a 4 nt a Monte dall'iniettore 3'-estremità (Figura 5, MM1 - 4) possibilmente dovuto la stabilità appaiamento al primer-modello giunzioni27. Inoltre, questo studio anche usato primer contenenti penultimo deoxyinosine lesioni per studiare una pol che riparare di endo ha scalfito V riparazione intermedi. I risultati hanno mostrato che T-ho è stato riparato in modo più efficiente rispetto a-I e G-I; Tuttavia, C-ero refrattaria il POL a riparare (tabella 1 e Figura 7). Questi risultati confermano che un'analisi MALDI-TOF MS può essere molto utile per la correzione di bozze e vari breve-patch28 grazie alla sua alta risoluzione di analisi di riparazione del DNA.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Ringraziamo il NCFPB Integrated Core Facility di genomica funzionale (Taipei, Taiwan) e il laboratorio di farmacogenomica NRPB (Taipei, Taiwan) per il loro supporto tecnico. Questo lavoro è stato sostenuto da borse di ricerca da Taiwan Health Foundation (L-I.L.) e il Ministero della scienza e tecnologia, Taipei, Taiwan, ROC [più 105-2320-B-002-047] per Hu Yao Wei, [più 105-2628-B-002-051-MY3] per Su Kang-Yi e [ Most-105-2320-B-002-051-MY3] per Lin Liang-In.
Materiali
| Name | Company | Catalog Number | Comments |
| Oligonucleotides | Mission Biotech (Taiwan) | ||
| phosphorothioate modified oligonucleotides | Integrated DNA Technologies (Taiwan) | ||
| DNA polymerase I, Large (Klenow) Fragment | New England Biolabs, MA | M0210L | |
| Klenow fragment (3'→5' exo-) | New England Biolabs, MA | M0212L | |
| NEBuffer 2.1 (10X) | New England Biolabs, MA | B7202S | |
| 2', 3' ddATP | Trilink Biotechnologies, CA | N4001 | |
| 2', 3' ddGTP | Trilink Biotechnologies, CA | N4002 | |
| 2', 3' ddTTP | Trilink Biotechnologies, CA | N4004 | |
| 2', 3' ddCTP | Trilink Biotechnologies, CA | N4005 | |
| dATP, dGTP, dCTP, dTTP set | Clubio, Taiwan | CB-R0315 | |
| SpectroCHIP array | Agena Bioscience, CA | #01509 | |
| MassARRAY | Agena Bioscience, CA | ||
| Typer 4.0 software | Agena Bioscience, CA | #10145 | |
| Clean Resin Tool Kit | Agena Bioscience, CA | #08040 |
Riferimenti
- Loeb, L. A., Kunkel, T. A. Fidelity of DNA synthesis. Annual Review of Biochemistry. 51, 429-457 (1982).
- Kornberg, A., Baker, T. . DNA replication. , (1992).
- Carroll, S. S., Benkovic, S. J. Mechanistic aspects of DNA polymerases: Escherichia coli DNA polymerase I (Klenow fragment) as a paradigm. Chemical Reviews. 90 (7), 1291-1307 (1990).
- Echols, H., Goodman, M. F. Fidelity Mechanisms in DNA Replication. Annual Review of Biochemistry. 60 (1), 477-511 (1991).
- Johnson, K. A. The kinetic and chemical mechanism of high-fidelity DNA polymerases. Biochimica et Biophysica Acta. 1804 (5), 1041-1048 (2010).
- Reha-Krantz, L. J. DNA polymerase proofreading: Multiple roles maintain genome stability. Biochimica et Biophysica Acta. 1804 (5), 1049-1063 (2010).
- Fidalgo da Silva, E., Reha-Krantz, L. J. DNA polymerase proofreading: active site switching catalyzed by the bacteriophage T4 DNA polymerase. Nucleic Acids Research. 35 (16), 5452-5463 (2007).
- Petruska, J., Goodman, M. F. Influence of neighboring bases on DNA polymerase insertion and proofreading fidelity. The Journal of Biological Chemistry. 260 (12), 7533-7539 (1985).
- Mendelman, L. V., Petruska, J., Goodman, M. F. Base mispair extension kinetics. Comparison of DNA polymerase α and reverse transcriptase. The Journal of Biological Chemistry. 265 (4), 2338-2346 (1990).
- Lutz, S., Burgstaller, P., Benner, S. A. An in vitro screening technique for DNA polymerases that can incorporate modified nucleotides. Pseudothymidine as a substrate for thermostable polymerases. Nucleic Acids Research. 27 (13), 2792-2798 (1999).
- Da Silva, E. F., Mandal, S. S. S., Reha-Krantz, L. J. Using 2-aminopurine fluorescence to measure incorporation of incorrect nucleotides by wild type and mutant bacteriophage T4 DNA polymerases. The Journal of Biological Chemistry. 277 (43), 40640-40649 (2002).
- Frey, M. W., Sowers, L. C., Millar, D. P., Benkovic, S. J. The nucleotide analog 2-aminopurine as a spectroscopic probe of nucleotide incorporation by the Klenow fragment of Escherichia coli polymerase I and bacteriophage T4 DNA polymerase. Biochemistry. 34 (28), 9185-9192 (1995).
- Leung, K. H., et al. A highly sensitive G-quadruplex-based luminescent switch-on probe for the detection of polymerase 3'-5' proofreading activity. Methods. 64 (3), 224-228 (2013).
- Song, C., Zhang, C., Zhao, M. Rapid and sensitive detection of DNA polymerase fidelity by singly labeled smart fluorescent probes. Biosensors and Bioelectronics. 26 (5), 2699-2702 (2011).
- Haff, L. A., Smirnov, I. P. Single-nucleotide polymorphism identification assays using a thermostable DNA polymerase and delayed extraction MALDI-TOF mass spectrometry. Genome Research. 7 (4), 378-388 (1997).
- Haff, L. A., Smirnov, I. P. Multiplex genotyping of PCR products with MassTag-labeled primers. Nucleic Acids Research. 25 (18), 3749-3750 (1997).
- Blondal, T., et al. A novel MALDI-TOF based methodology for genotyping single nucleotide polymorphisms. Nucleic Acids Research. 31 (24), e155 (2003).
- Su, K. Y., et al. Pretreatment Epidermal Growth Factor Receptor (EGFR) T790M mutation predicts shorter EGFR tyrosine kinase inhibitor response duration in patients with non-small-cell lung cancer. Journal of Clinical Oncology. 30 (4), 433-440 (2012).
- Lee, C. C., et al. Endonuclease V-mediated deoxyinosine excision repair in vitro. DNA Repair. 9, 1073-1079 (2010).
- Lee, C. C., et al. The excision of 3' penultimate errors by DNA polymerase I and its role in endonuclease V-mediated DNA repair. DNA Repair. 12 (11), 899-911 (2013).
- Kucera, R. B., Nichols, N. M. DNA-Dependent DNA Polymerases. Current Protocols in Molecular Biology. 84 (1), 3.5.1-3.5.19 (2008).
- Tabor, S., Richardson, C. C. A single residue in DNA polymerases of the Escherichia coli DNA polymerase I family is critical for distinguishing between deoxy- and dideoxyribonucleotides. Proceedings of the National Academy of Sciences of the United States of America. 92 (14), 6339-6343 (1995).
- Weiss, B. Removal of deoxyinosine from the Escherichia coli chromosome as studied by oligonucleotide transformation. DNA Repair. 7 (2), 205-212 (2008).
- Cao, W. Endonuclease V: an unusual enzyme for repair of DNA deamination. Cellular and Molecular Life Sciences. 70 (17), 3145-3156 (2013).
- Su, K. Y., et al. Application of single nucleotide extension and MALDI-TOF mass spectrometry in proofreading and DNA repair assay. DNA Repair. 61, 63-75 (2018).
- Carver, T. E., Hochstrasser, R. A., Millar, D. P. Proofreading DNA: recognition of aberrant DNA termini by the Klenow fragment of DNA polymerase I. Proceedings of the National Academy of Sciences of the United States of America. 91 (22), 10670-10674 (1994).
- Santa Lucia, J., Hicks, D. The thermodynamics of DNA structural motifs. Annual Review of Biophysics and Biomolecular Structure. 33, 415-440 (2004).
- Su, K. Y., et al. DNA polymerase I proofreading exonuclease activity is required for endonuclease V repair pathway both in vitro and in vivo. DNA Repair. 64, 59-67 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon