Method Article
Frazione di membrana del cervello: An
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui presentiamo un protocollo di frazionamento della membrana cerebrale che rappresenta una procedura robusta per isolare le proteine appartenenti a diversi compartimenti sinaptici.
Abstract
La valutazione della composizione e della funzione sinaptica della proteina costituisce una sfida importante nella neuroscienza. Tuttavia, non è facile valutare la neurotrasmissione che si verifica all'interno delle sinapsi perché è altamente regolata da interazioni proteiche-proteiche dinamiche e eventi di fosforilazione. Di conseguenza, quando uno qualsiasi metodo viene utilizzato per studiare la trasmissione sinaptica, un obiettivo principale è quello di preservare queste modifiche fisiologiche transitorie. Qui presentiamo un protocollo di frazionamento della membrana cerebrale che rappresenta una procedura robusta per isolare le proteine appartenenti a diversi compartimenti sinaptici. In altre parole, il protocollo descrive una metodologia biochimica per realizzare arricchimento proteico dai compartimenti presinaptici, postinaptici e extrasinaptici. In primo luogo, sinaptosomi o terminali sinaptici vengono ottenuti da neuroni che contengono tutti i compartimenti sinaptici mediante un gradiente discontinuo di saccarosio. Da notare, la qualità di questa preparazione iniziale della membrana sinaptica è critical. Successivamente, l'isolamento dei diversi compartimenti sottinaptici viene raggiunto con la solubilizzazione leggera usando detergenti delicati a condizioni di pH differenziali. Ciò consente la separazione mediante gradiente e centrifughe isopiche. Infine, l'arricchimento delle proteine nei differenti compartimenti subsintaptici ( cioè frazioni di membrana pre-, post- ed extrasinaptiche) viene convalidato mediante analisi di immunoblot mediante marcatori proteici sinaptici ben caratterizzati ( cioè SNAP-25, PSD-95 e sinaptofisina, Rispettivamente), consentendo così una valutazione diretta della distribuzione sinaptica di qualsiasi particolare proteina neuronale.
Introduzione
La trasmissione sinaptica si basa sull'integrità fisica della sinapsi, un concetto che era stato previsto già nel 1897 da Foster e Sherrington 1 . Così, la comprensione della distribuzione dei componenti chiave di neurotrasmissione ( es. Canali ionici, recettori, ecc. ) È essenziale per chiarire la funzione sinaptica, sia in condizioni normali che patologiche. La microscopia elettronica (EM) ha contribuito enormemente all'attuale nozione ultrastrutturale delle sinapsi prototipali del sistema nervoso centrale (CNS). In tal modo, EM ha stabilito finemente le differenze tra densità pre- e postinaptica, che sono separate da una fessura di una distanza piuttosto uniforme (~ 25 nm) 2 . È interessante notare che l'apparato postinaptico presenta un ispessimento relativamente continuo, elettrone-denso, sotto la sua membrana plasmatica, la cosiddetta densità postinaptica o PSD 2 . Al contrario, all'apparato presinaptico, un avvisoLa rete cytomatica discontinua è disposta appena sotto la membrana plasmatica, che è essenziale per l'allineamento e l'ancoraggio delle vescicole sinaptiche alla zona attiva della membrana plasmatica 3 . Quindi, EM costituisce l'approccio sperimentale d'oro per studiare la distribuzione delle proteine all'interno di sinapsi CNS strutturalmente conservati. Tuttavia, le informazioni fornite da microscopi elettronici sono statici. Infatti, le evidenze accumulate mostrano che le sinapsi in vivo sono estremamente dinamiche, provando quindi drammatiche modifiche strutturali alla trasmissione sinaptica sostenuta. Inoltre, la morfologia e la composizione delle sinapsi possono cambiare in diverse regioni del CNS e su sviluppo, maturazione, invecchiamento e sviluppo di condizioni neuropatologiche. Nel complesso, un protocollo focalizzato sull'isolamento di proteine appartenenti a diversi compartimenti sinaptici in condizioni fisiologiche rappresenta uno strumento prezioso per uno studio più completo del funzionamento sinaptico.
et al . (2001) 4 , si basa su un cambiamento di pH che indebolisce le interazioni adesive che si verificano all'interno dell'apparato pre- e postinaptico. In primo luogo, utilizzando detergenti delicati a pH 6,0, è possibile distinguere la giunzione aderente che contiene l'apparato pre- e postsinaptico e che viene mantenuto dal dominio della membrana extrasynaptica, che è solubilizzato e quindi può essere estratto dai contatti sinaptici. Successivamente, sollevando il pH da 6,0 a 8,0 in presenza di detergenti delicati, indebolisce la forza della giunzione aderente che mantiene la zona attiva presinaptica strettamente legata alla densità postinaptica. Quindi, lo scompartimento presinaptico è cosìLubrificata e può essere separata dalla densità postsinaptica, che è per lo più conservata perché la concentrazione del detergente utilizzato non promuove la sua solubilizzazione 4 . È interessante notare che l'efficienza di frazionamento, eventualmente superiore al 90%, può essere confermata da diversi marcatori sottosintesi: i ) la proteina associata alla sinaptosoma 25 (SNAP-25), dalla zona attiva presinaptica; Ii ) sinaptofisina, dalla frazione extrasinaptica ( cioè, al di fuori della zona attiva e microsomi inclusi); E iii ) proteina densità postinaptica 95 (PSD-95), dalla densità postinaptica. In particolare, questo metodo di frazionamento della membrana cerebrale è stato utilizzato con successo. Di conseguenza, è stato possibile determinare con precisione la localizzazione subsynaptica di diversi recettori, quali i recettori 5 dell'acido alfa-ammino-3-idrossi-5-metil-4-isossazolepropionico (AMPA), il recettore dell'adenosina A1 (A 1 R) 6 ,Adenosina A 2A (A 2A R) 7 , adenosine trifosfato (ATP) P2, 8 recettori recettori del acetilcolino nicotinico 9 e recettore GPR3710 associato alla malattia di Parkinson. Tuttavia, una serie di limitazioni può ostacolare la corretta valutazione della distribuzione sinaptica di una particolare proteina neuronale. Quindi, in questa procedura, non solo descriviamo completamente l'intero protocollo, ma evidenziamo anche alcuni punti critici da prendere in considerazione, come la quantità piuttosto elevata di tessuti necessari, la bassa resa proteica e il requisito obbligatorio per convalidare l'efficienza Ogni separazione prima di eseguire l'esperimento definito.
Protocollo
Tutte le procedure sperimentali animali sono state approvate dal Comitato di Barcellona per l'Uso e la Cura degli Animali (CEEA), conformemente alle linee guida descritte nella Guida per la cura e l'uso degli animali da laboratorio11 e seguendo la Comunità Europea, la legge 86/609 / CCE, FELASA e ARRIVE. Così, i topi sono alloggiati in gabbie standard, con accesso ad libitum all'alimentazione e all'acqua e vengono mantenute in condizioni standard controllate (ciclo scuro / leggero da 12 ore a partire da 7:30 AM, temperatura di 22 ° C e umidità del 66%).
1. Ottenere Synaptosomes del cervello del mouse usando un Gradiente Discontinuo di Sucroso
Nota: Questo metodo è stato segnalato in precedenza 10 .
- Preparare tampone di isolamento fresco (IB), pH 7,4; 2 M saccarosio; 1 M saccarosio / 0,1 mM CaCl2; E 0,1 mM CaCl2 (vedi tabella 1 ). Chill le soluzioni sul ghiaccio.
- SaCrizione di cinque topi per dislocazione cervicale. Decapitate e rimuovete rapidamente il cervello di ogni animale. Disciogliere la regione cerebrale di interesse (cioè l'ippocampo, 0,25-0,35 g di tessuto fresco) e metterlo in un tubo di vetro Potter-Elvehjem da 5 ml su ghiaccio con 1 ml di IB.
- Homogenizzare il tessuto utilizzando un agitatore omogeneizzante (10 colpi a 700-900 rotazioni al minuto), preferibilmente in un bagno di ghiaccio per evitare il riscaldamento del campione.
- Posizionare il tessuto omogeneizzato (1 mL) in un tubo da 15 mL contenente 6 mi di saccarosio da 2 M e 2,5 mL di 0,1 mM CaCl2 a 4 ° C. Mescolare lentamente invertendo il tubo.
Nota: l'aggiunta di calcio è essenziale per mantenere le interazioni adesive tra gli organelli e quindi per preservare la struttura delle diverse "densità". - Posizionare la soluzione in un tubo da centrifuga da 12 ml e aggiungere lentamente 2,5 ml di saccarosio di 1 M / 0,1 mM CaCl2 sopra ogni tubo per formare il gradiente di saccarosio.
Nota: contrassegnare la posizione oF l'interfaccia di gradiente sul tubo centrifuga utilizzando un indicatore permanente. - Pesare e equilibrare i tubi di centrifuga con soluzione IB all'interno dei rispettivi supporti in acciaio e con i loro coperchi di chiusura.
- Centrifugare i tubi per 3 ore a 100.000 x g e 4 ° C utilizzando una centrifuga a rotore a pozzo. Riempire completamente il rotore con tutti i supporti in acciaio (anche vuoto, se necessario).
- Scartare il livello superiore contenente mielina. Con una pipetta Pasteur raccogliere l'anello bianco tra l'interfaccia di saccarosio 1,25-M e 1-M corrispondente alla frazione sinaptosoma.
- Diluire i sinaptosomi con 9X il loro volume usando IB in un tubo di centrifuga.
- Pesare e equilibrare i tubi di centrifuga con soluzione IB all'interno dei rispettivi supporti in acciaio e con i loro coperchi di chiusura.
- Centrifugare i tubi per 30 minuti a 15.000 x g e 4 ° C utilizzando una centrifuga a rotore a pozzo.
- Scartare il surnatante e riposizionareE con 10 ml di soluzione IB. Raccogliere 100 μL di questa soluzione sinaptosomica e centrifugare per 5 minuti a 11.000 x g e 4 ºC.
- Riposizionare il pellet sinaptosomico in sodio dodecil solfato (SDS) al 5% e memorizzare questo campione a -20 ° C.
Nota: Questo campione corrisponderà alla frazione totale di sinaptosomi per ulteriori analisi Western blot. La restante frazione sinaptosomica (~ 1 ml) può essere congelata a -20 ° C fino all'uso o elaborata per la successiva frazionamento subsintattico. I sinaptosomi o le sinapsi purificati rappresentano tra il 1 e il 2% del volume totale ippocampale 12 .
2. Isolamento pre-, post- ed extrasinaptico
- Preparare un tampone di solubilizzazione fresco 2x, pH 6,0; 1x tampone di solubilizzazione, pH 6,0; Tampone di solubilizzazione, pH 8,0; E 0,1 mM CaCl2 (vedi tabella 1 ). Chill le soluzioni sul ghiaccio.
Nota: il pH di queste soluzioni dovrebbe essere accuratelY regolato per ottenere una buona frazionamento subsynaptic. - Diluire lentamente la frazione sinaptosomale resuspendente da 1 mL (vedere la fase 1.12) con 5 mL di 0,1 mM CaCl2.
- Aggiungere lo stesso volume (5 mL) di tampone di solubilizzazione 2x a ghiaccio freddo, pH 6,0 e incubare per 50 minuti su ghiaccio sotto agitazione elevata in un bicchiere su ghiaccio.
Nota: mentre l'1% di Triton X-100 a pH 6.0 solubilizza tutte le proteine della membrana plasmatica, conserva le proteine all'interno dei contatti o dei giunti sinaptici ( vale a dire, strutture pre e postsynaptiche). - Mettere la soluzione in un tubo di centrifuga. Pesare e equilibrare i tubi con volumi equivalenti di 0,1 mM CaCl2 e 2x soluzione tampone di solubilizzazione, pH 6,0, all'interno dei rispettivi supporti in acciaio e con i loro coperchi di chiusura.
- Centrifugare i tubi per 30 minuti a 40.000 x g e 4 ° C utilizzando una centrifuga a rotore a pozzo. Il supernatante risultante rappresenta la frazione extrasinaptica,E il pellet corrisponde alle giunzioni sinaptiche ( cioè, frazioni pre- e postinaptiche).
- Concentrare il supernatante contenente la frazione extrasinaptica a un volume finale di 200 μL usando un tubo filtrante da 15 mL di 10K centrifugato a 4.000 xg e 4 ºC.
- Precipitare la frazione extrasinaptica risultante risultante (200 μL) con 5 volumi (1 ml) di acetone pre-refrigerato (-20 ° C) per una notte a -20 ° C.
- Il giorno dopo, centrifuga la frazione extrasinaptica per 30 minuti a 18.000 x g e -15 ° C. Dopo la centrifugazione, scartare il supernatante di acetone e asciugare il pellet per rimuovere qualsiasi traccia di acetone.
- Infine, risospendere il pellet contenente le proteine extrasinaptiche con 200 μL di 5% SDS. Sonicare il pellet, se necessario.
- Senza interromperla, lavare attentamente il pellet contenente le frazioni pre- e postsinaptiche con 2 mL di tampone di solubilizzazione 1x, pH 6,0. Scartare il buffer.
- RisospendereIl pellet con 10 ml di tampone di solubilizzazione 1x, pH 8,0, utilizzando una pipetta di vetro Pasteur.
Nota: mentre l'1% di Triton X-100 a pH 8,0 solubilizza la specializzazione presinaptica, conserva la densità postinaptica insolubile 4 . - Incubare la sospensione per 50 minuti su ghiaccio sotto agitazione elevata in un bicchiere su ghiaccio.
- Mettere la soluzione in un tubo di centrifuga. Pesare e equilibrare i tubi con una soluzione di tampone di soluzione solubilizzazione, pH 8,0, all'interno dei relativi supporti in acciaio e con i loro coperchi di chiusura.
- Centrifugare i tubi per 30 minuti a 40.000 x g e 4 ° C utilizzando una centrifuga a rotore a cilindro oscillante; Il supernatante risultante corrisponde alla frazione presinaptica e al pellet alla frazione postsinaptica.
- Processare il surnatante contenente la frazione presinaptica, come descritto nei passaggi 2.6-2.9.
- Resuspendere la pellicola contenente la frazione postsinaptica con 200 μL di SDS al 5%. Sonicare il pellet, iF richiesto.
3. Analizzare i campioni mediante immunoblot per convalidare la frazionamento della membrana
- Determinare la quantità di proteine in ciascuna frazione ( cioè le frazioni totali, extra-, pre- e post-sinaptiche) utilizzando il saggio della proteina dell'acido bicinconico.
- Prendere 20 μg di proteine da ciascuna frazione e diluire fino ad un volume finale di 50 μl di SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Bollite per 5 min a 100 ºC.
- Separare le proteine mediante elettroforesi SDS-PAGE 10%, con un gel di concentrazione del 4% in condizioni riducenti. Elettroforesi a tensione costante di 80 V fino a quando il colorante entra nel gel inferiore e quindi aumenta la tensione a 120 V.
- Trasferire le proteine in una membrana PVDF e bloccare con IB soluzione di bloccaggio per 45 minuti a temperatura ambiente a scuotimento continuo.
- Incubare la membrana durante la notte a 4 ºC con l'anticorpo primario indicato ( cioè anti-SNAP-25,Anti-PSD-95, anti-sinaptofisina o anti-GPR37) diluita nella soluzione di blocco IB sotto scosse continue.
- Lavare la membrana tre volte (10 min ciascuno) con la soluzione di lavaggio IB per eliminare l'anticorpo primario non legato.
- Incubare con l'anticorpo secondario indicato per 90 min in condizioni scure a temperatura ambiente sotto scosse continue.
- Lavare la membrana tre volte (10 min ciascuna) con la soluzione di lavaggio IB per eliminare l'anticorpo secondario non legato.
- Incubare la membrana con substrato chemiluminescente (preparare il miscuglio in condizioni scure e seguire la proporzione 1: 1 della soluzione A e B fornita dal produttore).
- Analizzare la membrana in un dispositivo di rilevamento chemiluminescente.
Risultati
La metodologia descritta è stata ampiamente utilizzata per l'analisi subsynaptica delle proteine neuronali in generale e per l'isolamento e la caratterizzazione biochimica dei ricercatori sinaptici 5 , 6 , 7 , 8 , 9 in particolare. È interessante notare che il risultato rappresentativo mostrato qui mostra l'utilità di questa procedura sperimentale per l'analisi della distribuzione subastatica di ippocampo di un recettore orfano G-accoppiato alla proteina, vale a dire il recettore GPR3710 associato alla malattia di Parkinson. GPR37 è stato originariamente identificato attraverso ricerche per omologhi per endoteli e recettori bombesin 13 , anche se è stato trovato a non legarsi a endoteline o peptidi associati. Al suo posto, GPR37 è stato proposto per essere attivato dall'attivatore testa pL'eptide 14 , 15 , 16 e, più recentemente, dai neuropeptidi prosaposin e il prospatide 17 , anche se queste associazioni devono ancora essere universalmente accettate. GPR37 ha ricevuto la massima attenzione per il suo legame con la malattia di Parkinson 18 . Quindi, c'è un notevole interesse a conoscere la neurobiologia di questo intrigante recettore, sia in condizioni normali che patologiche. Pertanto, scoprire la localizzazione subsynaptica GPR37 potrebbe contribuire a chiarire la sua funzione all'interno del cervello. A tal fine, l'ippocampo è stato prima isolato da topi C57BL / 6J (WT) e GPR37-KO a otto settimane di età. Quindi, le frazioni extra-, pre- e post-subsynaptic sono state purificate usando il protocollo di frazionamento della membrana (vedere la figura 1 per una panoramica schematica della procedura). Successivamente, le purezza di questi compartimenti sottinaptici sono stati verificati dalSegregazione dei rispettivi marcatori sinaptici: i ) marcatore vescicolare extrasinaptico (sinaptofisina); Ii ) il marker di zona attivo presinaptico (SNAP-25); E iii ) il marker di densità postinaptica (PSD95). Di conseguenza, gli arricchimenti in sinaptofisina, SNAP-25 e PSD95 nelle frazioni extra-, pre- e post-subsynaptic, sono stati analizzati rispettivamente mediante immunoblot utilizzando anticorpi specifici contro queste proteine ( Figura 2 ). Quindi, per ciascun marcatore sinaptico testato ( Figura 3 ) è stata trovata un'efficienza di frazionamento di almeno il 90%, simile a quelle descritte precedentemente 6 . È interessante notare che la frazione extrasinaptica era più abbondante (n = 3, P <0,001) rispetto a quella dei presinaptici (20 ± 4%) e dei postsinaptici (36 ± 2%) ( Figura 3 ). Inoltre, i nostri dati indicavano che, mentre presente nella zona attiva presinaptica, GPR37 era principalmente loCalizzato nella densità postinaptica (n = 3; P <0,05) ( Figura 3 ). Nel complesso, il protocollo di frazionamento della membrana cerebrale ha permesso di valutare la distribuzione subsynaptica di GPR37 nell'ippocampo del mouse, fornendo così informazioni preziose per le future manipolazioni di questo recettore orfano.

Figura 1: Schema di flusso-diagramma del protocollo di frazionamento a membrana. Tutte le procedure sperimentali sono descritte nella colonna di sinistra, mentre la raccolta di campioni è raffigurata nella colonna di destra. Clicca qui per visualizzare una versione più grande di questa figura.

figura2: Distribuzione subsynaptica di GPR37 nell'ippocampo del mouse. L'immunoblot rappresentativo mostra Sinaptophysin, SNAP-25 e PSD-95 come marcatori sinaptici specifici extra-, pre- e postsynaptici, nonché immunoreattività in GPR37 nelle frazioni sinaptiche ippocampali dei topi WT e GPR37-KO. I sinaptosomi ippocampali (Syn) sono stati frazionati in frazioni extrasinaptiche (Extra) e Presynaptic (Pre) e densità postsinaptica (Post). Questi sono stati analizzati mediante immunoblot (20 μg di proteina / corsia) utilizzando l'anti-synaptophysin coniglio (1: 3,000), il mouse anti SNAP-25 (1: 3,000), il coniglio anti-PSD95 (1: 3,000) -GPR37 (1 μg / mL). L'anticorpo legato primario è stato rilevato utilizzando un anti-coniglio coniugato con HRP (1 / 30.000) o un anticorpo anti-mouse coniglio (1: 30.000). Questi dati vengono estratti dal riferimento 10 , con il permesso. Fare clic su hPer visualizzare una versione più grande di questa figura.
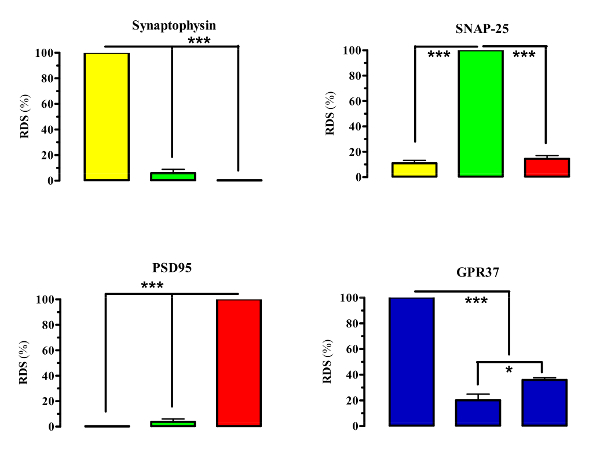
Figura 3: Quantificazione relativa dell'arricchimento GPR37 nelle frazioni extra-, pre- e postinaptiche ippocampali. Le intensità delle fasce immunoreattive sulle membrane immunoblottate corrispondenti a frazioni extrasinaptiche (Extra, colonna gialla), presinaptica (Pre, colonna verde) e postinaptica (Post, colonna rossa), mostrate in Figura 2, sono state misurate mediante scansione densitometrica. Le densità sono state quantificate da bande non saturate. I valori sono stati normalizzati (in% della scansione densitometrica relativa, RDS) utilizzando la quantità di Synaptophysin, SNAP-25, PSD95 e GPR37 nella frazione più arricchita e sono stati presentati come mezzo ± SEM di tre esperimenti indipendenti 10 . Gli asterischi indicano dati significativamente differenti: * p <0,05, *** p <0.001 (ANOVA a 1 vie con prova post-hoc di Bonferroni). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
The protocol presented here constitutes a powerful biochemical tool for the study of the subsynaptic distribution of specific proteins within any brain region. However, there are some drawbacks inherent to the technique that deserve to be highlighted here. For instance, one of the main limitations is the relatively large amount of tissue needed to purify a reasonable amount of protein in order to perform the immunoblot analysis of all subsynaptic fractions. This issue might be related to the fact that synapses (i.e., synaptosomes) represent only 1-2% of the total hippocampal volume12. Indeed, between 1 and 1.5 g of fresh tissue (i.e., the hippocampus) is needed to perform a successful fractionation; otherwise, the yield is too low to assess the identity, as well as the localization, of the protein being studied.
Conversely, if an excess of brain tissue is used, then the separation procedure will not be optimal. It is also critical to carefully adjust the pH of the solutions to ensure an optimal subsynaptic fractionation. Consequently, every time a brain membrane fractionation is performed, it is mandatory to validate the efficiency of each fraction before any further study. Importantly, the following protocol it is unlikely to be suitable for the subsynaptic fractionation of inhibitory synapses because of its differential structure and distribution. However, all these drawbacks do not overshadow the enormous usefulness of this experimental procedure, which, without any doubt, will become a universal methodology for the study of the synapse.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Ministero dell'Economia e della Compagnia / Instituto de Salud Carlos III (SAF2014-55700-P, PCIN-2013-019-C03-03 e PIE14 / 00034), Institutional Catalonia de Recerca i Estudis Avançats (ICREA Academia-2010 (SBO-140028) a FC Inoltre, X. M, VF-D e FC appartengono al gruppo di ricerca accreditato "Neuropharmacology and Pain" (Generalitat de Catalunya, 2014 SGR 1251) . Il lavoro è stato sostenuto anche dal "Programa Pesquisador Visite Especial-Ciência sem Fronteiras" da CAPES (Brasile) a FC
Materiali
| Name | Company | Catalog Number | Comments |
| Sucrose | Pancreac Química SL, Barcelona, Spain | 1,316,211,211 | |
| CaCl2 | Pancreac Química SL, Barcelona, Spain | 2,112,211,210 | |
| MgCl2·6H2O | Pancreac Química SL, Barcelona, Spain | 1,313,961,210 | |
| Protease inhibitor cocktail Set III | Millipore, Darmstadt, Germany | 535140 | |
| Trizma Base | Sigma, St. Louis, MO, USA | T1503 | |
| Tris-HCl | Pancreac Química SL, Barcelona, Spain | 1,236,541,209 | |
| Triton X-100 | Sigma, St. Louis, MO, USA | X100 | |
| SDS | Sigma, St. Louis, MO, USA | L3771 | |
| Glycerol | Sigma, St. Louis, MO, USA | G5516 | |
| Bromophenol Blue | Pancreac Química SL, Barcelona, Spain | 1,311,651,604 | |
| Dithiothreitol | Sigma, St. Louis, MO, USA | D0632 | |
| Tween 20 | Sigma, St. Louis, MO, USA | P2287 | |
| Non fat dry milk | |||
| NaCl | Pancreac Química SL, Barcelona, Spain | 1,216,591,211 | |
| KCl | Pancreac Química SL, Barcelona, Spain | 1,314,941,210 | |
| KH2PO4 | Merck | 4873 | |
| Na2HPO4 | Pancreac Química SL, Barcelona, Spain | 1,316,781,211 | |
| Basic 20 pH | Crison, Alella, Spain | ||
| Polytron VDI 12 Adaptable Homogenizer | VWR, Radnor, PA, USA. | ||
| Ultra-Clear Tubes (14x89mm) | Beckman Coulter, Hospitalet de Llobregat, Barcelona | 344059 | Tubes should be filled almost completely when used to prevent collapsing due to ultracentrifugation. |
| Amicon Ultra-15 Centrifugal filters Ultracel -10K | Merck Millipore, Darmstadt, Germany | UFC901008 | |
| Centrifuge 5430R | Eppendorf, Hamburgo, Germany | ||
| Optima L-90K Ultracentrifuge | Beckman Coulter, Hospitalet de Llobregat, Barcelona | ||
| Sonifier 250 | Branson, Danbury, Connecticut | ||
| Amersham Imager 600 | GE Healthcare Europe GmbH, Barcelona, Spain | ||
| Disposable Glass Pasteur Pippetes 230 mm | VWR, Radnor, PA, USA | 612-1702 | |
| Compact Balance EK-610 | A&D, Tokyo, Japan | ||
| Pierce™ BCA Protein Assay Kit | Pierce Biotechnology, Rockford, IL, USA | ||
| SuperSignal west pico chemiluminescent substrate | Thermo Fisher Scientific Inc., Waltham, MA, USA | ||
| GR 200 Precision Balance | A&D, Tokyo, Japan | ||
| Anti-GPR37 | Homemade antibody anti-GPR37 produced and validated in Francisco Ciruela Laboratory. | Primary antibodies used at a final concentration of 0.250 μg/mL | |
| Anti-SNAP-25, anti-PSD-95, anti-synaptophysin | Abcam, Cambridge, United Kingdom | Primary antibodies diluted 1:10,000 | |
| HRP-conjugated goat anti-mouse IgG | Thermo Fisher Scientific, Waltham, MA, USA. | Secondary antibody diluted 1:10,000 | |
| HRP-conjugated goat anti-rabbit IgG | Thermo Fisher Scientific, Waltham, MA, USA. | Secondary antibody diluted 1:30,000 |
Riferimenti
- Foster, M., Sherrington, C. S. Part III: The Central Nervous System. A Text Book of Physiology. , (1897).
- Peters, A., Palay, S. L., Webster, H. D. F. . The fine structure of the nervous system. , (1991).
- Harris, K. M., Weinberg, R. J. Ultrastructure of Synapses in the Mammalian Brain. Cold Spring Harb. Perspect. Biol. 4, 005587-005587 (2012).
- Phillips, G. R., et al. The presynaptic particle web: ultrastructure, composition, dissolution, and reconstitution. Neuron. 32, 63-77 (2001).
- Pinheiro, P. S., et al. Solubilization and immunological identification of presynaptic alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptors in the rat hippocampus. Neurosci. Lett. 336, 97-100 (2003).
- Rebola, N., Pinheiro, P. C., Oliveira, C. R., Malva, J. O., Cunha, R. A. Subcellular localization of adenosine A(1) receptors in nerve terminals and synapses of the rat hippocampus. Brain Res. 987, 49-58 (2003).
- Rebola, N., Canas, P. M., Oliveira, C. R., Cunha, R. A. Different synaptic and subsynaptic localization of adenosine A2A receptors in the hippocampus and striatum of the rat. Neuroscience. 132, 893-903 (2005).
- Rodrigues, R. J. Dual Presynaptic Control by ATP of Glutamate Release via Facilitatory P2X1, P2X2/3, and P2X3 and Inhibitory P2Y1, P2Y2, and/or P2Y4 Receptors in the Rat. J. Neurosci. 25, 6286-6295 (2005).
- Garção, P., Oliveira, C. R., Cunha, R. A., Agostinho, P. Subsynaptic localization of nicotinic acetylcholine receptor subunits: a comparative study in the mouse and rat striatum. Neurosci. Lett. 566, 106-110 (2014).
- Lopes, J. P., et al. The role of parkinson's disease-associated receptor GPR37 in the hippocampus: functional interplay with the adenosinergic system. J. Neurochem. 134, 135-146 (2015).
- Clark, J. D., Gebhart, G. F., Gonder, J. C., Keeling, M. E., Kohn, D. F. Special Report: The 1996 Guide for the Care and Use of Laboratory Animals. ILAR J. 38, 41-48 (1997).
- Rusakov, D. A., Harrison, E., Stewart, M. G. Synapses in hippocampus occupy only 1-2% of cell membranes and are spaced less than half-micron apart: a quantitative ultrastructural analysis with discussion of physiological implications. Neuropharmacology. 37, 513-521 (1998).
- Zeng, Z., Su, K., Kyaw, H., Li, Y. A novel endothelin receptor type-B-like gene enriched in the brain. Biochem. Biophys. Res. Commun. 233, 559-567 (1997).
- Bodenmuller, H., Schilling, E., Zachmann, B., Schaller, H. C. The neuropeptide head activator loses its biological acitivity by dimerization. EMBO J. 5, 1825-1829 (1986).
- Rezgaoui, M., et al. The neuropeptide head activator is a high-affinity ligand for the orphan G-protein-coupled receptor GPR37. J. Cell Sci. 119, 542-549 (2006).
- Gandìa, J., Fernández-Dueñas, V., et al. The Parkinson's disease-associated GPR37 receptor-mediated cytotoxicity is controlled by its intracellular cysteine-rich domain. J. Neurochem. 125, 362-372 (2013).
- Meyer, R. C., Giddens, M. M., Schaefer, S. A., Hall, R. A. GPR37 and GPR37L1 are receptors for the neuroprotective and glioprotective factors prosaptide and prosaposin. Proc. Natl. Acad. Sci. U. S. A. 110, 9529-9534 (2013).
- Takahashi, R., Imai, Y. Pael receptor, endoplasmic reticulum stress, and Parkinson's disease. J. Neurol. 250, 9 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon